ANALISIS KERAGAMAN GENETIK GEN 16S-rRNA DAN
KARAKTERISASI FISIOLOGIS BAKTERI ASAL USUS
UDANG VANAME Litopenaeus vannamei
DARI BERBAGAI UMUR
ULFI YUNIDA ARDIANI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
ABSTRAK
ULFI YUNIDA ARDIANI. Analisis Keragaman Genetik Gen 16S-rRNA dan
Karakterisasi Fisiologis Bakteri Asal Usus Udang Vaname Litopenaeus vannamei
dari Berbagai Umur. Dibimbing oleh MUNTI YUHANA dan DINAMELLA WAHJUNINGRUM.
Populasi mikroba usus sangat berperan dalam memelihara dan mempertahankan status kesehatan organisme dan secara keseluruhan memegang peran penting dalam produktivitas budidaya. Dalam penelitian ini dilakukan isolasi bakteri mikroflora normal asal usus udang vaname yang dipelihara di tambak perairan payau. Penelitian ini bertujuan untuk mengkarakterisasi keragaman genetik maupun fisiologis dari isolat-isolat yang terkumpul. Untuk pendekatan molekuler digunakan amplifikasi PCR terhadap gen target 16S-rRNA dengan teknik
ARDRA (Amplified Ribosomal DNA Restriction Analysis), sedangkan
karakterisasi fisiologis dilakukan dengan melakukan uji-uji biokimia dan
morfologi sel. Sebanyak 45 isolat terseleksi dan 2 isolat referens yaitu bakteri V.
harveyi digunakan dalam penelitian ini. Gen 16S-rRNA diamplifikasi dengan 3 pasang primer terpilih (yang paling sesuai untuk masing-masing isolat), yaitu primer 0008F berpasangan dengan 1524R , 63F berpasangan dengan 1387R, dan 0008F berpasangan dengan 1492RH. Hasil amplifikasi dipotong dengan enzim
restriksi Sau3AI (5’-↓GATC). Pola ARDRA pada gel elektroforesis digunakan
sebagai sumber data dan dilakukan input data matriks biner untuk kontruksi pohon filogenetika. Pohon filogenetika ini digunakan untuk mempelajari hubungan kekerabatan antar jenis bakteri yang diisolasi. Berdasarkan analisis filogeninya, diketahui keragaman bakteri pada usus udang terdiri dari 30 OTU (Organism Taxonomy Unit) yang berbeda. Berdasarkan hasil karakterisasi fisiologisnya, secara umum bakteri usus udang umur 1 bulan, 2 bulan, dan 3 bulan
termasuk dalam genus Bacillus dan Kurthia.
Kata kunci: Vaname, L. Vannamei, mikroflora usus, bakteri, ARDRA, analisis
ABSTRACT
ULFI YUNIDA ARDIANI. Analyses of Intestinal Bacteria Isolated from
Various Stages of Cultured-White Shrimp, Litopenaeus vannamei, using Genetic
Diversity of 16S-rRNA genes and the Physiological Characterization. Supervised by MUNTI YUHANA and DINAMELLA WAHJUNINGRUM.
Intestinal microbial population plays important roles in the shrimp health as the host and overall will influence the final productivity of the cultured shrimp. The number and the composition of the intestinal microbes of the aquatic organisms were greatly influenced by the microbes present in the water column which are mostly entered the digestion system of the shrimp unintentionally. In this study,
we isolated intestinal bacteria of the white shrimp, Litopenaeus vannamei,
cultured in brackishwater from various stages. The objective of this study was to analyse the diversity of the 16S rRNA gene employing ARDRA (Amplified performed using 0008F and 1492RH. Physiological characterizations were conducted to observe the cell morphologies, and biochemical tests employing Gram staining, O/F test, catalase test, and oxidase test. PCR products of the different primers pairs resulted in the DNA lenghts ranging from 1400 to 1500 basepairs. The PCR products were subjected to digestion of restriction enzyme of
Sau3AI (5’-↓GATC). After incubation, the digested PCR products were loaded in
the agarose gels and further run by electrophoresis. Based on polymorphisms profile of DNA bands appeared in the agarose gels, the binary matrix was recorded and was used as the data source for phylogenetic tree construction. Phylogenetic analyses showed that those isolates are distributed into 30 different
OTUs (Organisms Taxonomy Unit) which are common dominated by Bacillus
and Kurthia.
Keyword: White shrimp, L. vannamei, intestinal microflora, bacteria, ARDRA,
ANALISIS KERAGAMAN GENETIK GEN 16S-rRNA DAN
KARAKTERISASI FISIOLOGIS BAKTERI ASAL USUS
UDANG VANAME Litopenaeus vannamei
DARI BERBAGAI UMUR
ULFI YUNIDA ARDIANI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi & Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
ANALISIS KERAGAMAN GENETIK GEN 16S-rRNA DAN
KARAKTERISASI FISIOLOGIS BAKTERI ASAL USUS UDANG VANAME Litopenaeus vannamei DARI BERBAGAI UMUR
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, April 2011
ULFI YUNIDA ARDIANI
Menyetujui,
Pembimbing I Pembimbing II
Dr. Munti Yuhana, S.Pi., M.Si. Dr. Dinamella Wahjuningrum, S.Si., M.Si.
NIP. 19691220 199403 2 002 NIP. 19700521 199903 2 001
Mengetahui,
Ketua Departemen Budidaya Perairan
Dr. Ir. Odang Carman, M.Sc.
NIP. 19591222 198601 1 001
Tanggal Lulus: 01 April 2011
Judul Skripsi : Analisis Keragaman Genetik Gen 16S-rRNA dan
Karakterisasi Fisiologis Bakteri Asal Usus Udang
Vaname Litopenaeus vannamei dari Berbagai Umur
Nama Mahasiswa : Ulfi Yunida Ardiani
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas segala
limpahan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini sesuai
dengan waktu yang direncanakan. Skripsi yang berjudul “Analisis Keragaman
Genetik Gen 16S-rRNA dan Karakterisasi Fisiologis Bakteri Asal Usus Udang Vaname Litopenaeus vannamei dari Berbagai Umur” telah selesai
dikerjakan.
Penulis mengucapkan terima kasih kepada Dr. Munti Yuhana selaku
Pembimbing Skripsi I dan Dr. Dinamella Wahjuningrum selaku Pembimbing
Skripsi II yang telah memberikan pengarahan dan bimbingan selama penelitian
dan penyusunan skripsi, Dr. Tataq Budiardi selaku dosen penguji, serta Dr.
Sukenda selaku manager tambak PT. Pinang Gading yang telah mengijinkan
penulis memperoleh sampel udang, Dr. Dedi Jusadi selaku Pembimbing
Akademik yang telah memberikan nasehat selama proses studi, Bapak Ranta dan
Mbak Anna atas bimbingannya selama melaksanakan penelitian di laboratorium,
Ayahanda dan Ibunda serta keluarga yang telah memberikan dorongan dan
do’anya, sahabat KMK yang telah memberikan motivasi tersendiri, teman-teman LKI„ers, teman-teman Genetic’ers. teman-teman seperjuangan BDP angkatan’43,
serta bapak, ibu, dan kakak pasca sarjana. Adik-adik dari BDP angkatan ’44 dan
angkatan ’45 yang tidak dapat saya sebutkan satu per satu, penulis berterima kasih
atas segala bantuan, dukungan, dan supportnya.
Akhirnya penyusun berharap semoga skripsi ini bermanfaat bagi semua
pihak yang membutuhkannya.
Bogor, April 2011
i
DAFTAR ISI
Halaman
DAFTAR ISI ... .. i
DAFTAR GAMBAR ... .. ii
DAFTAR TABEL ... .. iii
DAFTAR LAMPIRAN ... iv
I. PENDAHULUAN ... 1
II. BAHAN DAN METODE ... 2.1 Isolasi bakteri ... 3
2.2 Amplified Ribosomal DNA Restriction Analysis (ARDRA)... 2.2.1 Ekstraksi DNA Genom Bakteri ... 3
2.2.2 Amplifikasi Gen 16S-rRNA ... 4
2.2.3 Digesti dengan Enzim Restriksi Sau3AI ... 5
2.2.4 Elektroforesis ... 5
2.2.5 Konstruksi Pohon Filogenetika dari Pola ARDRA ... 6
2.3 Analisis Keanekaragaman dan Dominansi ... 6
2.4 Karakterisasi Fisiologis dari Isolat... 7
III. HASIL DAN PEMBAHASAN ... 3.1 Hasil ... 8
3.2 Pembahasan ... 14
IV. KESIMPULAN ... 27
DAFTAR PUSTAKA ... 28
ii
DAFTAR GAMBAR
Halaman
1. PCR Amplifikasi Gen 16S-rRNA 47 Isolat Bakteri pada Usus Udang
dari Udang Umur 1 Bulan, 2 Bulan, dan 3 Bulan ... 9
2. Elektroforegraf Gel Agarosa Hasil Pemotongan Gen 16S-rRNA
dengan Enzim Restriksi Sau3AI untuk 47 Isolat Bakteri dari Usus
Udang ... 11
3. Intepretasi Hasil Pemotongan Gen 16S-rRNA dengan Enzim
Restriksi Sau3AI untuk 47 Isolat Bakteri dari Usus Udang ... 13
4. Bagian dari Anatomi Tubuh Udang (Usus) yang Diteliti ... 15
5. Bagian Sistem Pencernaan pada Udang ... 15
6. Pohon Filogenetika 31 Filotipe Bakteri dari Usus Udang Umur 1 Bulan, 2 Bulan, dan 3 Bulan dengan Menggunakan Enzim Restriksi
Sau3AI ... 20
7. Ilustrasi Komponen Bakteri Usus Udang Umur 1 Bulan, 2 Bulan, dan 3
iii
DAFTAR TABEL
Halaman
1. Pemilihan Koloni Bakteri Unik dari Usus Udang ... 8
2. Nilai Indeks Keanekaragaman dan Indeks Dominansi ... 13
3. Hasil Karakterisasi Morfologi, Fisiologi, dan Biokimia Bakteri Usus Udang yang Memiliki Pola ARDRA Unik ... 14
4. Kondisi Kualitas Air Pemeliharaan... 17
5. Kelompok Filogeni Bakteri Asal Usus Udang Umur 1 Bulan ... 22
6. Kelompok Filogeni Bakteri Asal Usus Udang Umur 2 Bulan ... 23
7. Kelompok Filogeni Bakteri Asal Usus Udang Umur 3 Bulan ... 23
8. Kelompok Filogeni Bakteri yang Terdapat pada Usus Udang Umur 1, 2, dan 3 Bulan ... 24
iv
DAFTAR LAMPIRAN
Halaman
1. Isolasi Bakteri dengan Metode Cawan Sebar ... 31
2. Pewarnaan Gram ... 32
3. PCR (Polymerase Chain Reaction)... 33
4. Uji Biokimia ... 34
5. Tabel Asal Isolat ... 37
6. Nilai Keanekaragaman dan Dominansi ... 38
I.
PENDAHULUAN
Selaras dengan program peningkatan produksi perikanan, KKP telah
menetapkan target produksi perikanan sebesar 22,54 juta ton pada tahun 2014.
Dari jumlah tersebut, sebanyak 16,89 juta ton berasal dari perikanan budidaya,
yang salah satu komoditas unggulannya adalah udang. Komoditas udang
diproyeksikan mengalami peningkatan produksi setiap tahun sebesar 13 persen
untuk udang windu Penaeus monodon dan 16 persen untuk vaname Litopenaeus
vannamei. Sementara produksi udang pada tahun 2014 ditargetkan adalah sebesar 699 ribu ton, yang terdiri atas 188 ribu ton udang windu dan 511 ribu ton udang
vaname (KKP, 2010).
Parameter indikator keberhasilan dalam budidaya intensif udang vaname
yaitu tingginya nilai Average Daily Growth (ADG) atau pertumbuhan rata-rata
harian (gram/hari) dan nilai Feed Convertion Ratio (FCR) yang rendah sehingga
memperoleh keuntungan yang tinggi (Shahab, 2006).
Keberhasilan dalam budidaya udang vaname didukung oleh kelebihan yang
dimiliki udang vaname. Kelebihan jenis udang vaname adalah resisten terhadap
penyakit dan toleran terhadap kualitas lingkungan yang rendah, antara lain toleran
terhadap perubahan suhu air yaitu antara 23-30 ºC dan kandungan oksigen terlarut
nilainya lebih dari 5 mg/l (Boyd, 1991). Selain itu, kelebihan udang vaname
adalah mampu memanfaatkan seluruh kolom air dengan padat tebar yang cukup
tinggi yaitu sekitar 100 – 300 ekor/m2 (Shahab, 2006).
Dengan mempertimbangkan kelebihan udang vaname tersebut maka perlu
dilakukan eksplorasi dan karakterisasi untuk mengetahui berbagai macam
mikroflora normal yang berada pada usus udang tersebut, karena keseimbangan
mikroflora yang normal merupakan salah satu faktor yang sangat menentukan
status kesehatan udang. Selain itu, perlu dilakukan karakterisasi keberagaman
bakterinya yang diduga memiliki potensi sebagai kandidat probiotik khususnya
untuk udang, dan umumnya untuk organisme budidaya air payau atau laut lainnya.
menampilkan keragaman genetika mikroba, baik yang dapat dikulturkan maupun
tidak. Gen 16S-rRNA merupakan pilihan karena gen ini terdapat pada semua prokariota dan memiliki bagian atau sekuen konservatif dan sekuen lainnya yang sangat bervariasi (Madigan et al. 1997). Penggunaan gen 16S rRNA telah digunakan sebagai parameter sistematik molekular yang universal, representatif, dan praktis untuk mengkonstruksi kekerabatan filogenetik pada tingkat spesies (Woese et al. 1990 dalam Khaeruni 2005). Analisis keragaman genetika yang cepat dan sederhana, untuk menelaah profil DNA gen 16S-rRNA hasil amplifikasi dengan PCR dapat dilakukan dengan teknik amplified ribosomal DNA restriction analysis (ARDRA). Analisis ini dilakukan dengan cara mengamplifikasi gen
16S-rRNA dengan primer yang disesuaikan dengan sampel DNA yang akan diamplifikasi (Bornerman et al. 1996). Marchesi et al. (1998) dan Lane (1991) telah mendesain primer untuk amplifikasi gen 16S-rRNA yang memungkinkan untuk melakukan studi keragaman bakteri secara genetik.
Hasil amplifikasi gen 16S-rRNA ini kemudian dipotong dengan enzim restriksi. Pola hasil pemotongan dengan enzim restriksi ini dapat digunakan untuk memperkirakan keragaman jenis bakterinya. Metode ini didasarkan pada prinsip
pemotongan enzim restriksi yang spesifik pada bagian tertentu dari gen 16S-rRNA sehingga dapat menunjukkan pohon filogenetika yang berbeda untuk setiap jenis prokariota (Deya et al. 1995).
Sifat metabolisme bakteri dalam fisiologis dan uji biokimia biasanya
dilihat dari interaksi metabolit-metabolit yang dihasilkan dengan reagen-reagen
kimia. Selain itu dilihat kemampuannya menggunakan senyawa tertentu sebagai
sumber karbon dan sumber energi (Waluyo, 2004).
I.
BAHAN DAN METODE
2.1Isolasi Bakteri
Isolasi bakteri merupakan proses memisahkan koloni-koloni bakteri yang secara morfologi terlihat mendominasi maupun yang unik (segi warna, morfologi, dan ukuran) dari media pemeliharaan. Udang sampel diambil dari tambak udang PT. Pinang Gading Lampung. Udang sampel ini berasal dari berbagai umur yang berbeda yaitu berumur 1 bulan, 2 bulan, dan 3 bulan. Ketiga umur tersebut masing-masing berjumlah 3 ekor dan diambil dari petak tambak yang berbeda.
Pengisolasian pertama kali dilakukan dengan pembedahan sampel usus udang vanname Litopenaeus vannamei. Bagian abdomen udang dibedah dan diambil ususnya, usus tersebut dicacah atau dihaluskan dengan menambahkan sedikit akuades. Usus yang telah dihaluskan dilakukan pengenceran dari 10-1, sampai 10-4 dengan larutan Phosphate-Buffered Saline (PBS) (Lampiran 1). Hasil dari pengenceran masing-masing disebar pada media Sea Water Complete (SWC)
yang berada dalam cawan petri. Setelah itu diinkubasi selama 24 jam. Koloni bakteri yang secara morfologi terlihat mendominasi maupun yang unik diisolasi untuk diamati keragaman genetik bakterinya. Koloni-koloni yang tampak unik dalam pigmentasi dan morfologinya secara visual juga diambil, kemudian
dimurnikan dengan metode kuadran hingga didapatkan koloni bakteri tunggal. Setelah itu koloni bakteri tunggal tersebut diidentifikasi dengan pewarnaan Gram.
Adapun metode dan bahan pewarnaan Gram dapat dilihat pada lampiran 2.
2.2 Amplified Ribosomal DNA Restriction Analysis (ARDRA)
2.2.1 Ekstraksi DNA Genom Bakteri
Pengekstraksian DNA dilakukan dengan menggunakan larutan
cetyltrimetyl ammonium bromide (CTAB) (modifikasi Murray and Thompson
1980). Isolat bakteri yang telah murni, masing-masing ditumbuhkan dalam media
suhu 28oC dalam shaker dengan kecepatan 140-160 rpm. Kemudian bakteri
dipanen sebanyak 5 ml dan dimasukkan ke dalam eppendorf, disentrifugasi
dengan kecepatan 12000 rpm selama 1 menit dan supernatannya dibuang. Pelet
yang telah mengendap dalam eppendorf dikeringkan dengan membalikkan di atas
tisue. Ke dalam tabung yang berisi pelet bakteri ditambahkan 500 µ l 1x TE buffer,
kemudian diresuspensi dan sentrifugasi dengan kecepatan 12000 rpm selama 5
menit. Supernatan dibuang dan pelet sel diresuspensikan kembali dengan 1x TE
buffer sebanyak 500 µ l. Kedalam tabung yang berisi pelet juga ditambahkan 100
µ l lysozym (50 mg/µ l) dan diinkubasi pada suhu 37oC selama 1 jam (setiap 15
menit dibolak-balik). Setelah itu ditambahkan 100 µ l SDS 10% dan 10 µ l
K-Proteinase diinkubasi lagi pada suhu 37oC selama 1 jam. Kemudian dimasukkan
100 µ l NaCl 5M dan100 µ l CTAB, dihomogenkan dan diinkubasi pada suhu 65oC
selama 20 menit. Selanjutnya ke dalam campuran ditambahkan 500 µ l
phenol:chloroform:isoamyl alkohol (25:24:1), divortex selama 30 detik, kemudian
disentrifugasi pada kecepatan 10.000 rpm selama 5 menit. Supernatan diambil dan
dipindahkan ke dalam Eppendorf steril yang telah berisi 600 µ l
isopropanol/ethanol absolut dingin (-20oC) dan dibolak-balik hingga timbul
benang-benang DNA. DNA dalam bentuk pelet dicuci dengan 1 ml ethanol 70%
dingin dan dikeringudarakan selama 4-24 jam untuk menguapkan ethanol yang
masih tersisa. Langkah terakhir dalam ekstraksi DNA adalah penambahan elution
buffer sebanyak 20 – 30 µ l dan selanjutnya DNA disimpan pada suhu -20oC untuk
keperluan selanjutnya.
2.2.2 Amplifikasi Gen 16S-rRNA
Sampel DNA sebanyak 0,5 µ l dimasukkan ke dalam tabung PCR yang
berisi reagen-reagen PCR yang dicampur. Reagen PCR yang dicampur ini antara
lain 17,5 µ l ddH2O, 2,5 µl dNTP 2,5 mM, 2,5 µl Buffer Taq, 0,2 µl enzim DNA
Taq Polimerase, 1 µ l primer. Secara umum sampel DNA bakteri pada penelitian
ini menggunakan primer 0008F (5’ AGA GTT TGA TCM TGG CTC AG 3’) 1.5 µM yang berpasangan dengan primer 1524R (5’ AAG GAG GTG ATC CAR
TCM TGG CTC AG 3’) 1,5 µM yang berpasangan dengan primer 1492RH (5’
GHT ACC TTG TTA CGA CTT 3’) 1,5 µM (Lane, 1991). Sampel DNA bakteri
yang tidak dapat teramplifikasi dengan primer 0008F yang berpasangan dengan
1524R, alternatifnya digunakan primer 63F (5’ CAG GCC TAA CAC ATG CAA
GTC 3’) 5 pmol berpasangan dengan 1387R (5’ GGG CGG WGT GTA CAA GGC 3’) 5 pmol (Marchesi et al. 1998). PCR dilakukan menggunakan PCR
GeneAmp®PCR System 2400, Perkin Elmer, USA (Lampiran 3). Primer 0008F
dan 1524R di PCR dengan kondisi: Pre start 94oC 2 menit; denaturasi 92oC 2
menit, annealing primer 58oC 30 detik, extention 72oC 1 menit 20 detik yang
dilakukan sebanyak 25 siklus; post PCR 72oC 10 menit. Primer 63F dan 1387R di
PCR dengan kondisi Pre start 94oC 2 menit, denaturasi 92oC 2 menit, annealing
primer 55oC 30 detik, extention 75oC 1 menit, yang dilakukan sebanyak 30 siklus;
post PCR 72oC 20 menit. Primer 0008f dan 1492rh diPCR dengan kondisi Pre
start 94oC 2 menit; denaturasi 94oC 15 detik, annealing primer 50oC 30 detik,
extention 72oC 1 menit 30 detik, ekstra extention 72 oC 10 menit, yang dilakukan
sebanyak 30 siklus; post PCR 10oC 10 menit. Setelah itu, suhu diturunkan dan
diakhiri pada 4oC.
2.2.3 Digesti dengan Enzim Restriksi Sau3AI
Hasil amplifikasi gen 16S-rRNA dari masing-masing sampel dipotong
dengan menggunakan enzim restriksi Sau3AI (5’-↓GATC) (EU, PureExtreme™
Fermentas). Setiap reaksi pemotongan terdiri atas 6 µ l hasil PCR (gen
16S-rRNA), 1,5 µl buffer enzim restriksi 10X, 0,15 µl enzim restriksi [10 unit/ µ l], dan
7,5 µl ddH2O. Selanjutnya setiap tabung yang berisi reaksi di atas, diinkubasi
pada suhu 37oC selama 16 jam. Hasil pemotongan kemudian dielektroforesis
dengan kondisi 150 V 80 mA, sampai ± 45 menit. Setelah proses elektroforesis
selesai, gel diamati di atas lampu UV transiluminator dan didokumentasi untuk
melihat pola ARDRA. Pola ARDRA ini dijadikan data biner sebagai input untuk
2.2.4 Elektroforesis
Gel agarose dibuat dengan melarutkan serbuk gel agarose sebanyak 1,9%
dalam 30 ml larutan Tris boric EDTA (TBE) yang mengandung ethidium bromida
(0,01 g/ml). Kemudian dipanaskan dalam microwave sampai larutan menjadi
berwarna bening. Larutan tersebut didiamkan sampai hangat lalu dituangkan ke
dalam cetakan yang sudah terpasang sisir pembuat sumur. Kemudian gel
dibiarkan sampai membeku. Setelah itu, sisir dilepaskan dan padatan gel
dimasukkan ke dalam bak elektroforesis yang berisi buffer TBE.
Sampel produk PCR sebanyak 5 µ l dicampurkan dengan 0,5-1 µ l loading
dye, lalu dimasukkan ke dalam sumur yang terdapat dalam gel dengan
menggunakan mikropipet. Setelah itu, 2 µ l marker DNA dimasukkan ke dalam
sumur di dekat sumur sampel. Bak elektroforesis ditutup dan listrik dialirkan
dengan tegangan 150 volt dan kuat arus 80 mA. DNA akan bermigrasi dari kutub
negatif ke positif. Setelah pewarna bromophenol blue bermigrasi sampai tiga per
empat bagian dari panjang gel (± 45 menit), aliran listrik dihentikan. Lalu gel
diangkat dan dilepaskan dari cetakannya. Kemudian keberadaan DNA dilihat
dengan bantuan ultraviolet transluminator. Dokumentasi dilakukan dengan
menggunakan kamera digitalyang sudah terhubung dengan komputer.
2.2.5 Konstruksi Pohon Filogenetika dari Pola ARDRA
Data biner hasil pemotongan dengan enzim restriksi Sau3AI dimasukkan
sebagai input program Treecon software copyright (c) Yves Van de Peer (Belgia)
untuk konstruksi pohon filogenetika.
2.2.6 Analisis Keragaman dan Dominansi
Analisis keragaman dan dominansi ini digunakan untuk menghitung
indeks keragaman dan dominansi suatu spesies di dalam populasi. Penelitian ini
menggunakan populasi bakteri usus udang umur 1 bulan, 2 bulan, 3 bulan, dan
dianalisis lagi indeks keragaman dan dominansinya, dengan indeks keragaman
dan indeks dominansi menurut Krebs (1972) yang dirumuskan sebagai berikut.
a. Indeks Keanekaragaman
Dimana: H’ = Indeks keanekaragaman
S = Jumlah jenis (spesies)
Pi = Ni/N = Sebagai proporsi jenis ke-i
Ni = Jumlah total individu jenis i
N = Jumlah seluruh individu dalam total n
Kriteria yang digunakan untuk menginterpretasikan keanekaragaman yaitu:
H’ < 1, keanekaragaman rendah
1 – 3, keanekaragaman sedang
>3, keanekaragaman tinggi
b. Indeks Dominansi
Dimana: C = Indeks dominansi
S = Jumlah jenis (spesies)
Pi = Ni/N = Sebagai proporsi jenis ke-i
Ni = Jumlah total individu jenis i
N = Jumlah seluruh individu dalam total n
Kriteria yang digunakan untuk menginterpretasikan dominansi yaitu:
Mendekati 1 : indeks besar atau cenderung dominansi oleh beberapa spesies
individu.
2.3 Karakterisasi Fisiologis dari Isolat
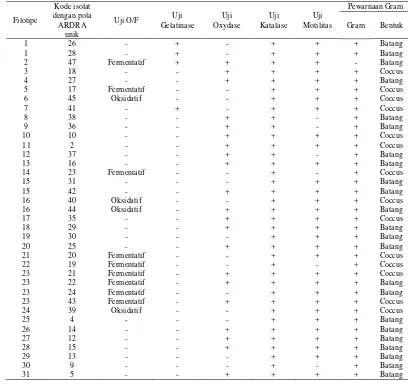
Hasil dari pola ARDRA yang berbeda yaitu didapatkan 31 pola ARDRA
dari 45 sampel dengan 2 sampel referens. Perwakilan dari sampel dengan pola
ARDRA yang berbeda dilakukan uji biokimia yang meliputi (1) uji motilitas
dengan menggunakan media Sulfide Indol Motile (SIM), (2) uji katalase dengan
menggunakan Hidrogen Peroksida (H2O2) 3%, (3) uji sitokrom oksidase dengan
menggunakan p-aminodimethylaniline-oxalat 1%, (4) uji oksidatif/fermentatif
menggunakan media oksidatif fermentatif, glukosa dan parafin cair (Lampiran 4)
I.
HASIL DAN PEMBAHASAN
3.1. Hasil
Pada saat pemeliharaan di tambak udang diberi probiotik bakteri Bacillus
sp dengan dosis yang sama banyaknya di setiap umur. Kondisi suhu, DO,
salinitas, dan pH juga relatif sama, sedangkan pembeda antara udang umur 1
bulan, 2 bulan, dan 3 bulan adalah tempat keberadaannya atau berbeda petak
tambaknya.
Bakteri yang tumbuh dominan dan unik dibandingkan dengan koloni
bakteri yang lain pada pengenceran tertinggi yaitu 104 diisolasi dari media Sea
Water Complete (SWC). Total jumlah koloni bakteri yang berada pada usus udang
yaitu 45 isolat dan 2 isolat bakteri Vibrio harveyi sebagai bakteri referens untuk
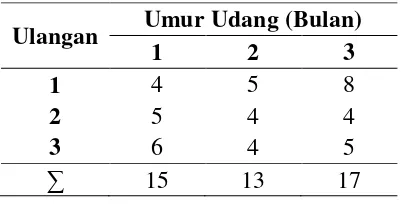
data biner pohon filogenetika. Pada usus udang umur 1 bulan didapatkan koloni
bakteri sebanyak 15 isolat, yaitu 4 koloni pada usus udang pertama, 5 koloni pada
usus udang kedua, dan 6 koloni pada usus udang ketiga. Pada usus udang umur 2
bulan didapatkan koloni bakteri sebanyak 13 isolat, yaitu 5 koloni pada usus
udang pertama, 4 koloni pada usus udang kedua, dan 4 koloni pada usus udang
ketiga. Pada usus udang umur 3 bulan didapatkan koloni bakteri sebanyak 17
isolat, yaitu 8 koloni pada usus udang pertama, 4 koloni pada usus udang kedua,
dan 5 koloni pada usus udang yang ketiga. Ditambahkan 2 isolat bakteri Vibrio
harveyi sebagai referens ke-45 isolat tersebut, jadi total semua bakteri berjumlah 47 isolat. Untuk lebih jelasnya dapat dilihat pada Tabel 1 berikut.
Tabel 1. Pemilihan Koloni Bakteri Unik dari Usus Udang
Ulangan Umur Udang (Bulan)
bulan. Sedangkan jumlah keragaman koloni bakteri pada udang umur 3 bulan
paling tinggi dibandingkan dengan umur 1 bulan dan 2 bulan.
Dilakukan ekstraksi DNA bakteri sebanyak 47 koloni, kemudian gen
16S-rRNAnya diamplifikasi dengan PCR, fragmen DNA gen 16S-rRNA yang
didapatkan berkisar 1400-1500 bp seperti yang terlihat pada Gambar 1.
1a. PCR amplifikasi gen 16S-rRNA isolat bakteri pada usus udang umur 1 bulan.
1b. PCR amplifikasi gen 16S-rRNA isolat bakteri pada usus udang umur 2 bulan.
1c. PCR amplifikasi gen 16S-rRNA isolat bakteri pada usus udang umur 3 bulan.
1d. PCR amplifikasi gen 16S-rRNA isolat bakteri referens.
Gambar 1. PCR Amplifikasi Gen 16S-rRNA 47 Isolat Bakteri pada Usus Udang dari Udang Umur 1 Bulan, 2 Bulan, dan 3 Bulan. M: Standar Ukuran
Molekul (Gene RulerTM DNA Ladder Lambda DNA/EcoRI+HindIII,
Fermentas); 1-47: Urutan Nomor Isolat Bakteri (Lampiran 5).
Hasil yang didapat setelah semua koloni bakteri berhasil diamplifikasi
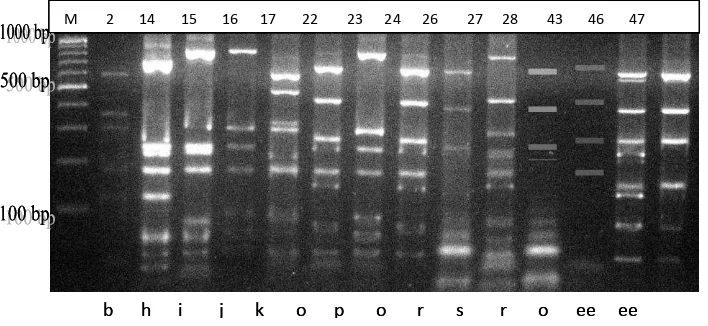
kemudian dipotong dengan enzim restriksi Sau3AI didapatkan 31 pola ARDRA,
yaitu pola a, b, c, d, e, f, g, h, i, j, k, l, m, n, o, p, q, r, s, t, u, v, w, x, y, z, aa, bb,
cc, dd, ee seperti yang terlihat pada Gambar 2.
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
M 29 30 31 32 33 34 35 43 37 38 39 40 41 42 36 44
M 45 46 47
2a. Elektroforegraf gel agarosa hasil pemotongan gen 16S-rRNA isolat koloni bakteri pada usus udang umur 1 bulan.
2b. Elektroforegraf gel agarosa hasil pemotongan gen 16S-rRNA isolat koloni bakteri pada usus udang umur 2 bulan.
2c. Elektroforegraf gel agarosa hasil pemotongan gen 16S-rRNA isolat koloni bakteri pada usus udang umur 3 bulan.
M 16 17 18 19 20 21 22 23 24 25 26 27 28
j k l m n o o p o q r s r M 1 2 3 4 5 6 7 8 9 10 11 12 13 1 4 15
a b b c a a a a d e b f g h i
M 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44
2d. Elektroforegraf gel agarosa hasil pemotongan gen 16S-rRNA isolat koloni bakteri referens.
2e. Elektroforegraf gel agarosa hasil pemotongan gen 16S-rRNA isolat koloni bakteri campuran.
Gambar 2. Elektroforegraf Gel Agarosa Hasil Pemotongan Gen 16S-rRNA
dengan Enzim Restriksi Sau3AI untuk 47 Isolat Bakteri dari Usus
Udang. M: Standar Ukuran Molekul (Gene RulerTM DNA Ladder 100
bp, Fermentas); 1-47: Urutan Nomor Isolat Bakteri; a-ee: Pola ARDRA. (Lampiran 5).
M 45 46 47
dd ee ee
M 2 14 15 16 17 22 23 24 26 27 28 43 46 47
b h i j k o p o r s r o ee ee M 2 14 15 16 17 22 23 24 26 27 28 43 46 47
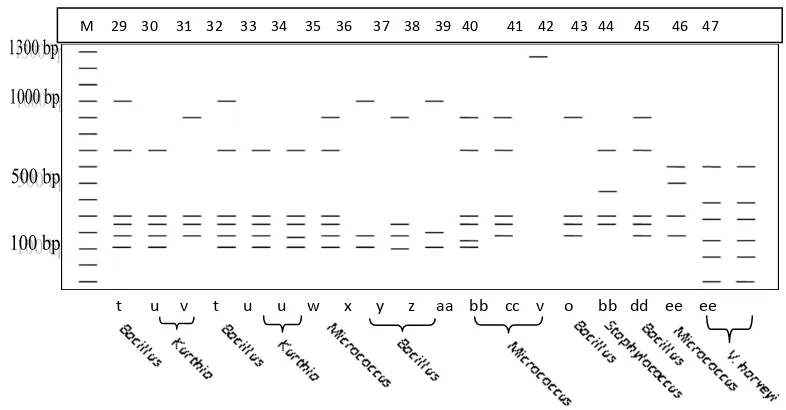
Intepretasi hasil pemotongan pola ARDRA dapat dilihat pada Gambar 3 berikut.
3a. Intepretasi hasil pemotongan gen 16S-rRNA isolat koloni bakteri pada usus udang umur 1 bulan.
3b. Intepretasi hasil pemotongan gen 16S-rRNA isolat koloni bakteri pada usus udang umur 2 bulan.
M 16 17 18 19 20 21 22 23 24 25 26 27 28
3c. Intepretasi hasil pemotongan gen 16S-rRNA isolat koloni bakteri pada usus udang umur 3 bulan dan bakteri V. harveyi sebagai referens.
Gambar 3. Intepretasi Hasil Pemotongan Gen 16S-rRNA dengan Enzim Restriksi
Sau3AI untuk 47 Isolat Bakteri dari Usus Udang. M: Standar Ukuran
Molekul; 1-47: Urutan Nomor Isolat Bakteri; a-ee: Pola ARDRA. (Lampiran 5).
Hasil pemotongan dengan ARDRA dijadikan data biner sebagai input data
dalam software pohon filogenetika untuk dilihat tingkat perbedaan dan
kekerabatannya. Untuk melihat nilai keragaman dan dominansinya digunakan
indeks keragaman dan indeks dominansi. Berdasarkan hasil perhitungan indeks
keanekaragaman dan indeks dominansi (Lampiran 6) dapat ditunjukkan pada tabel
2 berikut.
Tabel 2. Nilai Indeks Keanekaragaman dan Indeks Dominansi
Indeks Umur 1 bulan Umur 2 bulan Umur 3 bulan Gabungan
H' 2,9 3,2 3,3 4,6
C 0,18 0,13 0,10 0,04
Keterangan: H’ = Indeks Keanekaragaman C = Indeks Dominansi
Hasil yang didapat dari analisis pohon filogenetika yang berbeda
digunakan untuk pemilihan koloni, setiap koloni yang berbeda dilakukan uji
biokimia, hasil dari karakterisasi fisiologis dapat ditunjukkan pada Tabel 3
berikut.
t u v t u u w x y z aa bb cc v o bb dd ee ee
Tabel 3. Hasil Karakterisasi Morfologi, Fisiologi dan Biokimia Bakteri Usus
Pada penelitian kali ini dilakukan eksplorasi keragaman bakteri di dalam
usus udang umur 1 bulan, 2 bulan, dan 3 bulan. Jumlah bakteri terbanyak biasanya
berada di dalam usus, baik itu bakteri patogen maupun yang non-patogen. Bakteri
yang non patogen inilah yang memiliki potensi untuk meningkatkan produksi dan
mempertahankan SR (Survival Rate) pada udang vaname. Menurut Diogenes
(2006) usus udang terletak pada abdomen yang berada di sepanjang bagian dorsal
tubuh. Usus merupakan salah satu organ pencernaan yang vital dan selalu terdapat
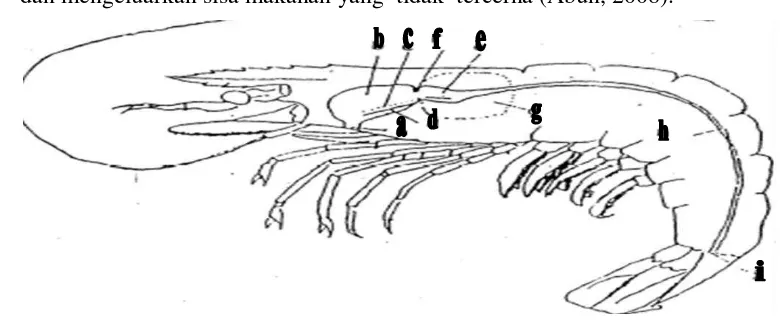
Gambar 4. Bagian dari Anatomi Tubuh Udang (Usus) yang Diteliti (Yudha, 2005)
Fungsi kolon pada usus udang antara lain: menyerap air selama proses
pencernaan, tempat dihasilkannya vitamin K, dan vitamin H (Biotin) sebagai hasil
simbiosis dengan bakteri usus, misalnya E.coli pada manusia atau bisa dikatakan
menciptakan lingkungan yang sesuai untuk mikroba usus, membentuk massa
feses, mendorong sisa makanan hasil pencernaan (feses) keluar dari tubuh
(Wasetiawan, 2009). Saluran pencernaan semua hewan dapat dianggap sebagai
tabung dari mulut sampai ke anus dan fungsinya adalah mencerna, mengabsorbsi,
dan mengeluarkan sisa makanan yang tidak tercerna (Abun, 2008).
Gambar 5. Bagian Sistem Pencernaan pada Udang (Abun, 2008)
Keterangan:
a.Oesophagus e.Gigi-gigicardiac i.anus
b.Ruang cardiac Proventriculus(perut) f.Cardiac ossicle
c.Ruang pyloric g.Hepatopancreas
d.Cardiac plate h.Usus
Pada penelitian ini dilakukan pengamatan tentang pola keragaman dan
dominansi genetik bakteri yang berada pada usus udang tersebut. Bakteri pada
usus udang umur 1 bulan, 2 bulan, dan 3 bulan relatif beragam baik jenis
bakterinya yang dilihat dari segi genetiknya maupun dari segi fisiologisnya.
Faktor yang menjadi pemicu keberagaman jenis bakteri pada usus tersebut diduga
karena sumber makanannya, akibat dipelihara pada petak tambak yang berbeda
dan adanya keberadaan bakteri probiotik. Rao et al., (1998), menjelaskan bahwa
probiotik merupakan mikroba hidup yang a-patogen, yang mekanisme kerjanya
mendesak mikroba non-indigenous keluar dari ekosistem saluran pencernaan, dan
menggantikan lokasi mikroba patogen di dalam saluran pencernaan. Karena
probiotik berasal dari mikroba indigenous, maka proses translokasi yang terjadi
berjalan secara alamiah di dalam ekosistem usus.
Keasaman bagian-bagian alat pencernaan mempunyai efek terhadap
kehidupan mikroba pencernaan yang erat sekali hubungannya dengan produk
enzim pencernaan maupun enzim produk mikroorganisme dari usus. Komponen
ion H+ dapat bersifat membunuh bakteri patogen ditambah dengan suasana pH
yang rendah (Abun, 2008). Salah satu pemicu tingkat keasaman pada bagian
alat-alat pencernaan adalah stres yang dialami udang.
Keberagaman jenis koloni bakteri yang berada pada usus udang dilihat
dari warna koloni, tepian koloni, serta bentuk koloni. Menurut, Abun, 2008,
faktor-faktor yang mempengaruhi kolorisasi mikroorganisme antara lain: faktor
yang berhubungan dengan inangnya (suhu tubuh, pH, dan tingkat potensi-oksidasi
reduksi, asam lambung, enzim, dan antibodi, faktor yang berhubungan dengan
interaksi mikroba (efek antagonistik, bakteriofag, bakteriosin), makanan dan
faktor lingkungan (seperti manosa, laktosa, dan karbohidrat lainnya dan atau serat
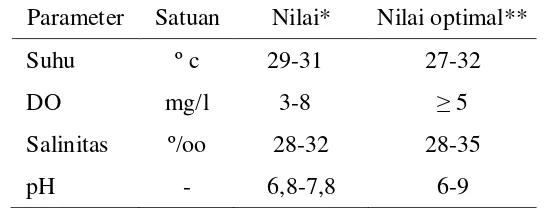
makanan serta faktor stres lingkungan). Tabel 4 berikut merupakan gambaran
Tabel 4. Kondisi Kualitas Air Pemeliharaan
Sumber:*) Tambak Udang PT. Pinang Gading Lampung **) Boyd, 1991
PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah
molekul DNA target tertentu dengan cara mensintesis molekul DNA baru yang
berkomplemen dengan molekul DNA target tersebut dengan bantuan enzim dan
oligonukleotida sebagai primer dalam suatu thermocycler (Muladno, 2002).
Amplifikasi DNA secara in vitro dengan PCR terdiri atas beberapa siklus, yang
setiap siklusnya terdiri dari 3 tahap, yaitu tahap denaturasi, pelekatan (annealing)
dan pemanjangan (elongation). Tahap denaturasi adalah pembentukan DNA utas
tunggal dari DNA utas ganda (putusnya ikatan hidrogen dari kedua utas tunggal
DNA yang berkomplementer) yang umumnya terjadi pada suhu ≥ 95oC. Tahapan
annealing yaitu pelekatan primer yang terjadi pada suhu sekitar 35-65oC, bergantung pada panjang pendeknya oligonukleotida primer yang digunakan.
Tahapan pemanjangan primer terjadi sebagai hasil aktivitas polimerisasi oleh
enzim Taq DNA polymerase, yang pada umumnya dilakukan pada suhu 70 oC
(Madigan et al., 1977).
Sebanyak 45 isolat bakteri didapatkan dari pengenceran paling tinggi, dan
2 isolat bakteri Vibrio harveyi sebagai referens ke-45 isolat tersebut, ke-47 isolat
bakteri tersebut gen 16S-rRNAnya diamplifikasi dengan PCR. Hasil amplifikasi
kemudian dilanjutkan dengan pemotongan DNA, dengan enzim restriksi atau
teknik ARDRA (Amplified Ribosomal DNA Restriction Analysis). Hasil
pemotongan 47 sampel dengan enzim restriksi Sau3AI ada yang menunjukkan
pola ARDRA yang dominan dan mendapatkan 31 pola ARDRA yang beragam.
Adapun pola ARDRA yang dominan pada udang umur 1 bulan, pola
pemotongannya a dengan kode sampel 1, 5, 6, 7, 8. Pada udang umur 2 bulan
memiliki pola ARDRA yang dominan pada pola pemotongan o dengan kode
Parameter Satuan Nilai* Nilai optimal**
Suhu º c 29-31 27-32
DO mg/l 3-8 ≥ 5
Salinitas º/oo 28-32 28-35
sampel 21, 22, 24, sedangkan pada udang umur 3 bulan yang memiliki pola
ARDRA yang dominan pada pola pemotongan u dengan kode sampel 30, 33, 34.
Pola ARDRA yang dominan ini menunjukkan bahwa pada setiap umur
udang memiliki bakteri yang mendominasi usus udang pada kisaran umur
tersebut. Pola ARDRA yang sama juga menunjukkan bahwa bakteri tersebut
memiliki hubungan kekerabatan yang dekat atau sejenis. Selain setiap usus udang
yang berbeda umur memiliki karakter yang mendominasi, ada juga bakteri yang
sejenis atau memiliki hubungan kekerabatan yang dekat tetapi terdapat pada usus
yang berbeda sampel udang dan yang berbeda umur. Hasil penelitian ini juga
menunjukkan bahwa pola ARDRA pada pola pemotongan o dengan kode sampel
43 adalah isolat bakteri yang terdapat pada usus udang umur 3 bulan, sedangkan
pola pemotongan o juga merupakan dominasi dari isolat usus udang umur 2 bulan.
Pada usus udang dengan umur yang sama, juga terdapat persamaan isolat
bakteri antara udang satu dengan kedua udang yang lain. Pada pola pemotongan a
dengan kode sampel 1 merupakan salah satu isolat bakteri yang terdapat pada usus
udang pertama umur 1 bulan, sedangkan kode sampel 5, 6, 7, 8 merupakan isolat
bakteri dari udang kedua umur 1 bulan. Begitu juga pada pola pemotongan b, v,
dan bb. Dimana pada pola b dengan kode sampel 11 merupakan salah satu isolat
bakteri pada udang ketiga umur 1 bulan, dan kode sampel 2, 3 merupakan isolat
bakteri pada udang pertama umur 1 bulan. Pada pola pemotongan v dengan kode
sampel 31 merupakan salah satu isolat bakteri pada udang pertama umur 3 bulan,
sedangkan kode sampel 42 merupakan salah satu isolat bakteri pada udang ketiga
umur 3 bulan. Pola pemotongan bb dengan kode sampel 40 dengan 44, dimana
kode sampel 40 merupakan salah satu isolat bakteri pada udang kedua umur 3
bulan, sedangkan kode sampel 44 merupakan salah satu isolat bakteri pada udang
ketiga umur 3 bulan.
Daerah yang dipotong oleh enzim tersebut adalah sama karena enzim
restriksi memiliki urutan nukleotida yang dikenali secara spesifik. Menurut,
Yuwono (2005), bahwa enzim endonuklease restriksi dapat dibedakan atas urutan
nukleotida yang dikenali yaitu dapat berupa urutan empat, lima, atau enam basa
yang spesifik. Daerah yang dipotong enzim tersebut bersifat spesifik dan terletak
Hubungan kekerabatan antar isolat bakteri beserta galur referens
berdasarkan hasil pemotongan dengan enzin restriksi Sau3AI dapat dilihat pada
Gambar 6 berikut ini.
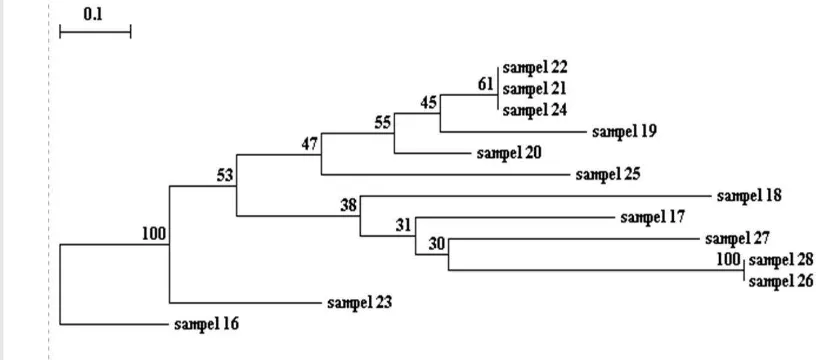
Gambar 6a. Pohon filogenetika pengelompokan isolat bakteri asal usus udang umur 1 bulan berdasarkan pola ARDRA.
Gambar 6c. Pohon filogenetika pengelompokan isolat bakteri asal usus udang umur 3 bulan berdasarkan pola ARDRA.
Gambar 6d. Pohon filogenetika umur 1 bulan, 2 bulan, dan 3 bulan berdasarkan pola ARDRA.
Gambar 6. Pohon Filogenetika 31 Filotipe Bakteri dari Usus Udang Umur 1 Bulan, 2 Bulan, dan 3 Bulan dengan Menggunakan Enzim Restriksi
Sau3AI. 0,1 : 10% Profile Difference, Angka 3 - 100 : Tingkat
Pada pohon filogenetika udang umur 1 bulan terdapat 9 felotipe dari 15
sampel, dari ke-9 filotipe yang berbeda tersebut terdapat 2 filotipe yang isolat
bakterinya berasal dari 2 udang yang berbeda tetapi masih dalam satu umur yaitu
umur 1 bulan, dengan kode sampel 1, 5, 6, 7, 8 dengan 2, 3, 11. Pada pohon
filogenetika umur satu bulan ini didominasi oleh filotipe 9 dengan kode sampel 1,
5, 6, 7, 8. Berdasarkan keanekaragaman dan dominansi yang dikemukakan oleh
Kreb (1972) (Lampiran 6). Didapatkan pada bakteri usus udang umur 1 bulan ini
tingkat keanekaragamannya bernilai sedang yaitu berkisar 1-3 dengan nilai
H’= 2,9. Nilai dominansi bakteri usus udang umur 1 bulan ini rendah yaitu mendekati 0 dengan nilai C= 0,18 , sehingga cenderung beragam.
Pada pohon filogenetika udang umur 2 bulan terdapat 10 filotipe dari 13
sampel, dan didominasi oleh filotipe pertama dengan kode sampel 22, 21, 24.
Pada bakteri usus udang umur 2 bulan ini indeks keanekaragamannya cenderung
tinggi yaitu bernilai >3 dengan nilai H’= 3,2 , nilai dominansinya juga mendekati
0 tetapi nilainya lebih rendah daripada bakteri usus udang pada umur 1 bulan
sampel 42, 31 dengan 44, 40. Dominasi bakteri udang umur 3 bulan terdapat pada
filotipe 11 dengan kode sampel 34, 33, 30. Berdasarkan nilai indeks
keanekaragaman, bakteri usus udang umur 3 bulan ini keanekaragamannya
bernilai tinggi, yaitu >3, tetapi lebih tinggi daripada keanekaragaman usus udang
umur 2 bulan dengan nilai H’= 3,3 , sedangkan nilai dominansinya rendah yaitu
mendekati 0. Bakteri usus udang umur 3 bulan ini nilai dominansinya paling
rendah diantara bakteri yang berasal dari 2 umur yang berbeda yaitu umur 1 bulan
dan 2 bulan dengan nilai C= 0,10.
Pada pohon filogenetika penggabungan bakteri usus udang umur 1 bulan,
2 bulan, dan 3 bulan yang ditambahkan 2 sampel referens yang sudah diketahui
6), berarti keragaman populasi bakteri yang terdapat pada usus udang vaname
sedikitnya terdiri atas 31 jenis bakteri yang berbeda dari segi keragaman
genetiknya. Dari ke-31 filotipe yang berbeda tersebut terdapat 1 filotipe yang
menggambarkan keberadaan isolat bakteri berjenis sama atau dekat
kekerabatannya tetapi berasal dari umur dan udang yang berbeda, ditunjukkan
pada filotipe ke 23 dengan kode sampel 21, 22, 24, 43. Pada filotipe ini juga
termasuk dalam dominasi isolat bakteri pada udang umur 2 bulan. Secara umum
dominasi isolat bakteri dari udang umur 1 bulan, 2 bulan, dan 3 bulan terdapat
pada filotipe ke-31, dimana kebanyakan berasal dari isolat bakteri udang umur 1
bulan. Berdasarkan nilai indeks keragamannya seluruh bakteri dari usus udang (
sebanyak 31 filotipe) ini memiliki nilai keanekaragaman yang tergolong tinggi,
yaitu >3 yaitu dengan niali H’= 4,6 , sedangkan nilai dominansi dari keseluruhan
bakteri usus udang ini tergolong mendekati 0 atau bernilai rendah dengan nilai C=
0,04.
Bakteri usus udang umur 1 bulan berdasarkan hasil pengamatan
fisiologinya didominasi dengan bakteri berbentuk batang dan termasuk Gram
positif. Berdasarkan sifat fisiologi, morfologi, dan biokimianya bakteri ini
termasuk dalam genus Bacillus (Tabel 5). Bakteri sejenis yang terdapat pada
sampel udang berbeda tetapi masih dalam satu umur yaitu umur 1 bulan ada 2,
yang pertama termasuk bakteri berbentuk coccus, Gram positif, dimana menurut
hasil karakterisasi fisiologinya termasuk dalam genus Streptococcus. Bakteri yang
kedua berbentuk batang termasuk Gram positif, hasil karakterisasinya termasuk
dalam genus Bacillus.
Tabel 5. Kelompok Filogeni Bakteri Asal Usus Udang Umur 1 Bulan
Kelompok
filotipe Kode sampel Kelompok genus
Keterangan
berbentuk batang dan coccus dan bersifat Gram positif. Berdasarkan hasil
(Tabel 6). Bakteri yang mendominasi usus udang umur 3 bulan berbentuk batang
termasuk dalam Gram positif, berdasarkan hasil identifikasinya termasuk genus
Kurthia. Bakteri sejenis yang terdapat pada sampel udang yang berbeda pada udang umur 3 bulan ada 2. Bakteri yang pertama termasuk dalam bakteri
berbentuk batang, Gram positif, hasil karakterisasi fisiologisnya termasuk genus
Bacillus dan Kurthia. Bakteri yang kedua berbentuk coccus dan batang termasuk
Gram positif, bedasarkan hasil identifikasinya termasuk genus Micrococcus dan
Bacillus (Tabel 7).
Tabel 6. Kelompok Filogeni Bakteri Asal Usus Udang Umur 2 Bulan
Kelompok
filotipe Kode sampel Kelompok genus Keterangan
Filotipe 1
22 Bacillus
21 Streptococcus Bakteri dominan
24 Listeria
Tabel 7. Kelompok Filogeni Bakteri Asal Usus Udang Umur 3 Bulan
Kelompok
filotipe Kode sampel Kelompok genus Keterangan
Filotipe 11 34, 33, 30 Kurthia Bakteri dominan
Filotipe 1 42 Bacillus Bakteri yang terdapat pada
sampel udang 1 dan 3
31 Kurthia
Filotipe 3 44 Bacillus Bakteri yang terdapat pada
sampel udang 2 dan 3
40 Micrococcus
Bakteri sejenis yang berasal dari isolat, umur, dan udang yang berbeda,
ditemukan dengan ciri-ciri bakteri yang berbentuk batang dan coccus bersifat
Gram positif, hasil karakterisasi fisiologinya termasuk genus Staphylococcus,
Bacillus, Streptococcus, dan Listeria. Bakteri yang mendominasi usus udang pada semua sampel udang adalah bakteri pada umur 1 bulan. Bakteri tersebut termasuk
Tabel 8. Kelompok Filogeni Bakteri yang Terdapat pada Usus Udang Umur 1, 2, dan 3 Bulan
Kelompok
filotipe Kode sampel Kelompok genus Keterangan
Filotipe 31 1, 5, 6, 7, 8 Bacillus Bakteri paling dominan
biokimianya dapat dilihat pada Gambar 7 berikut.
Gambar 7. Ilustrasi Komponen Bakteri Usus Udang Umur 1 Bulan, 2 Bulan, dan 3 Bulan Berdasarkan Uji Fisiologi, Morfologi, dan Biokimia.
Berdasarkan Gambar 7 terlihat bahwa pada bakteri usus udang umur 1
bulan dan 2 bulan berdasarkan karakterisasi fisiologisnya terdapat 3 bakteri yang
bergenus sama yaitu genus Streptococcus, Bacillus, dan Kurthia. Sedangkan
bakteri yang terdapat pada usus udang umur 2 bulan dan 3 bulan berdasarkan
karakterisasi fisiologisnya terdapat 4 bakteri yang bergenus sama yaitu genus
Micrococcus, Staphylococcus, Bacillus, dan Kurthia. Jika dilihat secara keseluruhan berdasarkan karakterisasi fisiologisnya bakteri yang terdapat pada
usus udang umur 1 bulan, 2 bulan, dan 3 bulan memiliki bakteri yang bergenus
sama, yaitu genus Bacillus dan Kurthia.
Berdasarkan hasil yang telah diperoleh, pada beberapa kelompok bakteri
ini diduga merupakan kelompok bakteri probiotik yang diberikan pada air
pemeliharaan udang. Bakteri ini diberikan ke tambak bertujuan untuk menjaga
kualitas air pemeliharaan. Diduga bakteri tersebut termakan oleh udang, dan
terekspresi di dalam usus udang sehingga menyeimbangkan mikroflora usus
udang vaname yang dipelihara. Pernyataan ini sesuai dengan Wanasuria, 2010,
yang mengatakan bahwa probiotik (mikroorganisme) yang ditambahkan ke dalam
air juga akan diserap oleh pakan dan ikut masuk ke dalam sistem pencernaan
untuk berkompetisi dengan bakteri patogen. Penggunaan probiotik merupakan
salah satu kontrol biologis untuk mengendalikan penyakit pada budidaya
perikanan. Mikroorganisme yang dapat digunakan sebagai probiotik tidak hanya
berasal dari golongan bakteri (Bacillus, Thiobacillus) tetapi juga berasal dari
golongan yeast (Sacharomyces cerevisiae) dan mikro alga (Tetraselmis sp).
Bakteri probiotik biasanya bersimbiosis pada usus atau saluran pencernaan
yang berperan sebagai bakteri non patogen, dan mengeliminir bakteri pathogen.
Bakteri ini juga membantu dalam sistem perombakan makanan dalam usus, maka
di dalam usus terjadi simbiosis mutualisme antara bakteri dan inangnya. Menurut
Fuller (1989) definisi probiotik adalah suatu produk yang mengandung mikroba
hidup non-patogen, yang diberikan pada hewan untuk memperbaiki laju
pertumbuhan, efisiensi konversi ransum, dan kesehatan hewan. Mulai saat ini
telah berkembang penggunaan probiotik sebagai pemacu pertumbuhan dan
meningkatkan kesehatan, termasuk untuk kesehatan ikan. Probiotik dalam
penerapannya sebagai produk bioteknologi terdiri atas tiga jenis produk yaitu
probiotik yang mengandung kultur bakteri, kultur khamir, dan kultur molds
(kapang) serta kombinasinya.
Probiotik tidak hanya menjaga keseimbangan ekosistem, namun juga
menyediakan enzim yang mampu mencerna serat kasar, protein, lemak, dan
mendetoksikasi zat racun atau metabolitnya. Probiotik mempercepat/menahan
aktivitas mikroba sehingga menyebabkan pH usus menurun. Hal ini akibat dari
terbentuknya ammonia. Probiotik pada hewan mempengaruhi indigenous
mikroflora sehingga merangsang pertumbuhan dengan konversi pakan lebih baik,
menjaga kesehatan, khususnya gangguan usus melalui stimulasi perbaikan
indigenous mikroflora dan kekebalan koloni dalam usus, stimulasi imun
non-spesifik, predigestion faktor antinutrisi (ANFs) seperti asam pitat, glukosinolat,
berbagai macam bakteri probiotik serta sistem aplikasinya dapat dilihat pada tabel
9 berikut.
Tabel 9. Probiotik Udang dalam Industri Akuakultur (Florez dan Guzman, 2009).
Bakteri
probiotik Digunakan di Aplikasi Cara kerja Dosis (cfu/ml) Bacillus sp.
harveyi dan kualitas air 108
Bacillus sp.
(Strain S11) P. monodon
Dicampur
dengan pakan Antagonis dengan V. harveyi 103
Bacillus sp.
(Strain P64) L. vannamei Air Antagonis dengan V. harveyi 107
Bacillus sp.
(Strain BT23) P. monodon Air Antagonis dengan V. harveyi 108
Bacillus sp. Penaeids Air
Nitrobacter sp. L. vannamei Air
Kualitas air dan kontrol
Nitrobacter sp. P. monodon Air
I.
KESIMPULAN
1.1. Kesimpulan
Sebanyak 45 isolat bakteri terseleksi, berhasil dikoleksi dari usus udang
berumur 1, 2, dan 3 bulan. Berdasarkan analisis genetik Gen 16S-rRNAnya,
didapatkan 30 pola ARDRA yang berbeda (OTU/ Organism Taxonomy Unit).
Analisa pohon filogenetika, menunjukkan keragaman genetika mikroflora usus
udang terkelompok menjadi 30 cabang filotipe (OTU). Dari hasil karakterisasi
fisiologis, jenis bakteri yang selalu ditemukan dalam populasi mikroflora usus
tersebut adalah genus Bacillus dan Kurthia.
1.2. Saran
Perlu dilakukan penelitian lanjutan, screening bakteri probiotik potensial
dari isolat bakteri terkoleksi, serta aplikasi bakteri probiotik tersebut pada
DAFTAR PUSTAKA
Abun. 2008. Hubungan Mikroflora dengan Metabolisme dalam Saluran Pencernaan Unggas dan Monogastrik. [Makalah Ilmiah]. Jurusan Nutrisi dan Makanan Ternak, Fakultas Peternakan, Universitas Padjadjaran Jatinangor. Bandung.
Bornerman, J., P.W. Skorch, K.M. O’Sullivan, J.A. Palus, N.G. Rumnajek, J.L.
Jansen, J. Neinhuis, E.W. Triplett. 1996. Molecular microbial diversity of an
agricultural soil in Wisconsin. Appl Environ Microbial 62: 1935-1943.
Deya, A.A.M., D.A. Odelson, R.F. Hiekey, J.M. Tiedje. 1995. Bacterial comunity fingerprinting of amplified 16S-23S ribosomal DNA gene sequences and restriction endonuclease analisis (ARDRA). Di dalam: Akkermans ADL,
Elsas JDV, Bruijin FJ. Moleculer Microbial Ecology Manual. London:
Kluwer Academic Publishers. Hlm 3.3.2/1-3.3.2/6.
Diogenes, P. 2006. Giant Red Hermit Crab Specimen Condition Live Specimen .
Gulf of Mexico, captive at Texas State Aquarium. Available
http://www.scribd.com/doc/28724426/ARTHOPODA. html. [8 Februari 2011].
Florez, M.L. and G.A. Guzman. 2009. The use of probiotic in fish and shrimp aquaculture. A. Review. Production, Evaluation, and Uses In Animal Feed. Campeche Mexico.
Fuller R. 1989. Application and Practical Aspects. Probiotik 2. Chapman & Hall.
Kennet, T. 2011. The genus Bacillus. Available http://www.text book of
bacteriology.net/Bacillus.html
Khaeruni, A. 2005. Keragaman genetik dan pengembangan metode deteksi cepat
penyebab pustule bakteri (Xanthomonas axonopodis pv. glycines) pada
kedelai. [Tesis]. Institut Pertanian Bogor, Bogor.
KKP. 2010. KKP Tingkatkan Produksi Udang dengan Jenis Unggul. Available http://www.cji.or.id/10/index.php?option=com_content&view=article&id=13 52:kkp-tingkatkan-produksi-udang-dengan-jenis unggul & catid = 22:news & Itemid=3. html. [10 Februari 2011].
Krebs, C. J. 1972. Ecology: The Experimental Analysis of Distribution and Abundance. Harper and Row Publisher. New York.
Lane D. J. 1991. 16S/23S rRNA sequencing. P. 115-175. In E. Stackebrandt and
Madigan, M.T., J.M. Martinko, J. Parker. 1997. Biology of Microorganisms. Ed ke-8. New Jersey: Prentice-Hall.
Marchesi, J.R., T. Sato, A.J. Weightman, T.A. Martin, J.C. Fry, S.J. Hiom, W.E. Wade. 1998. Design and evalution of useful bacterium specific PCR primers
that amplify genes coding for bacterial 16S-rRNA. Appl. Environ Microbiol
64: 795-799.
Muladno, 2002. Seputar Teknologi Rekayasa Genetika. Edisi pertama. Bogor: Wirausaha Muda dan USESE Foundation. Hlm 60-61.
Murray, M.G., and W.F. Thompson. 1980. Rapid isolation of high molecular weight plant DNA. Nucl. Acids. Res. 8: 4321-4325
Rao, M.B., A.M. Tanksale, M.S. Ghatge, and V.V. Deshpande, 1998. Molecular and Biotechnological Aspect of Microbial Proteases. J. Microbiol. Mol. Biol.
Rev. 62(3) : 597 – 635.
Shahab, A. 2006. Optimasi Produktivitas Budidaya Udang Vanname Litopenaeus
vanname dengan Menggunakan Metode Respon Surface dan non Linier Programming. [Tesis]. Institut Teknologi Surabaya, Surabaya.
Wasetiawan. 2009. Sistem Pencernaan Pada Hewan. Available http:// unila.ac.id/wasetiawan/files/2009/10/sistem-pencernaan-pada-hewan.pdf. html. [9 Februari 2011].
Waluyo, L. 2004. Mikrobiologi Umum. Universitas Muhamadiyah Malang:
Malang
Wanasuria, S. 2010. Probiotik Akuakultur. Available http://agritekno.com/ probiotik/103-probiotik-akuakultur.html. [1 Maret 2011]
Yudha, I.G. 2005. Udang Vanname kuning. Available http://blog. unila.ac.id/
indragumay/2010/06/05/udang-vannamei-kuning/. html. [21 Januari 2009].
Lampiran 1. Isolasi Bakteri dengan Metode Cawan Sebar
Gambar diatas merupakan cara pengenceran bakteri dari usus udang.
Setelah diinkubasi 24 jam, mendapatkan koloni yang dapat dilihat secara visual
berbeda bentuk, pigmentasi, dan morfologi. Koloni tersebut kemudian dimurnikan
di media SWC (Sea Water Complete).
0,1 ml
0,9 ml PBS
100 10-1 10-2 10-3 10-4 Usus udang
0,25 ml
Lampiran 2. Pewarnaan Gram
Koloni bakteri yang didapat diamati bentuk dan jenis Gramnya dengan
cara pewarnaan. Pewarnaan Gram ini yang harus dilakukan pertama kali yaitu
menginokulasikan koloni bakteri ke cover gelas yang telah ditetesi aquades dan
dikeringkan. Sampel tersebut kemudian ditetesi larutan kristal violet selama 1
menit, dibilas lagi dengan aquades, dan dikeringkan. Tahap selanjutunya isolat
ditetesi larutan Kalium Iodida selama 1 menit, dibilas lagi dengan aquades dan
dikeringkan. Sampel yang telah kering ditetesi lagi dengan alkohol 95% selama
30 detik, lalu dikeringkan. Tahap yang terakhir ditetesi pewarna safranin selama
30 detik, kemudian dibilas, dan dikering udarakan. Sampel tersebut siap diamati
di bawah mikroskop. Jika berwarna pink termasuk dalam bakteri Gram negatif,
tetapi jika berwarna ungu termasuk dalam bakteri Gram positif.
(http://aguskrisnoblog.wordpress.com/2011/01/11/pewarnaan-bakteri-dan-peran-nutrisi- sebagai-dasat-kehidupan-pada-mikroba/)
a. Ekspresi sel bakteri Gram negatif b. Ekspresi sel bakteri Gram positif
(http://www.textbookofbacteriology.n et/Bacillus.html)
Lampiran 3. PCR (Polymerase Chain Reaction)
Pertama kali dilakukan ketika proses PCR yaitu membuat master mix.
Master mix ini terdiri dari ddH2O, 10X Taq buffer, primer yang digunakan, dan
DNA Taq Polymerase. Pembuatan master mix ini selalu dalam keadaan suhu
rendah (-4 ºC sampai -20 ºC) untuk mengurangi kerusakan reagen-reagen PCR
yang akan digunakan. Master mix kemudian dibagi-bagi pada tube PCR sesuai
yang diperlukan. Tahap yang terakhir mencampur hasil ekstraksi DNA sampel ke
dalam pembagian master mix tersebut, dan menginkubasinya di mesin
thermocycler (PCR). Berikut merupakan gambaran pada saat dilakukannya proses PCR.
Master mix (on ice)
Spin down
Lampiran 4. Uji Biokimia
4a. Uji motilitas
Pada uji ini digunakan media SIM. Cara mengujinya yaitu isolat
bakteri diambil dari medianya dengan menggunakan jarum ose, kemudian
jarum ose tersebut ditusukkan ke dalam media yang semi padat tadi.
Diinkubasi selama 24 jam, diamati pergerakan bakterinya. Berikut
merupakan contoh hasil akhirnya.
Tipe Motilitas Bakteri
( http//science-query.com/tag/pada-media/)
Motil
4b. Uji Oksidasi/Fermentasi
Pada uji ini digunakan media O/F. Cara uji O/F dengan melakukan
inokulasi bakteri pada media O/F (dengan cara ditusukkan). Salah satu
tabung diberi parafin cair 1 ml. Media yang telah diinokulasikan tersebut
diinkubasi selama 24 jam. Jika warna kedua tabung setelah diinkubasi
berwarna kuning maka berarti bersifat fermentatif. Apabila tabung tetapi
jika tabung yang tidak diberi parafin cair berubah menjadi kuning
sedangkan yang diberi parafin cair tidak berubah warna maka bersifat
Oksidatif. Jika hasil kedua tabung berwarna hijau berarti bersifat negatif.
Berikut merupakan contoh hasilnya.
4c. Uji Oxydase
Uji ini dilakukan dengan p-aminodimethylaniline-oxalat 1%,
dimana cara ujinya dilakukan dengan meneteskan larutan tersebut diatas
gelas preparat yang sudah ada kertas saringnya, kemudian inokulasi isolat
bakteri diatas larutan dan kertas saring tersebut. Jika hasilnya berubah
warna berarti positif, tetapi jika tetap berwarna ungu hasilnya negatif.
Berikut merupakan salah satu hasil pengujiannya.
Fermentatif Negatif Oksidatif
positif
4d. Uji katalase
Uji ini dilakukan dengan larutan Hidrogen Peroksida (H2O2) 3%,
cara ujinya, Diinokulasi isolat bakteri dengan ose pada gelas preparat,
kemudian ditetesi larutan tersebut 1 tetes, hasilnya jika mengeluarkan
gelembung berarti positif, tetapi jika tidak bergelembung hasilnya negatif.
Berikut merupakan salah satu hasil yang didapatkan setelah diuji katalase.
6b. Indeks Dominansi
Keterangan: Pi = Proporsi jenis ke-i