Lampiran 1. Hasil identifikasi tanaman
Lampiran 2. Karakteristik daun pugun tanoh
Makroskopik daun pugun tanoh
Serbuk simplisia daun pugun tanoh
c d e
f g h
Mikroskopik serbuk simplisia daun pugun tanoh Keterangan:
a. Sel epidermis b. tulang daun c. Trikoma
d. Kristal kalsium oksalat bentuk prisma e. Berkas pembuluh angkut bentuk spiral f. Stomata tipe diasitik
g. Stomata tipe anomositik h. Sel tetangga
a b
Lampiran 3. Hasil karakterisasi Simplisia 1. Penetapan Kadar air
% Kadar air simplisia = volume air (ml )
berat sampel (g) x 100%
No. Berat sampel (g) Volume awal (ml) Volume akhir (ml)
1. 5,043 1,80 2,10
2. 5,032 2,10 2,40
3. 5,021 2,40 2,70
% Kadar air = volume akhir−volume awal
berat sampel x 100%
1. % Kadar air = 2,10− 1,80
5,043 x 100% = 5,95%
2. % Kadar air = 2,40− 2,10
5,032 x 100% = 5,96%
3. % Kadar air = 2,70− 2,40
5,021 x 100% = 5,97%
% rata-rata kadar air = 5,95% + 5,96% +5,97%
3 = 5,96%
2. Penetapan Kadar Sari Larut Air
3. Penetapan Kadar Sari Larut Etanol
4. Penetapan Kadar Abu Total
% Kadar abu total = berat abu (g)
berat sampel (g)
x 100%
No. Berat sampel (g) Berat abu (g)
1. 2,017 0,171
2. 2,034 0,176
3. 2,022 0,173
1. % Kadar abu total = 0,171
2,017 x 100% = 8,48%
2. % Kadar abu total = 0,176
2,034 x 100% = 8,65%
3. % Kadar abu total = 0,173
2,022 x 100% = 8,56%
% rata-rata kadar abu total = 8,48% +8,65%+8,56%
3 = 8,56%
5. Penetapan Kadar Abu Tidak Larut Asam
% Kadar abu total = berat abu (g)
berat sampel (g)
x 100%
No. Berat sampel (g) Berat abu (g)
1. 2,017 0,021
2. 2,034 0,021
3. 2,022 0,019
1. % Kadar abu tidak larut asam = 0,021
2,017 x 100% = 1,04%
2. % Kadar abu tidak larut asam = 0,021
2,034 x 100% = 1,03%
3. % Kadar abu tidak larut asam = 0,019
2,022 x 100% = 0,94%
% rata-rata kadar abu tidak larut asam = 1,04%+1,03%+0,94%
3 = 1,00%
Lampiran 4. Alat organ bath
Bejana organ
Monitor komputer dan seperangkat alat Power Lab
Lampiran 5. Pola kenaikan kontraksi otot polos trakea marmut terisolasi setelah diinduksi asetilkolin konsentrasi bertingkat
Lampiran 6. Pola penurunan kontraksi otot polos trakea marmut terisolasi setelah pemberian EEDPT
Lampiran 7. Perhitungan effective concentration (EC80) asetilkolin terhadap otot -2.52 100.0000 100.0000 100.0000 100.0000 100.0000 0.0000
3. Log EC80=� 80 –66,2069
100 – 66,2069 × (−2.5−(−3))�+ −3
= -2,8041 EC80 = 1,57x10-3 M
4. Log EC80=� 80 –66,6667
100 – 66,6667 × (−2.5−(−3))�+ −3
= -2,808 EC80 = 1,56x10-3 M
EC80 rata-rata =
1,05+1,40+1,57+1,56
4
x
10-3
M = 1,39x10-3 M
Lampiran 8. Analisis uji-t independen nilai % relaksasi EEDPT terhadap kontraksi otot polos trakea oleh pemberian asetilkolin 10-3 M dengan inkubasi awal menggunakan teofilin 10-4 M selama 20 menit dengan % relaksasi EEDPT terhadap kontraksi otot polos trakea oleh pemberian asetilkolin 10-3 M tanpa inkubasi sebagai kontrol
* This is a lower bound of the true significance. a Lilliefors Significance Correction
Independent Samples Test
.266 .620 .211 8 .838 .4321800 2.05158 -4.29876 5.16312
.211 7.584 .839 .4321800 2.05158 -4.34435 5.20871
1.337 .281 .121 8 .907 .6057200 5.00399 -10.9335 12.1450
.121 5.983 .908 .6057200 5.00399 -11.6470 12.8584
.308 .594 -.305 8 .768 -1.610940 5.27321 -13.7710 10.5491
-.305 7.690 .768 -1.610940 5.27321 -13.8569 10.6350
.017 .901 -1.231 8 .253 -9.080700 7.37844 -26.0954 7.93401
-1.231 7.995 .253 -9.080700 7.37844 -26.0972 7.93577
1.163 .312 -2.005 8 .080 -15.42974 7.69640 -33.1777 2.31820
-2.005 7.678 .081 -15.42974 7.69640 -33.3081 2.44867
.768 .406 -1.927 8 .090 -19.30150 10.0165 -42.3997 3.79668
-1.927 6.466 .099 -19.30150 10.0165 -43.3896 4.78656
.815 .393 -1.851 8 .101 -12.63156 6.82256 -28.3644 3.10129
-1.851 5.302 .120 -12.63156 6.82256 -29.8732 4.61011
1.172 .311 -.710 8 .498 -6.833180 9.62173 -29.0209 15.3546
-.710 5.985 .504 -6.833180 9.62173 -30.3907 16.7243 Equal t-test for Equality of Means
Lampiran 9. Uji korelasi regresi antara dosis EEDPT dengan besarnya efek relaksasi otot polos trakea
Correlations
dosis EEPT % relaksas i
Va riables Entere d/Re movedb
All reques ted variables ent ered. a.
Dependent Variable: % relaksasi b.
Model Summary
.981a .963 .957 8.4039254
Model
Predictors: (Constant), dosis EEPT a.
Coeffi cientsa
-19.003 6.548 -2. 902 .027
16.178 1.297 .981 12.476 .000
(Const ant)
Dependent Variable: % relak sas i a.
DAFTAR PUSTAKA
Alsagaff, H. (2010). Dasar-dasar Ilmu Penyakit Paru. Surabaya: Universitas Airlangga Pressa.
American Lung Association (ALA). (2012). Trends in Asthma Morbidity and Mortality. Washington D.C: American Lung Association Epidemiology and Statistics Unit Research and Health Education Division. Hal. 2.
Anonim. (2007). Picria fel-terrae Merr. Tanggal akses 18 Mei 2014. http://www.globinmed.com/IMRContent/detail.aspx?id=BOT00054
Anonim. (2009). Picria fel-terrae Lour. Tanggal akses 2 Juli 2013.
Anonim. (2011). Medicinal plant: Sagai-uak. Tanggal akses 18 Mei 2014. http://www.bpi.da.gov.ph/bpioldsite1/medicinalplant_s.php
Astuti, P., Yunus, F., Antariksa, B., dan Ratnawati. (2011). Prevalensi dan Gejala Klinis Obstructive Sleep Apnea (OSA) pada Pasien Asma. Journal Indonesia Medical Association. 61(7): 273-279.
Azadmehr, A., Hajiaghaee, R., Zohal, M.A., dan Maliji, G. (2013). Protective Effects of Scrophularia striata in Ovalbumin-induced Mice Asthma Model. DARU Journal of Pharmaceutical Sciences. 21(56): 1-7.
Barnes, P.J. (1993). Muscarinic Receptor Subtypes in Airways. European Respiratory Journal. 6(1): 328-331
Barnes, P.J. (1995). Cyclic Nucleotides and Phosphodiesterases and Airway Function. European Respiratory Journal. 8(1): 457-462.
Boskabady, M.H., Keyhanmanesh, R., dan Saadatloo, M.A.E. (2008). Relaxant Effects of Different Fractions from Nigella sativa L. on Guineapig Tracheal Chains and Its Possible Mechanism(s). Indian Journal of Experimental Biology. 46(12): 805-810.
Carron, R., Sanz, E., Puebla, P., Martin, M.L., Roman, L.S., dan Guerrero, M.F. (2010). Mechanisms of Relaxation Induced by Flavonoid Ayanin in Isolated Aorta Rings from Wistar Rats. Colombia Medica. 41(1): 1-7.
Cheriet, T., Aouabdia, S., Mancini, I., Defant, A., Seghiri, R., Boumaza, O., Mekkiou, R., Sarri, D., Leon, F., Brouard, I., Benayache, F., dan Benayache, S. (2014). Chemical constituents of Linaria reflexa Desf. (Scrophulariaceae). Scholars Research Library. 6(1): 54-57.
Choi, J.R., Lee, C.M., Jung, I.D., Lee, C.S., Jeong, Y.I., Chang, J.H, Park, H.J., Choi, I.W., Kim, J.S., Shin, Y.K., Park, S.N., dan Park, Y.M. (2009). Apigenin Protects Ovalbumin-induced Asthma Through The Regulation of GATA-3 Gene Depkes RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen
Kesehatan RI.
Depkes RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI.
Ditjen POM. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Hal. 300- 306, 321, 325, 333-337.
Ditjen POM. (2000) Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Hal. 3-5.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants. J. Pharm. Sci. 55 (3): 264.
Fawcett, D.W. (2002). Buku Ajar Histologi. Jakarta: EGC. Hal. 257.
Fenneck, R. (2007). Phosphodiesterase Inhibitors and The Cardiovascular System. Continuing Education in Anaesthesia, Critical Care & Pain. 7(6): 203-207.
Gosens, R., Zaagsma, J., Meurs, H., dan Halayko, A.J. (2006). Muscarinic Receptor Signaling in the Pathophysiology of Asthma and COPD. Respiratory Research. 7(73): 1-15.
Hajare, R., Darvhekar, V.M., Shewale, A., dan Patil, V. (2010). Evaluation of Antihistaminic Activity of Piper betel Leaf in Guinea pig. African Journal of Pharmacy and Pharmacology. 5(2): 113-117.
Hall, I.P. (2000). Second Messengers, Ion Channels and Pharmacology of Airway Smooth Muscle. European Respiratory Journal. 4(15): 1120-1127. Harfina, F., Bahri, S., dan Saragih, A. (2012). Pengaruh Serbuk Daun Puguntano
(Curanga fel-terrae Merr.) Pada Pasien Diabetes Mellitus. Journal of Pharmaceutics and Pharmacology. 1(2): 112 -118.
Harborne, J.B. (1987). Metode Fitokimia. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Edisi II. Bandung: Penerbit ITB. Hal. 152.
Hidayat, A. A. A., dan Uliyah, M. (2008). Praktikum Keterampilan Dasar Praktik Klinik: Aplikasi Dasar- dasar Praktik Kebidanan. Jakarta: Salemba Medika.
Huang, Y., Bruyne, T.D., Apers, S., Ma, Y., Claeys, M., Pieters, L., dan Vlietinck, A. (1999). Flavonoid Glucuronides from Picria fel-terrae. Elsevier Science. 52(8): 1701-1703
Husori, D,I. (2011). Peranan Epitelial Terhadap Efek Relaksasi Senyawa Marmin dari Aegle marmelos Correa pada Otot Polos Trakea Marmut Terisolasi. Tesis. Universitas Gadjah Mada – Yogyakarta.
Husori, D.I., Riyanto, S., dan Nugroho, A.E. (2012). Relaxation Effect of Marmin on Guinea pig Tracheal Smooth Muscle via NO-independent Mechanism. Asian Pacific Journal of Tropical Disease. 1(1): 154-158.
Ikawati, Z. (2006). Pengantar Farmakologi Molekuler. Yogyakarta: UGM Press. Hal. 38.
Juwita, N.A. (2009). Pengujian Efek Antiinflamasi Ekstrak Etanol Daun Pugun Tano (Curanga felterrae Merr.) terhadap Mencit Putih. Skripsi. Medan: Fakultas Farmasi USU.
Kandel, E.R., Schwartz, J.H., dan Jessell, T.M. (2000). Principles of Neural Science. Edisi IV. USA: McGraw-Hill. Hal. 234.
Karyono, S.S. (2006). Perubahan Respons Reseptor Adrenergik-β dan Muskarinik di Otot Polos Saluran Nafas Tikus Wistar Pada Proses Penuaan. Jurnal Kedokteran Brawijaya. 22(3): 141-148.
Katzung, B.G. (2001). Farmakologi Dasar dan Klinik. Jakarta: Salemba Medika. Hal. 43-45, 587.
Katzung, B.G. (2006). Basic and Clinical Pharmacology. Edisi IX. USA: McGraw-Hill. Hal. 181.
Kaushik, D., Tripathi, A., Tripathi, R., Ganachari, M., dan Khan, S.A. (2009). Anticonvulsant Activity of Bacopa monniera in Rodents. Brazilian Journal of Pharmaceutical Sciences. 45(4): 643-649.
Kusuma, F.R., dan Zaky, B.M. (2005). Tumbuhan Liar Berkhasiat Obat. Jakarta: AgroMedia Pustaka. Hal. 2.
Lewis, W.H. (1977). Medical Botany: Plants Affecting Man’s Health. USA: John Wiley & Sons, inc. Hal. 299.
Li, R.R., Pang, L.L., Du, Q., Shi, Y., Dai, W.J., dan Yin, K.S. (2010). Apigenin Inhibits Allergen-induced Airway Inflammation and Switches Immune Response in a Murine Model of Asthma. Immunopharmacol Immunotoxicol. 32(3): 364-370.
Li, J., dan Zhang, B, (2013). Apigenin Protects Ovalbumin-Induced Asthma Through The Regulation of Th17 cells. Fitoterapia. 91(9): 298-304. Martin, H.S. (2005). Physiologic Basis of Respiratory Disease. USA: BC Decker
inc. Hal. 381.
McCormick, D.A. (1989). Acetylcholine: Distribution, Receptors, and Actions. Section of Neuroanatomy. 89(2): 91-101.
Mohamed, N.H., dan El-Hadidy, A.M. (2008). Studies of Biologically Active Constituents of Verbascum eremobium Murb. and its Inducing Resistance against some Diseases of Cucumber. Egypt. Journal Phytopathol. 36(1): 133-150.
Oenema, T.A. (2013). Muscarinic Receptors in Airway Smooth Muscle: Roles in inflammation and remodeling. Dissertation. University of Groningen – Netherlands. Hal. 15.
Pearce, E.C. (2009). Anatomi dan Fisiologi untuk Paramedis. Jakarta: PT Gramedia Pustaka Utama. Hal. 258-259.
Perry, W. L. M. (1970). Pharmacological Experiments on Isolated Preparations. Edisi II. Edinburgh: Churcill Livingstone. Hal. 25.
Pudjaatmaka, A.H. (2002). Kamus Kimia. Jakarta: Balai Pustaka. Hal. 253.
Raff, M., Alberts, B., Johnson, A., Lewis, J., Roberts, K., dan Walter, P. (2002). Moleculer Biology of The Cell. Edisi 4. New York: Garland Science. Hal.836.
Rahajoe, N., Supriyanto, B., dan Setyanto, D.B. (2008). Buku Ajar Respilogi Anak. Jakarta: Badan Penerbit Ikatan Dokter Anak Indonesia. Hal. 89.
Rahardjo, R. (2009). Kumpulan Kuliah Farmakologi. Edisi II. Jakarta: EGC. Hal. 339.
Sah, J.N., dan Varshney, V.K. (2013). Chemical Constituents of Picrorhiza Genus: A Review. American Journal of Essential Oils and Natural Products. 1(2): 22-37.
Saladin, K. (2003). Anatomy and Physiology: The Unity of Form and Function. Edisi 3. USA: McGraw-Hill. Hal. 848.
Schmitz, S., Lepper, H., dan Heidrich, M. (2003). Farmakologi dan Toksikologi. Edisi 3. Jakarta: EGC. Hal.83.
Sellers, D.J., dan Williams, R.C. (2012). Muscarinic Agonists and Antagonists: Effects on the Urinary Bladder. Handbook of Experimental Pharmacology: Muscarinic Receptors. Volume 208. Editor: Allison D. Fryer, Arthur Christopoulos dan Neil M. Nathanson. Germany: Springer-Verlag, Berlin Heidelberg. Hal. 375-400.
Slonane, E. (2004). Anatomy and Physiology: An Easy Learner. USA: Jones and Bartlett Publishers, Inc. Hal. 268.
Sudowo, A.W., Setiyohadi, B., Alwi., Simadibrata, K.M., dan Setiati. (2006). Buku Ajar Ilmu Penyakit Dalam. Edisi IV. Jilid I. Jakarta: Pusat Penerbitan Ilmu Penyakit Dalam FKUI. Hal. 247
Sugiarto, A., dan Putera, T.D. (2008). Buku Pintar Tanaman Obat: 431 jenis tanaman penggempur aneka penyakit. Jakarta: AgroMedia Pustaka. Hal. 65.
Supriyatno, B. (2010). Terapi Kombinasi Pada Serangan Asma Akut Anak. Majalah Kedokteran Indonesia. 60(5): 232-236.
Suryo, J. (2010). Herbal Penyembuh Gangguan Sistem Pernapasan. Yogyakarta: Bentang Pustaka. Hal. 7-8.
Syamsudin dan Darmono. (2011). Buku Ajar Farmakologi Eksperimental. Jakarta: UI-Press. Hal. 76.
Syamsuni, H. A. (2006). Ilmu Resep. Jakarta: EGC.
Taylor, P., dan Brown, J.H. (2006). Basic Neurochemistry: Molecular, Cellular and Medical Aspects. USA: Elsevier, Inc. Hal. 195.
Vogel, H.G. (2002). Drug Discovery and Evaluation: Pharmacological Assays. Germany: Springer-Verlag, Berlin Heidelberg. Hal. 353.
Voigt, R. (1995). Buku Pelajaran Teknologi Farmasi. Edisi V. Yogyakarta: UGM Press.
Ward, J.P.T., Ward, J., Leach, R.M., dan Wiener, C.M. (2008). At a Glance: Sistem Respirasi. Jakarta: Erlangga. Hal.57.
Wibowo, D.S. (2008). Anatomi Tubuh Manusia. Jakarta: Grasindo. Hal. 68. World Health Organization. (1998). Quality Control Methods for Medicinal Plant
Materials. Geneva: WHO. Hal. 28.
BAB III
METODE PENELITIAN
Metode yang digunakan pada penelitian ini adalah metode eksperimental yaitu metode yang digunakan untuk mengamati hubungan variabel bebas dengan variabel terikat. Penelitian ini dilakukan untuk mengetahui pengaruh ekstrak etanol daun pugun tanoh (EEDPT) terhadap efek relaksasi otot polos trakea, dengan desain penelitian seperti ditunjukkan pada Tabel 3.1, 3.2, dan 3.3. Prosedur yang dilakukan meliputi pengumpulan dan pembuatan simplisia, skrining fitokimia, pembuatan ekstrak etanol daun pugun tanoh (EDPT), dan pengujian kontraksi trakea marmut menggunakan alat organ bath.
Tabel 3.1 Desain penelitian effective concentration (EC80) asetilkolin pada otot polos trakea
Keterangan: Axy
A = % kontraksi trakea oleh asetilkolin x = konsentrasi asetilkolin
Tabel 3.2 Desain penelitian efek relaksasi EEDPT pada otot polos trakea x = konsentrasi asetilkolin
y = subjek
Tabel 3.3 Desain penelitian mekanisme efek relaksasi EEDPT pada otot polos trakea melalui penghambatan fosfodiesterase oleh teofilin
Subjek Teofilin+Ach+EEDPT
M = % relaksasi trakea oleh EEDPT dengan inkubasi awal menggunakan teofilin
x = konsentrasi asetilkolin y = subjek
3.1 Alat dan Bahan 3.1.1 Alat-alat
Alat- alat yang digunakan pada penelitian ini adalah alat bedah, alat-alat gelas laboratorium, amplifier (ADinstrument), blender, lemari pengering, micropipet (Socorex, Swiss), mortir dan stamfer, neraca analitik, neraca kasar,
organ bath volume 40 mL (Panlab), oven listrik, recorder (ADinstrument), rotary
evaporator (Haake D), timbangan hewan, transducer (ADinstrument), vortex.
3.1.2 Bahan-bahan
Sampel yang digunakan dalam penelitian ini adalah daun pugun tanoh. Bahan-bahan kimia yang digunakan adalah etanol 96%, air suling, gas karbogen mengandung 95% oksigen dan 5% karbondioksida (Tri Gases, Medan), larutan Kreb’s (mengandung natrium klorida, kalium klorida, kalsium klorida, magnesium sulfat, natrium bikarbonat, kalium dihidrofosfat dan glukosa), dimetil sulfoksida (DMSO), asetilkolin klorida, dan teofilin.
3.2 Hewan Percobaan
Hewan yang digunakan pada penelitian ini adalah marmut (Cavia porcellus) jantan, berat badan antara 300-500 gram dengan usia 3-4 bulan. Hewan
ini diaklimatisasi selama 1 (satu) minggu dengan tujuan untuk menyeragamkan makanan dan hidupnya dengan kondisi yang serba sama sehingga dianggap memenuhi syarat untuk penelitian. Sebelum digunakan pada tahap penelitian, hewan percobaan dipuasakan selama 24 jam agar kontraksi trakea yang digunakan tidak dipengaruhi oleh zat-zat lain.
3.3 Pengumpulan dan Pengolahan Sampel 3.3.1 Pengumpulan sampel
Pengumpulan sampel dilakukan secara purposif, yaitu tanpa membandingkan tumbuhan yang sama dari daerah lain. Tumbuhan yang digunakan dalam penelitian ini adalah pugun tanoh yang diambil dari Kecamatan Pancur Batu, Kabupaten Deli Serdang, Provinsi Sumatera Utara. Bagian
tumbuhan yang digunakan yaitu daun pugun tanoh. Daun yang diambil sebagai sampel adalah keseluruhan dari daun tumbuhan yang masih dalam keadaan baik. 3.3.2 Identifikasi tanaman
Identifikasi tanaman daun pugun tanoh dilakukan di Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, Indonesia.
3.3.3 Pengolahan sampel
Sampel yang digunakan pada penelitian ini adalah daun pugun tanoh yang masih segar. Daun dicuci hingga bersih untuk menghilangkan tanah dan pengotoran lainnya, kemudian ditiriskan dan ditimbang. Diperoleh berat basah. Selanjutnya daun tersebut dikeringkan dalam lemari pengering sampai daun kering (ditandai bila diremas rapuh). Simplisia yang telah kering ditimbang, kemudian diblender menjadi serbuk. Lalu dimasukkan ke dalam kantung plastik dengan silika gel dan di simpan pada suhu kamar.
3.4 Karakterisasi Simplisia
Karakterisasi simplisia meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar abu total, penetapan kadar abu tidak larut asam, penetapan kadar sari larut air, dan penetapan kadar sari larut etanol.
3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati warna, bentuk, ukuran dan tekstur dari simplisia.
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik terhadap simplisia dilakukan dengan cara menaburkan serbuk simplisia di atas kaca objek yang telah diteteskan dengan
larutan kloralhidrat dan ditutup dengan kaca penutup kemudian diamati di bawah mikroskop.
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluena). Cara Kerja: toluena sebanyak 200 mL dan air suling sebanyak 2 mL dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Toluena didinginkan selama 30 menit dan volume air dalam tabung penerima dibaca (WHO, 1998). Kemudian ke dalam labu tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluena mendidih, kecepatan tetesan diatur 2 tetes tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (Ditjen POM, 1995).
3.4.4 Penetapan kadar abu total
Sebanyak lebih kurang 2 g zat yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselen yang telah dipijar dan ditara, kemudian diratakan. Krus dipijarkan perlahan-lahan hingga arang habis, kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995).
3.4.5 Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan dalam 25 mL asam klorida 2 N selama 5 menit. Bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring, dipijarkan hingga bobot tetap kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995). 3.4.6 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk dimaserasi selama 24 jam dalam 100 mL air kloroform (2,5 mL kloroform dalam air suling sampai 1000 mL) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 mL filtrat pertama diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot konstan. Kadar sari yang larut di dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995).
3.4.7 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dalam 100 mL etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama dan kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 mL filtrat pertama diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot konstan. Kadar sari yang larut dalam etanol dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995).
3.5 Skrining Fitokimia 3.5.1 Pemeriksaan alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 mL asam klorida 2 N dan 9 mL air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut:
a. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereaksi Mayer akan terbentuk endapan berwarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereaksi Bouchardat akan terbentuk endapan berwarna coklat-hitam.
c. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereaksi Dragendorff akan
terbentuk endapan berwarna merah atau jingga.
Alkaloida dinyatakan positif jika terjadi endapan atau paling sedikit dua atau tiga dari percobaan di atas (Ditjen POM, 1995).
3.5.2 Pemeriksaan flavonoid Larutan Percobaan:
Sebanyak 0,5 g sampel disari dengan 10 mL metanol lalu direfluks selama 10 menit, disaring panas-panas melalui kertas saring berlipat, filtrat diencerkan dengan 10 mL air suling. Setelah dingin ditambah 5 mL eter minyak tanah, dikocok hati-hati, didiamkan. Lapisan metanol diambil, diuapkan pada temperatur 40oC. Sisa dilarutkan dalam 5 mL etil asetat, disaring.
Cara Percobaan:
a. Satu mL larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam 1-2 mL etanol 96%, ditambahkan 0,5 g serbuk seng dan 2 mL asam klorida 2N, didiamkan selama satu menit. Ditambahkan 10 mL asam klorida pekat, jika
dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan adanya flavonoida (glikosida-3-flavonol).
b. Satu ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam 1 mL etanol 96%, ditambahkan 0,1 g magnesium dan 10 mL asam klorida pekat, terjadi warna merah jingga sampai merah ungu menunjukkan adanya flavonoida (Ditjen POM, 1995).
3.5.3 Pemeriksaan tanin
Sebanyak 0,5 g sampel disari dengan 10 mL air suling, disaring lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 mL larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966). 3.5.4 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 mL campuran 7 bagian volume etanol 96% dan 3 bagian volume air suling, selanjutnya ditambahkan 10 mL HCl 2 N, direfluks selama 10 menit, didinginkan dan disaring. Pada 30 mL filtrat ditambahkan 25 mL air suling dan 25 mL timbal (II) asetat 0,4 M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari sebanyak 3 kali, tiap kali dengan 20 mL campuran 3 bagian volume kloroform dan 2 bagian volume isopropanol. Diambil lapisan air kemudian ditambahkan 2 mL air dan 5 tetes pereaksi Molisch, ditambahkan hati-hati 2 mL asam sulfat pekat terbentuk cincin warna ungu pada batas kedua cairan menunjukkan adanya ikatan gula (Ditjen POM, 1995).
3.5.5 Pemeriksaan saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan ditambahkan 10 mL air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi 1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang menunjukkan adanya saponin (Ditjen POM, 1995).
3.5.6 Pemeriksaan steroida/triterpenoid
Sebanyak 1 g sampel dimaserasi dengan 20 mL eter selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa dalam cawan penguap ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna ungu atau merah kemudian berubah menjadi hijau biru menunjukkan adanya steroida triterpenoida (Harborne, 1987).
3.6 Tahapan Persiapan Percobaan 3.6.1 Pembuatan larutan Kreb’s
Larutan fisiologis yang digunakan adalah larutan Kreb’s. Untuk membuat 1 liter larutan Kreb’s ditimbang (Hajare, 2010):
NaCl : 5,9 gram KCl : 0,35 gram CaCl2 : 0,28 gram MgSO4 : 0,11 gram NaHCO3 : 2,1 gram KH2PO4 : 0,16 gram Glukosa : 2,0 gram
NaHCO3 (2,1 gram) dan glukosa (2,0 gram) dilarutkan dengan sebagian air suling sampai larut. Bahan yang lain (NaCl, KCl, MgSO, KH2PO4, CaCl2) dilarutkan terpisah dengan air suling sampai larut, kemudian ditambahkan larutan natrium bikarbonat dan glukosa. Setelah semua bahan tercampur, larutan diaerasi dengan karbogen (O2 95%, CO2 5%) agar tidak terjadi pengendapan garam kalsium yang ditandai dengan kekeruhan. Selanjutnya larutan diatur pada suhu 370C dan pH 7,4.
3.6.2 Pembuatan ekstrak etanol daun pugun tanoh
Metode ekstraksi yang digunakan pada penelitian ini adalah metode sokletasi. Ekstraksi dilakukan dengan memasukkan serbuk simplisia daun pugun tanoh yang telah dibungkus dengan kertas saring sebanyak 10 gram ke dalam alat soklet dan menggunakan etanol sebagai pelarut sebanyak 500 ml, selama ± 6 jam dan dilakukan hingga pelarut pengekstrak tidak berwarna lagi. Ekstraksi ini dilakukan pengulangan sebanyak 10 kali, sehingga jumlah serbuk daun pugun tanoh yang digunakan sebanyak 100 gram. Hasil sokletasi yang diperoleh dipekatkan dengan alat rotary evaporator dan diperoleh ekstrak kental 24,205 gram. Kemudian 1600 mg ekstrak etanol daun pugun tanoh dilarutkan dalam 1 mL DMSO, kemudian dicukupkan dengan larutan Kreb’s hingga 5 mL sehingga diperoleh konsentrasi ekstrak etanol daun pugun tanoh 320 mg/mL.
3.6.3 Penyiapan larutan asetilkolin
Penelitian ini menggunakan asetilkolin sebagai agonis reseptor muskarinik. Senyawa ini dapat menyebabkan kontraksi otot polos pada trakea. Larutan induk dibuat dengan cara melarutkan asetilkolin ke dalam aqua destilata
sehingga didapatkan konsentrasi 2x10M-1. Kemudian dibuat larutan yang lebih encer sampai kadar 2x10-6 M.
a. Pembuatan larutan baku asetilkolin klorida
Ditimbang secara seksama asetilkolin klorida (BM 181,60 g/mol) seberat 181,60 mg kemudian dilarutkan dalam 5 mL aquadest. Diperoleh larutan baku asetilkolin klorida 2x10-1 M.
b. Pembuatan seri konsentrasi asetilkolin klorida i. Asetilkolin klorida 2x10-2 M
Dipipet 500 μL larutan asetilkolin klorida konsentrasi 2x10-1
M, masukkan dalam tabung reaksi, tambahkan 4500 μL aquadest. Vortex selama 1 menit.
ii. Asetilkolin klorida 2x10-3 M
Dipipet 500 μL larutan asetilkolin klorida konsentrasi 2x10-2 M, masukkan dalam tabung reaksi, tambahkan 4500 μL aquadest. Vortex selama 1 menit.
iii. Asetilkolin klorida 2x10-4 M
Dipipet 500 μL larutan asetilkolin klorida konsentrasi 2x10-3
M, masukkan dalam tabung reaksi, tambahkan 4500 μL aquadest. Vortex selama 1 menit.
iv. Asetilkolin klorida 2x10-5 M
Dipipet 500 μL larutan asetilkolin klorida konsentrasi 2x10-4
M, masukkan dalam tabung reaksi, tambahkan 4500 μL aquadest. Vortex selama 1 menit.
v. Asetilkolin klorida 2x10-6 M
Dipipet 500 μL larutan asetilkolin klorida konsentrasi 2x10-5 M, masukkan dalam tabung reaksi, tambahkan 4500 μL aquadest. Vortex selama 1 menit.
3.6.4 Penyiapan larutan teofilin
Ditimbang secara seksama teofilin (BM 180,16 g/mol) seberat 18,016 mg kemudian dilarutkan dalam 5 mL HCl 0,1 N. Diperoleh larutan baku teofilin konsentrasi 2x10-2 M. Larutan teofilin 10-4 M diperoleh dengan cara menambahkan 200 μL larutan teofilin 2x10-2 M ke dalam organ bath yang telah berisi 40 mL larutan Kreb’s.
3.7 Tahap Pengujian 3.7.1 Preparasi organ
Pada penelitian ini digunakan trakea terpisah marmut yang sebelumnya telah dipuasakan selama 24 jam. Marmut dikorbankan dengan cara dislokasi tulang belakang kepala (cervix). Bagian dada atas dibedah sampai bagian leher. Trakea diambil kemudian dibersihkan dari lemak dan jaringan lain. Saat jaringan sudah rileks, dipotong trakea dengan arah melintang untuk mengambil 8-9 cincin trakea. Dengan menggunakan pinset, kedua ujung potongan cincin trakea diikat dengan benang pada masing-masing arah yang berlawanan. Benang bagian bawah trakea diikatkan pada batang penahan jaringan dan benang bagian atas trakea dihubungkan ke transduser. Kemudian dimasukkan kedalam organ bath yang diisi dengan 40 mL larutan Kreb’s, dengan suhu larutan 370C dan diaerasi dengan karbogen secara terus menerus. Jaringan yang telah terisolasi diekuilibrasi selama 45 menit sampai diperoleh kondisi stabil (Vogel, 2002).
3.7.2 Pengujian Effective Concentration (EC80) asetilkolin pada otot polos
trakea
Pengujian terhadap agonis muskarinik dilakukan untuk mengukur batas maksimun yang dapat ditunjukkan terhadap kontraksi trakea marmut, untuk
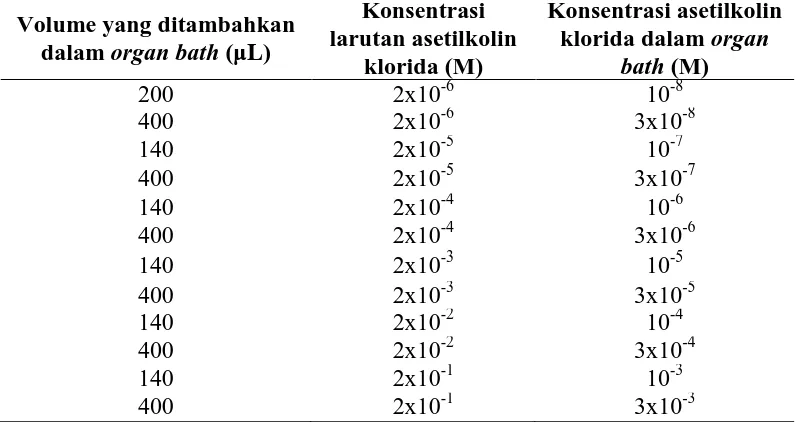
mendapatkan harga EC80. Pengukuran kontraksi dilakukan secara bertingkat dengan pemberian seri konsentrasi asetilkolin 10-8 sampai 3x10-3 M. Trakea marmut yang telah diekuilibrasi selama 45 menit (dengan pergantian larutan Kreb’s tiap 15 menit sebanyak tiga kali) diberikan larutan asetilkolin klorida dengan konsentrasi dalam organ bath 10-8 M sampai 3x10-3 M (otot polos trakea marmut menunjukkan respon kontraksi maksimum). Respons kontraksi otot polos trakea marmut yang terjadi akan tercatat pada rekorder.
Pemberian seri konsentrasi asetilkolin 10-8 sampai 3x10-3 M pada otot polos trakea marmut dapat dilihat pada Tabel 3.4.
Tabel 3.4 Penambahan asetilkolin klorida secara kumulatif pada organ bath volume 40 mL
3.7.3 Pengujian efek relaksasi ekstrak etanol daun pugun tanoh pada otot polos trakea
Trakea marmut yang telah diekuilibrasi selama 45 menit (dengan pergantian larutan Kreb’s tiap 15 menit sebanyak tiga kali) dikontraksi dengan pemberian 278 μL larutan asetilkolin klorida 2x10-1 M sehingga diperoleh konsentrasi asetilkolin klorida 1,39x10-3 M (konsentrasi EC80 asetilkolin) dalam
organ bath. Setelah diperoleh kondisi kontraksi maksimum yang stabil kemudian
diberikan secara bertingkat ekstrak etanol daun pugun tanoh (EEDPT) sebanyak 125 μL sampai 1000 μL sehingga akan diperoleh konsentrasi dalam organ bath 1 mg/mL sampai 8 mg/mL. Respons yang terjadi akan tercatat pada rekorder.
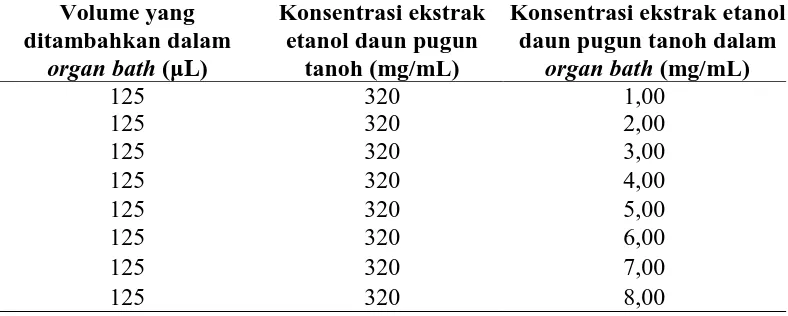
Pemberian seri konsentrasi EEDPT 1 mg/mL sampai 8 mg/mL pada otot polos trakea marmut dapat dilihat pada Tabel 3.5.
Tabel 3.5 Penambahan ekstrak etanol daun pugun tanoh secara kumulatif pada organ bath volume 40 mL
Volume yang daun pugun tanoh dalam
organ bath (mg/mL)
3.7.4 Pengujian mekanisme efek relaksasi ekstrak etanol daun pugun tanoh pada otot polos trakea melalui penghambatan fosfodiesterase oleh teofilin
Trakea marmut yang telah diekuilibrasi selama 45 menit (dengan pergantian larutan Kreb’s tiap 15 menit sebanyak tiga kali) diinkubasi selama 20 menit dengan pemberian teofilin 10-4 M yang diperoleh dengan cara menambahkan 200 μL larutan teofilin 2x10-2 M ke dalam organ bath. Kemudian trakea dikontraksi dengan pemberian 278 μL larutan asetilkolin klorida 2x10-1 M sehingga akan diperoleh konsentrasi asetilkolin klorida 1,39x10-3 M (konsentrasi EC80 asetilkolin) dalam organ bath. Setelah diperoleh kondisi kontraksi maksimum yang stabil kemudian diberikan secara bertingkat EEDPT sebanyak 125 μL sampai 1000 μL sehingga diperoleh konsentrasi dalam organ bath 1
mg/mL sampai 8 mg/mL. Respons yang terjadi akan tercatat pada rekorder. Kurva hubungan konsentrasi EEDPT dan % respons relaksasi kemudian dibandingkan dengan % respons relaksasi akibat pemberian EEDPT yang tanpa diinkubasi awal dengan teofilin.
3.8 Data dan Analisis Data 3.8.1 Data
Data yang diperoleh dalam penelitian ini adalah data kontraksi atau relaksasi otot polos trakea yang tercatat pada rekorder. Data tersebut diubah menjadi persentase (%) respons terhadap respons yang diinduksi agonis. Selanjutnya, dibuat kurva hubungan antara konsentrasi agonis terhadap % respons (program komputer: LabChart® 7.0.2)
3.8.2 Analisis data
Nilai EC80 (konsentrasi agonis yang dapat menghasilkan respon sebesar 80% dari respon maksimum) agonis reseptor muskarinik dihitung berdasarkan kurva hubungan konsentrasi terhadap % respons. EC80 dihitung menggunakan persamaan di bawah ini.
Log EC80 = �
80 – �1
�2 – �1
× (�2−�1)�+ �1
Keterangan:
X1 : Log. konsentrasi dengan respons tepat di bawah 80% X2 : Log. konsentrasi dengan respons tepat di atas 80% Y1 : % respons tepat di bawah 80%
Y2 : % respons tepat di atas 80%
Nilai %respons yang didapatkan dalam pengujian efek relaksasi ekstrak etanol daun pugun tanoh (Curanga fel-terrae (Lour) merr.) pada otot polos trakea
dianalisis secara statistik dengan menggunakan uji−t, namun sebelumnya dilakukan terlebih dahulu uji normalitas Kolmogorov – Smirnov (Husori, et al, 2012).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tanaman
Hasil identifikasi yang dilakukan di Herbarium Bogoriense, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor terhadap sampel tanaman yang digunakan pada penelitian ini adalah pugun tanoh (Curanga fel-terrae (Lour) merr.), suku Scrophulariaceae. Hasil identifikasi dapat dilihat pada Lampiran 1 halaman 53.
4.2 Karakterisasi Simplisia
Standarisasi suatu simplisia dilakukan sebagai pemenuhan terhadap persyaratan sebagai bahan obat dan menjadi penetapan nilai untuk berbagai parameter produk (Depkes, 2000).
Hasil pemeriksaan karakteristik simplisia daun pugun tanoh secara makroskopik adalah daun berwarna hijau muda sampai hijau tua, berbentuk bulat telur, tepi daun bergerigi, ukuran daun ± 3x7 cm, dengan tekstur permukaan daun
yang kasar dan berbulu. Hasil pemeriksaan makroskopik simplisia daun pugun tanoh dapat dilihat pada Lampiran 2 halaman 54.
Hasil pemeriksaan mikroskopik simplisia daun pugun tanoh terlihat adanya fragmen pengenal berupa trikoma, tulang daun, berkas pembuluh, kristal kalsium oksalat bentuk prisma dan stomata dengan dua tipe yaitu diasitik dan anomositik. Hasil pemeriksaan mikroskopik simplisia daun pugun tanoh dapat dilihat pada Lampiran 2 halaman 55.
Hasil karakterisasi simplisia dan ekstrak etanol daun pugun tanoh dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil karakteristik simplisia daun pugun tanoh
No. Pemeriksaan Karakteristik Kadar (%)
1. Kadar abu tidak larut asam
Kadar sari larut dalam air Kadar sari larut dalam etanol
5,96 8,56 1,00 16,36 13,65
Monografi dari simplisia pugun tanoh tidak ditemukan di buku Materia Medika Indonesia (MMI), sehingga tidak ada acuan untuk menentukan parameter simplisia tersebut. Hasil penetapan kadar air simplisia daun pugun tanoh adalah 5,96%, telah memenuhi standarisasi kadar air simplisia secara umum yaitu tidak lebih dari 10% (Ditjen POM, 1995). Kelebihan air dalam simplisia akan menyebabkan pertumbuhan mikroba, jamur atau serangga, serta mendorong kerusakan bahan aktif yang terkandung didalamnya karena dapat terurai (hidrolisis) (WHO, 1998).
Hasil karakterisasi simplisia daun pugun tanoh diperoleh kadar sari larut air sebesar 16,36% dan kadar sari larut etanol sebesar 13,65%. Tujuan dilakukannya penetapan kadar sari yaitu untuk mengetahui kadar sari bahan yang terlarut di dalam pelarut air dan etanol (Ditjen POM, 2000).
Hasil penetapan kadar abu total pada simplisia daun pugun tanoh sebesar 8,56% dan kadar abu tak larut asam sebesar 1,00%. Penentuan kadar abu merupakan metode pengukuran kadar terhadap abu yang dipanaskan pada temperatur tertentu, karena senyawa organik dan turunannya akan terdestruksi dan menguap sehingga yang tertinggal hanya unsur mineral dan anorganik, dan hal ini ini menunjukkan kandungan mineral internal dan eksternal yang terdapat pada
suatu simplisia (Ditjen POM, 2000). Perhitungan hasil karakterisasi simplisia daun pugun tanoh dapat dilihat pada Lampiran 3 halaman 56-58.
4.3 Skrining Fitokimia
Skrining fitokimia dilakukan untuk mengetahui golongan metabolit sekunder yang mempunyai aktivitas biologi yang terdapat dalam simplisia dan ekstrak etanol daun pugun tanoh. Skrining fitokimia yang dilakukan adalah pemeriksaan golongan senyawa alkaloid, flavonoid, tanin, glikosida, saponin dan steroid/triterpenoid. Hasil skrining fitokimia simplisia dan ekstrak dari daun pugun tanoh dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil skrining fitokimia simplisia dan ekstrak etanol daun pugun tanoh
No. Pemeriksaan Kandungan Hasil
Simplisia Ekstrak
Berdasarkan hasil skrining diketahui bahwa simplisia dan ekstrak etanol daun pugun tanoh mengandung flavonoid, tanin, glikosida, saponin, dan steroid/triterpenoid. Pada pengujian alkaloid tidak menunjukkan reaksi positif. Hal itu terbukti pada pengujian dengan menambahkan pereaksi Dragendorff tidak terbentuk suatu endapan. Hal yang sama juga terjadi pada saat penambahan pereaksi Bouchardat. Begitu juga dengan penambahan pereaksi Mayer tidak terbentuk endapan putih (Depkes RI, 1979).
4.4 Pengujian Effective Concentration (EC80) Asetilkolin pada Otot Polos
Trakea
Pengujian kontraksi otot polos trakea terisolasi dengan penambahan konsentrasi bertingkat asetilkolin (10-8 M sampai 3x10-3 M) dilakukan untuk mendapatkan effective concentration (EC80) asetilkolin yang selanjutnya akan digunakan untuk pengujian efek relaksasi ekstrak etanol daun pugun tanoh. Hasil pengujian ini diamati melalui perubahan % respons kontraksi otot polos trakea terisolasi terhadap peningkatan konsentrasi asetilkolin (10-8 M sampai 3x10-3 M).
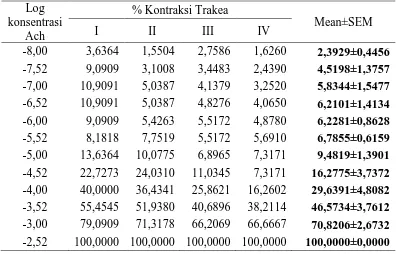
Hasil pengujian kontraksi otot polos trakea marmut dengan penambahan seri konsentrasi asetilkolin dapat dilihat pada Tabel 4.3 dan grafik pada Gambar 4.1.
Tabel 4.3 Data uji kontraksi seri konsentrasi asetilkolin terhadap otot polos trakea Log -4,52 22,7273 24,0310 11,0345 7,3171 16,2775±3,7372 -4,00 40,0000 36,4341 25,8621 16,2602 29,6391±4,8082 -3,52 55,4545 51,9380 40,6896 38,2114 46,5734±3,7612 -3,00 79,0909 71,3178 66,2069 66,6667 70,8206±2,6732 -2,52 100,0000 100,0000 100,0000 100,0000 100,0000±0,0000
Keterangan: Ach = asetilkolin
% kontraksi = dihitung dari kontraksi maksimum yang dicapai oleh asetilkolin
Gambar 4.1 Grafik % kontraksi otot polos trakea terisolasi yang dikontraksi dengan seri konsentrasi asetilkolin 10-8 M sampai 3x10-3 M (rata-rata±SEM, n=4)
Penambahan seri konsentrasi asetilkolin menyebabkan kontraksi otot polos trakea terisolasi. Kontraksi otot polos trakea meningkat dengan meningkatnya konsentrasi asetilkolin. Respons kontraksi maksimal otot polos trakea diperoleh pada konsentrasi asetilkolin 3x10-3 M, karena peningkatan konsentrasi asetilkolin yang lebih tinggi tidak lagi menunjukkan peningkatan kontraksi. Jumlah reseptor membatasi efek yang ditimbulkan, sehingga walaupun konsentrasi ditingkatkan, respon tidak bertambah.
Berdasarkan uraian di atas dapat disimpulkan bahwa kontraksi otot polos trakea terjadi karena stimulasi reseptor muskarinik oleh agonis, dalam penelitian ini digunakan asetilkolin sebagai penginduksi (Oenema, 2013).
Adapun EC80 asetilkolin yang diperoleh sebesar 1,39x10-3 M. Perhitungan untuk memperoleh EC80 asetilkolin dapat dilihat pada Lampiran 7 halaman 62-63.
EC80 asetilkolin digunakan untuk pengujian efek relaksasi ekstrak etanol daun pugun tanoh. Prosedur yang dilakukan yaitu EC80 asetilkolin diinduksi pada otot polos trakea marmut terisolasi, kemudian ditambahkan EEDPT dan diamati penurunan %kontraksi yang terjadi.
Efek kontraksi asetilkolin trakea marmut diregulasi terutama melalui stimulus reseptor muskarinik M3 pada saluran pernapasan (Karyono, 2006). Aktivasi reseptor muskarinik M3 selanjutnya akan mengaktifkan phospholipase C (PLC) melalui penggabungan dengan protein Gq, yang menghasilkan dua second messenger yaitu inositol 1,4,5-trisphosphate (IP3) dan diacylglycerol (DAG) sebagai hasil hidrolisis phospatidylinositol 4,5-biphosphat (PIP2). IP3 menduduki reseptor IP3 sehingga menginduksi pelepasan Ca2+ dari sarcoplasmatic reticulum (SR) (Gosens, et al., 2006). Sedangkan DAG akan menyebabkan influks Ca2+ ekstraseluler (Sellers dan Williams, 2012). Pelepasan Ca2+ dari SR dan influks Ca2+ akan meningkatkan jumlah Ca2+ di dalam sitosol (Hall, 2000). Peningkatan Ca2+ di sitosol akan membentuk kompleks Ca2+-kalmodulin yang mengaktifkan myosin light chain kinase (MLCK) yang akan memfosforilasi myosin light chain
(MLC), akibatnya terjadi interaksi miosin dengan aktin yang menghasilkan kontraksi otot polos saluran pernapasan (Oenema, 2013).
4.5 Pengujian Efek Relaksasi Ekstrak Etanol Daun Pugun Tanoh pada Otot Polos Trakea
Pengujian efek relaksasi ekstrak etanol daun pugun tanoh (EEDPT) terhadap otot polos trakea terisolasi dilakukan dengan cara mengontraksi otot polos trakea dengan asetilkolin 1,39x10-3 M lalu dilanjutkan dengan pemberian seri konsentrasi EEDPT 1-8 mg/mL.
Hasil pengujian efek relaksasi EEDPT terhadap otot polos trakea dapat dilihat pada Tabel 4.4 dan grafik pada Gambar 4.2.
Tabel 4.4 Data efek relaksasi EEDPT terhadap kontraksi otot polos trakea oleh pemberian asetilkolin 1,39x10-3 M
Dosis 8 mg 126,5957 106,5217 124,2424 131,3253 128,8889 123,5148±4,4084
Keterangan: EEDPT = ekstrak etanol daun pugun tanoh % relaksasi = dihitung dari relaksasi maksimum yang dicapai
oleh EEDPT
Pemberian seri konsentrasi EEDPT menghasilkan efek relaksasi terhadap kontraksi yang diinduksi oleh asetilkolin 1,39x10-3 M. Penambahan EEDPT
konsentrasi 1 mg/mL (6,53±1,61%) telah menunjukkan efek relaksasi pada otot polos trakea. EEDPT konsentrasi 8 mg/mL menunjukkan efek relaksasi yang
melebihi 100% yaitu sebesar 123,51±4,41% (Tabel 4.4 dan Gambar 4.2). Hasil
penelitian ini menunjukkan bahwa EEDPT memiliki efek relaksasi terhadap otot polos trakea marmut yang dikontraksi oleh asetilkolin.
Berdasarkan uji korelasi regresi juga diperoleh hubungan antara konsentrasi EEDPT dengan besarnya efek relaksasi otot polos trakea marmut yang bermakna (r = 0,981; p<0,05 ). Hal ini menunjukkan bahwa efek relaksasi yang terjadi merupakan akibat dari pemberian ekstrak etanol daun pugun tanoh.
Daun pugun tanoh mengandung metabolit sekunder golongan flavonoid, tanin, glikosida, saponin dan steroid/triterpenoid. Flavonoid diketahui dapat menimbulkan efek relaksasi pada otot polos (Carron, et al., 2010). Penelitian yang dilakukan oleh Huang, et al (1999), menunjukkan bahwa pugun tanoh
mengandung senyawa flavonoid glukuronida, yaitu senyawa apigenin 7-O-β
-glucuronide, luteolin 7-O-β-glucuronide dan apigenin 7-O-β-(2″-O-α-rhamnosyl) glucuronide. Apigenin memiliki efek sebagai anti asma (Li & Zhang, 2013; Li, et al., 2010; Choi, et al., 2009).
Namun, mekanisme efek relaksasi pada otot polos trakea yang ditimbulkan oleh EEDPT belum dapat dijelaskan lebih rinci, karena prosedur ini hanya pengamatan terhadap profil penurunan kontraksi otot polos trakea yang ditimbulkan oleh EEDPT.
4.6 Pengujian Mekanisme Efek Relaksasi Ekstrak Etanol Daun Pugun Tanoh pada Otot Polos Trakea Melalui Penghambatan Fosfodiesterase oleh Teofilin
Pengujian mekanisme efek relaksasi EEDPT pada otot polos trakea yang dikontraksi dengan asetilkolin 1,39x10-3 M diamati dengan pengujian yang diawali dengan inkubasi trakea dengan penghambat fosfodiesterase yaitu teofilin, selama 20 menit. Efek relaksasi yang dihasilkan kemudian dibandingkan dengan efek relaksasi EEDPT yang dilakukan tanpa inkubasi dengan teofilin (pengujian pada prosedur sebelumnya). Prosedur ini telah menjadi uji sederhana untuk mempelajari kemungkinan peran penghambatan fosfodiesterase dalam efek relaksasi suatu zat.
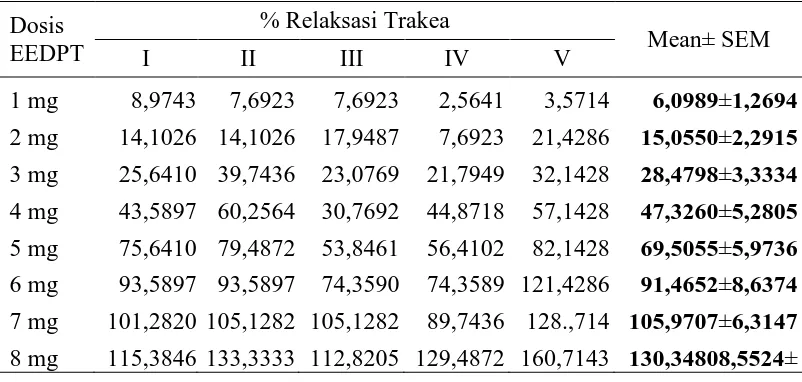
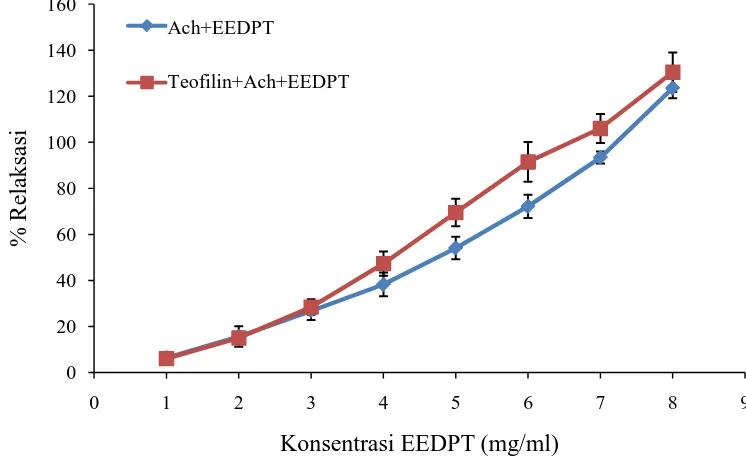
Hasil dari pengujian mekanisme efek relaksasi EEDPT pada otot polos trakea dapat dilihat pada Tabel 4.5 dan grafik pada Gambar 4.3.
Tabel 4.5 Data efek relaksasi EEDPT terhadap kontraksi otot polos trakea oleh pemberian asetilkolin 1,39x10-3 M dengan inkubasi awal menggunakan teofilin 10-4 M selama 20 menit
Dosis 6 mg 93,5897 93,5897 74,3590 74,3589 121,4286 91,4652±8,6374 7 mg 101,2820 105,1282 105,1282 89,7436 128.,714 105,9707±6,3147 8 mg 115,3846 133,3333 112,8205 129,4872 160,7143 130,34808,5524± Keterangan: EEDPT = ekstrak daun pugun tanoh
% relaksasi = dihitung dari relaksasi maksimum yang dicapai oleh EEDPT
Gambar 4.3 Grafik % relaksasi setelah pemberian seri dosis EEDPT dengan inkubasi awal menggunakan teofilin 10-4 M dengan % relaksasi EEDPT tanpa inkubasi sebagai kontrol (rata-rata±SEM, n=5). Data dianalisis menggunakan metode statistik uji-t independen. Inkubasi awal otot polos trakea dengan teofilin bertujuan untuk menghambat aktivitas dari fosfodiesterase (PDE) (Barnes, 1995). Penghambatan PDE akan meningkatkan kadar cAMP selular sehingga akan menyebabkan bronkodilatasi (Boskabady, et al., 2008). Perlakuan dengan teofilin pada penelitian ini akan memberi informasi tentang keterkaitan efek relaksasi EEDPT dengan efek relaksasi melalui penghambatan PDE.
Pengujian mekanisme efek relaksasi EEDPT pada otot polos trakea menunjukkan bahwa pada inkubasi awal dengan teofilin 10-4 M tidak terdapat perbedaan efek relaksasi EEDPT yang signifikan dibandingkan efek relaksasi pada perlakuan tanpa inkubasi teofilin (kontrol) (p>0.05; uji-t independen). Hasil ini disebabkan karena penghambatan PDE oleh teofilin menyebabkan EEDPT tidak lagi merelaksasi melalui mekanisme tersebut, sehingga efek relaksasi yang dihasilkan tidak berbeda dengan kontrol. Maka dapat disimpulkan bahwa efek
relaksasi EEDPT terkait dengan penghambatan efek aktivitas fosfodiesterase. Fosfodiesterase bekerja dengan cara mengubah cyclic adenosine monophosphate (cAMP) menjadi adenosine monophosphate (AMP) (Kandell, et al., 2000). cAMP menyebabkan otot polos merelaksasi melalui fosforilasi protein kontraktil dan menurunkan kadar Ca2+ intraseluler (Husori, 2011).
Namun, efek relaksasi yang dihasilkan EEDPT pada otot polos trakea yang diinkubasi dengan teofilin menunjukkan persentase relaksasi yang lebih besar dibandingkan kontrol. Hal ini menunjukkan bahwa efek relaksasi EEDPT selain melalui penghambatan PDE juga dapat melalui mekanisme relaksasi lainnya, sehingga perlu dilakukan penelitian relaksasi EEDPT melalui mekanisme lainnya. Selain fosfodiesterase, relaksasi otot polos saluran pernafasan juga dimediasi oleh nitritoksida (NO), prostaglandin E2 (PGE2), cGMP (Husori, et al., 2012) dan saraf adrenergik melalui reseptor β2-adrenergik (Katzung, 2006).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan pengamatan dari percobaan dan pembahasan dapat disimpulkan:
a. ekstrak etanol daun pugun tanoh (EEDPT) memiliki efek relaksasi terhadap otot polos trakea marmut terisolasi dengan menurunkan 80% kontraksi yang diinduksi oleh asetilkolin.
b. terdapat pengaruh antara peningkatan konsentrasi EEDPT dengan efek relaksasi otot polos trakea marmut terisolasi.
c. mekanisme efek relaksasi EEDPT pada otot polos trakea marmut terisolasi dimediasikan melalui penghambatan enzim fosfodiesterase.
5.2 Saran
Berdasarkan kesimpulan di atas disarankan:
a. melakukan isolasi senyawa aktif dari daun pugun tanoh (Curanga fel-terrae (Lour) Merr.) untuk mengetahui zak aktif yang menyebabkan
relaksasi pada otot polos trakea marmut terisolasi.
b. melakukan uji relaksasi dari ekstrak daun pugun tanoh terhadap kontraksi otot polos trakea terisolasi yang diinduksi oleh histamin.
c. melakukan pengujian mekanisme efek relaksasi daun pugun tanoh melalui mekanisme yang lain, seperti NO, β2-adrenergik, dan cGMP.
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi sistematika tumbuhan, nama daerah, nama asing, morfologi tumbuhan dan manfaat tumbuhan.
2.1.1 Sistematika tumbuhan
Sistematika tumbuhan pugun tanoh adalah sebagai berikut (Anonim, 2009): Divisi : Spermatophyta
Subdivisi : Angiospermae Kelas : Dicotyledoneae Subkelas : Asteridae Ordo : Scrophulariales Famili : Scrophulariaceae Genus : Curanga
Spesies : Curanga fel-terrae (Lour) Merr.
Sinonim : Curanga amara Vahl., Picria fel-terrae Lour. 2.1.2 Nama daerah
Nama daerah dari tumbuhan ini adalah pugun tanoh (Dairi), tamah raheut (Sunda), kukurang (Maluku), dan papaita (Ternate) (Anonim, 2009).
2.1.3 Nama asing
Nama asing dari tumbuhan ini adalah sagai-uak (Filipina), gelumak susu, hempedu tanah, rumput kerak nasi (Malaysia), kong saden (Laos) dan thanh (Vietnam) (Anonim, 2007).
2.1.4 Morfologi tumbuhan
Pugun tanoh merupakan tanaman berbatang basah, berbaring dan tumbuh merambat. Tumbuhan pugun tanoh memiliki tinggi 40 sampai 60 cm. Batangnya dengan cabang-cabang yang ramping, jarang, tegak atau melata, berakar di buku-buku, dan berbulu halus. Daunnya berbulu halus, berbentuk bundar telur dengan panjang 3-6 cm dan lebar 2-3 cm, ujung daun agak melancip dan tepi daun beringgit. Tangkai daunnya tumbuh berhadapan, permukaannya tidak berbulu, dan tipis. Bunga berupa tandan di ujung atau di batang, jumlah bunga 2-16, mahkota bunga menabung, dan berbibir rangkap (Anonim, 2009).
2.1.5 Manfaat tumbuhan
Pugun tanoh digunakan sebagai obat diabetes (Harfina, 2013), meningkatkan nafsu makan, diuretik (Anonim, 2011), antiinflamasi (Juwita, 2009) dan sesak napas (asma) (Sugiarto dan Putera, 2008). Di Filipina, rebusan daun pugun tanoh digunakan sebagai obat penurun panas, terutama untuk malaria, obat mual dan sakit perut (Anonim, 2011).
2.2 Ekstraksi
Ekstraksi adalah suatu cara untuk menarik satu atau lebih zat dari bahan asal dengan menggunakan pelarut. Umumnya zat berkhasiat tersebut dapat ditarik, namun khasiatnya tidak berubah. Tujuan utama ekstraksi adalah mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan dari zat-zat yang tidak dibutuhkan, agar lebih mudah dipergunakan (kemudahan diabsorpsi, rasa, dan pemakaian) dan disimpan dibandingkan simplisia asal, dan tujuan pengobatannya lebih terjamin. Hasil ekstraksi disebut dengan ekstrak, yaitu sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati
atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan (Depkes, 1995).
2.2.1 Metode ekstraksi
Ekstraksi dengan menggunakan pelarut dapat dilakukan dengan beberapa cara yaitu :
a. Cara dingin i. Maserasi
Maserasi adalah cara penarikan simplisia dengan merendam simplisia tersebut
dalam cairan penyari dengan beberapa kali pengocokan atau pengadukan pada
temperatur kamar, sedangkan remaserasi merupakan pengulangan penambahan
pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya (Ditjen POM, 2000).
ii. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar (Ditjen POM, 2000).
b. Cara panas i. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik (Ditjen POM, 2000).
ii. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet, dimana pelarut akan terdestilasi dari labu menuju pendingin, kemudian jatuh membasahi
dan merendam sampel dalam tabung soklet, kemudian setelah pelarut mencapai tinggi tertentu maka akan turun ke labu destilasi setelah melewati pipa sifon, demikian berulang-ulang (Ditjen POM, 2000).
Keuntungan dari metode ini adalah ekstraksi simplisia dapat dilakukan dengan sempurna dan pelarut yang digunakan lebih sedikit dibandingkan metode lainnya (Voigt, 1995).
iii. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50oC (Ditjen POM, 2000).
iv. Infus
Infus adalah sediaan cair yang dibuat dengan menyari simplisia nabati dengan air pada suhu 900C selama 15 menit (Depkes RI, 1979).
v. Dekok
Dekok adalah sediaan cair yang dibuat dengan menyari simplisia nabati dengan air pada waktu yang lebih lama ± 30 menit dangan temperatur sampai titik didih air (Ditjen POM, 2000).
2.3 Saluran Pernapasan
Saluran pernapasan atau tractus respiratorius (respiratory tract) adalah bagian tubuh manusia yang berfungsi sebagai tempat lintasan dan tempat pertukaran gas yang diperlukan untuk proses pernapasan. Saluran ini berpangkal pada hidung atau mulut dan berakhir pada paru-paru (Wibowo, 2008).
Sistem pernapasan terdiri atas saluran pernapasan bagian atas dan saluran pernapasan bagian bawah. Saluran pernapasan bagian atas berfungsi dalam
menyaring, menghangatkan, dan melembapkan udara yang dihirup. Saluran ini terdiri dari hidung, faring, dan laring. Sedangkan saluran pernapasan bagian bawah berfungsi untuk mengalirkan udara. Saluran ini terdiri dari trakea, bronkus, bronkiolus dan alveolus (Hidayat dan Uliyah, 2008).
Otot polos saluran pernapasan adalah jaringan yang memiliki fungsi fisiologis untuk menjaga kekakuan dari saluran pernapasan, yang dapat membantu menstabilkan saluran pernapasan saat terjadinya perubahan tekanan intrapleural. Kontraksi otot polos ini menyebabkan menyempitnya saluran pernapasan dan menghambat aliran udara, sehingga menyebabkan asma (Martin, 2005).
2.4 Trakea
Trakea atau batang tenggorok adalah tuba dengan panjang 10 cm sampai 12 cm dan diameter 2,5 cm serta terletak di permukaan anterior dari esofagus (Gambar 2.1). Trakea berjalan dari laring sampai kira-kira ketinggian vertebra koralis kelima dan di tempat ini bercabang menjadi dua bronkus (bronki) (Suryo, 2010).
Gambar 2.1 Potongan melintang trakea (Saladin, 2003) Lumen
trakea Esofagus
Otot polos t k
Silia Mukosa
Submukosa Kelenjar
seromukosa dalam Cincin
kartilago
Dinding trakea terdiri dari 3 lapisan (Suryo, 2010). Adapun 3 lapisan tersebut yaitu:
a. Lapisan luar, terdiri dari jaringan ikat;
b. Lapisan tengah, terdiri dari otot polos dan cincin tulang rawan; dan c. Lapisan dalam, terdiri dari jaringan epithelium bersilia.
Trakea terdiri dari 16 sampai 20 cincin kartilago/tulang rawan berbentuk-C yang dihubungkan oleh jaringan ikat dan otot polos. Tulang rawan berfungsi mempertahankan agar trakea tetap terbuka; karena itu, ujung posterior dari cincin trakea dihubungkan oleh otot polos, yaitu di tempat trakea menempel pada esophagus, yang memisahkannya dari tulang belakang (Slonane, 2004). Trakea dilapisi oleh epithelium bersilia pada lapisan dalamnya. Silia ini akan bergerak menuju ke atas ke arah laring; maka dengan gerakan ini debu dan butir-butir halus lainnya yang turut masuk bersama dengan udara dapat dikeluarkan (Pearce, 2009). Trakea marmut terisolasi dapat digunakan untuk menguji aktivitas reseptor muskarinik, histaminergik dan adrenergik. Selain itu, model ini dapat digunakan untuk menguji senyawa yang menghambat bronkospasme. Hal ini digunakan
untuk mendeteksi β-simpatomimetik, penyekat reseptor H1 dan reseptor
muskarinik (Vogel, 2002).
2.5 Asma
Asma adalah suatu penyakit dengan adanya penyempitan saluran pernapasan yang berhubungan dengan hiperaktivitas otot polos, hipersekresi mukus, edema dinding saluran pernapasan, dan infiltrasi sel inflamasi yang disebabkan berbagai macam rangsangan. Gejala klinis penyakit ini berupa kesukaran bernapas yang disebabkan oleh penyempitan saluran pernapasan.
Penyempitan saluran napas bersifat dinamis, derajat penyempitan dapat berubah, baik secara spontan maupun karena pemberian obat, dan kelainan dasarnya berupa gangguan imunologi (Alsagaff, 2010).
Penyebab dari hiperaktivitas otot polos saluran pernapasan salah satunya terjadi karena pengaktifan jalur saraf muskarinik oleh asetilkolin yang dapat menstimulasi kontraksi otot polos. Pemberian antagonis reseptor muskarinik akan menghambat efek asetilkolin dengan cara berikatan dengan reseptor muskarinik sehingga dapat menghambat kontraksi otot polos dan mengurangi sekresi kelenjar submukosa saluran pernapasan (Supriyatno, 2010). Namun, obat seperti teofilin dapat juga merelaksasi otot polos saluran pernapasan secara langsung dengan menghambat fosfodiesterase yang memecah cAMP (Katzung, 2001).
2.6 Asetilkolin
Asetilkolin merupakan molekul ester-kolin yang pertama diidentifikasi sebagai neurotransmitter. Asetilkolin (ACh) disintesis di dalam susunan saraf pusat oleh saraf yang badan selnya terdapat pada batang otak. ACh yang dihasilkan kemudian akan dilepas dari ujung presinaptik dan menduduki reseptornya. ACh diambil kembali (re-uptake) ke ujung presinaptik setelah mengalami degradasi menjadi kolin dan asetat oleh enzim asetilkolinesterase. ACh sebagai neurotransmitter dalam sistem motorik dan sistem saraf otonom harus dihilangkan dan diaktivasi dalam waktu tertentu (Katzung, 2001).
Enzim-enzim yang berperan dalam sintesis dan degradasi ACh. a. Choline Acetyltransferase (kolin asetiltransferase)
Enzim ini mengkatalisa asetilasi kolin dengan asetil koenzim A (disintesis di mitokondria dan tersedia dalam jumlah banyak di ujung saraf) sehingga
membentuk asetilkolin, kemudian asetilkolin ditransportasikan dari sitoplasma ke dalam vesikel-vesikel oleh sebuah antiporter sepanjang akson sampai ujungnya (Taylor dan Brown, 2006). Perkiraan jumlah ACh dalam vesikel sinaptik berkisar antara 1.000-50.000 molekul setiap vesikel. Dalam satu ujung saraf terdapat 300.000 atau lebih vesikel (Fawcett, 2002).
b. Acetylcholinesterase (Asetilkolin esterase, AChE)
AChE terdapat pada saraf kolinergik. Enzim ini mempunyai dua sisi pengikatan keduanya penting untuk degradasi ACh. Daerah anionik berfungsi untuk pengikatan sebuah molekul ACh pada enzim. Begitu ACh terikat, reaksi hidrolisis terjadi pada sisi aktif yang disebut daerah esteratik. Di sini ACh terurai menjadi kolin dan asam asetat. Kolin kemudian diambil lagi melalui sistem uptake kolin pada membran presinaps. Kolin ditransportasikan dari plasma ke dalam terminal neuron oleh pembawa membran bergantung – natrium (McCormick, 1989; Taylor dan Brown, 2006).
2.7 Reseptor Kolinergik
Reseptor kolinergik banyak dijumpai di sistem saraf otonom perifer. Ligan dari reseptor kolinergik adalah neurotransmiter asetilkolin (ACh). Reseptor kolinergik terbagi 2 tipe, yaitu reseptor nikotinik dan reseptor muskarinik.
2.7.1 Reseptor nikotinik
Reseptor nikotinik merupakan reseptor yang terhubung dengan kanal ion dan terdiri dari lima subunit yaitu subunit α1, α2, β, γ, dan δ yang masing-masing berkontribusi membentuk kanal ion dan memiliki tempat ikatan untuk molekul asetilkolin. Reseptor ini terdapat di neuromuscular junction, ganglia otonom, medula adrenal, dan susunan saraf pusat. Paling banyak ditemukan di
neuromuscular junction. Neuromuscular junction adalah sinaps yang terjadi
antara saraf motorik dengan serabut otot (Rahardjo, 2009). 2.7.2 Reseptor muskarinik
Reseptor muskarinik terdistribusi luas di seluruh tubuh dan mendukung berbagai fungsi vital, di otak, sistem saraf otonom terutama saraf parasimpatis. Reseptor muskarinik merupakan reseptor yang terhubung dengan protein G, terdiri dari 5 subtipe yaitu: M1, M2, M3, M4, M5. Reseptor M1, M3, dan M5 terhubung dengan protein Gq, sedangkan reseptor M2 dan M4 terhubung dengan protein Gi dan dengan suatu kanal ion. Respons yang timbul dari aktivasi reseptor muskarinik oleh ACh dapat berbeda, tergantung pada subtipe reseptor dan lokasinya (Rahardjo, 2009).
Gambar 2.2 Aktivasi reseptor muskarinik (sumber: www.COPDexchange.co.uk) Aktivasi reseptor M3 oleh asetilkolin menyebabkan kontraksi pada saluran pernafasan seperti yang terlihat pada Gambar 2.2 (Barnes, 1993; Karyono, 2006). Aktivasi reseptor M3 akan mengaktifkan phospolipase C (PLC) melalui
penggabungan dengan protein Gq. Aktifnya PLC akan meningkatkan hidrolisis komponen fosfolipid minor membran plasma yang disebut phospatidylinositol 4,5-biphosphat (PIP2). PIP2 dipecah menjadi pembawa pesan kedua (second messengers) yaitu inositol 1,4,5-trisphosphate (IP3) dan diacylglycerol (DAG). IP3 adalah second messenger yang larut air dan menyebar dalam sitosol (Katzung, 2001). IP3 akan menduduki reseptor IP3 pada calcium store di sarcoplasmatic reticulum (SR) sehingga menginduksi pelepasan kalsium dari SR ke dalam
sitosol. Hal ini mengakibatkan jumlah kalsium intraseluler meningkat (Hall, 2000).
DAG, produk lain dari hidrolisis PIP2, mampu mengaktifkan protein kinase C (PKC). Aktifnya PKC akan membuka gerbang kalsium sehingga terjadi peningkatan influks kalsium (Ikawati, 2006). Peningkatan Ca2+ di sitosol akan membentuk kompleks Ca2+-kalmodulin yang mengaktifkan myosin light chain kinase (MLCK) yang akan memfosforilasi myosin light chain (MLC), akibatnya
terjadi interaksi miosin dengan aktin yang menghasilkan kontraksi otot polos saluran pernapasan (Oenema, 2013).
2.8 Fosfodiesterase
Siklik nukleotida cyclic adenosine-3',5' monophosphate (cAMP) adalah second messenger yang penting dalam regulasi aktivitas sel. Di saluran
pernapasan cAMP mengatur tonus otot polos, sekresi mediator dan aktivasi sel-sel inflamasi. Meningkatnya konsentrasi cAMP intraseluler akan menyebabkan terjadinya bronkorelaksasi. Konsentrasi cAMP intraseluler ditentukan oleh stimulasi reseptor pada permukaan sel dan degradasi cAMP menjadi 5’-AMP oleh fosfodiesterase (PDE) (Raff, et al., 2002). Degradasi cAMP oleh PDE dapat
dilihat pada Gambar 2.3. Fosfodiesterase adalah enzim yang mengkatalisis hidrolisis ikatan ester pada molekul fosfat, seperti pada oligo- dan poli- nukleotida (Pudjaatmaka, 2002; Feneck, 2007).
Gambar 2.3 Hidrolisis cAMP oleh fosfodiesterase (Raff, et al., 2002) Terdapat lima jenis isoenzim PDE yang telah dibedakan berdasarkan spesifisitas substrat dan pengembangan inhibitor selektif. Pada otot polos trakea dan bronkus manusia, telah diidentifikasi adanya PDE I, II, III, IV dan V. Pada percobaan secara in vivo menggunakan marmut, diketahui bahwa penghambatan terhadap PDE III, IV dan V dapat menyebabkan bronkorelaksasi. Penghambatan PDE III menyebabkan relaksasi otot polos saluran napas, baik saat tonus spontan atau tonus yang disebabkan oleh induksi karbakol. Sedangkan penghambatan PDE IV tidak menurunkan tonus spontan tetapi dapat menurunkan tonus yang disebabkan oleh induksi karbakol (Barnes, 1995).
Kombinasi inhibitor PDE III dan IV yang paling efektif dalam merelaksasi otot polos saluran napas. Hal ini menunjukkan bahwa kerjasama dua isoenzim PDE III dan IV diperlukan untuk efek bronkodilator yang optimal. Inhibitor PDE V, juga efektif sebagai bronkodilator, yang menunjukkan bahwa cGMP juga terlibat dalam relaksasi otot polos saluran napas (Barnes, 1995; Hall, 2000).
2.9 Teofilin
Rumus struktur teofilin dapat dilihat pada Gambar 2.4.
Gambar 2.4 Struktur teofilin (Depkes RI, 1995)
Nama Kimia : 1,3-dimethyl-3,7-dihydro-1H-purine-2,6-dione Rumus Molekul : C7H8N4O2
Berat Molekul : 180,17
Pemerian : Serbuk hablur, putih, tidak berbau, rasa pahit, stabil di udara
Kelarutan : Sukar larut dalam air, tetapi lebih mudah larut dalam air panas, mudah larut dalam larutan alkali hidroksida dan
dalam amonium hidroksida, agak sukar larut dalam etanol, dalam kloroform dan dalam eter (Depkes RI, 1995).
Teofilin merupakan derivat xantin yang menyebabkan relaksasi otot polos, terutama otot polos bronkus, serta merangsang otot jantung, dan meningkatkan diuresis. Adapun mekanisme kerja dari teofilin yaitu dengan cara menghambat enzim fosfodiesterase sehingga mencegah pemecahan cAMP dan cGMP masing-masing
menjadi 5’-AMP dan 5’-GMP. Penghambatan fosfodiesterase menyebabkan
akumulasi cAMP dan cGMP dalam sel sehingga menyebabkan relaksasi otot polos,
termasuk otot polos bronkus (Katzung, 2006). Sehingga teofilin digunakan sebagai bronkodilator yang diperlukan pada serangan asma yang berlangsung lama. Selain itu, teofilin juga digunakan sebagai profilaksis terhadap serangan asma (Ward, et al., 2008).
Teofilin mempunyai efek samping berupa mual dan muntah, gangguan sistem saraf pusat (gelisah dan gangguan tidur), juga efek kardiovaskular, seperti takikardia, aritmia dan hipotensi (Schmitz, et al., 2003).
2.10 Organ Terisolasi
Organ terisolasi adalah suatu metode percobaan in vitro. Pada prinsipnya penelitian ini menggunakan organ yang direndam dalam larutan fisiologis yang sesuai, temperatur diatur atau dikondisikan pada kondisi yang sama dari mana organ tersebut berasal serta pengaturan aliran oksigen. Percobaan organ terisolasi ini menggunakan alat organ bath (Perry, 1970).
Percobaan dengan organ terisolasi mempunyai keuntungan tidak dipengaruhi oleh faktor farmakokinetika, dengan demikian obat yang digunakan relatif lebih sedikit dosisnya dibandingkan in vivo. Percobaan dengan organ terisolasi lebih ditekankan untuk mengobservasi mekanisme pada sel target sebagai tempat kerja. Hasil yang didapat dari percobaan organ terisolasi adalah
respon kontraktilitas terhadap rangsangan yang diberikan. Respon kontraktilitas dapat direkam dan dapat diukur untuk selanjutnya dapat dibuat kurva dosis respons. Untuk mendapatkan hasil percobaan yang akurat, maka diperlukan persiapan yang baik dan seluruh percobaan harus betul-betul terkontrol. Hewan percobaan yang digunakan dibunuh tanpa anestesi sehingga tidak memengaruhi kontraktilitasnya. Organ yang diambil segera dimasukkan ke dalam cairan fisiologis dan dikontrol oksigenasinya dan dihubungkan ke transduser dan diteruskan ke alat pencatat misalnya, kymograph atau maclab computer (Syamsudin dan Darmono, 2011).