Lampiran 1. Gambar alat pencetak kapsul dan pengering kapsul
a) Gambar alat pencetak kapsul
Lampiran 2. Gambar alat-alat uji spesifikasi cangkang kapsul
a) Gambar jangka sorong
Lampiran 3. Gambar alat-alat uji disolusi
a) Gambar pH meter
b) Gambar termometer c) Gambar spektrofotometer
Lampiran 4. Gambar alat uji kerapuhan
a) Untuk cangkang kapsul kosong
a. Kotak akrilik (9x 9x 13 cm) b. Pipa plastik
c. Anat timbangan 50 g
b) Untuk cangkang kapsul berisi
Lampiran 5. Gambar alat uji aktivitas antibakteri
a) Mikropipet
b) Oven c) Inkubator
Lampiran 7. Kurva Serapan larutan klaritromisin dalam medium lambung buatan
Lampiran 8. Kurva kalibrasi larutan klaritromisin pada panjang gelombang 272
Lampiran 9. Data pelepasan klaritromisin dari cangkang kapsul alginat 80-120
cP dalam medium lambung buatan pH 1,2 Percobaan I
Dosis Klaritromisin: 500 mg
Lampiran 9. (Lanjutan)
Percobaan 2
Dosis Klaritromisin: 500 mg
Lampiran 9. (Lanjutan)
Percobaan 3
Dosis Klaritromisin: 500 mg
Lampiran 10. Data % kumulatif pelepasan klaritromisin dari cangkang kapsul
alginat 80-120 cP
Waktu (menit)
Disolusi Rata-rata STDEV
Disolusi 1 Disolusi 2 Disolusi 3
Lampiran 11. Grafik kinetika pelepasan klaritromisin 500 mg dari cangkang
Lampiran 12. Data pelepasan klaritromisin:PVP K30 (2:1) dari cangkang kapsul
alginat 80-120 cP dalam medium lambung buatan pH 1,2 Percobaan 1
Lampiran 12. (Lanjutan)
Percobaan 2
Lampiran 12. (Lanjutan)
Percobaan 3
Lampiran 13. Data % kumulatif pelepasan klaritromisin:PVP K30 (2:1) dari
cangkang kapsul alginat 80-120 cP
Waktu (menit)
Disolusi
Rata-rata STDEV Disolusi 1 Disolusi 2 Disolusi 3
Lampiran 14. Grafik kinetika pelepasan klaritromisin:PVP K30 (2:1) dari
Lampiran 15. Data pelepasan klaritromisin:PVP K30 (3:2) dari cangkang kapsul
alginat 80-120 cP dalam medium lambung buatan pH 1,2 Percobaan 1
Lampiran 15. (Lanjutan)
Percobaan 2
Lampiran 15. (Lanjutan)
Percobaan 3
Lampiran 16. Data % kumulatif pelepasan klaritromisin:PVP K30 (3:2) dari
cangkang kapsul alginat 80-120 cP
Waktu (menit)
Disolusi
Rata-rata STDEV Disolusi 1 Disolusi 2 Disolusi 3
Lampiran 17. Grafik kinetika pelepasan klaritromisin:PVP K30 (3:2) dari
Lampiran 18. Data AUC pelepasan klaritromisin dari cangkang kapsul alginat
Total 19064,87 20534,75 11780,52
Lampiran 19. Data AUC pelepasan dispersi padat klaritromisin (2:1) dari
cangkang kapsul alginat 80-120 cP
Waktu (menit) AUC 1 AUC 2 AUC 3
Total 29197,50 30132,24 29269,03
Lampiran 20. Data AUC pelepasan dispersi padat klaritromisin (3:2) dari
cangkang kapsul alginat 80-120 cP
Waktu (menit) AUC 1 AUC 2 AUC 3
Total 46740,12 45816,69 46412,85
Lampiran 21. Data pengujian aktivitas antibakteri larutan standar klaritromisin
terhadap Staphylococcus aureus
Konsentrasi (ppm)
Diameter Daerah Hambat (mm)
Rata-rata STDEV Perlakuan I Perlakuan
II
Perlakuan III
0 0,00 0,00 0,00 0,00 0,00
1 0,80 0,60 0,80 0,73 0,12
2 2,20 2,50 2,43 2,38 0,16
3 5,70 5,60 5,70 5,67 0,06
4 7,20 7,50 7,30 7,33 0,15
5 8,50 8,20 8,40 8,37 0,15
10 11,40 11,50 11,50 11,47 0,06
20 13,30 13,00 13,10 13,13 0,15
40 14,70 14,90 14,70 14,77 0,12
60 15,80 15,70 15,80 15,77 0,06
80 16,20 16,50 16,40 16,37 0,15
100 17,10 16,90 16,90 16,97 0,12
120 17,40 17,20 17,30 17,30 0,10
140 17,40 17,70 17,70 17,60 0,17
160 17,90 18,10 18,00 18,00 0,10
180 18,20 18,20 18,30 18,23 0,06
Lampiran 22. Data pengujian aktivitas antibakteri larutan standar klaritromisin
terhadap Eschericia coli
Konsentrasi (ppm)
Diameter daerah hambat (mm)
Lampiran 23. Data pengujian aktivitas antibakteri aliquot disolusi sediaan
floating dispersi padat klaritromisin (2:1) terhadap Staphylococcus aureus
Diameter daerah hambat uji disolusi 1 Waktu
(jam)
Diameter daerah Hambat (mm)
Rata-rata STDEV Perlakuan I Perlakuan II Perlakuan III
0 0 0 0 0,00 0,00
Diameter daerah hambat uji disolusi 2
Waktu (jam)
Diameter daerah Hambat (mm)
Rata-Rata STDEV Perlakuan I Perlakuan II Perlakuan III
Lampiran 23. (Lanjutan)
Diameter daerah hambat uji disolusi 3
Waktu (jam)
Diameter daerah Hambat (mm)
Rata-Rata STDEV Perlakuan I Perlakuan II Perlakuan III
0 0 0 0 0,00 0,00
Rata-rata diameter daerah hambat uji disolusi
Lampiran 24. Data pengujian aktivitas antibakteri aliquot disolusi sediaan
floating dispersi padat klaritromisin (2:1) terhadap Eschericia coli
Diameter daerah hambat uji disolusi 1
Waktu (jam)
Diameter daerah Hambat (mm)
Rata-Rata STDEV Perlakuan I Perlakuan II Perlakuan III
0 0 0 0 0,00 0,00
Diameter daerah hambat uji disolusi 2
Waktu (jam)
Diameter daerah Hambat (mm)
Rata-Rata STDEV Perlakuan I Perlakuan II Perlakuan III
Lampiran 24. (Lanjutan)
Diameter daerah hambat uji disolusi 3
Waktu (jam)
Diameter daerah Hambat (mm)
Rata-Rata STDEV Perlakuan I Perlakuan II Perlakuan III
0 0 0 0 0,00 0,00
Rata-rata diameter daerah hambat uji disolusi
DAFTAR PUSTAKA
Agoes, G. (2008). Sistem Penghantaran Obat Pelepasan Terkendali. Bandung:
Penerbit ITB. Halaman 99. Anggono, J. (2015). Formulasi dan Evaluasi Pemakaian Cangkang Kapsul Alginat
untuk Pembuatan Sediaan Floating dari Dispersi Padat Aspirin. Skripsi. Medan: Universitas Sumatera Utara. Halaman 6, 46-49.
Ansel, H.C. (2005). Pengantar Bentuk Sediaan Farmasi. Edisi keempat. Jakarta: UI Press. Halaman 217-218.
Attwood, D., dan Florence, A.T. (2008). Physical Pharmacy. London: Pharmaceutical Press. Halaman 301-302.
Balouiri, M., Sadiki, M., dan Ibnsouda, S.K. (2016). Method for in vitro evaluation antimikrobial activity: A review. Journal of Pharmaceutical Analysis. 6(2):71-79.
Bangun, H., Simanjuntak, M.T., Tarigan, P., dan Ismanelly, T. (2005). Pembuatan dan Karakterisasi Kapsul Alginat yang Tahan terhadap Asam Lambung. Media Farmasi 13(1): 70-79.
Belitz, H.D., Grosch, W., dan Schieberle, P. (2009). Food Chemistry. Edisi Keempat. Berlin: Springer-Verlag. Halaman 232.
Berardi, R.R., dan Welage, L.S. (2005). Peptic Ulcer Disease. Dalam: Pharmacotherapy: A Pathopysiologic Approach. Edisi Keenam. Editor Joseph T. Dipiro. New York: McGraw-Hill. Halaman 630.
Bharathi, D.Y., Mahalakshmi, K., dan Uma, M.R.V. (2015). An Overview On Floating Drug Delivery Sytems. International Journal of Innovative Pharmaceutical Sciences and Research. 3(9): 1419-1432.
Bonev, B., Hopper J., dan Parisot, J. (2008). Principles of Assessing Bacterial Susceptibility to Antibiotics Using the Agar Diffusion Method. J. Antimicrob. Chemoter. 61(6): 1-7.
Chiou, W.L., dan Riegelman, S. (1971). Pharmaceutical Application of Solid Dispersion System. Journal of Pharmaceuticl Science. 60(9): 81-94.
Clinical dan Laboratory Standards Institute. (2007). Performance Standards for Antimicrobial Susceptibility Testing; Sixteenth Informational Supplement. M100-S16. 26(3): 19.
Ditjen POM RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Depkes RI. Halaman 510.
Ditjen POM RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Depkes RI. Halaman 1066, 1084-1085, 1143-1144.
Ditjen POM RI. (2014). Farmakope Indonesia. Edisi V. Jakarta: Depkes RI. Halaman 644-645.
Draget, K.I., Smidsrod, O., dan Gudmund, S. (2005). Alginate from Algae. Weinheim: WILEY-VCH Verlag GmbH and Co. Halaman 3-4.
Dwivedi, S., dan Kumar, V. (2011). Floating Drug Delievery System - A Concept of Gastroretention Dosages Form. International Journal of Research in Pharmaceutical and Biomedical Sciences. 2(4): 1413-1414.
Fransiska, E. (2015). Pembuatan dan Evaluasi Sediaan Gastroretentif Metronidazol dari Flim Alginat-Kitosan yang Ditambahkan HPMC. Tesis. Medan: Universitas Sumatera Utara. Halaman 32-33.
Fraschini, F., Francesco, S., dan Germana, D. (1993). Clarithromycin Clinical Pharmacokinetics. Clinical Pharmacokinetics. 25(3): 189-204.
Goldberg, A.H., Gibaldi, M., dan Kanig, J. L. (1966). Increasing dissolution rates and gastrointestinal absorption of drug via solid solutions and eutectic mixtures II. Experimental evaluation of a eutectic mixture: urea-acetaminophen system. J Pharm Sci. 55(5): 482-487.
Grasdalen, H., Larsen, B., dan Smidsroed, O. (1979). A Proton Magnetic Resonance Study of the Composition and Sequence Residues in Alginates. Carbohydr. Res. 68: 23-31.
Guyton, A.C., dan Hall. (2012). Fisiologi Manusia dan Mekanisme Penyakit. Jakarta: EGC Penerbit Buku Kedokteran. Halaman 606-608.
Irianto, K. (2006). Mikrobiologi Menguak Dunia Mikroorganisme. Jilid I. Bandung: Yrama Widya. Halaman 56-58.
Isha, C., Nimrata, S, Rana, A.C., dan Surbhi, G. (2012). Oral Sustained Release Drug Delivery System: An Overview. Internasional Research Journal of Pharmacy. 3(5): 57-62.
Itai, S.N.M., Kouchiwa, S., Murayama, H., dan Nagai, T. (1985). Influence of wetting factors on the dissolution behavior of fufenamic acid. Chem Pharm: Bull. 33(12): 64-73.
Jorgensen, J.H., dan Ferraro, M.J. (2009) Antimicrobial susceptibility testing: a review of general principles and contemporary practices. Clinical Infection Disease. (49):1749–1755.
Clarithromycin Oral Dosage Form Against Helicobacter pylori. Internasional Research Journal of Pharmacy. 3(4) : 281.
Kumar, S.K.P., Bhowmik, D., dan Srivastava, S. (2012). Sustained Release Drug Delivery System Potential. 1(2): 46-48.
Lee, V.H.L. (1987). Controlled Drug Delivery Fundamentals and Applications: Introduction. Edisi Kedua. New York: Marcel Dekker INC. Halaman 29.
Leuner, C., dan Dressman, J. (2000). Improving Drug Solubility For Oral Delivery Using Solid Dispersion. Eur. J. Pharm. Biopharm. 40(7): 47-60. Levy, G. (1963). Effect of Certain Tablet Formulation Factors on Dissolution Rate
of the Active Ingredient I. Importance of Using Appropriate Agitation Intensities for In Vitro Dissolution Rate Measurements to Reflect In Vivo Conditions. Journal of Pharmaceutical Sciences. 52(11): 1039-1046. Margareth, R.C.M., Cole., E., Kruep, D., Gray, V., Murachanian, D., Brown,
W.E., dan Giancaspro. (2009). Liquid-filled Gelatine Capsules. Pharmacopeial Forum. 35(4): 1032-1033.
Morris, E.R., Rees, D.A., dan Thom, D. (1980). Characterisation of Alginates Composition and Block Structure by Circular Dichroism. Carbohydrate Research. 81(2): 305-310.
Murthy, K.S., dan Ghebre-Selasie, I. (1993). Current Perspectives on the Dissolution Stability of Solid Oral Dosage Forms. Journal of Pharmaceutical Sciences. 82(2):113-126.
Nagata, S. (2002). Advantages to HPMC Capsules: A New Generation’s. Pharm Tech. 2(2): 5-10.
Narang, N. (2010). An Updated Review On: Floating Drug Delivery System (FDDS). International Journal of Applied Pharmaceutics. 3(1): 2-4.
Nayak, A.K., Maji, R., dan Das, B. (2010). Gastroretentive drug delivery systems: a review. Asian Journal of Pharmaceutical and Clinical Research. 3(1): 3-4.
Neb, G.B., Atram S.C., Udavant Y.K., Salunke R.J., Shahi S.R., Gulecha B.S., dan Padalkar, A.N. (2009). Formulation and evaluation of Floating Capsules of Clarithromycin. Journal of Pharmacy Research. 2(8): 1348-1356.
Pratiwi, S.T. (2008). Mikrobiologi Farmasi. Jakarta: Penerbit Erlangga. Halaman 171.
Price, S.A., dan Wilson, L.M. (2005). Patofisiologi: Konsep Klinis Proses-proses Penyakit. Volume 1. Edisi keenam. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 423-430.
Rani, A.A., dan Fauzi, A. (2009). Tukak Gaster. Dalam: Sudoyo, A. W., Setiyohadi, B. , Alwi,I., Simadibrata, M., dan Setiati, S., Buku Ajar Ilmu Penyakit Ilmu Dalam Edisi V Jilid I. Jakarta: Interna Publishing. Halaman 501-507.
Shah, S.H., Patel, J.K., dan Patel, N.V. (2009). Stomach Specific Floating Drug Delivery System: A Review. International Journal of PharmTech Research. 1(3): 623-633.
Sharma, N., Dilip, A., Gupta, M.K., dan Mahaveer, P.K. (2011). A Comprehensive Review on Floating Drug Delivery System. International Journal of Research in Pharmaceutical and Biomedical Sciences. 2(2): 428-429.
Simamora, E. R. F. (2014). Studi Pemakaian Cangkang Kapsul Alginat sebagai Sediaan Floating dari Metronidazol. Skripsi. Medan: Universitas Sumatera Utara. Halaman 41-54.
Simanjuntak, A. Y. (2016). Pembuatan Sediaan Floating Amoksisilin Menggunakan Cangkang Kapsul Alginat dan Uji Aktivitas antibakterinya. Skripsi. Medan: Universitas Sumatera Utara. Halaman 31-33.
Simonelli, A.P., Mehta, S.C., dan Higuchi, W.I. (1969). Disolution Rates of High Energy Polyvinylpyrrolidone (PVP)-Sulfathiazole Coprecipitates. 58(5):538-549.
Siregar, C. J. P., dan Wikarsa, S. (2010). Teknologi Farmasi Sediaan Tablet Dasar-dasar Praktis. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 170-171.
Sunil, K., Amandeep, K., Robin, S., dan Ramica, S. (2012). Peptic Ulcer: A Review on Etiology and Pathogenesis. International Research Journal of Pharmacy. 3(6): 34-38.
Tachibana, T., dan Nakamura, A. (1965). A Method for Preparing an Aqueous Colloidal Dispersion of Organic Materials by Using Water-Soluble Polymers: Dispersion of B-Carotene by Polyvinylpyrrolidone. Kolloid-Zeitschrift und Kolloid-Zeitschrift fur Polymere. 203 (2): 130-133.
Thom, D., Toft, K., dan Walsh, M. J. (1980). Interchain Associations of Alginates and Pectins. Program Food Nutrition Science. 6(8): 97-108.
Voight, R. (1995). Buku Pelajaran Teknologi Farmasi. Edisi Kelima. Yogyakarta: Gadjah Mada University Press. Halaman 166, 269.
Zhanjiang, F. (1990). Training Manual of Gracilaria Culture and Seaweed Proscessing in China. Regional Seafarming Development and Demonstration Project China
BAB III
METODE PENELITIAN
Penelitian ini dilakukan secara eksperimental yang meliputi pembuatan
cangkang kapsul alginat, dispersi padat klaritromisin, evaluasi cangkang kapsul, uji in vitro dan uji efek antibakteri di Laboratorium Farmasi Fisik Fakultas Farmasi USU dan Laboratorium Mikrobiologi Farmasi Fakultas Farmasi USU.
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat pencetak kapsul yang terbuat dari batang stainless steel berbentuk silindris dengan panjang 10 cm serta berdiameter 5,5 mm untuk bagian badan cangkang kapsul dan berdiameter 6,0 mm untuk bagian tutup cangkang kapsul, alat disolusi metode dayung (Erweka), batang pengaduk, buret (Pyrex), cawan petri, cawan porselen, desikator, erlenmeyer (Pyrex), gelas beker (Pyrex), gelas ukur (Pyrex), jangka sorong (Tricle), kamera digital, labu tentukur (Pyrex), lemari pengering, mikrometer (Delta), mikropipet (Oppendorf), neraca analitis (Ohaus Pioneer), otoklaf, oven (Marment), penunjuk waktu (Stopwatch), pH meter (Eutech Instrument), pipet mat (MBL), pipet volum (MBL), spektrofotometer (Shimadzu UV 1800), termometer, dan termostat.
3.2 Bahan-bahan
HCl(p) (Merck), kalsium klorida dihidrat (Merck), muller hinton agar (Oxoid), nutrient agar (Merck), natrium alginat 80-120 cP (Wako pure chemical industries, Ltd Japan), nutrient broth (Merck), natrium klorida (Merck), natrium metabisulfit, nipagin, polivinilpirolidon K30 (Wako pure chemical industries, Ltd Japan) dan titanium dioksida.
3.3 Pembuatan Pereaksi
3.3.1 Pembuatan larutan kalsium klorida 0,15 M
Kalsium klorida dihidrat (CaCl2.2H2O) sebanyak 22,05 g dilarutkan dalam akuades bebas CO2 hingga 1000 mL (Ditjen POM, 1995).
3.3.2 Medium cairan lambung buatan tanpa enzim (medium pH 1,2)
Larutkan 2 g natrium klorida dalam 7 mL asam klorida pekat dan akuades secukupnya hingga 1000 mL (Ditjen POM, 1995).
3.4 Pembuatan Kurva Serapan dan Kurva Kalibrasi Klaritromisin 3.4.1 Pembuatan larutan induk baku klaritromisin
Ditimbang sebanyak 100 mg klaritromisin dan dimasukkan kedalam labu tentukur 100 mL, dilarutkan dengan medium cairan lambung buatan pH 1,2 dan dicukupkan sampai garis tanda. Diperoleh konsentrasi 1000 mcg/mL (1000 ppm).
3.4.2 Pembuatan kurva serapan larutan klaritromisin
3.4.3 Pembuatan kurva kalibrasi larutan klaritromisin
Larutan induk baku dibuat dalam berbagai konsentrasi yaitu 50; 100; 400; 500; dan 600 ppm, dengan cara memipet larutan induk baku masing-masing sebanyak 1,25; 2,5; 10; 12,5; dan 15 mL. Dimasukkan kedalam labu tentukur 25 mL dan dicukupkan dengan medium cairan lambung buatan pH 1,2 sampai garis tanda. Dikocok homogen, diukur menggunakan spektrofotometer UV pada panjang gelombang maksimum yang telah ditentukan sebelumnya.
3.5 Pembuatan Dispersi Padat
Sistem dispersi padat dibuat dengan metode pelarutan dengan memvariasikan jumlah PVP K30 dengan perbandingan berat (Klaritromsin : PVP K30) = 2:1 dan 3:2.
Formula dispersi padat Klaritromisin-PVP K30 yang akan dibuat dengan metode pelarutan dapat dilihat pada Tabel 2.1 berikut ini:
Tabel 3.1 Rancangan formula sediaan dispersi padat setara 250 mg klaritromisin
Formula Bahan Bahan (mg)
PVP K30 Klaritromisin Total Setara
FI 125 250 375 250
Klaritromisin
FII 166,67 250 416,67 250
Klaritromisin Keterangan:
F I = Klaritromisin : PVP K30 (2:1) F II = Klaritromisin : PVP K30 (3:2)
Klaritromisin-PVP K30 ditimbang sesuai komposisi campuran masing-masing, kedua bahan dicampur dan dilarutkan dengan pelarut etanol sebanyak 25 ml. Kemudian diuapkan pelarut dengan udara panas di oven (400C) sampai
selama 24 jam. Kemudian padatan yang dihasilkan dikerok lalu diayak dengan menggunakan ayakan no. 12.
3.6 Pembuatan Cangkang Kapsul Alginat
Cangkang kapsul alginat dibuat dengan metode pencelupan (Simanjuntak, 2016), yaitu dengan mencelupkan alat pencetak kapsul kedalam larutan alginat.
3.6.1 Pembuatan larutan alginat
Natrium alginat 80-120 cp 4,5 g
Gliserin 2 g
Nipagin 0,25 g
TiO2 0,4 g
Natrium metabisulfit 0,1 g
Akuades ad 100 mL
Ditimbang masing-masing bahan yang diperlukan. Gelas beker dikalibrasi 100 mL. Nipagin dilarutkan dalam sebagian akuades yang telah dipanaskan terlebih dahulu, setelah dingin dilarutkan Gliserin dan Natrium metabisulfit dalam larutan tersebut (massa I). Didispersikan TiO2 dalam sebagian akuades (massa II). Selanjutnya kedalam gelas beker yang sudah dikalibrasi ditambahkan massa I dan massa II sedikit demi sedikit, kemudian ditaburkan serbuk alginat, didiamkan selama 24 jam lalu diaduk dan dicukupkan dengan akuades sampai 100 mL. Larutan didiamkan selama beberapa saat sampai tidak ada lagi gelembung udara.
3.6.2 Pembuatan badan cangkang kapsul alginat
kapsul yang telah mengeras dilepaskan dari alat pencetak stainless steel tersebut lalu direndam dalam akuades selama beberapa jam untuk menghilangkan kalsium yang menempel pada cangkang kapsul dan selanjutnya dikeringkan di lemari pengering.
3.6.3 Pembuatan tutup cangkang kapsul alginat
Alat pencetak kapsul terbuat dari bahan stainless steel dengan panjang 10 cm dan diameter 6,2 mm dicelupkan kedalam larutan natrium alginat sedalam 2,5 cm, lalu alat pencetak stainless steel yang telah dilapisi larutan natrium alginat tersebut direndam dalam larutan CaCl2 0,15 M selama 75 menit. Setelah itu cangkang kapsul yang telah mengeras dilepaskan dari alat pencetak stainless steel tersebut lalu direndam dalam akuades selama beberapa jam untuk menghilangkan kalsium yang menempel pada cangkang kapsul dan selanjutnya dikeringkan di lemari pengering.
3.6.4 Pengeringan cangkang kapsul alginat
Pengeringan cangkang kapsul alginat tersebut dilakukan dengan cara mengeringkannya dalam lemari pengering selama 4 jam. Cangkang kapsul alginat yang basah ditempatkan pada alat pengering stainless steel yang telah diolesi oleh minyak silikon lalu dimasukkan kedalam lemari pengering. Setelah kering, cangkang kapsul alginat dilepaskan dari alat pengering stainless steel dan cangkang kaspul alginat tersebut disimpan.
3.7 Pengisian Cangkang Kapsul Alginat
yang terbuka. Setelah itu ditutup dengan bagian tutup cangkang kapsul alginat dengan mendorong bagian tutup ke bagian badan cangkang kapsul alginat yang terbuka sehingga bagian tutup kapsul dengan bagian badan kapsul menyatu dengan baik. Diberi perekat larutan natrium alginat pada kapsul.
3.8 Penentuan Spesifikasi Cangkang Kapsul Alginat
3.8.1 Pengukuran panjang dan diameter cangkang kapsul alginat
Pengukuran panjang dan diameter cangkang kapsul alginat dilakukan dengan menggunakan jangka sorong.
3.8.2 Pengukuran ketebalan cangkang kapsul alginat
Pengukuran ketebalan cangkang kapsul alginat dilakukan dengan menggunakan mikrometer skrup. Pengukuran dilakukan 5 kali untuk masing-masing sampel, satu kali di pusat dan 4 kali di perimeter sekitarnya, kemudian diambil rata-ratanya.
3.8.3 Penimbangan berat cangkang kapsul alginat
Penimbangan berat cangkang kapsul alginat dilakukan dengan menggunakan neraca analitik.
3.8.4 Pengamatan warna cangkang kapsul alginat
Pengamatan warna cangkang kapsul alginat diamati secara visual.
3.8.5 Pengukuran volume cangkang kapsul alginat
3.9 Uji Floating
Sediaan cangkang kapsul alginat 80-120 cP yang telah dibuat dilakukan uji waktu floating dengan cara menempatkan cangkang kapsul tersebut ke dalam gelas beaker berisi medium lambung buatan pH 1,2.
Floating lag time sebagai waktu yang dibutuhkan sediaan cangkang
kapsul alginat mulai mengapung dan Floating Time sebagai lamanya waktu dimana sediaan cangkang kapsul alginat dapat mengapung.
3.10 Uji Kerapuhan
3.10.1 Cangkang kapsul kosong
Cangkang kapsul kosong dijatuhi beban seberat 50 g dari ketinggian 10 cm. Kemudian diamati kerapuhan cangkang kapsul tersebut. Pengujian dilakukan terhadap 6 cangkang kapsul (Nagata, 2002).
3.10.2 Cangkang kapsul berisi (uji ketahanan terhadap tekanan)
Cangkang kapsul diisikan dengan dispersi padat klaritromisin, kemudian ditekan beban seberat 2 kg. Diamati kerapuhan cangkang kapsul. Pengujian dilakukan terhadap 6 cangkang kapsul (Nagata, 2002).
3.11 Uji Disolusi
Medium disolusi : Cairan lambung buatan tanpa enzim pH 1,2 Kecepatan pengadukan : 100 rpm
Volume medium : 900 mL Suhu medium : 37 ± 0,5oC
Sampel : 1. Cangkang kapsul alginat 80-120 cP berisi klaritromisin 500 mg.
2. Cangkang kapsul alginat 80-120 cP berisi dispersi padat dengan klaritromisin : PVP K30 (2:1).
3. Cangkang kapsul alginat 80-120 cP berisi dispersi padat dengan klaritromisin : PVP K30 (3:2).
3.12 Uji Aktivitas Antibakteri Sediaan Floating 3.12.1 Sterilisasi alat dan bahan
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan didalam oven pada suhu 170°C selama 1 jam. Media disterilkan di autoklaf pada suhu 121°C selama 15 menit. Jarum ose dengan lampu bunsen.
3.12.2 Pembuatan media
3.12.2.1Media nutrient agar (NA)
Komposisi: Peptone 5 g Meat extract 2 g
Agar-agar 12 g
Distilled water 1 L
pH: 7.0 ± 0,2 pada suhu 250C
Cara pembuatan: Sebanyak 20 g serbuk NA dilarutkan dalam air suling hingga 1 liter dengan bantuan pemanasan sampai semua bahan larut sempurna lalu disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Merck, 2005).
3.12.2.2 Media nutrient broth (NB)
Komposisi : Peptone 5 g
Meat extract 3 g
Distilled water 1 L
pH: 7,0 ± 0,2 pada suhu 25oC
3.12.2.3 Media muller hinton agar (MHA)
Komposisi: Acid casein peptone 17,5 g
Beef Infusion 2 g
Starch 1.5 g
Bacteriological agar 17 g Distilled water 1 L pH: 7.4 ± 0,2 pada suhu 250C
Cara pembuatan: Sebanyak 38 g serbuk MHA dilarutkan dalam air suling hingga 1 liter dengan bantuan pemanasan sampai semua bahan larut sempurna, lalu disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Pronadisa, 1993).
3.12.3 Pembuatan agar miring
Sebanyak 10 ml media nutrient agar yang sudah dicairkan dimasukkan ke dalam tabung reaksi steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30-45o. Kemudian disimpan dalam lemari pendingin pada suhu 5oC (Lay, 1994).
3.12.4 Pembuatan stok kultur bakteri
Biakan bakteri S.aureus diambil dengan menggunakan jarum ose steril, lalu ditanam pada agar miring dengan cara menggores. Lalu diinkubasi dalam inkubator pada suhu 36-37oC selama 18 jam (Ditjen POM, 1995). Hal yang sama dilakukan terhadap bakteri E.coli.
3.12.5 Pembuatan inokulum bakteri uji
kekeruhan yang sama dengan standar kekeruhan larutan Mc.Farland. Perlakuan yang sama dilakukan pada bakteri Escherichia coli.
3.12.6 Pengujian aktivitas antibakteri larutan standar klaritromisin
Larutan standar klaritromisin dibuat dalam berbagai konsentrasi (0-200
μg) dengan melarutkan klaritromisin menggunakan medium lambung butan pH
1,2. Masing-masing larutan dimasukkan ke dalam vial. Dimasukkan pencadang kertas ke dalam masing-masing larutan dan dibiarkan selama 30 menit. Kedalam cawan petri dimasukkan 0,1 mL inokulum, ditambahkan 15 mL media MHA steril yang telah dicairkan dan ditunggu hingga suhu mencapai 45oC, dihomogenkan dan dibiarkan sampai media memadat. Selanjutnya, ke dalam petri dimasukkan pencadang kertas yang telah direndam dan ditiriskan. Diinkubasi pada suhu 36-37oC selama 18 jam. Selanjutnya diameter daerah hambat di sekitar pencadang kertas diukur dengan menggunakan jangka sorong. Pengujian dilakukan sebanyak 3 kali.
3.12.7 Pengujian aktivitas antibakteri sediaan floating
BAB IV
HASIL DAN PEMBAHASAN
Cangkang kapsul alginat yang telah dibuat dari natrium alginat 80-120 cP dilakukan penentuan spesifikasi, pengujian waktu floating dan uji kerapuhan. Selanjutnya, cangkang kapsul alginat diisi dengan bahan obat klaritromisin dilakukan uji disolusi dan uji aktivitas antibakteri dari aliquot hasil uji disolusi.
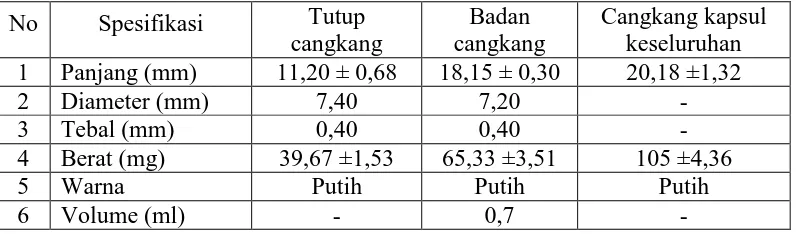
4.1 Hasil Penentuan Spesifikasi Cangkang Kapsul Alginat 80-120 cP
Penentuan spesifikasi cangkang kapsul alginat 80-120 cP No.0 dilakukan terhadap bagian badan cangkang kapsul, bagian tutup cangkang kapsul dan cangkang kapsul secara keseluruhan yang meliputi pengukuran panjang, diameter, berat, volume, ketebalan dan pengamatan warna. Pengukuran ketebalan dilakukan terhadap badan dan tutup cangkang kapsul. Pengukuran volume dilakukan hanya terhadap bagian badan cangkang kapsul, karena umumnya bahan obat hanya diisikan ke dalam bagian badan cangkang kapsul. Pengukuran volume dilakukan menggunakan air, dimana air diisi kebagian badan cangkang kapsul alginat sampai meniskus atas menyentuh ujung kapsul.
Cangkang kapsul No.0 yang dibuat dari alginat 80-120 dapat dilihat pada Gambar 4.1.
Hasil penentuan spesifikasi cangkang kapsul alginat 80-120 cP yang di peroleh dibandingkan dengan spesifikasi cangkang kapsul menurut Capsugel Division. Hasil penentuan spesifikasi cangkang kapsul alginat 80-120 cP dapat dilihat pada Tabel 4.1 dan spesifikasi cangkang kapsul menurut Capsugel Division dapat dilihat pada Tabel 4.2.
Tabel 4.1 Spesifikasi cangkang kapsul alginat 80-120 cP No. 0
No Spesifikasi Tutup cangkang
Tabel 4.2 Spesifikasi cangkang kapsul ukuran No. 0 menurut Capsugel Division
No Spesifikasi Tutup kapsul Badan kapsul Cangkang Kapsul keseluruhan 1 Panjang (mm) 10,72 ± 0,46 18,44 ± 0,46 21,7 ±0,30
2 Diameter (mm) 7,64 7,34 -
3 Volume (ml) - 0,68 -
4 Berat (mg) - - 96 ± 6
Pada tabel dapat dilihat bahwa cangkang kapsul yang dibuat dari natrium
alginat 80-120 cP memliki panjang, diameter, volume dan berat yang tidak jauh
berbeda dengan spesifikasi cangkang menurut Capsugel Division.
Ketebalan dari cangkang kapsul akan mempengaruhi laju pelepasan dari
bahan obat. Pada penelitian ini, natrium alginat yang digunakan memiliki
viskositas yang rendah yaitu 80-120 cP sehingga cangkang kapsul yang dihasilkan
memiliki ketebalan yang kecil (tipis). Penggunaan cangkang kapsul tipis ini disesuaikan dengan kelarutan dari bahan obat, dimana klaritromisin memiliki
bertujuan untuk melindungi bahan obat dari cahaya oleh karena itu digunakan
TiO2 dalam formulasi cangkang kapsul alginat 80-120 cP.
4.2 Hasil Uji Floating
Uji waktu floating terdiri dari floating lag time dan floating time. Floating lag time adalah waktu yang dibutuhkan oleh cangkang kapsul untuk dapat
mengapung dan floating time adalah lamanya cangkang kapsul dapat mengapung pada medium lambung buatan.
Uji floating lag time dari cangkang kapsul alginat 80-120 cP no.0 kosong menunjukkan hasil 0 detik, dimana cangkang kapsul alginat langsung mengapung ketika pertama kali diletakkan kedalam medium lambung buatan. Hal ini karena cangkang kapsul alginat memiliki berat jenis yang lebih rendah jika dibandingkan dengan berat jenis medium lambung buatan pH 1,2. Sedangkan floating time cangkang kapsul alginat lebih dari 12 jam.
Pengujian floating time untuk cangkang kapsul alginat 80-120 cP dalam medium cairan lambung buatan pH 1,2 dapat dilihat pada Gambar 4.2.
(a) (b) (c) (d)
Gambar 4.2 Uji waktu floating cangkang kapsul alginat 80-120 cP
Pada Gambar 4.2 dapat dilihat bahwa cangkang kapsul alginat 80-120 cP dapat tetap mengapung mulai dari waktu 0 menit sampai 660 menit, bahkan cangkang kapsul alginat 80-120 cP ini dapat bertahan tetap mengapung selama lebih dari 660 menit.
4.3 Hasil Uji Kerapuhan
4.3.1 Uji kerapuhan cangkang kapsul kosong
Pengujian kerapuhan cangkang kapsul alginat 80-120 cP kosong dilakukan dengan cara menjatuhkan beban seberat 50 g dari ketinggian 10 cm, dimana beban seberat 50 g diibaratkan sebagai tekanan yang terjadi saat membuka kemasan kapsul. Kapsul kosong tersebut dikatakan rapuh apabila setelah dijatuhkan beban, cangkang kapsul kosong tersebut retak atau pecah (Nagata, 2002).
Hasil pengujian kerapuhan cangkang kapsul alginat 80-120 cP kosong dapat dilihat pada Gambar 4.3.
(a) (b)
Gambar 4.3 Uji kerapuhan cangkang kapsul alginat 80-120 cP kosong
Keterangan: (a) Sebelum uji kerapuhan (b) Sesudah uji kerapuhan
sebelumnya juga tidak menunjukkan adanya cangkang kapsul yang retak atau pecah (Simamora, 2014).
4.3.2 Uji kerapuhan cangkang kapsul berisi (uji ketahanan terhadap tekanan)
Pada pengujian ini dilakukan terhadap cangkang kapsul alginat 80-120 cP berisi bahan obat. Pada penelitian ini bahan obat yang digunakan adalah klaritromisin. Klaritromisin merupakan salah satu antibiotik yang digunakan dalam terapi eradikasi Helicobacter pylori.
Pengujian dilakukan dengan cara menekan cangkang kapsul alginat berisi dengan beban seberat 2 kg (Nagata, 2002). Beban ini diibaratkan seperti tekanan yang mungkin terjadi selama proses pengisian kapsul sampai pada tahap pengemasan kapsul.
Hasil pengujian kerapuhan cangkang kapsul alginat 80-120 cP berisi dispersi padat klaritromisin dapat dilihat pada Gambar 4.4.
(a) (b)
Gambar 4.4 Uji kerapuhan cangkang kapsul alginat 80-120 cP berisi dispersi
padat klaritromisin
Keterangan: (a) Sebelum uji kerapuhan
(a) Sesudah uji kerapuhan (pipih pada lokasi tertentu)
Pada gambar diatas dapat dilihat tidak ada cangkang kapsul yang retak
tersebut. Kapsul akan menjadi rapuh apabila kadar uap air dalam cangkang kapsul tersebut sedikit. Sebaliknya jika kadar uap airnya terlalu banyak, kapsul cenderung akan menjadi melunak. Akan tetapi, kisaran kadar uap air dalam cangkang kapsul berbeda antara satu bahan dengan bahan yang lain.
4.4 Hasil Uji Disolusi
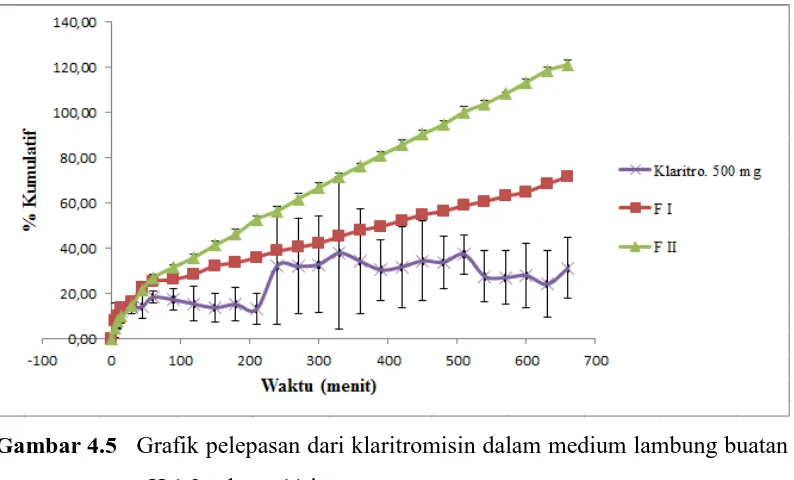
Profil uji pelepasan klaritromisin, dispersi padat klaritromisin-PVP K30 2:1 dan 3:2 dari cangkang kapsul alginat 80-120 cP dalam medium lambung buatan pH 1,2 selama 11 jam dapat dilihat pada Gambar 4.5.
Gambar 4.5 Grafik pelepasan dari klaritromisin dalam medium lambung buatan
pH 1,2 selama 11 jam.
Keterangan : FI = Klaritromisin-PVP K30 (2:1) FII = Klaritromisin-PVP K30 (3:2)
diformulasi dalam bentuk dispersi padat dengan pembawa polivinilpirolidon (PVP) K30 menggunakan 2 cangkang kapsul alginat, hal ini dikarenakan jumlah bahan obat tidak cukup jika dimasukkan didalam satu cangkang kapsul alginat no. 0. Formulasi I adalah dispersi padat klaritromisin:PVP K30 (2:1), berdasarkan grafik klaritromisin yang terlepas dari cangkang kapsul pada menit ke-180 sebanyak 33,66%, pada menit ke-360 sebanyak 48,06%, dan pada menit ke-660 sebanyak 71,85% bahan obat telah terlepas. Pada formulasi II yang berisi dispersi padat klaitromisin:PVP K30 dengan perbandingan 3:2 menujukkkan klaritromisin yang terlepas pada menit ke-180 sebanyak 46,25%, pada menit ke-360 sebanyak 76,43%, dan pada menit ke-660 sebanyak 121,28%.
Formulasi klaritromisin yang memberikan pelepasan memenuhi syarat sustained release menurut Murthy dan Ghebre (1993) adalah formulasi I dengan
perbandingan klaritromisi-PVP K30 2:1, hal ini dapat dilihat pada Tabel 4.3.
Tabel 4.3 Perbandingan pelepasan dispersi padat klaritromisin (2:1) dengan
persyaratan Murthy dan Gebre
Interval
pemberian Waktu (jam)
Jumlah yang
Keterangan: D (interval pemberian)= 12 jam
bahan obat dalam bentuk dispersi padat akan menurunkan ukuran partikel dari bahan obat sehingga luas permukan kontak obat dengan media akan semakin besar dan kelarutan semakin bertambah (Agoes, 2008). Sistem dispersi padat dengan konsentrasi PVP K30 yang semakin besar menyebabkan jumlah klaritromisin yang terdispersi molekuler dalam PVP K30 menjadi semakin besar oleh karena itu, laju disolusi klaritromisin pun semakin meningkat sebanding dengan banyaknya PVP K30 dalam sistem dispersi padat tersebut.
Gambar uji disolusi sediaan floating dispersi padat klaritromisin menggunakan cangkang kapsul alginat dapat dilihat pada Gambar 4.6.
(a) (b)
(c) (d)
Gambar 4.6 Uji disolusi dari sediaan floating dispersi padat klaritromisin
menggunakan cangkang kapsul alginat 80-120 cP Keterangan: a. Pada waktu 0 menit
Cangkang kapsul alginat pada Gambar 3.6 tetap utuh dan mengapung sampai 660 menit. Cangkang kapsul alginat yang tetap utuh di dalam medium lambung buatan selama waktu pengujian dikarenakan kalsium alginat (kalsium guluronat) yang terbentuk dari natrium alginat dan kalsium klorida akan berikatan dengan asam dari medium lambung buatan pH 1,2 menghasilkan asam alginat.
2Na-alginat + CaCl2 Ca-alginat + 2NaCl Ca-alginat + H+ Ca2+ + H-alginat
Asam alginat yang terbentuk bersifat hidrofob sehingga menjadi sukar larut dan tetap utuh dalam medium lambung pH 1,2 (Bangun, et al., 2005).
4.5 Kinetika Orde Pelepasan
Tabel 4.4 Kinetika pelepasan klaritromisin 500 mg dari cangkang kapsul alginat
80-120 cP
Persamaan Regresi R2
Orde Nol y = 0,0368x + 12,84 0,5802
Orde Satu y = 0,001x + 1,016 0,4343
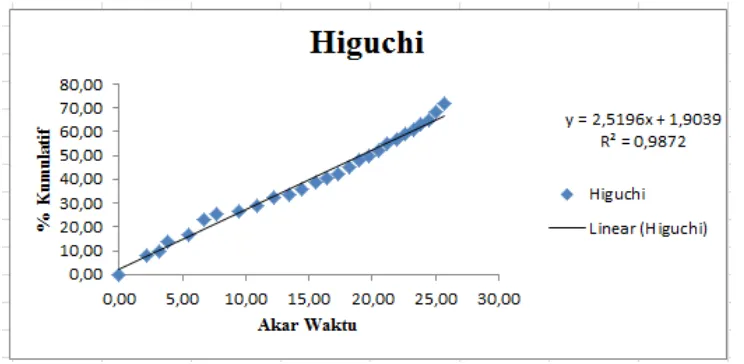
Higuchi Y= 1,1243x + 6,434 0,7004
Tabel 4.5 Kinetika pelepasan klaritromisin : PVP K30 (2:1) dari cangkang
kapsul alginat 80-120 cP
Persamaan Regresi R2
Orde Nol y = 0,0891x + 14,351 0,9563
Orde Satu y = 0,0014x + 1,110 0,5786
Higuchi y = 2,5196x + 1,904 0,9872
Korsmeyer-Peppas y = 0,0432x + 0,849 0,7526
Gambar 4.7 Grafik kinetika pelepasan orde nol klaritromisin dari cangkang
kapsul alginat 80-120 cP
Gambar 4.8 Grafik kinetika pelepasan orde nol dispersi padat klaritromisin
(2:1) dari cangkang kapsul alginat 80-120 cP
4.6 Hasil Uji Aktivitas Antibakteri
4.6.1 Pengujian aktivitas antibakteri larutan standar klaritromisin
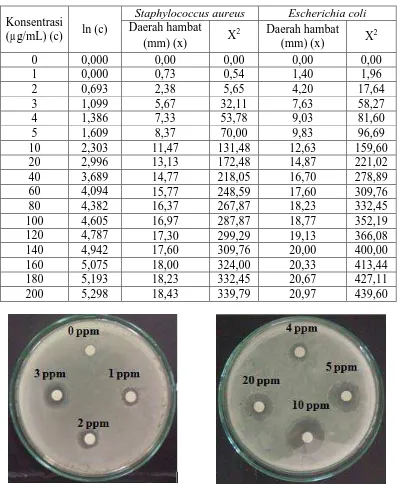
Hasil uji larutan standar klaritromisin dengan konsentrasi 0-200 µg/mL terhadap pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli yang diinkunbasi pada suhu 37oC selama 18 jam ditunjukkan pada Tabel 4.6 dan Gambar 4.9 dan 4.10.
Tabel 4.6 Aktivitas antibakteri dari larutan standar klaritromisin
Konsentrasi
(µg/mL) (c) ln (c)
Gambar 4.9 Hasil pengujian daerah hambat dari larutan standar klaritromisin
terhadap bakteri Staphylococcus aureus
Gambar 4.10 Hasil pengujian daerah hambat dari larutan standar klaritromisin
terhadap bakteri Escherichia coli
4.6.2 Penentuan konsentrasi hambat minimum (KHM) klaritromisin
Konsentrasi Hambat Minimum (KHM) dari klaritromisin di dapat berdasarkan persamaan berikut (Beg, et. al., 2012):
ln (KHM) = ln (c) – x2
/4Dt ….………. (1) Keterangan: KHM = Konsentrasi Hambat Minimum
c = Konsentrasi larutan x2 = Daerah hambat D = Koefisien difusi t = Waktu difusi
Persamaan (1) kemudian diturunkan menjadi:
berdasarkan persamaan (2) dibuat plot antara ln (c) vs x2. Intersept dari persamaan garis tersebut merupakan ln (KHM) yang kemudian digunakan untuk mencari nilai Konsentrasi Hambat Minimum (KHM) dari larutan standar klaritromisin. Grafik plot ln(c) vs x2 larutan standart klaritromisin terhadap bakteri S.aureus dan E.coli dapat dilihat pada Gambar 4.11 dan 4.12.
Gambar 4.11 Plot ln (c) vs x2 larutan standar klaritromisin terhadap bakteri Staphylococcus aureus
Gambar 4.12 Plot ln (c) vs x2 larutan standar klaritromisin terhadap bakteri Escherichia coli
Sedangkan dari Gambar 4.12 plot garis yang didapat memiliki koefisien korelasi sebesar 0,992, hal ini juga menunjukkan hubungan linearitas yang baik. Nilai intersept persamaan garis (ln KHM) adalah 0,3184, maka nilai KHM klaritromisin terhadap bakteri E.coli adalah 2,08 µg/mL.
Menurut Clinical and Laboratory Standard Institude (2007) konsentrasi hambat minimum klaritromisin menggunakan metode difusi agar terhadap bakteri Staphylococcus aureus, dikatakan sensitif apabila nilai KHM ≤2 μg/ml dan
4.6.3 Uji aktivitas antibakteri aliquot disolusi
Hasil pengujiaan aktivitas antibakteri aliquot hasil disolusi sediaan floating dispersi padat klaritromisin-PVP K30 (2:1) dengan metode difusi
terhadap pertumbuhan bakteri S.aureus dan E.coli ditunjukkan pada Tabel 4.7.
Tabel 4.7 Pengujian aliquot disolusi terhadap pertumbuhan bakteri
Staphylococcus aureus dan Escherichia coli
Menurut Clinical Laboratory Standart Institute (2007) apabila zona
hambat yang terbentuk pada uji difusi terhadapa bakteri Staphylococcus aureus
berukuran ≤ 13 mm, maka aktivitas penghambatannya dikategorikan lemah. Apabila zona hambat berukuran 14-17 mm dikategorikan sedang, dan ≥18 mm dikategorikan kuat. Apabila zona hambat yang terbentuk terhadap Eschericia coli berukuran ≤8 mm, maka aktivitas penghambatnya dikategorikan lemah. Apabila zona hambat yang terbentuk 16 mm dikategorikan sedang, dan ≥32 mm
dikategorikan kuat. Berdasarkan Tabel 4.7 terlihat bahwa aliquot hasil disolusi sediaan floating dispersi padat klaritromisin pada waktu 11 jam memiliki potensi
Waktu (jam) Daerah hambat (mm)
Staphylococcus aureus Escherichia coli
yang sedang dalam menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli dengan Daerah hambat 15,72±0,57 mm dan 15,75±0,42 mm.
Daerah hambat dari sediaan floating dispersi padat klaritromisin yang dihasilkan dari uji aktivitas antibakteri terhadap pertumbuhan bakteri Staphylococcus aureus dan bakteri Escherichia coli terus bertambah dengan
meningkatnya waktu, peningkatan diameter daerah hambat vs waktu dapat dilihat di grafik pada Gambar 4.13dan 4.14 sedangkan gambar hasil pengujian dapat dilihat pada Gambar 4.15 dan 4.16
Gambar 4.13 Grafik daerah hambat aliquot disolusi sediaan floating dispersi
Gambar 4.14 Grafik daerah hambat aliquot disolusi sediaan floating dispersi
padat klaritromisin terhadap pertumbuhan bakteri E.coli
Gambar 4.15 Hasil pengujian daerah hambat aliquot disolusi sediaan floating
dispersi padat klaritromisin terhadap bakteri Staphylococcus aureus
Gambar 4.16 Hasil pengujian daerah hambat aliquot disolusi sediaan floating
dispersi padat klaritromisin terhadap bakteri Escherichia coli
Hasil pengujian aktivitas antibakteri sediaan floating dispersi padat klaritromisin terhadap pertumbuhan bakteri Staphylococcus aureus dan pertumbuhan bakteri Escherichia coli diperoleh hasil yang sama.
4.6.4 Korelasi daerah hambat aliquot disolusi dan Daerah hambat larutan standar (hitung)
Tabel 4.8 Korelasi pengujian daerah hambat aliquot disolusi sediaan floating
dispersi padat dan daerah hambat larutan standar (hitung) terhadap bakteri S.aureus
Aliquot disolusi Larutan standar (hitung) Waktu
(jam)
Daerah hambat (mm) (x)
X2 Ln C (y) C
Daerah hambat (x)
(mm)
0 0,00 0,0000 0,40 0,00000 0,0000
0,5 8,99 80,8001 1,58 80,80012 8,9889
1 10,14 102,9098 1,91 102,90975 10,1444 2 10,51 110,4835 2,02 110,48346 10,5111 3 11,02 121,4894 2,18 121,48938 11,0222 4 11,37 129,2011 2,30 129,20111 11,3667 5 12,04 145,0686 2,53 145,06864 12,0444 6 12,80 163,8400 2,81 163,84000 12,8000 7 13,51 182,5501 3,08 182,55012 13,5111 8 13,61 185,2623 3,12 185,26235 13,6111 9 13,97 195,0678 3,26 195,06778 13,9667 10 14,36 206,0820 3,43 206,08198 14,3556 11 15,72 247,1883 4,03 247,18827 15,7222
Gambar 4.17 Grafik plot daerah hambat aliquot disolusi praktek vs Daerah
Tabel 4.9 Korelasi pengujian daerah hambat aliquot disolusi sediaan floating
dispersi padat dan daerah hambat larutan standar (hitung) terhadap bakteri E.coli
Aliquot disolusi Larutan standar (hitung) Waktu
(jam)
Daerah hambat (mm) (x)
X2 Ln C (y) C Daerah hambat (x) (mm)
0 0 0,0000 0,32 0,00000 0,0000
0,5 9,12 83,2149 1,30 83,21494 9,1222 1 10,18 103,5872 1,54 103,58716 10,1778 2 11,49 131,9946 1,88 131,99457 11,4889 3 11,74 137,9320 1,95 137,93198 11,7444 4 12,17 148,0278 2,07 148,02778 12,1667 5 12,43 154,5878 2,14 154,58778 12,4333 6 12,86 165,2653 2,27 165,26531 12,8556 7 13,16 173,0686 2,36 173,06864 13,1556 8 13,40 179,5600 2,44 179,56000 13,4000 9 14,04 197,2464 2,65 197,24642 14,0444 10 14,87 221,0178 2,93 221,01778 14,8667 11 15,75 248,0275 3,25 248,02750 15,7489
Gambar 4.18 Grafik plot daerah hambat aliquot disolusi praktek vs daerah
hambat hitung terhadap bakteri Escherichia coli
daerah hambat berdasarkan perhitungan diperoleh nilai R2 terhadap bakteri S.aureus dan E.coli adalah 1. Hal ini menunjukkan adanya hubungan yang linear
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
a. Cangkang kapsul alginat dapat digunakan sebagai sediaan floating yang
bertahan dilambung karena cangkang kapsul alginat memiliki kemampuan untuk tetap utuh dan mengapung dalam medium lambung buatan pH 1,2. b. Pelepasan sediaan floating dispersi padat klaritromisin dengan
polivinilpirolidon (PVP) K30 (2:1) memberikan pelepasan sustained release dalam medium pH 1,2 selama 11 jam. Dimana pelepasannya pada
pada menit ke-180 sebanyak 33,66%, pada menit ke-360 sebanyak 48,06%, dan pada menit ke-660 sebanyak 71,85%.
c. Sedian floating dispersi padat klaritromisin dengan PVP K30 (2:1) memiliki potensi untuk menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli yang ditunjukkan dengan adanya diameter
daerah hambat dari aliquot uji disolusi.
5.2 Saran
BAB II
TINJUAN PUSTAKA
2.1 Ulkus Peptikum
Ulkus peptikum merupakan tukak yang terjadi dalam saluran pencernaan baik di lambung maupun di duodenum. Gambaran klinis utamanya adalah rasa nyeri yang terjadi pada bagian lambung dan akan mereda setelah makan atau sesudah menelan antasida. Nyeri biasanya timbul 2 sampai 3 jam setelah makan atau pada malam hari sewaktu lambung kosong. Nyeri ini seringkali digambarkan sebagai nyeri teriris, terbakar, atau rasa tidak enak. Sekitar seperempat dari penderita m engalami perdarahan, walaupun hal ini lebih lazim terjadi pada ulkus duodenum. Gejala dan tanda penyakit ini adalah muntah, muntahan berwarna merah atau “seperti kopi”, mual, anoreksia, dan penurunan berat badan (Price dan Wilson, 2005).
Awalnya, hal tersebut diperkirakan terjadi karena stres dan makanan pedas, akan tetapi setelah diteliti lebih lanjut hal tersebut terjadi karena beberapa faktor, dapat disebabkan karena adanya asam lambung dan enzim pepsin ketika Helicobacter pylori, NSAIDs, atau faktor lainnya mengganggu sistem pertahanan
mukosa dan penyembuhan mukosa (Berardi dan Welage, 2005).
2.2 Helicobacter Pylori
Helicobacter pylori merupakan bakteri basil berbentuk spiral, pH-sensitif,
et. al., 2005). H.pylori dapat berkembang dalam lambung karena bakteri tersebut dapat menghasilkan urease dan protein penghambat asam lambung. Bakteri ini hanya dapat berkembang di epitel seperti epitel dan mukosa lambung (Siddalingam dan Cidambaram, 2014).
Secara umum, ada 3 mekanisme infeksi bakteri H. pylori yang menyebabkan tukak lambung. Pertama, H. pylori menginfeksi bagian bawah lambung antrum. Kedua, setelah infeksi akan terjadi peradangan bakteri yang mengakibatkan peradangan lendir lambung (gastritis), peristiwa ini seringkali terjadi tanpa penampakan gejala (asimptomotik). Ketiga, terjadinya peradangan dapat berimplikasi terjadinya tukak lambung atau usus 12 jari. Hal ini bisa terjadi komplikasi akut, yaitu luka dengan pendarahan dan luka berlubang. Tujuan terapi obat H.pylori adalah untuk eradikasi organisme ini. Terapi yang digunakan harus efektif, dapat ditoleransi, mudah dikombinasi, dan murah (Rani dan Fauzi, 2009).
2.3 Klaritromisin 2.3.1 Uraian bahan
Gambar 2.1 Struktur klaritromisin
Rumus Molekul : C38H69NO13
Berat Molekul : 747,95
Pemerian : Serbuk hablur; putih sampai hampir putih
Kelarutan : Larut dalam aseton; sukar larut dalam etanol absolut, dalam metanol, dalam asetonitril dan dalam dapar fosfat pH 2-5; praktis tidak larut dalam air (Ditjen POM, 2014).
2.3.2 Farmakologi klaritromisin
Antibiotik makrolida semisintesis ini menghambat sintesis protein bakteri dengan cara berikatan dengan subunit ribosomal 50s organisme yang rentan dan menghambat sintesis protein dalam proses translokasi aminoacyl transfer RNA (Kumar et. al., 2012).
2.3.3 Farmakokinetik klaritromisin
a. Absorbsi: Klaritromisin larut dalam lemak dan sangat cepat diserap dalam
saluran pencernaan dengan bioavailabilitas sekitar 50-55%. Hal ini dikarenakan
efek metabolisme lintas pertama yang menghasilkan 14-hidroksiklaritromisin
(Fraschini et. al., 1993).
b. Distribusi dan Ikatan protein: Sekitar 42-50% klaritromisin akan berikatan dengan protein plasma. Klaritromisin kan didistribusikan ke seluruh jaringan tubuh keculai ke sistem saraf pusat (Frashcini et. al., 1993).
c. Metabolisme: Klaritromisin di metabolisme di hati dan mengalami dimetilasi, hidrosilasi, dan hidrolisis.
2.4 Sistem Penghantaran Obat Gastroretentif
Penyampaian obat secara oral merupakan rute pemberian obat yang paling banyak digunakan dikarenakan penggunaan yang mudah, pasien lebih patuh, formulasi yang mudah, dan lebih murah. Akan tetapi, bentuk sediaaan oral memiliki beberapa kekurangan yaitu proses absorbsi yang cepat, degradasi oleh asam lambung, dan waktu paruh yang pendek. Oleh karena hal tersebut, peneliti mengembangkan sediaan oral dengan pelepasan berkelanjutan yang dapat mencapai efek yang diinginkan (Neetika dan Manish, 2012).
Salah satu sediaan oral yang telah dikembangkan adalah sistem penyampaian obat yang bertahan dilambung atau gastroretentive drug delivery system. Sistem ini dapat mempertahankan obat tetap berada di dalam lambung
selama beberapa jam dan karenanya dapat memperpanjang waktu tinggal obat di lambung secara signifikan. Peningkatan waktu tinggal di lambung dapat meningkatkan bioavailabilitas atau ketersediaan hayati, mengurangi residu obat, dan meningkatkan kelarutan obat yang kurang larut dalam lingkungan pH tinggi. Sistem ini juga diaplikasikan dalam pengobatan lokal untuk bagian perut dan bagian atas usus kecil. Motilitas saluran cerna yang melambat dengan pemberiaan bersamaan dengan obat ini juga meningkatkan waktu tinggal obat didalam lambung (Neetika dan Manish, 2012).
Gambar 2.2 Sistem penghantaran obat di lambung
density yang dikembangkan untuk meningkatkan lama tinggal sediaan di dalam
lambung (Neetika dan Manish, 2012).
2.5 Sistem Penghantaran Obat Mengapung (Floating Drug Delivery System)
Sediaan dengan sistem penghantaran mengapung (floating drug delivery system) memiliki berat jenis yang jauh lebih kecil dari cairan lambung, hal ini
menyebabkan sediaan dapat tetap mengapung dalam waktu yang lama. Disaat sediaan mengapung, maka obat akan terlepas lambat, kemudian residual akan dikosongkan dari lambung. Hal ini menyebabkan lama tinggal sediaan dilambung meningkat dan kontrol pelepasan konsentrasi obat lebih baik (Shah, 2009).
Sistem penghantaran obat mengapung dibagi ke dalam dua variabel formulasi yaitu sistem effervescent dan sistem non-effervescent.
a. Bentuk Sediaan Floating Effervescent
Merupakan sistem yang menggunakan polimer agar dapat mengapung seperti HPMC, senyawa polisakarida polisakarida lain, kitosan, dan effervescent seperti sodium bikarbonat, kalsium karbonat, asam sitrat, dan asam tartat. Sediaan diformulasikan sedemikian rupa sehingga saat kontak dengan asam lambung CO2 akan dilepaskan dan terperangkap dalam hidrokoloid yang telah mengembang, hal
ini menyebabkan sediaan mengapung (Narang, 2010). b. Bentuk Sediaan Floating Non-Effervescent
formulasinya, obat dan hidrokoloid pembentuk gel dicampurkan secara merata. Setelah diberikan secara oral, sediaan akan mengembang setelah kontak dengan asam lambung dengan massa jenis lebih kecil dari satu, daya apung sediaan disebabkan oleh udara yang terjerap didalam matriks (Narang, 2010).
2.5.1 Kandidat obat untuk sediaan mengapung
Pada sistem penghantaran obat ini dimaksudkan untuk obat-obat dengan tujuan pemakaian tertentu, dengan maksud untuk penghantaran, dan aktivitas kerja obat yang lebih baik. Berbagai macam kandidat obat yang tepat untuk diformulasikan pada sistem penghantaran obat mengapung diantaranya:
a. Obat-obat yang aktif bekerja secara lokal di lambung, contoh: misoprostol dan antasida.
b. Obat-obat yang memiliki rentang absorpsi sempit dalam saluran pencernaan, contoh: Levodopa, asam p-amino benzoat, furosemid, dan riboflavin.
c. Obat-obat yang tidak stabil pada lingkungan basa di bagian usus atau kolon, contoh: Captopril, ranitidine HCl, dan metronidazol.
d. Obat-obat yang mengganggu aktivitas kerja mikroba di kolon, contoh: antibiotik yang digunakan pada pengobatan Helicobacter Pylori, diantaranya tetrasiklin, klaritomisin, metronidazol, dan amoksisilin.
e. Obat-obat yang menunjukkan kelarutan yang rendah pada pH yang tinggi, contoh: diazepam, klordiazeposid, dan verapamil (Bharathi, et al., 2015).
2.5.2 Keuntungan bentuk sediaan mengapung
Bentuk sediaan floating memiliki beberapa keuntungan, yaitu:
a. Peningkatan penyerapan obat karena peningkatan waktu tinggal di lambung dan peningkatan waktu kontak obat dengan daerah penyerapan.
c. Penghantaran obat secara lokal untuk daerah kerja di lambung.
d. Meminimalkan terjadinya iritasi pada mukosa lambung karena obat-obatan tertentu dengan cara melepaskan obat secara lambat pada tingkat terkendali. e. Digunakan untuk pengobatan gangguan pencernaan.
f. Menggunakan peralatan yang sederhana dan konvensional.
g. Kemudahan dalam penggunaannya dan meningkatkan faktor kepatuhan pasien menjadi lebih baik.
h. Penghantaran obat pada daerah tertentu (Sharma, et al., 2011).
Berbagai keuntungan ini menjadikan sistem lebih dikembangkan lagi untuk menghasilkan sistem penghantaran yang ideal (Sharma, et al., 2011).
2.5.3 Kekurangan sistem penyampaian obat mengapung
Selain keuntungan, bentuk sediaan ini juga memiliki beberapa kekurangang, diantaranya:
a. Retensi lambung yang dipengaruhi oleh banyak faktor seperti makanan, pH, dan motilitas lambung. Faktor-faktor ini tidak pernah tetap dan karenanya daya apung sediaan tidak dapat diprediksi.
b. Obat-obatan yang menyebabkan iritasi dan lesi pada mukosa lambung tidak cocok untuk sistem pemberian obat ini.
c. Variabilitas tinggi dalam waktu pengosongan lambung.
2.6 Sistem Dispersi Padat 2.6.1 Definisi dispersi padat
Istilah dispersi padat mengacu kepada sekelompok produk padatan yang terdiri setidaknya dari dua komponen yang berbeda, umumnya matriks hidrofilik dan obat hidrofobik. Matriks ini dapat berupa kristal atau amorf. Obat ini dapat terdispersi secara molekuler, dalam partikel amorphous (kluster) atau dalam partikel kristal (Chiou dan Reigelman, 1971).
Dispersi padat dapat didefenisikan sebagai sistem dispersi satu atau lebih bahan aktif ke dalam suatu pembawa atau matriks inert dalam kondisi padat, yang dibuat dengan cara peleburan, pelarutan, atau kombinasi dari peleburan dan pelarutan, dimana masing-masing metode ini memiliki keuntungan dan kerugian masing-masing dan disesuaikan dengan sifat bahan dan matriks yang akan didispersikan. Keuntungan dari formulasi dispersi padat dibandingkan tablet/kapsul konvensional untuk peningkatan disolusi dan biovailabilitas dari obat yang sukar larut dalam air (Chiou dan Rielgeman, 1971).
2.6.2 Metode pembuatan sistem dispersi padat 2.6.2.1 Metode pelelehan
Keuntungan utama metode ini adalah sederhana dan ekonomis. Sebagai tambahan dapat dicapai supersaturasi zat terlarut atau obat pada sistem dengan mengkristalkan lelehan langsung secara cepat dari temperatur tinggi Dibawah kondisi seperti itu, molekul zat terlarut tertahan pada matriks pelarut dengan proses pemadatan langsung. Sehingga didapat dispersi kristalit yang lebih halus dari sistem campuran eutetis sederhana bila metode ini digunakan. Kekurangannya adalah banyak zat baik obat atau pembawa, dapat terurai atau menguap selama proses peleburan pada suhu tinggi (Chiou dan Riegelman, 1971).
2.6.2.2 Metode pelarutan
Metode ini telah lama digunakan dalam pembuatan dispersi padat atau kristal campuran senyawa organik dan anorganik (Chiou dan Riegelman, 1971). Dispersi padat dibuat dengan melarutkan campuran dua komponen padat dalam suatu pelarut umum, diikuti dengan penguapan pelarut. Metode ini digunakan untuk membuat dispersi padat ß- karoten-polivinilpirolidon (Tachibana dan Nakamura, 1965), sulfathiazol-polivinilpirolidon (Simonelli, et al., 1969). Keuntungan utama dari metode ini adalah penguraian obat atau pembawa dapat dicegah karena penguapan pelarut terjadi pada suhu rendah. Kekurangannya adalah biaya mahal, kesukaran memisahkan pelarut secara sempurna, kemungkinan efek merugikan dari pelarut yang jumlahnya dapat diabaikan terhadap stabilitas obat, pemilihan pelarut umum yang mudah menguap, dan kesukaran menghasilkan kembali bentuk kristal (Chiou dan Riegelman, 1971).
2.6.2.3 Metode pelarutan-pelelehan
dengan dosis terapetik yang rendah, misalnya dibawah 50 mg (Chiou dan Riegelman, 1971).
2.6.3 Pembawa dispersi padat
Pembentukan sistem dispersi padat dalam pembawa yang mudah larut telah luas digunakan diantaranya: polivinilpirolidon (PVP), polietilen glikol (PEG), polivinilalkohol (PVA), derivat selulosa, poliakrilat dan polimethakrilat, urea, gula, poliol dan polimernya, dan emulsifier (Leuner dan Dressman, 2000).
Polivinilpirolidon merupakan homopolimer dari N-vinilpirolidon dengan berat molekul 2500-3000 yang digunakan sebagai agen pensuspensi dan dispersi, pengikat tablet dan agen granulasi, dan sebagai pembawa untuk obat-obat seperti penisilin, kortison, prokain, dan insulin. PVP tersedia dengan range angka dari K15 sampai K90 (Attwood, 2008). Oleh karena kelarutan yang bagus dalam pelarut organik, PVP cocok digunakan untuk pembuatan dispersi padat dengan metode pelarutan. Peningkatan laju disolusi dari dispersi padat dengan PVP telah dilakukan pada asam fufenamat (Itai et al., 1985).
2.7 Natrium Alginat
Alginat sangatlah berlimpah di alam indonesia karena alginat ini sebagai komponen struktural yang terdapat dalam alga coklat (Phaeophyceae), yang komponennya mencapai 40% dari bahan keringnya (Draget, et al., 2005)
Alginate komersil umumnya diproduksi dari Laminaria hyperborean, Macrocystis pyrifera, Laminaria digitata, Ascophyllum nodosum, Laminaria
japonica, Edonia maxima, Lessonia nigrescens, Durvillea Antarctica, dan
Sargassum sp (Draget, et al., 2005).
Asam alginat merupakan kopolimer biner yang terdiri dari residu β -D-mannuronat (M) dan α-L-asam guluronat (G) yang tersusun dalam blok-blok yang
membentuk rantai linier (Grasdalen, et. al., 1979). Kedua unit tersebut berikatan pada atom C1 dan C4 dengan susunan homopolimer dari masing-masing residu (MM dan GG) dan suatu blok heteropolimer dari dua residu (MG) (Thom, et al., 1980).
Gambar 2.3 Struktur Alginat (a) monomer alginat (b) ikatan antar monomer
(c) gambaran blok monomer alginat
Asam alginat bersifat asam, dan sering digunakan dalam granulasi asam atau netral. Jika digunakan dalam garam basa atau garam asam organik, zat ini cenderung membentuk alginat yang larut atau tidak larut yang mempunyai sifat gel dan memperlambat desintegrasi. Asam alginat biasa digunakan pada konsentrasi 1% sampai 5%, sedangkan natrium alginat digunakan antara 2,5% sampai 10%. Asam alginat dan garamnya merupakan suatu kombinasi yang baik dengan pengembangan yang cukup dengan kelekatan minimal dan konsentrasi serendah mungkin antara 4% sampai 5% sudah memadai dalam memberikan sifat pengembangan tersebut (Siregar dan Wikarsa, 2010).
(i) pH pelarut merupakan parameter penting karena akan menentukan adanya muatan elektrostatik pada residu asam uronat.
(ii) Kekuatan ionik total zat terlarut juga berperan penting (terutama efek salting-out kation-kation non-gelling), dan
(iii) Kandungan dari ion-ion pembentuk gel dalam pelarut membatasi kelarutan
(Draget, et al., 2005).
Kegunaan alginat dan kemampuannya mengikat air bergantung pada jumlah ion karboksilat, berat molekul dan pH. Kemampuan mengikat air meningkat bila jumlah ion karboksilat semakin banyak dan jumlah residu kalsium alginat kurang dari 500, sedangkan pH dibawah 3 terjadi pengendapan. Secara umum, alginat dapat mengabsorpsi air dan dapat digunakan sebagai pengemulsi dengan viskositas yang rendah (Zhanjiang, 1990).
Dilaboratorium Farmasi Fisik Fakultas Farmasi USU dalam beberapa tahun terakhir telah dikembangkan kapsul yang tahan terhadap asam lambung. Dimana cangkang kapsul tersebut dibuat dengan bahan dasar berupa natrium alginat dengan kalsium klorida menggunakan cetakan. Telah terbukti bahwa cangkang kapsul alginat tahan atau tidak pecah dalam cairan lambung buatan (pH 1,2). Utuhnya cangkang kapsul alginat didalam medium lambung buatan pH 1,2 disebabkan komponen penyusun cangkang kapsul alginat yaitu kalsium guluronat masih utuh (Bangun, dkk., 2005).
2.8 Kapsul
Kebanyakan kapsul-kapsul yang diedarkan di pasaran adalah kapsul yang semuanya dapat ditelan oleh pasien untuk memperoleh keuntungan dalam pengobatan. Kapsul gelatin keras merupakan kapsul yang digunakan oleh ahli farmasi dalam menggabungkan obat-obat dan pada umumnya kapsul jenis ini sering diproduksi oleh para pembuat sediaan farmasi (Ansel, 2005).
Kulit kapsul dibuat dari gelatin pelentur, dan air. Kulit kapsul dapat juga mengandung bahan-bahan tambahan seperti pengawet, bahan pewarna dan bahan pengeruh, pemberi rasa, gula, asam, dan bahan obat untuk mendapat efek yang diinginkan. Plasticizier (pelentur) yang digunakan dengan gelatin pada pembuatan kapsul lunak relatif sedikit. Yang paling banyak adalah Gliserin USP, Sorbitol USP, Pharmaceutical Grade Sorbitol Special, dan kombinasi-kombinasinya. Perbandingan berat plastisator kering terhadap gelatin kering menetukan kekerasan kulit/cangkang gelatin, dengan anggapan tidak ada pengaruh dari bahan yang dikapsulkan (Lachman, dkk., 2008). Laju pengeringan kapsul juga mempengaruhi kekerasan dan kerapuhan kapsul, kemampuan pelarutan, dan kecenderungan untuk melekat satu sama lain. Kondisi penyimpanan yang direkomendasikan untuk bentuk sediaan kapsul berkisar 15-30 o C dan 30%-60% kelembaban relatif (Margareth, et. al., 2009).
2.9 Uji Aktivitas Antibakteri
mengontrol kemoterapi obat. Kegunaan uji antimikroba adalah diperolehnya susatu sistem pengobatan yang efektif dan efisien. Beberapa macam metode uji antimikroba dijelaskan berikut ini (Pratiwi, 2008).
2.9.1 Metode difusi
2.9.1.1 Tes Kirby & Bauer (disk-diffusion agar method)
Metode ini telah dikembangkan sejak tahun 1940, digunakan dalam banyak uji klinis mikrobiologi untuk pengujian sensitivitas antimikroba. Sekarang ini, banyak standar umum dan diakui telah dipublikasikan oleh Clinical Laboratory Standart Institute (CLSI) untuk menguji bakteri dan jamur, meskipun tidak semua bakteri tertentu dapat diuji menggunakan metode ini (Clinical Laboratory Standart Institute, 2007).
Prosedur pengujiannya, plat agar diikulasi dengan inokulum mikroorganisme yang telah distandarisasi. Kemudian, pencadang kertas/paper discs (beriameter 6 mm) yang mengandung bahan yang akan diuji dengan
Gambar 2.4 Tes Kirby & Bauer (disk-diffusion agar method) terhadap bakteri
C.albicas
2.9.1.2 Metode E-test
Metode E-test digunakan untuk mengestimasi konsentrasi hambat minimum (KHM), yaitu konsentrasi minimal suatu agen antimikroba untuk menghambat pertummbuhan mikroorganisme. Pada metode ini digunakan stip plastik yang mengandung agen antimikroba dari kadar yang terendah hingga kadar yang tertinggi dan diletakkan pada permukaan media agar yang telah ditanami mikroorganisme. Pengamatan dilakukan pada areah jernih yang telah ditimbulkannya yang menunjukkan kadar agen antimikroba yang menghambat pertumbuhan mikroorganisme pada media agar (Pratiwi, 2008).
2.9.1.3 Metode difusi lain
digunakan adalah agar well diffusion method, agar plug diffusion method, cross streak method, dan pasioned food method (Balouiri, et.al., 2016).
2.9.2 Metode dilusi
Metode dilusi dibedakan menjadi dua yaitu dilusi cair (broth dilution) dan dilusi padat (solid dilution) (Pratiwi, 2008).
2.9.2.1 Metode dilusi cair
Gambar 2.5 Mikrodilusi cair untuk uji antibakteri berdasarkan CLSI 2.9.2.2 Metode dilusi padat
Metode ini sama dengan metode dilusi cair namaun menggunakan media padat (solid), keuntungan dari metode ini adalahh satu konsentrasi dari agen antimikroba yang diuji dapat digunakan untuk menguji beberapa mikroba uji (Pratiwi, 2008).
2.9.3 Media pertumbuhan bakteri
Menurut Irianto (2006) media pertumbuhan bakteri berdasarkan kegunaannya dapat di bagi atas:
1. Media selektif yaitu media biakan yang mengandung paling sedikit satu bahan yang dapat menghambat perkembangbiakan mikroorganisme yang tidak diinginkan dan membolehkan perkembangbiakan mikroorganisme tertentu yang ingin diisolasi.