DINAMIKA POPULASI MIKROORGANISME RIZOSFER
TANAMAN KILEMO (
Litsea cubeba
L. Persoon) PADA
PERLAKUAN PEMANGKASAN DAN PEMUPUKAN
ANNISA NURUL RAMADHANI
DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Dinamika Populasi Mikroorganisme Rizosfer Tanaman Kilemo (Litsea cubeba L. Persoon) Pada Perlakuan Pemangkasan dan Pemupukan adalah benar karya saya dengan arahan dari komisi pembimbing (Fahrizal Hazra dan Enny Widyati) dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Data-data dalam penelitian ini merupakan bagian dari proyek yang didanai oleh DIPA tahun 2013, Pusat Penelitian dan Pengembangan Produktivitas Hutan, Bogor. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ANNISA NURUL RAMADHANI. Dinamika Populasi Mikroorganisme Rizosfer Tanaman Kilemo (Litsea cubeba L. Persoon) Pada Perlakuan Pemangkasan dan Pemupukan. Dibimbing oleh FAHRIZAL HAZRA dan ENNY WIDYATI.
Tumbuhan kilemo (Litsea cubeba L. Persoon) merupakan salah satu jenis tanaman yang dapat dimanfaatkan sebagai tanaman obat, salah satunya adalah penghasil minyak atsiri. Tanaman ini dipanen bagian pucuk dan daunnya sehingga perawatan dalam budidaya tanaman ini adalah pemangkasan dan pemupukan. Tujuan penelitian ini adalah untuk mengetahui pengaruh pemangkasan dan pemupukan terhadap populasi komunitas rizosfer tanaman kilemo (Litsea cubeba L. Persoon). Pemangkasan dilakukan pada tanaman kilemo umur 2 tahun dan pemupukan dilakukan dengan empat perlakuan yaitu kontrol (tanpa pemupukan), pupuk NPK, pupuk Daun, dan pupuk Kompos diberikan baik pada tanaman yang dipangkas maupun tidak dipangkas. Hasil penelitian menunjukan bahwa pemangkasan pada tanaman kilemo dapat menurunkan populasi mikroorganisme penambat N (Azotobacter), mikroorganisme pelarut fosfat (MoPP), dan mikroorganisme perombak selulosa (MPS). Pemangkasan dengan perlakuan pemupukan NPK juga cenderung menurunkan populasi mikroorganisme. Namun demikian, pemberian pupuk organik dapat meningkatkan populasi mikroorganisme Azotobacter dan mikroorganisme pelarut fosfat (MoPP). Sedangkan pupuk daun cenderung hanya meningkatkan populasi mikroorganisme perombak selulosa (MPS).
ABSTRACT
ANNISA NURUL RAMADHANI. Dynamics on Rhizosphere Microorganisms Population of Kilemo (Litsea cubeba L. Persoon) Affected by Pruning and Fertilizing Treatments. Supervised by FAHRIZAL HAZRA and ENNY WIDYATI.
Kilemo (Litsea cubeba L. Persoon) is the one of plant which cultivated as a medicine plant, such an essential oil. This plant harvested at the tip of leaves and the leaves, therefore the management include pruning and fertilizing. This research was aimed to observe the effect of pruning and fertilizing toward population of rhizosphere communities on kilemo (Litsea cubeba L. Persoon). Pruning was practiced on to kilemo after 2 years and four fertilizing treatments i.e control (without fertilizing), NPK fertilizer, microfertilizer and compost,were applied on to the plant with pruning and without pruning. Results of this research showed that pruning was able to decrease population of Azotobacter, P solubilizing microorganism (MoPP), cellulose solubilizing microorganism (MPS). Pruning with fertilizing NPK treatment also decreased population of microorganism. Furthermore, giving organic fertilizer was able to increase population of Azotobacter microorganism and P solubilizing microorganism (MoPP). Meanwhile, microfertilizer only increased population of cellulose solubilizing microorganism (MPS).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Ilmu Tanah dan Sumberdaya Lahan
DINAMIKA POPULASI MIKROORGANISME RIZOSFER
TANAMAN KILEMO (
Litsea cubeba
L. Persoon) PADA
PERLAKUAN PEMANGKASAN DAN PEMUPUKAN
ANNISA NURUL RAMADHANI
DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Dinamika Populasi Mikroorganisme Rizosfer Tanaman Kilemo (Litsea cubeba L. Persoon) Pada Perlakuan Pemangkasan dan Pemupukan.
Nama : Annisa Nurul Ramadhani NIM : A14090085
Disetujui oleh
Ir Fahrizal Hazra M.Sc Pembimbing I
Dr Enny Widyati Pembimbing II
Diketahui oleh
Dr Ir Baba Barus M.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2013 ini ialah Dinamika Populasi Mikroorganisme Rizosfer Tanaman Kilemo (Litsea cubeba L. Persoon) Pada Perlakuan Pemangkasan dan Pemupukan sebagai salah satu syarat dalam memeroleh gelar Sarjana Pertanian Institut Pertanian Bogor.
Terima kasih penulis ucapkan atas dukungan dan bantuan berbagai pihak yang terlibat dalam penelitian ini, khususnya:
1. Bapak Fahrizal Hazra sebagai pembimbing pertama, dan Ibu Enny Widyati sebagai pembimbing kedua atas arahan dan motivasi yang diberikan selama pelaksanaan penelitian sampai penulisan skripsi ini. 2. Ibu Rahayu Widyastuti selaku penguji dalam ujian skripsi yang turut
memberikan arahan dan masukan kepada penulis dalam menyelesaikan skripsi.
3. Pusat Penelitian dan Pengembangan Peningkatan Produktivitas Hutan-Bogor atas bantuan pendanaan penelitian melalui dana DIPA tahun 2013. 4. Staff bagian Labolatorium Bioteknologi Tanah yaitu Bapak Jito, Ibu Asih,
Ibu Jul dan Ibu Yani atas segala saran dan bantuan yang diberikan.
5. Orang tua, adik dan seluruh keluarga besar yang telah mendukung dan memberikan doa tulus kepada penulis.
6. Seluruh teman-teman Ilmu Tanah angkatan 46, kepada Agung Ardianto, Sri Indahyani dan Teguh Rianto atas segala bantuan dan motivasi yang diberikan kepada penulis selama pelaksanaan penelitian.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 2
Tanaman Kilemo (Litsea Cubeba L. Persoon) 2
Rizosfer 3
Populasi Mikroorganisme di Rizosfer 3
Interaksi Mikroorganisme Rizosfer 4
Pemangkasan 6
Pemupukan 7
METODE 7
Waktu dan Tempat 7
Deskripsi Lokasi Penelitian 7
Bahan 7
Alat 8
Prosedur 8
HASIL DAN PEMBAHASAN 11
Pengaruh Pemangkasan Terhadap Total Populasi Mikroorganisme 11 Pengaruh Pemupukan dan Pemangkasan Terhadap Total Populasi
Mikroorganisme 15
Identifikasi Mikroorganisme Rizosfer Dominan 21
SIMPULAN 23
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1. Kode perlakuan tanaman pangkas dan non-pangkas 8 2. Kode perlakuan tanaman pangkas dan non-pangkas 9 3. Total populasi Azotobacter tanaman pangkas dan non-pangkas 12 4. Total populasi MoPP tanaman pangkas dan non-pangkas 13 5. Total populasi MPS tanaman pangkas dan non-pangkas 14 6. Analisis pengaruh pemberian pupuk terhadap total populasi
mikroorganisme 20
7. Hasil identifikasi mikroorganisme penambat N (Azotobacter) 21 8. Hasil identifikasi mikroorganisme pelarut P (MoPP) 21 9. Hasil identifikasi mikroorganisme perombak selulosa (MPS) 22
DAFTAR GAMBAR
1. Tanaman kilemo umur 2 tahun (foto: Enny 2013) 2 2. Tanaman kilemo umur 2 tahun setelah dipangkas (foto: Enny 2013) 6 3. Total populasi Azotobacter pada tanaman pangkas dan non-pangkas 11 4. Total populasi MOPP pada tanaman pangkas dan non-pangkas 12 5. Total populasi MPS pada tanaman pangkas dan non-pangkas 13 6. Pengaruh pemangkasan dan pemupukan terhadap total populasi
Azotobacter 15
7. Pengaruh pemupukan terhadap total populasi Azotobacter 16 8. Pengaruh pemangkasan dan pemupukan terhadap total populasi
MOPP 17
DAFTAR LAMPIRAN
1. Total Populasi Azotobacter Tanaman Pangkas 10 HSP 27 2. Total Populasi Azotobacter Tanaman Non-Pangkas 10 HSP 27 3. Total Populasi Azotobacter Tanaman Pangkas 30 HSP 27 4. Total Populasi Azotobacter Tanaman Non-Pangkas 30 HSP 28 5. Total Populasi Azotobacter Tanaman Pangkas 60 HSP 28 6. Total Populasi Azotobacter Tanaman Non-Pangkas 60 HSP 28 7. Total Populasi Azotobacter Tanaman Pangkas 90 HSP 29 8. Total Populasi Azotobacter Tanaman Non-Pangkas 90 HSP 29 9. Total Populasi Azotobacter Tanaman Pangkas (Kontrol) 90 HSP 29 10. Total Populasi Azotobacter Tanaman Non-Pangkas (Kontrol) 90 HSP 30 11. Total Populasi MOPP Tanaman Pangkas 10 HSP 30 12. Total Populasi MOPP Tanaman Non-Pangkas 10 HSP 30 13. Total Populasi MOPP Tanaman Pangkas 30 HSP 31 14. Total Populasi MOPP Tanaman Non-Pangkas 30 HSP 31 15. Total Populasi MOPP Tanaman Pangkas 60 HSP 31 16. Total Populasi MOPP Tanaman Non-Pangkas 60 HSP 32 17. Total Populasi MOPP Tanaman Pangkas 90 HSP 32 18. Total Populasi MOPP Tanaman Non-Pangkas 90 HSP 32 19. Total Populasi MOPP Tanaman Pangkas (Kontrol) 90 HSP 33 20. Total Populasi MOPP Tanaman Non-Pangkas (Kontrol) 90 HSP 33 21. Total Populasi MPS Tanaman Pangkas 10 HSP 33 22. Total Populasi MPS Tanaman Non-Pangkas 10 HSP 34 23. Total Populasi MPS Tanaman Pangkas 30 HSP 34 24. Total Populasi MPS Tanaman Non-Pangkas 30 HSP 34 25. Total Populasi MPS Tanaman Pangkas 60 HSP 35 26. Total Populasi MPS Tanaman Non-Pangkas 60 HSP 35 27. Total Populasi MPS Tanaman Pangkas 90 HSP 35 28. Analisis ragam populasi Azotobacter Tanaman pangkas dan
non-pangkas 36
29. Analisis ragam populasi Azotobacter tanaman tangkas dan
non-pangkas dan pemupkan 36
30. Analisis ragam populasi MoPP tanaman tangkas dan non-pangkas 36 31. Analisis ragam populasi MoPP tanaman tangkas dan non-pangkas dan
pemupukan 37
32. Analisis ragam populasi MPS tanaman tangkas dan non-pangkas 37 33. Analisis ragam populasi MPS tanaman tangkas dan non-pangkas dan
pemupukan 37
1
PENDAHULUAN
Latar Belakang
Tanaman Litsea cubeba L. Persoon yang lebih dikenal dengan nama kilemo termasuk dalam famili Lauraceae. Tumbuhan ini merupakan salah satu tumbuhan penghasil minyak atsiri (Heyne 1987). Minyak atsiri merupakan salah satu hasil metabolisme tanaman yang dapat dimanfaatkan sebagai bahan pembuatan obat-obatan tradisional, kosmetik, aromaterapi dan bahan penyedap makanan (Liu et al. 2012). Penyebaran tanaman ini meliputi Asia Tenggara, Cina bagian selatan, Jepang dan Taiwan (Liu et al. 2012). Di Indonesia tanaman ini banyak dijumpai di daerah Jawa, Sumatera dan Kalimantan dan berada pada dataran tinggi dalam himpunan vegetasi hutan alam, hutan tanaman, belukar, perkebunan dan lahan yang dibudidayakan masyarakat (Prosea 1999).
Bagian tanaman yang dipanen umumnya adalah bagian kulit batang, namun pemanenan pada bagian ini akan menyebabkan kematian pada tanaman. Sehingga pemanenan hanya dilakukan pada bagian pucuk untuk menghindari kepunahan, upaya yang dilakukan untuk meningkatkan produktivitas pucuk adalah dengan pemangkasan. Mengacu Effendi et al. (2010) pada budidaya tanaman teh pemangkasan dapat dilakukan untuk meningkatakan produktivitas pucuk. Selain untuk peningkatan produktivitas pucuk, pemangkasan juga berfungsi untuk mengatur arah tumbuh tanaman, menjaga kesehatan tanaman, mengurangi bagian tanaman yang tidak produktif (parasite), dan mengurangi habitat hidup bagi organisme pengganggu tanaman (Alvarez 2013).
Pembentukan dan produktivitas pucuk juga dapat ditingkatkan dengan melakukan pemupukan. Hal ini dilakukan untuk memberikan tambahan unsur-unsur hara pada komplek tanah, yang secara langsung maupun tidak langsung dapat menyumbangkan nutrisi bagi tanaman. Pemupukan bertujuan untuk memperbaiki tingkat kesuburan tanah agar tanaman mendapatkan nutrisi yang cukup dalam meningkatkan kualitas dan kuantitas pertumbuhan tanaman. Mengacu pada budidaya tanaman teh, Effendi et al. (2010) menyatakan bahwa tingkat kesuburan tanah juga dapat mempengaruhi kecepatan dan tingkat produktivitas pucuk yang baru.
2
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui pengaruh pemangkasan dan pemupukan terhadap dinamika populasi mikroorganisme rizosfer yaitu mikroorganisme penambat N, mikroorganisme pelarut P, dan mikroorganisme perombak selulosa pada tanaman kilemo.
TINJAUAN PUSTAKA
Tanaman Kilemo (Litsea Cubeba L. Persoon)
Tumbuhan Litsea cubeba L. Persoon di daerah Jawa Barat dikenal dengan nama kilemo, di Jawa Tengah dikenal dengan nama krangean, sedangkan di Sumatera Utara dengan nama antarasa (Gambar 1). Tumbuhan ini termasuk famili Lauraceae, yang merupakan pohon perdu dengan diameter batang 6 – 20 cm serta tinggi pohon mencapai 5 – 12 meter. Penyebaran tumbuhan kilemo di Indonesia meliputi daerah Jawa, Kalimantan dan Sumatera. Tumbuhan kilemo di pulau Jawa banyak dijumpai di daerah dengan ketinggian 230 – 700 m di atas permukaan laut, terutama di daerah lereng gunung (Heyne 1987).
Tumbuhan ini merupakan salah satu tumbuhan penghasil minyak atsiri (Heyne 1987). Minyak atsiri dikenal dengan nama minyak eteris atau minyak terbang (essential oil, volatile) yang merupakan salah satu hasil metabolisme tanaman. Istilah esensial dipakai karena minyak atsiri mewakili bau dari tanaman asalnya. Dalam keadaan segar dan murni, minyak atsiri umumnya tidak berwarna, namun pada penyimpanan lama minyak atsiri dapat teroksidasi. Untuk mencegah teroksidasi, minyak atsiri harus disimpan dalam bejana gelas yang berwarna gelap, diisi penuh, ditutup rapat, serta disimpan di tempat yang kering dan sejuk (Gunawan & Mulyani, 2004). Minyak atsiri bersifat mudah menguap pada suhu kamar, mempunyai rasa getir, serta berbau wangi sesuai dengan bau tanaman penghasilnya (Sudaryani dan Sugiharti, 1990). Minyak atsiri pada industri banyak
3 digunakan sebagai bahan pembuat kosmetik, parfum, antiseptik dan lain-lain. Beberapa jenis minyak atsiri mampu bertindak sebagai bahan terapi (aromaterapi) atau bahan obat suatu jenis penyakit. Fungsi minyak atsiri sebagai bahan obat tersebut disebabkan adanya bahan aktif, sebagai contoh bahan anti radang, hepatoprotektor, analgetik, anestetik, antiseptik, psikoaktif dan anti bakteri (Agusta 2000).
Seperti halnya minyak atsiri yang lain, minyak kilemo juga termasuk hasil metabolisme dari tumbuhan aromatik, karena hampir semua bagian tumbuhan ini beraroma dan mengandung minyak (Kayang et al. 2009). Minyak kilemo juga umumnya dimanfaatkan dalam industri makanan, kosmetik dan rokok. Selain digunakan sebagai sumber minyak untuk berbagai makanan dan keperluan industri obat-obatan, minyak tersebut juga dapat digunakan untuk industri kimia seperti cat, tinta, resin, vanish, plastik dan biodisel (Chen et al. 2008). Sebagai bahan obat-obatan tradisional minyak kilemo digunakan sebagai obat rematik, pegal-pegal, demam, dan untuk rempah (Rahmawati 2004). Akar dan cabang kilemo digunakan oleh masyarakat untuk obat sakit pencernaan, sakit kepala, sakit otot, sakit saat menstruasi, dan obat mabuk perjalanan (Heryati 2009).
Rizosfer
Istilah rizosfer diperkenalkan pada tahun 1904 oleh Hiltner, seorang ilmuan Jerman untuk menunjukkan bagian tanah yang dipengaruhi oleh perakaran tanaman (Rao 1994). Rizosfer berasal dari kata rhizo dan sphere. Rhizo berarti akar, sedangkan sphere diartikan sebagai suatu zona yang mengelilingi suatu “sentral point” dimana menjadi tempat aktivitas komunitas (“society”) dari beragam jenis mikroorganisme (Rao 1994).
Rizosfer adalah habitat yang didominasi oleh tanaman dan bukan didominasi oleh tanah (Yulipriyanto 2010). Rizosfer dipengaruhi oleh akar tanaman. Nutrien-nutrien yang tersedia dipengaruhi oleh metabolisme tanaman, demikian juga pH, oksigen dan konsentrasi CO2, tekanan osmosis dan pengaruh permukaan tanah juga ditentukan oleh sistem perakaran dan hanya sedikit dipengaruhi oleh tanah yang ada disekitarnya. Akumulasi sumber nutrien yang dihasilkan dari sekresi akar dan dari pengelupasan kulit akar menyebabkan perbedaan yang nyata terhadap jumlah dan kesuburan populasi mikroorganisme antara daerah rizosfer dengan non-rizosfer (Yuliprianto 2010).
Populasi Mikroorganisme di Rizosfer
Kondisi rizosfer berbeda dengan kondisi tanah non-rizosfer, dalam rizosfer terjadi proses fisika, kimia dan biologi karena adanya interaksi akar terkait mikroorganisme (Oliveira et al. 2009). Pada rizosfer, akar tanaman yang berbeda bersaing untuk mendapatkan air, mineral dan nutrisi (Sanaullah et al. 2011). Banyak mikroorganisme rizosfer memiliki kemampuan untuk meningkatkan pertumbuhan tanaman dan produktivitas akibat adanya interaksi antara mikroorganisme, tanah dan tanaman ( Rosas et al. 2006).
4
anorganik yang berada disekelilingnya, tetapi juga dengan sekelompok mikroorganisme tanah yang sangat aktif. Bentuk dan sifat mikroorganisme sekeliling akar jauh berbeda dengan kelompok mikroorganisme yang beberapa centimeter jaraknya dari permukaan akar. Kehadiran mikroorganisme tersebut tidak secara tiba-tiba, tetapi sudah merupakan sifat alami yang terbawa sejak biji tanaman tersebut berkecambah. Juga sebaliknya, akar sangat dipengaruhi oleh kelompok mikroorganisme tersebut (Yulipriyanto 2010).
Struktur komunitas mikroorganisme di dalam rizosfer berbeda dengan tanah non-rizosfer, jumlah dan jenis populasi akan sangat berbeda tergantung pada jumlah dan komposisi eksudat akar yang dihasilkan oleh tanaman (Marschner et al. 2011). Jumlah dan komposisi ini bervariasi antar jenis tanaman yang dipengaruhi oleh fisiologi tanaman, status hara, tekanan lingkungan dan penyakit pada tanaman.
Selain itu mikroorganisme dapat mempengaruhi pertumbuhan tanaman dan serapan hara oleh tanaman dengan merangsang atau menghambat zat yang mempengaruhi fisiologi akar dan sistem akar. Pelepasan eksudat akar dengan kepadatan mikroorganisme dan aktivitas metabolisme yang tinggi akan lebih besar dalam tanah rizosfer dibandingkan tanah non-rizosfer (Marschner et al. 2011).
Mikroorganisme memainkan perananan kunci dalam siklus hara dengan cara menguraikan, mineralisasi bahan organik dan melepaskan serta mengubah nutrisi anorganik. Ketika suatu mikroorganisme kekurangan unsur hara tertentu yang dibutuhkan, mereka dapat mempengaruhi ketersediaan hara dengan cara reduksi atau oksidasi (Marschner et al. 2011). Sebagian besar mikroorganisme di rizosfer adalah saprofit atau dekomposer yang berinteraksi secara netral (tidak secara langsung menguntungkan tetapi tidak menimbulkan kerusakan). Dampak yang ditimbulkan oleh mikroorganisme kelompok ini adalah mempengaruhi pertumbuhan tanaman secara tidak langsung (Widyati 2013).
Sejalan dengan pertumbuhan akar, terjadi perubahan musim-musim populasi mikroorganisme. Komunitas bakteri di rizosfer tidak pernah statis tetapi selalu berfluktuasi sejalan dengan tahapan pertumbuhan tanaman. Komposisi bakteri akan berbeda pada lokasi yang satu dengan yang lainnya. Komposisi akan berbeda pula pada jenis tanah yang berbeda, spesies tanaman yang berbeda, musim yang berbeda dan sangat dipengaruhi oleh kondisi iklim setempat. Adapun tahapan pertumbuhan tanaman mungkin merupakan faktor yang sangat penting dalam menentukan struktur komunitas mikroorganisme rizosfer. Hal ini karena pada fase pertumbuhan tanaman yang berbeda akan menghasilkan eksudat akar yang berbeda (Widyati 2013).
Interaksi Mikroorganisme Rizosfer
5 dapat bersifat menguntungkan maupun merugikan bagi tanaman. Berbagai mikroorganisme yang menguntukan diantaranya kelompok fungsional mikroorganisme penambat N (Azotobacter), mikroorganisme pelarut P (MoPP), dan mikroorganisme perombak selulosa (MPS).
Azotobacter
Tanah selalu berada dalam kekurangan unsur N (Hardjowigeno 2007). Namun di rizosfer terdapat sekelompok bakteri yang membantu menambat N. Salah satu bakteri penambat N tersebut adalah Azotobacter yang merupakan bakteri penambat nitrogen yang hidup bebas. Genus Azotobacter memiliki peranan menambat N pada kisaran di lingkungan yang berbeda seperti tanah, air dan sedimen. Bahkan berbagai percobaan telah menunjukan bahwa dalam kondisi lingkungan tertentu, inokulasi dengan Azotobacter memiliki efek menguntungkan hasil tanaman, karena peningkatan tetap kandungan nitrogen dalam tanah dan sekresi mikroorganisme merangsang hormon, seperti giberelin, auksin dan sitokinin. Distribusi Azotobacter dalam tanah juga sangat dipengaruhi oleh nilai pH(Aquilanti 2004).
Mikroorganisme Pelarut P (MoPP)
Fosfor (P) merupakan salah satu nutrisi makro penting utama untuk pertumbuhan tanaman. P dalam tanah terutama ditemukan sebagai P yang terikat dengan mineral atau P organik yang tidak larut dan tidak tersedia bagi tanaman. Mikroorganisme, bakteri dan jamur memainkan peranan kunci dalam siklus P alam dan mengkonversi dalam bentuk P yang tersedia, yang penting untuk pertumbuhan dan kelangsungan hidup tanaman (Behera 2013). Bakteri pelarut P adalah mikroorganisme dominan yang melarutkan mineral P dalam tanah, dibandingkan dengan jamur atau actinomycetes (Guang-can et al. 2008). Salah satu akibat dari inokulasi bakteri MoPP dalam melarutkan P diantaranya adalah peningkatan produksi asam di rizosfer. Pseudomonas sp., Bacillus sp., Bacillus megaterium, dan Chromobacterium sp. adalah sebagian dari kelompok MoPP yang mempunyai kemampuan tinggi sebagai “biofertilizer” dengan cara melarutkan unsur P yang terikat pada unsur lain (Fe, Al, Ca, dan Mg), sehingga unsur P tersebut menjadi tersedia bagi tanaman (Widawati 2006).Berbagai jenis bakteri MoPP diantaranya Pseudomonas, Mycobacterium, Micrococcus, Bacillus, Flavobacterium, Rhizobium, Mesorhizobium dan Sinorhizobium (Rosas et al. 2006).
Mikroorganisme Perombak Selulosa (MPS)
6
Pemangkasan
Pemangkasan adalah kegiatan pembuangan secara selektif bagian dari tanaman seperti cabang, pucuk, tunas atau akar. Dalam bidang kehutanan, pemangkasan cabang adalah kegiatan pembuangan cabang untuk memperoleh batang bebas cabang yang bebas dari mata kayu dan membentuk struktur pohon (Kosasih et al. 2010). Pemangkasan dilakukan sebagai usaha untuk perbaikan kualitas kayu dan sering digunakan dalam bidang silvikultur dalam pengelolaan hutan. Pembuangan batang sekunder dan cabang-cabang kecil dilakukan untuk meningkatkan pertumbuhan dan kuantitas dan kualitas kayu yang diproduksi. Fungsi lain dari pemangkasan diantaranya mengurangi kompetisi pertumbuhan batang tanaman. Berdasarkan tujuan pengelolaannya, pemangkasan telah disarankan sebagai alat penting untuk meningkatkan produktivitas kayu, meningkatkan kualitas hutan produksi atau produksi buah. Selain efek positif, terdapat efek negatif dari pemangkasan tanaman diantaranya pengurangan daerah fotosistesis tanaman, kematian akar, dan pengurangan cadangan (Alvarez 2013). Pemangkasan tanaman kilemo dilakukan dengan memangkas seluruh bagian dahan di atas cabang terendah (Gambar 2).
Pemangkasan meningkatkan distribusi cahaya melalui kanopi dan mendorong pertumbuhan tanaman penutup tanah yang dapat digunakan untuk memerangi erosi tanah. Distribusi pestisida yang diseprotkan pada tanaman untuk pengendalian hama dan penyakit juga umumnya juga lebih efektif diaplikasikan di pohon kanopi terbuka yang telah dipangkas (Olesen 2013). Calatayud (2008) melaporkan bahwa perlakuan pemangkasan telah terbukti memberikan pengaruh besar terhadap perkembangan tanaman, yang secara langsung berpengaruh pada biomas akar tanaman, melalui penurunan luas permukaan daun, perubahan fotosintesis atau alokasi laju respirasi, laju pertumbuhan dan pola alokasi karbon yang dapat menyebabkan perubahan total populasi mikroorganisme.
7 Pemupukan
Pemupukan telah lama menjadi praktek agronomi penting untuk meningkatkan kualitas dan produktivitas tanaman (Zhou 2013). Pengaruh pemupukan banyak terbukti dapat meningkatkan hasil panen tanaman. Namun, efek pemupukan pada struktur tanah masih belum jelas dampak positif dan negatifnya. Berbagai penelitian menunjukan bahwa pemupukan jangka panjang menggunakan bahan kimia dapat meningkatkan produksi tanaman tetapi mengurangi kualitas struktur tanah yaitu meningkatkan bobot isi tanah dan struktur tanah menjadi memburuk (Zhou 2013).
Pemupukan dapat berpengaruh pada peningkatan biomasa tanaman tetapi cenderung tidak berpengaruh pada pertumbuhan akar tanaman (Glab 2013). Pemberian pupuk N berbanding terbalik dengan pertumbuhan akar tanaman. Menurut Zhao (2013) pengaruh pemupukan terhadap komunitas mikroorganisme di dalam tanah masih belum jelas, bahkan beberapa penelitian melaporkan pemupukan dapat mengurangi biomasa mikroorganisme tanah.
METODE
Waktu dan Tempat
Penelitian dilakukan antara bulan April sampai bulan September 2013 di Laboratorium Bioteknologi Tanah Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor. Sampel tanah diambil dari rizosfer tanaman kilemo umur dua tahun yang ditanam di Hutan Penelitian Desa Cikole Kecamatan Lembang, Bandung.
Deskripsi Lokasi Penelitian
Hutan Penelitian (HP) Cikole terletak di Desa Cikole, Kecamatan Lembang, Kabupaten Bandung. Keadaan topografi adalah bergelombang sampai berbukit dengan ketinggian 1.350-1.500 m di atas permukaan laut (dpl). Bentuk wilayahnya bergunung dengan kelerengan yang sangat curam (>25%) dan kelerengan mengarah ke selatan. Secara geografi HP Cikole terletak pada 6º45’30″ sampai dengan 6º47’30″ LS dan 107º39’59″ sampai dengan 107º41’30″ BT. Penanaman tanaman kilemo dilakukan searah lereng karena mengutamakan teknik konservasi lahan.
Bahan
8
Alat
Alat yang akan digunakan dalam penelitian ini antara lain: peralatan pemangkasan dan pengambilan sampel tanah rizosfer, peralatan gelas, shaker, jarum ose, bunsen, autoklaf, laminair flow, oven, inkubator, timbangan, mikroskop, dan lain-lain.
Prosedur Pengambilan Sampel Tanah (Pemangkasan)
Pengambilan sampel tanah rizosfer tanaman kilemo umur 2 tahun dilakukan pada 12 tanaman terpilih untuk setiap perlakuan dan dikompositkan menjadi 4 ulangan. Pemangkasan tanaman kilemo dilakukan dengan memotong semua bagian dahan diatas cabang terendah, sehingga masih tersisa daun dalam jumlah sedikit. Hasil pemangkasan digunakan sebagai hasil panen untuk selanjutnya diolah untuk menghasilkan minyak kilemo. Pemangkasan dilakukan sekali di awal yaitu pada 0 hari setelah pangkas (HSP). Selanjutnya sampel tanah rizosfer pada tanaman pangkas diambil pada empat waktu berbeda yaitu pada 10 HSP, 30 HSP, 60 HSP, dan 90 HSP. Sampel tanah rizosfer tanaman non-pangkas disesuaikan waktu pengambilannya bersama sampel rizosfer tanaman pangkas dengan tujuan mengefektifkan waktu dan biaya pengambilan sampel. Selanjutnya ditetapkan total populasi dari tiga kelompok fungsional mikroorganisme diantaranya mikroorganisme penambat N (Azotobacter), mikroorganisme pelarut fosfat (MoPP) dan mikroorganisme perombak selulosa (MPS).
Pengambilan Sampel Tanah (Pemupukan)
Pemupukan dilakukan secara melingkar terhadap pohon dengan jari-jari 1 – 1,25 meter. Pemupukan dilakukan pada tanaman pangkas dan non-pangkas pada umur 30 HSP. Selanjutnya sampel tanah rizosfer diambil pada dua waktu berbeda yaitu 60 HSP (30 hari setelah pemupukan) dan 90 HSP (60 hari setelah pemupukan). Perlakuan yang diberikan antara lain kontrol (tanpa pupuk), pupuk NPK, pupuk daun, dan pupuk organik. Dosis pupuk yang diberikan sesuai dengan anjuran pada kemasan label, yaitu pupuk NPK sebanyak 200 g/pohon, pupuk daun sebanyak 3 g/ 10 liter/ 20 pohon dan pupuk organik sebanyak 500 g/ pohon. Tabel 1 Kode perlakuan tanaman pangkas dan non-pangkas
HSP Pangkas (P) Non-Pangkas (NP)
10 P1 NP1
30 P2 NP2
60 P3 NP3
9
Rancangan percobaan menggunakan rancangan acak lengkap yang tediri dari empat blok dan kemudian dilakukan analisis statistik menggunakan Anova-SAS. Penetapan Total Mikroorganisme
a. Sterlisasi Alat dan Bahan
Setiap alat dan bahan yang akan digunakan untuk proses isolasi harus dipastikan steril agar hasil yang didapatkan tidak terdapat kontaminan. Sterilisasi pada alat seperti cawan, pipet, tabung reaksi, erlenmeyer dilakukan dengan membungkus alat-alat tersebut menggunakan kertas dan memasukannya ke dalam autoklaf selama 20 menit pada temperatur 120⁰ Celcius tekanan 1 atm. Selanjutnya setelah proses autoklaf selesai, alat dimasukan ke alam oven 60⁰ Celcius agar kering. Berbeda dengan alat, sterilisasi bahan hanya dilakukan dengan mengautoklaf bahan (media dan larutan fisiologis) selama 15 menit dengan temperatur 120⁰ Celcius tekanan 1 atm.
b. Pengenceran (dilution series)
Larutan yang digunakan untuk pengenceran adalah larutan fisologis. Larutan fisiologis merupakan larutan pengencer yang terbuat dari 8,5 gram NaCl untuk setiap liter aquades. Sebelum melakukan proses pengenceran, harus dipastikan larutan fisiologis/pegencer yang digunakan sudah melalui proses sterilisasi. Proses pengenceran dilakukan dengan menimbang 10 gram bahan tanah yang digunakan untuk menentukan jumlah mikroorganisme dengan ditambahkan 90 ml larutan fisiologis yang dimasukan ke dalam erlenmeyer 250 ml. Erlenmeyer dengan bahan tanah 10 gram dan larutan fisiologis 90 ml tersebut merupakan larutan pengencer 10⁻¹. Selanjutnya untuk mendapatkan seri pengenceran 10⁻², 10⁻³, 10⁻⁴, dan 10⁻⁵ pipet 1 ml suspensi dari seri pengenceran sebelumnya ke dalam 9 ml larutan fisiologis yang telah dimasukan dalam tabung reaksi. Sebelum suspensi dipindahkan, pastikan larutan dengan seri pengencer sebelumnya sudah dikocok sedemikian rupa sehingga didapatkan suspensi bakteri yang homogen. Tutup semua erlenmeyer dan tabung reaksi dengan memakai penutup kapas atau almunium foil.
Tabel 2 Kode perlakuan tanaman pangkas dan non-pangkas HSP Pangkas (P) Non-Pangkas (NP)
60
Kontrol Kontrol
NPK NPK
Daun Daun
Organik Organik
90
Kontrol Kontrol
NPK NPK
Daun Daun
10
c. Persiapan Media
• Media NFM untuk pertumbuhan mikroorganisme Azotobacter
a). K2HPO4 0,9 g, KH2PO4 0,1 g, MgSO4.7H2O 0,1 g, CaCl2.2H2O 0,1 g, NaMoO4 0,005 g, FeSO4 0,0125 g, Manitol 5 g, Agar 20 g ditimbang.
b). Bahan-bahan media tersebut dilarutkan dalam 1 liter aquades dan dikocok hingga homogen dan dipanaskan.
c). Media tersebut diautoklaf selama 15 menit pada temperatur 120oC tekanan 1 atm.
d). Media tersebut siap dipakai.
• Media Pikovskaya untuk pertumbuhan mikroorganisme pelarut fosfat
a). Glukosa 10 g, Ca3PO4 5 g, (NH4)SO4 0,5 g, KCL 0,2 g, MgSO4.7H2O 0,1 g, MnSO4 sedikit, FeSO4 sedikit, Yeast extract 0,5 g, Agar 20 g ditimbang. b). Bahan-bahan media tersebut dilarutkan dalam 1 liter aquades dan dikocok
hingga homogen dan dipanaskan.
c). Media tersebut diautoklaf selama 20 menit pada temperatur 120oC tekanan 1 atm.
d). Media tersebut siap dipakai.
• Media CMC untuk pertumbuhan mikroorganisme perombak selulosa
a). KH2PO4 1,0 g, K2SO4.7H2O 0,5 g, NaCl 0,5 g, FeSO4 0,01 g, MnSO4 0,01 g, NH4NO3 1,0 g, Tepung selulosa 10 g, Agar 20 g ditimbang.
b). Bahan-bahan media tersebut dilarutkan dalam 1 liter aquades dan dikocok hingga homogen dan dipanaskan.
c). Media tersebut diautoklaf selama 15 menit pada temperatur 120oC tekanan 1 atm.
d). Media tersebut siap dipakai. d. Isolasi
1. Buat suatu seri pengenceran sesuai dengan kondisi tanah dan mikroorganisme yang akan di isolasi. MOPP pengenceran 10⁻³ dan 10⁻⁴, Perombak Selulose 10⁻³ dan 10⁻⁴, dan Azotobacter 10⁻² dan 10⁻³.
2. Kemudian pipet 1 ml suspensi dari yang paling encer dipindahkan ke dalam cawan petri yang sudah disterilisasi. Dalam setiap cawan dituliskan informasi penting mengenai isolat yang dimasukan seperti nomor contoh/perlakuan, seri pengenceran, tanggal inkubasi, dan media yang digunakan.
3. Media yang telah disiapkan didinginkan sampai temperatur media tersebut sekitar 40-45º Celcius. Hal ini dilakukan karena apabila media yang dituang ke dalam cawan terlalu panas maka akan membunuh mikroorganisme yang akan diteliti, sebaliknya apabila terlalu dingin maka agar akan memadat dan membentuk gumpalan-gumpalan dalam cawan. Jumlah media yang dituangkan ke cawan petri berkisar antara 10-15 ml.
11 5. Pengamatan dilakukan setelah 3, 5, atau 7 hari setelah inkubasi tergantung
pada pertumbuhan bakteri/ fungi yang akan diamati.
6. Perhitungan jumlah mikroorganisme yang dihasilkan dengan mengalikan rata-rata jumlah koloni per cawan petri dengan faktor pengenceran untuk mendapatkan jumlah mikroorganisme total untuk setiap gram contoh tanah kering udara. Hasil ini dikonversikan ke jumlah mikroorganisme di dalam 1 gram tanah kering mutlak dengan memperhitungkan kadar air tanah.
Identifikasi Mikroorganisme Dominan
Koloni yang sering muncul selanjutnya dianggap sebagai mikroorganisme yang paling dominan. Koloni tersebut kemudian diidentifikasi meliputi tiga tahapan yaitu identifikasi morfologi koloni meliputi warna, bentuk, tepi koloni, elevasi, morfologi sel meliputi bentuk sel dan fisiologi terbatas yaitu pewarnaan gram.
HASIL DAN PEMBAHASAN
Pengaruh Pemangkasan Terhadap Total Populasi Mikroorganisme Azotobacter
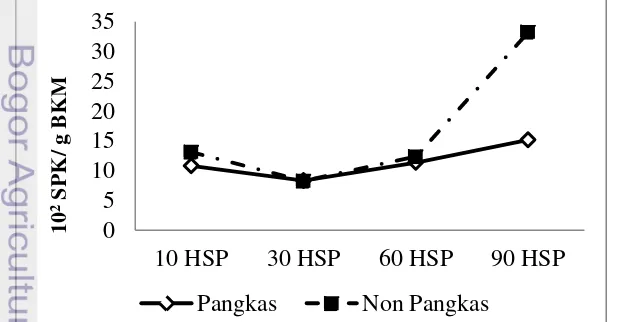
Berdasarkan Gambar 3. populasi Azotobacter pada perlakuan pangkas cenderung lebih rendah dari perlakuan non-pangkas pada semua pengamatan kecuali pada umur 30 HSP. Perbedaan yang nyata terlihat secara statistik antara populasi Azotobacter pangkas dan non-pangkas pada umur 90 HSP. Perlakuan pangkas maupun non-pangkas dari umur 10 HSP ke 30 HSP menurun diduga akibat turunnya kadar air. Menurut Haei (2011) kadar air merupakan salah satu faktor utama yang berperan dalam aktivitas mikroorganisme, ketika kadar air menurun maka aktivitas mikroorganisme juga menurun. Selain itu beberapa faktor seperti tipe tanah, kelembaban tanah, pH dan temperatur, dan umur serta kondisi tanaman juga mempengaruhi efek rizosfer yang juga mempengaruhi keberadaan dan distribusi mikroorganisme di dalamnya (Rao 1994).
12
Berdasarkan uji statistik pada Tabel 3, perbedaan yang nyata terlihat pada total populasi Azotobacter umur 90 HSP antara tanaman pangkas dan non-pangkas. Sedangkan pada umur 10 HSP, 30 HSP, dan 60 HSP perbedaan antara tanaman pangkas dan non-pangkas tidak terlihat nyata secara statistik. Pada umur 90 HSP total populasi Azotobacter baik pada tanaman pangkas maupun non-pangkas memiliki nilai paling tinggi dan perbedaan yang nyata diduga akibat pada umur 90 HSP mikroorganisme berada pada fase pertumbuhan (eksponensial). Pada fase ini mikroorganisme membelah dengan cepat dan konstan mengikuti kurva logaritmik.
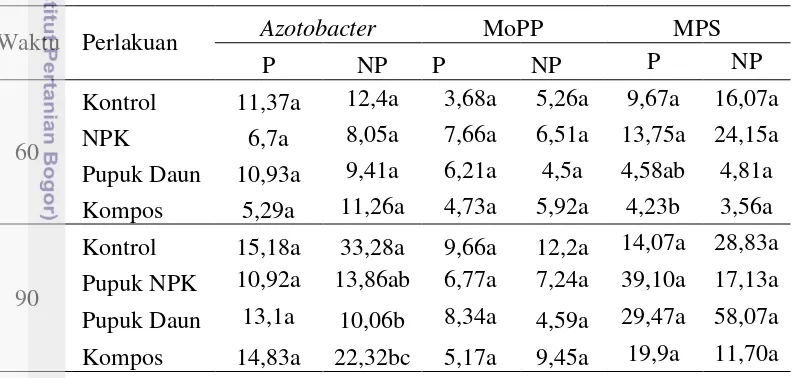
Tabel 3 Total populasi Azotobacter tanaman pangkas dan non-pangkas
Umur Pangkas Non-pangkas
10 HSP 10,83 13,15a
30 HSP 8,32 8,29a
60 HSP 11,37 12,40a
90 HSP 15,18 33,28b
Keterangan : Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada uji DMRT taraf 5%
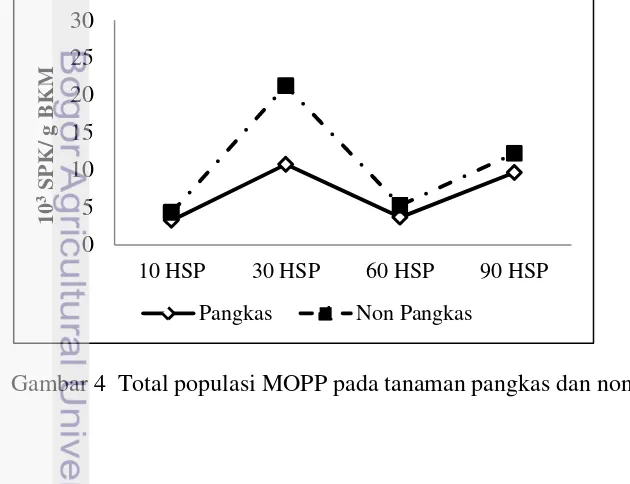
Mikroorganisme Pelarut P (MoPP)
Seperti halnya pada populasi Azotobacter, pada Gambar 4. terlihat populasi MoPP dengan perlakuan pemangkasan juga selalu lebih rendah dari perlakuan non-pangkas. Secara statistik perbedaan yang nyata pada populasi MOPP terlihat pada umur 30 HSP sedangkan pada umur 10, 60 dan 90 HSP perbedaan populasi MoPP tidak berbeda nyata.. Terjadi peningkatan populasi mikroorganisme dari umur 10 HSP dengan nilai 3,26 x 103 SPK/g BKM hingga 30 HSP menjadi 10,74 x 103 SPK/g BKM dan selanjutnya kembali menurun pada umur 60 HSP hingga umur 90 HSP. Pada perlakuan pemangkasan populasi MOPP juga terjadi peningkatan populasi mikroorganisme dari umur 10 HSP dengan nilai 4,32 x 103 SPK/g BKM hingga umur 30 HSP menjadi 21,24 x 103 SPK/g BKM dan selanjutnya kembali menurun pada umur 60 HSP hingga umur 90 HSP.
13 Berdasarkan uji statistik pada Tabel 4, perbedaan yang nyata terlihat pada total populasi MoPP umur 30 HSP antara tanaman pangkas dan non-pangkas. Sedangkan pada umur 10 HSP, 60 HSP, dan 90 HSP perbedaan antara tanaman pangkas dan non-pangkas tidak terlihat nyata secara statistik. Pada umur 30 HSP total populasi MoPP baik pada tanaman pangkas maupun non-pangkas memiliki nilai paling tinggi dan perbedaan yang nyata diduga akibat pada umur 90 HSP mikroorganisme berada pada akhir fase pertumbuhan (eksponensial). Pada akhir fase eksponensial kecepatan pertumbuhan populasi menurun dikarenakan nutrien untuk sumber pertumbuhan mikroorganisme sudah berkurang, atau adanya hasil metabolisme yang mungkin beracun atau dapat menghambat pertumbuhan mikroorganisme.
Tabel 4 Total populasi MoPP tanaman pangkas dan non-pangkas
Umur Pangkas Non-pangkas
10 HSP 3,26 4,32a
30 HSP 10,73 21,24ab
60 HSP 3,68 5,26a
90 HSP 9,66 12,20a
Keterangan : Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada uji DMRT taraf 5%
Mikroorganisme Perombak Selulosa (MPS)
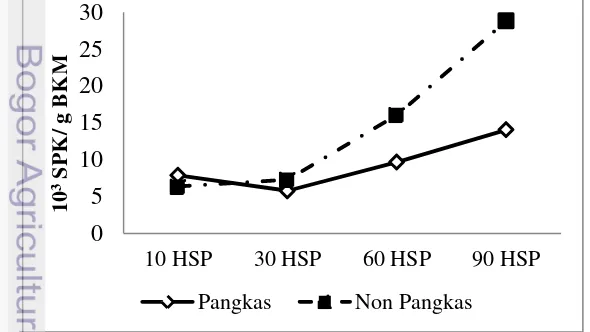
Gambar 5. menunjukan populasi MPS pada perlakuan pangkas umur 30, 60 dan 90 HSP lebih rendah dari perlakuan non-pangkas kecuali pada umur 10 HSP menunjukan populasi MPS pangkas lebih tinggi dibandingkan non-pangkas. Secara statistik perbedaan populasi MPS yang nyata terlihat pada umur 30 HSP. Pada perlakuan pangkas umur 10 HSP populasi MPS sebesar 7,86 x 103 SPK/g BKM dan menurun pada umur 30 HSP dan selanjutnya kembali meningkat pada umur 60 HSP hingga umur 90 HSP. Sedangkan pada perlakuan non-pangkas populasi MPS terus meningkat dari umur 10 HSP hingga 90 HSP.
14
Berdasarkan uji statistik pada Tabel 5, perbedaan yang nyata terlihat pada total populasi MPS umur 30 HSP antara tanaman pangkas dan non-pangkas. Sedangkan pada umur 10 HSP, 60 HSP, dan 90 HSP perbedaan antara tanaman pangkas dan non-pangkas tidak terlihat nyata secara statistik. Tetapi, sama halnya seperti Azotobacter, nilai populasi tertinggi MPS terdapat pada umur 90 HSP karena diduga mikroorganisme berada pada fase pertumbuhan (eksponensial). Pada fase ini kecepatan pertumbuhan sangat dipengaruhi oleh medium tempat tumbuhnya mikroorganisme seperti pH dan kandungan nutrient, juga kondisi lingkungan termasuk suhu dan kelembaban udara.
Tabel 5 Total populasi MPS tanaman pangkas dan non-pangkas
Umur Pangkas Non-pangkas
10 HSP 7,89 6,37a
30 HSP 5,79 7,30ab
60 HSP 9,67 16,07a
90 HSP 14,07 28,83a
Keterangan : Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada uji DMRT taraf 5%
Secara umum ketiga kelompok fungsional mikroorganisme dari tanaman dengan perlakuan pangkas lebih rendah dari tanaman dengan perlakuan non-pangkas. Hal ini diduga berhubungan dengan berkurangnya luas permukaan tanaman untuk melakukan proses fotosintesis sehingga berkurangnya jumlah karbohidrat yang disintesis yang berpengaruh terhadap ketersediaan energi bagi mikroorganisme di dalam rizosfer tanaman tersebut. Hal tersebut menyebabkan hasil asimilat dari fotosintesis yang dilakukan pada daun terbagi untuk pertumbuhan cabang sekunder.Calatayud (2008) melaporkan bahwa perlakuan pemangkasan telah terbukti memberikan pengaruh besar terhadap perkembangan tanaman, yang secara langsung berpengaruh pada biomasa akar tanaman, melalui penurunan luas permukaan daun, perubahan fotosintesis atau alokasi laju respirasi, laju pertumbuhan dan pola alokasi karbon yang dapat menyebabkan perubahan total populasi mikroorganisme.
Sejalan dengan itu, Glenn (2011) menyatakan sistem akar tanaman berasal dari energi dari hasil fotosintat yang ditanslokasikan dari kanopi ke sistem akar. Sehingga diduga apabila hasil fotosintesis menurun akibat berkurangnya jumlah daun maka energi yang dihasilkan dari fotosintesis yang akan ditranslokasikan ke akar juga menurun. Selain itu, perbedaan total populasi juga dapat disebabkan oleh keberadaan substrat yang dihasilkan oleh akar tanaman berupa eksudat akar.Eksudat ini akan mempengaruhi kehidupan mikroorganisme disekitar perakaran dengan memanfaatkannya sebagai sumber nutrisi dan sumber karbon bagi pertumbuhannya (Dermiyati 2009). Eksudat tersebut merupakan senyawa yang dikeluarkan oleh perakaran tanaman meliputi asam amino, gula, asam organik, vitamin-vitamin, nukleotid (Rao 1994).
15 sehingga terjadi kompetisi dengar akar tanaman (Calatayud 2008). Hal ini menyebabkan berkurangnya substrat yang dikeluarkan oleh akar sehingga sumber nutrisi bagi mikroorganisme berkurang yang menyebabkan populasinya juga menurun.
Perlakuan pemangkasan juga mempengaruhi naungan tanaman karena berkurangnya jumlah daun sehingga meningkatkan distribusi cahaya yang masuk melalui kanopi. Tetapi pengaruh naungan tidak secara langsung mempengaruhi total populasi mikroorgannisme. Karena efek yang diberikan langsung berpengaruh kepada tanah dan bukan tanaman. Sejalan dengan Yuliprianto (2010) yang menyatakan bahwa pengaruh rizosfer didominasi oleh kondisi tanaman dan hanya sedikit dipengaruhi oleh tanah yang ada disekitarnya.
Pengaruh Pemupukan dan Pemangkasan Terhadap Total Populasi Mikroorganisme
Setelah 30 HSP, pada setiap tanaman baik pada perlakuan pangkas maupun non pangkas dilakukan pemupukan. Hal ini dilakukan untuk memberikan tambahan unsur-unsur hara pada komplek tanah sehingga dapat memperbaiki tingkat kesuburan tanah agar tanaman mendapatkan nutrisi yang cukup untuk meningkatkan kualitas dan kuantitas pertumbuhan tanaman. Menurut Leiwakabessy dan Sutandi (2004) hara atau nutrient adalah zat yang diserap tanaman untuk makanannya.Perlakuan pemupukan ini menggunakan tiga jenis pupuk dan satu kontrol. Pupuk yang digunakan diantaranya NPK, pupuk daun, dan pupuk kompos. Pemupukan dilakukan pada umur 30 HSP setelah pemangkasan dikarenakan tanamanan yang telah dipangkas sudah menghasilkan tunas.
Azotobacter
16
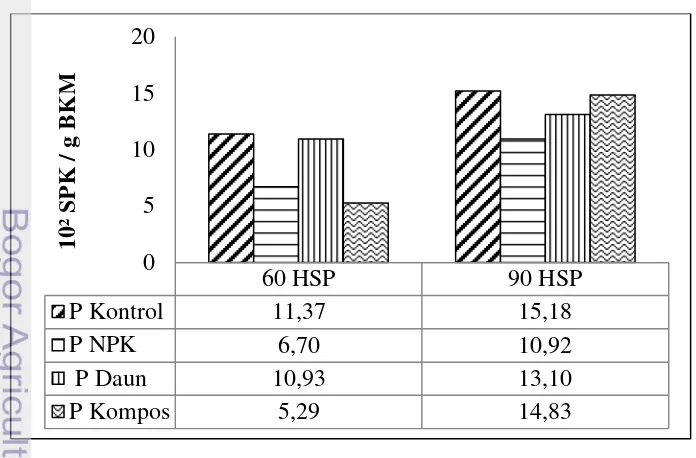
Berdasarkan Gambar 6. terlihat populasi Azotobacter pada tanaman kontrol selalu lebih tinggi dibandingkan tanaman dengan perlakuan pemupukan. Berdasarkan perhitungan persen peningkatan populasi dari umur pangkas 60 HSP ke 90 HSP populasi mikroorganisme cenderung meningkat untuk setiap jenis pupuk kecuali pemberian pupuk daun dibandingkan kontrol. Pupuk yang memberikan peningkatan tertinggi populasi secara berturut-turut yaitu kompos 180%, NPK 63%, dan pupuk daun 19,85% sedangkan kontrol 33,5%.
Berdasarkan Gambar 7. Sama seperti pada tanaman pangkas, pada tanaman non-pangkas terlihat populasi Azotobacter pada tanaman kontrol selalu lebih tinggi dibandingkan tanaman dengan perlakuan pemupukan. Setelah satu bulan pemberian pupuk yaitu pada umur pangkas 60 HSP hingga 90 HSP populasi Azotobacter meningkat untuk setiap jenis pupuk maupun kontrol. Berdasarkan perhitungan peningkatan populasi dari 60 HSP ke 90 HSP, pemberian pupuk dapat menurunkan populasi mikroorganisme. Diantara ketiga perlakuan pemberian pupuk, pemberian pupuk kompos merupakan yang paling rendah dalam menurunkan populasi yaitu sebesar 98,22% dibandingkan kontrol sebesar 168,3%.
Secara umum pada tanaman pangkas maupun non-pangkas, pemberian pupuk kompos cenderung lebih besar meningkatkan populasi Azotobacter dibandingkan pemberian pupuk NPK dan pupuk daun. Hal ini sesuai dengan kecenderungan bahwa peningkatan bahan organik tanah karena pemberian pupuk organik dapat mengatur kelembaban dan aerasi, pemantap struktur tanah, meningkatkan KTK, sebagai sumber hara bagi tanaman dan sebagai sumber energi bagi aktivitas jasad mikro (Suryantini 2002). Matias (2009) juga menyatakan bahwa sebagian besar populasi mikroorganisme bergantung pada masukan bahan organik dalam tanah. Selain itu bahan organik diketahui mempengaruhi pertumbuhan dan perkembangbiakan mikroorganisme. Jumlah sel-sel Azotobacter dan jumlah nitrogen yang difiksasi olehnya juga semakin banyak dengan adanya penambahan bahan organik (Rao 1994).
Gambar 7 Pengaruh pemupukan terhadap total populasi Azotobacter
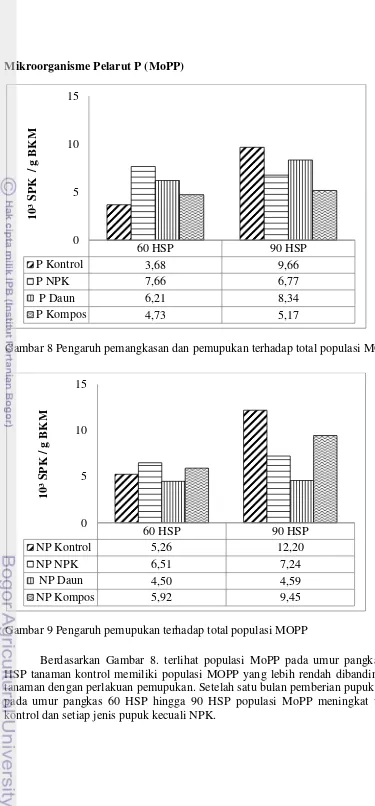
17 Mikroorganisme Pelarut P (MoPP)
Berdasarkan Gambar 8. terlihat populasi MoPP pada umur pangkas 60 HSP tanaman kontrol memiliki populasi MOPP yang lebih rendah dibandingkan tanaman dengan perlakuan pemupukan. Setelah satu bulan pemberian pupuk yaitu pada umur pangkas 60 HSP hingga 90 HSP populasi MoPP meningkat untuk kontrol dan setiap jenis pupuk kecuali NPK.
Gambar 8 Pengaruh pemangkasan dan pemupukan terhadap total populasi MOPP
60 HSP 90 HSP
P Kontrol 3,68 9,66
P NPK 7,66 6,77
P Daun 6,21 8,34
P Kompos 4,73 5,17
0 5 10 15
10³ S
P
K
/
g B
K
M
Gambar 9 Pengaruh pemupukan terhadap total populasi MOPP
60 HSP 90 HSP
NP Kontrol 5,26 12,20
NP NPK 6,51 7,24
NP Daun 4,50 4,59
NP Kompos 5,92 9,45
0 5 10 15
10³ S
P
K
/
g B
K
18
Berdasarkan perhitungan persen peningkatan populasi dari 60 HSP ke 90 HSP, pemberian pupuk cenderung menurunkan populasi MoPP dibandingkan kontrol. Pupuk yang memberikan peningkatan tertinggi populasi MoPP secara berturut-turut yaitu pupuk daun 34,29%, dan kompos 9,30% sedangkan kontrol meningkat 162,5%. Sedangkan pada pemberian pupuk NPK mengalami penurunan dari 60 HSP ke 90 HSP sebesar 11,61%. Populasi MoPP menurun ketika diberikan pupuk NPK diduga akibat ketersediaan P dalam tanah meningkat sehingga aktivitas dan populasi MoPP dalam melarutkan P menjadi menurun. Hal ini sesuai dengan penyataan Marschner (1995) bahwa pemberian unsur hara yang berlebih akan mempengarui proses mikroorganisme dalam memfiksasi unsur hara bagi tanaman.
Berdasarkan Gambar 9. terlihat populasi MoPP pada umur pangkas 60 HSP tanaman kontrol memiliki populasi MoPP yang lebih rendah dibandingkan tanaman dengan perlakuan pemupukan. Setelah satu bulan pemberian pupuk yaitu pada umur pangkas 60 HSP hingga 90 HSP populasi MoPP meningkat untuk kontrol dan setiap jenis pupuk. Sama seperti pada tanaman pangkas, pemberian pupuk pada tanaman non-pangkas juga cenderung menurunkan populasi MoPP dibandingkan kontrol. Berdasarkan perhitungan persen peningkatan populasi dari umur 60 HSP ke 90 HSP, pupuk yang memberikan peningkatan tertinggi populasi MoPP secara berturut-turut yaitu kompos 60%, NPK 11,21%, dan pupuk daun 2%, sedangkan kontrol meningkat 131%.
Pemberian kontrol meningkatkan populasi mikroorganisme dibandingkan perlakuan pupuk lainnya. Mengacu pada Dini (2013) kondisi kontrol yang memiliki nilai populasi yang lebih besar dibandingkan perlakuan lainnya mengindikasikan bahwa tanah tanpa perlakuan pemberian pupuk sudah cukup menyediakan unsur hara bagi tanaman sehingga pemberian pupuk cenderung tidak efektif bagi pertumbuhan mikroorganisme didalamnya.
Pemberian pupuk NPK cenderung tidak meningkatkan populasi MoPP dan bahkan terjadi penurunan populasi pada perlakuan tanaman pangkas. Hal ini diduga adanya kecenderungan penurunan populasi MoPP tersebut akibat zat hara yang terkandung dalam tanah menjadi diikat oleh molekul-molekul kimiawi dari pupuk sehingga proses regenerasi humus tidak dapat dilakukan lagi (Novita 2012). Pemupukan juga mempengaruhi jumlah dan jenis substrat yang dikeluarkan oleh
akar tanaman (Kleine 2013).Selain itu menurut Novita (2012) pemupukan dapat
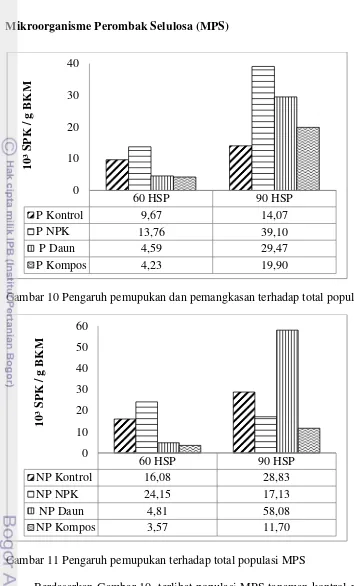
19 Mikroorganisme Perombak Selulosa (MPS)
Berdasarkan Gambar 10. terlihat populasi MPS tanaman kontrol pada umur 90 HSP pangkas memiliki populasi MPS yang lebih rendah dibandingkan tanaman dengan perlakuan pemupukan terutama penambahan pupuk NPK. Setelah satu bulan pemberian pupuk yaitu pada umur pangkas 60 HSP hingga 90 HSP populasi MPS meningkat signifikan untuk setiap penambahan ketiga jenis pupuk. Pupuk yang memberikan peningkatan tertinggi populasi MPS secara berturut-turut yaitu pupuk daun 542%, kompos 370%, NPK 184% dan kontrol 45,5%.
Gambar 10 Pengaruh pemupukan dan pemangkasan terhadap total populasi MPS
60 HSP 90 HSP
Gambar 11 Pengaruh pemupukan terhadap total populasi MPS
20
Berdasarkan Gambar 11. terlihat populasi MPS tanaman kontrol pada umur 60 HSP lebih rendah dibandingkan tanaman dengan pemberian pupuk NPK. Setiap pemberian ketiga jenis pupuk dan kontrol meningkatkan populasi MPS dari umur 1 bulan setelah pemupukan atau 60 HSP pemangkasan hingga 90 HSP kecuali pemupukan NPK. Pupuk yang memberikan peningkatan tertinggi populasi MPS secara berturut-turut yaitu pupuk daun 1170%, kompos 227,7% dan kontrol 79,29%. Sedangkan pada pemberian pupuk NPK mengalami penurunan 29%.
Total populasi MPS cenderung mengalami peningkatan yang cukup signifikan baik pada tanaman yang dipangkas maupun tidak dari umur 60 HSP hingga 90 HSP pada setiap jenis pemupukan kecuali pupuk NPK. Perubahan populasi MPS salah satunya disebabkan oleh tingkat dekomposisi tanah dalam mendekomposisi selulosa. Diduga apabila tingkat dekomposisi selulosa dalam tanah tinggi maka jumlah populasi MPS juga tinggi. Faktor-faktor yang mempengaruhi laju dekomposisi selulosa diantaranya adalah kesuburan tanah. Semakin tinggi bahan organik yang terdekomposisi maka tingkat dekomposisi selulosa juga semakin tinggi (Drewnik 2006).
Tabel 6 Analisis pengaruh pemberian pupuk terhadap total populasi mikroorganisme
Waktu Perlakuan Azotobacter MoPP MPS
P NP P NP P NP Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan
tidak berbeda nyata pada uji DMRT taraf 5%
21 Identifikasi Mikroorganisme Rizosfer Dominan
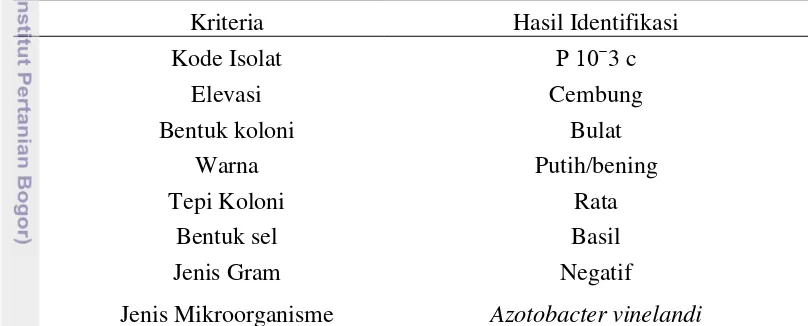
Selain penetapan total populasi mikroorganisme ditentukan juga jenis mikroorganisme dominan dari masing-masing kelompok fungsional mikroorganisme dalam penelitian ini. Mikroorganisme dominan adalah mikroorganisme yang paling sering muncul yang memiliki kesamaan ciri secara morfologi. Penentuan jenis mikroorganisme dominan ini dilakukan dengan metode identifikasi secara morfologi makroskopis dan mikroskopis sera penentuan jenis gram bakteri untuk mempermudah identifikasi. Jenis dan jumlah mikroorganisme tanah ini tergantung pada aktivitas masing-masing golongannya, yang terutama dipengaruhi oleh tiga faktor, yaitu 1) cuaca, terutama curah hujan dan kelembaban; 2) kondisi atau sifat tanah, terutama kemasaman, kelembaban, suhu dan ketersediaan hara; dan 3) tipe vegetasi penutup lahan, misalnya hutan, belukar dan padang rumput (Hanafiah et al., 2003). Jenis mikroorganisme dominan yang didapatkan antara lain ditunjukan pada tabel 7, 8 dan 9.
Tabel 7 Hasil identifikasi mikroorganisme penambat N (Azotobacter)
Kriteria Hasil Identifikasi
Kode Isolat P 10ˉ3 c
Elevasi Cembung
Bentuk koloni Bulat
Warna Putih/bening
Tepi Koloni Rata
Bentuk sel Basil
Jenis Gram Negatif
Jenis Mikroorganisme Azotobacter vinelandi
Tabel 8 Hasil identifikasi mikroorganisme pelarut P (MoPP)
Kriteria Hasil Identifikasi
Kode Isolat P 10ˉ4 a
Elevasi Cembung
Bentuk koloni Bulat
Warna Putih susu
Tepi Koloni Agak rata
Bentuk sel Kokus
Jenis Gram Negatif
22
Tabel 9 Hasil identifikasi mikroorganisme perombak selulosa (MPS)
Kriteria Hasil Identifikasi
Kode Isolat P 10ˉ4 a
Elevasi Cembung
Bentuk koloni Bulat
Warna Putih, agak krem
Tepi Koloni Agak keriput
Bentuk sel Basil
Jenis Gram Negatif
Jenis Mikroorganisme Bacillus
Dari hasil identifikasi morfologi dan fisiologi koloni dan sel pada Tabel 7, 8 dan 9 maka mikroorganisme penambat N, mikroorganisme pelarut P (MoPP), dan mikroorganisme perombak selulosa (MPS) apabila merujuk pada buku Bergey’s Manual of Determinative Bacteriology (1974) mendekati sifat-sifat yang dimiliki oleh Bacillus, Pseudomonas, dan Azotobacter vinelandi. Gambar koloni secara makroskopis dapat dilihat di Gambar 12.
23
SIMPULAN
Perlakuan pemangkasan pada tanaman kilemo menurunkan populasi mikroorganisme rizosfer, antara lain Azotobacter, MoPP dan mikroorganisme perombak selulose. Secara umum pemberian pupuk pada tanah tidak memberikan pengaruh yang nyata terhadap perubahan populasi mikroorganisme rizosfer. Dibandingkan ketiga jenis pupuk yang diberikan, pemberian pupuk organik dapat meningkatkan populasi mikroorganisme rizosfer baik pada tanaman yang dipangkas maupun yang tidak dipangkas. Pemberian pupuk NPK cenderung menurunkan populasi mikroorganisme rizosfer dibanding kontrol. Pemberian pupuk mikro melalui daun (pupuk daun) tidak memberikan pengaruh terhadap populasi mikroorganisme rizosfer tanaman kilemo. Mikroorganisme yang paling dominan ditentukan berdasarkan koloni yang sering muncul yaitu Bacillus, Pseudomonas, dan Azotobacter vinelandi.
DAFTAR PUSTAKA
Agusta A. 2000. Minyak Atsiri Tumbuhan Tropika. Penerbit ITB. Bandung.
Alexander M. 1997. Introduction to Soil Microbiology. Krieger Publishing Company. Malabar, Florida.
Alvarez Juan A, Villagra, Pablo E, Villalba, Ricardo, Debandi, Guillermo. 2013. Effects of the pruning intensity and tree size on multi-stemmed Prosopis. Forest Ecology and Management. 310 : 857-864.
Aquilanti L, Favilli F, Clementi, F. 2004. Comparison of different strategies for isolation and preliminary identification of Azotobacter from soil sample. Soil Biology & Biochemistry. 36 : 1475–1483.
Behera B C, Singdevsachan S K, Mishra R R, Dutta S K, Thatoi H N. 2013. Diversity, mechanism and biotechnology of phosphate solubilising microorganism in mangrove. Biocatalysis and Agricultural Biotechnology. Buchanan R E, Gibbons N E. 1974. Bergey’s Manual of Determinative
Bacteriology. The Williams and Wilkins Company.
24
Dermiyati, Antari J, Yusnaini S, Nugroho S G. 2009. Perubahan Populasi Mikroroganisme Pelarut Fosfat pada Lahan Sawah dengan Sistem Pertanian Intensif menjadi Sistem Pertanian Organik Berkelanjutan. Jurnal. Tanah Tropika. 14 (2) : 143-148.
Drewnik M. 2006. The effect of environmental conditions on the decomposition
rate of cellulose in mountain soils. Geoderma. 132 : 116– 130.
Effendi D S, Syakir M, Yusron M, Wiratno. 2010. Budidaya dan Pasca Panen Teh. Pusat Penelitian dan Pengembangan Perkebunan.
Glenn D M, Campostrini E. 2011. Girdling and summer pruning in apple increase soil respiration. Scientia Horticulturae. 129 : 889–893.
Glab T. 2013. Effect of tractor traffic and N fertilization on the root morphology of grass/red clover mixture. Soil & Tillage Research. 134 : 163–171. Guangcan T, Tian S J, Cai M Y, Xie G H. 2008. Phosphatesolubilizing and
-mineralizing abilities of bacteria isolated from soils. Pedosphere. 18 (4): 515–523.
Gunawan D, Mulyani I. 2004. Ilmu Obat Alam (Farmakognosi) Jilid I. Penerbit Penebar Swadaya. Jakarta.
Haei M, Rousk J, Ulrik I, Oquist M, Baat E, Laudon H. 2011. Effects of soil frost on growth, composition and respiration of the soil microbial decomposer community. Soil Biology & Biochemistry. 43 : 2069-2077.
Hanafiah, K A, dkk. 2003. Biologi Tanah Ekologi dan Makrobiologi Tanah. PT Raja Grafindo Persada. Jakarta.
Hardjowigeno S. 2007. Ilmu Tanah. Akademika Presindo. Jakarta.
Heryati Y, N Mindawati, A S Kosasih. 2009. Prospek pengembangan Lemo (Litsea cubeba L. Persoon) di Indonesia. Jurnal Tekno. Hutan Tanaman. Vol 2 (1): 9-17.
Heyne K. 1987. Tumbuhan Berguna Indonesia, Jilid II. Badan Litbang Kehutanan-Yayasan Sarana Wanajaya. Jakarta.
Kayang H, B Kharbuli, D Syeim. 2009. Litsea cubeba Pers.-An untapped economic plant species of Meghalaya. Natural Product Radiance, A Bimontly Journal on Natural Product. 8(1): 1-2.
25 Kosasih A S, Bogidarmanti R, Rustaman B. 2006. Silvikultur Hutan Tanaman
Campuran. Puslitbang Hutan Tanaman. Badan Litbang Kehutanan. Departemen Kehutanan.
Leiwakabessy F M, Sutandi A. 2004. Pupuk dan Pemupukan. Departemen Ilmu Tanah. Fakultas Pertanian. Institut Pertanian Bogor. Bogor. 208 hal.
Liu T, Yang T. 2012. Antimicrobial impact of the components of essential oil of Litsea cubeba from Taiwan and antimicrobial activity of the oil in food systems. International Journal of Food Microbiology. 156 : 68–75.
Marschner. 1995. Mineral Nutrition of Higher Plants. Second Edition. Academic Press. New York.
Marschner, Petra, Crowley, David., Rengel, Zed. 2011. Rhizosphere interactions between microorganisms and plants govern iron and phosphorus acquisition along the root axis e model and research methods. Soil Biology & Biochemistry. 43 : 883- 894.
Matias S R, Pagano M C, Muzzi F C, Oliveira C A, Carneiro A A, Horta S N, Scotti M R. 2009. Effect of rhizobia, mycorrhizal fungi and phosphate-solubilizing microorganisms in the rhizosphere of native plants used to recover an iron ore area in Brazil. European Journal of Soil Biology. 45 : 259–266.
Novita D. 2013. Pengaruh Pupuk terhadap Populasi Mikroorganisme Rizosfer pada Tanaman Kilemo (Litsea cubeba Pers). IPB.
Oliveira C A, Alves V M C, Marriel I E., Gomes E A, Scotti M R, Carneiro N P, Guimara C T, Schaffert R E, Sa N M H. 2009. Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome. Soil Biology and Biochemistry. 41 : 1782–1787.
Olesen, Trevor, Menzel, Christopher M, McConchie, Cameron A, Wiltshire, Neil. 2013. Pruning to control tree size, flowering and production of litchi. Scientia Horticulturae. 156 : 93–98
Prosea, 1999. Plant Resources Of South-East Asia 19. Essential-Oil Plants. Prosea Foundation. Bogor.
Rahmawati D. 2004. Mempelajari Aktifitas Antioksidan dan Antimikroorganisme Ekstrak Antarasa (Litsea cubeba L. Persoon) dan Aplikasinya sebagai Pengawet Alami pada Bahan Makanan. Skripsi. Fak. Teknologi Pertanian, IPB, Bogor.
26
Rosas, S B, Javier A, Andre, Rovera M, Correa N S. 2006. Phosphate-solubilizing Pseudomonas putida can influence the rhizobia–legume symbiosis. Soil Biology & Biochemistry. 38 : 3502–3505.
Sanaullah, Muhammad., Blagodatskaya, Evgenia., Chabbi, Abad, Rumpel, Cornelia., Kuzyakov, Yakov. 2011. Drought effects on microbial biomass and enzyme activities in the rhizosphere of grasses depend on plant community composition. Applied Soil Ecology. 48 : 38–44.
Sudaryanti T dan Sugiharti E. 1990. Budidaya dan Penyulingan Nilam. Penerbit Penebar Swadaya. Jakarta.
Suryantini. 2002. Pemanfaatan bahan organik dan VAM untuk pertumbuhan dan hasil tanaman kacang. Badan Penelitian dan Pengembangan Pertanian. Jakarta.
Widawati S, Sulasih. 2006. Populasi Bakteri Pelarut Fosfat (BPF) di Cikaniki, Gunung Botol, dan Ciptarasa, serta Kemampuannya Melarutkan P Terikat di Media Pikovskaya Padat. Jurnal Biodiversitas. Vol 7 (3) : 109-113. Widyati E. 2013. Dinamika Mikroorganisme di Rhizosfir dan Kontribusinya
terhadap Pertumbuhan Tanaman Hutan. Jurnal Tekno Hutan Tanaman. Vol 3 (2) (dalam proses penerbitan).
Yulipriyanto H. 2010. Biologi Tanah dan Strategi Pengelolaannya. Edisi Pertama – Yogyakarta. Graha Ilmu.
Zhao J, Wan S, Fu S, Wang X, Wang M, Liang C, Chen Y, Zhu X. 2013. Effects of understory removal and nitrogen fertilization on soil microbial communities in Eucalyptus plantations. Forest Ecology and Management. 310 : 80–86.
27
LAMPIRAN
Lampiran 1 Total Populasi Azotobacter Tanaman Pangkas 10 HSP
Kode Pengenceran Ulangan Rata-rata Jumlah
sel
Lampiran 2 Total Populasi Azotobacter Tanaman Non-Pangkas 10 HSP
Kode Pengenceran Ulangan Rata-rata Jumlah
sel
Lampiran 3 Total Populasi Azotobacter Tanaman Pangkas 30 HSP
Kode Pengenceran Ulangan Rata-rata Jumlah
28
Lampiran 4 Total Populasi Azotobacter Tanaman Non-Pangkas 30 HSP
Kode Pengenceran Ulangan Rata-rata Jumlah
sel
Lampiran 5 Total Populasi Azotobacter Tanaman Pangkas 60 HSP
Kode Pengenceran
Lampiran 6 Total Populasi Azotobacter Tanaman Non-Pangkas 60 HSP
Kode Pengenceran Ulangan Rata-rata Jumlah
29 Lampiran 7 Total Populasi Azotobacter Tanaman Pangkas 90 HSP
Kode Pengenceran Ulangan
Rata-rata
Lampiran 8 Total Populasi Azotobacter Tanaman Non-Pangkas 90 HSP
Kode Pengenceran
Lampiran 9 Total Populasi Azotobacter Tanaman Pangkas (Kontrol) 90 HSP
Kode Pengenceran Ulangan
30
Lampiran 10 Total Populasi Azotobacter Tanaman Non-Pangkas (Kontrol) 90 HSP
Kode Pengenceran Ulangan
Rata-rata
Lampiran 11 Total Populasi MOPP Tanaman Pangkas 10 HSP
Kode Pengenceran Ulangan
Rata-rata
Lampiran 12 Total Populasi MOPP Tanaman Non-Pangkas 10 HSP
Kode Pengenceran Ulangan
31 Lampiran 13 Total Populasi MOPP Tanaman Pangkas 30 HSP
Kode Pengenceran
Lampiran 14 Total Populasi MOPP Tanaman Non-Pangkas 30 HSP
Kode Pengenceran Ulangan
Rata-rata
Lampiran 15 Total Populasi MOPP Tanaman Pangkas 60 HSP
Kode Pengenceran Ulangan
32
Lampiran 16 Total Populasi MOPP Tanaman Non-Pangkas 60 HSP
Kode Pengenceran
Lampiran 17 Total Populasi MOPP Tanaman Pangkas 90 HSP
Kode Pengenceran Ulangan
Rata-rata
Lampiran 18 Total Populasi MOPP Tanaman Non-Pangkas 90 HSP
Kode Pengenceran Ulangan
33 Lampiran 19 Total Populasi MOPP Tanaman Pangkas (Kontrol) 90 HSP
Kode Pengenceran Ulangan
Rata-rata
Lampiran 20 Total Populasi MOPP Tanaman Non-Pangkas (Kontrol) 90 HSP
Kode Pengenceran Ulangan
Rata-rata
Lampiran 21 Total Populasi MPS Tanaman Pangkas 10 HSP
34
Lampiran 22 Total Populasi MPS Tanaman Non-Pangkas 10 HSP
Kode Pengenceran Ulangan Rata-rata Jumlah
sel
Lampiran 23 Total Populasi MPS Tanaman Pangkas 30 HSP
Kode Pengenceran Ulangan
Rata-rata
Lampiran 24 Total Populasi MPS Tanaman Non-Pangkas 30 HSP
35 Lampiran 25 Total Populasi MPS Tanaman Pangkas 60 HSP
Kode Pengenceran
Lampiran 26 Total Populasi MPS Tanaman Non-Pangkas 60 HSP
Kode Pengenceran
Lampiran 27 Total Populasi MPS Tanaman Pangkas 90 HSP
Kode Pengenceran Ulangan Rata-rata Jumlah
36
Lampiran 28 Analisis ragam populasi Azotobacter Tanaman pangkas dan non-pangkas
Waktu Perlakuan Source DF Anova SS Mean Square F Value Pr > F
10
Pangkas dan Non-pangkas
blok 3 22.10093750 7.36697917 0.73 0.6006 prlk 1 10.74161250 10.74161250 1.06 0.3792
30 blok 3 25.83183750 8.61061250 1.00 0.4994
prlk 1 10.74161250 0.00151250 0.00 0.9902
60 blok 1 961.0000000 961.0000000 348.74 0.0341
prlk 1 25.0000000 25.0000000 9.07 0.2041
90 blok 2 147.5532333 73.7766167 4606.24 0.0002
prlk 1 491.2340167 491.2340167 30670.2 <.0001
Lampiran 29 Analisis ragam populasi Azotobacter tanaman tangkas dan non-pangkas dan pemupkan
Waktu Perlakuan Source DF Anova SS
Mean
blok 1 2568.294450 2568.294450 28.13 0.0131 prlk 3 787.172250 262.390750 2.87 0.2045
Non-pangkas- Pemupukan
blok 1 450.1500125 450.1500125 11.76 0.0416
prlk 3 81.0072375 27.0024125 0.71 0.609
90
Pangkas -Pemupukan
blok 1 329.4744500 329.4744500 2.62 0.2037 prlk 3 44.4987000 14.8662333 0.12 0.9434
Non- pangkas-Pemupukan
blok 1 270.0488000 270.0488000 28.60 0.0128
prlk 3 609.8809000 203.2936333 21.53 0.0157
Lampiran 30 Analisis ragam populasi MoPP tanaman tangkas dan non-pangkas
Waktu Perlakuan Source DF Anova SS
Mean
blok 3 548.470000 182.823333 3.71 0.1549
prlk 1 106.580000 106.580000 2.16 0.2376
30 blok 3 983.647375 327.882458 8.17 0.0591
prlk 1 2208.151125 2208.151125 55.02 0.0051
60 blok 1 5524.850250 5524.850250 37.57 0.1030
prlk 1 380.072250 380.072250 2.58 0.3543
90 blok 2 1677.213333 838.606667 1.58 0.3879
37 Lampiran 31 Analisis ragam populasi MoPP tanaman tangkas dan non-pangkas
dan pemupukan
Waktu Perlakuan Source DF Anova SS
Mean
blok 1 1682.290013 1682.290013 22.22 0.0181
prlk 3 235.953337 78.651112 1.04 0.4878
Non- pangkas-Pemupukan
blok 1 1160.415313 1160.415313 52.90 0.0054
prlk 3 46.948637 15.649546 0.71 0.6060
90
Pangkas-Pemupukan
blok 1 2084.319613 2084.319613 11.75 0.0416
prlk 3 657.242738 219.080913 1.24 0.4331
Non- pangkas-Pemupukan
blok 1 1171.038013 1171.038013 4.49 0.1243
prlk 3 923.906638 307.968879 1.18 0.4472
Lampiran 32 Analisis ragam populasi MPS tanaman tangkas dan non-pangkas Waktu Perlakuan Source DF Anova SS Mean
Square
blok 3 6.20550000 2.06850000 0.51 0.7049
prlk 1 4.62080000 4.62080000 1.13 0.3656
30 blok 3 6.65895000 2.21965000 5.80 0.0914
prlk 1 4.62080000 4.62080000 11.99 0.0405
60 blok 1 1501.562500 1501.562500 28.57 0.1177
prlk 1 680.166400 680.166400 12.94 0.1726
90 blok 2 260.4516333 130.2258167 2.04 0.3294
prlk 1 326.7864000 326.7864000 5.11 0.1522
Lampiran 33 Analisis ragam populasi MPS tanaman tangkas dan non-pangkas dan pemupukan
Waktu Perlakuan Source DF Anova SS Mean Square F
Value Pr > F
60
Pangkas-Pemupukan
blok 1 1283.471113 1283.471113 116.95 0.0017 prlk 3 1934.386138 644.795379 58.75 0.0037
Non- pangkas-Pemupukan
blok 1 4769.226113 4769.226113 5.76 0.0959
prlk 3 8455.112238 2818.370746 3.40 0.1707
90
Pangkas-Pemupukan
blok 1 23745.65281 23745.65281 5.54 0.1000 prlk 3 25270.96964 8423.65655 1.97 0.2965
Non- pangkas-Pemupukan
blok 1 23660.73811 23660.73811 1.77 0.2760
38
Lampiran 34 Sifat kimia awal tanah pada rizosfer tanaman Kilemo (Dini 2013)
Parameter Satuan Nilai
pH 6.6
C-org
(%)
3.4
N-total 0.6
Kb 21.7
P tersedia
(ppm) 1.9
P Total 641.7
KTK
(me/100g)
49.7
Ca 5.0
Mg 4.6
K 0.6
39
RIWAYAT HIDUP
Penulis dilahirkan tanggal 29 Maret 1991 di Bogor dari pasangan Edi Edwar dan Siti Hafsah. Penulis adalah anak pertama dari tiga bersaudara.
Pendidikan dasar penulis ditempuh di SD Negeri 1 Malabar-Bogor, kemudian pindah saat kelas 3 ke SD Negeri 1 Dewi Sartika-Cianjur dan lulus tahun 2003. Kemudian pada tahun 2003 penulis melanjutkan pendidikan di SMP Negeri 1 Cianjur hingga tahun 2006. Pada tahun 2009 penulis menyelesaikan pendidikan SMA di SMA Negeri 1 Cianjur. Penulis diterima di Institut Pertanian Bogor sebagai mahasiswa pada tahun 2009 melalui jalur Ujian Talenta Mandiri (UTM) dengan Mayor Manajemen Sumberdaya Lahan, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian.