KISARAN INANG Squash mosaic comovirus ISOLAT OYONG
(Luffa acutangula L. Roxb)
EGI PUSPITA SARI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kisaran Inang Squash mosaic comovirus Isolat Oyong (Luffa acutangula L. Roxb) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Egi Puspita Sari
ABSTRAK
EGI PUSPITA SARI. Kisaran Inang Squash mosaic comovirus Isolat Oyong (Luffa acutangula L. Roxb). Dibimbing oleh TRI ASMIRA DAMAYANTI.
Squash mosaic virus (SqMV) (Comoviridae: Comovirus) merupakan salah satu virus yang menginfeksi tanaman Cucurbitaceae dan dilaporkan merugikan secara ekonomi. SqMV telah banyak dilaporkan di berbagai negara di dunia namun di Indonesia virus ini relatif baru ditemukan, sehingga penelitian maupun informasi mengenai virus ini masih sangat terbatas. Oleh karena itu, penelitian ini bertujuan untuk mengetahui salah satu sifat biologi virus yaitu kisaran inangnya. Pengamatan lapangan dilakukan di daerah Bogor untuk mengetahui tingkat kejadian penyakit dan koleksi sampel. Kisaran inang SqMV diuji melalui penularan secara mekanis terhadap 16 spesies dari 5 famili tanaman yang berbeda. Peubah yang diamati yaitu masa inkubasi, tipe gejala, dan kejadian penyakit. Hasil pengamatan menunjukkan bahwa gejala mosaik ditemukan pada semua lokasi budidaya tanaman oyong yang diamati (Leuwikopo, Cikabayan, dan Bantar Jaya) dengan persentase kejadian penyakit antara 51.11% sampai 63.33%. Uji kisaran inang menunjukkan bahwa SqMV isolat oyong dapat menginfeksi sistemik tiga famili tanaman yaitu Cucurbitaceae (timun, melon, paria, dan labu siam), Solanaceae (tembakau, ciplukan, dan kecubung), dan Amaranthaceae (bunga kenop) serta menimbulkan infeksi lokal pada famili Chenopodiaceae (Chenopodium amaranticolor dan C. quinoa). Tanaman yang tidak terinfeksi SqMV yaitu famili Cucurbitaceae (labu kuning), Solanaceae (cabai, tomat, dan tembakau cleveland), dan famili Leguminosae (kacang panjang dan buncis).
ABSTRACT
EGI PUSPITA SARI. Host Range of Squash mosaic comovirus Ridged Gourd Isolate (Luffa acutangula L. Roxb). Supervised by TRI ASMIRA DAMAYANTI.
Squash mosaic virus (SqMV) (Comoviridae: Comovirus) is one of plant virus that infect Cucurbitaceae which caused economically yield loss. SqMV had been reported in various countries in the world, however it is newly found in Indonesia. Thus, the research and information related with it’s biological character
such as it’s host range is few. Therefore, the aim of the study is to determine the host range of SqMV ridged gourd isolate. The disease incidence and samples collection are conducted by field observation in several ridged gourd cultivation areas in Bogor. Host range of SqMV is tested by mechanical inoculation of 16 plants species from 5 different families. The incubation period, the type of symptom, and the disease incidence were observed. Results showed that the mosaic symptoms found in all cultivation areas in Bogor (Leuwikopo, Cikabayan, dan Bantar Jaya) with the disease incidence ranges from 51.11% to 63.33%. SqMV isolate ridged gourd could infect sistemically of several plants such as Cucurbitaceae (Cucumis sativus, C. melo, Sechium edule, and Momordica charantia), Solanaceae (Nicotiana tabacum, Physalis floridana, and Datura stramonium), and Amaranthaceae (Gomphrena globosa). SqMV could infect locally on Chenopodiaceae (Chenopodium amaranticolor and C. quinoa), whereas some plants species unable to be infected by SqMV such as Cucurbitaceae (Cucurbita pepo), Solanaceae (Lycopersicon esculentum, Capsicum annuum, and
N. clevelandii) and Leguminosae (Vigna sinensis and Phaseolus vulgaris)
KISARAN INANG Squash mosaic comovirus ISOLAT OYONG
(Luffa acutangula L. Roxb)
EGI PUSPITA SARI
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
11
Judul Skripsi : Kisaran Inang Squash mosaic comovirus Isolat Oyong (Luffa acutangula L. Roxb)
Nama : Egi Puspita Sari NIM : A34100060
Disetujui oleh
Dr Ir Tri Asmira Damayanti MAgr Pembimbing
Diketahui oleh
Dr Ir Abjad Asih Nawangsih MSi Ketua Departemen
13
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis mampu menyelesaikan tugas akhir dengan judul “Kisaran Inang Squash mosaic comovirus Isolat Oyong (Luffa acutangula L. Roxb)” sebagai salah satu syarat mendapat gelar Sarjana Pertanian, di Departemen Proteksi Tanaman, Institut Pertanian Bogor.
Penulis mengucapkan terimakasih kepada semua pihak yang telah membantu selama proses penyelesaian tugas akhir, khususnya kepada keluarga, Ibunda Latifah, Ayahanda Djoko Suratno, kakak, serta adik yang selalu memberikan doa dan dukungan dalam penyelesaian tugas akhir. Ungkapan terima kasih juga penulis sampaikan kepada Dr Ir Tri Asmira Damayanti MAgr selaku dosen pembimbing tugas akhir yang telah banyak memberi masukan dan saran selama penelitian hingga penyusunan tugas akhir, serta Dr Ir Yayi Munara Kusuma MSi selaku dosen pembimbing akademik yang telah memberikan bimbingan dan saran selama periode akademik berlangsung. Terima kasih penulis sampaikan pula kepada Endang Sri Ratna PhD selaku dosen penguji tamu.
Rasa terimakasih juga penulis sampaikan kepada kepada Dayang Diani Putri, Gita Sri Lestari, dan Titah Nurjannah yang telah membantu penulis selama proses pengumpulan data. Terimakasih kepada Sari Nurulita SP MSi, Fitrianingrum Kurniawati SP MSi, seluruh anggota laboratorium Virologi Tumbuhan dan teman-teman Proteksi Tanaman angkatan 47.
Semoga tugas akhir ini dapat bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
Tempat dan Waktu Penelitian 3
Metode 3
Pengamatan Gejala dan Kejadian Penyakit Mosaik Pada
Tanaman Oyong 3
Sumber Inokulum dan Perbanyakan Virus 3 Persiapan Media Tanam dan Tanaman Uji 3
Komposisi Media Tanam 3
Persiapan Tanaman Uji 3
Penularan Virus Secara Mekanis 4
Parameter Pengamatan. 5
Deteksi Serologi dengan DIBA (Dot Immunobinding Assay) 5
DAFTAR TABEL
1 Spesies tanaman yang digunakan pada uji kisaran inang 4 2 Hasil pengamatan kejadian penyakit mosaik di daerah Bogor, Jawa Barat 6 3 Hasil deteksi virus terhadap isolat tanaman oyong dari tiga lokasi berbeda 7 4 Hasil penularan mekanis SqMV isolat oyong pada 16 spesies tanaman uji 8
DAFTAR GAMBAR
1 Gejala mosaik yang ditemukan pada tiga lokasi pertanaman oyong. a: Cikabayan (bercak klorosis), b: Leuwikopo (mosaik hijau gelap-terang), dan c: Bantar Jaya (mosaik hijau-kuning dan vein clearing). ... 6 2 Gejala fenotip tanaman oyong yang terinfeksi virus SqMV hasil penularan
secara mekanis. a: bercak klorosis, b: mosaik hijau-kuning dan vein clearing, c: moasik hijau gelap-terang dan lepuhan, d: tanaman sehat. ... 7 3 Gejala hasil penularan mekanis pada (a-c) timun, (d-f) melon, (g-i) pare
dan (j-l) labu siam. a,d,g,j: tanaman sehat; b: mosaik hijau gelap terang berat, c: mosaik hijau gelap-terang ringan, e: vein clearing, f: mosaik hijau gelap-terang ringan, h: bercak klorosis sistemik dan vein clearing, i: mosaik hijau gelap-terang berat, k: bercak klorosis sistemik, l: mosaik hijau-kuning. ... 10 4 Gejala hasil penularan mekanis pada (a-c) kecubung, (d-f) tembakau, (g-i)
ciplukan. a,d,g: tanaman sehat, b: daun menggulung dan kaku, c: mosaik hijau gelap-terang, e: daun lebih lanset dan kaku, f: vein banding dan klorosis sistemik, h: mosaik hijau-kuning, i: mosaik hijau-kuning dan mengering. ... 11 5 Gejala hasil penularan mekanis pada (b-c) C. amaranticolor, (e-f) C.
quinoa. a,d: tanaman sehat, b: klorosis lokal ringan kuning, c: lesio lokal nekrotik (LLN) berat dengan halo merah keunguan, e: klorosis lokal ringan, f: lesio lokal nekrotik (LLN) berat... 12 6 Gejala hasil penularan mekanis pada G. globosa. a: tanaman sehat, b: daun
menggulung dan bergelombang, c: mosaik hijau gelap-terang dan keriting. .. 12 7 Tanaman yang tidak menunjukkan gejala setelah diinokulasi SqMV(a,b)
1
PENDAHULUAN
Latar Belakang
Oyong (Luffa acutangula L. Roxb) merupakan salah satu tanaman
monoecious yang tergolong ke dalam famili Cucurbitaceae dengan genus Luffa
(Stephen 2012). Selain di Indonesia, oyong banyak dibudidayakan di berbagai negara di dunia seperti China, Korea, India, Jepang, dan Amerika. Selain dapat digunakan sebagai bahan makanan, oyong juga dapat dijadikan sebagai bahan baku obat tradisional (diabetes, enteritis, dan demam), bahan baku industri pembuatan alas bagian dalam sepatu, bahan baku kosmetik dan bahan pembuatan spons (Dashora et al. 2013).
Oyong berupa tanaman rambat yang biasanya dibudidayakan dengan cara dililitkan pada sandaran tegak. Tanaman ini menghasilkan buah yang berbentuk silindris memanjang dengan garis longitudinal berwarna hijau dengan permukaan yang kasar. Satu individu tanaman dapat menghasilkan 15 sampai 20 buah atau 8 sampai 12 ton per hektar dengan ukuran buah berkisar 27 cm sampai 30 cm (Oboh dan Aluyor 2009). Tanaman ini dapat tumbuh secara optimal di daerah yang bersuhu 18 °C sampai 24 °C dengan kelembaban 50% sampai 60%. Lahan budidaya harus memiliki sistem aerasi dan drainase yang baik, subur, dan gembur dengan pH antara 5.5-6.8 (Edi dan Bobihoe 2010).
Gangguan OPT (Organisme Pengganggu Tumbuhan) merupakan salah satu faktor yang dapat menurunkan hasil produksi. Berbagai penyakit tanaman yang pernah dilaporkan menyerang tanaman ini diantaranya busuk sclerotium (Sclerotinia sclerotiorum), embun tepung (Erysiphe cichoracearum), embun bulu (Pseudoperonospora cubensis), nematoda (Meloidogyne spp.), dan virus tanaman (Soladoye dan Adibisi 2004; Mondal et al. 2014).
Squash mosaic comovirus (SqMV; Comovirus) merupakan salah satu virus yang dapat menimbulkan gejala mosaik pada tanaman Cucurbitaceae. SqMV berhasil diidentifikasi dan dipublikasikan secara resmi pertama kali di California pada tahun 1934, dimana virus ini menjadi masalah pada pertanaman hortikultura di California (Nelson dan Knuhtsen 1973). SqMV pertama kali dilaporkan di Iran (Izadpanah 1987), kemudian di Australia, Selandia Baru (Envirologix 1998), Israel, Jepang, Cina (Han et al. 2002), dan terdeteksi secara serologi di Indonesia pada timun (Rezania 2005), melon (Purba 2011), dan benih Cucurbitaceae (Lestari 2011).
SqMV merupakan virus dengan RNA utas tunggal yang terdiri atas RNA-1 (5900 nt) dan RNA-2 (3600 nt), bentuk partikel isometrik dengan diameter 28 nm sampai 30 nm. Partikel virus tidak terbungkus (tanpa amplop) tanpa susunan capsomer yang mencolok. Partikel virus dapat ditemukan pada tiap bagian tanaman yang terinfeksi (Haudenshield dan Palukaitis 1998). Sifat fisik SqMV secara in vitro: titik panas inaktivasi (thermal inactivation point) antara 70 °C sampai 80 °C, ketahanan in vitro (longevity in vitro) selama 30 hari, dengan titik batas pengenceran (dilution end point) sebesar log10-4 sampai log 10-6 (Campbell 1985).
tanaman semangka. Gejala awal pada tanaman labu kuning berupa bercak berwarna kuning pada daun muda, kemudian berkembang menjadi mosaik hijau gelap dan terang. Pada tanaman timun bercak kuning pada daun pertama berkembang menjadi penebalan tulang daun (vein-banding). Pada daun yang tua gejala sulit diamati seperti tanpa gejala (no symptom), sehingga virus ini sulit diketahui jika hanya melihat gejalanya saja (Hull 2002). Gejala awal SqMV pada tanaman melon, timun, kabocha, labu kuning, dan semangka berupa mosaik sistemik ringan dan bercak kekuningan pada daun muda, gejala lanjut berupa mosaik disertai dengan malformasi bentuk daun dan buah serta penurunan produksi tanaman. Selain SqMV, beberapa virus lain yang dapat berasosiasi dan menimbulkan gejala mosaik yang serupa pada Cucurbitaceae diantaranya
Cucumber mosaic virus (CMV), Papaya ringspot virus (PRSV), Watermelon mosaic virus (WMV), Zucchini yelow mosaic virus (ZYMV), dan Tobacco ringspot virus (TRSV) (Coutts 2006; Babadoost 1999).
SqMV dapat ditularkan secara non persisten di lapangan dengan bantuan serangga vektor kumbang, yaitu Acalymma trivittata (Mam), Epilachna paunelata, Henosepilachna vigintiocto punctata, Diabrotica balteata Le Conk,
Acalymma thiemei thiemei Buly, Epilachna chrysomelina (Babadoost 1999; Coutts 2006). Vektor menjadi infektif setelah 5 menit makan akuisisi pada tanaman terinfeksi (Babadoost 1999).
Berdasarkan Keputusan Menteri Pertanian Nomor 93/Permentan/OT.140/12/2011 menyatakan bahwa SqMV masih tergolong ke dalam OPTK A1. Penelitian terkait respon ketahanan galur melon, timun, dan efisiensi tular benih SqMV pada Cucurbitaceae pernah dilakukan sebelumnya (Rezania 2005; Purba 2011; Lestari 2011), namun sampai saat ini informasi terkait sifat biologi SqMV khususnya isolat oyong belum ada, sehingga perlu dilakukan penelitian terkait hal tersebut.
Tujuan Penelitian
Penelitian ini bertujuan mendeteksi dan mengetahui kisaran inang SqMV isolat tanaman oyong untuk mendapatkan informasi dasar sifat biologi virus.
Manfaat Penelitian
3
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Rumah Kaca Kebun Percobaan Cikabayan dan Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB). Penelitian dilaksanakan dari bulan Januari sampai Mei 2014.
Metode
Pengamatan Gejala dan Kejadian Penyakit Mosaik Pada Tanaman Oyong Pengamatan dilakukan terhadap berbagai tipe gejala mosaik yang ditunjukkan tanaman pada pertanaman oyong di Desa Leuwikopo, Cikabayan, dan Bantar Jaya Kabupaten Bogor, Jawa Barat. Persentase kejadian penyakit mosaik dihitung menggunakan rumus:
KP = x 100% dengan,
KP = Kejadian Penyakit (%)
n = Jumlah tanaman yang menunjukkan gejala N = Total keseluruhan tanaman yang diamati
Sumber Inokulum dan Perbanyakan Virus
Sumber inokulum dikumpulkan dari pertanaman oyong di Desa Leuwikopo, Cikabayan, dan Bantar Jaya. Sumber inokulum diperbanyak pada tanaman oyong sehat kultivar Pagoda dengan tujuan untuk mengeliminasi virus lain yang hanya dapat ditularkan melalui serangga vektor. Hasil perbanyakan inokulum kemudian dideteksi secara serologi menggunakan antiserum CMV dan SqMV dengan metode DIBA (Dot Immunobinding Assay), serta dilakukan konfirmasi deteksi asam nukleat dengan RT-PCR menggunakan primer spesifik SqMV dan CMV serta primer universal Potyvirus. Inokulum yang terdeteksi positif terinfeksi tunggal oleh SqMV dan negatif terhadap virus lain kembali diperbanyak dengan cara diinokulasikan secara mekanis pada tanaman oyong sehat lain dan dijadikan sebagai sumber inokulum.
Persiapan Media Tanam dan Tanaman Uji
Komposisi Media Tanam. Media tanam yang digunakan terdiri atas campuran tanah dan pupuk kandang steril dengan perbandingan 2:1 dan ditempatkan pada polybag berukuran 20 cm x 25 cm.
charantia L.), dan melon (Cucumis melo L.), famili Chenopodiaceae (Chenopodium amaranticolor Coste et Reyn) dan (Chenopodium quinoa), serta tanaman dari famili Amaranthaceaeyaitu bunga kenop (Gomphrena globosa L.).
Benih tanaman tembakau, tembakau cleveland, tomat, cabai, kecubung, ciplukan, C. quinoa, C. amaranticolor, dan bunga kenop disemai terlebih dahulu, setelah berkecambah bibit kemudian dipindah (transplanting) kedalam polybag
yang berdiameter 20 cm. Buah labu siam ditanam langsung dalam polybag yang berisi media tanam sampai berkecambah. Benih kacang panjang, buncis, timun, pare, labu kuning, dan melon ditanam 2 sampai 3 benih tiap polybag. Setelah benih tumbuh, dipilih satu bibit tanaman yang tumbuh paling baik untuk dijadikan tanaman uji. Tanaman dipelihara pada rumah kaca yang dikondisikan kedap serangga sampai tanaman siap diinokulasi. Setiap spesies tanaman masing-masing terdiri atas sepuluh tanaman uji. Inokulasi mekanis dilakukan pada bagian tanaman dan umur yang berbeda sesuai dengan ketentuan yang dijelaskan oleh Walkey (1991) untuk tiap jenis tanaman uji (Tabel 1).
Tabel 1 Spesies tanaman yang digunakan pada uji kisaran inang
Spesies tanaman Umur saat inokulasi Bagian tanaman yang diinokulasi
N. clevelandii 5 minggu Daun muda
P. floridana 4 minggu Daun muda
Penularan virus dilakukan secara mekanis. Sap tanaman dengan perbandingan 1:10 (b/v) disiapkan dengan cara daun oyong bergejala mosaik digerus menggunakan mortar, kemudian ditambahkan bufer fosfat pH 7 yang
5
dilarutkan dalam 900 ml aquades. Permukaan jaringan daun tanaman oyong yang akan diinokulasi dilukai dengan karborundum 600 mesh terlebih dahulu untuk memudahkan virus masuk ke dalam sel (Nordam 1973). Sap dioleskan pada daun yang telah dilukai, kemudian dibilas dengan air untuk menghilangkan sisa karborundum.
Parameter Pengamatan. Setelah diinokulasi, tanaman uji dipelihara pada rumah kaca yang kedap serangga, kemudian dilakukan pengamatan terhadap masa inkubasi, tipe gejala, dan kejadian penyakit. Gejala penyakit diamati sampai satu bulan setelah inokulasi mekanis dilakukan. Tanaman yang tidak menunjukkan gejala, dideteksi secara serologi untuk konfirmasi kejadian penyakit dengan metode DIBA menggunakan antiserum SqMV (Agdia).
Deteksi Serologi dengan DIBA (Dot Immunobinding Assay)
Metode DIBA dilakukan berdasarkan metode yang dideskripsikan Mahmood et al. (1997) dengan modifikasi minor terhadap suhu inkubasi antibodi ke-1 seperti yang dilakukan oleh Kadwati (2013). DIBA digunakan untuk mendeteksi sumber inokulum, dan tanaman yang tidak menunjukkan gejala pada uji kisaran inang.
Blotting. Jaringan daun tanaman digerus dalam tris buffer saline (TBS:
Tris-HCl 0.02 M dan NaCl 0.15 M, pH 7.5) dengan perbandingan 1:10 (b/v). Cairan perasan tanaman selanjutnya diteteskan ke atas kertas membran nitroselulosa membran (ukuran 3 cm × 3 cm) sebanyak 2 μl.
Blocking. Tetesan sampel yang telah kering pada kertas membran direndam
di dalam 3 ml larutan blocking (3 ml TBS dicampur dengan 0.06 g skim milk dan 60 µl Triton X-100). Membran kemudian diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 2 jam dengan menggunakan shaker
(EYELA multishaker MMS). Membran kemudian dicuci 5 kali dengan akuades, tiap pencucian berlangsung 5 menit sambil digoyang dengan kecepatan 100 rpm.
Antibodi 1. Membran selanjutnya direndam dalam 5 ml larutan antibodi ke-1 (TBS yang mengandung 2% skim milk dan antiserum SqMV) dengan perbandingan 1:2 500 (v/v), kemudian membran diinkubasi semalam pada suhu 4 °C. Membran kemudian dicuci sebanyak 5 kali dengan TBST (TBS yang mengandung Tween 0.05%), tiap pencucian berlangsung selama 5 menit sambil digoyang dengan kecepatan 100 rpm.
Antibodi 2. Membran nitroselulosa selanjutnya direndam dalam 5 ml antibodi ke-2 (TBS yang mengandung 2% skim milk dan goat anti rabbit-IgG, Agdia) dengan perbandingan 1:3 000 (v/v), kemudian membran diinkubasi selama 60 menit sambil digoyang menggunakan shaker dengan kecepatan 50 rpm. Membran selanjutnya dicuci 5 kali dengan TBST. Tiap pencucian berlangsung 5 menit sambil digoyang dengan kecepatan 100 rpm.
HASIL DAN PEMBAHASAN
Hasil Pengamatan Kejadian Penyakit
Pengamatan kejadian penyakit dilakukan pada tiga lokasi berbeda di daerah Bogor, yaitu di daerah Leuwikopo, Cikabayan, dan Bantar Jaya. Gejala mosaik ditemukan pada setiap lahan budidaya yang diamati, dengan persentase kejadian penyakit antara 51.11% sampai 63.33% (Tabel 2).
Tabel 2 Hasil pengamatan kejadian penyakit mosaik di daerah Bogor, JawaBarat
Lokasi mengecil, terdapat bercak klorosis pada permukaan daun dan pertulangan daun mengalami klorosis (Gambar 1a). Gejala isolat di Leuwikopo berupa daun mengeras dan kaku, pertulangan daun mengalami klorosis (vein clearing), serta terlihat mosaik hijau terang-gelap (Gambar 1b), sedangkan gejala isolat Bantar Jaya gejala berupa mosaik hijau-kuning, daun menggulung dan mengerut, pertulangan daun mengalami klorosis, dan terdapat lepuhan (Gambar 1c).
Gambar 1 Gejala mosaik yang ditemukan pada tiga lokasi pertanaman oyong. a: Cikabayan (bercak klorosis), b: Leuwikopo (mosaik hijau gelap-terang), dan c: Bantar Jaya (mosaik hijau-kuning dan vein clearing).
7
Sumber Inokulum Virus
Hasil deteksi terhadap tiga sumber inokulum menunjukkan bahwa isolat asal Leuwikopo dan Bantar Jaya terdeteksi positif mengandung SqMV, namun hanya isolat Leuwikopo yang menunjukkan hasil negatif terhadap keberadaan virus lain. Sehingga isolat asal Leuwikopo dijadikan sebagai sumber inokulum untuk pengujian kisaran inang (Tabel 3).
deteksi dilakukan dengan metode DIBA dan RT-PCR, bdeteksi dengan metode RT-PCR
Inokulasi SqMV secara mekanis pada tanaman oyong sehat kultivar Pagoda menunjukkan semua tanaman oyong bergejala antara 7 sampai 14 hari setelah inokulasi jika tanaman dipelihara di lapangan. Masa inkubasi SqMV pada tanaman oyong yang dipelihara dirumah kaca berlangsung lebih singkat yaitu berkisar 5 sampai 10 hari setelah inokulasi.
Gejala yang muncul pada tanaman oyong yang terinfeksi SqMV diawali dengan ukuran daun tanaman yang lebih kecil dari ukuran normal, munculnya bercak klorosis pada daun muda (Gambar 2a), gejala lanjut berupa pemucatan tulang daun (vein clearing), malformasi, dan mosaik hijau-kuning pada daun (Gambar 2b). Gejala kemudian berkembang menjadi mosaik hijau gelap-terang, melepuh dan disertai malformasi daun (Gambar 2c).
Kisaran Inang
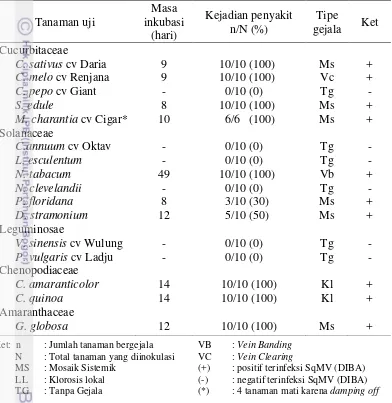
Hasil penularan SqMV isolat oyong menunjukkan sepuluh spesies tanaman uji dari empat famili tanaman berbeda yaitu Cucurbitaceae, Solanaceae, Chenopodiaceae, dan Amaranthaceae dapat diinfeksi dan dijadikan tanaman inang SqMV (Tabel 4).
Tabel 4 Hasil penularan mekanis SqMV isolat oyong pada 16 spesies tanaman uji
Tanaman uji
Hasil uji kisaran inang menunjukkan bahwa masa inkubasi SqMV rata-rata berlangsung selama 14 hari, paling singkat terjadi pada tanaman labu siam dan ciplukan, gejala muncul selama 8 hari setelah inokulasi dan yang terpanjang pada tanaman tembakau yaitu selama 49 hari setelah inokulasi. Untuk tanaman dari famili Cucurbitaceae rata-rata masa inkubasi selama 9 hari.
9
kemudian menjadi mosaik hijau gelap-terang (Gambar 3i). Gejala pada tanaman labu siam berupa klorosis pada daun yang diinokulasi (Gambar 3k) dilanjutkan dengan mosaik hijau gelap-terang disertai dengan daun yang mengerut dan lebih kaku dibandingkan dengan daun sehat (Gambar 3l). Gejala pada tanaman Cucurbitaceae jelas terlihat ketika tanaman masih dalam fase vegetatif awal, namun saat tanaman memasuki fase generatif gejala menjadi tidak jelas.
Tanaman Solanaceae yang dapat diinfeksi SqMV diantaranya tembakau, kecubung, dan ciplukan (Gambar 4). Gejala pada kecubung berupa daun menggulung dan lebih kaku dibandingkan dengan tanaman sehat (Gambar 4b), kemudian berkembang menjadi mosaik hijau gelap-terang (Gambar 4c). Pada tembakau, daun lebih lanset dan tebal dibandingkan pada daun sehat (Gambar 4e), tulang daun menjadi lebih tebal, daun mengerut, dan keriting (Gambar 4f). Pada ciplukan gejala berupa mosaik hijau-kuning (Gambar 4h), daun menggulung, memuntir, dan mengering (Gambar 4i).
Semua tanaman Chenopodiaceae (C. amaranticolor dan C. quinoa) dapat diinfeksi SqMV secara lokal (Gambar 5). Gejala pada C. amaranticolor berupa klorosis lokal pada daun yang diinokulasi (Gambar 5b), berkembang menjadi lesio lokal nekrotik (LLN) dengan tepi lesio merah keunguan (Gambar 5c). Pada
C. quinoa gejala awal berupa klorosis lokal pada daun yang diinokulasi (Gambar 5e), kemudian berkembang menjadi LLN (Gambar 5f).
Bunga kenop (Amaranthaceae) dapat diinfeksi SqMV (Gambar 6). Gejala berupa tepian daun melekuk dan bergelombang (Gambar 6b), kemudian berkembang menjadi mosaik hijau gelap-terang (Gambar 6c).
Gambar 3 Gejala hasil penularan mekanis pada (a-c) timun, (d-f) melon, (g-i) pare dan (j-l) labu siam. a,d,g,j: tanaman sehat; b: mosaik hijau gelap terang berat, c: mosaik hijau gelap-terang ringan, e: vein clearing, f: mosaik hijau gelap-terang ringan, h: bercak klorosis sistemik dan
vein clearing, i: mosaik hijau gelap-terang berat, k: bercak klorosis sistemik, l: mosaik hijau-kuning.
a c
d e
g h
f b
i
11
Gambar 4 Gejala hasil penularan mekanis pada (a-c) kecubung, (d-f) tembakau, (g-i) ciplukan. a,d,g: tanaman sehat, b: daun menggulung dan kaku, c: mosaik hijau gelap-terang, e: daun lebih lanset dan kaku, f: vein banding dan klorosis sistemik, h: mosaik hijau-kuning, i: mosaik hijau-kuning dan mengering.
a c
d e
g h
f b
Gambar 5 Gejala hasil penularan mekanis pada (b-c) C. amaranticolor, (e-f) C. quinoa. a,d: tanaman sehat, b: klorosis lokal ringan kuning, c: lesio lokal nekrotik (LLN) berat dengan halo merah keunguan, e: klorosis lokal ringan, f: lesio lokal nekrotik (LLN) berat.
Gambar 6 Gejala hasil penularan mekanis pada G. globosa. a: tanaman sehat, b: daun menggulung dan bergelombang, c: mosaik hijau gelap-terang dan keriting.
a
f
d e
b c
13
Gambar 7 Tanaman yang tidak menunjukkan gejala setelah diinokulasi SqMV (a,b) labu kuning, (c,d) kacang panjang, (e,f) buncis, (g,h) tomat, (i,j) cabai, (k,l) tembakau cleveland. (a,c,e,g,i,k) kontrol, (b,d,f,h,j,l) daun tanaman yang diinokulasi.
c d
e f
g
b a
h
i j
Pembahasan
Hasil penularan mekanis mengonfirmasi bahwa SqMV selain terbawa benih dan ditularkan melalui serangga vektor di alam, juga dapat ditularkan secara mekanis pada bagian kotiledon maupun daun pertama yang muncul pada fase vegetatif tanaman inang. Inokulasi virus secara mekanis tidak mampu menularkan virus tanaman yang hanya dapat tersebar melalui pembuluh angkut, karena inokulasi mekanis hanya mampu mengintroduksi virus ke sel epidermis tanaman (Walkey 1991). Keberhasilan penularan virus secara mekanis dipengaruhi oleh beberapa faktor diantaranya konsentrasi virus yang terkandung di dalam sap, sumber inokulum yang digunakan, media dan cara penyimpanan sumber inokulum, ketahanan virus didalam sap maupun faktor lingkungan, seperti cahaya maupun suhu (Hull 2002).
Tanaman melon, timun, pare, labu siam, ciplukan, tembakau, kecubung, dan bunga kenop dapat terinfeksi sistemik, sedangkan pada tanaman C. amaranticolor
dan C. quinoa muncul infeksi lokal berupa klorosis. Gejala sistemik muncul dan terlihat pada daun dibagian pucuk, bukan pada daun yang diinokulasi. Virus ditransfer bersamaan dengan nutrisi yang diangkut tanaman melalui jaringan pembuluh angkut pada tanaman (floem) menuju ke bagian akar. Virus yang berada pada akar tanaman kembali diangkut (xilem) dan menginfeksi daun baru pada tanaman. Siklus berlangsung berulang kali hingga keseluruhan bagian tanaman terinfeksi dan menimbulkan gejala sistemik (long distance movement), sedangkan gejala lokal muncul terbatas pada bagian tanaman yang terinfeksi virus (situs infeksi). Gejala lokal yang banyak dijumpai biasanya berupa nekrosis sebagai akibat dari terganggunya proses pembentukan klorofil, maupun karena kematian sel tanaman. Reaksi ini sering disebut sebagai reaksi hipersensitif tanaman sebagai bentuk ketahanan tanaman terhadap infeksi virus (Agrios 2005).
Tingkat ketahanan kultivar tanaman terhadap virus tumbuhan ditentukan oleh genotipe tanaman. Beberapa tanaman inang memiliki mekanisme pertahanan tersendiri untuk mencegah infeksi virus yang terdiri atas mekanisme aktif seperti kemampuan mendeteksi partikel asing dan mendegradasi sel yang telah terinfeksi virus agar tidak semakin meluas, serta mekanisme pasif seperti menghentikan pembentukan beberapa faktor yang dapat mendukung perkembangan maupun penyebaran virus dalam sel tanaman inang. Reaksi pertahanan tanaman terhadap virus terlihat dengan munculnya gejala pada tanaman (Gergerich dan Dolja 2006).
15
Menurut Nameth et al. (1986) secara alami hampir semua tanaman dari famili Cucurbitaceae dapat menjadi inang SqMV. Selain Cucurbitaceae,
experimentally SqMV dapat menginfeksi Amaranthaceae, Chenopodiaceae, Hydrophyllaceae, Leguminosae, dan Umbelliferae (Freitag 1956).
Hasil uji kisaran inang menunjukkan tanaman melon, timun, pare, labu siam, tembakau, kecubung, dan ciplukan dapat menjadi inang SqMV, namun dalam penelitian ini tanaman labu kuning kultivar Giant (berdaging dan berkulit oranye) tidak dapat diinfeksi SqMV. Lestari (2011), melaporkan tanaman labu kuning kultivar Golden Mama menunjukkan gejala mosaik berat jika terinfeksi SqMV isolat labu kuning, sedangkan oyong kultivar Jaka menunjukkan gejala mosaik ringan bahkan tidak bergejala. Perbedaan hasil ini mungkin disebabkan karena perbedaan isolat SqMV, ketahanan tanaman, dan kultivar yang digunakan. Tanaman tomat, cabai, tembakau cleveland, kacang panjang, dan buncis pada penelitian ini tidak dapat diinfeksi SqMV. Hal ini sesuai dengan laporan VIDE (1996).
Menurut Hull (2002), kisaran inang dapat digunakan untuk mempelajari strain suatu virus. Perbedaan strain virus mempengaruhi jenis tanaman yang dapat diinfeksi dan dijadikan sebagai inang. Menurut Nelson dan Knuthsen (1973), terdapat dua kelompok besar SqMV dengan enam biotipe yang berbeda yang diklasifikasikan berdasarkan karakteristik gejala dan kisaran inangnya. Berdasarkan reaksi serologi SqMV terdiri dari dua grup, yaitu I dan II. Beberapa anggota grup I menginfeksi semangka (Citrullus vulgaris; watermelon), menyebabkan gejala berat pada melon (cantaloupe) dan gejala ringan pada labu kuning (Cucurbita pepo; pumpkin) dengan gejala awal berupa ringspot pada daun. SqMV grup II tidak menginfeksi semangka, menyebabkan gejala ringan pada melon (cantaloupe) dan gejala berat pada labu kuning (pumpkin) yang diawali dengan gejala distorsi berat pada daun. Tanaman kisaran inang yang dapat diinfeksi SqMV isolat oyong tidak menunjukkan gejala awal berupa mosaik cincin (ring-mosaic), melainkan klorosis dan distorsi daun. SqMV di Maroko isolat Chenopodium album dapat menginfeksi sistemik C. quinoa, C. pepo dan
Pisum sativum tergolong dalam serotipe I (Lockhart 1982). SqMV isolat oyong menunjukkan gejala yang berbeda berupa LLN pada C. quinoa dan C.
amaranticolor, vein clearing dan distorsi daun pada melon dan tidak dapat menginfeksi C. pepo var Giant. Perbedaan ini menyebabkan SqMV isolat oyong belum diketahui serotipenya, sehingga perlu dilakukan penelitian lebih lanjut.
Kisaran inang yang diperoleh juga dapat mempengaruhi cara budidaya tanaman. Setelah mengetahui kisaran inang suatu virus tanaman maka diketahui tempat bertahan virus di lapangan selain pada inang utamanya. SqMV dapat menginfeksi sistemik tanaman timun, melon, pare, labu siam, tembakau, kecubung, ciplukan, dan bunga kenop. Oleh karena itu dianjurkan untuk tidak menanam jenis tanaman tersebut dalam suatu areal lahan budidaya pada waktu yang bersamaan.
SIMPULAN
SqMV isolat oyong dapat ditularkan secara mekanis dan menginfeksi sistemik pada timun, pare, melon, labu siam, tembakau, kecubung, ciplukan, dan bunga kenop, serta hanya menginfeksi lokal pada C. amaranticolor dan C. quinoa. Tanaman labu kuning, tomat, cabai, tembakau cleveland, kacang panjang, dan buncis tidak dapat diinfeksi SqMV
SARAN
17
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Ed ke-5. New York (US): Academic Press. Babadoost M. 1999. Mosaic diseases of cucurbits [internet]. Urbana Champaign
(US): University of Illionis. [diunduh 2013 Januari 10]. Tersedia pada http://web.aces.uiuc.edu/vista/pdf_ pubs/926.pdf.
Campbell RN. 1985. Squash mosaic comovirus. [internet]. [diunduh 2013 November 21]. Tersedia pada http://image.fs.uidaho.edu/vide/descr753.htm Coutts B. 2006. Virus disease of cucurbit crops. Farmnote 166: 1-3.
Dashora N, Chauhan LS, Kumar N. 2013. Luffa acutangula L. Roxb. var. Amara (Roxb.) A consensus review. International Journal of Pharma and Bio Sciences 4(2):835 – 846.
Edi S, Bobihoe J. 2010. Budidaya Tanaman Sayuran. Jambi (ID): Balai Pengkajian Teknologi Pertanian Jambi.
Envirologix. 1998. Squash mosaic virus background [internet]. [diunduh 2013 November 15]. Tersedia pada http://www.envirologix.com/artman/publish /article_291.shtml.
Freitag. 1956. Beetle transmision, host range, and properties of Squash mosaic virus. Phytopathology 46(2):73-81
Gergerich RC, Dolja VV. 2006. Introduction to plant virus, the invisible foe [internet]. The Plant Health Instructor. DOI: 10.1094/PHI-I-2006-0414-01. Han SS, Yoshida K, Karasev AV, Iwanami T. 2002. Nucleotide sequence of a
Japanese isolate of Squash mosaic virus. Archives of Virology 147: 437-443.
Haudenshield JS, Palukaitis P. 1998. Diversity among isolates of squash mosaic virus. Journal of General Virology 79(1):2331-2341.
Hull R. 2002. Matthews’ Plant Virology. Ed ke-4. San Diego (US): Elsevier Academic Press.
Izadpanah K. 1987. Squash mosaic virus as the cause of melon vein banding mosaic in Iran. Phytopathology 120(3): 276-282.
Kadwati. 2013. Deteksi virus-virus utama bawang merah (Allium cepa L.) dan bawang putih (A. sativum L.) dari daerah Jawa Barat dan Jawa Tengah [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Lestari, SM. 2011. Keberadaan beberapa virus dan efisiensi tular benih Squash mosaic comovirus pada Cucurbitaceae [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Lockhart BEL. 1982. Squash mosaic virus in Morocco. Plant Disease 66:1191-1193.
Mahmood T, Hein GL, French RC. 1997. Development of serological procedures for rapid and reliable detection of Wheat streak mosaic virus in a single wheat curl mite. Plant Disease 81:250-253.
Mondal B, Khatua DC, Hansda S, Ray SK. 2014. Sclerotinia rot of ridge gourd and pointed gourd in Lateritic Zone of West Bengal, India. Scholars Academic Journal Biosciences 2(4):251-254.
Nameth ST, Dudds JA, Paulus AO, Laemmlen FF. 1986. Cucurbit viruses of California. Plant Disease 70(1): 8-12.
Nordam D. 1973. Identification of Plant Viruses: Methods and Experiments. Wegeningen (NL): Centre for Agricultural Publishing and Documentations. Oboh IO, Aluyor EO. 2009. Luffa cylindrica – an emerging cash crop. African
Journal of Agricultural Research 4(8):684-688.
Purba ERD. 2011. Pengaruh infeksi Squash mosaic comovirus terhadap perkembangan penyakit mosaik pada lima varietas mentimun (Cucumis sativus L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rezania F. 2005. Tingkat ketahanan sembilan galur Cucumis melo L. terhadap
Squash mosaic comovirus [skripsi]. Bogor (ID): Institut Pertanian Bogor. [RI] Menteri Pertanian. 2011. Peraturan Menteri Pertanian Nomor
93/Permentan/OT.140/12/2011 tentang Jenis Organisme Penggangu Tumbuhan Karantina. Jakarta (ID): RI.
Soladoye MO, Adebisi AA. 2004. Luffa acutangula L. Roxb. Plant Resources of Tropical Africa [Internet]. [diunduh 2013 Nov 11]. Tersedia pada: http://www.prota4u.org/search.asp.
Stephen JM. 2012. Gourd, Luffa - Luffa cylindrica L. Roem., Luffa aegyptica
Mill., and Luffa acutangula L. Roxb. Gainesville (US): IFAS University of Florida.
VIDE. 1996. Squash mosaic comovirus [internet]. [diunduh 2013 Nov 15]. Tersedia pada http://pvo.bio-mirror.cn/descr753.htm.
19
RIWAYAT HIDUP
Penulis merupakan anak kedua dari tiga bersaudara dari pasangan Bapak Djoko Suratno dan Ibu Latifa yang dilahirkan pada tanggal 17 Juni 1992 di Kotabumi, Lampung Utara.
Penulis menyelesaikan pendidikan sekolah dasar di SDN 1 Sawah Lama (2004), sekolah menengah pertama di SMP Negeri 2 Bandar lampung (2007), dan sekolah menengah atas di SMA Negeri 9 Bandar Lampung (2010), serta diterima di Institut Pertanian Bogor pada Departemen Proteksi Tanaman pada tanggal 28 Juni 2010 melalui jalur USMI (Undangan Seleksi Masuk IPB).