KLASIFIKASI DAUN SEHAT DAN TERINFEKSI PENYAKIT
HUANGLONGBING PADA JERUK MENGGUNAKAN
SPEKTROSKOPI Vis-NIR
R ARIEF FIRMANSYAH
F151130091
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul klasifikasi daun sehat dan terinfeksi penyakit huanglongbing pada jeruk menggunakan spektroskopi vis-nir adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
R Arief Firmansyah
RINGKASAN
R. ARIEF FIRMANSYAH. Klasifikasi Daun Sehat dan Terinfeksi Penyakit Huanglongbing pada Jeruk Menggunakan Spektroskopi Vis-NIR. Dibimbing oleh KUDANG BORO SEMINAR dan WIDODO.
Huanglongbing adalah penyakit jeruk yang merupakan ancaman utama bagi budidaya jeruk. Tidak ada pengendalian yang tepat untuk Huanglongbing. Oleh karena itu, deteksi dini penting untuk mencegah penyebaran dan pengembangan penyakit ini. Deteksi dini yang paling efektif menggunakan tes DNA dengan metode PCR. Namun, identifikasi menggunakan tes DNA memerlukan persiapan sampel, memakan waktu dan mahal.Tujuan dari penelitian ini adalah membangun perangkat lunak deteksi daun sehat dan terinfeksi HLB berbasis absorban panjang gelombang Vis-NIR.
Sampel daun dikumpulkan dari kebun jeruk di Desa Situ Gede, Bogor.Tahap awal, kegiatan survey lapang dilakukan untuk menentukan pohon yang memiliki gejala huanglongbing atau mirip dan pohon yang tidak bergejala huanglongbing atau penyakit lain. Selanjutnya, pohon yang terindikasi gejala huanglongbing diambil daunnya untuk diuji kandungan pati. Sampel daun dibagi menjadi tiga kelompok, yaitu daun yang terinfeksi HLB, daun sehat dan daun belum bergejala.
Semua sampel tersebut telah diuji dengan PCR untuk verifikasi gejala visual Huanglongbing. Spektrometer VIS-NIR dengan rentang spektrum dari 339-1022nm digunakan untuk mengumpulkan data spektrum daun sakit HLB dan sehat. MSC, SVN, baseline correction, turunan pertama dan kedua dari spektra digunakan sebagai metode praperlakuan spektrum. Jaringan syaraf tiruan digunakan untuk membangun model klasifikasi. Plot X-loading, hasil analisis komponen utama digunakan untuk mendapatkan panjang gelombang sensitif. Absorban daun sehat dan sakit pada panjang gelombang sensitif dari setiap metode praperlakuan diklasikasi untuk mendapatkan panjang gelombang sensitif terbaik. Akurasi klasifikasi dan kinerja cross entropy adalah parameter untuk menentukan panjang gelombang sensitif terbaik.
Klasifikasi menggunakan panjang gelombang sensitif berbasis baseline correction memiliki kinerja terbaik. Panjang gelombang sensitif tersebut, yaitu 500.52, 538.61, 658.16, 680.8, 725.84 dan 997.25nm. Nilai bobot dan bias JST dari hasil klasifikasi spektrum daun sehat dan sakit HLB menggunakan absorban panjang gelombang sensitif tersebut menjadi model klasifikasi untuk membedakan spektrum daun sehat dan sakit HLB. Selanjutnya, model klasifikasi tersebut ditanam pada perangkat lunak berbasis komputer desktop yang dikembangkan dengan bahasa pemrograman visual basic. Data spektrum daun belum bergejala dari pohon positif terinfeksi HLB digunakan untuk menguji model klasifikasi. Model mengklasifikasikan data tersebut ke kelompok terinfeksi HLB, yang konsinten dengan hasil pengujian PCR yang juga mengelompokkan pada daun terinfeksi HLB. Hasil penelitian ini menunjukkan bahwa perangkat lunak tersebut dapat digunakan untuk deteksi HLB pada tahap awal perkembangan penyakit.
SUMMARY
R. ARIEF FIRMANSYAH. Classification of Healthy and Huanglongbing-infected Leaves Citrus Using VIS-NIR Spectroscopy. Supervised by KUDANG BORO SEMINAR and WIDODO
Huanglongbing is citrus disease which is a major threat for citrus orchard. Neither disease has a cure nor an efficient means of control. Therefore, early detection is important to prevent development and spread of the disease. The most effective detection used DNA test by PCR. However, identification used DNA test required sample preparation, time-consuming and expensive. The objective of this study was to build detection of healthy and HLB-infected leaves software based on Vis-NIR absorbance.
The leaf samples collected from citrus orchard in Situgede village, Bogor. Firstly, scouting was carried out to find which trees had HLB or similar symptoms and trees without HLB symptoms or other diseases. Secondly, tree was indicated HLB symptoms, its leaves was picked for starch accumulation test. Sample leaves divided into three group, i.e Huanglongbing-infected leaves, healthy leaves and asymptomatic leaves. All samples was tested by PCR for verification visual symptoms of huanglongbing. VIS-NIR spectrometer with a spectra range of 339 to 1022nm was used to acquisition HLB-infected and healthy leaves spectral data. MSC, SNV, baseline correction, first and second derivative were used for pretreatment method. Artificial neural network was used to build classification model. X-loading plot from principal component analysis was used to obtain sensitive wavelength. Healthy and HLB-infected absorbance on sensitive wavelength from each pretreatment methods were classified to obtain the best sensitive wavelengths. Classification accuracy and cross entropy value were parameter to determine the best sensitive wavelength.
Classification model used sensitive wavelength baseline correction-based had the best performance. The Sensitive wavelength, ie 500.52, 538.61, 658.16, 680.8, 725.84 and 997.25nm. Weights and biases value of neural network from healthy and HLB-infected classification result using absorbance of sensitive wavelength became classification model to distinguish healthy and HLB-infected spectrum. Furthemore, the classification model was embedded in software PC-desktop based which was used visual basic programming language. Asymptomatic leaves spectral from HLB-positive tree were used to testing classification model. Model classified data into HLB-infected group, which was consistent with PCR test. The result from this study indicated that developed software could be used to HLB detection in early stage of disease.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknik Mesin Pertanian dan Pangan
KLASIFIKASI GEJALA DAUN SEHAT DAN TERINFEKSI
HUANGLONGBING PADA JERUK MENGGUNAKAN
SPEKTROSKOPI Vis-NIR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Syukur Alhamdulillah kepada Allah azza wa jalla atas nikmat berupa kesempatan untuk dapat mengikuti pendidikan pascasarjana di IPB hingga tuntas. Terima kasih kepada Prof. Kudang Boro Seminar, ketua komisi pembimbing atas kobaran semangatnya agar tetap bertahan di topik penelitian ini hingga tuntas. Terima kasih kepada Dr.Widodo atas ide penelitian ini dan wawasan kebangsaan di setiap konsultasi tesis. Pak Yunus dan keluarga, terimakasih atas kerelaannya untuk pohon jeruknya dipetik berulang-ulang. Kawan-kawan TMP 2013, what a great experience I have with you, guys, especially mas ubay, I hope, we can be a partner for Ig Nobel Prizes, LOL. Penghuni Pondok D’qaka yang lama dan baru,
terimakasih atas kepercayaannya untuk menjadi tetua kalian. Terimaksih untuk ibu dan saudara saya (Aria dan Anita), serta erdytaa. Terakhir, terimaksih kepada pemerintah RI melalui kemenristek dikti atas bantuan beasiswa unggulan calon dosen tahun 2013.
Bogor, Juni 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 4
2 TINJAUAN PUSTAKA 4
Gejala penyakit Huanglongbing 4
Spektroskopi Vis-NIR 5
Metode Analisis Kualitatif Multivariat 7
3 METODE 8
Waktu dan Lokasi Penelitian 9
Bahan 9
Prosedur uji kandungan pati 10
Prosedur uji menggunakan PCR 11
Prosedur pengukuran spektrum VIS-NIR 11
Analisis data spektrum dan pembangunan model klasifikasi 12
Pengembangan aplikasi klasifikasi daun jeruk 13
4 HASIL DAN PEMBAHASAN 13
Karakteristik spektrum daun jeruk 13
Analisis spektrum dengan analisis komponen utama (PCA) 15 Pengklasifikasian menggunakan panjang gelombang sensitif 17
Aplikasi untuk deteksi penyakit HLB 19
5 PENUTUP 20
KESIMPULAN 20
SARAN 20
DAFTAR TABEL
1. Hasil analisis KU dan klasifikasi menggunakan JST 16 2. Panjang gelombang sensitif tiga jenis praperlakuan spektrum 17
3. Hasil klasifikasi menggunakan JST 18
4. Hasil pengujian menggunakan sampel tidak bergejala 19
DAFTAR GAMBAR
1. Ilustrasi terminologi untuk jenis sampel yang digunakan 3 2. Perbandingan daun yang terinfeksi HLB dan kurang nutrisi
(Pourreza et al. 2013) 4
3. Gejala kurang nutrisi (kiri) dan gejala HLB (kanan) pada daun
(crec.ifas.ufl.edu) 5
4. Skema pembagian metode analisis multivariat kuantitatif dan kualitatif (Blanco dan Villarroya 2002) 7
5. Tahapan penelitian 9
6. Sampel daun jeruk sehat (A), sakit (B) dan belum bergejala (C) 10 7. Potongan daun untuk uji kandungan pati, bagian panah
menunjukkan bagian yang perlu diamati (Etxeberria et al,
2007) 10
8. Uji kandungan pati daun jeruk terindikasi penyakit HLB (kiri)
dan daun jeruk sehat (kanan) 11
9. Pengambilan spektrum daun dengan spectrometer Vis-NIR 12 10.Hasil pengujian sampel daun dengan metode PCR 14
11.Spektrum daun jeruk sehat dan sakit 15
12.Plot skor komponen utama spektrum daun 16 13.Plot X-loading untuk tiga jenis praperlakuan spektrum 17 14.User interface aplikasi klasifikasi daun jeruk terinfeksi HLB 19 15.Tampilan hasil klasifikasi aplikasi klasifikasi daun jeruk
terinfeksi HLB 20
DAFTAR LAMPIRAN
1. Spektrum penuh daun jeruk sehat dan sakit 25 2. Plot antara Explained variance dan komponen utama (KU) untuk
5 jenis praperlakuan spektra dan tanpa praperlakuan spektra 26 3. Nilai bobot dan bias JST yang digunakan untuk pengembangan
aplikasi 27
4. Script aplikasi klasifikasi daun jeruk sakit dan sehat, dengan
1
PENDAHULUAN
Latar Belakang
Huanglongbing (HLB) atau citrus greening termasuk jenis penyakit berbahaya bagi budidaya jeruk sebab kerugian akibat penyakit tersebut menyebabkan kehilangan hasil sebesar 30-100% (Iftikhar et al. 2016). Di Indonesia, penyakit tersebut telah memusnahkan 2000 ha kebun jeruk dalam jangka waktu 6 bulan dengan nilai kerugian Rp 120 miliar/tahun (Nurhadi 2015) dan menghancurkan daerah sentra produksi jeruk, yaitu Garut, Tawangmangu, Punten dan Tejakula (Ekowarso dalam Asaad 2006). Di Asia, penyakit ini disebabkan oleh bakteri Candidatus liberactus asiaticum (Bove et al. 2006) yang penyebarannya dibantu oleh serangga Diaphorina citri (Taufik et al. 2010). Ciri gejala penyakit ini adalah pucuk daun menguning, warna daun sebagian kuning, hijau, dengan beberapa corak kuning, hijau pucat dan hijau gelap, yang warna tersebut saling bercampur tanpa ada batasan antar corak (blotchy mottle), buah yang dihasilkan berukuran kecil, bentuk asimetris dan miring sebelah (Bove et al. 2006). Selain itu terdapat akumulasi pati pada jaringan parenkima daun yang terserang HLB (Schneider 1968). Ciri gejala lain yang ditimbulkan oleh penyakit ini adalah terdapat gejala mirip dengan gejala kekurangan nutrisi pada daun, misalnya gejala kekurangan unzur Zn. Oleh karena itu, salah satu tantangan dalam deteksi penyakit HLB adalah membedakan gejala yang disebabkan oleh HLB dan kekurangan nutrisi (Sankaran and Ehsani 2011).
Pengendalian efektif terhadap penyakit ini belum ada hingga saat ini, tetapi deteksi awal dan pemusnahan pohon berpenyakit menjadi solusi untuk meminimalkan penyebaran penyakit dalam satu kebun (Sankaran and Ehsani 2011; Pourreza et al. 2014). Metode paling efektif untuk mendeteksi penyakit ini adalah menggunakan polymer chain reaction (PCR) (Iftikhar et al. 2016) tetapi metode tersebut memerlukan waktu dan mahal (Mishra et al. 2012; Pourreza et al. 2014). Selain itu, ada jeda waktu antara konfirmasi hasil deteksi dengan PCR dan tindakan pengendalian yang dilakukan sehingga meningkatkan kemungkinan penyebaran penyakit akibat tindakan pengendalian yang terlambat (Sankaran et al 2010).
2
yang efektif mendeteksi HLB pada kondisi laboratorium, yaitu yellow fluorescence
yang tereksitasi warna hijau dan far-red fluorescence yang tereksitasi gelombang UV.
Tehnik spektroskopi VIS-NIR juga diaplikasikan untuk mendeteksi HLB, Sankaran et al. (2011) menggunakan tehnik tersebut untuk pengaplikasian di lahan menggunakan beberapa model klasifikasi. Lanjutan dari penelitian tersebut, Sankaran dan Ehsani (2011) menggunakan teknih spektroskopi yang sama untuk memperoleh spektrum terpilih. Dari hasil penelitian diperoleh spektrum terpilih yaitu 537, 662, 713nm untuk daerah panjang gelombang cahaya tampak dan 813, 1120, 1472nm untuk daerah panjang gelombang NIR, dengan spektrum terpilih tersebut nilai akurasi klasifikasi untuk dua kelas objek daun sehat dan sakit sekitar 84-87% dengan metode klasifikasi QDA (quadratic discriminant analysis). Mishra
et al. (2012) menggunakan tehnik spektroskopi yang sama untuk mendeteksi HLB pada kondisi lapang dengan pengulangan pengukuran spektrum pada setiap pohon yang diukur. Dari penelitian tersebut diperoleh bahwa keakuratan deteksi HLB meningkat ketika diterapkan pengukuran spektrum pada setiap pohon sebanyak 3 dan 5 kali ulangan, dengan SVM (support vector machine) sebagai metode klasifikasinya.
Metode deteksi HLB dengan tehnik pencitraan (imaging) telah dilakukan oleh Kim et al. (2009) dimana menggunakan mikroskop sistem digital untuk akuisisi citra RGB daun. Jenis kondisi sampel daun yang digunakan untuk deteksi HLB ada 7 jenis yaitu blotchy mottle, green island, kekurangan zat besi, kekurangan Zn, kekurangan Mn, young flush leaf, dan daun normal. Klasifikasi dilakukan berdasarkan analisis tekstur citra menggunakan metode matrik co-occcurence dari citra warna, dimana citra RGB dikonversi ke ruang warna HSI terlebih dahulu. Nilai akurasi klasifikasi terbaik didapatkan pada model HSI_15 yaitu 94% dimana jumlah feature tekstur yang digunakan sebanyak 15 jenis. Tehnik deteksi menggunakan pencitraan juga dikembangkan oleh Sankaran et al. (2013), dimana pengambilan citra dilakukan menggunakan filter cahaya tampak (visible), near-infrared dan termal untuk mendeteksi dua kelas objek yaitu daun sehat dan daun terinfeksi HLB. Nilai akurasi klasifikasi yang diperoleh lebih dari 87% dengan menggunakan metode klasifikasi SVM, juga diperoleh nilai spektrum pada daerah spectrum VIS-NIR yang dapat digunakan untuk mendeteksi gejala HLB yaitu 560 nm dan 710 nm. Pourreza et al. (2013) mengembangkan tehnik deteksi HLB dengan menggunakan analisis citra pada panjang gelombang cahaya tampak yang pada bagian sistem sensornya dilengkapi dengan filter polarisasi untuk mendeteksi kandungan pati pada daun terinfeksi HLB. Dari penelitian tersebut didapatkan bahwa filter polarisasi berpotensi untuk digunakan sebagai tehnik deteksi HLB, tetapi tehnik tersebut masih belum mampu mengklasifikasikan antara daun yang terinfeksi HLB dan daun yang kekurangan unsur Zn.
Tehnik deteksi HLB yang ada di Indonesia dikembangkan oleh Balitjestro (balitjestro.litbang.pertanian.go.id), dimana tehnik yang digunakan berbasis asam nukleat yang tidak memerlukan thermal cycler yaitu Loop-mediated isothermal amplification (LAMP). Hasil pengujian DNA dengan menggunakan tehnik ini pada berbagi level pengenceran memiliki sensitivitas assay hingga level 10 picogram, hasil tersebut relatif sama dengan nilai yang diperoleh dengan menggunakan tehnik
3 Perumusan Masalah
Deteksi awal terhadap penyakit tanaman (sebelum muncul gejala penyakit) diperlukan sebagai sumber informasi penting untuk melakukan tindakan strategis manajemen penyakit serta mencegah perkembangan dan penyebaran penyakit (Sankaran et al. 2010). Peningkatan kandungan pati pada daun terinfeksi HLB dapat menjadi indikator untuk mendekteksi awal penyakit HLB (Cardinali et al. 2012) sebab pohon yang terinfeksi HLB fase awal perkembangan penyakit, daunnya tidak menunjukkan gejala sakit. Klasifikasi terhadap sampel daun yang belum bergejala HLB dan daun sehat telah dilakukan oleh Sankaran et al. (2011), Sankaran dan Ehsani (2011), dan Cardinali et al. (2012). Hasil akurasi klasifikasi terhadap dua jenis sampel daun tersebut yang diperoleh oleh Sankaran et al. (2011) cukup tinggi yaitu 88% tetapi hasil tersebut berlaku untuk klasifikasi terhadap daun belum bergejala terhadap kelas daun sakit sedangkan pada klasifikasi sampel daun belum bergejala HLB terhadap kelas daun sehat menghasilkan lebih banyak false positif (daun sehat secara aktual tetapi masuk kategori daun sakit). Nilai akurasi klasifikasi yang dihasilkan oleh Sankaran dan Ehsani (2011) lebih rendah (dibawah 80%). Hal serupa juga diperoleh dari penelitian Cardinali et al. (2012) dimana hasil akurasi klasifikasi antara dua jenis daun tersebut berkisar 80%, hal tersebut disebabkan kenampakan visual kedua jenis daun tersebut sama.
Upaya untuk meningkatkan hasil akurasi klasifikasi terhadap daun belum bergejala HLB dan daun sehat perlu ditingkatkan supaya terbentuk sistem deteksi dini penyakit HLB. Gambar 1 adalah ilustrasi untuk menjelaskan istilah daun belum bergejala. Pada penelitian ini objek kelas yang diklasifikasikan adalah daun belum bergejala HLB pada pohon yang positif terinfeksi HLB, daun terinfeksi HLB dan daun sehat. Penentuan kategori daun belum bergejala HLB bertujuan untuk menganalisis potensi pendeteksian awal penyakit HLB sebelum gejala morfologi (fisik) muncul karena gejala awal HLB menunjukkan peningkatan kandungan pati, baik pada daun yang menunjukkan gejala fisik atau tidak (Fan et al. 2010). Tehnik spektroskopi Vis-NIR digunakan untuk mengklasifikasi tiga kelas daun tersebut. Spektroskopi Vis-NIR dipilih karena telah teruji dapat mengklasifikasikan daun sakit dan daun sehat dengan tingkat akurasi tinggi. Pada penelitian ini, sampel yang digunakan berupa helai daun yang spektrumnya diukur pada kondisi laboratorium. Pembangunan model klasifikasi menggunakan metode jaringan saraf tiruan. Output dari penelitian ini adalah panjang gelombang sensitif yang dapat digunakan untuk mempersempit rentang spektrum dalam proses klasifikasi daun belum bergejala HLB.
4
Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut,
1. Menganalisis karakteristik spektrum Vis-NIR daun sakit HLB dan daun sehat. 2. Mengklasifikasi tiga kelas daun, yaitu daun jeruk belum bergejala HLB pada
pohon positif HLB, daun sakit HLB dan daun sehat.
3. Membangun aplikasi deteksi penyakit HLB pada jeruk berdasarkan data panjang gelombang sensitif.
2
TINJAUAN PUSTAKA
Gejala penyakit Huanglongbing
Menurut da Graça (1991), secara umum gejala penyakit ini pada daun terbagi atas dua jenis, gejala primer berupa warna daun yang berukuran normal menjadi kuning disepanjang tulang daun dan berkembang menjadi blotchy mottle. Blochy mottle adalah pola klorosis acak yang tidak sama antara bagian kanan dan kiri daun (crec.ifas.ufl.edu). Gejala sekunder dari HLB berupa ukuran daun yang kecil, daun menggulung ke atas (upright), dan menunjukkan gejala klorosis yang mirip dengan gejala kurang zinc (Zn). Analisis terhadap daun yang terinfeksi HLB didapatkan kandungan potassium yang tinggi, rendahnya konsentrasi kalsium, magnesium dan zinc. Gejala pada buah berupa ukuran buah yang kecil, memiliki rasa pahit, sebagian bentuk buah berbentuk lebih kecil dari yang lain, banyak buah yang jatuh sebelum waktunya, dan buah berwarna hijau pada bagian yang ternaungi. Fase perkembangan awal penyakit ini diawali dengan gejala blotchy mottle, daun yang menebal dan berkulit. Berikutnya, gejala berupa kurang zinc berkembang dan beberapa daun tumbuh menggulung. Terakhir, tanaman mengalami kerontokan (defoliation) dan mati (Bove et al. 2006). Kesulitan dalam mendeteksi penyakit ini pada daun adalah gejala yang mirip dengan kekurangan hara, berikut adalah contohnya yang tersaji pada Gambar 2.
Gambar 2 Perbandingan daun yang terinfeksi HLB dan kurang nutrisi (Pourreza et al. 2013)
5 bagian daun yang bergejala mirip HLB atau kurang nutrisi. Selanjutnya pada kedua sisi daun yang telah digaris, daerah yang menunjukkan gejala digambar lingkaran pada kedua sisinya. Bila daerah yang ditandai lingkaran pada kedua sisi daun berpola sama maka gejala tersebut termasuk gejala HLB. Gambar 2 menunjukkan cara pengujian tersebut.
Gambar 3 Gejala kurang nutrisi (kiri) dan gejala HLB (kanan) pada daun (crec.ifas.ufl.edu)
Penyakit ini di Indonesia berkembang pada daerah panas dataran rendah, contohnya daerah dataran rendah seluruh pesisir pula Jawa sedangkan di Bali penyakit ini berkembang pada daerah dengan ketinggian kurang dari 650 mdpl. Pengendalian terhadap penyakit ini belum ada, tetapi upaya mencegah penyebaran penyakit ini dapat dilakukan melalui kegiatan survey (scouting) serangan penyakit untuk menccegah sebanyak mungkin pohon yang menjadi sumber infeksi. Tehnik pengendaliannya dilakukan dengan memusnahkan pohon yang terinfeksi secepat mungkin dan/atau menekan populasi dari vektor serangga pembawa bakteri penyebab penyakit ini (Bove et al. 2006).
Spektroskopi Vis-NIR
6
digunakan untuk tujuan kualitatif dan kuantitatif pengujian bahan (Burgess dan Hammond 2007).
Informasi dari spektrum hasil pengukuran tidak dapat langsung digunakan sebab data spektrum tersebut selain mengandung informasi juga terdapat gangguan (noise). Ada dua alasan utama penyebab hal tersebut menurut Ozaki et al. (2007), pertama adalah alasan intrisik bahwa spektrum NIR terdiri atas sejumlah panjang gelombang yang timbul dari mode kombinasi dan overtone panjang gelombang yang saling tindih (overlap) satu sama lain. Alasan kedua adalah alasan secara praktek dimana tehnik spektroskopi cukup mewakili kondisi nyata sampel sehingga menghasilkan rasio sinyal dan gangguan (noise) yang buruk, fluktuasi pada
baseline dan saling tindih antar panjang gelombang yang parah akibat banyaknya komponen. Oleh karena itu, algoritma praperlakuan (pretreatment) diperlukan untuk mengurangi kompleksitas model sehingga lebih mudah tercapai metode intepretasinya selain itu metode dengan praperlakuan lebih stabil terhadap gangguan spektrum yang tidak diinginkan dibandingkan model yang tidak dilakukan praperlakuan spektrum (Heise dan Winzen 2002). Berikut adalah 4 jenis metode pretreatment,
1. Noise Reduction Methods
Terdapat jenis gangguan yang timbul dari mencampurnya proses fisik dan kimia, yaitu high frequency dan low frequency noise. Untuk mengurangi gangguan tersebut, salah satu metode yang dapat digunakan adalah
smoothing (Heise dan Winzen 2002). Metode smoothing yang paling umum digunakan adalah moving-average method dan Savitzky-Golay method
(Ozaki et al 2007). Metode Savitzky-Golay mencocokkan sebuah polinomial derajat rendah melalui titik-titik data didalam spektrum lokal dan menurunkan (derivative) nilai proses sinyal tersebut dari fungsi polinomialnya.
2. Baseline Correction Methods
Dasar spektrum yang konstan dan efek non-sistemik yang mempengaruhi bentuk global dan level absolut spektrum dapat dengan mudah dihilangkan dengan turunan spektrum (Heise dan Winzen 2002). Turunan spektrum adalah turunan dari persamaan berikut dnA/d λn (n=1,2..) dimana A( ) adalah fungsi dari . Turunan kedua, yaitu d2A/d λ2adalah yang paling sering digunakan. Keuntungan dari spektrum turunan kedua adalah puncak spektrum yang berlapis naik pada spektrum asli dibentuk dengan jelas perbedaannya antara puncak yang menurun. Keuntungan lain dari spektrum turunan kedua adalah menghapus penambahan dan pengalian ragam baseline pada spektrum asli (Ozaki et al 2007). Beragam cara digunakan untuk mengoreksi efek multiplicative pada data praperlakuan, salah satunya adalah multicaptive scatter correction (MSC). Pendekatan koreksi spektrum dengan MSC adalah dengan cara menggeser dan mengskalakan setiap spektrum agar cocok dengan spektrum target, dalam praktiknya spektrum rata-rata pada saat kalibrasi sering dipilih sebagai spektrum target (Heise dan Winzen 2002). Umumnya, MSC secara esensi meningkatkan sifat linear dari spektroskopi NIR (Ozaki et al 2007). 3. Resolution Enhancement Methods
7 gelombang yang tidak jelas (Ozaki et al 2007). Salah satu metode peningkatan resolusi pada praperlakuan spektrum adalah perbedaan spectra (difference spectra), dimana perbedaan spektrum antara sampel a dan b dihitung berdasarkan selisih spektrum sampel a dan spektrum sampel b. Perhitungan perbedaan spectra berguna untuk menganalisis gangguan spektrum NIR yang bersifat ketergantungan (dependent) contohnya
temperature-dependent, pH-dependent, atau concentration-dependent spectra.
4. Centering and Normalization Methods
Centering adalah metode penskala spektra yang diaplikasikan pada setiap variabel individu pada semua sampel (Kang 2011). Metode mean centering digunakan untuk menghitung spektrum rata-rata dari data dan mengurangkan nilai rata-rata pada setiap spektrum. Normalisasi mentransformasikan titik spektra dalam sebuah unit hypersphere dan semua data didekati dalam skala yang sama. Normalisasi berguna untuk menemukan kesamaan antara dua vektor spektrum dengan mengukur produk skalar dari dua vektor (Kang 2011).
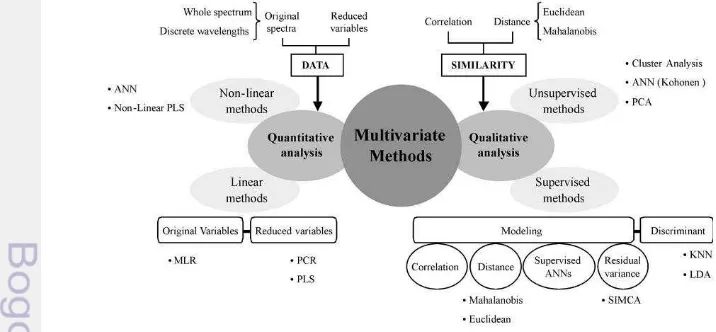
Metode Analisis Kualitatif Multivariat
Analisis kualitatif, lebih dikenal dengan metode pengenalan pola bertujuan untuk mengklasifikasikan objek yang dibagi menjadi dua, yaitu supervised dan
unsupervised learning algorithm. Algoritma pembelajaran tak terawasi (unsupervised learning algorithm) tidak memerlukan pengetahuan tentang objek yang dikelompokkan malah sebaliknya membentuk kelompok sendiri, sedangkan algoritma pembelajaran terawasi (supervised learning algorithm) perlu ada struktur kelompok data training (Heise and Winzen 2002). Metode ini menyusun kriteria secara matematis yang membuat kesamaan (similarity) antar dua sampel atau sampel antar kelas yang dinyatakan secara kuantitatif, umumnya kesamaan tersebut dinyatakan sebagai koefisien korelasi antar sampel atau ukuran jarak (dapat dihitung dengan Mahalanobis distance atau Euclidean distance) (Blanco dan Villarroya 2002). Skema yang menerangkan metode kuantitatif dan kualitatif multivariat tersaji pada Gambar 3.
8
Contoh dari metode analisis multivariate kualitatif (Gambar 3) antara lain, LDA (linear discriminant analysis), KNN (k-nearest neighbors), SIMCA (Soft Independent Modelling Class of Analogy), PLS regression, ANN (artificial neural network) dan SVM (support vector machine). Metode kualitatif tidak hanya digunakan untuk masalah klasifikasi untuk penyakit atau kerusakan tetapi juga telah lama digunakan untuk masalah klasifikasi terutama kualitas pangan. Contoh klasifikasi yang dilakukan adalah mengklasifikasikan benih berdasarkan daya kecambah atau varietas (Li et al. 2008; Lohumi et al. 2013; Mo et al. 2014) dan mengklasifikasikan produk segar berdasarkan kandungan kimia dan bahkan varietas produk tersebut (Li et al. 2007; Mendoza et al. 2014).
3
METODE
9
Uji PCR (polymer chain reaction)
Klasifikasi menggunakan JST
Penelitian ini dilaksanakan mulai Juni-Oktober 2015. Lokasi penelitian dilakukan pada beberapa tempat yaitu, laboratorium bioteknologi, PPSHB, IPB, laboratorium fisika material, departemen Fisika IPB, klinik tanaman departemen Proteksi Tanaman IPB, laboratorium teknik bioinformatika, departemen Teknik Mesin dan Biosistem, dan kebun jeruk di desa Situgede, Bogor.
Bahan
10
seluruh proses penelitian hanya daun tua. Setiap sampel daun disimpan dalam kantong plastik berklip yang didalamnya terdapat silika jel dan diberi label. Kegiatan survey lapang mendapatkan 15 dari 236 pohon jeruk yang memiliki gejala daun HLB sehingga direkomendasikan untuk dilakukan uji kandungan pati. Hasil dari pengujian kandungan pati tersebut dilanjutkan pada pengujian secara biologi dengan PCR untuk memastikan sampel pohon yang terinfeksi HLB dan sehat. Pada pengujian sampel secara biologi ditambahkan satu kategori lain yaitu kategori sampel daun tidak bergejala HLB yang dipetik dari pohon yang sama yang juga terdapat gejala penyakit HLB. Jumlah sampel daun untuk pengukuran spektroskopi Vis-NIR sebanyak 10-12 helai daun jeruk untuk setiap kategori. Pengujian terhadap sampel dilakukan pada hari yang sama saat pengambilan sampel di lahan.
Gambar 6 Sampel daun jeruk sehat (A), sakit (B) dan belum bergejala (C) Prosedur uji kandungan pati
Uji kandungan pati pada daun mengikuti metode yang dikembangkan oleh Etxeberria et al, (2007). Daun dari setiap pohon yang bergejala atau mirip HLB dan pohon yang tidak bergejala HLB atau gejala penyakit lain diambil sejumlah tiga hingga empat helai daun. Selanjutnya, setiap daun dipotong menjadi empat bagian, Gambar 7.
Gambar 7 Potongan daun untuk uji kandungan pati, bagian panah menunjukkan bagian yang perlu diamati (Etxeberria et al, 2007)
Potongan daun tersebut direndam pada larutan iodine dengan perbandingan 1:10 selama dua menit. Larutan iodine diganti setiap satu sampel daun. Sampel daun ditiriskan setelah dua menit. Pada Gambar 8 disajikan hasil uji kandungan pati yang menunjukkan perubahan warna pada potongan daun (ditunjukkan oleh tanda panah), warna hitam menunjukkan adanya kandungan pati dan tidak berwarna
A
B
11 menujukkan tidak ada kandungan pati. Penentuan sebuah sampel perlu dilanjutkan uji PCR atau tidak, dilakukan dengan memperhatikan hasil uji kandungan pati pada setiap sampel daun yang dipetik dari satu sampel pohon tersebut. Jika seluruh daun yang dipetik (3 atau 4 helai daun) menunjukkan perubahan warna hitam atau tidak berwarna maka sampel pohon tersebut tidak perlu konfimasi lanjutan dengan PCR. Sebaliknya, jika salah satu dari daun yang dipetik menunjukkan hasil yang berbeda antara satu dengan yang lain dalam satu sampel pohon yang sama maka direkomendasikan untuk dilakukan uji PCR.
Gambar 8 Uji kandungan pati daun jeruk terindikasi penyakit HLB (kiri) dan daun jeruk sehat (kanan)
Prosedur uji menggunakan PCR
Ekstraksi DNA total dilakukan terhadap contoh segar dari lapang yang sudah dipisahkan berdasarkan asal tanaman, kemudian ekstraksi dilakukan dengan menggunakan Qiagen DNeasy Plant Mini Kit (Qiagen, Hilden), dengan prosedur yang sudah ditentukan. Produk akhir dari ekstraksi DNA berupa isolat DNA yang dapat langsung digunakan untuk proses PCR atau disimpan dalam freezer. Isolat DNA kemudian dilakukan amplifikasi DNA dimana dibutuhkan PCR beads, primer forward OI 1 l (5’-GCG CGT ATG CAA TAC GAG CGG CA-3’), primer reverse
OI2c 1 l (5’-GCC TCG CGA CTT CGC AAC CCA T.-3’), ddH2O 9.5 l dan
template (DNA hasil ekstraksi) 1 l. Amplifikasi dilakukan dengan menggunakan mesin PCR gene amp PCR system 9700. Kondisi PCR yang digunakan adalah denaturasi awal 92ºC selama 2 menit, denaturasi pada 94ºC selama 1 menit, ekstensi akhir pada 72ºC selama 10 menit dan diakhiri dengan suhu 4ºC. Urutan tahap denaturasi, annealing dan ekstensi diulang sebanyak 40 kali. Tahap selanjutnya adalah elekstroforesis gel agarosa, dimana DNA hasil amplifikasi PCR sebanyak 5 l, yang telah ditambahkan loading dye 1 l, dielektroforesis dalam gel agarosa 1% (mengandung etidium bromide dalam buffer TAE 2X), 75 Volt DC selama 25 menit. Elektroforesis dilakukan dengan alat elektroforesis horizontal. Untuk memperkirakan ukuran DNA digunakan marker 1 Kbp (Thermo Scientific, USA). Pita DNA yang terbentuk hasil eletroforesis diamati di atas transilluminator UV dan selanjutnya diambil citranya.
Prosedur pengukuran spektrum VIS-NIR
12
(USB2000-VIS-NIR, Ocean Optics, USA). Panjang gelombang yang digunakan dalam pengukuran memiliki rentang 339 hingga 1022nm (resolusi rata-rata 0.33nm). Cahaya bersumber dari lampu tungsten halogen (LS-1, Ocean Optics, USA), Gambar 9A, yang dilewatkan ke daun dengan metode transmitan, selanjutnya transmisi cahaya tersebut diterima oleh kabel fiber optik dan diteruskan ke spektrometer (Gambar 9B). Akuisisi, pemprosesan dan kalibrasi spektrum menggunakan perangkat lunak Spectra Suite (Ocean Optics, USA). Total data spektrum absorban pada setiap pengukuran terdiri dari 2048 spektrum. Pengukuran spektrum daun dilakukan pada lapisan atas daun, sedangkan data yang diukur adalah serapan (absorban) sampel daun. Setiap lima kali pengukuran spektrum dilakukan kalibrasi ulang untuk meminimalkan gangguan (noise). Kalibrasi ulang dilakukan dengan pengukuran data intensitas transmisi referensi, yang dalam hal ini intensitas transmisi gelas preparat dan data intensitas gelap. Daun yang telah diukur spektrumnya disimpan kembali dalam kantong plastik berklip.
Gambar 9 Pengambilan spektrum daun dengan spectrometer Vis-NIR Analisis data spektrum dan pembangunan model klasifikasi
Proses praperlakuan (pretreatment) yang merupakan analisis data awal terhadap data spektrum pengukuran yang bertujuan untuk meminimalkan kontribusi spektrum yang tidak berhubungan dan tidak relevan agar diperoleh model yang sederhana dan kuat (Cen dan He 2007). Metode praperlakuan yang digunakan 5 jenis, antara lain turunan pertama spektrum, turunan kedua spektrum,
mean scattering correction (MSC), baseline correction, standart normal variate
(SNV). Seluruh data yang sudah dilakukan praperlakuan dianalisis menggunakan analisis komponen utama (AKU) untuk mengurangi dimensi data (Sankaran et al. 2011) dan memvisualisasikan pengelompokan data (Li et al. 2007). Output dari analisis PCA adalah skor, X-loading komponen utama dan explained variance. Pemberian praperlakuan dan analisis komponen utama terhadap spektrum menggunakan perangkat lunak Unscrambler 10.3 (Camo ASA, Oslo, Norway). Skor komponen utama digunakan untuk proses pengklasifikasian data menggunakan metode jaringan saraf tiruan. Nilai X-loading komponen utama digunakan untuk mendapatkan panjang gelombang yang sensitif pembeda spektrum sehat dan sakit.
Proses pengklasifikasian menggunakan pendekatan klasifikasi terawasi (supervised classification) dengan metode jaringan saraf tiruan (JST), dimana nilai skor komponen utama sebagai input data dan data target adalah kategori kelas daun sehat dan daun sakit. Pengklasifikasian dengan JST menggunakan neural network toolbox yang tersedia pada MATLAB® 8.3 (The MathWorks Inc., Natick, MA). Data untuk pembangunan model klasifikasi dibagi tiga bagian, data pelatihan, validasi dan pengujian dengan perbandingan 70:15:15, dimana pembagian data dilakukan acak. Jumlah neuron yang digunakan pada lapisan tersembunyi adalah
13 10 neuron. Pelatihan model JST menggunakan algoritma scaled conjugate gradient backpropagation. Fungsi transfer pada lapisan tersembunyi menggunakan fungsi
tansig. Fungsi transfer pada lapisan output adalah fungsi softmax. Model klasifikasi dengan JST ditentukan berdasarkan parameter errorcross-entropy (CE) dan akurasi klasifikasi. Error cross-entropy (CE) adalah fungsi error JST yang menjadi standar pilihan untuk penyelesaian masalah dalam bidang klasifikasi (Granitto et al. 2002). Penggunaan CE sebagai fungsi error dapat mempercepat konvergensi (Yuan et al.
2003) dan memberikan kinerja JST yang baik dibandingkan dengan fungsi kinerja
mean square error (MSE) (Nasr et al. 2002). Oleh karena itu, semakin kecil nilai CE semakin baik kinerja model JST tersebut dan semakin tinggi nilai akurasi menujukkan bahwa model JST memiliki kinerja yang baik dalam proses klasifikasi. Metode JST digunakan untuk dua kali proses klasifikasi, pertama untuk mendapatkan jenis praperlakuan yang tepat dengan input nilai komponen utama yang dihasilkan dari AKU. Kedua, JST digunakan untuk mendapatkan set panjang gelombang sensitif terbaik dengan memperhatikan nilai kinerja JST.
Pengembangan aplikasi klasifikasi daun jeruk
Nilai panjang gelombang sensitif terbaik berdasarkan parameter nilai akurasi dan kinerja JST digunakan untuk mengembangkan aplikasi berbasis desktop. Pengembangan aplikasi menggunakan bahasa visual basic dengan Microsof Visual Studio Premium 2013 sebagai perangkat lunak pengembangan aplikasi. Aplikasi klasifikasi penyakit HLB pada jeruk didesain dengan kriteria: 1) dapat langsung membaca file dengan format txt, karena output dari hasil pengukuran spektroskopi Vis-NIR berformat file txt, 2) tidak ada tindakan input nilai apapun, semua perintah dikerjakan dengan menekan tombol yang tersedia, 3) aplikasi dapat digunakan untuk perhitungan berulang kali tanpa perlu tindakan buka/tutup aplikasi lebih dulu. Model klasifikasi yang telah dibangun menggunakan metode JST dipindahkan dalam aplikasi klasifikasi dengan mengambil nilai bobot layer input, bias input, bobot output layer dan bias output layer.
4
HASIL DAN PEMBAHASAN
Karakteristik spektrum daun jeruk
14
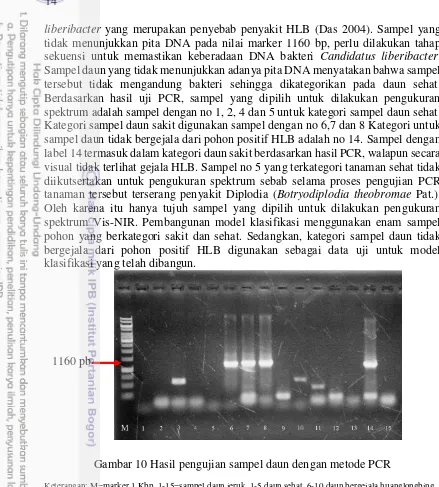
liberibacter yang merupakan penyebab penyakit HLB (Das 2004). Sampel yang tidak menunjukkan pita DNA pada nilai marker 1160 bp, perlu dilakukan tahap sekuensi untuk memastikan keberadaan DNA bakteri Candidatus liberibacter. Sampel daun yang tidak menunjukkan adanya pita DNA menyatakan bahwa sampel tersebut tidak mengandung bakteri sehingga dikategorikan pada daun sehat. Berdasarkan hasil uji PCR, sampel yang dipilih untuk dilakukan pengukuran spektrum adalah sampel dengan no 1, 2, 4 dan 5 untuk kategori sampel daun sehat. Kategori sampel daun sakit digunakan sampel dengan no 6,7 dan 8 Kategori untuk sampel daun tidak bergejala dari pohon positif HLB adalah no 14. Sampel dengan label 14 termasuk dalam kategori daun sakit berdasarkan hasil PCR, walapun secara visual tidak terlihat gejala HLB. Sampel no 5 yang terkategori tanaman sehat tidak diikutsertakan untuk pengukuran spektrum sebab selama proses pengujian PCR tanaman tersebut terserang penyakit Diplodia (Botryodiplodia theobromae Pat.). Oleh karena itu hanya tujuh sampel yang dipilih untuk dilakukan pengukuran spektrum Vis-NIR. Pembangunan model klasifikasi menggunakan enam sampel pohon yang berkategori sakit dan sehat. Sedangkan, kategori sampel daun tidak bergejala dari pohon positif HLB digunakan sebagai data uji untuk model klasifikasi yang telah dibangun.
Gambar 10 Hasil pengujian sampel daun dengan metode PCR
Keterangan: M=marker 1 Kbp, 1-15=sampel daun jeruk, 1-5 daun sehat, 6-10 daun bergejala huanglongbing, 11-15 daun belum bergejala huanglongbing dari pohon yang terdapat gejala huanglongbing
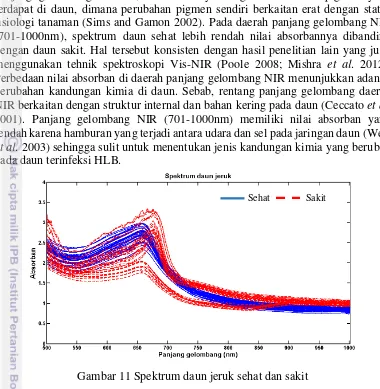
Hasil pengukuran spektrum daun (64 sampel) tersaji pada Gambar 11. Rentang panjang gelombang 500-1000nm dipilih karena memiliki gangguan yang minimal dibanding rentang panjang gelombang 399-499nm dan 1001-1022nm (lampiran 1). Spektrum daun sehat memiliki puncak pada panjang gelombang 660nm sedangkan spektrum daun sakit memiliki dua puncak, di panjang gelombang 660nm dan 675nm. Puncak spektrum tersebut menyatakan bahwa daun menyerap lebih banyak gelombang cahaya pada panjang gelombang tersebut. Absorban pada beberapa sampel daun sakit memiliki nilai yang lebih rendah dibandingkan dengan absorban daun sehat, tetapi beberapa spektrum daun sakit memiliki nilai absorban yang berhimpit dengan absorban daun sehat. Nilai absorban daun sakit di daerah panjang gelombang cahaya tampak (500-700nm) lebih rendah dibanding daun sehat akibat perubahan pigmen yang terjadi di daun. Penyerapan cahaya pada daerah
15 panjang gelombang tersebut, erat kaitannya dengan konsentrasi pigmen yang terdapat di daun, dimana perubahan pigmen sendiri berkaitan erat dengan status fisiologi tanaman (Sims and Gamon 2002). Pada daerah panjang gelombang NIR (701-1000nm), spektrum daun sehat lebih rendah nilai absorbannya dibanding dengan daun sakit. Hal tersebut konsisten dengan hasil penelitian lain yang juga menggunakan tehnik spektroskopi Vis-NIR (Poole 2008; Mishra et al. 2012). Perbedaan nilai absorban di daerah panjang gelombang NIR menunjukkan adanya perubahan kandungan kimia di daun. Sebab, rentang panjang gelombang daerah NIR berkaitan dengan struktur internal dan bahan kering pada daun (Ceccato et al. 2001). Panjang gelombang NIR (701-1000nm) memiliki nilai absorban yang rendah karena hamburan yang terjadi antara udara dan sel pada jaringan daun (West
et al. 2003) sehingga sulit untuk menentukan jenis kandungan kimia yang berubah pada daun terinfeksi HLB.
Gambar 11 Spektrum daun jeruk sehat dan sakit
Analisis spektrum dengan analisis komponen utama (PCA)
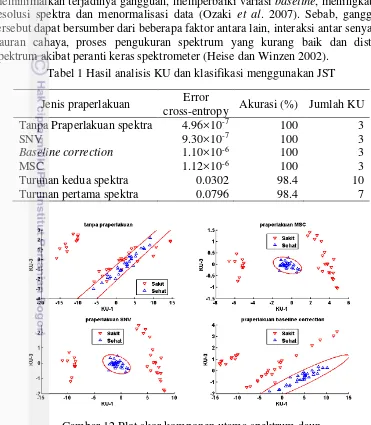
Data spektrum yang tersaji pada Gambar 11 perlu dilakukan praperlakuan untuk mengurangi gangguan yang masih terdapat pada spektrum daun. Sebanyak 5 jenis praperlakuan spektra berbeda (MSC, SNV, baseline correction, turunan pertama dan kedua spektra) digunakan untuk mendapatkan praperlakuan yang tepat dengan memperhatikan nilai akurasi klasifikasi dari setiap jenis praperlakuan yang digunakan. Data yang digunakan untuk klasifikasi tersebut adalah skor komponen utama hasil AKU dari setiap data spektrum yang diberi praperlakuan spektra. Klasifikasi nilai akurasi klasifikasi tersaji pada Tabel 1, yang menunjukkan jenis praperlakuan spektra dengan menggunakan MSC, SNV dan baseline correction
dapat dengan tepat (akurasi 100%) mengklasifikasi spektrum daun sakit dan sehat dibandingkan praperlakuan spektra turunan pertama dan kedua spektra.
Berdasarkan nilai error cross-entropy dari jaringan saraf tiruan, data spektrum yang tidak diberikan praperlakuan spektra memiliki nilai error yang paling rendah dibandingkan dengan data spekrum dengan praperlakuan. Namun demikian, pada Gambar 12 yang menyajikan plot skor komponen utama (KU-1 vs KU-3) dari praperlakuan spektra menggunakan MSC, SNV, dan baseline correction serta skor komponen utama dari spektrum tanpa praperlakuan spektra
16
menunjukkan bahwa pemberian praperlakuan spektra pada data spektrum dapat mengelompokkan data lebih baik dibandingkan dengan tanpa praperlakuan spektra yang ditunjukkan dengan tidak ada data kelas sakit yang masuk kelas sehat. Pada plot skor KU tanpa praperlakuan terdapat data kelas sakit yang masuk kelas sehat, yang batas pengelompokan tiap kelas ditunjukkan oleh garis merah (Gambar 12). Hal tersebut menunjukkan bahwa pemberian praperlakuan spektra dapat meminimalkan terjadinya gangguan, memperbaiki variasi baseline, meningkatkan resolusi spektra dan menormalisasi data (Ozaki et al. 2007). Sebab, gangguan tersebut dapat bersumber dari beberapa faktor antara lain, interaksi antar senyawa, bauran cahaya, proses pengukuran spektrum yang kurang baik dan distorsi spektrum akibat peranti keras spektrometer (Heise dan Winzen 2002).
Tabel 1 Hasil analisis KU dan klasifikasi menggunakan JST Jenis praperlakuan Error
cross-entropy Akurasi (%) Jumlah KU Tanpa Praperlakuan spektra 4.96×10-7 100 3
SNV 9.30×10-7 100 3
Baseline correction 1.10×10-6 100 3
MSC 1.12×10-6 100 3
Turunan kedua spektra 0.0302 98.4 10
Turunan pertama spektra 0.0796 98.4 7
Gambar 12 Plot skor komponen utama spektrum daun
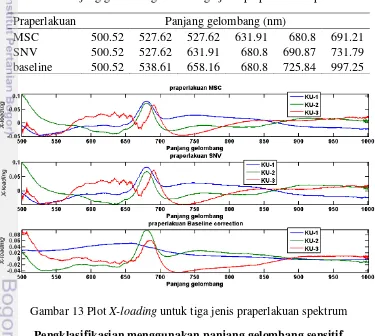
17 untuk memdapatkan panjang gelombang sensitif pengklasifikasian data spektrum daun sakit dan sehat melalui nilai X-loading komponen utama. Gambar 13 menyajikan plot X-loading dari tiga jenis praperlakuan. Berdasarkan plot X-loading
tersebut panjang gelombang sensitif diperoleh dari nilai positif dan negatif terbesar dari setiap komponen utama (Pholpho et al. 2011), nilai tersebut menunjukkan bahwa variabel panjang gelombang sensitif terpilih berperan penting dalam pengklasifikasian daun sakit dan sehat. Tabel 2 menyajikan panjang gelombang sensitif setiap jenis praperlakuan spektra (MSC, SNV dan baseline correction). Pada Tabel 2 tersebut ditunjukkan bahwa informasi spektrum pada daerah panjang gelombang cahaya tampak lebih dominan dibandingkan dengan panjang gelombang NIR pada pendeteksian daun sakit dan sehat. Kondisi sampel daun yang bergejala blotchy mottle (warna daun sebagian kuning, hijau, dengan beberapa corak kuning, hijau pucat dan hijau gelap, dimana warna tersebut saling bercampur tanpa ada batasan antar corak) berpengaruh terhadap spektrum di daerah cahaya tampak. Panjang gelombang sensitif di daerah NIR (725.84, 731.79, 997.25nm) berperan dalam pengklasifikasian yang berkaitan dengan perbedaan komposisi kimia pada daun. Keuntungan dari penggunaan beberapa panjang gelombang dibanding seluruh panjang gelombang dapat meningkatkan proses deteksi daun terinfeksi huanglongbing (Sankaran dan Ehsani 2011), menghemat waktu analisis (Luo et al. 2012) dan meningkatkan correlation robustness (Rady dan Guyer 2015)
Tabel 2 Panjang gelombang sensitif tiga jenis praperlakuan spektrum Praperlakuan Panjang gelombang (nm)
MSC 500.52 527.62 527.62 631.91 680.8 691.21 SNV 500.52 527.62 631.91 680.8 690.87 731.79 baseline 500.52 538.61 658.16 680.8 725.84 997.25
Gambar 13 Plot X-loading untuk tiga jenis praperlakuan spektrum Pengklasifikasian menggunakan panjang gelombang sensitif
18
sama (Tabel 2). Oleh karena itu, dibuat dataset panjang gelombang sensitif baru yang terdiri atas panjang gelombang sensitif yang sama dari tiga praperlakuan spektra dan gabungan panjang gelombang sensitif dari tiga jenis praperlakuan spektra. Total ada 5 dataset yang digunakan sebagai input klasifikasi, yang tersaji pada Tabel 3. Tujuan penambahan dataset tersebut untuk mendapatkan model klasifikasi JST terbaik dengan panjang gelombang sensitif sebagai input modelnya. Hasil klasifikasi terhadap data spektrum daun sakit dan sehat menggunakan panjang gelombang sensitif tersaji pada Tabel 3. Berdasarkan nilai akurasi dan kinerja JST dari Tabel 3, panjang gelombang sensitif yang diperoleh dari praperlakuan spektra
baseline correction menghasilkan akurasi tertinggi dan nilai error cross-entropy
yang paling rendah. Selanjutnya, model klasifikasi JST dengan input panjang gelombang sensitif dari praperlakuan spektra baseline correction diuji menggunakan data spektrum dari jenis sampel daun belum bergejala dari pohon yang positif terserang HLB yang tidak diikutkan selama proses pembangunan model klasifikasi daun jeruk. Data spektrum yang digunakan untuk pengujian model berjumlah 8 sampel spektrum.
Tabel 3 Hasil klasifikasi menggunakan JST
Praperlakuan Akurasi (%) Error cross-entrpy
Baseline correction 100 4.9×10-7
Semua data 100 5.32×10-7
Panjang gelombang yang sama 100 2.27×10-6
SNV 100 1.54×10-6
MSC 100 0.000584
Hasil uji terhadap model klasifikasi JST tersebut tersaji pada Tabel 4. Kolom target pada Tabel 4 menyatakan nilai yang harus terpenuhi sedangkan kolom aktual adalah nilai yang diperoleh dari hasil klasifikasi menggunakan model klasifikasi JST dengan input panjang gelombang sensitif dari praperlakuan spektra
19 Tabel 4 Hasil pengujian menggunakan sampel tidak bergejala
No. sampel Aktual Target
1 0.000101189 0.999899 0 1
2 3.45E-06 0.999997 0 1
3 2.72E-08 1.000000 0 1
4 9.67E-05 0.999903 0 1
5 1.79E-05 0.999982 0 1
6 5.93E-06 0.999994 0 1
7 3.88E-08 1.000000 0 1
8 0.00350559 0.996494 0 1
Keterangan [0 1] kodifikasi untuk kategori sakit. [1 0] kodifikasi untuk kategori sehat
Aplikasi untuk deteksi penyakit HLB
Pengklasifikasian spektrum data pengukuran Vis-NIR didasarkan atas model klasifikasi yang dibangun menggunakan metode JST. Nilai bobot dan bias pada lapisan tersembunyi dan lapisan output yang merupakan penyusun dari model klasifikasi ditanamkan pada aplikasi deteksi penyakit HLB untuk mengklasifikasikan data spektrum Vis-NIR yang diinput pada sistem (Lampiran 3).
Aplikasi yang telah dikembangkan berbasis komputer dekstop tidak memerlukan kebutuhan sistem operasi tertentu (lihat Lampiran 4 untuk script
pmograman). Output aplikasi ini berupa keputusan dalam bentuk biner, bahwa data spektum yang diinputkan terklasifikasi sebagai kelompok sakit atau sehat. Aplikasi ini memiliki kelebihan dapat mendeteksi daun jeruk yang terserang HLB walaupun secara morfologi (fisik) belum menunjukkan gejala sakit. Fitur utama dari aplikasi tersaji pada Gambar 14, yang terdiri atas tombol open, transfer, dan classify, textbox
untuk menampilkan data pengukuran spektrum Vis-NIR, textbox2 untuk menampilkan hasil perhitungan, berupa keputusan bahwa spektrum yang diukur dikategorikan sakit atau sehat, serta listview untuk menampikan data khusus tipe numerik.
20
keputusan klasifikasi ditampilkan pada textbox2. Gambar 15 menampilkan hasil klasifikasi data pengukuran spektrum.
Gambar 15 Tampilan hasil klasifikasi aplikasi klasifikasi daun jeruk terinfeksi HLB
5
PENUTUP
KESIMPULAN
Penelitian klasifikasi daun jeruk sehat dan belum bergejala menggunakan spektroskopi Vis-NIR menghasilkan beberapa simpulan, antara lain:
1. Pada rentang panjang gelombang 660-680nm (daerah cahaya tampak), yang merupakan daerah serapan klorofil, absorban daun sehat lebih tinggi dibandingkan dengan daun sakit.
2. Pada daerah panjang gelombang NIR, spektrum daun sakit lebih tinggi dibanding daun sehat, hal tersebut menunjukkan adanya perubahan komposisi kimia dalam daun.
3. Panjang gelombang 500.52, 538.61, 658.16, 680.8, 725.84 dan 997.25nm merupakan panjang gelombang sensitif yang memiliki nilai error cross-entropy paling rendah yang diperoleh dari X-loading komponen utama dengan praperlakuan spektra baseline correction.
4. Model klasifikasi dengan menggunakan panjang gelombang sensitif dari praperlakuan spektra baseline correction, spektrum daun sakit dan sehat dapat diklasifikasikan dengan baik (akurasi 100%), bahkan dengan spektrum daun belum bergejala secara fisik dapat diklasifikasikan dengan tepat pada kategori daun sakit.
5. Aplikasi untuk klasifikasi daun jeruk terinfeksi HLB berdasarkan panjang gelombang sensitif telah berhasil dibangun menggunakan bahasa pemograman visual basic yang berbasis komputer desktop.
SARAN
1. Pengembangan selanjutnya perlu dilakukan sistem klasifikasi berdasarkan tingkat keparahan serangan HLB menggunakan tehnik spektroskopi Vis-NIR.
21
DAFTAR PUSTAKA
Agrios G. 2005. Plant Pathology. 5th ed. London: Academic Press.
Asaad M. 2006. Karakterisasi Patogen CVPD pada Tanaman Jeruk dan Vektor CVPD Menggunakan Teknik Polymerase Chain Reaction. J. Hort 16:327–335.
Blanco M, Villarroya I. 2002. NIR spectroscopy μ a rapid-response analytical tool.
trends Anal. Chem. 21:240–250.
Bove JM, Genomique DR, Pathogene P, Recherche C De, Bordeaux I De, Bourlaux
E, Cedex O, Df A, Pereira A, Araraquara P. 2006. HUANGLONGBING μ A
Destructive, Newly-Emerging, Century-Old Disease of Citrus. J. Plant Pathol.
88:7–37.
Burgess C, Hammond J. 2007. Wavelength Standards for the Near-Infrared Spectral Region. Spectroscopy 22:40–48.
Cardinali MC do B, Boas PRV, Milori DMBP, Ferreira EJ, Silva MF e, Machado MA, Bellete BS, Silva MF das GF da. 2012. Infrared spectroscopy: A potential tool in huanglongbing and citrus variegated chlorosis diagnosis. Talanta 91:1– 6.
Carter GA, Knapp AK. 2001. Leaf optical properties in higher plants: linking spectral characteristics to stress and chlorophyll concentration. Am. J. Bot.
88:677–684.
Ceccato P, Flasse S, Tarantola S, Jacquemoud S, Gregoire JM. 2001. Detecting vegetation leaf water content using reflectance in the optical domain. Remote Sens. Environ. 77:22–33.
Cen H, He Y. 2007. Theory and application of near infrared reflectance spectroscopy in determination of food quality. Trends Food Sci. Technol.
18:72–83.
Chelladurai V, Jayas DS. 2014. Near-infrared Imaging and Spectroscopy. In: Manickavasagan A, Jayasuriya H, editors. Imaging with Electromagnetic Spectrum. Berlin Heidelberg: Springer.
Das AK. 2004. Rapid detection of Candidatus Liberibacter asiaticus, the bacterium associated with citrus Huanglongbing (Greening) disease using PCR. Curr. Sci.
87:1183–1185.
Fan J, Chen C, Brlansky RH, Gmitter FG, Li ZG. 2010. Changes in carbohydrate
metabolism in Citrus sinensis infected with “Candidatus Liberibacter asiaticus.” Plant Pathol. 59:1037–1043.
da Graça J V. 1991. Citrus Greening Disease. Annu. Rev. Phytopathol. 29:109–136. Granitto PM, Navone HD, Verdes PF, Ceccatto H a. 2002. Weed seeds
identification by machine vision. Comput. Electron. Agric. 33:91–103.
Heise HM, Winzen R. 2002. Fundamental Chemometric Methods. In: Siesler H., Ozaki Y, Kawata S, Heise H., editors. Near-Infrared Spectroscopy Principles, Instruments, Applications. Weinheim: Wiley-VCH. p. 125–162.
Iftikhar Y, Rauf S, Shahzad U, Zahid MA. 2016. Huanglongbing μ Pathogen
detection system for integrated disease management – A review. J. Saudi Soc. Agric. Sci. 15:1–11.
Kang S. 2011. NIR Spectroscopy for Chemical Composition and Internal Quality in Foods. In: Cho Y-J, editor. Emerging Technologies for Food Quality and Food Safety Evaluation. Boca Raton, FL: CRC press. p. 113–148.
22
Greening Using Microscopic Imaging. CIGR J. XI.
Li X, He Y, Fang H. 2007. Non-destructive discrimination of Chinese bayberry varieties using Vis/NIR spectroscopy. J. Food Eng. 81:357–363.
Li X, He Y, Wu C. 2008. Non-destructive discrimination of paddy seeds of different storage age based on Vis/NIR spectroscopy. J. Stored Prod. Res. 44:264–268. Lohumi S, Mo C, Kang J, Hong S, Cho B. 2013. Nondestructive Evaluation for the Viability of Watermelon ( Citrullus lanatus ) Seeds Using Fourier Transform Near Infrared Spectroscopy. J. Biosyst. Eng. 38:312–317.
Luo X, Takahashi T, Kyo K, Zhang S. 2012. Wavelength selection in vis / NIR spectra for detection of bruises on apples by ROC analysis. J. Food Eng.
109:457–466.
Mendoza F, Lu R, Cen H. 2014. Grading of apples based on firmness and soluble solids content using Vis / SWNIR spectroscopy and spectral scattering techniques. J. Food Eng. 125:59–68.
Mishra A, Karimi D, Ehsani R, Albrigo LG. 2011. Evaluation of an active optical sensor for detection of Huanglongbing (HLB) disease. Biosyst. Eng. 110:302– 309.
Mishra AR, Karimi D, Ehsani R, Lee WS. 2012. Identification of Citrus Greening (Hlb) Using a Vis-Nir Spectroscopy Technique. Trans. Asabe 55:711–720. Mo C, Kim G, Lee K, Kim MS, Cho B, Lim J, Kang S. 2014. Non-Destructive
Quality Evaluation of Pepper (Capsicum annuum L.) Seeds Using LED-Induced Hyperspectral Reflectance Imaging. :7489–7504.
Nasr G, Badr E, Joun C. 2002. Cross Entropy Error Function in Neural Networks: Forecasting Gasoline Demand. FLAIRS Conf.:381–384.
Nurhadi. 2015. Penyakit Huanglongbing Tanaman Jeruk (Candidatus Liberibacter Asiaticus): Ancaman Dan Strategi Pengendalian. Pengemb. Inov. Pertan.
8:21–32.
Osborne BG, Fearn T, Hindle PH, Hindle PT. 1993. Practical NIR Spectroscopy with Applications in Food and Beverage Analysis. Singapore: Longman Scientific & Technical (Longman food technology).
Ozaki Y, Morita S, Du Y. 2007. Spectral Analysis. In: Ozaki Y, McClure WF, Christy AA, editors. Near-Infrared Spectroscopy In Food Science And Technology. New Jersey: Wiley-Interscience. p. 47–72.
Park HS, Dailey R, Lemus D. 2002. The Use of Exploratory Factor Analysis and Principal Components Analysis in Communication Research. Hum. Commun. Res. 28:562–577.
Pholpho T, Pathaveerat S, Sirisomboon P. 2011. Classification of longan fruit bruising using visible spectroscopy. J. Food Eng. 104:169–172.
Poole G. 2008. Visible/near-infrared spectroscopy for discrimination of HLB-infected citrus leaves from healthy leaves. In: Proc. Intl. Research Conf. on Huanglongbing. St. Paul, Minn: Plant Management Network. p. 178–180. Pourreza A, Lee WS, Raveh E, Ehsani R, Etxeberria E. 2014. Citrus Huanglongbing
Detection Using Narrow-Band Imaging and Polarized Illumination. Trans. Asabe 57:259–272.
23
Preacher KJ, MacCallum RC. 2003. Repairing Tom Swift’s Electric Factor
Analysis Machine. Underst. Stat. 2:13–43.
Rady A, Guyer D. 2015. Utilization of visible/near-infrared spectroscopic and wavelength selection methods in sugar prediction and potatoes classification.
J. Food Meas. Charact. 9:20–34.
Sankaran S, Ehsani R. 2011. Visible-near infrared spectroscopy based citrus greening detection: Evaluation of spectral feature extraction techniques. Crop Prot. 30:1508–1513.
Sankaran S, Ehsani R. 2012. Detection of Huanglongbing Disease in Citrus Using Fluorescence Spectroscopy. Trans. Asabe 55:313–320.
Sankaran S, Ehsani R, Etxeberria E. 2010. Mid-infrared spectroscopy for detection of Huanglongbing (greening) in citrus leaves. Talanta 83:574–581.
Sankaran S, Maja JM, Buchanon S, Ehsani R. 2013. Huanglongbing (citrus greening) detection using visible, near infrared and thermal imaging techniques.
Sensors (Basel). 13:2117–30.
Sankaran S, Mishra A, Maja JM, Ehsani R. 2011. Visible-near infrared spectroscopy for detection of Huanglongbing in citrus orchards. Comput. Electron. Agric. 77:127–134.
Schneider H. 1968. Anatomy of greening-diseased sweet orange shoots.
Phytopathology 58:1155–1160.
Sims DA, Gamon JA. 2002. Relationships between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and developmental stages. Remote Sens. Environ. 81:337–354.
Taufik M, Khaeruni A, Pakki T. 2010. Deteksi Keberadaan Citrus Vein Phloem Degeneration (CVPD) dengan Teknik PCR ( Polymerase Chain Reaction ) di Sulawesi Tenggara. J. HPT Trop. 10:73–79.
West JS, Bravo C, Oberti R, Lemaire D, Moshou D, McCartney HA. 2003. The Potential of Optical Canopy Measurement for Targeted Control of Field Crop Diseases. Annu. Rev. Phytopathol 41:593–614.
Windham WR, Poole GH, Park B, Heitschmidt G, Hawkins SA, Albano JP, Gottwald TR, Lawrence KC. 2011. Rapid screening of Huanglongbing-infected citrus leaves by near-infrared reflectance spectroscopy. Trans. ASABE
54:2253–2258.
Yuan HC, Xiong FL, Huai XY. 2003. A method for estimating the number of hidden neurons in feed-forward neural networks based on information entropy.
24
25 Lampiran 1 Spektrum penuh daun jeruk sehat dan sakit
S
akit Seha
26
27 Lampiran 3 Nilai bobot dan bias JST yang digunakan untuk pengembangan
28
Handles Button1.Click 'tombol open
31
Convert.ToDouble(bias12) + Convert.ToDouble(bias13) +
Convert.ToDouble(bias14) + Convert.ToDouble(bias15) +
Convert.ToDouble(bias16) + Convert.ToDouble(bias17) +
Convert.ToDouble(bias18) + Convert.ToDouble(bias19) +
Convert.ToDouble(bias20)
total2 = Convert.ToDouble(bias21) +
Convert.ToDouble(bias22) + Convert.ToDouble(bias23) +
Convert.ToDouble(bias24) + Convert.ToDouble(bias25) +
32
Convert.ToDouble(bias28) + Convert.ToDouble(bias29) +
Convert.ToDouble(bias30)
'bias output layer
bias31 = total1 + -0.337853028
bias32 = total2 + 0.548852194
'fungsi aktivasi output
'exponensial
sum1 = Math.Exp(bias31)
sum2 = Math.Exp(bias32)
'softmax
hasil1 = sum1 / (sum1 + sum2)
hasil2 = sum2 / (sum1 + sum2)
'konversi ke tulisan
If hasil1 > 0 And hasil1 < 0.1 And hasil2 > 0.9 Then hasil.Text = "SAKIT"
Else
hasil.Text = "SEHAT"
End If End Sub
Private Sub Button4_Click(sender As Object, e As EventArgs)
Handles Button4.Click 'tombol clear
ListBox1.Items.Clear()
ListView1.Items.Clear()
hasil.Clear()
33