PRODUKSI FRUKTO-OLIGOSAKARIDA
DARI INULIN
UMBI DAHLIA (
Dahlia pinnata
) SECARA HIDROLISIS
ENZIMATIK
RENI SUPARWATI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Produksi Frukto-oligosakarida dari Inulin Umbi Dahlia (Dahlia pinnata) secara Hidrolisis Enzimatik adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Reni Suparwati
ABSTRAK
RENI SUPARWATI. Produksi Frukto-oligosakarida dari Inulin Umbi Dahlia (Dahlia pinnata) secara Hidrolisis Enzimatik. Dibimbing oleh DJUMALI MANGUNWIDJAJA dan MULYORINI RAHAYUNINGSIH.
Frukto-oligosakarida (FOS) merupakan prebiotik yang dapat diperoleh dengan menghidrolisis inulin. Tujuan dari penelitian ini yaitu mendapatkan dan menganalisis kadar inulin, mendapatkan enzim inulinase dan mengukur nilai aktivitas enzimnya, serta mendapatkan FOS dan karakterisasinya. Penelitian ini dilaksanakan dalam dua tahap, yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan meliputi analisis proksimat bahan (umbi dahlia, gembili, bonggol pisang, dan turubuk), ekstraksi tepung inulin, pengujian kadar inulin, produksi enzim inulinase kasar dan pengujian aktivitas enzimnya. Penelitian utama meliputi proses hidrolisis tepung inulin menjadi FOS menggunakan enzim inulinase komersial (dosis 1; 2; 3; 5; 7,5; dan 10 U/g) dan inulinase kasar (dosis 1; 2; dan 3 U/g) selama 24 jam serta pengujian karakteristik FOS. Hasil rendemen tepung inulin tertinggi didapatkan dari umbi dahlia sebesar 48,20% dengan kadar inulin 80,09%. Nilai aktivitas enzim inulinase inulinase kasar yang dihasilkan sebesar 0,76 U/ml. Pada hidrolisis inulin menggunakan inulinase komersial rata-rata produk yang terbentuk sebagian besar adalah fruktosa. Pada hidrolisis inulin menggunakan inulinase kasar rata-rata produk yang terbentuk sebagian besar adalah FOS.
Kata kunci: FOS, inulin, inulinase, hidrolisis enzimatik
ABSTRACT
RENI SUPARWATI. Production of Fructo-oligosaccharide from Dahlia Tuber (Dahlia pinnata) Inulin by Enzymatic Hydrolysis. Supervised by DJUMALI MANGUNWIDJAJA and MULYORINI RAHAYUNINGSIH.
Fructo-oligosaccharide (FOS) is a prebiotic which can be obtained by inulin enzymatically hydrolyzed. The purpose of this research are extracting and analyzing the levels of inulin, producing inulinase enzyme and measuring the value of enzyme activity, and producing and characterizing FOS. This study was conducted in two stages, preliminary researches and primary researches. Preliminary researches include proximate analysis (dahlia tuber, gembili, banana weevil, and turubuk), producing inulin, inulin assays, producing inulinase enzymes, and enzyme activity assays. Primary researches include inulin hydrolysis using commercial (dossage 1; 2; 5; 7,5; and 10 U/g) and raw inulinase (dossage 1; 2; and 3 U/g) for 24 hours and characterize of this product. The highest yield of inulin powder obtained from dahlia tubers at 48,20% with 80,09% content of inulin. The enzyme activity of raw inulinase is 0,76 U/ml. Product formed by commercial inulinase mostly fructose, meanwhile raw inulinase mostly produced FOS.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknik Pertanian
pada
Departemen Teknologi Industri Pertanian
PRODUKSI FRUKTO-OLIGOSAKARIDA
DARI INULIN
UMBI DAHLIA (
Dahlia pinnata
) SECARA HIDROLISIS
ENZIMATIK
RENI SUPARWATI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Produksi Frukto-oligosakarida dari Inulin Umbi Dahlia (Dahlia pinnata) secara Hidrolisis Enzimatik
Nama : Reni Suparwati NIM : F34090066
Disetujui oleh
Prof Dr Ir Djumali Mangunwidjaja, DEA Pembimbing I
Dr Ir Mulyorini Rahayuningsih, MS Pembimbing II
Diketahui oleh
Prof Dr Ir Nastiti Siswi Indrasti Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 ini ialah sakarida, dengan judul Produksi Frukto-oligosakarida dari Inulin Umbi Dahlia (Dahlia pinnata) secara Hidrolisis Enzimatik.
Ungkapan terima kasih penulis sampaikan kepada :
1. Prof Dr Ir Djumali Mangunwidjaja, DEA dan Dr Ir Mulyorini Rahayuningsih, MS selaku dosen pembimbing atas bimbingan dan support
nya selama penelitian dan penyusunan skripsi ini.
2. Ir Ade Iskandar, M.Si selaku dosen penguji yang telah memberikan saran bagi perbaikan skripsi ini.
3. Ayahanda Suroto, Ibunda Warminah, Mas Arifin, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
4. Laboran TIN yang telah membantu dalam pelaksanaan penelitian.
5. Keluarga besar TIN 46 atas bantuan, masukan, semangat, dan kebersamaannya dari awal semester 3 hingga penulis menyelesaikan studinya.
6. Teman-teman Pondok JAIKA yang selalu menemani dan memberikan dukungankepada penulis.
7. Seluruh pihak yang tidak dapat disebutkan satu persatu yang telah membantu sehingga penelitian dan penulisan skripsi ini dapat terselesaikan. Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna, oleh karena itu penulis mengharapkan kritik dan saran yang membangun agar skripsi ini menjadi lebih baik. Semoga karya ilmiah ini bermanfaat bagi pembaca dan perkembangan ilmu pengetahuan.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
METODE 3
Bahan 3
Alat 3
Metode Penelitian 3
HASIL DAN PEMBAHASAN 5
Penelitian Pendahuluan 5
Penelitian Utama 10
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 20
DAFTAR TABEL
1 Komposisi kimia umbi dahlia, gembili, turubuk, dan bonggol
pisang 6
2 Komposisi kimia umbi gembili dan umbi dahlia 6
3 Rendemen tepung inulin dan kadar inulin 8
4 Derajat konversi inulin menjadi FOS 11
5 Analisis statistik produk hidrolisat inulin 17
DAFTAR GAMBAR
1 Pola pemutusan ikatan inulin oleh inulinase 9
2 Hubungan dosis enzim inulinase komersial dan waktu hidrolisis
terhadap sisa kadar inulin dalam FOS 12
3 Hubungan dosis enzim inulinase kasar dan waktu hidrolisis
terhadap sisa kadar inulin dalam FOS 12
4 Hubungan dosis enzim inulinase komersial dan waktu hidrolisis
terhadap nilai gula pereduksi 14
5 Hubungan dosis enzim inulinase kasar dan waktu hidrolisis
terhadap nilai gula pereduksi 14
6 Hubungan dosis enzim inulinase komersial dan waktu hidrolisis
terhadap nilai total gula 15
7 Hubungan dosis enzim inulinase kasar dan waktu hidrolisis
terhadap nilai total gula 15
8 Hubungan dosis enzim inulinase komersial dan waktu hidrolisis
terhadap derajat polimerisasi 16
9 Hubungan dosis enzim inulinase kasar dan waktu hidrolisis
terhadap derajat polimerisasi 16
DAFTAR LAMPIRAN
1 Tata cara analisis proksimat bahan baku 20
2 Tata cara pengujian kadar inulin 21
3 Tata cara pengujian aktivitas enzim inulinase 22 4 Tata cara pengujian produk hidrolisat inulin 22 5 Hasil perhitungan rendemen dan kadar inulin tepung inulin 24
PENDAHULUAN
Latar Belakang
Kebutuhan akan prebiotik saat ini semakin meningkat. Prebiotik yaitu makanan yang tidak dapat dicerna oleh usus namun dapat menstimulasi pertumbuhan atau aktivitas bakteri tertentu dalam kolon manusia. Prebiotik dapat diperoleh dari berbagai sumber, salah satunya adalah frukto-oligosakarida(FOS), yaitu campuran oligosakarida yang terdiri dari unit-unit fruktosa dengan ikatan
rantai β-2,1 dan memiliki jumlah unit fruktosa penyusun antara dua sampai sembilan unit. Komponen FOS hanya dapat dicerna sebagian saja oleh manusia. Bagian lain yang tidak dapat dicerna dijadikan sebagai sumber makanan oleh bakteri yang menguntungkan seperti spesies Bifidobacteria dan Lactobacillus
yang mampu mencegah infeksi pada sistem pencernaan. Manfaat tersebut membuat FOS menjadi produk prebiotik yang cukup populer.
Produksi FOS di industri biasanya menggunakan substrat sukrosa yang dikultivasi menggunakan fruktosiltransferase, namun penggunaan cara tersebut masih menghasilkan inhibitor yaitu glukosa yang terbentuk dari proses kultivasi. Oleh karena itu perlu penambahan glukosa oksidase untuk menghilangkan glukosa dari produk FOS, hal ini menjadi salah satu kelemahan dalam proses tersebut (Sirisansaneeyakul et al. 2000). Salah satu alternatif untuk memperoleh FOS dapat dilakukan dengan cara menghidrolisis inulin karena FOS merupakan produk antara dari inulin dan fruktosa. Hidrolisis inulin menjadi FOS dapat dilakukan menggunakan dua metode yaitu hidrolisis secara asam dan enzimatik. Hidrolisis secara enzimatik lebih baik dibandingkan hidrolisis secara asam karena dapat memutus secara spesifik rantai ikatan dalam inulin sehingga produk FOS yang dihasilkan lebih murni. Enzim yang digunakan dalam menghidrolisis inulin menjadi FOS yaitu enzim inulinase yang memiliki pola aksi dalam atau disebut endo enzim (Singh dan Singh 2010).
2
Perumusan Masalah
Salah satu alternatif untuk mendapatkan FOS dapat dilakukan dengan menghidrolisis inulin karena FOS merupakan produk antara inulin dan fruktosa. Berbagai sumber potensial dapat diteliti mengenai kandungan inulinnya. Umbi dahlia dan gembili sudah terbukti mengandung inulin, sementara itu turubuk dan bonggol pisang juga diduga mengandung inulin.
FOS yang dihasilkan dari inulin dapat diperoleh dengan dua macam cara hidrolisis yaitu hidrolisis asam dan enzimatik. Hidrolisis enzimatik menggunakan inulinase diharapkan dapat membentuk FOS dengan hasil yang lebih murni karena dapat memutus secara spesifik rantai ikatan dalam inulin. Dua faktor yang diduga berpengaruh terhadap hidrolisis ini yaitu dosis enzim dan waktu hidrolisis. Enzim inulinase tentunya akan bekerja optimal pada dosis dan waktu tertentu.
Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Mendapatkan dan menganalisis kadar inulin yang terdapat pada umbi dahlia, gembili, bonggol pisang, dan turubuk.
2. Mendapatkan enzim inulinase kasar dari kapang Aspergillus niger dan menguji aktivitas enzim tersebut.
3. Mendapatkan FOS dari inulin umbi dahlia secara hidrolisis enzimatik dan mengetahui pengaruh dosis enzim inulinase kasar dan komersial serta waktu hidrolisis terhadap kinerja hidrolisis inulin.
Manfaat Penelitian
Manfaat dari penelitian ini yaitu memberikan pengetahuan baru mengenai kandungan inulin yang diduga ada pada turubuk dan bonggol pisang, serta memberikan gambaran mengenai produksi FOS dari inulin menggunakan inulinase.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi
1. Karakterisasi bahan baku yang meliputi uji proksimat.
2. Ekstraksi tepung inulin dari umbi dahlia, gembili, bonggol pisang, dan turubuk, serta pengujian kadar inulin pada tepung inulin.
3. Produksi enzim inulinase kasar serta pengujian aktivitas enzim.
3
METODE
Bahan
Bahan-bahan yang digunakan untuk ekstraksi inulin yaitu umbi dahlia, gembili, bonggol pisang, turubuk, dan etanol. Bahan-bahan untuk produksi enzim inulinase kasar yaitu kultur stok Aspergillus niger yang didapat dari Laboratorium Bioindustri Teknologi Industri Pertanian IPB, medium potato dextrose agar
(PDA), inulin komersial dari akar chicori, larutan garam, dan mikronutrien. Untuk produksi FOS digunakan enzim inulinase komersial dan enzim inulinase kasar. Untuk analisis kadar inulin digunakan sistein 1,5% dan karbazol 0,12%, serta bahan kimia lain digunakan untuk analisis.
Alat
Alat-alat yang digunakan adalah peralatan gelas, mikropipet, peralatan pengecilan ukuran, spektrofotometer, dan waterbath.
Metode Penelitian
Penelitian dilaksanakan dalam dua tahap yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan meliputi karakterisasi komposisi kimia bahan baku, ekstraksi tepung inulin, dan produksi enzim inulinase kasar. Penelitian utama meliputi hidrolisis inulin menjadi FOS, analisis kimia produk hidrolisat inulin, dan analisis statistik produk hidrolisat inulin.
Penelitian pendahuluan
a. Karakterisasi komposisi kimia bahan baku
Karakterisasi komposisi kimia bahan baku umbi dahlia, gembili, bonggol pisang, dan turubuk meliputi analisis proksimat yang mencakup kadar air, kadar abu, kadar lemak, kadar serat kasar, kadar protein, dan kadar karbohidrat. Tata cara analisis proksimat menggunakan metode AOAC (1995) yang disajikan dalam Lampiran 1.
b. Ekstraksi tepung inulin
4
diperoleh endapan. Endapan yang tersaring dikeringkan menggunakan panas matahari atau mesin pengering sampai bobotnya konstan.
Tepung inulin gembili juga diekstrak menggunakan metode yang dilakukan Susdiana (1997) namun dengan dilakukan modifikasi. Gembili dikeringkan terlebih dahulu dan dibuat menjadi tepung gembili sebelum diekstrak menjadi tepung inulin. Selanjutnya gembili tidak dipanaskan selama 30 menit, melainkan dilarutkan dalam air panas selama 30 menit. Hal ini dikarenakan gembili memiliki getah yang sangat banyak sehingga pada saat mengalami pengecilan ukuran dengan cara diparut, gembili akan menjadi sangat lengket seperti lem, dan ketika dipanaskan akan langsung tergelatinisasi. Selanjutnya dilakukan penyaringan dengan menggunakan kain saring untuk diambil filtratnya. Filtrat yang dihasilkan diukur volumenya, kemudian ditambahkan etanol sebesar 40% dari volume filtrat. Larutan disimpan dalam freezer yang bersuhu ± -10 oC selama ± 18 jam sampai diperoleh endapan. Endapan yang tersaring dikeringkan menggunakan panas matahari atau mesin pengering sampai bobotnya konstan.
Hasil yang diperoleh dari pengeringan berupa tepung inulin. Rendemen dihitung berdasarkan persentase berat tepung inulin yang dihasilkan terhadap berat awal bahan baku dalam basis kering.
n n rat a a a an a a i rin rat t n in in
Setelah diperoleh tepung inulin dari umbi dahlia, gembili, turubuk, dan bonggol pisang, selanjutnya dilakukan pengujian kadar inulin. Kadar inulin diuji menggunakan metode sistein-karbazol yang disajikan pada Lampiran 2. Bahan yang mengandung kadar inulin tertinggi akan digunakan dalam penelitian utama untuk mendapatkan FOS.
c. Produksi enzim inulinase kasar
Tata cara produksi enzim inulinase kasar didasarkan pada metode yang dilakukan oleh Setiawan (2005). Langkah produksi enzim inulinase kasar terdiri dari tiga tahap yaitu penyegaran isolat, propagasi, dan kultivasi. Untuk penyegaran isolat digunakan media agar miring yang berisi potato dextrose agar
(PDA). Pada tahap propagasi, biakan segar yang berumur 5 hari disuspensikan dalam 10 ml garam fisiologis. Suspensi spora kemudian diinokulasikan dalam media fermentasi steril inulin 2% (v/v). Selanjutnya dilakukan proses kultivasi yaitu produksi enzim inulinase menggunakan erlenmeyer dalam waterbath shaker
selama 84 jam pada suhu 37 oC. Selanjutnya dilakukan penyaringan menggunakan corong buchner yang berisi kertas saring Whatman 41 untuk memisahkan produk dengan substrat yang belum terhidrolisis. Enzim kasar yang diperoleh kemudian diuji aktivitas enzimnya menggunakan tata cara yang disajikan pada Lampiran 3. Penelitian utama
a. Hidrolisis inulin menjadi FOS
5 dengan dosis 1; 2; 3; 5; 7,5; dan 10 U/g, dan inulinase kasar dengan dosis enzim 1, 2, dan 3 U/g. Hidrolisis dilakukan dalam waktu 24 jam pada 3 titik waktu hidrolisis (0,25; 12; dan 24 jam) dalam waterbath pada suhu 45 oC. Setiap erlenmeyer berisi 20 ml substrat inulin dan enzim inulinase pada masing-masing dosis dan diambil pada satu titik waktu hidrolisis. Selama proses hidrolisis dilakukan pengambilan produk pada jam ke-0,25; 12; dan 24. Produk yang telah diambil langsung dilakukan pemucatan yaitu menambahkan arang aktif 1,5% (w/v) kemudian dipanaskan pada suhu 80-90°C selama 15 menit. Contoh selanjutnya disaring menggunakan kertas saring. Pemucatan secara langsung ini dimaksudkan untuk menginaktifkan enzim yang mungkin terikut pada produk.
a n i an ita a an i n i ቀ
U
ቁ a trat a ti ita n i U
Jumlah FOS yang dihasilkan dapat dihitung dari kadar inulin awal dikurangi sisa kadar inulin yang ada pada produk akhir hidrolisis. Jumlah FOS ini digunakan untuk mengetahui derajat konversi proses hidrolisis. Tata cara pengujian sisa kadar inulin yang masih terdapat dalam FOS disajikan pada Lampiran 2.
b. Analisis kimia produk hidrolisat inulin
Produk yang dihasilkan dari hidrolisis inulin kemudian dilakukan pengujian yang meliputi nilai gula pereduksi dengan menggunakan metode DNS, kadar total gula dengan metode fenol, dan nilai derajat polimerisasi. Tata cara analisis selengkapnya disajikan pada Lampiran 4.
Data yang diperoleh dari dua kali pengulangan diambil nilai rata-ratanya. Selanjutnya dilakukan plot data dalam grafik pada masing-masing uji (gula pereduksi, total gula, dan derajat polimerisasi) di dalam produk terhadap waktu hidrolisis pada masing-masing dosis enzim.
c. Analisis statistik produk hidrolisat inulin
Analisis statistik produk hidrolisat inulin dilakukan menggunakan software
SPSS 16.0 untuk mengetahui pengaruh dosis enzim pada hidrolisis inulin. Analisis statistik ini dilakukan pada gula pereduksi, total gula, nilai derajat polimerisasi, serta inulin sisa dalam produk hidrolisis.
HASIL DAN PEMBAHASAN
Penelitian Pendahuluan Karakterisasi komposisi kimia bahan baku
6
(1995). Tata cara selengkapnya disajikan pada Lampiran 1. Hasil pengujian proksimat bahan-bahan tersebut disajikan pada Tabel 1.
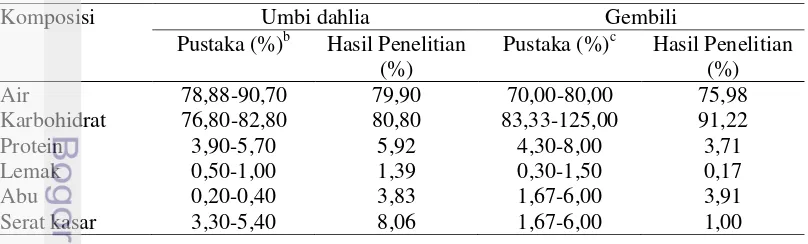
Tabel 1 Komposisi kimia umbi dahlia, gembili, turubuk, dan bonggol pisanga Bahan
Umbi dahlia merupakan cadangan makanan pada tanaman dahlia yang tersimpan pada akarnya. Menurut Vandamme dan Derycke (1983), umbi dahlia banyak mengandung inulin. Umbi akar dahlia mengandung 80% air dan 20% padatan. Padatan ini tersusun oleh kira-kira 85% gula jenis inulin dan bahan berselulosa. Pada Tabel 2 disajikan komposisi kimia umbi dahlia. Kadar serat dan abu penelitian lebih tinggi dibandingkan pustaka yang disebutkan Saryono et al
(1998). Kadar karbohidrat, lemak, dan protein nilainya masih dalam rentang yang disebutkan dalam pustaka.
Gembili merupakan salah satu jenis umbi-umbian yang tumbuh di Asia. Komposisi kimia terbesar pada gembili adalah air kemudian karbohidrat. Karbohidrat pada gembili tersusun atas gula, amilosa, dan amilopektin. Komposisi gula tersusun atas glukosa, fruktosa, dan sukrosa sehingga menyebabkan rasa manis. Produk gembili umumnya memiliki indeks glikemik yang rendah sehingga baik di konsumsi penderita diabetes. Menurut Muchtadi dkk (2010), komposisi kimia umbi gembili disajikan dalam Tabel 2. Secara umum nilai analisis proksimat gembili yang dilakukan dalam penelitian ini hampir sama dengan pustaka yang disebutkan Muchtadi et al (2010).
Tabel 2 Komposisi kimia umbi gembili dan umbi dahliaa
Komposisi Umbi dahlia Gembili
Pustaka (%)b Hasil Penelitian
(%)
Pustaka (%)c Hasil Penelitian
(%)
Air 78,88-90,70 79,90 70,00-80,00 75,98
Karbohidrat 76,80-82,80 80,80 83,33-125,00 91,22
Protein 3,90-5,70 5,92 4,30-8,00 3,71
Sumber: Saryono et al. 1998 c
Sumber: Muchtadi et al. 2010
7 dalam konsentrasi tinggi (Simmonds 1966). Menurut Munadjim (1983), bonggol pisang basah mengandung kurang lebih 11% pati.
Turubuk (Saccharum edule Hassk) atau terubuk merupakan salah satu jenis tanaman yang dijadikan sayuran oleh masyarakat terutama di daerah Jawa Barat. Turubuk merupakan salah satu kerabat dari tebu, oleh karena itu tidak heran jika turubuk memiliki rasa manis.
Hasil pengujian proksimat untuk kadar air terbesar adalah bonggol pisang dan turubuk. Turubuk juga memiliki kadar air yang tinggi, hal tersebut ditunjukkan oleh umur simpan turubuk yang tidak terlalu lama, artinya turubuk mudah busuk selama penyimpanan. Oleh karena itu sebaiknya dalam penanganan bahan dari turubuk harus dilakukan sesegera mungkin sejak bahan tersebut dipanen. Selain itu, semakin besar kadar air maka padatannya akan semakin kecil, sehingga untuk ekstraksi tepung inulin, bahan yang memiliki kadar air besar kemungkinan menghasilkan rendemen tepung inulin menjadi semakin kecil.
Kadar abu menunjukkan kandungan mineral yang ada dalam bahan. Pada hasil proksimat kadar abu tertinggi didapatkan pada turubuk. Hal ini menunjukkan dari keempat bahan yang digunakan, turubuk memiliki kandungan mineral yang paling tinggi. Kadar lemak menunjukkan kandungan minyak atau lemak dalam bahan. Dari keempat bahan yang telah diuji, kadar lemak tertinggi dimiliki oleh turubuk.
Kadar serat kasar akan berpengaruh terhadap kemampuan bahan dicerna tubuh, bahan yang memiliki kadar serat kasar yang tinggi akan cenderung susah dicerna, karena sifat serat pada umumnya tidak dapat dicerna oleh tubuh. Bonggol pisang memiliki kadar serat paling tinggi, hal ini dapat terlihat ketika diparut bahan tersebut terlihat memiliki tekstur berserat.
Pada pengujian kadar protein, prinsipnya adalah pengukuran nitrogen yang dibebaskan oleh bahan. Dari keempat bahan yang diuji, kadar protein tertinggi dimiliki oleh turubuk. Hal ini sesuai dengan pemanfaatannya sebagai sayuran yang memiliki protein tinggi. Kadar portein ini juga menunjukkan daya tahan bahan terhadap kebusukan, bahan-bahan yang memiliki kadar protein tinggi akan segera busuk karena bakteri akan segera tumbuh dalam bahan tersebut. Kadar protein pada turubuk yang tinggi menyebabkan bahan ini juga mudah busuk.
Kadar karbohidrat sangat berpengaruh terhadap ekstraksi tepung inulin, karena inulin merupakan salah satu jenis dari karbohidrat sehingga bahan yang memiliki kadar karbohidrat yang tinggi akan berpotensi baik untuk diekstrak menjadi tepung inulin dibandingkan bahan yang memiliki kadar karbohidrat rendah. Dari tabel hasil uji proksimat diatas, dapat dilihat bahwa kadar karbohidrat tertinggi dimiliki oleh gembili dan umbi dahlia.
Ekstraksi tepung inulin
8
tersebut diekstrak dari tanaman yang segar, dalam rangka pencegahan untuk menghambat aktivitas inulinase tanaman itu sendiri serta hidrolisis secara asam.
Inulin biasanya mengandung minimum 30 unit fruktosa, atau dengan kata lain derajat polimerisasi (DP) seharusnya 30 atau lebih. Derajat polimerisasi ini menyebabkan berat molekul inulin mencapai 5400. Sehubungan dengan beragamnya panjang rantai inulin yang ada, maka berat molekul inulin bervariasi antara 3500 sampai 5500 (Vandamme dan Derycke 1983) .
Dalam ekstraksi tepung inulin, bahan dipanaskan dengan tujuan untuk melarutkan inulin ke dalam cairan, karena inulin larut dalam air panas. Selain itu pada proses pemanasan dengan suhu mencapai 90 oC pati akan tergelatinisasi dan akan menempel pada serat, sehingga pada saat dilakukan penyaringan maka pati akan terikut dengan ampas bukan pada filtrat. Hal ini akan menjadikan tepung inulin yang dihasilkan lebih murni tidak ada campuran pati. Setelah dingin maka inulin akan terdispersi, pada saat itulah etanol ditambahkan untuk mengendapkan inulin yang telah terdispersi tersebut sehingga ketika diendapkan inulin akan terpisah dari filtrat.
Setelah diperoleh tepung inulin maka dilakukan pengukuran massa untuk mengetahui rendemennya. Rendemen dihitung berdasarkan persentase berat kering tepung inulin yang dihasilkan terhadap berat awal bahan baku dalam basis kering. Tepung inulin yang diperoleh dari umbi dahlia, gembili, bonggol pisang, dan turubuk kemudian diuji kadar inulinnya. Hasil perhitungan rendemen dan kadar inulin pada tepung inulin disajikan pada Lampiran 5. Rendemen dan kadar tepung inulin umbi dahlia, gembili, bonggol pisang, dan turubuk dapat dilihat pada Tabel 3.
Pada Tabel 3 dapat dilihat bahwa rendemen tepung inulin tertinggi diperoleh dari hasil ekstraksi umbi dahlia sebesar 48,20%. Hal ini sesuai dengan kandungan karbohidrat umbi dahlia yang tinggi pada pengujian proksimat. Sementara itu, pada turubuk hasil rendemen tepung inulin sangat rendah, hal ini terlihat jelas pada hasil pengujian proksimat bahwa sebagian besar komponen yang terdapat dalam turubuk adalah air dan protein.
Tabel 3 Rendemen tepung inulin dan kadar inulin a
Bahan Rendemen tepung inulin (%) Kadar inulin (%)
Umbi dahlia 48,20 80,09
Modifikasi proses ekstraksi dari Susdiana (1997)
9 tepung inulin sangat mungkin dalam jumlah yang besar karena etanol selain mengendapkan inulin juga dapat mengendapkan protein. Jadi selain inulin, kemungkinan protein yang ada dalam tepung inulin turubuk juga besar. Kadar protein pada bonggol pisang juga tinggi namun tidak lebih besar dari turubuk, kadar inulin yang didapatkan juga lebih tinggi dari kadar inulin turubuk yaitu sebesar 1,16%. Dari hasil ini dipilih satu bahan yang memiliki kadar inulin tertinggi yaitu umbi dahlia untuk produksi FOS pada penelitian utama.
Produksi enzim inulinase kasar
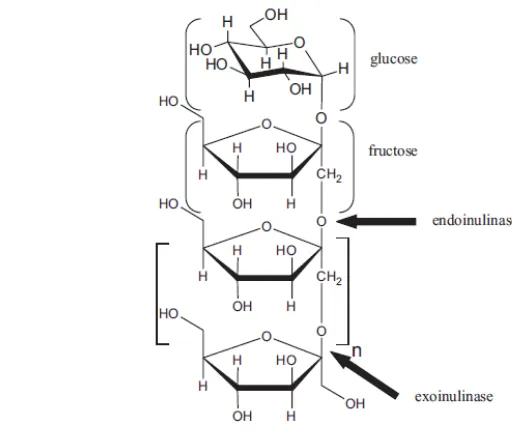
Menurut Singh dan Singh (2010), inulinase dikategorikan menjadi 2 jenis yaitu endoinulinase dan eksoinulinase. Eks in ina t n i atan β-2,1 secara berurutan sehingga menghasilkan fruktosa, sementara endoinulinase memotong secara acak dan menghidrolisis ikatan internal pada inulin sehingga menghasilkan fruktooligosakarida. Inulinase dari fungi secara umum memiliki pola aksi luar (ekso), namun pada Aspergillus niger ditemukan hanya dapat memproduksi endoinulinase ekstraseluler kecuali pada A. niger galur 12 yang dapat memproduksi baik ekso- maupun endoinulinase. Sebagai gambaran, pemutusan ikatan pada inulin oleh inulinase dapat dilihat pada Gambar 1.
Gambar 1 Pola pemutusan ikatan inulin oleh inulinase Sumber : Singh dan Singh (2010)
10
Penelitian Utama Hidrolisis inulin menjadi FOS
Singh dan Singh (2010) menjelaskan bahwa FOS merupakan salah satu kelas dari bifidogenik oligosakarida (oligosakarida yang secara selektif menstimulasi pertumbuhan dan atau aktivitas Bifidobacteria dan Lactobacillus di dalam kolon). FOS terkandung secara alami pada beberapa tanaman seperti
Jerusalem artichoke, bawang, dan pisang. FOS digunakan sebagai pemanis, peningkat aroma, pengembang, dan humektan. Sebagai pengganti sukrosa rendah kalori, FOS digunakan dalam pembuatan kue, roti, permen, produk susu dan beberapa minuman.
Oligofruktosa lebih mudah larut dibanding inulin (sekitar 80% dalam air pada suhu ruang). Ketika murni, oligofruktosa memiliki tingkat kemanisan sekitar 35% dibandingkan sukrosa. Kemanisannya mirip dengan gula, rasanya sangat bersih tanpa adanya efek iritasi pada lidah dan dapat pula menimbulkan aroma buah-buahan. Oligofruktosa menunjukkan stabilitas yang baik selama proses pemasakan seperti perlakuan panas (Gibson dan Roberfroid 1995).
FOS dapat diperoleh dari bahan baku sukrosa maupun inulin. FOS dihasilkan dari sukrosa melalui proses transfruktosilasi dengan menggunakan enzim β-fruktofuranosidase atau juga bisa dihasilkan dari inulin melalui proses hidrolisis menggunakan endoinulinase. FOS yang dihasilkan dari sukrosa tersebut memiliki derajat polimerisasi yang lebih rendah yaitu antara dua sampai empat dibanding FOS dari inulin yang dihidrolisis menggunakan enzim inulinase yaitu antara dua sampai sembilan (Singh dan Singh 2010).
11 menggunakan enzim ini tidak membutuhkan kondisi yang steril dan oksigen terlarut.
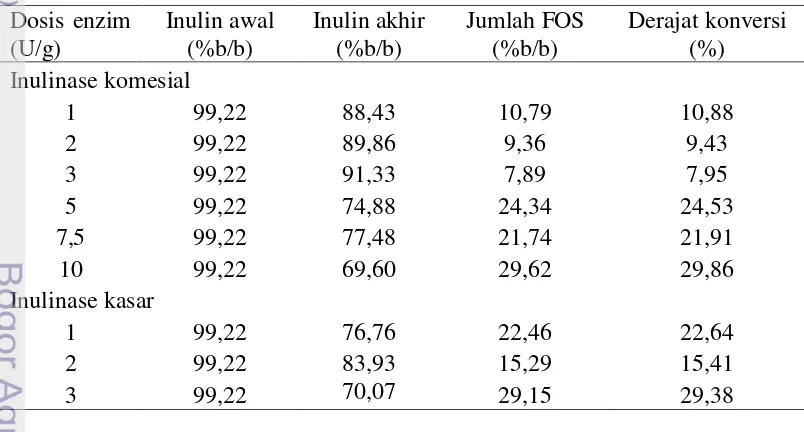
Substrat inulin awal dalam erlenmeyer sebelum dihidrolisis mengandung inulin sebesar 99,22(%b/b) larutan. Substrat ini kemudian akan dihirolisis enzim inulinase sehingga menghasilkan FOS. Jumlah FOS yang dihasilkan dapat dihitung dari kadar inulin yang ada pada produk akhir hidrolisis. Dari jumlah FOS yang dihasilkan oleh inulin tersebut dapat diketahui derajat konversi inulin menjadi FOS, sehingga dapat dilihat apakah dari segi teknologi proses, proses hidrolisis ini sudah maksimal atau belum. Proses hidrolisis dikatakan maksimal apabila derajat konversi mencapai angka 100%, yang mengindikasikan bahwa semua substrat telah diubah menjadi produk oleh enzim. Jumlah FOS yang dihasilkan serta derajat konversi pada proses hidrolisis disajikan pada Tabel 4.
Jumlah FOS yang dihasilkan sangat kecil dalam produk yang dihasilkan dari hidrolisis inulin pada penelitian ini. Pada Tabel 4 dapat dilihat bahwa sisa inulin pada akhir proses hidrolisis masih tinggi jika dibandingkan dengan jumlah inulin yang digunakan pada awal proses hidrolisis, artinya proses hidrolisis inulin menjadi FOS ini belum optimal. Hal ini dapat dilihat dari persentase derajat konversi yang menunjukkan bahwa nilai derajat konversi dalam produksi FOS ini masih belum optimal atau belum mencapai 100%, bahkan masih jauh dari 100%. Pada tabel tersebut dapat dilihat bahwa derajat konversi paling tinggi hanya sebesar 29,86% yang dihasilkan oleh enzim inulinase komersial pada dosis 10 U/g, sementara derajat konversi paling rendah sebesar 7,95% yang dihasilkan oleh enzim inulinase komersial pada dosis 3 U/g. Pola perubahan konversi inulin pada waktu hidrolisis jam ke-0,25; 12; dan 24 pada enzim inulinase komersial dan kasar dapat dilihat pada Gambar 2 dan Gambar 3.
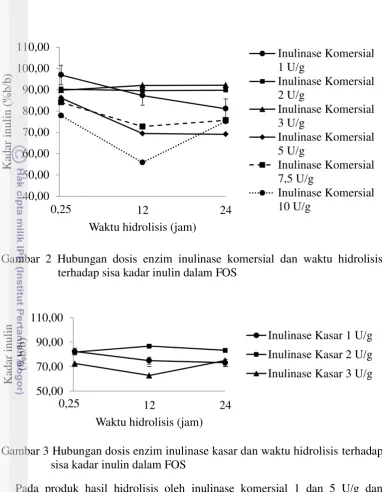
12
Gambar 2 Hubungan dosis enzim inulinase komersial dan waktu hidrolisis terhadap sisa kadar inulin dalam FOS
Gambar 3 Hubungan dosis enzim inulinase kasar dan waktu hidrolisis terhadap sisa kadar inulin dalam FOS
Pada produk hasil hidrolisis oleh inulinase komersial 1 dan 5 U/g dan inulinase kasar 1 U/g, kadar substrat inulin menurun dari awal hidrolisis sebesar 99,22 (%b/b) kemudian menurun waktu hidrolisis pada jam ke-0,25; 12; dan 24. Hal ini mengindikasikan bahwa semakin lama waktu hidrolisis maka jumlah substrat akan menurun karena substrat di konversi menjadi produk oleh enzim. Namun berbeda halnya dengan produk hasil hidrolisis oleh inulinase komersial 2 dan 3 U/g yang mengalami penurunan kadar inulin pada jam ke-0,25 dan cenderung stabil jumlah inulin sampai jam ke-24, berarti pada jam ke-0,25 sampai 24 perubahan inulin menjadi FOS sudah sangat kecil. Hal ini ditunjukkan juga pada Tabel 4 yang memperlihatkan derajat konversi substrat oleh enzim inulinase komersial 2 dan 3 U/g sangat kecil yaitu sebesar 9,43% dan 7,95%.
Pada produk hasil hidrolisis oleh inulinase komersial 7,5 dan 10 U/g serta inulinase kasar 3 U/g kadar inulin menurun sampai waktu hidrolisis jam ke-12, namun mengalami peningkatan sampai jam ke-24. Pada produk hasil hidrolisis oleh inulinase kasar 2 U/g kadar inulin menurun pada jam ke-0,25 lalu meningkat
13 pada jam ke-12 namun menurun kembali pada jam ke-24. Naik turunnya kadar substrat pada produk hasil hidrolisis dapat disebabkan oleh reaksi enzimatis yang bersifat reversible. Artinya enzim bekerja bisa dua arah, enzim bisa menghidrolisis substrat menjadi produk namun pada waktu tertentu enzim justru mensintesis substrat dari produk.
Untuk mengetahui produk yang dikonversi dari inulin merupakan FOS atau bukan FOS dapat dilihat dengan menganalisis derajat polimerisasi dari produk hasil hidrolisis. Derajat polimerisasi ini diperoleh dari pembagian total gula terhadap nilai gula pereduksinya. Jika nilai derajat polimerisasi antara dua sampai sembilan itu menandakan bahwa produk yang terbentuk adalah FOS, sementara jika derajat polimerisasinya 1 berarti produk tersebut adalah fruktosa karena fruktosa merupakan monomer, dan jika derajat polimerisasinya lebih dari 9 berarti produk tersebut adalah inulin.
Analisis kimia produk hidrolisat inulin 1 Gula pereduksi
Gula pereduksi merupakan golongan gula yang dapat mereduksi senyawa ion logam dalam keadaan basa. Monosakarida (glukosa, fruktosa , dan galaktosa) termasuk ke dalam golongan gula pereduksi, beberapa disakarida juga termasuk gula pereduksi yaitu laktosa, maltosa, dan isomaltosa. Gula-gula tersebut memiliki sifat pereduksi karena adanya gugus keton atau aldehida dalam molekul gula tersebut. Gula pereduksi berhubungan dengan aktivitas enzim, semakin tinggi nilai gula pereduksi maka nilai aktivitas enzim juga semakin tinggi (Gusmarwani
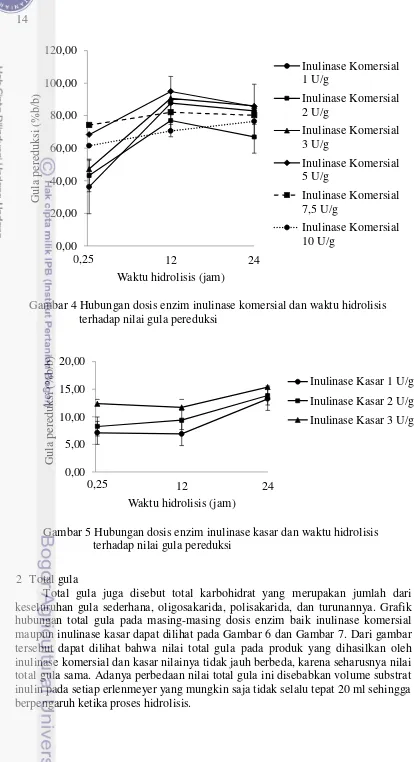
et al. 2010). Grafik hubungan nilai gula pereduksi pada masing-masing dosis enzim baik inulinase komersial maupun inulinase kasar dapat dilihat pada Gambar 4 dan Gambar 5.
14
Gambar 4 Hubungan dosis enzim inulinase komersial dan waktu hidrolisis terhadap nilai gula pereduksi
Gambar 5 Hubungan dosis enzim inulinase kasar dan waktu hidrolisis terhadap nilai gula pereduksi
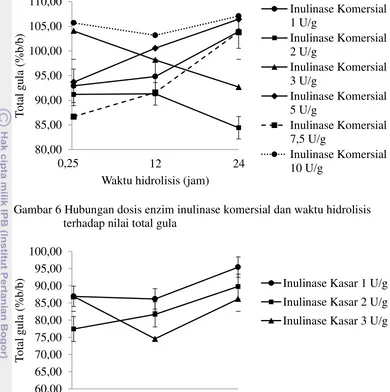
2 Total gula
15
Gambar 6 Hubungan dosis enzim inulinase komersial dan waktu hidrolisis terhadap nilai total gula
Gambar 7 Hubungan dosis enzim inulinase kasar dan waktu hidrolisis terhadap nilai total gula
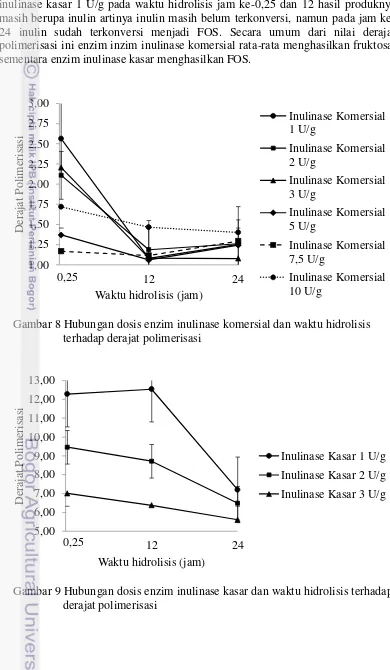
3 Derajat polimerisasi
Derajat polimerisasi adalah jumlah unit monomer pada makro molekul atau molekul oligomer dalam suatu blok atau rantai. Nilai derajat polimerisasi diperoleh dari kadar total gula per kadar gula pereduksi. Nilai derajat polimerisasi menunjukkan bahwa produk yang diuji merupakan FOS atau bukan. Jika nilai derajat polimerisasi antara dua sampai sembilan itu menandakan bahwa produk yang terbentuk adalah FOS. Jika derajat polimerisasinya satu berarti produk tersebut adalah fruktosa. Jika derajat polimerisasinya lebih dari sembilan berarti produk tersebut masih berupa inulin yang belum terhidrolisis. Grafik hubungan derajat polimerisasi pada masing-masing dosis enzim baik inulinase komersial maupun inulinase kasar dapat dilihat pada Gambar 8 dan Gambar 9. Derajat polimerisasi yang menunjukkan bahwa produk yang dihasilkan adalah FOS adalah produk hasil hidrolis oleh enzim inulinase komersial dosis 1; 2; dan 3 U/g
16
pada waktu hidrolisis 0,25 jam, enzim inulinase kasar dosis 1 U/g pada waktu hidrolisis jam ke-24, serta inulinase kasar dosis 2 dan 3 U/g baik pada pada waktu hidrolisis jam ke-0,25; 12; maupun 24. Sementara pada inulinase komersial dosis lain dan waktu hidrolisis lain hasil yang diperoleh adalah fruktosa. Untuk inulinase kasar 1 U/g pada waktu hidrolisis jam ke-0,25 dan 12 hasil produknya masih berupa inulin artinya inulin masih belum terkonversi, namun pada jam ke-24 inulin sudah terkonversi menjadi FOS. Secara umum dari nilai derajat polimerisasi ini enzim inzim inulinase komersial rata-rata menghasilkan fruktosa, sementara enzim inulinase kasar menghasilkan FOS.
Gambar 8 Hubungan dosis enzim inulinase komersial dan waktu hidrolisis terhadap derajat polimerisasi
17 Analisis statistik produk hidrolisat inulin
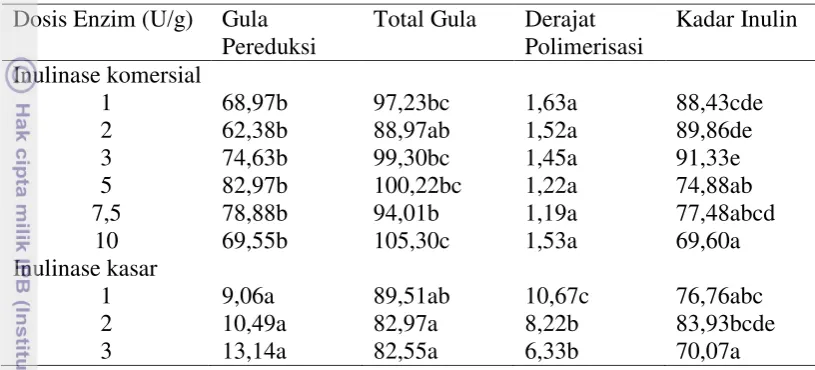
Untuk mengetahui pengaruh perlakuan dosis dan jenis enzim maka dilakukan analisis statistik terhadap produk yang dihasilkan dari proses hidrolisis inulin. Pengujian statistik ini menggunakan software SPSS 16.0, hasil analisisnya disajikan pada Tabel 5.
Tabel 5 Analisis statistik produk hidrolisat inulin Dosis Enzim (U/g) Gula
Angka-angka pada kolom yang sama yang diikuti huruf yang sama tidak berbeda signifikan pada taraf uji 5%
Pada kolom gula pereduksi terlihat jelas perbedaan antara enzim inulinase komersial dengan enzim inulinase kasar pada taraf uji 5%. Enzim inulinase komersial berbeda signifikan dengan enzim inulinase kasar pada semua dosis enzim. Nilai rata-rata tertinggi gula pereduksi pada FOS dihasilkan oleh inulinase komersial dosis 5 U/g yaitu sebesar 82,97 (%b/b), sementara rata-rata nilai gula pereduksi terendah dihasilkan oleh enzim inulinase kasar dengan dosis 1 U/gr sebesar 9,06 (%b/b). Artinya aktivitas enzim tertinggi ditunjukkan oleh enzim inulinase komersial dosis 5 U/g sementara aktivitas enzim tertinggi ditunjukkan oleh enzim inulinase kasar dosis 1 U/gr.
Pada kolom total gula enzim inulinase komersial dengan dosis 2 U/g tidak berbeda signifikan dengan enzim inulinase kasar pada dosis 1; 2; dan 3 U/g, namun berbeda signifikan dengan inulinase komersial dosis 1; 3; 5; 7,5; dan 10 U/g. Untuk total gula yang diuji pada FOS, nilai rata-rata tertinggi dihasilkan enzim inulinase komersial dosis 10 U/g sebesar 105,30 (%b/b), sementara rata-rata terendah dihasilkan enzim inulinase kasar dosis 3 U/g sebesar 82,55 (%b/b). Secara umum nilai total gula pada masing-masing dosis enzim baik inulinase komersial maupun inulinase kasar tidak jauh berbeda nilainya.
18
menunjukkan hasil yang diperoleh masih berupa inulin yang belum terkonversi menjadi FOS, sementara inulinase kasar 2 dan 3 U/g menunjukkan hasil yang diperoleh adalah FOS.
Kadar inulin yang terdapat pada produk hasil hidrolisis untuk enzim inulinase tidak berbeda signifikan baik pada enzim inulinase komersial maupun enzim inulinase kasar. Nilai rata-rata tertinggi sisa kadar inulin dihasilkan oleh enzim inulinase komersial dosis 2 U/g sebesar 89,86 (%b/b), sementara rata-rata terendah dihasilkan enzim inulinase komersial dosis 10 U/g sebesar 69,60 (%b/b).
SIMPULAN DAN SARAN
Simpulan
Umbi dahlia berdasarkan hasil penelitian pendahuluan memiliki rendemen tepung inulin tertinggi yaitu sebesar 48,20% dibandingkan dengan gembili, bonggol pisang, dan turubuk. Kadar inulin yang diperoleh dari umbi dahlia, gembili, bonggol pisang, dan turubuk masing-masing 80,09%; 4,02%; 1,16%; 0,23%. Enzim inulinase kasar yang dihasilkan dalam penelitian ini nilai aktivitasnya sebesar 0,76 U/ml.
Derajat konversi hidrolisis inulin paling tinggi sebesar 29,86% yang dihasilkan oleh enzim inulinase komersial dengan dosis 10 U/g, sementara derajat konversi paling rendah sebesar 7,95% yang dihasilkan oleh enzim inulinase komersial dengan dosis 3 U/g. Pada hidrolisis inulin menggunakan inulinase komersial rata-rata produk yang terbentuk sebagian besar adalah fruktosa. Pada hidrolisis inulin menggunakan inulinase kasar rata-rata produk yang terbentuk sebagian besar adalah FOS.
Saran
Perlu dilakukan hidrolisis inulin menggunakan inulinase komersial dibawah dosis 1 U/g dan waktu hirolisis antara 0 sampai 15 menit.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemistry. 1995. Official Method of Analysis of the Association of Official Analytical Chemistry. Washington DC (USA):AOAC.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati, dan Budiyanto S. 1989. Analisa Pangan. Bogor (ID):IPB Press
19 Gibson GR, Roberfroid MB. 1995. Dietary modulation of the human colonic
microbiota : Introducing The Concept of Prebiotics. J Nutrition 25:1401-1412.
Gusmarwani SR, Budi MSP, Sediawan WB, Hidayat M. 2010. Pengaruh perbandingan berat padatan dan waktu reaksi terhadap gula pereduksi terbentuk pada hidrolisis bonggol pisang. J Teknik Kimia Indonesia (9):77-82.
Kierstan MPJ. 1978. Biotechnology and Bioengineering 20:447-450. New York(USA): John Wiley&Sons.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem. 31(3):426-428.doi: 10.1021/ac60147a030. Muchtadi TR, Sugiono, Ayustaningwarno F. 2010. Ilmu Pengetahuan Bahan
Pangan. Bogor(ID):Alfabeta.
Munadjim, 1983. Teknologi Pengolahan Pisang. Jakarta(ID):Gramedia Pustaka. Saryono. 2008. Isolasi dan karakterisasi inulinase dari Aspergillus niger Gmn 11.1
galur lokal. J Natur Indonesia 11(1):19-23.
Saryono, Chainulfiffah, Devi S, Monalisa, Dasli. 1998. Pemanfaatan umbi Dahlia variabilis untuk produksi sirup fruktosa (HFS) dan fruktooligosarida (FOS).
Seminar Nasional PBBMI XIV, Bandung.
Singh RS, Singh RP. 2010. Production of fructooligosaccharides from inulin by endoinulinases and their prebiotic potential. J Food Technol. 48(4):435-450. Setiawan A. 2005. Pengaruh aerasi dan agitasi pada proses produksi enzim inulinase kasar dari Aspergillus niger [skripsi]. Bogor(ID):Institut Pertanian Bogor.
Simmonds NW. 1966. Bananas. London(GB):Longman Group Limited.
Sirisansaneeyakul S, Lertsiri S, Tonsagunrathanachai P, Luangpituksa P. 2000. Enzymatic production of fructo-oligosaccharides from sucrose. J Kasetsart
(Nat. Sci)34:262-269.
Steinbüchel A, Sang KR. 2005. Polysaccharides and Polyamides in the Food Industry : Volume 1. Münster(DE): Wiley-VHC.
Susdiana Y. 1997. Ekstraksi dan karakterisasi inulin dari umbi dahlia (Dahlia pinnata cav.) [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Winarti S, Harmayani E, Nurismanto R. 2011. Karakteristik dan profil inulin beberapa jenis uwi (Dioscorea spp). J Agritech. 31(4):378.
20
LAMPIRAN
Lampiran 1 Tata cara analisis proksimat bahan baku 1.1 Kadar air (AOAC 1995)
Pinggan alumunium dipanaskan pada suhu 105 oC, kemudian didinginkan di dalam desikator dan ditimbang beratnya. Lebih kurang 2 gram contoh dimasukkan di dalam pinggan alumunium dan dipanaskan di dalam oven pada suhu 105 oC selama 1 jam (pengukuran 1 jam dimulai ketika suhu oven tepat 105 oC ). Setelah itu pinggan cepat-cepat dimasukkan di dalam desikator dan ditimbang setelah mencapai suhu kamar. Pemanasan diulang hingga diperoleh berat konstan. Sisa contoh dihitung sebagai total padatan dan berat yang hilang sebagai kadar air. Kadar air dihitung dengan rumus :
a ar air rat a a nt rat a ir nt rat a a nt
1.2 Kadar abu (AOAC 1995)
Abu dalam bahan pangan ditetapkan dengan menimbang sisa mineral sebagai hasil pembakaran bahan organik pada suhu sekitar 550 °C. Penentuan dilakukan dengan memanaskan cawan porselin di dalam tanur, didinginkan di dalam desikator dan secepatnya ditimbang setelah dicapai suhu kamar. Contoh sekitar 2-3 gram ditimbang di dalam cawan kemudian dibakar di dalam tanur pada suhu 550 °C hingga abu berwarna kelabu atau beratnya konstan, didinginkan di dalam desikator dan ditimbang secepatnya setelah mencapai suhu kamar. Kadar abu dihitung dengan rumusan sebagai berikut :
a ar a rat nt rat a
1.3 Kadar protein (AOAC 1995)
Contoh seberat satu gram didekstruksi dengan 5 ml asam sulfat pekat dengan katalisator CuSO4 sampai berwarna hijau jernih. Destilasi dilakukan setelah ditambahkan 5 ml air suling dan 15 ml NaOH 50%. Sebagai penampung digunakan 25 ml asam sulfat 0,02 N dan 2-3 tetes indikator mengsel. Hasil destilasi dititrasi dengan larutan NaOH 0,02 N. Tata cara blanko ditentukan seperti diatas tanpa menggunakan bahan yang dianalisis. Kadar protein dihitung dengan rumus sebagai berikut :
a ar r t in a nt
21 1.4 Kadar lemak (AOAC 1995)
Contoh sebanyak 3 gram dimasukkan ke dalam kertas saring yang dibuat seperti kantong. Kemudian dimasukkan ke dalam soxhlet dan diekstraksi selama 6 jam dengan menggunakan petroleum benzene. Sebelumnya labu lemak dan batu didih dikeringkan di dalam oven 105 – 110 oC selama 1 jam, didinginkan dalam desikator dan ditimbang. Setelah ekstraksi cukup, pelarut dalam labu lemak diuapkan sampai habis lalu didinginkan dalam desikator dan ditimbang sampai diperoleh berat yang konstan. Kadar lemak dihitung dengan rumus sebagai berikut :
a ar a aa
a = berat contoh
c = berat labu dan batu didih setelah diekstraksi 1.5 Kadar serat kasar (AOAC 1995)
Prinsip uji ini adalah ekstraksi contoh dengan asam dan basa untuk memisahkan serat kasar dari bahan lain. Sebanyak 2-4 gram sampel (a) ditimbang dan dibebaskan lemaknya dengan cara ekstraksi menggunakan soxhlet atau dengan cara mengaduk-mengendap-tuangkan sampel dalam pelarut organik sebanyak 3 kali. Sampel dikeringkan dan dimasukkan ke dalam erlenmeyer 500 ml. Ditambahkan 50 ml larutan H2SO4 1,25%, kemudian dididihkan selama 30 menit dengan menggunakan pendingin tegak. Selanjutnya ditambahkan 50 ml NaOH 3,25% dan dididihkan lagi selama 30 menit. Dalam keadaan paas, sampel disaring menggunakan corong bunchner yang berisi kertas saring Whatman 41 yang telah dikeringkan dan diketahui bobotnya. Endapan yang terdapat pada kertas saring berturut-turut dicuci menggunakan H2SO4 1,25% panas, air panas, dan etanol 96%. Kertas saring beserta isinya diangkat, dikeringkan dalam oven suhu 105 oC, didinginkan, dan ditimbang sampai bobot tetap (b).
a ar rat a ar a
a = Bobot sampel (g)
b = Bobot endapan pada kertas saring (g) 1.6 Kadar karbohidrat (AOAC 1995)
Kadar karbohidrat diperoleh dengan metode by difference artinya semua uji proksimat dalam basis basah dijumlahkan kemudian ditambahkan kadar karbohidrat hingga hasilnya mencapai 100%.
a ar ar i rat a ar air a a rat a ar r t in
Lampiran 2 Tata cara pengujian kadar inulin
2.1 Kadar inulin metode sistein-karbazol (Kierstan 1978)
22
ditambah 0,2 ml sistein 1,5%, kemudian ditambahkan 6 ml H2SO4 70% dan dikocok. Campuran kemudian ditambah 0,2 ml karbazol 0,12% dalam larutan etanol. Campuran dipanaskan pada suhu 60 oC selama 10 menit kemudian didinginkan dan diukur kadar inulinnya menggunakan spektrofotometer dengan panjang gelombang 560 nm. Kurva standar dibuat dengan menggunakan inulin dengan kisaran 0-30 mg/l.
Grafik kurva standar inulin
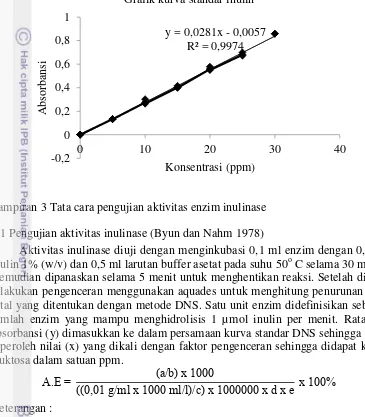
Lampiran 3 Tata cara pengujian aktivitas enzim inulinase 3.1 Pengujian aktivitas inulinase (Byun dan Nahm 1978)
Aktivitas inulinase diuji dengan menginkubasi 0,1 ml enzim dengan 0,4 ml inulin 1% (w/v) dan 0,5 ml larutan buffer asetat pada suhu 50o C selama 30 menit. Kemudian dipanaskan selama 5 menit untuk menghentikan reaksi. Setelah dingin dilakukan pengenceran menggunakan aquades untuk menghitung penurunan gula total yang ditentukan dengan metode DNS. Satu unit enzim didefinisikan sebagai jumlah enzim yang mampu menghidrolisis 1 µmol inulin per menit. Rata-rata absorbansi (y) dimasukkan ke dalam persamaan kurva standar DNS sehingga akan diperoleh nilai (x) yang dikali dengan faktor pengenceran sehingga didapat kadar fruktosa dalam satuan ppm.
c = BM inulin rata-rata (2500 g/mol) d = Waktu inkubasi (30 menit)
e = Jumlah enzim yang ditambahkan (0,1 ml)
Lampiran 4 Tata cara pengujian produk hidrolisat inulin 4.1 Kadar gula pereduksi metode DNS (Miller 1959)
23 dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 3 ml pereaksi DNS. Selanjutnya ditempatkan dalam air mendidih selama 5 menit, dibiarkan dingin sampai suhu ruang. Kemudian dibaca menggunakan spektrofotometer dengan absorbasi pada panjang gelombang 550 nm. Blanko yang digunakan adalah aquades. Kurva standar dibuat dengan menggunakan larutan fruktosa standar dengan kisaran 0-300 mg/l.
Grafik kurva standar DNS
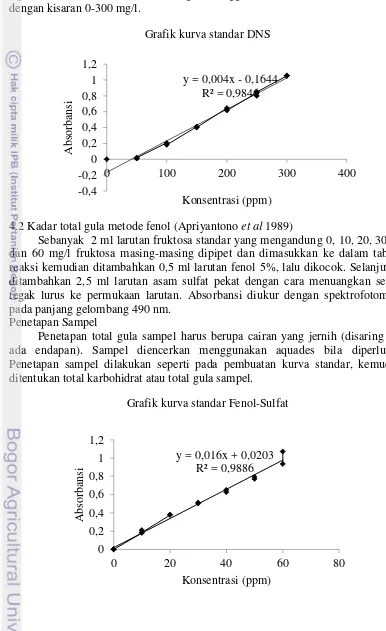
4.2 Kadar total gula metode fenol (Apriyantono et al 1989)
Sebanyak 2 ml larutan fruktosa standar yang mengandung 0, 10, 20, 30, 40 dan 60 mg/l fruktosa masing-masing dipipet dan dimasukkan ke dalam tabung reaksi kemudian ditambahkan 0,5 ml larutan fenol 5%, lalu dikocok. Selanjutnya ditambahkan 2,5 ml larutan asam sulfat pekat dengan cara menuangkan secara tegak lurus ke permukaan larutan. Absorbansi diukur dengan spektrofotometer pada panjang gelombang 490 nm.
Penetapan Sampel
Penetapan total gula sampel harus berupa cairan yang jernih (disaring jika ada endapan). Sampel diencerkan menggunakan aquades bila diperlukan. Penetapan sampel dilakukan seperti pada pembuatan kurva standar, kemudian ditentukan total karbohidrat atau total gula sampel.
24
4.3 Derajat Polimerisasi (Apriyantono et al 1989)
Nilai derajat polimerisasi ditentukan setelah mengukur nilai gula pereduksi, karena derajat polimerisasi diperoleh dengan membagi nilai total gula terhadap nilai gula pereduksi.
ra at i ri a i a r i t ta a
Lampiran 5 Hasil perhitungan rendemen dan kadar inulin tepung inulin 5.1 Rendemen tepung inulina
Bahan Umbi dahlia Gembili Bonggol
pisang
turubuk
Berat awal basah (g) 2.470 1.700 1.750 5.750
Kadar air (%) 79,90 75,95 91,22 90,20
Berat awal kering (g) 122,89 70,77 199,32 586,73
Berat tepung inulin (g) 59,22 28,85 6,13 5,16
Rendemen 48,20 40,77 3,07 0,88
a
Basis kering
n n rat a a rin a an a rat t n in in
5.2 Kadar inulin tepung inulin Bahan
Nilai absorbansi 1
Nilai
absorbansi 2 Rata-rata
Faktor pengenceran
Kadar inulin (% b/b)
Umbi Dahlia 0,441 0,446 0,4435 2500 80,09
Gembili 0,095 0,120 0,1075 500 4,02
Bonggol Pisang 0,790 0,825 0,8075 20 1,16
Turubuk 0,624 0,660 0,642 5 0,23
a ar in in ata rata a r an i a t r n n ran
Larutan inulin yang diukur absorbansinya adalah inulin 5% (b/v) atau 5 g/100ml
a ar in in a ar in in
Lampiran 6 Analisis statistik karakterisasi FOS 6.1 Gula pereduksi
SS df MS F Sig.
Perlakuan 23921,72 8 2990,22 13,72* 0.000
Galat 3922,03 18 217,89
25 Dosis enzim
(U/g) N
Subset for alpha = 0,05
1 2
1* 3 9,06
2* 3 10,49
3* 3 13,14
2 3 62,38
1 3 68,97
10 3 69,55
3 3 74,63
7,5 3 78,88
5 3 82,97
Sig. 0,75 0,15
*Enzim inulinase kasar
6.2 Total gula
SS df MS F Sig.
Perlakuan 1464,38 8 183,05 5,17* 0.002
Galat 637,94 18 35,44
Total 2102,32 26
Dosis enzim
(U/g) N
Subset for alpha = 0,05
1 2 3
3* 3 82,55
2* 3 82,97
2 3 88,97 88,97
1* 3 89,51 89,51
7,5 3 94,01
1 3 97,22 97,22
3 3 98,30 98,30
5 3 10,02 10,02
10 3 10,53
Sig. 0,21 0,05 0,14
*Enzim inulinase kasar
6.3 Derajat polimerisasi
SS df MS F Sig.
Perlakuan 321,53 8 40,19 27,10* 0,000
Galat 26,69 18 1,48
26
Dosis enzim
(U/g) N
Subset for alpha = 0,05
1 2 3
7,5 3 1,19
5 3 1,22
3 3 1,46
2 3 1,52
10 3 1,53
1 3 1,63
3* 3 6,33
2* 3 8,220
1* 3 10,67
Sig. 0,70 0,07 1,00
*Enzim inulinase kasar
6.4 Kadar inulin
SS df MS F Sig.
Perlakuan 1684,12 8 210,51 4,59* 0,003
Galat 825,40 18 45,86
Total 2509,52 26
Dosis enzim
(U/g) N
Subset for alpha = 0.05
1 2 3 4 5
10 3 69,60
3* 3 70,07
5 3 74,88 74,88
1* 3 76,77 76,77 76,77
7,5 3 77,48 77,48 77,48 77,48
2* 3 83,93 83,93 83,93 83,93
1 3 88,43 88,43 88,43
3 3 89,86 89,86
2 3 91,33
Sig. 0,22 0,15 0,07 0,05 0,23
27
RIWAYAT HIDUP
Penulis dilahirkan di Kota Temanggung pada tanggal 28 Agustus 1991 dari ayah Suroto dan ibu Warminah, dan merupakan anak kedua dari dua bersaudara. Penulis yang berdarah Jawa ini menempuh studi di SDN Congkrang 1997-2003, SMPN 1 Ngadirejo 2003-2006, SMAN 1 Parakan 2006-2009, dan diterima sebagai mahasiswa Departemen Teknologi Industri Pertanian IPB pada tahun 2009 melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjalani perkuliahan, penulis aktif dalam Himpunan Mahasiswa Teknologi Industri (HIMALOGIN) sebagai anggota departemen pengabdian masyarakat pada tahun 2010-2012. Selain itu penulis juga aktif dalam berbagai kepanitiaan salah satunya adalah sebagai bendahara acara One STEP yang diselenggarakan RAMP-IPB pada tahun 2010. Selain aktif dalam organisasi, penulis juga aktif dalam akademik yaitu menjadi asisten praktikum Teknologi Pati, gula, dan sukrokimia pada tahun 2013 dan Pengawasan Mutu pada tahun yang sama. Penulis juga mendapatkan dana dari PKM-GT yang dilaksanakan oleh DIKTI dengan “P n ra an T n i i fi t r a ai S i P n n alian