TRANSFORMASI GENETIK Nicotiana benthamiana L.
DAN KEDELAI DENGAN GEN MaMt2
PENYANDI METALLOTHIONEIN TIPE II
DARI Melastoma malabathricum L.
YUSTINUS ULUNG ANGGRAITO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Transformasi Genetik Nicotiana benthamiana L. dan Kedelai dengan gen MaMt2 Penyandi Metallothionein Tipe II dari Melastoma malabathricum L. adalah karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan, maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2012
ABSTRACT
YUSTINUS ULUNG ANGGRAITO. Genetic Transformation of Nicotiana benthamiana L. and Soybean with MaMt2 Gene Encoding Metallothionein Type II from Melastoma malabathricum L. Supervised by SUHARSONO, SAPTOWO J. PARDAL, and DIDY SOPANDIE.
The low pH and high concentration of aluminum (Al) are major limiting factors for crops production. The capability of crops to cope those stresses can be improved by expressing genes controlling adaptation to low pH and high concentration of Al. One of these genes was MaMt2 encoding for metallothionein type II which isolated from Melastoma malabathricum. The objectives of the research were 1) to construct overexpression vector of MaMt2 gene with pIG6 plasmid, 2) to transform Nicotiana benthamiana and soybean with MaMt2 gene, and to analyze the transgenic plants. The MaMt2 gene were successfully fused with the strong promoter pUbiquitin in the pIG6 plasmid, and the recombinant plasmid was introduced into Escherichia coli DH5α by electroporation method. The pIG6-MaMt2 recombinant vector was successfully introduced into A. tumefaciens LBA4404 by triparental mating method (TPM). Genetic transformation was performed by co-cultivating A. tumefaciens LBA4404-pIG6-MaMt2 with N. benthamiana leaf explants and half seed explants of soybean cv. Lumut. The T0 and T1 generations of transgenic plants were already obtained. The integration of MaMt2 transgene into the genom of T0 transgenic plants was confirmed by PCR. Segregation analysis in the T1 generation of N. benthamiana showed that hpt gene was inherited to the offspring in Mendelian pattern and all samples of transgenic plants were heterozygote containing one functional hpt gene. Transformation of cv. Lumut half seed explants with MaMt2 gene was succesful, based on PCR by UbiF and NosTR primer combination. PCR analysis of T1 generation of transgenic soybean showed that MaMt2 gene was transmitted into the offspring indicating that this transgene is integrated in the genome of transgenic soybean plants.
RINGKASAN
YUSTINUS ULUNG ANGGRAITO. Transformasi Genetik Nicotiana benthamiana L. dan Kedelai dengan Gen MaMt2 Penyandi Metallothionein Tipe II dari Melastoma malabathricum L. Dibimbing oleh SUHARSONO, SAPTOWO J. PARDAL, dan DIDY SOPANDIE.
Cekaman pH rendah dan kandungan aluminium yang tinggi pada tanah masam, khususnya tanah Ultisol, merupakan faktor-faktor pembatas produksi dan kualitas tanaman pangan. Kemampuan beberapa tanaman pangan penting dalam mengatasi toksisitas logam dapat ditingkatkan dengan cara mengekspresikan gen-gen yang terkait dengan toleransi pH rendah dan aluminium (Al) tinggi. Melastoma malabathricum merupakan salah satu tanaman yang mampu hidup di tanah ber- pH rendah dan kelarutan Al tinggi. Sejumlah gen yang ekspresinya diinduksi oleh cekaman pH rendah dan aluminium tinggi pada M. malabathricum sebagian sudah berhasil diisolasi dan dikarakterisasi. Salah satu gen tersebut adalah gen MaMt2 yang menyandi metallothionein tipe II. Protein ini banyak mengandung sistein yang mampu mengikat berbagai macam logam. Penelitian ini bertujuan untuk mengkonstruksi vektor ekspresi berlebih gen MaMt2 menggunakan plasmid pIG6, mentransformasi tanaman Nicotiana benthamiana dan kedelai dengan gen MaMt2, dan menganalisis tanaman transgenik secara molekular.
Gen MaMt2 diisolasi dari plasmid pGEMT-Easy yang mengandung sisipan gen MaMt2 dengan teknik PCR. Gen MaMt2 kemudian dipotong dengan enzim restriksi BamH1 dan Spe1, kemudian diligasikan ke dalam situs pengklonan ganda pada plasmid pIG6 yang sudah dipotong dengan enzim restriksi yang sama. Plasmid rekombinan pIG6-MaMt2 selanjutnya dimasukkan ke dalam bakteri Escherichia coli DH5α dengan metode elektroporasi. Vektor rekombinan pIG6-MaMt2 diintroduksikan ke dalam A. tumefaciens LBA4404 menggunakan metode triparental mating (TPM), dengan bantuan E. coli DH1 yang membawa plasmid pembantu pRK2013. Transformasi genetik N. benthamiana dan kedelai dilakukan dengan kokultivasi menggunakan eksplan potongan daun untuk N. benthamiana dan eksplan setengah biji untuk kedelai. Keberhasilan setiap tahap penelitian diperiksa melalui PCR. Keberadaan gen hptII, diperiksa dengan menggunakan primer-primer spesifik hptIIF dan hptIIR, sedangkan keberadaan gen MaMt2 diperiksa dengan menggunakan kombinasi primer spesifik UbiF-SM2UR dan UbiF-NosTR.
Gen MaMt2 telah berhasil difusikan dengan promoter Ubiquitin dengan penyisipan ke dalam situs BamHI-SpeI dari pIG6 yang kemudian disebut dengan pIG6-MaMt2. Plasmid rekombinan ini telah berhasil dimasukkan ke dalam E. coli DH5α. Keberhasilan penyisipan gen MaMt2 dibuktikan dengan hasil PCR terhadap hasil ligasi antara plasmid pIG6 dengan gen MaMt2 yang ada di dalam E. coli DH5α menggunakan kombinasi primer UbiF-SMt2UR dan menghasilkan fragmen berukuran 960 pb. PCR dengan kombinasi primer UbiF-NosT menghasilkan fragmen berukuran 1160 pb.
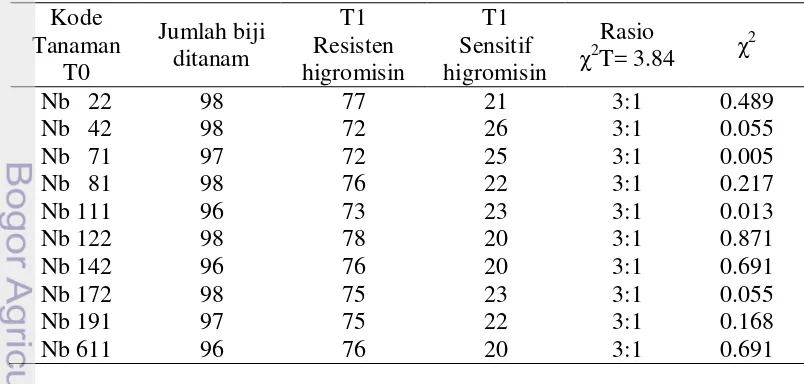
UbiF- SMt2UR dan UbiF-NosTR, masing-masing menghasilkan fragmen DNA berukuran 960 pb dan 1160 pb. Ukuran fragmen-fragmen ini sama dengan ukuran sisipan di dalam vektor rekombinan pIG6-MaMt2 yang ada dalam E. coli DH5α. Efisiensi transformasi N. benthamiana berdasarkan jumlah eksplan yang mampu menghasilkan menghasilkan tunas pada pada medium seleksi II sebesar 79.03%. Uji integrasi gen MaMt2 pada genom N. benthamiana generasi T0 dengan PCR menunjukkan bahwa 16 tanaman adalah transgenik yang mengandung gen MaMt2. Uji resistensi tanaman N. benthamiana T1 terhadap higromisin menunjukkan bahwa gen hpt diwariskan ke generasi berikutnya mengikuti pewarisan Mendel dengan perbandingan 3 resisten: 1 sensitif. Pola ini menunjukkan bahwa tanaman transgenik T0 adalah heterozigot dan mengandung satu gen hpt fungsional.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
TRANSFORMASI GENETIK Nicotiana benthamiana L.
DAN KEDELAI DENGAN GEN MaMt2
PENYANDI METALLOTHIONEIN TIPE II
DARI Melastoma malabathricum L.
YUSTINUS ULUNG ANGGRAITO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi Ujian Tertutup: Tanggal 24 Januari 2012 1. Dr. Ir. Miftahudin 2. Dr. Ir. Nurul Khumaida Penguji Luar Komisi Ujian Terbuka: Tanggal 30 Januari 2012
1. Dr. Ir. Muhamad Yunus, M.Si.
Judul Disertasi: Transformasi Genetik Nicotiana benthamiana L. dan Kedelai dengan Gen MaMt2 Penyandi Metallothionein Tipe II dari Melastoma malabathricum L.
Nama : Yustinus Ulung Anggraito NIM : G361060071
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Suharsono, DEA. Ketua
Dr. Saptowo J. Pardal, M.S. Prof. Dr. Ir. Didy Sopandie, M.Agr.
Anggota Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi Solihin, DEA Dr. Ir. Dahrul Syah, MSc.Agr.
PRAKATA
Puji syukur penulis panjatkan kepada Allah yang Maha Pemurah atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema penelitian yang dilaksanakan sejak bulan April 2008 sampai September 2011 ini ialah cekaman pH rendah dan aluminium, dengan judul Transformasi Genetik Nicotiana benthamiana L. dan Kedelai dengan Gen MaMt2 Penyandi Metallothionein Tipe II dari Melastoma malabathricum L. Penelitian ini dilakukan dalam dua tahap. Tahap pertama, konstruksi vektor ekspresi dilakukan di Laboratorium Gene Research Center, College of Agriculture Ibaraki University Japan. Tahap kedua, transformasi genetik Nicotiana benthamiana dan Kedelai dilakukan di Laboratorium Biotechnology Research Indonesia-The Netherland (BIORIN) dan Laboratorium Biologi Molekular dan Selular Tanaman (BMST) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB Bogor.
Kepada Rektor, Dekan FMIPA, Ketua Jurusan Biologi Universitas Negeri Semarang, atas izin tugas belajar yang diberikan kepada penulis untuk melanjutkan studi di Sekolah Pascasarjana IPB Bogor; Rektor, Dekan Sekolah Pascasarjana, Dekan FMIPA, Ketua Departemen Biologi, Ketua Program Biologi SPs IPB Bogor penulis mengucapkan terima kasih atas kesempatan yang diberikan untuk mengikuti pendidikan di SPs IPB Bogor. Penulis juga mengucapkan terima kasih kepada seluruh staf pengajar dan administrasi SPs IPB dan Departemen Biologi atas ilmu dan bantuan administrasi yang diberikan.
Penulis juga menyampaikan terima kasih kepada rekan-rekan di Lab. BIORIN, Lab. BMST, dan semua staf PPSHB IPB Bogor atas segala bantuan, dukungan semangat dan doa, serta persahabatan selama penulis melakukan penelitian. Masih banyak pihak yang telah membantu kelancaran penelitian, namun tidak dapat penulis sebutkan satu per satu, untuk itu penulis juga mengucapkan terima kasih.
Ucapan terima kasih juga disampaikan kepada istriku Vita dan anak-anakku (Aga, Asti, dan Abi), serta seluruh keluarga besar Y. Soetiarto dan Y. Soemadi Soerowiyoto atas segala doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
RIWAYAT HIDUP
Penulis dilahirkan di Brebes pada tanggal 27 April 1964 sebagai anak ke-4 dari pasangan Johanes Soetiarto dan Yustina Sutini. Pendidikan sarjana ditempuh di Jurusan Pendidikan Biologi IKIP Semarang, lulus pada tahun 1988. Pada tahun 1998 penulis menamatkan studi S2 di Program Studi Biologi Sekolah Pascasarjana UGM Yogyakarta. Pada tahun 2006 mendapatkan beasiswa BPPS dari Departemen Pendidikan Republik Indonesia untuk melanjutkan studi S3 di Program Studi Biologi Program Pascasarjana IPB Bogor.
Penulis bekerja sebagai pengajar di Jurusan Biologi Universitas Negeri Semarang sejak tahun 1990 hingga sekarang. Mata kuliah yang menjadi tanggung jawab penulis adalah Genetika Dasar dan Biologi Molekular.
DAFTAR ISI
Gen-Gen yang Ekspresinya Diinduksi oleh Cekaman Aluminium …… 10
Cekaman Logam dan Metallothionein ………... 11
Metallothionein pada Tumbuhan, Yeast, dan Bakteri……….. 12
Metallothionein pada Hewan dan Manusia ……… 17
Transformasi Diperantarai Agrobacterium ………..………. 20
Mekanisme Transfer DNA-T ke Sel Tanaman ………... 23
Seleksi terhadap Sel Tanaman Transgenik ………. 25
Transformasi Kedelai Diperantarai Agrobacterium tumefaciens……… 26
Rekayasa Genetik Kedelai ……….. 27
BAHAN DAN METODE Waktu dan Tempat Penelitian ………. 29
Bahan Penelitian ………. 29
Metode Penelitian……… 30
HASIL DAN PEMBAHASAN Konstruksi Vektor Ekspresi pIG6-MaMt2………... 38
Introduksi vektor ekspresi ke dalam A. tumefaciensLBA4404 ….. 39
Perakitan N. benthamianadan Kedelai Transgenik ……… 40
Transformasi genetik N. benthamiana dengan gen MaMt2……… 40
Transformasi genetik kedelai dengan gen MaMt2…...……… 42
Analisis Tanaman Transgenik ……… 44
Uji integrasi transgen MaMt2 di dalam N. benthamianaT0….….. 44
Uji segregasi tanaman N. benthamianaT1……….. 47
Uji integrasi transgen MaMt2 di dalam kedelai T0 dan T1 transgenik ………. 48
SIMPULAN DAN SARAN ..………. 55
DAFTAR PUSTAKA ……… 57
DAFTAR TABEL
Halaman
1 Perkembangan jumlah eksplan N. benthamiana pascatransformasi pada
generasi T0 ……… 41
2 Respon regenerasi kedelai cv. Lumut pascatransformasi pada generasi T0.. 42 3 Hasil uji keturunan T1 N. benthamiana dalam media seleksi MS-50 mg/l
DAFTAR GAMBAR
Halaman
1 Peta fisik plasmid Ti helperdan vektor biner ………... 22 2 Tahapan proses transfer DNA-T dari Agrobacterium ke sel tanaman 24 3 Peta fisik plasmid pIG6 sebagai vektor ekspresi ……… 30 4 Alur kerja perakitan N. benthamianadan kedelai transgenik ……… 30 5 Hasil PCR terhadap plasmid rekombinan pIG6-MaMt2 dari E. coli
DH5α menggunakan primer UbiF dan SMt2UR, serta UbiF dan NosT.. 38 6 Hasil PCR terhadap plasmid yang dibawa A. tumefaciens LBA4404
setelah proses TPM……… ………. 39 7 Perkembangan N. benthamiana pascatransformasi dengan gen MaMt2.. 41 8 Regenerasi kedelai pasca transformasi kedelai cv. Lumut……….. 43 9 Hasil PCR terhadap tanaman N. benthamiana transgenik T0 dengan
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Jumlah penduduk dan kesadaran tentang pentingnya gizi yang meningkat, menyebabkan meningkatnya kebutuhan pangan. Peningkatan kebutuhan pangan ini harus diantisipasi dengan peningkatan produksi tanaman pangan, melalui dua pendekatan, yaitu ekstensifikasi dan intensifikasi pertanian. Pendekatan pertama, dihadapkan pada kendala semakin meningkatnya konversi tanah pertanian yang subur menjadi kawasan perumahan, perkantoran, maupun industri. Tanah marjinal memiliki potensi sebagai salah satu alternatif pelaksanaan ekstensifikasi pertanian. Namun sebagian besar tanah marjinal di Indonesia berupa tanah dengan pH rendah dan kelarutan aluminium (Al) tinggi, padahal keduanya merupakan faktor pembatas produksi tanaman. Mulyani et al. (2003) memperkirakan ada sekitar 18.2 juta ha tanah dengan kemiringan <15o yang sesuai untuk budidaya tanaman pangan tersebar di Sumatera, Kalimantan, dan Papua. Tanah Ultisol merupakan salah satu jenis tanah di Indonesia yang mempunyai sebaran mencapai 45.794.000 ha atau sekitar 25% dari total luas daratan Indonesia (Subagyo et al. 2004). Tanah Ultisol (terutama Podsolik Merah kuning) yang tersebar di Sumatera, Kalimantan, Sulawesi, dan Papua ini, potensial untuk dijadikan tanah pertanian, namun tanahnya bereaksi masam dengan kejenuhan basa rendah sehingga memiliki potensi peracunan Al dan miskin kandungan bahan organik. Toksisitas Al merupakan kendala utama untuk pengembangan tanah ber-pH rendah, selain defisiensi unsur hara tertentu seperti P, Ca, Mg, N, dan K (Sopandie 2006, Prasetyo & Suriadikarta 2006).
untuk mendapatkan genotip-genotip yang diharapkan. Cara kedua adalah melalui rekayasa genetik tanaman dengan menyisipkan gen toleransi terhadap pH rendah dan kelarutan Al tinggi. Gen yang disisipkan pada tanaman pertanian bisa berasal dari tanaman spesies yang sama atau berbeda.
Kedelai merupakan salah satu komoditas penting yang digunakan sebagai bahan pangan dan pakan karena kandungan protein nabati yang tinggi. Peningkatan kebutuhan kedelai yang tidak diimbangi oleh produksi dalam negeri menyebabkan Indonesia harus mengimpor kedelai dari Negara lain seperti Amerika Serikat dan Argentina. Oleh karena itu sangat diperlukan usaha untuk meningkatkan produksi kedelai nasional. Salah satu cara adalah dengan merakit tanaman kedelai toleran pH rendah dan cekaman Al, yang merupakan salah satu karakteristik tanah marjinal di Indonesia. Perakitan ini bisa dilakukan dengan mengintroduksikan gen untuk toleransi terhadap pH rendah dan Al ke dalam tanaman kedelai sehingga mampu berproduksi pada tanah marjinal tersebut. Oleh sebab itu perbaikan genetik ke arah toleransi tanaman kedelai terhadap pH rendah dan cekaman Al sangat menunjang program peningkatan produksi kedelai nasional.
bahwa M. affine D. Don. (sin: M. malabathricum) pada media cair dengan pH 4.0 dan 3.2 mM Al, mampu mengakumulasi 8.81 g Al/kg daun tua selama dua bulan.
Sejumlah gen yang diduga terkait dengan toleransi Melastoma terhadap cekaman pH rendah dan Al sudah berhasil diisolasi dan diklon, meskipun sebagian belum utuh, misalnya MaMrp (multidrug resistance protein), MaMFs (major facilitator superfamily), MaSOD (super oxide dismutase), dan MaMt2 (metallothionein) dari M. affine (Suharsono & Jusuf 2006; Widyartini 2006, Suharsono et al. 2008; Suharsono et al. 2009), dan H+-ATPase membran plasma (Muzuni et al. 2010). Gen-gen tersebut diisolasi dari mRNA yang telah dibuat cDNAnya dengan reaksi transkripsi balik, sehingga gen yang diperoleh merupakan daerah penyandi (coding region). Gen-gen tersebut sangat penting untuk perakitan tanaman kedelai toleran terhadap pH rendah dan konsentrasi Al tinggi.
Metallothionein (MT) merupakan protein dengan berat molekul rendah yang kaya sistein, diperlukan dalam mengatasi ion-ion metal toksik dalam konsentrasi tinggi. Zhou & Goldsbrough (1994) telah mengisolasi MT1 dan MT2 dari Arabidopsis yang homolog dengan MT hewan dan jamur. Transkripsi MT2 meningkat dengan perlakuan CuSO4, ZnSO4, dan CdSO4. Cu merupakan logam
Bila isolasi, identifikasi, dan analisis molekuler gen-gen toleransi kedelai terhadap cekaman pH rendah dan kelarutan Al tinggi berhasil dilakukan, maka akan membuka jalan bagi pengembangan dan rekayasa tanaman yang toleran terhadap cekaman abiotik. Selain itu isolasi gen ini akan memberikan pengetahuan dasar tentang fisiologi dan molekuler toleransi tanaman kedelai terhadap cekaman pH rendah dan Al tinggi. Di Indonesia, kajian toleransi tanaman bernilai penting seperti kedelai belum banyak dilakukan pada aras molekuler.
Untuk memenuhi kebutuhan kedelai dalam negeri yang semakin tinggi, Indonesia mengimpor kedelai sekitar 1-1.6 juta ton setiap tahun (BPS 2009). Pada sisi yang lain masih banyak tanah yang tersedia untuk pertanaman kedelai. Namun pada umumnya tanah tersebut berupa tanah ber-pH rendah dengan kelarutan Al tinggi, akibatnya tanaman tidak mampu tumbuh secara optimal. Untuk itu diperlukan usaha perakitan varietas kedelai yang mampu beradaptasi terhadap tanah ber-pH rendah dengan kelarutan Al tinggi. Perakitan verietas tersebut bisa dilakukan dengan melakukan seleksi dan persilangan, atau dengan memanfaatkan teknologi DNA rekombinan, yaitu dengan cara menyisipkan gen untuk toleransi terhadap pH rendah dan kelarutan Al tinggi. Gen MaMt2 yang diperoleh dari hasil transkripsi balik mRNA dari M. malabathricum telah berhasil diisolasi, dikarakterisasi, dan diklon dalam plasmid pGEMT-Easy. Dalam penelitian ini, gen tersebut difusikan dengan promoter kuat yaitu pUbiquitin di dalam plasmid pIG6 sebagai vektor ekspresi, kemudian dimasukkan ke dalam Agrobacterium tumefaciens LBA4404. Tranformasi genetik tanaman N. benthamiana dan kedelai dilakukan dengan bantuan A. tumefaciens LBA4404 yang membawa vektor rekombinan pIG6-MaMt2.
Tujuan Penelitian Penelitian ini bertujuan untuk melakukan: 1. Konstruksi vektor ekspresi untuk gen MaMt2.
2. Transformasi genetik tanaman N. benthamiana dan kedelai dengan gen MaMt2.
Manfaat Penelitian Manfaat dari penelitian ini adalah:
1. Mendapatkan A. tumefaciens yang mengandung vektor ekspresi gen Mt2 yang dapat digunakan untuk melakukan transformasi genetik berbagai spesies tanaman.
TINJAUAN PUSTAKA
Toksisitas Tanah Asam
Faktor utama yang menyebabkan pH tanah menjadi rendah adalah dekomposisi bahan organik dan curah hujan yang tinggi (Salisbury & Ross 1995). Karbondioksida yang dilepaskan dari proses dekomposisi bahan organik bereaksi dengan molekul air yang akan melepaskan ion-ion H+. Selanjutnya ion-ion H+ akan menggantikan ion-ion K+, Mg2+, dan Mn2+ dari kompleks pertukaran kation. Curah hujan yang tinggi akan menyebabkan ion-ion tersebut hilang dari permukaan tanah, sehingga terbentuklah tanah asam. Pada pH rendah pertumbuhan tanaman dapat terhambat yang disebabkan oleh Al bebas dan Al dapat ditukar dalam jumlah berlebihan, keracunan Mn, dan kekurangan P, Ca, dan Mg, serta ketersediaan N sangat rendah (Marschner 1995).
Salah satu jenis tanah ber-pH rendah yang banyak tersebar di Indonesia adalah tanah Ultisol. Menurut Prasetyo & Suriadikarta (2006), reaksi tanah Ultisol pada umumnya masam hingga sangat masam (pH 5.0-3.1), kecuali tanah Ultisol dari batu gamping yang mempunyai reaksi netral hingga agak masam (pH 6.80-6.50). Kandungan hara pada tanah Ultisol umumnya rendah karena pencucian basa berlangsung intensif, sedangkan kandungan bahan organik rendah karena proses dekomposisi berjalan cepat dan sebagian terbawa erosi.
Toksisitas Aluminium terhadap Tanaman
Aluminium merupakan unsur nomer tiga dalam hal kemelimpahannya di bumi setelah oksigen dan silikon (Pilon-Smits et al. 2009). Aluminium yang dilepaskan ke larutan tanah akan berpengaruh buruk pada taraf tertentu bagi tanaman dan merupakan faktor pembatas pertumbuhan pada berbagai tanah masam di dunia (Harjadi & Yahya 1988; Horst et al. 2004). Bentuk Al dalam tanah sangat dipengaruhi pH tanah. Pada pH tanah <4.0, bentuk Al yang paling dominan adalah Al3+ yang sangat toksik bagi tanaman. Bentuk Al(OH)2+ terdapat pada kisaran pH 4.0-5.5. Sedangkan pada pH di atas nilai tersebut, Al akan lebih banyak terdapat dalam bentuk gibsit [Al(OH)3], yang dapat mengikat fosfat
meskipun tidak sekuat ion-ion Al dan tidak meracuni tanaman, sehingga pengaruhnya dapat diabaikan (Kinraide et al. 1985; Kochian et al. 2004).
Pada tanah ber-pH rendah umumnya ketersediaan hara sangat terbatas dan kemampuan tanaman untuk menyerap hara juga dibatasi oleh adanya kandungan Al yang tinggi. Tanaman barley yang ditanam pada media mengandung Al, hanya mengandung Ca2+ dan K+ setengahnya, dibandingkan dengan kontrol (Matsumoto et al. 1992). Kekurangan P pada umumnya juga diinduksi oleh kandungan Al yang tinggi. Hal ini berkaitan dengan terbentuknya kompleks Al-fosfat, baik di dalam larutan tanah maupun di dalam sel tanaman sehingga Al tidak tersedia bagi tanaman. Kemampuan tanaman untuk dapat memanfaatkan kandungan P yang rendah secara efisien selalu dihubungkan dengan sifat toleransi terhadap Al. Kation trivalen Al3+ menghambat transpor Ca2+ secara efektif ke dalam akar, protoplas, dan membran vesikel. Hasil kajian pada lipida dua lapis menunjukkan bahwa Al dapat memblok saluran Ca2+ dan K+ (Ryan et al. 1997; Buchanan et al. 2006). Pada akar barley, perlakuan Al menurunkan kandungan Ca pada membran sampai 50% dan menyebabkan penurunan aktivitas H+-ATPase dalam menghidrolisis ATP (Matsumoto et al. 1992).
et al. 1997; Horst et al. 2004; Buchanan et al. 2006). Gejala yang tampak dari keracunan Al adalah sistem perakaran yang tidak berkembang (tebal dan pendek) sebagai akibat penghambatan perpanjangan sel. Selain itu juga terjadi gangguan penyerapan hara mineral, penggabungan Al dengan dinding sel, dan penghambatan pembelahan sel (Matsumoto et al. 1992; Horst et al. 2004).
Gejala keracunan Al yang paling mudah dilihat adalah penghambatan pertumbuhan akar. Menurut Marschner (1995) dan Horst et al. (2004), gejala awal yang tampak dari toksisitas Al adalah sistem perakaran tidak berkembang sebagai akibat penghambatan pemanjangan sel. Pada tanaman yang sensitif, menurut Marschner (1995), Al ditemukan dalam nukleus dan dinding sel. Pada dinding sel, penghambatan terjadi karena Al menggantikan kedudukan Ca2+ pada lamela
tengah. Ikatan Al dengan gugus karboksil akan menimbulkan ikatan yang kuat sehingga sel tidak dapat membesar. Dalam nukleus, Al berikatan dengan DNA sehingga menghentikan proses pembelahan meristem apikal. Al dalam bentuk polimer memiliki muatan positif yang besar serta memiliki banyak situs pengikatan. Polimer ini dapat mengikat P yang ada pada kedua utas DNA, mengakibatkan gagal berpisahnya utas ganda DNA.
Marschner (1995) menyatakan bahwa kerusakan pada sel tudung akar yang berfungsi sebagai sensor terhadap cekaman lingkungan menyebabkan akumulasi Al yang tinggi pada nukleus tudung akar sehingga menghambat pemanjangan akar. Karakteristiknya adalah permukaan akar berwarna coklat kekuningan, berbintik, dan mudah patah. Matsumoto et al. (1992), menunjukkan bahwa pembelahan sel pada ujung akar bawang putih berhenti setelah diberi perlakuan 10-3 M AlCl3 selama 10 hari. Sivaguru et al. (1999) dan Horst et al.
(2004) membuktikan bahwa pada kultivar jagung sensitif Al, bagian zona transisi distal (DTZ, 1-2 mm) merupakan zona ujung akar yang sensitif Al. Pendedahan Al pada daerah ini mengurangi pemanjangan sel pada daerah pemanjangan akar.
positif dapat berikatan dengan gugus fosfat dari ATP atau fosfolipid pada membran yang akan mempengaruhi efektivitas transpor proton.
Menurut Taylor (1991) mekanisme toleransi tanaman terhadap Al terbagi menjadi dua kelompok, yaitu: 1) dengan mencegah Al masuk ke dalam simplas dan sampai daerah metabolik yang peka di dalam sel tanaman (mekanisme ekslusi), dan 2) dengan detoksikasi, imobilisasi atau pengubahan dalam metabolisme saat Al telah masuk ke dalam simplas sehingga memungkinkan tanaman melanjutkan proses tumbuhnya (mekanisme internal).
Mekanisme (eksklusi) berhubungan dengan: imobilisasi Al dalam dinding sel, sifat selektif permeabel membran plasma, meningkatkan pH di sekitar perakaran, dan kelatisasi Al oleh asam organik. Mekanisme internal berhubungan dengan: kelatisasi Al dalam sitosol oleh asam organik atau protein, kompartementasi Al dalam vakuola, evolusi enzim pada tanaman toleransi Al.
Aluminium dapat berinteraksi baik dengan senyawa organik maupun anorganik. Interaksi dengan senyawa (anion) organik paling kuat terjadi dengan asam-asam dikarboksilat seperti asam sitrat dan asam malat. Asam-asam dikarboksilat tersebut sangat efektif sebagai bahan amelioran untuk mendetoksikasi Al. Sedangkan interaksi Al dengan senyawa (anion) anorganik seperti sulfat, fosfat, fluor, dan silikat membentuk suatu kompleks yang memiliki afinitas tinggi terhadap oksigen atau air. Interaksi Al dengan anion tersebut berpotensi untuk meningkatkan pH perakaran sekaligus dapat membuat rancu pengaruh toksisitas Al dengan defisiensi unsur tertentu seperti fosfat, karena terbentuk kompleks Al-P sehingga P tidak tersedia bagi tanaman.
Kemampuan apoplas sel akar menyerap Al dianggap sebagai salah satu mekanisme toleransi terhadap Al, semakin kecil kemampuan akar untuk menyerap Al, semakin peka tanaman terhadap Al (Duncan & Baligar 1990). Marschner (1995) menambahkan bahwa tanaman yang toleran terhadap Al akan meningkatkan pH pada daerah perakaran sehingga menurunkan kelarutan dan keracunan Al. Selain apoplas, membran plasma dianggap mampu menghalangi penyerapan Al secara selektif. Duncan & Baligar (1990) menyatakan bahwa perbedaan permeabilitas membran terhadap Al merupakan salah satu mekanisme toleransi terhadap Al. Sistem dalam membran harus mampu mendeteksi status Al di luar dan di dalam akar.
Gen-Gen yang Ekspresinya Diinduksi oleh Cekaman Al
Beberapa peneliti telah melakukan penelitian tentang gen yang ekspresinya diinduksi oleh cekaman Al untuk mengetahui mekanisme toleransi tanaman terhadap cekaman Al. Snowden & Gardner (1993), Richards et al. (1994), dan Snowden et al. (1995) telah mengisolasi tujuh klon cDNA. Ezaki et al. (1995) telah mengisolasi gen-gen yang ekspresinya diinduksi oleh cekaman Al pada kultur sel tembakau. Richards et al. (1998) telah mempelajari gen yang ekspresinya diinduksi oleh cekaman Al pada A. thaliana.
Kajian genetik dan fisiologi tanaman kedelai yang mendapat cekaman pH rendah dan Al tinggi, telah dilakukan oleh Sopandie et al. (1996) dan Jusuf et al. 1999). Sedangkan kajian tentang biologi molekuler kedelai yang mendapat cekaman abiotik seperti kekeringan, pH rendah, dan Al tinggi telah dilakukan oleh Anwar (1999) dan Jusuf et al. (1999).
Gen-gen yang ekspresinya diinduksi oleh cekaman pH rendah dan aluminium pada Melastoma sudah berhasil diisolasi, dikarakterisasi, dan diklon, di antaranya adalah MaMrp (multidrug resistance protein) (Suharsono et al. 2008), MaMFs (major facilitator superfamily), MaSOD (super oxidedismutase), dan MaMt2 (metallothionein) dari M. affine (Suharsono & Jusuf 2006; Widyartini 2006, Suharsono et al. 2008; Suharsono et al. 2009), H+-ATPase membran plasma (Muzuni et al. 2010), dan MmCu/Zn-SOD (Hannum 2011).
Cekaman Logam dan Metallothionein
Logam-logam ditemukan di lingkungan berasal dari pelapukan alami perut bumi, erosi tanah, pembuangan industri pertambangan, limbah buangan, agen-agen pembasmi hama dan penyakit, dsb. Menurut Singh et al. (2003), pada dekade terakhir penglepasan logam berat di seluruh dunia mencapai 22.000 ton Cd, 93.000 ton Cu,783.000 ton Pb, dan 1.350.000 ton Zn. Akumulasi logam dan peredarannya dalam biosfer menjadi perhatian karena efek lingkungan dan kesehatan yang berkaitan dengan toksisitas logam-logam esensial (Cu, Cr, Zn, Mn, Fe, Ni, dan Mo), maupun non-esensial (Cd, Pb, dan Hg). Logam-logam penting untuk struktur dan fungsi banyak protein mulai dari zinc-finger binding protein pengikat DNA, hingga protein untuk respirasi yang memerlukan Fe atau Cu. Diperkirakan hampir setengah dari semua enzim yang ada adalah metalloprotein (Waldron et al. 2009). Dalam konsentrasi memadai keberadaan ion-ion logam sangat penting untuk pertumbuhan dan perkembangan organisme, namun dalam konsentrasi tinggi keberadaan logam-logam ini akan bersifat toksik bagi sel, jaringan, ataupun organisme. Mekanisme toksisitas umum ion-ion logam dibagi dalam tiga kategori: (1) menghambat gugus fungsional yang penting secara biologis dari biomolekul khususnya protein dan enzim, (2) menggantikan ion-ion logam esensial dalam biomolekul, dan (3) memodifikasi konformasi aktif biomolekul yang menyebabkan hilangnya aktivitas pesifik.
tetap dari matallothionein pada spesies hewan. Sifat elektrofilik dari sulfur pada gugus sulfhidril dari asam amino bertanggungjawab untuk afinitasnya yang tinggi terhadap ion-ion logam. Metallothionein menunjukkan afinitas tertinggi terhadap logam dari kelompok transisi (misalnya Zn, Cd, Hg, Cu dan Ag). Logam yang terikat membentuk struktur tetrahedral, dengan empat residu sistein mengambil bagian dalam mengkoordinasi pengikatan logam. Afinitas metallothionein terhadap logam dengan urutan sebagai berikut: Ag > Hg > Cu > Cd > Zn > Co = Ni (Bremner & Beattie 1990).
Protein metallothionein berperan penting dalam memetabolisme logam-logam penting untuk pertumbuhan dan perkembangan pada organisme (Philcox et al. 1994). MT merupakan cadangan ion-ion Zn dan Cu, protein ini mampu memulihkan kemampuannya ketika didedah dengan Cd, jika diinkubasi dengan metallothionein-zinc (ZnMT).
Gen Metallothionein pada Tumbuhan, Yeast, dan Bakteri
Gln-Cys-X-Lys-Lys-Gly. MT tipe IV memiliki tiga domain kaya Cys, masing-masing memiliki 5 atau 6 residu Cys yang terkonservasi.
Protein MT terdiri dari dua domain pengikatan (α, β), yang tersusun dari sekelompok sistein. Bagian ujung-N dari protein ini ditandai sebagai domain-α, yang memiliki tiga tempat pengikatan untuk ion-ion divalent. Domain-β (bagian ujung-C) memiliki kemampuan untuk mengikat empat ion-ion divalen logam berat (Capasso et al. 2006). Dalam kasus ion-ion logam berat monovalen, MT mampu mengikat dua ion logam. Asam amino sistein berperan penting dalam mengatasi ion-ion metal toksik dalam konsentrasi tinggi. Menurut Simpkins (2000), ada tiga proses fundamental yang terkait dengan protein MT, di antaranya: (1) melepaskan gas perantara seperti radikal hidroksil atau oksida nitrit; (2) apopotosis; (3) pengikatan dan pertukaran logam berat, seperti Zn, Cd, atau Cu.
MT tipe I, II, dan III diduga berfungsi dalam homeostasis dan toleransi Cu (Murphy & Taiz 1995; van Hoof et al. 2001; Guo et al. 2003; Roosens et al. 2004; Guo et al. 2008), sedangkan MT tipe 4 berfungsi dalam homeostasis Zn (Lane et al. 1987; Guo et al. 2008). Meskipun demikian, semuanya dapat mengikat berbagai ion logam dan metaloid, termasuk ion-ion nonesensial (Cobbett & Goldsbrough 2002). Data-data tersebut menunjukkan bahwa MT tumbuhan memiliki fungsi yang terkait dengan detoksifikasi logam-logam nonsesensial, selain homeostasis logam-logam esensial (Guo et al. 2008).
Protein MT pada tanaman paling banyak dipelajari pada Arabidopsis dan hasil penelitian menunjukkan bahwa tanaman ini yang memiliki lebih dari satu famili gen Mt. Menurut Guo et al. (2003), Arabidopsis mengandung famili gen dengan tujuh gen Mt yang aktif. Pada padi ditemukan ada 11 gen yang menyandikan OsMt yang masing-masing memiliki urutan dan pola ekspresi jaringan yang berbeda (Zhou et al. 2006).
Zhou & Goldsbrough (1994) berhasil mengisolasi dua tipe MT (MT1 dan MT2) dari Arabidopsis yang homolog dengan MT hewan dan jamur. Transkripsi MT2 meningkat dengan perlakuan CuSO4, ZnSO4, dan CdSO4. Dari ketiga logam
mendapat perlakuan 50 M Cu menunjukkan peningkatan transkripsi MT2 sampai 72 jam perlakuan.
Richards et al. (1998) telah mengisolasi beberapa klon cDNA dari tanaman Arabidopsis yang diberi nama gen-gen EARLI (early Arabidopsis alumnium induced). Klon pEARLI menyandikan gen yang termasuk ke dalam kelompok hidrofobik yang belum diketahui fungsinya dan dihasilkan dari perlakuan Al yang sangat cepat. Sivaguru et al. (2003) melaporkan bahwa Al menginduksi ekspresi gen wak1 (cell wall-associated receptor kinase 1) pada organ spesifik. Hasil analisis RT-PCR membuktikan bahwa ekspresi gen wak1 pada akar diinduksi oleh Al. Puncak ekspresi terjadi pada 3 jam setelah pemberian cekaman Al, diikuti dengan penurunan ekspresi pada 6 jam setelah perlakuan dan ekspresinya terus menurun hingga pada 9 jam setelah pemberian cekaman Al, ekspresi gen tersebut benar-benar tidak ada. Gen wak1 diduga kspresinya diinduksi oleh Al. Tanaman transgenik yang mengekspresikan gen tersebut secara berlebihan menunjukkan peningkatan toleransi terhadap Al.
Berdasarkan penelitian pada sejumlah leguminosa (kedelai, kacang merah, kidney bean), diketahui bahwa cDNA Mt tipe-1 memiliki ukuran 530-550 pb, sedangkan cDNA Mt tipe-2 berukuran 540-570 bp. Menurut Sun et al. (2004), kedua cDNA tersebut memiliki susunan Cys pada setiap ujung-N dan ujung-C dari masing-masing urutan. Beberapa kandidat cDNA yang ekspresinya diduga diinduksi oleh cekaman Al telah diisolasi melalui konstruksi pustaka cDNA dari tanaman kedelai kultivar Lumut yang peka terhadap cekaman Al dan penapisan diferensial terhadap pustaka genom tersebut (Jusuf et al. 1999; Anwar et al. 2000). Klon kandidat tersebut adalah gmali1 (GenBank No. AF901303) yang diduga menyandi H+-ATPase membran plasma, gmali4 yang menyandi Histon H3,
gmali20 yang menyandi katalase, gmali49 yang menyandi NADH dehidrogenase, gmali50 (GenBank No. AF169830) yang menyandi auxin-induced protein. Anwar (1999) berhasil mengisolasi gen sapali (GenBank No. AF 901304) yang menyandi aminoasilpeptidase.
2002), senesensi daun (Bhalerao et al. 2003; Andersson et al. 2004), dan logam-logam berat (Usha et al. 2007; Huang et al. 2009; Huang et al. 2010). Hal ini menunjukkan bahwa MT kemungkinan diekspresikan sebagai tanggap cekaman umum seperti disebutkan oleh Cobbett & Goldsbrough (2002). Diduga kuat MT berfungsi sebagai juga sebagai antioksidan dan berperan penting dalam perbaikan membran plasma (Hall 2002). Selain tanggap terhadap cekaman logam toksik, gen Mt juga dapat terinduksi oleh cekaman kadar garam. Analisis ekspresi yang dilakukan oleh Yang et al. (2011) pada tanaman Tamarix hispida, menunjukkan bahwa mRNA dari ThMT3 diatur meningkat oleh salinitas tinggi dan juga ion-ion logam berat, dan ThMT3 dominan diekspresikan dalam daun. Yeast transgenik (Saccharomyces cerevisiae) yang mengekspresikan ThMT3 menunjukkan peningkatan toleransi terhadap cekaman Cd2+, Zn2+, Cu2+, dan NaCl. Selain itu,
analisis ekspresi yang dilakukan oleh Yang et al. (2009), menunjukkan bahwa OsMT1a diekspresikan dominan pada akar, dan diinduksi oleh dehidrasi. Ekspresi OsMT1a juga diinduksi secara spesifik oleh perlakuan Zn2+. Tanaman padi dan yeast transgenik yang membawa OsMT1a mengakumulasi Zn2+ lebih banyak dibandingkan kontrol tipe liar, menunjukkan bahwa OsMT1a tampaknya terlibat dalam homeostasis Zn. Tanaman padi transgenik yang mengekspresikan berlebih OsMT1a menunjukkan peningkatan toleransi terhadap kekeringan.
Peran berbagai gen Mt juga dipelajari dengan melakukan transformasi, ekspresi berlebih ataupun dengan melakukan pembungkaman gen pada sejumlah organisme. Zhigang et al. (2006), mengekspresikan fusi TrxA::BjMT2 pada sel-sel Escherichia coli sehingga lebih toleran terhadap pendedahan Cu2+ dan Cd2+ dibandingkan galur kontrol. Kecambah A. thaliana menunjukkan peningkatan toleransi terhadap Cu2+ dan Cd2+ berdasarkan pertumbuhan pucuk dan kandungan klorofil, ketika cDNA BjMT2 diekspresikan dalam pengaturan promoter 35S. Zhang et al. (2006) menunjukkan bahwa sel-sel yeast yang ditransformasi dengan AsMT2b mengalami peningkatan resistensi terhadap Cd. Arabidopsis yang mengekspresikan berlebih AsMT2b menunjukkan toleransi Cd lebih kuat dan akumulasi Cd lebih tinggi dibandingkan tanaman tipe liar. Hasil tersebut menunjukkan bahwa di masa yang akan datang AsMT2b dapat digunakan untuk fitoremidiasi tanah tercemar Cd. Zimeri et al. (2005), menyatakan bahwa tanaman dengan MT1 terbungkam semuanya menjadi hipersensitif terhadap Cd dan mengakumulasi As, Cd, dan Zn beberapa kali lebih tinggi dibandingkan tipe liar, sedangkan aras Cu dan Fe tidak terpengaruh. Urutan protein MT1 pada genom tanaman memiliki sifat pengikatan logam yang berbeda, memberikan toleransi terhadap Cd, dan membantu homeostasis Zn.
dengan menyisipkan gen MT ke dalam tanaman tembakau. Tanaman tembakau transgenik menunjukkan peningkatan kemampuan antioksidan dibandingkan dengan tanaman nontransgenik. Amiard et al. (2006), tanaman tembakau (Nicotiana tabaccum) transgenik yang mengekspresikan berlebih GhMT3a menunjukkan peningkatan toleransi terhadap cekaman abiotik dibandingkan tanaman tipe liar. Ekspresi GhMT3a diinduksi oleh cekaman garam, kekeringan, dan suhu rendah, dapat dihambat oleh adanya antioksidan. Aras H2O2 pada
tanaman tembakau transgenik hanya setengah dari tanaman tipe liar (WT) dalam kondisi cekaman semacam itu.
Murthy et al. (2011) mendapatkan bahwa konsentrasi metallothionein pada Bacillus cereus yang diperlakukan dengan berbagai konsentrasi Pb meningkat seiring meningkatnya konsentrasi Pb, berbeda jauh dibandingkan dengan bakteri kontrol. Su et al. (2009), menunjukkan bahwa kemampuan bioakumulasi senyawa As(III) oleh E. coli rekombinan meningkat lebih dari tiga kali dari 76.3 menjadi
319.6 μg/g sel kering dibandingkan dengan kontrol. Bioakumulasi mencapai 70% dari nilai jenuh dalam 1 jam. E. coli rekombinan akan berguna dalam bioremidiasi arsenik atau logam berat lain yang mencemari air. Sel-sel yeast yang ditransformasi dengan AsMT2b dari Allium sativum mengalami peningkatan resistensi terhadap Cd (Zhang et al. 2006). Hasil penelitian Ruiz et al. (2011), menunjukkan bakteri transgenik MT-1 mengakumulasi hingga 100.2 ± 17.6 μM Hg dari media yang mengandung 120 μM Hg.
Metallothionein pada Hewan dan Manusia
penanda biologi yang diekspresikan pada berbagai tumor pada manusia, meskipun masih sedikit laporan yang terjadi pada karsinoma. Peran MT tidak hanya terbatas pada peristiwa apoptosis dan sebagai antioksidan pada organ-organ tertentu, sekarang eksplorasi berbagai isoform MT misalnya I, II, III dan MT-IV ataupun isoform lain dalam berbagai sistem biologi diketahui memodulasi penyakit kompleks dan sistem imun dalam tubuh, meskipun peran utamanya tetap masih belum diketahui (Thirumoorthy et al. 2011),
Metallothionein pada manusia terlibat dalam proses proliferasi dan diferensiasi. Sejumlah besar gugus thiolat dalam molekul MT dengan sifat-sifat nukleofilik membuatnya tidak hanya mampu mengikat ion-ion logam tetapi juga ROS dan radikal-radikal organik, selain unsur sulfur dengan mudah berikatan dengan unsur yang memiliki kekurangan elektron. Sejumlah kajian menunjukkan MT terlibat dalam proses apoptosis (Floriańczyk 2007). Sedangkan Carpene et al. (2007), menyebutkan bahwa bahwa isoform MT-1/MT-2 mamalia terlibat dalam homeostasis Zn serta perlindungan terhadap toksisitas logam berat dan cekaman oksidatif. MT-3 diekspresikan terutama pada neuron tetapi juga pada glia. MT-4 sebagian besar ada dalam sel-sel epitel squamousa berlapis yang berdiferensiasi. Moluska laut dapat mengakumulasi logam-logam trace dengan tingkat besaran lebih tinggi dari konsentrasi yang ada dalam air laut. Dengan demikian, moluska sudah digunakan secara luas sebagai indicator polusi logam pada eksositem laut. Logam berat tertentu, misalnya Cd, Cu dan Hg diasumsikan sebagai penginduksi kuat biosintesis MT. Artinya Mt dianggap sebagai suatu penanda biologis yang valid untuk pendedahan logam pada moluska laut (Carpene et al. 2007).
Peran metallothioenin (MT) sebagai protein anticekaman yang diinduksi oleh cekaman fisiologis dinyatakan oleh Kondoh et al. (2004), yang menunjuk-kan bahwa bau kamfer menstimulir peningkatan aras MT pada hati tikus yang diberi perlakuan kamfer selama tiga hari. MT juga berperan penting dalam homeostasis Zn dan Cu pada Phocoena phocoena. Peningkatan konsentrasi Zn hepatik menyebabkan peningkatan Zn yang terikat pada MT, menunjukkan bahwa protein ini mengambil alih kelebihan Zn. Metallothionein mampu mengikat 50% konsentrasi Zn hepatik total dan 36% konsentrasi Cu hepatik total. MT ginjal juga berperan dalam detoksifikasi Cd, karena mampu mengikat 56% dari Cd total ginjal (Das et al. 2006). Ren et al. (2003), menemukan bahwa induksi mRNA MT1 lebih rendah dibandingkan dengan mRNA MT2 pada hati tikus yang diperlakukan dengan Cd, tetapi hasil yang berlawanan ditemukan pada sel-sel interstisial. Pendedahan Cd meningkatkan MT hepatis (3.9 kali), tetapi tidak meningkatkan translasi MT pada sel-sel interstisial. Ekspresi isoform MT yang diinduksi Cd tidak hanya bergantung pada tipe jaringan tetapi juga bergantung waktu. Dalam eksperimennya menggunakan toksin dari jamur pada gandum, Vasatkova et al. (2009), membuktikan bahwa MT terlibat dalam proses ketahanan terhadap mikotoksin penyebab cekaman oksidatif pada jaringan hati tikus. Hal ini ditunjukkan dengan meningkatnya aras MT sesuai dengan peningkatan kandungan gandum yang berjamur. Sementara itu, Hawse et al. (2007) menemukan bahwa ekspresi berlebih MTIIa pada sel-sel epitel lensa menyebabkan perlindungan terhadap cekaman oksidatif yang diinduksi Cd dan TBHP. Hasil menunjukkan bahwa MTIIa, dan/atau gen-gen antioksidan penting lainnya kemungkinan berperan dalam mengatur ekspresi terhadap cekaman oksidatif.
Kemampuan MT dalam mengikat Cu dan Cd pada siput Helix pomatia ditunjukkan oleh Palacios et al. (2011). HpCuMT dan HpCdMT disintesis dengan adanya Cd2+, Zn2+ atau Cu2+. Kedua isoform MT hanya mampu membentuk dua
(2010), menemukan bahwa induksi MT pada Merluccius merluccius dan Mullus barbatus berkorelasi dengan peningkatan konsentrasi Cu dan Pb pada lingkungan perairan tempat hidupnya. Hal ini juga menunjukkan potensi MT sebagai indikator pencemaran lingkungan.
Transformasi diperantarai Agrobacterium
Menurut Glick & Pasternak (2010), ada tiga alasan utama untuk mengembangkan tanaman transgenik: 1) Penambahan sebuah gen seringkali mampu meningkatkan nilai agrikultur, hortikultur, atau ornamental tanaman budidaya. 2) Tanaman transgenik dapat berperan sebagai bioreaktor untuk produksi protein atau metabolit yang penting secara ekonomi dengan biaya produksi lebih murah 3) Tranformasi genetik tanaman menjadi alat yang kuat untuk mempelajari aksi gen selama proses perkembangan dan proses biologis lainnya.
Sejumlah sifat ditentukan secara genetik yang dapat dimasukkan ke dalam tanaman melalui gen tunggal atau kelompok kecil gen, misalnya gen untuk proteksi terhadap infeksi virus, resistensi herbisida, penundaan senesensi, toleransi terhadap cekaman lingkungan, pengubahan pigmentasi bunga, dan peningkatan kualitas protein biji. Sekarang sejumlah besar tanaman transgenik sudah dihasilkan termasuk banyak spesies tanaman budidaya misalnya tomat, kentang, kapas kedelai, jagung, wortel, ketimun, strawberry, terong, pear, apel, anggur, asparagus, padi, dsb. (Tzfira & Chitovsky 2008; Glick & Pasternak 2010).
antaranya adalah relatif mudah dilakukan, lebih ekonomis, dan memberikan transgen dengan jumlah salinan rendah. Untuk meningkatkan efisiensi transformasi beberapa faktor harus diperhatikan, yaitu umur dan tipe jaringan tanaman, galur Agrobacterium, penambahan senyawa fenolik, pH, senyawa antioksidan (Paz et al. 2004; Tzfira & Chitovsky 2008; Glick & Pasternak 2010).
Biologi Agrobacterium tumefaciens
Agrobacterium tumefaciens adalah bakteri tanah yang termasuk dalam famili Rhizobiaceae. Bakteri ini berbentuk batang, bersifat gram negatif, dan bersifat obligat aerob. Suhu optimal pertumbuhan bakteri Agrobacterium adalah pada 28-30oC. Bakteri ini mampu menginfeksi sejumlah besar tanaman dikotil
dan sejumlah kecil tanaman monokotil. A. tumefaciens merupakan spesies yang dapat menginfeksi tanaman dan menyebabkan penyakit tumor mahkota (crown gall) yaitu suatu gumpalan atau jaringan kalus yang tumbuh pada tempat infeksi.
Dasar-dasar molekular transformasi genetik sel-sel tanaman oleh Agrobacterium adalah transfer suatu plasmid berukuran besar penginduksi tumor (tumour inducing, Ti) atau penginduksi akar (rhizogenic inducing, Ri) yang ada dalam Agrobacterium dari bakteri dan integrasinya ke dalam genom nuklear tanaman target. Ti plasmid berukuran dari 200 hingga 800 kpb (Paulus et al. 1991; Porter 1991; Suzuki et al. 2000). DNA yang ditransfer (transferred DNA, T-DNA) dirujuk sebagai daerah-T yang terletak pada Ti atau Ri plasmid. DNA-T pada plasmid Ti dan Ri alami, berukuran sekitar 10 hingga 30 kpb (Suzuki et al. 2000; Opabode 2008). Plasmid Ti membawa gen-gen yang menyandikan penginduksi tumor, penginduksi sintesis opin, dan kemampuan untuk memetabolisir opin. Bila ada plasmid Ti di dalam sel, maka bakteri pembawanya akan memiliki kemampuan untuk membentuk tumor pada tanaman inangnya. Sebaliknya bila plasmid Ti tersebut dihilangkan, maka kemampuan untuk menginfeksi tanaman akan hilang.
plasmid Ti yang berperan pada pembentukan tumor adalah: (1) DNA-T yang akan ditransmisikan ke sel tanaman inang. DNA-T mengandung gen-gen yang bertanggungjawab untuk biosintesis hormon tumbuh tanaman dan opin; (2) daerah vir berukuran 30-40 kb yang tidak ditransfer ke sel tanaman inang, berperan dalam transfer DNA-T (Hood et al. 1987; Draper et al. 1993). Tumbuhnya jaringan tumor disebabkan terjadinya transfer dan integrasi segmen DNA-T dari A. tumefaciens ke dalam sel tanaman. Kemampuan bakteri ini digunakan sebagai vektor untuk memasukkan gen-gen asing ke dalam sel tanaman. Menurut Hinchee et al. (1988), Paz et al. (2004) dan Travella et al. (2005), transformasi menggunakan A. tumefaciens merupakan salah satu metode transfer DNA terbaik ke jaringan tanaman.
Plasmid Ti sebagai vektor
Plasmid Ti merupakan vektor yang potensial untuk memindahkan gen-gen asing ke dalam sel tanaman. Pewarisan DNA-T yang terintegrasi pada kromosom tanaman dari satu generasi ke generasi berikutnya mengikuti hukum Mendel (Gelvin 2003). Plasmid Ti dapat dibagi menjadi dua kategori, yaitu plasmid ko-integrasi dan plasmid biner. Plasmid ko-ko-integrasi merupakan turunan plasmid Ti tipe liar yang gen-gen onc-nya diganti dengan gen-gen dari vektor intermedier yang memiliki daerah homologi dengan gen-gen onc. Gen-gen yang menggantikan gen-gen onc merupakan penanda seleksi dari bakteri lain. Plasmid biner memiliki dua plasmid (Gambar 1). Plasmid pertama terdiri dari urutan pembatas daerah T, „multiple cloning site‟, titik awal replikasi, dan gen penanda seleksi. Plasmid kedua tidak memiliki DNA-T tetapi memiliki daerah vir (Draper et al. 1993).
DNA-T
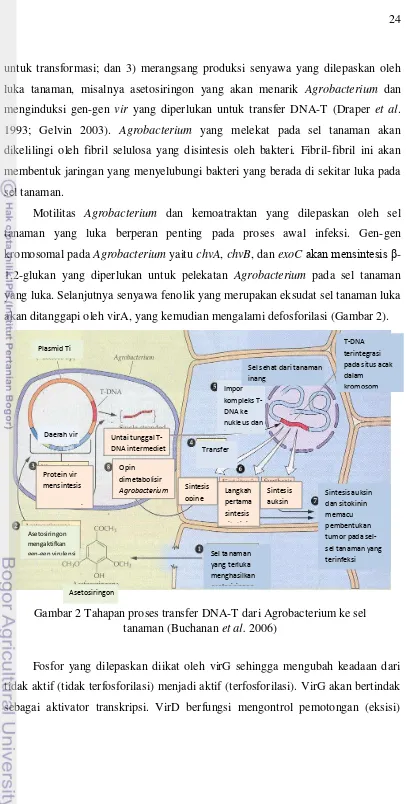
Daerah DNA-T adalah segmen dari plasmid Ti yang homolog dengan urutan target yang ada pada sel tanaman yang mengalami transformasi. Ukuran DNA-T bervariasi bergantung pada plasmid Ti-nya. Daerah DNA-T diapit oleh urutan pembatas (right border, RB dan left border, LB) yang berukuran 25 pb yang ikut berperan dalam memobilisasi DNA-T ke sel tanaman (Gambar 2). Urutan pembatas kanan sangat diperlukan untuk proses dan integrasi DNA-T ke kromosom sel tanaman (Gelvin 2003).
Somers et al. (2003) dan Opabode (2006), menyatakan bahwa segmen DNA-T memiliki gen-gen yang menyandi dua enzim untuk biosintesis auksin yaitu triptofan monooksigenase (iaaM) dan indolasetamid hidrolase (iaaH). Kedua enzim ini mampu mengubah triptofan menjadi asam indol asetat (IAA). Selain kedua enzim tersebut, DNA-T juga mempunyai gen yang menyandi enzim isopentenil transferase (ipt) yang akan mengubah adenosin monofosfat menjadi sitokinin isopentenil adenosin. Produksi kedua macam fitohormon ini dalam jumlah berlebihan menyebabkan sel-sel yang terinfeksi akan membentuk tumor mahkota. Meskipun demikian proses transmisi DNA-T ke sel tanaman tidak memerlukan enzim-enzim tersebut.
Mekanisme Transfer DNA-T ke Sel Tanaman
untuk transformasi; dan 3) merangsang produksi senyawa yang dilepaskan oleh luka tanaman, misalnya asetosiringon yang akan menarik Agrobacterium dan menginduksi gen-gen vir yang diperlukan untuk transfer DNA-T (Draper et al. 1993; Gelvin 2003). Agrobacterium yang melekat pada sel tanaman akan dikelilingi oleh fibril selulosa yang disintesis oleh bakteri. Fibril-fibril ini akan membentuk jaringan yang menyelubungi bakteri yang berada di sekitar luka pada sel tanaman.
Motilitas Agrobacterium dan kemoatraktan yang dilepaskan oleh sel tanaman yang luka berperan penting pada proses awal infeksi. Gen-gen kromosomal pada Agrobacterium yaitu chvA, chvB, dan exoCakan mensintesis β -1,2-glukan yang diperlukan untuk pelekatan Agrobacterium pada sel tanaman yang luka. Selanjutnya senyawa fenolik yang merupakan eksudat sel tanaman luka akan ditanggapi oleh virA, yang kemudian mengalami defosforilasi (Gambar 2).
Fosfor yang dilepaskan diikat oleh virG sehingga mengubah keadaan dari tidak aktif (tidak terfosforilasi) menjadi aktif (terfosforilasi). VirG akan bertindak sebagai aktivator transkripsi. VirD berfungsi mengontrol pemotongan (eksisi)
DNA-T sehingga dihasilkan untai tunggal DNA linier. DNA utas tunggal ini selanjutnya diintegrasikan ke DNA kromosom inti sel tanaman. DNA-T yang diintegrasikan ke sel tanaman bisa berjumlah satu atau lebih. Susunan DNA-T yang terintegrasi ke kromosom tanaman dapat berbentuk tandem atau tidak (Winans 1992; Opabode 2006).
Produksi tanaman transgenik saat ini sering melalui transformasi jaringan eksplan. Beberapa tanaman dikotil yang diregenerasi dari eksplan dan waktu yang dibutuhkan mulai saat inokulasi hingga menjadi tanaman dewasa lebih cepat dibandingkan dengan transformasi protoplas (Baldes et al. 1987). Tipe dan umur jaringan yang optimum digunakan pada proses transformasi dan regenerasi yang sangat bervariasi, tergantung spesies dan vairietas tanaman. Teknik-teknik yang telah berhasil dikembangkan pada proses ini adalah dengan menggunakan irisan daun, irisan batang, irisan kotiledon, dan lapisan sel tipis dari bunga.
Seleksi terhadap Sel Tanaman Transgenik
pelapor (reporter gene). Secara umum gen uidA sering disebut gen GUS (Sundar & Sakhtivel 2008).
Transformasi Kedelai Diperantaraan Agrobacterium tumefaciens Kedelai [Glycine max (L.) Merrill] merupakan tanaman budidaya penting karena merupakan sumber ekonomi untuk minyak dan protein. Pengembangan teknologi transformasi genetik yang efisien untuk kedelai dapat mempermudah kajian fisiologi dan biologi molekular dan juga produksi kultivar transgenik untuk produktivitas dan kualitas yang lebih tinggi.
Tanaman kedelai transgenik sudah dikembangkan baik menggunakan metode transformasi diperantarai Agrobacterium atau penembakan partikel pada meristem pucuk, buku kotiledon atau jaringan embrionik yang dikultur (Hinchee et al. 1988; Di et al. 1996; Tricker & Finer 1998). Transformasi diperantarai Agrobacterium pada metode buku kotiledon dianggap lebih efisien dalam transformasi kedelai (Olhoft et al. 2003). Efisiensi transformasi kedelai juga dapat ditingkatkan dengan menambahkan antioksidan ke medium ko-kultivasi (Olhoft et al. 2003), sedangkan metode pelukaan yang berbeda juga berhasil digunakan untuk meningkatkan infeksi Agrobacterium ke dalam jaringan target tanaman (Trick and Finer 1998; Xue et al. 2006).
mendapatkan jaringan kotiledon yang dimaserasi pada saringan nilon atau baja, diinfeksi dengan Agrobacterium dan ditempatkan pada medium kultur untuk menghasilkan embrio somatik. Awalnya Hinchee et al. (1988) melaporkan infeksi Agrobacterium pada daerah buku kotiledon (cotyledonary node, CN) untuk menghasilkan kedelai transgenik. Pengembangan protokol CN ini secara aktif dilakukan untuk meningkatkan efisiensi (Clemente et al. 2000; Olhoft et al. 2003; Liu et al. 2004; Paz et al. 2004; Zeng et al. 2004; Hoa et al. 2008). Sistem CN melibatkan pelukaan eksplan yang berasal dari semaian umur 5–7 dengan membuat pemotongan akurat pada sisi adaksial menggunakan pisau bedah. Prosedur pelukaan ini memerlukan pemotongan eksplan yang tepat sebelum infeksi.
Pendekatan transformasi kedelai dengan berbagai bentuk pelukaan eksplan sudah dieksplorasi dan menghasilkan efisiensi transformasi berbeda. Sebagai contoh, sonikasi digunakan untuk membantu transformasi yang diperantarai Agrobacterium (SAAT), baik pada ekspan CN (Meurer et al. 1998) dan kotiledon belum matang (Santarem et al. 1998; Finer & Finer 2000). Perlakuan biolistik digunakan untuk melukai jaringan embrionik yang berasal dari eksplan kotiledon diikuti dengan inokulasi Agrobacterium pada jaringan (Droste et al. 2002). Pelukaan eksplan dari aksis embrionik yang dipotong dari biji belum matang menggunakan garpu pelukaan jarum ganda (Ko et al. 2003) dan kotiledon menggunakan pinset (Yan et al. 2000) juga dilaporkan. Meskipun beberapa perlakuan pelukaan tersebut menyebabkan meningkatnya ekspresi transien gen-gen penanda, tetapi belum mampu meningkatkan pemulihan tanaman transgen-genik stabil, yang sudah dibuktikan menggunakan sistem tanaman yang lain (Wroblewski et al. 2005).
Rekayasa Genetik Kedelai
berlebih gen Δ6, Δ5 desaturase dan GLELO elongase dari Mortierella alpinai yang berperan dalam produksi asam arakhidonat berhasil meningkatkan akumulasi lemak total hingga 8.4% pada biji kedelai (Chen et al. 2006). Sementara itu, Chiera et al. (2004), berusaha meningkatkan kandungan fosfor pada biji kedelai yang sedang berkembang melalui ekspresi ektopik gen penyandi fitase sehingga kandungan asam fitat pada biji bisa diturunkan. Ding et al. (2006). mengekspresikan berlebih basic fibroblast growth factor dari manusia pada biji kedelai dan mengkarakterisasi aktivitas biologisnya. Akumulasi human basic fibroblast growth factor (bFGF) pada biji kedelai mencapai 2.3% dari protein terlarut total. Hal ini menunjukkan bahwa kedelai bisa digunakan untuk memproduksi bahan obat-obatan. Pemanfaatan tanaman kedelai untuk kepentingan medis juga dilakukan oleh Powell et al. (2011) yang berhasil mengekspresikan tiroglobulin manusia homodimer 660 kDa dalam biji kedelai sebagai sumber alternatif tiroglobulin manusia. Kedelai terbukti mampu mengekspresikan protein-protein besar dan kompleks.
El-Shemy et al. (2007), berusaha meningkatkan kualitas protein kedelai dengan memasukkan gen-gen hpt dan V3-1 dan mampu menunjukkan bahwa terdapat akumulasi glisin yang lebih tinggi pada tanaman kedelai transgenik dibandingkan pada tanaman non-transgenik. Peningkatan kualitas protein kedelai juga dilakukan oleh Ishimoto et al. (2010), yang berusaha meningkatkan kandungan asam amino triptofan pada kedelai. Mereka mendapatkan kandungan triptofan total biji kedelai transgenik sekitar dua kali dari biji non-transgenik, artinya galur-galur transgenik menunjukkan peningkatan akumulasi triptofan bebas dalam bijinya.
Arabidopsis untuk meningkatkan tanggap fotosintetik tanaman kedelai selama tercekam panas dan kekeringan. Tanaman dengan konstruk sense hanya mengalami cekaman ringan dibandingkan tanaman antisense yang tercekam sangat hebat. Peningkatan toleransi kedelai terhadap cekaman kekeringan/garam juga dilakukan oleh Seo et al. (2011) yang mengekspresikan gen AtMYB44 dari Arabidopsis. Kedelai transgenik menunjukan peningkatan nyata terhadap cekaman kekeringan/garam, seperti yang terjadi pada Arabidopsis transgenik. Xue et al. (2007), mengekspresikan berlebih gen NTR1 pada kedelai untuk meningkatkan toleransi terhadap cekaman air. Tanaman kedelai transgenik secara konstitutif mengekspresikan NTR1dan mengakumulasi aras metal jasmonat lebih tinggi dibandingkan tanaman tipe liar. Ekspresi berlebih gen pada kedelai transgenik memberikan toleransi terhadap dehidrasi selama perkecambahan benih dan pertumbuhan kecambah, yang tercermin dari persentase berat segar kecambah. Selain itu, tanaman kedelai transgenik juga memiliki kemampuan yang lebih baik terhadap kondisi kekurangan air dibandingkan tanaman tipe liar.
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Maret 2008 sampai dengan September 2011 di Lab. Biotechnology Research Indonesia–The Netherlands (BIORIN) dan Lab. Biologi Molekuler dan Seluler Tanaman (BMST), Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB Bogor. Konstruksi vektor ekspresi dilakukan di Gene Research Center, College of Agriculture Ibaraki University Jepang, dari Desember 2008 sampai dengan April 2009.
Bahan Penelitian
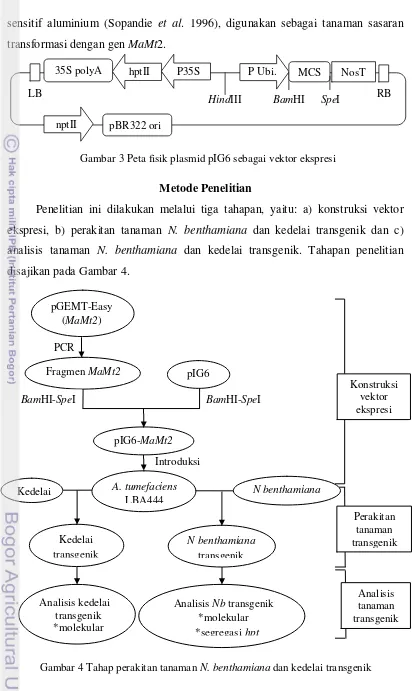
Plasmid pGEM®-T Easy (Promega) dalam bakteri E. coli DH5 yang membawa sisipan gen MaMt2 (Suharsono et al. 2009), digunakan sebagai sumber gen MaMt2. Plasmid pIG6 (Gene Research Center, Ibaraki Univ. Japan) dalam bakteri E. coli DH5 digunakan sebagai vektor ekspresi untuk gen MaMt2 (Gambar 3). Plasmid ini memiliki T-DNA yang mengandung gen hptII (hygromycin phosphotransferase) dan situs pengklonan ganda (multiple cloning sites, MCS) yang diapit oleh promoter Ubiquitin dari jagung dan terminator Nos (nopaline synthase). Plasmid ini mempunyai gen nptII (neomycin phosphotransferase) di luar T-DNA. Plasmid pRK2013 dalam E. coli DH1
digunakan untuk membantu proses transfer gen antar bakteri. Bakteri A. tumefaciens LBA4404 digunakan sebagai inang vektor biner pIG6 rekombinan.
sensitif aluminium (Sopandie et al. 1996), digunakan sebagai tanaman sasaran transformasi dengan gen MaMt2.
Metode Penelitian
Penelitian ini dilakukan melalui tiga tahapan, yaitu: a) konstruksi vektor ekspresi, b) perakitan tanaman N. benthamiana dan kedelai transgenik dan c) analisis tanaman N. benthamiana dan kedelai transgenik. Tahapan penelitian disajikan pada Gambar 4.
Gambar 4 Tahap perakitan tanaman N. benthamiana dan kedelai transgenik Perakitan
Persiapan sumber eksplan N. benthamiana.
Biji-biji N. benthamiana disterilisasi permukaan dengan cara direndam dalam ethanol 70% selama 5 menit, lalu direndam dalam 20% larutan Bayclin (5.25% NaClO) selama 10 menit. Biji-biji selanjutnya dibilas dengan air steril sebanyak lima kali, kemudian dikeringanginkan di atas kertas tissue steril. Sebanyak 25 biji steril dikecambahkan pada media MS0 (garam MS, vitamin MS, 3% sukrosa, 0.3% Gelrite) dalam cawan petri 100 x 20 mm dan dipelihara dalam ruang kultur pada suhu 26oC dalam gelap selama lima hari, dilanjutkan dengan pencahayaan lampu dengan fotoperiode 16 jam, selama satu bulan. Selanjutnya biji dipindahkan dalam botol kultur yang berisi media 1/2MS (1/2x garam MS, vitamin MS, 3% sukrosa, 0.3% Gelrite), dan dipelihara dalam ruang kultur pada suhu 26oC dengan fotoperiode 16 jam, selama satu bulan.
Konstruksi vektor ekspresi plasmid pIG6
cDNA MaMt2 yang telah disisipkan ke dalam pGEMT-Easy (Suharsono et al. 2009) diisolasi dengan PCR. Campuran reaksi PCR yang digunakan adalah 10 ng DNA plasmid, 5x buffer PrimeStar (Takara Co.Ltd.), 0.2 mM dNTP mix, 0.5 µM primer SMt2UF, 0.5 µM primer SMt2UR, 1.25 U PrimeStar HS DNA polymerase (Takara Co.Ltd.) dan ditambahkan ddH2O hingga volume 20 µl. PCR
Plasmid rekombinan diisolasi dari bakteri yang tumbuh di media seleksi menurut metode Suharsono (2002). PCR menggunakan plasmid rekombinan yang diisolasi dari bakteri yang mampu hidup dalam media seleksi sebagai cetakan dilakukan untuk memeriksa keberadaan gen hptII sebagai gen penanda seleksi dan gen MaMt2 sebagai gen sasaran. Primer hptIIF dan hptIIR digunakan untuk memeriksa keberadaan gen hptII. Sedangkan kombinasi primer UbiF dan SMt2UR serta UbiF dan NosTR digunakan untuk memeriksa keberadaan gen MaMt2 yang telah difusikan dengan promoter Ubiquitin dan NosT.
Introduksi vektor ekspresi ke dalam A. tumefaciens LBA4404
Vektor ekspresi pIG6-MaMt2 yang ada dalam E. coliDH5α dimasukkan ke dalam A. tumefaciens LBA4404 dengan bantuan plasmid penolong pRK2013 dalam E. coli DH1 menggunakan metode triparental mating (TPM). Satu koloni A. tumefaciens LBA4404 diambil dan dikultur dalam media LB cair yang mengandung 100 mg/l streptomisin, diinkubasi pada suhu 28oC dalam gelap, dengan penggoyangan pada kecepatan 220 rpm selama dua hari atau hingga OD650
yang tumbuh diisolasi dan dibiakkan dalam media LB. Plasmid diisolasi dari bakteri ini dan keberadaan gen MaMt2 yang difusikan dengan promoter Ubiquitin diperiksa dengan PCR menggunakan primer spesifik UbiF dan SMt2UR serta UbiF dan NosTR.
Transformasi genetik N. benthamiana
Satu koloni A. tumefaciens LBA4404 yang membawa vektor rekombinan pIG6-MaMt2 dikultur dalam LB cair yang mengandung 50 mg/l kanamisin dan 100 mg/l streptomisin pada suhu 28oC, digoyang dengan pada kecepatan 220 rpm selama 2 hari atau hingga OD650 = 1. Sebanyak 1500 µl A. tumefaciens LBA4404
disentrifugasi pada kecepatan 4000 rpm, 5 menit dan endapannya diresuspensi dalam media infeksi (garam MS, vitamin MS, 3% sukrosa, 0.5 mg/l BAP, dan 20 mM asetosiringon), hingga mencapai OD650 = 0.7-0.8. Daun N. benthamiana dari
berdiameter 22 cm dengan media tanah-kompos (1:1) dan dipelihara di rumah kaca sampai dewasa.
Uji integrasi gen MaMt2 di dalam N. benthamiana
Integrasi transgen MaMt2 di dalam genom N. benthamiana transgenik diperiksa dengan melakukan PCR terhadap DNA genom yang diisolasi dari contoh daun tanaman T0 menggunakan Kit Plant DNA Preparation (sesuai prosedur Qiagen). Campuran reaksi yang digunakan adalah 100 ng DNA genom, 0.5 mM primer UbiF dan 0.5 mM primer NosTR, 10 µl PCR mix GoldTaq (Fermentas), ditambah dengan ddH2O hingga volume 20 µl. Kondisi PCR yang
digunakan adalah pra-PCR 95oC, 5 menit; denaturasi 94oC, 60 detik; penempelan
primer 60oC, 60 detik; pemanjangan 72oC, 1 menit 20 detik; dan pemanjangan
akhir 72oC, 5 menit; serta pasca-PCR 20oC, 10 menit, sebanyak 25 siklus,
menggunakan mesin PCR MJ Research. Hasil PCR divisualisasi dalam 1.5% gel agarose (Vivantis) yang diwarnai dengan ethidium bromida (0.5 µg/ml).
Uji segregasi gen hptII di tanaman N. benthamiana transgenik T1