Pemanfaatan Bakteri Rhizoplane dan Fungi Mikoriza Arbuskula (FMA) Untuk Meningkatkan Pertumbuhan Semai Jelutung
(Dyera polyphylla Miq. Steenis.)
Oleh :
Rifa’ Atunnisa , Irdika Mansur, Irnayuli R. Sitepu
Hasil hutan bukan kayu merupakan sumber pendapatan yang penting di hutan tropis, tetapi beberapa jenis pohon penghasil bukan kayu populasinya mengalami penurunan dan terancam kepunahannya karena kegiatan eksploitasi yang terlalu berlebahan. Hal ini meningkatkan perhatian pada jenis jelutung (Dyera polyphylla Miq. Steenis.) karena terjadinya degradasi potensi dalam menghasilkan hasil hutan bukan kayu. Keuntungan dari akar yang berkoloni dengan bakteri rizosfir yang dikenal dengan isilah Plant Growth Promoting Rhizobacteria (PGPR) telah diketahui peranan pentingnya di dalam proses ekosistem, seperti peranannya dalam siklus nutrisi, dan pertumbuhan semai. Asosiasi dari akar tanaman dan fungi yang terdapat di dalam tanah dikenal dengan istilah mikoriza. Objek dari penelitian ini adalah untuk mengetahui efektifitas dari dua jenis Fungi Mikoriza Arbuskula (FMA) jenis Glomus sp., Gigaspora sp., dan 13 jenis bakteri rhizoplane (CK32, FL.13.2.1, JW1, JW6, JW9, JW13, JW14, CK26, CK4, JW3a, SB, NT, CR.R1), pada semai jelutung, dibawah kondisi rumah kaca. Perhitungan persentase infeksi akar, pertumbuhan tanaman, kandungan unsur N dan P dilakukan 150 setelah penanaman. Berdasarkan hasil penelitian menunjukkan bahwa persentase infeksi akar oleh FMA adalah 100%. Perlakuan FMA jenis Glomus sp. secara signifikan meningkatkan pertambahan tinggi tanaman sebesar 18,95% dan pertambahan diameter sebesar 16,16% dari perlakuan tanpa FMA. Perlakuan kombinasi antara bakteri JW 13 dan Glomus sp. meningkatkan berat kering pucuk sebesar 36,28% dan meningkatkan kandungan unsur hara N sebesar 69,59% terhadap kontrol. Kombinasi perlakuan dari bakteri jenis JW1 dan Gigaspora sp. meningkatkan kandungan unsur hara P sebesar 42,05% dari kontrol. Dengan ditemukannya kombinasi dari mikroba yang memiliki banyak manfaat, dapat menjadi rekomendasi di bidang bioteknologi dalam upaya meningkatkan pertumbuahan tanaman.
Utilization of Rhizoplane Bacteria and Arbuscular Mycorrhizal Fungi (AMF) to Promote The Early Growth of Jelutung
(Dyera polyphylla Miq. Steenis.)
By :
Rifa’ Atunnisa, Irdika Mansur, Irnayuli R. Sitepu
Nontimber forest products (NTFPs) represent sources of income from tropical forest, but some NTFP species have decreased in population and become endangered due to overexploitation. There is increasing concern that the planting stock of Dyera polyphylla is not sufficient to sustain the yield of NFTPs. The beneficial root colonizing rhizosphere bacteria, the so-called plant growth-promoting rhizobacteria have been known to carry out many important ecosystem processes, such as those involved in the nutrient cycling and/or seedling establishment. The roots of most plant species associate with certain soil fungi and establish what are known as mycorrhiza. The objective of this study was to determine the effect of two arbuscular miycorrhizal (AMF) fungi, Glomus sp.,
Gigaspora sp. and thirteen strains of rhizoplane bacteria (CK32, FL.13.2.1, JW1, JW6, JW9, JW13, JW14, CK26, CK4, JW3a, SB, NT, CR.R1), on the early growth of D. polyphylla, under greenhouse condition. Percentage of AMF colonization, plant growth, and nitrogen (N) and phosphorus (P) concentration were measured after 150 days of planting. The results showed that the percentage of AM colonization of D. polyphylla was 100%. Colonization by Glomus sp. significanly increased plant height by 18,95% and diameter by 16,16% compared to those non AMF. Combination of bacterial and AMF inoculant between JW13 dan Glomus sp. increased shoot weight by as much as 36,28% from control and increased N concentration by 69,59% compared to those of non inoculate a seedlings. Combination of JW1 and Gigaspora sp. increased P concentration by as much as 42,05% compared to those of non inoculate seedlings. Despite the difficulty of selecting a multifunctional microbial consortia, appropriate microbial combinations can be recommended for a biotechnological input related to improvement of plant performance.
BAB I
BAB I
PENDAHULUAN
1.1. Latar Belakang
Jelutung (Dyera polyphylla Miq. Steenis.) merupakan jenis pohon dari famili Apocynaceae. Kayu jelutung termasuk dalam kelas awet V, kayunya ringan dan lunak sehingga mudah dikerjakan. Kayu jelutung digunakan untuk papan lukis, pensil, korek api, bingkai, bahan ukiran, mebel dan getahnya sebagai bahan baku pembuatan permen karet (Whitmore 1972; Martawijaya et al. 1981).
Menurut Puslitbang (1994) potensi jenis jelutung di hutan-hutan alam diduga semakin berkurang. Hal ini disebabkan oleh penebangan pohon untuk dimanfaatkan kayunya, selain itu dikhawatirkan karena banyaknya pohon yang rusak atau mati akibat praktek penyadapan getah yang tidak sesuai dengan aturan. Sementara itu permudaan alam jenis jelutung ini sangat jarang terjadi, sedangkan budidayanya belum pernah dilakukan untuk menjaga kelestarian dan meningkatkan produksi baik getah maupun kayu jelutung. Oleh karena itu usaha budidaya pohon jelutung perlu dilakukan. Sebagai tahap awal dari upaya tersebut adalah pengadaan bibit yang berkualitas.
Nitrogen adalah elemen penting bagi tanaman. Nitrogen merupakan unsur yang paling biasa digunakan dalam program pemupukan, karena jumlahnya yang diperlukan banyak (sebagai salah satu unsur makro), mobilitasnya dalam sistem tinggi, dan proporsi nitrogen total yang tersedia dalam tanah untuk digunakan tumbuhan kecil. Oleh karena itu, dalam prakteknya, nitrogen yang dibutuhkan tanaman banyak terpenuhi oleh pupuk anorganik. Namun pupuk anorganik dapat memberikan dampak negatif terhadap lingkungan jika terakumulasi secara terus menerus sehingga penggunaan biofertilizer sangat dianjurkan untuk mengurangi dampak negatif dari penggunaan pupuk anorganik.
dimana keberadaan bakteri-bakteri ini dapat menstimulasi pertumbuhan tanaman yang tumbuh pada tanah tersebut (Werner 2003).
Semenjak ditemukannya teknik isolasi dari Clostridium pasteurianum oleh Winogradsky pada tahun 1893, serta isolasi Azotobacter chroococcum dan
Azotobacter agilis oleh Beijerinck pada tahun 1901, pengetahuan mengenai mikroorganisme penambat nitrogen nonsimbiotik mulai berkembang.
Mikoriza merupakan hubungan yang saling menguntungkan antara cendawan dengan tumbuhan tinggi. Fungi Mikoriza Arbuskula (FMA) dapat dikatakan sebagai alternatif pengganti pupuk anorganik, karena mikoriza bersifat
biofertilizer yang berfungsi untuk membantu penyediaan hara bagi tanaman, mempermudah penyerapan hara bagi tanaman, mencegah terserangnya dari penyakit tertentu, menciptakan lingkungan rizosfir yang lebih baik, sehingga pada akhirnya akan mendukung pertumbuhan dan meningkatkan produksi tanaman.
Berdasarkan uraian permasalahan di atas maka dalam penelitian ini mencoba untuk mengaplikasikan mikoriza dan PGPR sebagai pupuk hayati untuk meningkatkan pertumbuhan semai jelutung. Dari hasil penelitian Sitepu (2007) telah diidentifikasi sejumlah bakteri penambat nitrogen nonsimbiotik dari hasil
screening PGPR pada tanaman Dipterocarpaceae. Dari beberapa bakteri fiksasi nitrogen nonsimbiotik ini perlu dilakukan pengujian lebih lanjut, sehingga keefektifan dari isolat-isolat bakteri yang telah ditemukan tersebut dapat diketahui dengan jelas.
1.2.Tujuan
Tujuan dari penelitian ini adalah untuk mengetahui efektivitas isolat bakteri dan Fungi Mikoriza Arbuskula (FMA), yang berasal dari 13 isolat bakteri (Tabel 1) dan dari inokulum fungi mikoriza jenis Glomus sp. (G1). dan Gigaspora
sp.(G2), untuk meningkatkan pertumbuhan semai jelutung.
1.3.Hipotesis
BAB II
TINJAUAN PUSTAKA
2.1 Jelutung (Dyera polyphylla Miq. Steenis)
Jelutung rawa (Dyera polyphylla Miq. Steenis = Dyera lowii Hook.f.) termasuk keluarga Apocynaceae, genus Dyera. Tumbuhan ini dikenal pula menghasilkan getah dan kayu yang bernilai ekonomi tinggi (Withmore 1972; Heyne 1987).
Perhatian terhadap jelutung meningkat setelah sumber bahan baku permen karet yaitu pohon Achras zapota, salah satu jenis pohon tropis dari Amerika Tengah populasinya menipis karena penyadapan getahnya yang serampangan, sehingga menjadi semakin langka. Pada tahun 1940 jelutung dapat menggantikan lateks pohon Achras zapota seluruhnya. Mulai tahun 1970 dengan berkembangnya eksploitasi hutan di luar jawa, pohon jelutung juga ditebang untuk dimanfaatkan kayunya. Walaupun keawetannya termasuk rendah, lunak dan tidak tahan lama, kayu jelutung sangat disukai konsumen karena mudah dikerjakan, permukaannya halus dan warnanya putih menarik (Puslitbang 1994).
2.1.1 Budidaya
Menurut Puslitbang (1994) di Indonesia belum pernah dilakukan pembudidayaan tanaman jelutung, kecuali yang ditemukan Van Wijk pada tahun 1950 di Kalimantan Tengah, yaitu di sekitar Kampung Kanamit dan Buntui di daerah hilir sungai Kahayan dengan luas tanaman yang relative kecil.
Di hutan alam jelutung menyebarkan bijinya dengan bantuan angin. Jatuhnya biji-biji yang bersayap dan sangat ringan ini berlangsung secara berangsur-angsur, terpencar-pencar pada areal yang sangat luas dan hanya sedikit yang berhasil tumbuh dan mencapai tahap anakan.
2.1.2 Sifat Botanis
berangsur-angsur memipih apabila buah menjadi tua. Biji berbentuk oval dan pipih, kulit biji berupa selaput tipis yang melebar dan memanjang membentuk sayap. Biji sebanyak 12-36 tersusun dalam dua baris yang berhimpitan di dalam polong kayu. Daun tunggal tersusun melingkar pada ranting sebanyak 4-8, berbentuk lonjong atau bulat telur, ujung daun membulat, panjang 15-20 cm lebar 6-8 cm. Batang memiliki kulit luar rata tetapi kasar, tebal kulit batang 1-2 cm, tidak berbulu, bergetah putih, kayu berwarna putih sampai kuning, halus dan tidak berteras.
Pohon berpenampilan besar dan tinggi, dengan tinggi pohon dapat mencapai 60 meter, diameter 260 cm, bentuk batang silindris, tidak berbanir, kulit batang abu-abu atau kehitam-hitaman, tajuk tipis atau jarang.
Berdasarkan kebutuhannya terhadap naungan jelutung termasuk pohon yang membutuhkan naungan pada waktu muda, tetapi kemudian memerlukan cukup cahaya untuk pertumbuhan selanjutnya.
2.1.3 Penyebaran dan Tempat Tumbuh
Di Indonesia pohon jelutung terdapat di Sumatra, Bangka, Belitung, Riau, Kalimantan dan Sulawesi. Menurut Foxworthy (1927) dalam Puslitbang (1994) jelutung tumbuh di tanah organosol, khususnya di hutan rawa gambut.
2.2 Mikoriza
Mikoriza adalah asosiasi simbiotik yang esensial untuk satu atau kedua mitra, antara fungi (khususnya yang hidup dalam tanah dan tanaman) dan akar (atau organ lain yang bersentuhan dengan substrat) dari tanaman hidup, terutama bertugas untuk memindahkan hara. Mikoriza terdapat dalam organ tanaman spesifik dimana hubungan intimnya tercipta sebagai akibat perkembangan serempak tanaman-fungi (Brundrett 2004). Dalam fenomena ini fungi menginfeksi dan mengkoloni akar tanpa menimbulkan nekrosis sebagaimana biasa terjadi pada infeksi fungi patogen, dan mendapat pasokan nutrisi secara teratur dari tanaman (Rao 1994).
2.2.1 Tipe-tipe mikoriza
Ektomikoriza yaitu mikoriza yang pada permukaan luar akar terbentuk selubung jalinan hifa fungi.
Endomikoriza yaitu fungi pembentuk mikoriza berkembang hanya dalam sel-sel korteks akar dan tidak terbentuk selubung hifa pada akar.
Ektendomikoriza yaitu struktur yang memiliki kedua ciri-ciri tersebut. Adanya fungi di sel-sel korteks dan juga terbentuknya hifa pada permukaan akar.
Marx dalam Fakuara et al. (1993) menyatakan bahwa semai yang akarnya bermikoriza lebih tahan terhadap patogen akar dibandingkan dengan semai yang tidak bermikoriza. Mekanisme yang memungkinkan dapat meningkatkan ketahanan terhadap patogen akar adalah sebagai berikut :
1. Pemanfaatan surplus karbohidrat di dalam akar sehingga stimulan untuk patogen akar berkurang.
2. Hifa mantel jadi penghambat bagi penetrasi patogen akar.
3. Mengeluarkan sekresi antibiotik yag mengahambat patogen akar.
4. Sepanjang rizosfir terdapat perlindungan oleh populasi mikroorganisme.
2.2.2 Fungi Mikoriza Arbuskula (FMA)
Istilah endomikoriza adalah digunakan untuk membedakan tipe mikoriza ini dari ektomikoriza, karena pada endomikoriza biasanya tidak ada sarung miselium fungi di sekitar akar yang terinfeksi mikoriza seperti halnya pada akar yang terinfeksi ektomikoriza (Fakuara 1988)
Karakteristik utama dari FMA ialah biotrof obligat yang berarti bahwa setiap tahap daur hidupnya harus berasosiasi dengan tanaman hidup. Sebagaimana halnya fungi berfilamen pada umumnya, perbanyakan FMA berlangsung melalui diferensiasi dan perkecambahan spora atau dengan perpanjangan miselium yang menembus tanah dan akar. Diferensiasi spora terjadi melalui penggelembungan interkalar atau apical pada hifa (Nusantara et al. 2008).
FMA dapat dibedakan dari ektomikoriza, karena beberapa karakteristik (Setiadi 1989) yakni :
1. Perakaran yang terinfeksi tidak membesar.
3. Hifa yang menyerang masuk ke dalam individu sel jaringan korteks dan endodermis.
4. Adanya struktur khusus berbentuk oval yang disebut vesikula dan sistem percabangan hifa yang disebut arbuskula.
2.2.3. Peranan Fungi Mikoriza Arbuskula (FMA)
Peranan Fungi Mikoriza Arbuskula (FMA) sebagai agen pengendali hayati sudah banyak dibuktikan, namun bagaimana mekanismenya belum diketahui dengan baik. Dalam upaya memahami mekanisme pengendalian hayati patogen tular tanah oleh FMA, pengetahuan tentang keragaman genetik FMA dari sisi agen pengendali hayati sangat penting (Sukarno dan Setiadi 2001).
2.3 Bakteri
Dalam tanah, bakteri akan dijumpai dalam bentuk koloni di sekitar atau sekeliling butir tanah yang mengandung bahan makanan. Selama bahan makanan masih tersedia, koloni bakteri akan terus dijumpai di tempat itu. Dengan demikian akan selalu terjadi fluktuasi yang hebat disebabkan oleh perkembangan yang pesat dan kematian karena kekurangan atau kelebihan bahan makanan (Setiadi 1989). Menurut Agrios (1996) bakteri adalah mikroorganisme sederhana, yang mana biasanya terdiri atas sel prokariot tunggal. Meskipun bakteri berukuran kecil dimana panjangnya kurang lebih beberapa mikrometer, tetapi mereka menonjol di dalam tanah karena jumlahnya besar.
Dalam tanah bakteri merupakan kelompok mikroflora dominan dengan massa sel melebihi setengah dari biomassa mikroba tanah. Umumnya jumlah bakteri melimpah pada permukaan tanah dan semakin berkurang kearah semakin dalam dari permukaan tanah sejalan dengan semakin berkurangnya bahan organik yang terkandung dalam tanah (Ma’sum et al. 2003).
2.3.1 Bakteri Penambat N
nitrogen ialah proses pertukaran nitrogen udara menjadi nitrogen dalam tanah oleh jasad renik tanah yang simbiotik dan non simbiotik. Kapasitas bakteria non simbiotik mengikat nitrogen atmosferik dan sejumlah nitrogen tertentu sebagaian besar adalah tergantung pada tanah dan konsentrasi tersedianya energi ( Sutedjo et al. 1991).
2.4 Rizosfir (Rhizophere)
Rizosfir merupakan zona tanah yang dipengaruhi akar dan dapat mempunyai populasi organisme berlipat ganda lebih banyak dibandingkan dengan tanah yang tidak terpengaruh akar (Vancura et al. 2000).
Menurut Rao (1994) istilah rizosfir diperkenalkan pada tahun 1904 oleh Hiltner, seorang ilmuan Jerman untuk menunjukkan bagian tanah yang lebih dipengaruhi oleh perakaran tanaman. Rizosfir dicirikan oleh lebih banyaknya kegiatan mikrobiologis dibandingkan kegiatan di dalam tanah yang jauh dari perakaran tanaman.
Kehidupan bersama antara mikrobia dan tanaman berlangsung di rizosfir tanaman, karena di daerah inilah tersedia sejumlah senyawa yang diperlukan oleh mikrobia untuk kehidupan dan aktivitasnya. Eksudat akar mengandung variasi asam amino dan vitamin sebagai nutrisi bagi mikroba dan faktor tumbuh (Tate 2000).
2.5 Rhizoplane
Rhizoplane merupakan permukaan akar dalam tanah. Rhizoplane adalah tempat dimana air dan nutrisi diserap dan tempat dilepaskannya bahan-bahan eksudat. Seperti halnya rizosfir, rhizoplane dapat pula mempengaruhi lingkungan dalam tanah (Anonim 2004).
2.6 PGPR (Plant Growth Promoting Rhizobacteria)
PGPR merupakan bakteri non simbiotik tanah yang secara alami terdapat di dalam tanah yang memiliki kemampuan untuk mengkolonisasi akar dan meningkatkan pertumbuhan tanaman ketika diberikan pada benih atau akar (Kloepper dan Schroth 1978).
Mekanisme langsung dari PGPR memberikan fungsi meliputi penyediaan P dan Fe tersedia untuk tanaman, terjadinya penambat nitrogen yang digunakan oleh tanaman, produksi hormon tanaman seperti auksin, sitokinin, dan geberelin dan menurunkan tingkat etilen pada tanaman (Glick 1995; Lucy et al. 2004).
Fungsi PGPR secara tidak langsung terhadap pertubuhan tanaman meliputi pertahanan tanaman terhadap satu atau lebih organisme phytopathogenik, memproduksi antibiotik, siderophores dan berbagai enzim. PGPR juga diketahui dapat mengurangi keracunan terhadap logam berat pada tanaman (Burd et al. 2000).
2.7 Interaksi Dalam Rizosfir
Di dalam rizosfir terjadi berbagai interaksi sinergisme maupun antagonisme. Salah satu interaksi di dalam rizosfir yang mendapat perhatian adalah interaksi antara FMA (simbiosis obligat) dengan bakteri yang hidup bebas di rizosfir (Rizobakteri). Dalam rangka pemanfaatan mikroorganisme untuk membentuk peningkatan pertumbuhan tanaman, banyak dilakukan inokulasi ganda antara dua kelompok organisme, seperti mikoriza dan bakteri penambat N, bakteri pelarut P dan bakteri penghasil faktor tumbuh (Pujiyanto 2001).
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2008 - Mei 2009, bertempat di Laboratorium Mikrobiologi dan Rumah Kaca Pusat Penelitian dan Pengembangan Kehutanan Bogor.
3.2 Alat dan Bahan
Alat yang digunakan untuk kegiatan di Laboratorium adalah neraca analitik, cawan Petri, Erlenmeyer, gelas ukur, sendok pengaduk, pipet, jarum ose,
Laminar Air Flow Cabinet, bunsen, hot plate, autoclave, Centrifuges, mesin
shaker, alumunium foil, plastic wrap, tissue, gunting, kertas label, oven, mikroskop binokuler, plastik, tabung film, preparat slide, jarum, alat hitung. Sedangkan peralatan untuk produksi di rumah kaca adalah pot plastik, bak kecambah, alat penyiram, kamera, mistar, caliper, dan alat tulis.
Bahan yang digunakan pada saat pengecambahan benih adalah media kecambah (tanah, ziolit, sekam), benih jelutung. Untuk perlakuan digunakan inokulum fungi mikoriza Glomus sp. (G1). dan Gigaspora sp. (G2), 13 isolat bakteri (CK32, FL.13.2.1, JW1, JW6, JW9, JW13, JW14, CK26, CK4, JW3a, SB, NT, CR.R1), batu zeolit. Isolat bakteri dan inokulum fungi mikoriza didapat dari koleksi bakteri dan mikoriza di Puslitbang Bogor. Jenis bakteri dapat dilihat pada Tabel 1. Untuk perbanyakan bakteri, bahan yang dibutuhkan adalah Nutrient Broth (tanpa agar) 10%, NaCl 0,7%, dan air steril. Untuk bahan yang digunakan dalam pewarnaan dan pengamatan infeksi akar yaitu aquades, KOH 2,5%, HCl 2%, Tryphan blue, glycerin dan cat kuku.
3.3 Metode Pelaksanaan Penelitian
3.3.1 Persiapan media semai dan media sapih
dari media tersebut. Setelah itu campuran tanah, pasir dan sekam diaduk, kemudian dimasukkan ke dalam bak kecambah (campuran tanah, sekam, dan zeolit dengan perbandingan 2 : 1 : 1). Untuk media sapih yang digunakan adalah tanah yang dimasukkan ke dalam polybag.
3.3.2 Persiapan semai
Sebelum disemaikan buah jelutung dijemur kurang lebih selama 2 hari sampai buah merekah dan bijinya tampak. Setelah itu biji dibersihkan dari sayapnya dan ditabur dalam media kecambah yang telah dipersiapkan. Bak kecambah disiram secukupnya sesuai dengan kebutuhan untuk tetap menjaga kelembaban media perakaran.
3.3.3 Perbanyakan isolat bakteri
Sebanyak 13 isolat bakteri diperbanyak dengan menggunakan Media Nutrient Broth. Nutrient Broth dibuat berkadar 10% sehingga untuk membuat satu liter media diperlukan 0,8 gram Nutrient Broth. Kemudian media tersebut dilarutkan dalam Erlenmeyer dengan bantuan hot plate hingga media benar-benar larut. Setelah itu, media Nutrient Broth dimasukkan ke dalam Erlenmeyer berukuran 250 ml sebanyak jumlah isolat bakteri yang diperbanyak masing-masing 50 ml. Kemudian Erlenmeyer yang berisi media Nutrient Broth dibungkus bagian lehernya dengan alumunium foil untuk disterilisasi dengan cara dimasukkan dalam autoclave dengan suhu 121°C dan tekanan 1 atm selama 20 menit.
3.3.4 Pembuatan larutan isolat bakteri
Media cair hasil perbanyakan bakteri kemudian dituangkan ke dalam tabung centrifuges. Sebelumnya tabung centrifuges dibilas dengan aquades steril terlebih dahulu, hal ini dilakukan agar tabung centrifuges dalam keadaan steril. Setelah dituang, media cair hasil perbanyakan diendapkan dengan cara dicentrifuge agar bakteri mengendap di dasar tabung. Tabung dicentrifuge dengan kecepatan 4000 rpm selama 10 menit.
Centrifuge dilakukan sebanyak tiga kali. Centrifuges pertama semua media cair sebanyak 50 ml dimasukkan dalam tabung sentrifuge. Untuk menyamakan berat, kerena dalam pemindahan ke dalam tabung dimungkinkan terjadi tumpah, dapat ditambah dengan larutan NaCl 0,7%. Setelah 10 menit pertama cairan yang ada dalam tabung dibuang sehingga hanya ada endapan isolat bakteri saja. Setelah itu pada centrifuges kedua endapan bakteri dicampur dengan larutan NaCl 0,7 % sebanyak 100 ml. Perlu dipastikan kembali tabung yang akan dimasukkan ke dalam alat centrifuges memiliki berat yang sama. Penambahan larutan NaCl ini dilakukan pula pada centrifuge ketiga yang sebelumnya larutan NaCl dibuang sampai diperoleh hanya endapan bakterinya saja. Setelah centrifuge
ketiga selesai larutan NaCl dibuang, kemudian endapan isolat bakteri dilarutkan pada air steril sebanyak 100 ml dan dipindahkan pada tabung lain. Perlu dipastikan bahwa endapan bakteri larut semua dalam air steril. Kemudian untuk mengikat bakteri larutan diberi gelan gum sebanyak 0,3 gr dan diaduk sampai rata.
3.3.5 Inokulasi mikoriza dan inokulasi bakteri
Setelah inokulan mikoriza dan bakteri siap diinokulasikan, terlebih dahulu dilakukan penyiapan media sapih, dan penyapihan tanaman jelutung.
3.3.5.1Pembuatan media sapih
tengah media dalam polybag, ± 5 cm dari permukaan media. Kemudian polybag
diberi label sesuai dengan perlakuan.
3.3.5.2Penyapihan jelutung
Tanaman jelutung yang sudah berkecambah dan telah memiliki minimal dua helai daun sudah dapat disapih. Tanaman jelutung yang sudah disapih kemudian dibersihkan akarnya menggunakan air dan dicelupkan ke dalam air steril.
3.3.5.3Inokulasi bakteri
Tanaman jelutung yang telah dicelupkan ke dalam air steril kemudian sesuai dengan perlakuan yang diberi bakteri, dicelupkan pada larutan bakteri yang telah disiapkan selama 30 menit. Perlu dipastikan akar dari tanaman jelutung terendam larutan bakteri. Setelah 30 menit tanaman jelutung dipindahkan ke dalam polybag yang telah diberi media sapih sesuai dengan label perlakuan pada
polybag. Perlu dipastikan agar tidak salah dalam penempatan pada polybag. Kemudian setelah tanaman berada dalam lubang polybag, larutan bakteri kembali dimasukkan dengan menggunakan mikro pipet sebanyak 1 ml kemudian akar dalam lubang ditutup dengan media sapih dan dipadatkan.
3.3.5.4Inokulasi fungi mikoriza
Tanaman jelutung yang akan diberi perlakuan mikoriza, dimasukkan ke dalam polybag yang telah diisi media. Kemudian pada lubang yang telah ditempatkan tanaman, diberi inokulum fungi mikoriza sesuai dengan jenis perlakuannya sebanyak 5 gr kemudian akar dalam lubang ditutup dengan media sapih dan dipadatkan.
3.3.6 Pemeliharaan
Untuk pemeliharaan dilakukan penyiraman dengan air biasa sebanyak dua kali dalam sehari (pagi dan sore) tergantung kondisi media. Jika media dalam kondisi basah atau lembab maka cukup disiram sekali saja (pagi atau sore). Untuk pengendalian hama dilakukan secara manual dengan mematikan hama dan pencabutan gulma disekitar media tanah. Jika tanaman terserang penyakit maka dilakukan isolasi.
3.3.7 Pengamatan parameter dan pengumpulan data
Dalam pengamatan, parameter yang diamati adalah : (1) tinggi tanaman (2) diameter tanaman (3) pengukuran berat kering akar dan pucuk (4) perhitungan IMB (Indeks Mutu Bibit) (5) persentase infeksi akar FMA (6) analisis jaringan (N, P). Untuk pengamatan tinggi dan diameter dilakukan di rumah kaca, untuk pengukuran biomassa dilakukan di laboratorium mikrobiologi Puslitbang Kehutanan, sedangkan analisis jaringan unsur N dan P dilakukan di laboratorium departemen Ilmu Tanah dan Sumberdaya Lahan IPB.
3.3.7.1Tinggi tanaman
Pengukuran tinggi tanaman dilakukan setiap satu bulan sekali selama lima bulan. Tinggi diukur dari pangkal batang sampai titik tumbuh tunas yang paling muda.
3.3.7.2Diameter tanaman
Pengukuran diameter dilakukan setiap satu bulan sekali selama lima bulan. Diameter diukur pada pangkal batang dengan menggunakan alat caliper.
3.3.7.3Pengukuan Berat Kering Akar dan Pucuk
IMB = A + B C/D + A/B
3.3.7.4Perhitungan IMB (Indeks Mutu Bibit)
Menurut Lackey dan Alm (1982) dalam Hendromono (1987), Indeks Mutu Bibit dapat dihitung dengan menggunakan rumus :
Keterangan : IMB = Indeks Mutu Bibit A = Bobot kering pucuk (g) B = Bobot kering akar (g) C = Tinggi tanaman (cm) D = Diameter tanaman (mm) 3.3.8.5 Persentase infeksi akar FMA
Identifikasi persentase infeksi akar dilakukan dengan cara mengambil contoh akar yang muda (serabut) secara acak dari polybag kemudian dilakukan proses pembersihan dan pewarnaan akar. Menurut Setiadi et al.(1992), pengukuran persen infeksi dapat dilakukan dengan cara sebagai berikut :
1. Akar diambil, dicuci dengan air biasa untuk melepaskan semua miselium luar. 2. Bagian akar muda (serabut) diambil dan dimasukkan ke dalam tabung reaksi
atau tabung film bekas dan direndam dalam larutan KOH 2,5%, dibiarkan selama semalam atau akar sampai berwarna kuning bersih.
3. Setelah akar berwarna kuning bersih larutan KOH 2,5% dibuang dan akar dibilas dengan air.
4. Akar diasamkan dengan HCl 2%, dibiarkan semalam atau sampai akar berwarna kuning jernih.
5. HCl 2% dibuang, diganti dengan larutan staining (gliserol, asam laktat dan aquades dengan perbandingan 2 : 2 : 1 dan ditambah Tryphan blue sebanyak 0,05%), kemudian dibiarkan semalam.
6. Larutan staining dibuang dan diganti dengan larutan destaining (larutan
staining tanpa Tryphan blue) dan dibiarkan semalam.
8. Potongan-potongan akar pada kaca preparat diamati dengan mikroskop stereo pada setiap bidang pandang.
Akar yang terinfeksi oleh FMA dicirikan oleh adanya : vesikula, arbuskula atau hifa. Persen infeksi akar akan dihitung berdasarkan jumlah bidang pandang akar terinfeksi dibagi dengan jumlah bidang pandang akar yang diamati (Budi 1989).
Persentase akar yang terinfeksi dapat dihitung dengan rumus : 100% diamati
yang akar pandang Bidang
feksi akar terin pandang
Bidang (%)
feksi
Akar terin = ×
∑
∑
3.3.8.6Analisis jaringan
Analisis jaringan dilakukan pada jaringan daun. Analisis dilakukan sebanyak 3 kali ulangan pada setiap perlakuan. Pada penelitian ini penulis memberikan 126 sampel daun kepada Laboratorium Ilmu Tanah dan Sumberdaya Lahan untuk dilakukan analisis jaringan unsur Nitrogen dan Fosfor.
3.3.9 Rancangan percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Kelompok (RAK) dengan 42 perlakuan, masing-masing perlakuan diulang sebanyak sepuluh kali. Dengan demikian, jumlah total polybag
pengamatan seluruhnya berjumlah 420 polybag.
Adapun kombinasi perlakuan yang diujicobakan adalah sebagai berikut : 1. Kontrol (K)
12.Bakteri 11 (CR R1) 13.Bakteri 12 (Jw 9) 14.Bakteri 13 (SB)
15.Mikoriza Glomus sp.(G1)
16.Mikoriza Glomus sp. dikombinasikan dengan bakteri 01 (Jw1 G1) 17.Mikoriza Glomus sp. dikombinasikan dengan bakteri 02 (Jw13 G1) 18.Mikoriza Glomus sp. dikombinasikan dengan bakteri 03 (Jw14 G1) 19.Mikoriza Glomus sp. dikombinasikan dengan bakteri 04 (Jw3a G1) 20.Mikoriza Glomus sp. dikombinasikan dengan bakteri 05 (Ck 4 G1) 21.Mikoriza Glomus sp. dikombinasikan dengan bakteri 06 (Nt G1) 22.Mikoriza Glomus sp. dikombinasikan dengan bakteri 07 (Ck26 G1) 23.Mikoriza Glomus sp. dikombinasikan dengan bakteri 08 (Ck32 G1) 24.Mikoriza Glomus sp. dikombinasikan dengan bakteri 09 (FL13.2.1 G1) 25.Mikoriza Glomus sp. dikombinasikan dengan bakteri 10 (Jw6 G1) 26.Mikoriza Glomus sp. dikombinasikan dengan bakteri 11 (CR R1 G1) 27.Mikoriza Glomus sp. dikombinasikan dengan bakteri 12 (Jw9 G1) 28.Mikoriza Glomus sp. dikombinasikan dengan bakteri 13 (SB G1) 29.Mikoriza Gigaspora sp.(G2)
Adapun model rancangan yang digunakan menurut Mattjik (2000) adalah sebagai berikut :
Dimana :
Yijk : Nilai dari pengamatan yang memperoleh i faktor pemberian mikoriza dan taraf j faktor pemberian bakteri pada ulangan ke- k
µ : Nilai rata-rata umum
γi : Nilai pengaruh taraf kelompok ke-i
αj : Nilai pengaruh taraf faktor pemberian mikoriza ke-j
βk : Nilai pengaruh taraf faktor pemberian bakteri ke-k (αβ)jk : Nilai interaksi pemberian mikoriza ke-j dan bakteri ke-k
εijk : Nilai galat dari unit percobaan yang diberikan taraf j faktor pemberian mikoriza dan taraf k faktor pemberian bakteri pada ulangan ke-i
Untuk mengetahui pengaruh perlakuan yang diberikan terhadap peubah yang diamati, maka dilakukan analisis data dengan menggunakan program Minitab. Bila pengaruh yang diberikan menunjukkan perbedaan yang nyata maka dilakukan uji lanjut Duncan.
Tabel 1 Daftar isolat bakteri
No Kode Tanaman
Inang
Tempat Tegakan Lokasi Strain Bakteri Subklas No.
Asosiasi Bank Gen
Panjang (Bp)
1. CK32 S. balangeran Rhizoplane Tiang-1th Tiang-3th
Nursery UP
Burkholderia sp. β Proteobacteria DQ195894 370 2. FL.13.2.1 S. leprosula Rhizoplane Tiang Carita Enterobacter sp. γ Proteobacteria DQ091238 1556 3. JW1 S. selanica Rhizoplane Semai-7bln FNCRDC Burkholderia sp. β Proteobacteria - 358 4. JW6 S. selanica Rhizoplane Semai-7bln FNCRDC Burkholderia sp. β Proteobacteria - 1333 5. JW9 S. selanica Rhizoplane Semai-7bln FNCRDC Burkholderia sp. β Proteobacteria - 1230 6. JW13 S. selanica Rhizoplane Semai-7bln FNCRDC Azospirillum sp. γ Proteobacteria - 946 7. JW14 S. selanica Rhizoplane Semai-7bln FNCRDC Azospirillum sp. γ Proteobacteria - 1333 8. CK26 S. teysmanniana Rhizoplane Tiang-1th Nyaru
Menteng
Azospirillum sp. γ Proteobacteria - 1385 9. NICK4 S. balangeran Rhizoplane Tiang-1th Nursary
UP
TI TI - TI
10. NIJW3a S. selanica Rhizoplane Semai-7bln FNCRDC TI TI - TI
11. SB S. Balangeran Rhizoplane TI TI TI TI
12. NT Palaquium Rhizoplane TI TI TI TI
13. CR R1 Combretocarpus rotumdum
Rhizoplane TI TI TI TI
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Pengujian Mikoriza, Isolat Bakteri dan Kombinasinya terhadap Parameter Pertumbuhan Semai Jelutung
Beberapa parameter yang diamati dalam pertumbuhan semai jelutung yang telah diberi perlakuan diantaranya adalah pertumbuhan tinggi tanaman, pertumbuhan diameter tanaman, persentase infeksi akar FMA, pengukuran berat kering, dan analisis jaringan terhadap unsur P dan N. Rekapitulasi hasil analisis sidik ragam pertumbuhan semai jelutung disajikan pada Tabel 2.
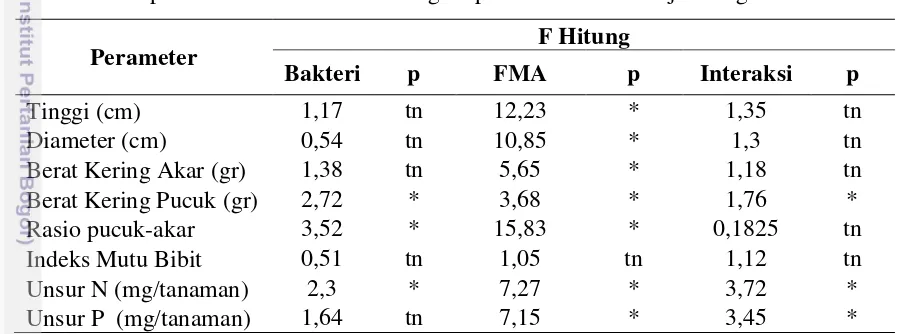
Tabel 2 Rekapitulasi hasil analisis sidik ragam pertumbuhan semai jelutung
Perameter F Hitung
Bakteri p FMA p Interaksi p
Tinggi (cm) 1,17 tn 12,23 * 1,35 tn
Diameter (cm) 0,54 tn 10,85 * 1,3 tn
Berat Kering Akar (gr) 1,38 tn 5,65 * 1,18 tn
Berat Kering Pucuk (gr) 2,72 * 3,68 * 1,76 *
Rasio pucuk-akar 3,52 * 15,83 * 0,1825 tn
Indeks Mutu Bibit 0,51 tn 1,05 tn 1,12 tn
Unsur N (mg/tanaman) 2,3 * 7,27 * 3,72 *
Unsur P (mg/tanaman) 1,64 tn 7,15 * 3,45 *
Keterangan: tn : tidak nyata; * : nyata; (p<0,05), pada selang kepercayaan 95%
4.1.2 Tinggi Semai
Parameter tinggi semai jelutung diukur setelah penyapihan. Pengukuran dilakukan setiap satu bulan sekali selama 5 bulan. Selama 5 bulan pengamatan diperoleh 6 data pengukuran, dimana data awal setelah penyapihan atau bulan ke nol ikut dimasukkan ke dalam data. Pengolahan data yang digunakan adalah data pertambahan tinggi, yang diperoleh dari data tinggi pada bulan ke lima yang dikurangi dengan data tinggi bulan ke nol.
Gigaspora sp. memberikan nilai rata-rata pertambahan tinggi yang lebih besar daripada perlakuan tanpa FMA (Tabel 3).
Tabel 3 Uji lanjut Duncan Pertambahan tinggi semai jelutung
Perlakuan Rata-rata (cm)
Peningkatan terhadap Perlakuan
tanpa FMA (%)
Glomus sp. (G1) 5,71a 18,95
Gigaspora sp. (G2) 5,36a 11,67
Tanpa FMA 4,80b 0
Keterangan : huruf yang berbeda menunjukkan pengaruh yang berbeda nyata berdasarkan uji lanjut Duncan pada selang kepercayaan 95%.
Inokulasi FMA jenis Glomus sp. memberikan pengaruh yang lebih baik yaitu 18,95% dibandingkan dengan perlakuan tanpa FMA (Tabel 3).
Perlakuan inokulasi bakteri dan interaksi antara FMA dan bakteri, memberikan pengaruh yang tidak nyata terhadap pertambahan tinggi pada selang kepercayaan 95%. Rekapitulasi data dapat dilihat pada lampiran 1. Pertumbuhan tinggi semai jelutung dapat dilihat pada Gambar 1.
a -1 0 1 2 3 4 5 6 7
0 1 2 3 4 5 6
b
Gambar 1 Grafik pertumbuhan tinggi semai jelutung (a,b).
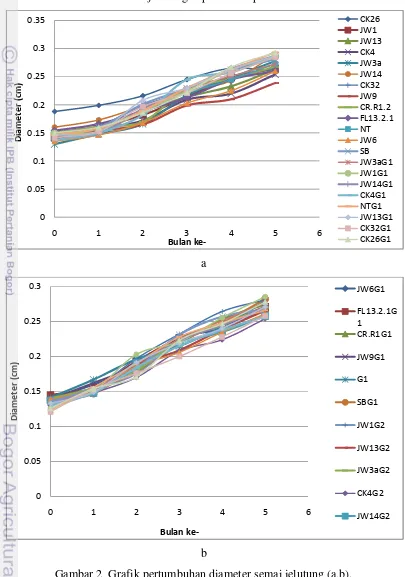
4.1.3 Diameter Semai
Pengukuran diameter dilakukan setiap satu bulan sekali selama lima bulan. Data yang digunakan adalah data pengukuran bulan ke lima dikurangi bulan ke nol. Berdasarkan hasil analisis sidik ragam (Tabel 2) diketahui, inokulasi FMA memberikan pengaruh nyata pada pertambahan diameter.
Berdasarkan uji lanjut Duncan semai jelutung yang diinokulasi FMA memiliki nilai rata-rata pertambahan diameter lebih besar daripada perlakuan tanpa FMA (Tabel 4). Inokulasi FMA pada jenis Glomus sp. memberikan pengaruh yang lebih baik ditunjukkan pada Tabel 4 bahwa perlakuan inokulasi FMA jenis Glomus sp. mengalami peningkatan sebesar 16,16% terhadap perlakuan tanpa FMA.
Tabel 4 Uji lanjut Duncan Pertambahan diameter semai jelutung
Perlakuan Rata-rata (cm) Peningkatan terhadap
Perlakuan tanpa FMA (%)
Glomus sp. (G1) 0,137a 16,16
Gigaspora sp. (G2) 0,136a 13,33
Tanpa FMA 0,120b 0
Keterangan : huruf yang berbeda menunjukkan pengaruh yang berbeda nyata berdasarkan uji lanjut Duncan pada selang kepercayaan 95%.
0 1 2 3 4 5 6 7 8
0 1 2 3 4 5 6
Perlakuan inokulasi bakteri dan interaksi antara FMA dan bakteri, memberikan pengaruh yang tidak nyata terhadap pertambahan diameter pada selang kepercayaan 90%. Rekapitulasi data dapat dilihat pada lampiran 2. Pertumbuhan diameter semai jelutung dapat dilihat pada Gambar 2.
a
b
Gambar 2 Grafik pertumbuhan diameter semai jelutung (a,b). 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35
0 1 2 3 4 5 6
D iam e te r (c m ) Bulan ke-CK26 JW1 JW13 CK4 JW3a JW14 CK32 JW9 CR.R1.2 FL13.2.1 NT JW6 SB JW3aG1 JW1G1 JW14G1 CK4G1 NTG1 JW13G1 CK32G1 CK26G1 0 0.05 0.1 0.15 0.2 0.25 0.3
0 1 2 3 4 5 6
4.1.4 Berat Kering Akar
Berdasarkan analisis sidik ragam berat kering akar semai jelutung, perlakuan inokulasi FMA memberikan pengaruh yang nyata pada selang kepercayaan 95%. Berdasarkan uji lanjut Duncan semai jelutung yang diinokulasi FMA dengan jenis Glomus sp. memiliki nilai rata-rata pertambahan diameter lebih besar daripada perlakuan tanpa FMA (Tabel 5). Inokulasi FMA pada jenis Glomus sp. memberikan pengaruh nyata ditunjukkan dengan peningkatan berat kering akar yang lebih besar yaitu sebesar 10,93% terhadap perlakuan tanpa FMA.
Tabel 5 Uji lanjut Duncan berat kering akar
Perlakuan Rata-rata (cm) Peningkatan terhadap
Perlakuan tanpa FMA (%)
Glomus sp. (G1) 0,489a 10,93
Gigaspora sp. (G2) 0,437b -2,46
Tanpa FMA 0,448b 0
Keterangan : huruf yang berbeda menunjukkan pengaruh yang berbeda nyata berdasarkan uji lanjut Duncan pada selang kepercayaan 95%.
Perlakuan inokulasi bakteri dan interaksi antara FMA dan bakteri, memberikan pengaruh yang tidak nyata terhadap berat kering akar pada selang kepercayaan 95%. Rekapitulasi data disajikan pada lampiran 3.
4.1.5 Berat Kering Pucuk
Berdasarkan hasil analisis sidik ragam berat kering pucuk, interaksi antara perlakuan inokulasi FMA dan bakteri menunjukkan beda nyata pada selang kepercayaan 95%.
Dari uji lanjut Duncan (Tabel 6) diketahui bahwa perlakuan kombinasi JW13G1 memiliki rata-rata berat kering pucuk yaitu 0,586 gr dengan peningkatan terhadap kontrol sebesar 36,28%.
Tabel 6 Uji lanjut Duncan Berat Kering Pucuk
Perlakuan Berat Kering Pucuk (gr) Peningkatan
Terhadap Kontrol (%)
JW13 G1 0,586 a 36,28
JW1 G2 0,559 ab 30,00
JW6 G2 0,473 abc 10,00
CR.R1 G2 0,472 abc 9,77
CK32 G2 0,467 abc 8,60
Perlakuan Berat Kering Pucuk (gr) Peningkatan Terhadap Kontrol (%)
FL.13.2.1 G2 0,443 abc 3,02
JW1 G1 0,436 bc 1,40
K 0,430 bc 0,00
NT G1 0,409 bc -4,88
JW9 G2 0,408 bc -5,12
JW6 G1 0,406 bc -5,58
CK26 G2 0,405 bc -5,81
SB G1 0,394 c -8,37
CK4 G2 0,390 c -9,30
JW13 G2 0,387 c -10,00
CK26G1 0,384 c -10,70
FL13.2.1 G1 0,364 c -15,35
JW9 G1 0,355 c -17,44
NT G2 0,355 c -17,44
CK4 G1 0,354 c -17,67
JW14 G1 0,350 c -18,60
CR.R1G1 0,348 c -19,07
JW3aG2 0,346 c -19,53
SB G2 0,330 c -23,26
CK32 G1 0,328 c -23,72
JW3a G1 0,321 c -25,35
Keterangan : huruf yang berbeda menunjukkan pengaruh yang berbeda nyata berdasarkan uji lanjut Duncan pada selang kepercayaan 95%.
4.1.6 Rasio Pucuk Akar
Berdasarkan analisis sidik ragam rasio pucuk akar perlakuan inokulasi bakteri dan FMA menunjukkan beda nyata pada selang kepercayaan 95%. Sedangkan interaksinya tidak berbeda nyata.
Uji lanjut Duncan pada perlakuan inokulasi bakteri (Tabel 7) menunjukkan jenis bakteri JW13 memiliki rata-rata rasio pucuk akar sebesar 1,067 atau mengalami peningkatan sebesar 20,97% terhadap perlakuan tanpa bakteri.
Tabel 7 Uji lanjut Duncan rasio pucuk akar semai jelutung
Perlakuan Rata-rata
JW13 1,067 a
JW1 0,999 ab
FL13.2.1 CK4 K JW14 JW6 CK32 NT CK26 JW3a SB JW9 CR.R1
0,927 bc 0,923 bc 0,882 bcd 0,879 bcd 0,878 bcd 0,864 bcd 0,836 cd 0,817 cd 0,812 cd 0,808 cd 0,804 cd 0,762 d
Keterangan : huruf yang berbeda menunjukkan pengaruh yang berbeda nyata berdasarkan uji lanjut Duncan pada selang kepercayaan 95%.
Uji lanjut Duncan pada perlakuan inokulasi FMA (Tabel 8) menunjukkan perlakuan FMA pada jenis Gigaspora sp.berbeda nyata dengan perlakuan tanpa FMA dengan rata-rata sebesar 0,967.
Tabel 8 Uji lanjut Duncan rasio pucuk akar
Perlakuan Rata-rata
Glomus sp. (G1) 0,815b
Gigaspora sp. (G2) 0,967a
Tanpa FMA 0,847b
Keterangan : huruf yang berbeda menunjukkan pengaruh yang berbeda nyata berdasarkan uji lanjut Duncan pada selang kepercayaan 95%.
4.1.7 Indeks Mutu Bibit
bakteri dan kombinasinya memberikan pengaruh tidak nyata terhadap parameter IMB pada selang kepercayaan 95%. Nilai IMB terbesar terdapat pada perlakuan NTG1, yaitu sebesar 0, 259 (Tabel 9). Perlakuan bakteri CK26 menunjukkan nilai IMB terendah yaitu 0,183.
Tabel 9 Rekapitulasi data indeks mutu bibit
Perlakuan IMB Perlakuan IMB
K 0,183 JW 13 G1 0,193
CK 26 0,124 JW 14 G1 0,204
CK 32 0,167 JW 3a G1 0,189
CK 4 0,170 JW 6 G1 0,197
CR.R1 0,207 JW 9 G1 0,172
FL.13.2.1 0,145 NT G1 0,259
JW1 0,177 SB G1 0,201
JW 13 0,172 G2 0,135
JW 14 0,183 CK 32 G2 0,240
JW 3a 0,194 CK 4 G2 0,156
JW 6 0,198 CK 26 G2 0,242
JW 9 0,142 CR.R1 G2 0,223
NT 0,186 FL.13.2 G2 0,184
SB 0,164 JW 1 G2 0,218
G1 0,191 JW 13 G2 0,163
CK 26 G1 0,204 JW 14 G2 0,153
CK 32 G1 0,148 JW 3a G2 0,159
CK 4 G1 0,161 JW 6 G2 0,192
CR.R1 G1 0,186 JW 9 G2 0,181
FL.13.2.1 G1 0,176 NT G2 0,160
JW 1 G1 0,167 SB G2 0,155
a b Gambar 4 Semai jelutung perlakuan (a) kontrol, NT, NTG1, NTG2; (b) kontrol,
4.1.8 Persentase Infeksi Akar
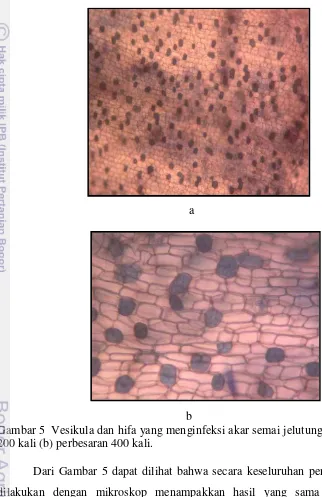
Pada parameter pengamatan persentase infeksi akar tidak dilakukan analisis sidik ragam karena hasil yang didapat dari seluruh perlakuan yang diberikan akar semai jelutung terkena infeksi mikoriza.
a
b
Gambar 5 Vesikula dan hifa yang menginfeksi akar semai jelutung (a) perbesaran 200 kali (b) perbesaran 400 kali.
4.1.9 Unsur N
Analisis jaringan dimaksudkan untuk mengetahui kandungan suatu unsur tertentu. Berdasarkan analisis sidik ragam data analisis jaringan N menunjukkan perlakuan inokulasi bakteri, FMA, dan interaksinya berbeda nyata pada selang kepercayaan 95%.
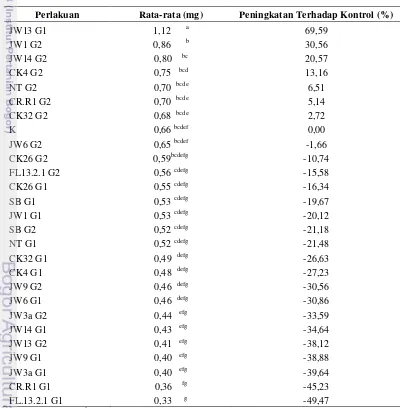
[image:30.595.109.509.320.728.2]Berdasarkan uji lanjut Duncan (Tabel 11) diketahui perlakuan kombinasi JW13G1 memiliki rata-rata kandungan unsur N terbesar yaitu 1,12 mg atau mengalami peningkatan terhadap kontrol sebesar 69,59%, sedangkan pada perlakuan FL13.2.1G1 memiliki rata-rata kandungan unsur N sebesar 0,33 mg atau mengalami penurunan sebesar 49,47% terhadap perlakuan kontrol.
Tabel 10 Uji lanjut Duncan Unsur N semai jelutung
Perlakuan Rata-rata (mg) Peningkatan Terhadap Kontrol (%)
JW13 G1 1,12 a 69,59
JW1 G2 0,86 b 30,56
JW14 G2 0,80 bc 20,57
CK4 G2 0,75 bcd 13,16
NT G2 0,70 bcde 6,51
CR.R1 G2 0,70 bcde 5,14
CK32 G2 0,68 bcde 2,72
K 0,66 bcdef 0,00
JW6 G2 0,65 bcdef -1,66
CK26 G2 0,59bcdefg -10,74
FL13.2.1 G2 0,56 cdefg -15,58
CK26 G1 0,55 cdefg -16,34
SB G1 0,53 cdefg -19,67
JW1 G1 0,53 cdefg -20,12
SB G2 0,52 cdefg -21,18
NT G1 0,52 cdefg -21,48
CK32 G1 0,49 defg -26,63
CK4 G1 0,48 defg -27,23
JW9 G2 0,46 defg -30,56
JW6 G1 0,46 defg -30,86
JW3a G2 0,44 efg -33,59
JW14 G1 0,43 efg -34,64
JW13 G2 0,41 efg -38,12
JW9 G1 0,40 efg -38,88
JW3a G1 0,40 efg -39,64
CR.R1 G1 0,36 fg -45,23
FL.13.2.1 G1 0,33 g -49,47
4.1.10 Unsur P
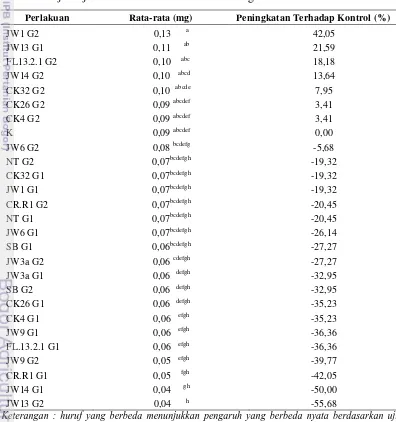
[image:31.595.112.508.303.725.2]Berdasarkan analisis sidik ragam terhadap data analisis jaringan unsur P diketahui bahwa perlakuan FMA dan interaksi antara perlakuan inokulasi FMA dan bakteri berbeda nyata pada selang kepercayaan 95%. Berdasarkan uji lanjut Duncan (Tabel 12) diketahui perlakuan kombinasi JW1G2 memiliki rata-rata kandungan unsur P terbesar yaitu 0,13 mg atau mengalami peningkatan terhadap kontrol sebesar 42,05%, sedangkan pada perlakuan JW13G2 memiliki rata-rata kandungan unsur P 0,04 mg atau mengalami penurunan sebesar 55,68% terhadap perlakuan kontrol.
Tabel 11 Uji lanjut Duncan Unsur P Semai Jelutung
Perlakuan Rata-rata (mg) Peningkatan Terhadap Kontrol (%)
JW1 G2 0,13 a 42,05
JW13 G1 0,11 ab 21,59
FL13.2.1 G2 0,10 abc 18,18
JW14 G2 0,10 abcd 13,64
CK32 G2 0,10 abcde 7,95
CK26 G2 0,09 abcdef 3,41
CK4 G2 0,09 abcdef 3,41
K 0,09 abcdef 0,00
JW6 G2 0,08 bcdefg -5,68
NT G2 0,07bcdefgh -19,32
CK32 G1 0,07bcdefgh -19,32
JW1 G1 0,07bcdefgh -19,32
CR.R1 G2 0,07bcdefgh -20,45
NT G1 0,07bcdefgh -20,45
JW6 G1 0,07bcdefgh -26,14
SB G1 0,06bcdefgh -27,27
JW3a G2 0,06 cdefgh -27,27
JW3a G1 0,06 defgh -32,95
SB G2 0,06 defgh -32,95
CK26 G1 0,06 defgh -35,23
CK4 G1 0,06 efgh -35,23
JW9 G1 0,06 efgh -36,36
FL.13.2.1 G1 0,06 efgh -36,36
JW9 G2 0,05 efgh -39,77
CR.R1 G1 0,05 fgh -42,05
JW14 G1 0,04 gh -50,00
JW13 G2 0,04 h -55,68
4.2 Pembahasan
4.2.1 Pengaruh Inokulasi Bakteri terhadap Infeksi Mikoriza pada Semai
Jelutung
Salah satu parameter untuk menentukan tingkat keberhasilan simbiosis antara FMA dengan tanaman inang adalah adanya persentase infeksi mikoriza. Akar tanaman dinyatakan terinfeksi oleh mikoriza jika ditemukan adanya vesikula, arbuskula, hifa dan spora atau keempat hal tersebut. FMA mempunyai dua organ yang terdapat di dalam jaringan akar terinfeksi, yaitu vesikula dan arbuskula (Imas et al. 1989). Arbuskula berperan sebagai pemindah unsur-unsur hara diantara simbion-simbion, vesikula merupakan struktur-struktur yang menggelembung yang dibentuk pada hifa-hifa utama, yang berfungsi sebagai organ simpan (Imas et al. 1989). Persentase infeksi mikoriza yang tinggi mengindikasikan bahwa struktur perakaran tanaman inang telah mengalami modifikasi oleh adanya simbiosis mutualistik antara FMA dengan akar.
diinokulasi dengan FMA jenis tersebut. Hal ini sesuai dengan pernyataan Pujianto (2001) bahwa FMA menunjukkan bermacam-macam derajat spesifitas terhadap tanaman inang, banyak yang dapat berasosiasi dengan bermacam-macam inang dan sebagian lainnya hanya dapat berasosiasi dengan inang yang spesifik, sehingga dalam hal ini jenis inokulan yang digunakan dalam penelitian ini dapat dikatakan sesuai dengan inangnya yang ditunjukkan dengan persen infeksi akar yang tinggi.
Bakteri yang diinokulasikan secara bersamaan dengan inokulum FMA beberapa diantaranya memiliki kerjasama yang baik. Hal ini diduga bakteri memudahkan mikoriza dalam menginfeksi akar tanaman inang. Dupponois (1992)
dalam Garbaye (1994) menyatakan bahwa bakteri mengeluarkan enzim spesifik yang mampu melunakkan dinding sel tanaman (akar) sehingga mempermudah mikoriza untuk menginfeksi inang. Selain itu diterangkan oleh Bianciotto (1996)
dalam Werner (2003) bahwa matari-materi ekstraselular dari bakteri mengandung selulose yang diproduksi didaerah sekitar invasi bakteri dapat menjadi media yang baik antara fungi dan bakteri.
4.2.2. Pengaruh Inokulasi FMA, Bakteri dan Kombinasinya terhadap
Pertumbuhan Semai Jelutung
Parameter yang diamati pada penelitian ini antara lain pertambahan tinggi, pertambahan diameter, berat kering akar, berat kering pucuk, rasio pucuk-akar, Indeks Mutu Bibit (IMB), persentase infeksi mikoriza, dan analisis jaringan nitrogen dan fosfor. Berdasarkan hasil penelitian, respon yang bervariasi ditunjukkan oleh pengaruh perlakuan terhadap parameter yang diamati. Secara umum, perlakuan mikoriza dan bakteri memberikan respon yang baik terhadap parameter pertumbuhan semai jelutung. Hal ini selaras dengan pernyataan bahwa di dalam rizosfir terjadi berbagai interaksi sinergisme maupun antagonisme. Salah satu interaksi di dalam rizosfir yang mendapat perhatian adalah interaksi antara FMA (simbiosis obligat) dengan bakteri yang hidup bebas di rizosfir (Rhizobakteria) (Pujiyanto 2001).
kombinasi perlakuan, dimana pengaruh terhadap pertambahan tinggi tidak berbeda nyata. Inokulasi FMA jenis Glomus sp. memberikan pengaruh yang lebih baik dibandingkan perlakuan tanpa FMA. ditunjukkan pada Tabel 3 bahwa persen peningkatan perlakuan FMA Glomus sp. sebesar 18,95% terhadap perlakuan tanpa FMA. Optimalisasi dari interaksi mikroba tergantung dari jenis mikroba, keadaan lingkungan, tanaman inang dan bekerja secara spesifik (Pujianto 2001), sehingga dari hasil penelitian interaksi antara jenis mikroba akan memberikan pengaruh yang berbeda pada setiap parameter pertumbuhan. Imas dan Setiadi (1987) menyatakan bahwa akar hidup akan menunjang sejumlah nutrien secara terus menerus pada suatu area terbatas. Disamping itu juga menyediakan suatu permukaan yang berekspansi terus-menerus untuk memungkinkan kolonisasi dan dengan aktivitas metabolisme mengubah lingkungan di dalam tanah. Oleh karena itu tidak mengherankan bila terjadi perubahan besar dalam aktivitas mikroba di daerah perakaran yang mungkin berakibat menguntungkan atau merugikan bagi tanaman itu sendiri.
Berdasarkan uji lanjut Duncan semai jelutung yang diinokulasi FMA memiliki nilai rata-rata pertambahan diameter lebih besar daripada perlakuan tanpa FMA. Inokulasi FMA pada jenis Glomus sp. memberikan pengaruh yang nyata ditunjukkan pada Tabel 4 bahwa perlakuan inokulasi FMA jenis Glomus sp.
mengalami peningkatan yang lebih besar yaitu sebesar 16,16% terhadap perlakuan tanpa FMA. Hal ini diduga bahwa mikoriza telah bersimbiosis secara baik dengan tanaman inang. Dengan demikian kebutuhan mikoriza akan nutrien dapat terpenuhi dari akar tanaman. Menurut Imas dan Setiadi (1987) stimulasi mikroorganisme tanah dapat terjadi karena akar mensuplai nutrien. Kebutuhan nutrisi sangat penting bagi keberadaan mikroorganisme rizosfir. Hal ini berarti bahwa zona perakaran menjadi daerah yang kondusif bagi mikoriza dan untuk berkembang. Sehingga, kinerja mikoriza dalam memacu pertumbuhan tanaman inang menjadi lebih optimum.
semai jelutung, perlakuan inokulasi FMA memberikan pengaruh yang nyata pada selang kepercayaan 95%. Inokulasi FMA pada jenis Glomus sp. memberikan pengaruh yang lebih baik ditunjukkan dengan peningkatan berat kering akar sebesar 10,93%. Untuk perlakuan bakteri dan interaksinya berdasarkan hasil analisis sidik ragam pada selang kepercayaan 95% tidak menunjukkan hasil yang berbeda nyata. Hal ini menunjukkan tidak terjalinnya kerjasama yang baik antara bakteri dan mikoriza sehingga pada akhirnya tidak mampu secara optimum meningkatkan biomassa akar semai. Hal lain yang dapat diduga adalah terjadinya persaingan antara bakteri dan mikoriza.
Rasio pucuk-akar merupakan hasil perhitungan yang membandingkan antara biomassa pucuk dengan biomassa akar tanaman. Sehingga, besarnya nilai rasio pucuk-akar tanaman sangat ditentukan oleh pertumbuhan pucuk dan akar tanaman. Pertumbuhan tanaman yang baik dan normal ditunjukkan dengan nilai rasio pucuk-akar yang seimbang. Hal ini mengindikasikan bahwa bagian pucuk dan akar tanaman mengalami pertumbuhan dan perkembangan yang seimbang. Berdasarkan analisis sidik ragam rasio pucuk akar perlakuan inokulasi bakteri dan FMA menunjukkan beda nyata pada selang kepercayaan 95%. Sedangkan interaksinya tidak berbeda nyata.
Uji lanjut Duncan pada perlakuan inokulasi bakteri menunjukkan jenis bakteri JW13 memiliki rata-rata rasio pucuk sebesar 1,067 atau mengalami peningkatan sebesar 20,97% terhadap perlakuan tanpa bakteri. Respon dari bakteri JW13 berbeda nyata dengan perlakuan jenis bakteri CR.R1 memiliki rata-rata rasio pucuk akar sebesar 0,762. Perlakuan FMA pada jenis Gigaspora sp. menunjukkan respon yang lebih baik daripada perlakuan FMA pada jenis Glomus
sp., dimana pada perlakuan mikoriza jenis Gigaspora sp. memiliki nilai rata-rata sebesar 0,967 sedangkan rata-rata pada perlakuan FMA jenis Glomus sp. hanya sebesar 0,815. Dari rasio pucuk akar dapat dihubungkan dengan serapan hara oleh tanaman. Perlakuan yang mempunyai serapan hara yang tinggi mempunyai rasio pucuk akar yang tinggi demikian juga sebaliknya, hal ini berarti hubungan serapan hara tanaman dengan pertumbuhan tanaman sangat erat sekali, dimana serapan hara yang rendah akan mempunyai pertumbuhan yang buruk dan rasio pucuk akar yang rendah.
beragam. Rata-rata nilai IMB terbesar terdapat pada perlakuan NTG1, yaitu sebesar 0, 259. Perlakuan bakteri CK26 menunjukkan nilai IMB terendah yaitu 0,183. Dari hasil tersebut, menunjukkan bahwa ada tidaknya perlakuan yang diberikan tidak memberikan pengaruh yang signifikan. Roller (1977) dalam
Hendromono (1987) menyebutkan bahwa bibit yang mempunyai angka indeks mutu lebih kecil dari 0,09 tidak akan berdaya hidup tinggi dikondisi lapangan. Berdasarkan nilai rata-rata dari IMB diketahui bahwa nilainya diatas 0,09 sehingga dapat dikatakan ada atau tidaknya perlakuan nilai IMB semai jelutung tetap dalam kondisi baik.
Analisis jaringan dimaksudkan untuk mengetahui kandungan suatu unsur tertentu. Berdasarkan analisis sidik ragam data analisis jaringan N menunjukkan interaksinya berbeda nyata pada selang kepercayaan 95%. Berdasarkan uji lanjut Duncan diketahui perlakuan kombinasi JW13G1 memiliki rata-rata kandungan unsur N terbesar yaitu 1,12 mg atau mengalami peningkatan terhadap kontrol sebesar 69,59%. Berdasarkan analisis sidik ragam terhadap data analisis jaringan unsur P diketahui bahwa interaksi antara perlakuan inokulasi FMA dan bakteri berbeda nyata pada selang kepercayaan 95%. Perlakuan kombinasi JW1G2 memiliki rata-rata kandungan unsur P sebesar 0,13 mg sedangkan pada perlakuan JW13G2 memiliki rata-rata kandungan unsur P sebesar 0,04 mg atau mengalami penurunan sebesar 55,68% terhadap perlakuan kontrol.
dibebaskan oleh akar tanaman. Karbohidrat yang dibebaskan ini dapat digunakan oleh bakteri penambat nitrogen (Fakuara 1990).
Bukman dan Brady (1969) dalam Suyono (2003) menambahkan bahwa bakteri dapat membantu pertumbuhan tanaman tingkat tinggi dengan baik, karena bakteri secara praktis dapat memegang monopoli tiga buah pokok transformasi enzim yaitu nitrifikasi, oksidasi sulfur dan fiksasi N. Selain itu bakteri dapat membantu pertumbuhan tanaman diantaranya dengan cara membantu penyediaan unsur hara penting bagi tanaman. Disamping itu, terdapat beberapa bakteri yang merugikan tanaman inang. Hal ini diduga bahwa dalam jumlah banyak nutrisi yang dihasilkan oleh tanaman inang, dimanfaatkan bakteri untuk pertumbuhannya. Bukman dan Brady (1982) dalam Suyono (2003) menyebutkan bahwa organisme tanah dapat merugikan tanaman tingkat tinggi diantaranya melalui persaingan untuk memperoleh hara yang tersedia. Organisme tanah biasanya memperoleh unsur hara lebih dulu, baru tanaman tingkat tinggi dapat mempergunakan yang masih tersisa. Pelczar et al. (1986) menambahkan bahwa bakteri tidak hanya bervariasi dalam persyaratan nutrisinya, tetapi juga menunjukkan respon yang berbeda-beda terhadap kondisi fisik di dalam lingkungannya. Untuk berhasilnya pembiakan berbagai tipe bakteri, dibutuhkan suatu kombinasi hara serta lingkungan fisik yang sesuai.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan dari hasil penelitian, diketahui pemberian tunggal mikoriza jenis Glomus sp. maupun dengan interaksinya dengan bakteri JW13 secara signifikan meningkatkan pertumbuhan semai jelutung. Inokulasi mikoriza jenis
Glomus sp. meningkatkan pertumbuhan tinggi tanaman sebesar 18,95% dan pertambahan diameter sebesar 16,16% dari perlakuan tanpa FMA. Perlakuan kombinasi antara bakteri JW 13 dan Glomus sp. meningkatkan berat kering pucuk sebesar 36,28% dan meningkatkan kandungan unsur hara N sebesar 69,59% terhadap control. Selain itu juga ditemukan interaksi mikoriza dan bakteri jenis JW1G2, JW13G1, JW14G2, CK32G2 memberikan pengaruh positif terhadap pertumbuhan semai jelutung dan dapat digunakan sebagai rekomendasi dalam aplikasi pupuk hayati.
5.2. Saran
1. Pasangan mikroba yang sudah diketahui dalam penelitian ini mampu meningkatkan pertumbuhan semai jelutung, hendaknya diformulasikan untuk dijadikan sebagai alternatif dari pupuk hayati.
2. Perlu dilakukan penelitian pada jenis tanaman yang berbeda untuk melihat respon interaksi antara mikoriza dengan bakteri rhizoplane dalam meningkatkan pertumbuhan tanaman.
3. Perlu dilakukan analisis yang lebih lengkap tentang kandungan hara dalam tanah.
PEMA
DAN FUNGI
MENINGKATKA
D
IN
ANFAATAN BAKTERI
RHIZOPLAN
GI MIKORIZA ARBUSKULA (FMA)
TKAN PERTUMBUHAN SEMAI JELU
(
Dyera polyphylla
Miq. Steenis.)
RIFA’ ATUNNISA
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
2009
ANE
DAFTAR PUSTAKA
Anonim. 2004. The soil habitat.http://www.soilhealth.see.uwa.edu.au/page/59597. [20 Oktober 2009].
Barea JM, Requenat N, Toro IJM. 1997. Interaction between plant-growth-promoting rhizobacteria (PGPR), arbuscular mycorrhizal fungi and Rhizobium
sp. In the rhizosphere of Anthyllis cytisoides, a model legume for revegatation in mediterranean semi-arid ecosystems. New Phytologist.136: 667-677.
Brundrett M. 2004. Keragaman dan Klasifikasi Asosiasi Mikoriza. Nusantara AD, penerjemah; Bengkulu: Universitas Bengkulu. Terjemahan dari: Diversity and Classification of Mycorrhizal Association.
Burd GI, Dixon DG, Glick BR. 2000. Plant growth-promoting bacteria that decrease heavy metal toxicity in plants. Can J Microbiology. 46 : 237-245. Burgman H, F. Widmer, WV Sigler, J Zeyer. 2004. New molecular screening
tools for analysis of free living diazotrophs in soil. Applied and Environmental Microbiology. 70:240-247.
Fakuara MY. 1988. Mikoriza, Teori dan Kegunaan dalam Praktek. Bogor: PAU Bioteknologi Institut Pertanian Bogor.
Fakuara Y. 1990. Teknologi Mikroba Hutan. Potensi dan Peranannya dalam Pembinaan Hutan Hujan Tropik. Bogor: Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor.
Fakuara MY, Arum SW dan Luluk S. 1993. Peningkatan Efektivitas Mikoriza Untuk Hutan Tanaman Industri. Bogor: Pusat Antar Universitas Bioteknologi IPB.
Garbaye J. 1994. Helper bacteria : a new dimension to the mycorrhijal symbiosis.
New Phytologist, 128: 197 – 120.
Glick BR. 1995. The enhancement of plant growth by free-living bacteria.
Canidian Journal of Microbiology. 41: 109-117.
Hendromono. 1987. Pertumbuhan dan Mutu Bibit Acacia mangium Willd.,
Eucalyptus deglupta Blume. Pada Tujuh Macam Medium yang Telah Diberi Kapur [Tesis]. Bogor : Sekolah Pascasarjana Institut Pertanian Bogor.
Imas T dan Setiadi Y. 1987. Mikrobiologi Tanah. Bogor: Pusat Antar Universitas Bioteknologi IPB.
Heyne K. 1987. Tumbuhan Berguna Indonesia. Jiilid III. Jakarta: Koperasi Karyawan Departemen Kehutanan.
Kloepper JW, Schroth MN. 1978. Plant growth promoting rhizobacteria on radishes. In: Station de Pathologie Vegetable et Phytobacteriologie, ed. Proceedings of the 4th international conference on plant pathogenic bacteria II. Tours: Gilbert-Clary, 879-882.
Lucy M, Reed E, Glick BR. 2004. Aplication of free living plant growth-promoting rhizobacteria. Antonie van leeuwenhoek. 86: 1-25.
Martawijaya A, Kartasujana K, Kadir SA, Prawira. 1981. Atlas Kayu Indonesia. Jilid I. Bogor: Badan penelitian dan Pengembangan Kehutanan.
Nusantara AD, Kusmana C, Mansur I, Darusman LK, Soedarmadi. 2008. Memahami Simbiosis Mikoriza. Makalah Disampaikan dalam Workshop Mikoriza. Kongres Mikoriza Indonesia III. “Implementasi Ternologi Mikoriza Sebagai Agens Hayati Dalam Meningkatkan Efisiensi dan Produktifitas Pertanian Berkelanjutan ”. Pada Tanggal 12-15 November 2008. Padang. Pujiyanto. 2001. Pemanfaatan Jasad Mikro Cendawan Mikoriza dan Bakteri
dalam Sistem Pertanian Berkelanjutan di Indonesia : Tinjauan dari Perspektif Falsafah Sains. Bogor: Program Pasca Sarjana IPB.
Puslitbang. 1994. Pedoman Teknik Budidaya Dan Pemanfaatan Jelutung. Bogor: Departemen Kehutanan.
Pelczar MJ and Chan ECS. 1986. Dasar-Dasar Mikrobiologi (Terjemahan : Hadioetomo, R.S dkk). Jakarta : UI Press.
Rao S. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Edisi Kedua. Susilo H, penerjemah; Jakarta: Universitas Indonesia (UI-Press). Terjemahan dari: Soil Microorganisms and Plant Growth.
Safriyanto T.O. 2004. Pengaruh Inokulasi Cendawan Mikoriza Arbuskula (CMA) dan Bakteri Rhizosfer Paraserianthes falcataria terhadap Pertumbuhan Semai Acacia mangium Wild. [Skripsi]. Bogor: Departemen Manajemen Hutan Fakultas Kehutanan IPB.
Salisbury FB dan Ross. 1995. Fisiologi Tumbuhan, Jilid 3. Bandung: ITB.
Setiadi Y. 1989. Pemanfaatan Mikroorganisme dalam Kehutanan. Departemen Pendidikan dan Kebudayaan. Direktorat Jenderal Pendidikan Tinggi. Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor.
investigations of their functions on seedling growth [disertasi]. Sapporo: Hokkaido University.
Sukarno N dan Setiadi Y. 2001. Studi Keragaman Genetik Cendawan Mikoriza Vesikula-Arbuskula (MVA) dalam Upaya Penanggulangan Penyakit Infeksi Patogen Akar [laporan penelitian]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor.
Sutedjo MM, Kartasapoetra AG, Sastroatmodjo S. 1991. Mikrobiologi Tanah. Jakarta: Rineka Cipta.
Suyono. 2003. Pengaruh Inokulasi Bakteri dan Endomikoriza terhadap Pertumbuhan Sengon (Paraserianthes falcataria). [Skripsi]. Bogor: Jurusan Manajemen Hutan Fakultas Kehutanan IPB.
Tate RL. 2000. Soil Microbiology. Second Edition. Canada: John Wiley and Sons, Inc.
Turjaman M, Tamai Y, Santoso E. 2006. Arbuscular mycorrhizal fungi increased early growth of two nontimber forest product species Dyera polyphylla and
Aquilaria filarial under greenhouse condition. Mycorrhiza 16:456-464.
Vancura V, Kunc F. 2000. Soil Microbial Association. New York: Elsevier Science Publishing Company Inc.
Werner. 2003. Plant Surface Microbiology. Berlin: Springer.
Whitmore TC. 1972. Tree Flora of Malaya. Volume Two. Longman, London. Whitmore TC, Tantra IGM, U Sutisna. 1989. The Flora of Indonesia. Cheklist for
PEMA
DAN FUNGI
MENINGKATKA
D
IN
ANFAATAN BAKTERI
RHIZOPLAN
GI MIKORIZA ARBUSKULA (FMA)
TKAN PERTUMBUHAN SEMAI JELU
(
Dyera polyphylla
Miq. Steenis.)
RIFA’ ATUNNISA
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
2009
ANE
PEMA
DAN FUNGI
MENINGKATKA
D
IN
ANFAATAN BAKTERI
RHIZOPLAN
GI MIKORIZA ARBUSKULA (FMA)
TKAN PERTUMBUHAN SEMAI JELU
(
Dyera polyphylla
Miq. Steenis.)
RIFA’ ATUNNISA
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
2009
ANE
A) UNTUK
Pemanfaatan Bakteri Rhizoplane dan Fungi Mikoriza Arbuskula (FMA) Untuk Meningkatkan Pertumbuhan Semai Jelutung
(Dyera polyphylla Miq. Steenis.)
Oleh :
Rifa’ Atunnisa , Irdika Mansur, Irnayuli R. Sitepu
Hasil hutan bukan kayu merupakan sumber pendapatan yang penting di hutan tropis, tetapi beberapa jenis pohon penghasil bukan kayu populasinya mengalami penurunan dan terancam kepunahannya karena kegiatan eksploitasi yang terlalu berlebahan. Hal ini meningkatkan perhatian pada jenis jelutung (Dyera polyphylla Miq. Steenis.) karena terjadinya degradasi potensi dalam menghasilkan hasil hutan bukan kayu. Keuntungan dari akar yang berkoloni dengan bakteri rizosfir yang dikenal dengan isilah Plant Growth Promoting Rhizobacteria (PGPR) telah diketahui peranan pentingnya di dalam proses ekosistem, seperti peranannya dalam siklus nutrisi, dan pertumbuhan semai. Asosiasi dari akar tanaman dan fungi yang terdapat di dalam tanah dikenal dengan istilah mikoriza. Objek dari penelitian ini adalah untuk mengetahui efektifitas dari dua jenis Fungi Mikoriza Arbuskula (FMA) jenis Glomus sp., Gigaspora sp., dan 13 jenis bakteri rhizoplane (CK32, FL.13.2.1, JW1, JW6, JW9, JW13, JW14, CK26, CK4, JW3a, SB, NT, CR.R1), pada semai jelutung, dibawah kondisi rumah kaca. Perhitungan persentase infeksi akar, pertumbuhan tanaman, kandungan unsur N dan P dilakukan 150 setelah penanaman. Berdasarkan hasil penelitian menunjukkan bahwa persentase infeksi akar oleh FMA adalah 100%. Perlakuan FMA jenis Glomus sp. secara signifikan meningkatkan pertambahan tinggi tanaman sebesar 18,95% dan pertambahan diameter sebesar 16,16% dari perlakuan tanpa FMA. Perlakuan kombinasi antara bakteri JW 13 dan Glomus sp. meningkatkan berat kering pucuk sebesar 36,28% dan meningkatkan kandungan unsur hara N sebesar 69,59% terhadap kontrol. Kombinasi perlakuan dari bakteri jenis JW1 dan Gigaspora sp. meningkatkan kandungan unsur hara P sebesar 42,05% dari kontrol. Dengan ditemukannya kombinasi dari mikroba yang memiliki banyak manfaat, dapat menjadi rekomendasi di bidang bioteknologi dalam upaya meningkatkan pertumbuahan tanaman.
Utilization of Rhizoplane Bacteria and Arbuscular Mycorrhizal Fungi (AMF) to Promote The Early Growth of Jelutung
(Dyera polyphylla Miq. Steenis.)
By :
Rifa’ Atunnisa, Irdika Mansur, Irnayuli R. Sitepu
Nontimber forest products (NTFPs) represent sources of income from tropical forest, but some NTFP species have decreased in population and become endangered due to overexploitation. There is increasing concern that the planting stock of Dyera polyphylla is not sufficient to sustain the yield of NFTPs. The beneficial root colonizing rhizosphere bacteria, the so-called plant growth-promoting rhizobacteria have been known to carry out many important ecosystem processes, such as those involved in the nutrient cycling and/or seedling establishment. The roots of most plant species associate with certain soil fungi and establish what are known as mycorrhiza. The objective of this study was to determine the effect of two arbuscular miycorrhizal (AMF) fungi, Glomus sp.,
Gigaspora sp. and thirteen strains of rhizoplane bacteria (CK32, FL.13.2.1, JW1, JW6, JW9, JW13, JW14, CK26, CK4, JW3a, SB, NT, CR.R1), on the early growth of D. polyphylla, under greenhouse condition. Percentage of AMF colonization, plant growth, and nitrogen (N) and phosphorus (P) concentration were measured after 150 days of planting. The results showed that the percentage of AM colonization of D. polyphylla was 100%. Colonization by Glomus sp. significanly increased plant height by 18,95% and diameter by 16,16% compared to those non AMF. Combination of bacterial and AMF inoculant between JW13 dan Glomus sp. increased shoot weight by as much