PENGARUH SALINITAS DAN NITROGEN
TERHADAP KANDUNGAN PROTEIN TOTAL Nannochloropsis sp.
Oleh
NINDRI YARTI
(Skripsi)
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA PERIKANAN
Pada
Program Studi Budidaya Perairan Fakultas Pertanian Universitas Lampung
PROGRAM STUDI BUDIDAYA PERAIRAN FAKULTAS PERTANIAN
ABSTRAK
PENGARUH SALINITAS DAN NITROGEN
TERHADAP KANDUNGAN PROTEIN TOTAL Nannochloropsis
sp.
Oleh
NINDRI YARTI
Nannochloropsis sp. memiliki kandungan protein yang cukup tinggi, merupakan pakan alami yang digunakan sebagai pakan larva ikan laut. Perubahan salinitas dan nitrogen dapat mempengaruhi pertumbuhan Nannochloropsis sp. Penelitian bertujuan untuk mengetahui pengaruh perubahan salinitas dan nitrogen terhadap kandungan protein total Nannochloropsis sp., dilakukan pada Oktober sampai November 2012. Nannochloropsis sp. dikultur dengan kepadatan awal 1,1 x 106 sel/ml dan diberi perlakuan A (salinitas 30-34 ppt dan NaNO3 100 gr/l), B
(salinitas 30-34 ppt dan NaNO3 50 gr/l), C (salinitas 35-38 ppt dan NaNO3 100
gr/l), dan D (salinitas 35-38 ppt dan NaNO3 50 gr/l). Hasil penelitian
menunjukkan kepadatan dan kandungan protein tertinggi pada perlakuan salinitas 35 – 38 ppt dan NaNO3 100 gr/l. Hasil uji chi-square menunjukkan peningkatan
salinitas dan penurunan nitrogen berpengaruh terhadap kepadatan
Nannochloropsis sp. pada akhir kultur, tetapi tidak berpengaruh terhadap kandungan protein total Nannochloropsis sp. Hubungan antara kepadatan dan kandungan protein total Nannochloropsis sp. menunjukkan korelasi positif yang artinya bahwa bertambahnya kepadatan mampu meningkatkan kandungan protein total Nannochloropsis sp.
DAFTAR ISI
Hal.
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
I. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan ... 3
1.3. Manfaat ... 3
1.4. Kerangka Pikir ... 4
1.5. Hipotesis ... 5
II. TINJAUAN PUSTAKA 2.1. Biologi Nannochloropsis sp. ... 7
2.2. Faktor Lingkungan yang Mempengaruhi Pertumbuhan Nannochloropsis sp. ... 8
2.2.1. Faktor Lingkungan ... 8
2.2.2. Pertumbuhan Nannchloropsis sp. ... 9
2.3. Nitrogen ... 10
2.4. Protein ... 11
III. METODE PENELITIAN 3.1. Waktu dan Tempat ... 16
3.2. Materi Penelitian ... 16
3.2.1. Biota Uji ... 16
3.2.2. Media Ujia ... 16
3.2.3. Alat dan Bahan ... 17
3.4. Prosedur Penelitian ... 18
3.4.1. Persiapan Penelitian ... 18
a. Sterilisasi Alat ... 18
b. Sterilisasi Media (Air) ... 19
c. Pembuatan Pupuk Conwy ... 19
3.4.2. Pelaksanaan Penelitian ... 20
3.5. Parameter ... 21
3.5.1. Penghitungan Kepadatan Nannochloropsis sp. ... 21
3.5.2. Uji Proksimat Protein ... 21
3.5.3. Kualitas air ... 21
3.6. Analisis Data ... 22
3.6.1. Uji Chi-square... 22
3.6.2. Regresi dan Korelasi ... 23
IV. HASIL DAN PEMBAHASAN 4.1. Kepadatan Nannochloropsis sp. ... 25
4.2. Protein Total Nannochloropsis sp. ... 30
4.3. Hubungan antara Kepadatan dan Protein Total ... 33
4.4. Kualitas Air ... 35
V. KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 36
5.2. Saran ... 36
DAFTAR PUSTAKA ... 37
I. PENDAHULUAN
1.1. Latar Belakang
Benih ikan berkualitas baik dibutuhkan dalam tahapan utama pembesaran ikan.
Peningkatan benih berkualitas mampu didapatkan dengan pengontrolan panti
benih dan pakan benih. Benih berkualitas mampu dipenuhi dengan produksi benih
secara intensif dan berkelanjutan. Ketersediaan pakan alami yang cukup
merupakan salah satu faktor untuk mendapatkan hasil benih yang berkualitas.
Pakan alami belum mampu digantikan oleh pakan buatan, sehingga kualitas dan
kuantitas pakan alami menjadi faktor penentu kualitas benih ikan laut (Sumiarsa
dan Irwan, 2010).
Benih ikan membutuhkan pakan alami pada tahap awal kehidupannya. Pakan
alami tersebut harus memiliki kualitas nutrisi (protein) yang tinggi untuk
pertumbuhan benih. Salah satu pakan alami yang dipergunakan untuk pemenuhan
kebutuhan nutrisi benih yaitu mikroalga. Mikroalga adalah alga kecil (ukuran 2-20
µm) berupa tanaman talus yang memiliki klorofil sehingga mampu melakukan
fotosintesis. Mikroalga bereproduksi secara aseksual melalui pembelahan sel
(Sasmita dkk, 2004). Salah satu mikroalga yang biasa digunakan sebagai pakan
alami bagi benih ikan, juga berperan sebagai pakan bagi zooplankton adalah
Nannochloropsis sp. memiliki klorofil a dan c, serta termasuk jenis yang memiliki
daya tahan yang paling tinggi dan mudah penanganannya, sehingga dapat dikultur
secara massal (Aliabbas, 2002). Nannochloropsis sp. memiliki kandungan protein
33% (Isnansetyo dan Kurniastuty, 1995). Pertumbuhan Nannochloropsis sp.
dipengaruhi oleh lingkungan seperti suhu, pH, salinitas, juga kandungan nitrogen
yang ada di media kultur (Gunawan, 2012). Nannochloropsis sp. dapat tumbuh
dengan baik pada suhu 25-30oC, pH 8 - 9,5, dan salinitas 30-32 ppt (Budiman,
2009).
Nannochloropsis sp. membutuhkan nutrien dalam pertumbuhannya, baik dalam
bentuk makronutrien maupun mikronutrien. Makronutrien untuk pertumbuhan
Nannochloropsis sp. yaitu unsur Nitrogen, P (Posfat), K (Kalium), C (Karbon), Si
(silikat), S (Sulfat) dan Ca (Kalsium). Unsur mikronutrien terdiri atas Fe (Besi),
Zn (Seng), Cu (Tembaga), Mg (Magnesium), Mo (Molybdate), Co (Kobalt), dan
B (Boron). Makronutrien yang sangat dibutuhkan dalam pertumbuhan
Nannochloropsis sp. yaitu nitrogen. Richmond (1986) dalam Yanuaris dkk (2012)
menyatakan bahwa ketersediaan unsur nitrogen mempengaruhi pertumbuhan
Nannochloropsis sp. Perbedaan jenis media kultur mempengaruhi kepadatan
Nannochloropsis sp. Yanuaris dkk (2012) menyatakan kultur Nannochloropsis sp.
dengan media menggunakan pupuk dari kotoran sapi yang telah difermentasikan
memiliki kepadatan lebih tinggi dibandingkan dengan media menggunakan pupuk
Walne. Pemenuhan sumber hara (N, P, dan K) yang mencukupi kebutuhan dapat
Pemberian perubahan lingkungan yang meliputi salinitas, suhu, fotoperiode,
intensitas cahaya, dan nutrient dapat mempengaruhi biokimia mikroalga
(Widianingsih dkk, 2011). Beberapa penelitian melaporkan bahwa mikroalga
mengalami perubahan komposisi biokimia ketika kondisi kultur bervariasi.
Penelitian Arifin (2010), perubahan salinitas dan CO2 pada tahap kedua dapat
meningkatkan kepadatan dan mengubah kandungan lipid. Penelitian Muhaemin
(2011) menyatakan bahwa kombinasi antara peningkatan salinitas dan penurunan
nitrogen pada kultur Duniella sp. mampu menghasilkan lipid yang tinggi sebesar
31,45%. Penelitian salinitas dan kandungan nitrogen terhadap kultur
Nannochloropsis sp. belum banyak dilakukan sehingga perlu adanya penelitian
mengenai pengaruh peningkatan salinitas dan penurunan kandungan nitrogen pada
saat kultur terhadap kandungan protein Nannocholoropsis sp.
1.2. Tujuan
Tujuan penelitian untuk mengetahui pengaruh perubahan salinitas dan nitrogen
terhadap kandungan protein total Nannochloropsis sp.
1.3. Manfaat
Hasil penelitian diharapkan dapat menjadi salah satu cara peningkatan protein
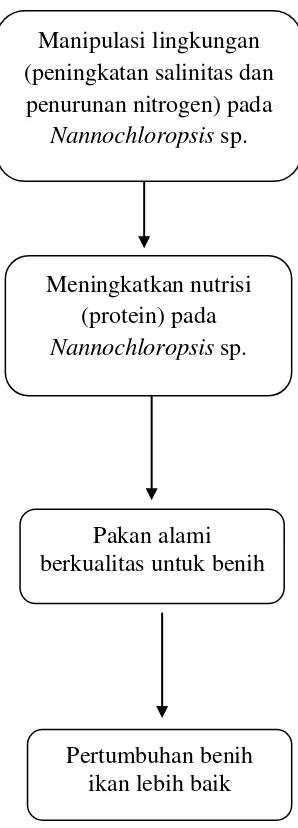
1.4. Kerangka Pikir
Pakan alami yang diberikan bagi benih pada awal fase hidup adalah fitoplankton
(mikroalga) dan zooplankton. Salah satu fitoplankton (mikroalga) yang berperan
sebagai pakan bagi zooplankton(Brachionus plicatilis) dan pakan alami bagi
benih ikan adalah Nannochloropsis sp. Penelitian sebelumnnya menyatakan
bahwa mikroalga mengalami perubahan komposisi biokimia ketika kondisi kultur
yang bervariasi. Safitri dkk (2013) menyatakan bahwa fotoperiode yang berbeda
mempengaruhi kandungan lemak Nannochloropsis sp. pada fase stasioner. Pada
jenis mikroalga lain yaitu Chaetoceros gracilis, perbedaan media kultur
mempengaruhi kandungan protein dan lemaknya (Jati dkk, 2012). Dengan
beberapa penelitian tersebut, dapat dikatakan bahwa manipulasi lingkungan dapat
mempengaruhi biokimia dari mikroalga.
Manipulasi lingkungan media kultur dengan cara peningkatan salinitas dan
pengurangan sumber nitrogen dapat meningkatkan kandungan nutrisi
Nannochloropsis sp. Muhaemin (2011) peningkatan salinitas dan penurunan
nitrogen pada media kultur dapat meningkatkan kandungan lemak total sebesar 31
%. Manipulasi lingkungan tersebut diharapkan mampu meningkatkan kandungan
protein Nannochloropsis sp., sehingga dapat dimanfaatkan sebagai pakan alami
Gambar 1. Kerangka pikir penelitian
1.5. Hipotesis
Hipotesis yang digunakan dalam penelitian yaitu:
a. Hipotesis perlakuan dengan kandungan protein total Nannochloropsis sp.
H0= perubahan salinitas dan nitrogen pada media tidak berpengaruh pada
meningkatkan kandungan protein total Nannochloropsis sp. Manipulasi lingkungan
(peningkatan salinitas dan penurunan nitrogen) pada
Nannochloropsis sp.
Meningkatkan nutrisi (protein) pada
Nannochloropsis sp.
Pakan alami berkualitas untuk benih
H1= perubahan salinitas dan nitrogen pada media berpengaruh pada meningkatkan
kandungan protein total Nannochloropsis sp.
b. Hipotesis hubungan antara kepadatan dan kandungan protein total
Nannochloropsis sp.
H0 = kepadatan tidak berhubungan terhadap peningkatan kandungan protein total
Nannochloropsis sp.
H1 = kepadatan berhubungan terhadap peningkatan kandungan protein total
II. TINJAUAN PUSTAKA
2.1. Biologi Nannochloropsis sp.
Fitoplankton adalah alga yang berfungsi sebagai produsen primer, selama
hidupnya tetap dalam bentuk plankton dan merupakan makanan langsung bagi
larva ikan dan zooplankton (Maula, 2008). Nannochloropsis sp. merupakan mikro
alga berwarna kehijauan, tidak motil, dan tidak berflagel. Selnya berbentuk bola
dan berukuran kecil. Nannochloropsis sp. merupakan pakan Brachionus plicatilis,
dan Artemia (Fachrullah, 2011).
Klasifikasi Nannochloropsis sp. adalah sebagai berikut (Hibberd, 1981):
Filum : Chromophyta
Kelas : Eustigmatophyceae
Ordo : Eustigmatales
Famili : Eustigmataceae
Genus : Nannochloropsis
Spesies : Nannochloropsis sp.
Sel Nannchloropsis sp. berbentuk bulat memanjang dengan diameter sel berkisar
2 sampai 4 μm (Isnansetyo dan Kurniastuty, 1995). Memiliki stigma di
salah satunya flagel berambut tipis yang terbuat dari komponen selulosa
(Aliabbas, 2002).
Nannochloropsis sp. memiliki kandungan energi yang tinggi diatas 20 kJ/g berat
kering dan kandungan total lemak dari berat kering 10,3 % - 16,1 % (Mourente et
al., 1990 dalam Maula, 2010). Kandungan nutrisi yang tinggi berupa protein
52,11 %, karbohidrat 12,32 %, vitamin C 0,85 %, klorofil a 0,89 %, dan kalori
48,4 % (Maula, 2010).
2.2. Faktor Lingkungan yang Mempengaruhi Pertumbuhan Nannochloropsis sp.
2.2.1. Faktor Lingkungan
Faktor yang mempengaruhi pertumbuhan mikroalga Nannochlorpsis sp.
diantaranya adalah suhu, pH, cahaya, salinitas, dan nutrien.
Pertumbuhan Nannochloropsis sp. pada suhu 25-30 0C, juga dapat tumbuh pada
kisaran pH 8-9,5 dan intensitas cahaya 1.000 – 10.000 lux (Fachrullah, 2011).
Nannochloropsis sp. dapat tumbuh pada salinitas 0-35 ppt (Isnansetyo dan
Kurniastuty, 1995). Salinitas optimum untuk pertumbuhannya sebesar 25-35 ppt
(Fahcrullah, 2011). Kepadatan optimum yang dapat dicapai untuk skala
laboratrium 50-60 juta sel/mL, skala semi masal 20-25 juta sel/mL dan massal
15-20 juta sel/mL dengan masa kultur 4-7 hari (Fachrullah, 15-2011).
Mikroalga Nannochloropsis sp. dalam pertumbuhannya membutuhkan nutrien
N, P, K, C, Si, S, dan Ca. Unsur mikro nutrien terdiri atas Fe, Zn, Cu, Mg, Mo,
Co, Mn, dan B (Prabowo, 2009). Unsur N dan P merupakan dua unsur terpenting
yang tersedia dalam media kultur alga (Wahyudi, 1999 dalam Maula, 2010).
Nitrogen merupakan salah satu makronutrien yang sangat mempengaruhi
pertumbuhan dan produktifitas biomassa alga karena dibutuhkan untuk
pembentuk protein, lemak dan klorofil (Maula, 2010).
2.2.2. Pertumbuhan Nannochloropsis sp.
Nannochloropsis sp. berkembang secara aseksual, dengan pembelahan sel atau
pemisahan autospora dari sel induknya (Isnansetyo dan Kurniastuty, 1995).
Pertumbuhan mikroalga ditandai dengan bertambahnya ukuran sel atau jumlah
sel. Kepadatan sel tersebut selanjutnya dapat digunakan untuk mengetahui
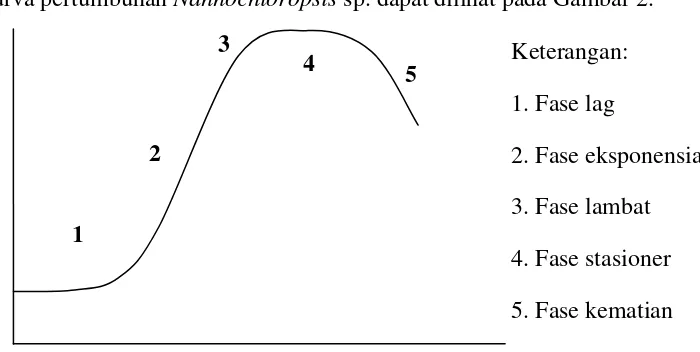
pertumbuhan Nannochloropsis sp. (Fachrullah, 2011). Lima fase pertumbuhan
(Kartikasari, 2010)yaitu:
1. Fase lag disebut sebagai fase adaptasi kondisi lingkungan yang ditandai
dengan peningkatan populasi yang tidak nyata.
2. Fase eksponensial disebut sebagai fase pertumbuhan, ditandai dengan
peningkatan laju pertumbuhan beberapa kali lipat.
3. Fase pengurangan pertumbuhan yang ditandai dengan terjadinya penurunan
pertumbuhan jika dibandingkan dengan fase eksponensial.
4. Fase stasioner yang ditandai dengan laju pertumbuhan stabil.
5. Fase kematian ditandai dengan laju kematian lebih tinggi dari laju
Kurva pertumbuhan Nannochloropsis sp. dapat dilihat pada Gambar 2.
Gambar 2. Kurva pertumbuhan Nannochloropsis sp.
2.3.Nitrogen
Nitrogen dapat dimanfaatkan langsung oleh beberapa organisme akuatik dalam
bentuk gas. Nitrogen di perairan berupa nitrogen organik dan nitrogen anorganik.
Nitrogen anorganik terdiri dari amonia (NH3), amonium (NH4 +), nitrit (NO2-),
nitrat (NO3-), dan molekul nitrogen (N2) dalam bentuk gas. Nitrogen organik
berupa protein, asam amino, dan urea (Effendi, 2003).
Nitrogen organik merupakan bentuk nitrogen yang terikat pada senyawa organik,
terutama nitrogen bervalensi tiga yang biasanya berupa partikular yang tidak larut
dalam air. Nitrogen organik biasa disebut amino atau albuminoid nitrogen.
Senyawa tersebut berupa protein, polipeptida, asam amino, urea (N2NCONH2),
dan senyawa lainnya. Sumber dari nitrogen organik berasal dari proses
pembusukan makhluk hidup yang telah mati (Effendi, 2003).
Nitrit (NO2-) dan nitrat (NO3-) merupakan bentuk dari nitrogen anorganik yang
dimanfaatkan. Nitrat (NO3-) adalah bentuk utama nitrogen di perairan alami dan
1
2
3
4 5 Keterangan:
1. Fase lag
2. Fase eksponensial
3. Fase lambat
4. Fase stasioner
merupakan nutrien utama bagi pertumbuhan tanaman dan alga. Nitrat sangat
mudah larut dalam air dan bersifat stabil. senyawa tersebut dihasilkan dari
oksidasi sempurna senyawa nitrogen dan berlangsung secara aerob. Oksidasi
amonia menjadi nitrit dilakukan oleh bakteri Nitrosomonas, yang ditunjukkan
dalam persamaan reaksi berikut (Effendi, 2003):
Nitrosomonas
2 NH3 + 3 O2 2 NO2- + 2 H+ + 2 H2O
Terjadi oksidasi nitrit menjadi nitrat yang dilakukan oleh bakteri Nitrobacter,
ditunjukkan pada persamaan reaksi berikut (Effendi, 2003):
Nitrobacter
2 NO2- + O2 2 NO3
-Nitrat inilah yang menjadi sumber nitrogen bagi tumbuhan yang selanjutnya
dikonversi menjadi protein. Proses tersebut dapat dilihat pada persamaan reaksi
berikut (Effendi, 2003):
NO3- + CO2 + tumbuhan + cahaya matahari protein
Tumbuhan membentuk protein dari CO2 , H2O dan senyawa nitrogen (NO3-).
2.4.Protein
Protein merupakan suatu polipeptida yang mempunyai bobot molekul yang
bervariasi. Berdasarkan strukturnya, protein terbagi dalam dua golongan besar
yaitu golongan protein sederhana yang terdiri dari protein fiber dan protein
polipeptida yang memanjang dan dihubungkan satu dengan lain oleh beberapa
ikatan silang hingga terbentuk serat atau serabut yang stabil. Protein globular
umumnya berbentuk bulat satu atau elips dan terdiri atas rantai polipeptida yang
berlipat. Sedangkan protein gabungan ialah protein yang berikatan dengan
senyawa yang bukan protein seperti lipoprotein yaitu protein yang larut dalam air
dengan lipid berupa lesitin dan kolesterol (Poedjiadi, 1994).
Protein komponen penting yaitu sebagai pembentukan sel-sel tubuh, juga dapat
digunakan sebagai sumber energi bagi tubuh (Poedjiadi, 1994). Serta, fungsi dari
protein sebagai biokatalisator yang berupa enzim (Page, 1981). Komposisi
rata-rata unsur kimia yang terdapat dalam protein adalah: karbon 50%, hidrogen 7%,
oksigen 23%, nitrogen 16%, sulfur 0-3%, dan fosfor 0-3%. Jumlah protein dalam
tubuh juga ditentukan dengan jumlah nitrogennya (Poedjiadi, 1994).
Protein mempunyai molekul besar dengan bobot molekul bervariasi antara 5000
sampai jutaan. Hidrolisis oleh asam atau oleh enzim, protein akan menghasilkan
asam-asam amino. Asam-asam amino tersebut terikat oleh ikatan peptida sehingga
terbentuklah protein (Poedjiadi, 1994). Asam amino tidak hanya berperan sebagai
bahan pembangun protein, juga sebagai pelopor kimia bagi banyak senyawa yang
mengandung nitrogen (Page, 1981).
Reaksi metabolisme asam amino, melibatkan pelepasan gugus asam amino,
kemudian perubahan kerangka karbon pada molekul asam amino. Proses tersebut
adalah transaminasi dan deaminasi. Transaminasi merupakan reaksi yang
melibatkan satu asam amino ke asam amino lainnya. Reaksinya gugus amino dari
asam piruvat, α ketoglutarat atau aksaloasetat, sehingga senyawa keto berubah
menjadi asam keto. Reaksi transaminasi ada dua jenis enzim yang penting yaitu
alanin transaminase dan glutamate transminase yang bekerja sebagai berikut
(Poedjiadi, 1994):
Alanin transaminase
Asam amino + asam piruvat asam α keto + alanin
Glutamate transaminase
Asam amino + asam α ketoglutarat asam α keto + asam glutamate asam α keto + asam glutamat
Reaksi transaminasi bersifat reversible, sehingga tidak ada gugus asam amino
yang hilang. Karena gugus amino yang dilepaskan oleh asam amino diterima oleh
asam keto (Poedjiadi, 1994)
Asam amino yang diubah menjadi asam glutamate pada reaksi transaminasi dalam
beberapa sel misalnya dalam bakteri, mengalami deaminasi oksidatif yang
menggunakan glutamate sebagai dehidrigenase sebagai katalis.
Asam glutamat + NAD+ Asam α ketoglutarat + NH4+ + NADH + H+
Asam glutamat melepaskan gugus amino dalam bentuk NH4+. Selain NAD +
glutamat dehidrogenase menggunakan pula NADP+ sebagai akseptor electron.
Oleh karena asam glutamat merupakan hasil akhir proses transaminase, maka
glutamat dehidrogenase merupakan enzim yang penting dalam metabolisme asam
Selain metabolisme gugus amino, asam amino dapat mengalami reaksi-reaksi
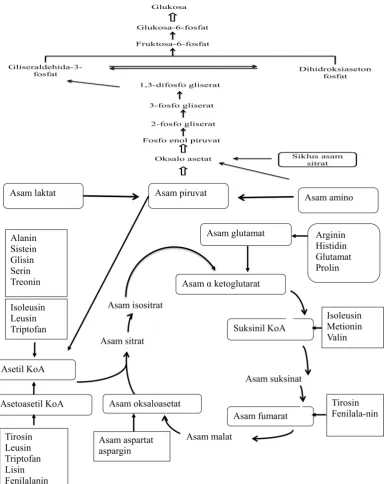
yang mengakibatkan berubahnya rantai karbon. Poedjiadi (1994) menggambarkan
skema metabolisme rantai karbon asam amino yang dikaitkan dengan siklus asam
sitrat pada Gambar 3.
Terlihat pada skema bahwa asetil koenzim A merupakan senyawa penghubung
antara metabolisme asam amino dengan siklus asam sitrat. Jalur metabolik yang
menuju pembentukan asetil koenzim A, yaitu melalui asam piruvat dan asam
asetoasetat (Poedjiadi, 1994).
Asam amino yang merupakan komponen dari protein memiliki fungsi yang besar
pada sel organisme. Protein adalah salah satu nutrisi yang sangat dibutuhkan bagi
larva ikan sebagai pembentuk jaringan tubuh dalam proses pertumbuhan (Serang,
2006). Protein dapat digunakan oleh organisme hidup setelah diuraikan menjadi
komponen-komponen penyusunnya, misalnya asam amino. Ketersediaan asam
amino yang merupakan komponen dari protein dalam pakan dapat mempengaruhi
tingkat kelangsungan hidup larva (Zonneveld dkk, 1991). Asam amino tersebut
dibutuhkan sebagai suplai energi untuk proses metabolisme tubuh (Putra, 2008).
Pemanfaatan protein dalam tubuh dinyatakan dalam penyimpanan nitrogen
III. METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian dilaksanakan pada bulan Oktober - November 2012 di Laboratorium
Fitoplankton Balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung.
3.2. Materi penelitian 3.2.1. Biota Uji
Biota uji yang digunakan dalam penelitian adalah Nannochloropsis sp. yang
dikultur pada skala laboratorium di BBPBL dengan kepadatan awal 1,1 x 106
sel/ml dan volume air 2 l.
3.2.2. Media Uji
Media yang dipergunakan dalam kultur Nannochloropsis sp. berbentuk cair atau
larutan yang tersusun dari senyawa kimia (pupuk) yang merupakan sumber
nutrien untuk keperluan hidup. Pupuk yang akan digunakan dalam penelitian
Tabel 1. Komposisi pupuk Conwy untuk fitoplankton skala laboratorium (1 liter)
100 gram (sumber nitrogen 100%) 50 gram (sumber nitrogen 50 %) 1 ml
1 cc
Hingga 1 liter
Tabel 2. Larutan Trace metal solution
No. Bahan Kimia Komposisi
3.2.3. Alat dan Bahan
Tabel 3. Alat dan bahan yang digunakan dalam penelitian
No. Alat dan bahan Kegunaan Selang dan batu aerasi Haemocytometer
Wadah media kultur Nannochloropsis sp. Perangkat sirkulasi aerasi media
Penghitungan kepadatan Nannochloropsis sp. Pengamatan Nannochloropsis sp.
Pengamatan pH Pengamatan DO Pengambilan sampel Sumber cahaya
Alat untuk sterilisasi air laut sebagai media kultut Nannochloropsis sp.
Penutup media kultur setelah disterilkan, sebelum dipergunakan
Biota Uji
Air media kultur
Sterilisasi untuk alat berbahan kaca
3.3. Rancangan Penelitian
Penelitian terdiri dari 3 perlakuan dan 1 kontrol yang masing-masing diulang 3
kali. Perlakuan tersebut sebagai berikut:
Perlakuan A : kultur Nannochloropsis sp. pada salinitas 30-34 ppt dan NaNO3 100
gr/l.
Perlakuan B : kultur Nannochloropsis sp. pada salinitas 30-34 ppt dan NaNO3 50
gr/l.
Perlakuan C : kultur Nannochloropsis sp. pada salinitas 35-38 ppt dan NaNO3 100
gr/l.
Perlakuan D : kultur Nannochloropsis sp. pada salinitas 35-38 ppt dan NaNO3 50
gr/l.
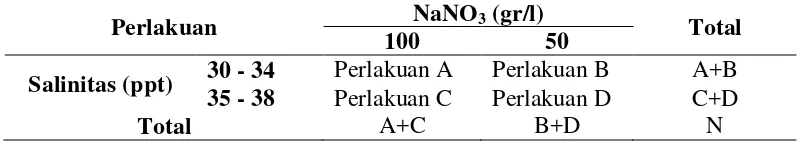
Tabel 4. Kontingensi perlakuan salinitas dan nitrogen
Perlakuan NaNO3 (gr/l) Total
100 50
Salinitas (ppt) 30 - 34 Perlakuan A Perlakuan B A+B 35 - 38 Perlakuan C Perlakuan D C+D
Total A+C B+D N
3.4. Prosedur Penelitian 3.4.1. Persiapan Penelitian a. Sterilisasi Alat
Sterilisasi alat seperti toples direndam kaporit 100 ppm selama 24 jam, dicuci
dengan air bersih dan dibilas hingga bersih dengan air tawar. Setelah bersih
berbahan plastik dilakukan dengan perendaman kaporit 100 ppm selama 24 jam.
Dibersihkan dengan air tawar, lalu dilakukan perebusan selama 20 menit.
b. Sterilisasi Media (Air)
Air laut dialirkan ke UV sterilizer dan diberi ozon menggunakan Ozon sterilizer.
Selanjutnya direbus hingga mendidih. Air laut diukur salinitasnya menggunakan
refraktometer, kemudian dilakukan perebusan berulang kali hingga mendapatkan
stok air laut salinitas yang diinginkan yaitu air laut salinitas 30-34 ppt dan air laut
salinitas 35 - 38 ppt. Kemudian disaring dengan menggunakan plankton net mesh
size 15 mikron.
c. Pembuatan Pupuk Conwy
Pupuk yang digunakan pada kultur Nannochloropsis sp. yaitu pupuk Conwy.
Komposisi pupuk Conwy adalah NaEDTA 45 gram, FeCl3.6H2O 1,3 gram, H2BO3
33,6 gram, NaHPO4 20 gram, NaNO3 100 gram dan 1 Liter aquades (Tabel. 1).
Pembuatan pupuk Conwy dilakukan dengan cara mencampurkan bahan-bahan,
kemudian ditambahkan trace metal 1cc yang terdiri dari ZnCl2 2.1 gr,
CoCl2.6H2O 2 gr, CuSO4.5H2O 2 gr, dan (NH4) M7O24 0.9 gr (Tabel 2) yang
masing-masing telah dicairkan dengan aqubides 100 ml. Pupuk kultur
Nannochlropsis sp. perlakuan pengurangan kadar nitrogen hingga 50% tidak
dilakukan dengan mengencerkan larutan pupuk kultur Conwy stok. Pembuatan
pupuk kultur perlakuan pengurangan kadar nitrogen hingga 50% dibuat dengan
cara mengurangi penggunaan NaNO3 hingga 50% dari kebutuhan standar NaNO3
3.4.2. Pelaksanaan Penelitian
Mikroalga Nannochloropsis sp. dikultur pada toples 2 liter dengan kepadatan 11 x
106 sel/ml masing-masing pada 12 (4 perlakuan x 3 ulangan) toples. Pupuk Conwy
diberikan sebanyak 1 ml/liter kultur, dilakukan pengukuran kualitas air setelah
biota dibiakkan. Media kultur disusun di rak kultur dan diberi aerasi kuat pada
pencahayaan lampu TL 38 W. Kepadatan Nannochlopsis sp. diamati pada
mikroskop setiap 6 jam sekali pada tiap media kultur. Setelah mencapai fase akhir
eksponensial atau pada fase awal stasioner (waktu panen), dilakukan pengukuran
kualitas air kembali. Kemudian Nannochloropsis sp. dipanen secara total dengan
cara dibuat natan menggunakan larutan NaOH. Larutan tersebut dimasukkan
kedalam kultur sedikit demi sedikit sambil diaduk searah jarum jam. Setelah
cukup homogen, putar arah adukan secara berlawanan hingga larutan terasa
mengental. Larutan didiamkan hingga biakan mengendap. Kemudian
masing-masing biakan dimasukkan ke dalam botol sampel yang telah dibersihkan dan
disemprot alkohol, dan disimpan dalam lemari pendingin. Langkah terakhir yang
dilakukan yaitu sampel yang telah disimpan dalam botol sampel dibawa untuk
3.5. Parameter
3.5.1. Penghitungan Kepadatan Nannochloropsis sp.
Penghitungan kepadatan Nannochloropsis sp. dengan cara Nannochloropsis sp.
pada media kultur diambil sebanyak 1 ml dengan pipet, kemudian diamati dengan
Haemacytometer dibawah mikroskop dengan pembesaran 10 x 10 dengan
menggunakan rumus yang dikembangkan oleh BBPBL:
∑
Keterangan : N = Kepadatan
n = Jumlah kotak hitungan
Ki = Kepadatan plankton ke-i
K1-K5 = jumlah Nannochloropsis sp. dalam lapang pandang (kotak) hitungan ke
1 hingga 5
3.5.2. Uji Proksimat Protein
Uji proksimat protein pada Nannochloropsis sp. dengan menggunakan metoda
Gunning di laboratorium Politeknik Lampung (Lampiran 3).
3.5.3. Kualitas air (oksigen terlarut, pH, dan suhu media kultur)
Pengukuran oksigen terlarut, pH, dan suhu media kultur menggunakan DO meter,
pH meter, dan termometer. Pengukuran parameter kualitas air dilakukan 2 kali,
yaitu 24 jam sejak Nannochloropsis sp. di tempatkan di media kultur dan
3.6. Analisis Data
3.6.1. Uji Chi Square (χ2)
Analisis data yang digunakan untuk menguji hasil perlakuan adalah uji Chi square
(χ2
). Uji Chi square (χ2) merupakan teknik nonparametrik yang berguna untuk
menganilisis data yang terpisah bila kedua sampel bebas. Uji tersebut dipakai
apabila nilai-nilai yang didapat dari dua sampel acak bebas semuanya masuk
dalam salah satu dari dua kelas yang berbeda satu sama lain. Setiap subyek dalam
kedua kelompok tersebut mendapatkan satu dari dua nilai yang mungkin.
Nilai-nilai tersebut dipresentrasikan dalam frekuensi-frekuensi suatu tabel kontingensi
(Siegel, 1985) (Tabel 4).
Siegel (1985) menyatakan bahwa perhitungan data dengan uji chi square (χ2)
menggunakan dua pendekatan berdasarkan jumlah data (N) pada penelitian:
a. Jika kepadatan Nannochloropsis sp. berjumlah N > 40 maka rumus yang
digunakan:
| |
Keterangan:
N = jumlah total nilai data
A = Kepadatan Nannochloropsis sp. perlakuan A
B = Kepadatan Nannochloropsis sp. perlakuan B
C = Kepadatan Nannochloropsis sp. perlakuan C
D = Kepadatan Nannochloropsis sp. perlakuan D
A B
A+B
(i.1)
C D C+D(i.2)
b. Jika kandungan protein total Nannocholropsis sp. berjumlah N < 20 maka
rumus yang digunakan:
∑( )
Keterangan :
Oij = frekuensi pengamatan ke-ij i = jumlah baris
Eij = frekuensi harapan ke-ij j = jumlah kolom
in = jumlah data pada baris ke-n
jn = jumlah data pada kolom ke-n
Jika nilai dari χ2lebih besar dari pada χ 2
tabel pada taraf nyata 0,05, maka
diputuskan untuk menolak H0. Jika nilai dari χ 2lebih kecil dari pada χ 2 tabel pada
taraf nyata 0,05, maka diputuskan untuk menerima H0 (Gaspersz, 1991).
3.6.2. Regresi dan Korelasi
Analisis regresi dan korelasi digunakan untuk mempelajari hubungan antara dua
variabel atau lebih. Hubungan antar variabel tersebut dapat dipergunakan untuk
memperkirakan besarnya dampak kuantitatif yang terjadi dari perubahan satu
kejadian terhadap kejadian lainnya. Regresi linier merupakan model hubungan
antara dua variable berdasarkan persamaan garis linier (Supangat, 2007).
Model regresi yang dipergunakan adalah:
X = kepadatan Nannochlropsis sp.
= titik potong Y, nilai perkiraan bagi Y ketika X = 0
= kemiringan garis atau perubahan rata-rata pada Y untuk setiap
satu unit perubahan (naik atau turun) pada variabel bebas X
Koefisen korelasi merupakan tingkat hubungan antara dua variabel atau lebih.
Korelasi merupakan ukuran atau besaran yang menyatakan ada atau tidaknya
hubungan diantara variabel-variabel yang bersangkutan dinyatakan dengan notasi
(r). Nilai korelasi (r) dapat diartikan sebagai tingkat kekuatan hubungan amtara
dua variabel atau lebih (besarnya kontribusi yang diberikan oleh variabel yang
mempengaruhi), baik secara langsung maupun tidak langsung. Tingkat korelasi
bernilai antara -1 < r < 1. Jika nilai r berada pada kisaran -1 < r < 0, maka korelasi
cenderung bersifat korelasi negatif. Jika nilai r berada pada kisaran 0 < r < 1,
maka korelasi cenderung bersifat positif. Penentuan nilai korelasi menggunakan
persamaan berikut (Supangat, 2007):
∑ ∑ ∑
√[ ∑ ∑ ][ ∑ ∑ ]
Keterangan: r = nilai korelasi
n = jumlah sampel
X = data kepadatan Nannochloropsis sp. Y = data protein total Nannochloropsis sp.
Koefisiensi determinasi (R2) merupakan ukuran (besar) untuk menyatakan tingkat
kekuatan hubungan dalam bentuk persentasi (%). Koefisien tersebut dihitung
dengan mengkuadratkan koefisensi korelasi, sebagai berikut (Supangat, 2007) :
V. KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan penelitian dapat disimpulkan bahwa:
a. Peningkatan salinitas dan penurunan nitrogen tidak berpengaruh nyata
terhadap kandungan protein total Nannochloropsis sp., namun berpengaruh
nyata terhadap kepadatan pada akhir kultur Nannochloropsis sp.
b. Hubungan antara kepadatan dan protein total Nannochloropsis sp. cenderung
bersifat korelasi linier positif dan lemah.
c. Peningkatan salinitas cenderung meningkatkan kandungan protein total,
sedangkan penurunan nitrogen menurunkan kandungan protein total
Nannochloropsis sp.
5.2. Saran
Penelitian selanjutnya perlu dilakukan pengujian mengenai salinitas dan nitrogen,
terutama variasi dari salinitas yang digunakan saat kultur Nannochlorpsis sp.
DAFTAR PUSTAKA
Arifin, Z. 2010. Pengaruh Salinitas dan Konsentrasi CO2 Terhadap Pertumbuhan
dan Kadar Lipid Mikroalga Nannochloropsis sp. Bioteknologi.
Aliabbas, A. 2002. Kualitas Nannochloropsis sp. Akibat Lama Penyimpanan Nata de Nanno. Skripsi. Program Studi Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. IPB. Bogor. Hal. 3-18.
Asriyana, dan Yuliana. 2012. Produktivitas Perairan. Bumi Aksara. Jakarta. Hal. 125.
Bellinger, E. G. dan David C. S. 2010. Freswater Algae: Identification and use as Bioindicators. Wiley-Blackwell. UK. p: 73.
Budiman. 2009. Penentuan Intensitas Cahaya Optimum Pada Pertumbuhan dan Kadar Lipid Mikroalga Nannochloropsis sp.Tesis. Proram Magister Kimia. Fakultas Matematikan dan Ilmu Pengetahuan Alam. Institut Teknologi Sepuluh Nopember. Surabaya.
Effendi, H. 2003. Telaah Kualitas Air. Penerbit Kanisius. Yogyakarta. Hal. 66-156.
Fachrullah, M. R. 2011. Laju Pertumbuhan Mikroalga Penghasil Biofuel Jenis
Chlorella sp. dan Nannochloropsis sp. yang Dikultivasi Menggunakan Air Limbah Hasil Penambangan Timah Di Pulau Bangka. Skripsi. Fakultas Perikanan dan Ilmu Kelautan. IPB. Bogor. Hal. 3-11.
Gaspersz, V. 1991. Metode Perancangan Percobaan. Armico. Bandung. Hal. 440-445.
Gunawan. 2012. Pengaruh Perbedaan pH pada Pertumbuhan Mikroalga Klas
Chlorophyta. Jurnal Bioscientiae, 9 (2): 62 – 65.
Hibberd, D. J. 1981. Noteron the Taxonomy and Nomenclature of the Alha Classes Eustigmatophyceae and Tribophyceae (Synonym Xanthiphyceae).
Journal of the Linnean Society of London. Botany 82 : 92-119.
Isnansetyo, A. dan Kurniastuty. 1995. Teknik Kultur Fitoplankton dan
Jati, F., Johanes H., dan Vivi E.H. 2012. Pengaruh Penggunaan Dua Jenis Media Kultur yang Berbeda Terhadap Pola Pertumbuhan, Kandungan Protein dan Asam Lemak Omega 3 EPA (Chaetocerosgracilis). Jurnal of Aquaculture Management and Technology. 1 (1): 221 -235.
Kartikasari, D. 2010. Pengaruh Penggunaan Media Yang Berbeda Terhadap Kemampuan Penyerapan Logam Berat Pb Pada Nannochloropsis sp.
Skripsi. Fakultas Pertanian Universitas Lampung. Lampung.
Maula, R.N. 2010. Optimasi Kultivasi Mikroalga Laut NannochloropsisOculata
Dengan Perlakuan Pupuk Urea Untuk Produksi Lemak Nabati.Skripsi. Fakultas Perikanan dan Ilmu Kelautan Universitas Brawijaya. Malang.
Muhaemin, M. 2011. Lipid Production of Nannochloropsis under Environmental Stress. Jurnal Penelitian Sains. 14 (3): 61-62.
Page, D. S. 1981. Prinsip-prinsip Biokimia. Penerbit Erlangga. Jakarta.
Poedjiadi, A. 1994. Dasar-dasar Biokimia. Jakarta.UI-Press. 472 hlm.
Prabowo, D. A. 2009. Optimasi Pengembangan Media Untuk Pertumbuhan
Chlorella sp. pada Skala Laboratorium. Skripsi. Program Studi Ilmu dan Teknologi Kelautan. Fakultas Perikanan dan Ilmu Kelautan. IPB. Bogor. Hal 7 – 14.
Putra, A. N. 2008. Aplikasi Pemberian Taurine Pada Larva Ikan Kerapu Bebek (Cromileptesaltivelis). Skripsi. Program Studi Teknologi dan Manajemen Akuakultur. Fakultas Perikanan dan Ilmu Kelautan. IPB. Bogor.
Safitri, M. E., Rara D., Suparmono, dan Moh. Muhaemin. 2013. Kandungan Lemak Total Nannochloropsis sp.pada Fotoperiode yang Berbeda. Jurnal Rekayasa dan Teknologi Budidaya Perairan. 1: 127-134.
Sasmita, P.G., I.G. Wenten, dan G. Suantika. 2004. Pengembangan Teknologi Ultrafiltrasi Untuk Pemekatan Mikroalga. Universitas Diponegoro Semarang. Hal. 1-5.
Serang, A. M. 2006. Pengaruh Kadar Protein dan Rasio Energi Protein Pakan Berbeda Terhadap Kinerja Pertumbuhan Benih Rajungan (Portunus
pelagicus). Tesis. Pascasarjana Institut Pertanian Bogor. Bogor. Hal. 5-23.
Siegel, S. 1985. Statistik Nonparametrik. Gramedia. Jakarta. 130-137 hlm.
Supangat, A. 2007. Statistika: Dalam Kajian Deskriptif, Inferasi, dan
Nonparametrik. Kencana Prenada Media Group. Jakarta. Hal. 325-357.
Sutomo. 2005. Kultur Tiga Jenis Mikroalga (Tetraselmis sp., Chlorella sp.dan
Chaetocerosgracilis) dan Pengaruh Kepadatan Awal Terhadap
Pertumbuhan C. gracilis di Laboratorium. Oseanologi dan Limnologi di Indonesia. Pusat Penelitian Oseanografi. No. 37 :43-58.
Sylvester, B., Nelvy, dan Sudjiharno. 2002. Biologi Fitoplankton, Budidaya Fitoplankton dan Zooplankton. Makara. Teknologi. 9: 3-23.
Walpole, R. E. 1982. Pengantar Statistik. Gramedia. Jakarta. 340-372 hlm.
Widianingsih, Retno H., H. Endarwati., Ervia Y., dan Valentina R.I. 2011. Pengaruh Pengurangan Konsentrasi Fosfat dan Nitrat Terhadap Kandungan Lipid Total Nannochloropsis sp. Jurnal Kelautan. 16: 24-29.
Yanuaris, L, M., Rahayu K. dan Kismiyati. 2012. Pengaruh Fermentasi
Actinobacillus sp. Pada Kotoran Sapi Sebagai Pupuk Terhadap Pertumbuhan
Nannochloropsis sp.Jurnal Ilmiah Perikanan dan Kelautan. Fakultas Perikanan dan Kelautan. Universitas Airlangga. Surabaya. 4 : 21-26.
A B A+B
perlakuan Nitogen Total
N1 N2
Perlakuan Nitogen Total
N1 N2
salinitas S1 1370 1167 2537
S2 1370 1344 2714
Kepadatan Awal - Akhir
Awal Akhir Total
perlakuan Nitogen Total
Antar Perlakuan 0.04116 0.00973 0.00976
< χ2 tabel 0.05 = 5.99
0.30077 0.63563 0.07633 0.3361 0.7103 0.08529
A 121 140 110 371
0.54838 0.79821 0.03347 0.54673 0.79581 0.03336
< χ2 tabel 0.05 = 5.99
0.31148 0.35111 0.00426 0.29207 0.32923 0.004
C 120 108 104 332 0.03953 0.10185 0.01429
438.34 453.335
χ2 hitung
0.37096 0.21273 0.02962 0.39065 0.21288 0.02964
> χ2 tabel 0.05 = 5.99 0.06843 0.50821 0.19412
> χ2 tabel 0.05 = 5.99 3.38584 3.44637 0.02025
426.42 485.809 431.771
χ2 hitung
5.36279 3.0372 0.20501 4.66052 2.63947 0.17816
> χ2 tabel 0.05 = 5.99
Awal dan Akhir Kultur - Perlakuan A –A’ 0.18915 0.79076 0.19478
B 104 127 100 331
0.86259 0.03666 0.44212 0.24445 0.01039 0.12529
> χ2 tabel 0.05 = 5.99
0.30373 0.00192 0.26956 0.0736 0.00046 0.06532
0.00254 0.07644 0.05459 0.00067 0.02008 0.01434
∑
∑
< χ2 tabel 0.05 = 5.99
Perlakuan C – D
U1 U2 U3 Total
C 0.2868 0.2986 0.256 0.8414
D 0.2249 0.1772 0.2426 0.6447
Total 0.5117 0.4758 0.4986 1.4861
db (r-1) (k-1) = (2-1) (3-1) = 2 χ2
tabel 0.05 = 5.99
∑
∑
< χ2 tabel 0.05 = 5.99
Eij U1 U2 U3
A 0.2897 0.2694 0.2823
Uji proksimat protein pada Nannochloropsis sp. dengan menggunakan metoda
Gunning.
1. Nannochloropsis sp. yang dipanen diberi NaOH, setelah 24 jam dipindahkan
natan yang terbentuk ke wadah sampel uji.
2. Ditimbang 0,5 – 1,0 gr bahan kering uji yang telah dihaluskan dan
dimasukkan dalam labu kjeldahl, tambahkan 10 gr K2S atau Na2SO4 anhidrat,
dan 10 – 15 ml H2SO4 pekat. Kalau distruksi sukar dilakukan perlu ditambah
0,1 – 0,3 gr CuSO4 dan gojok
3. Kemudian bahan uji dilakukan distruksi diatas pemanas listrik dalam lemari
asam, mula mula dengan api kecil, setelah asap hilang api dibesarkan,
pemanasan diakhiri setelah cairan menjadi jernih tak berwarna lagi
4. Dibuat perlakuan blangko, yaitu seperti perlakuan diatas tanpa contoh.
5. Setelah dingin ditambahkan kedalam labu kjeldahl aquades 100 ml, serta
larutan NaOH 45 % sampai cairan bersifat basis, dipasang labu kjeldahl
dengan segera pada alat distilasi.
6. Dipanaskan labu Kjeldahl sampai amonia menguap semua, distilat ditampung
dalam erlenmeyer berisi 25 ml HCL 0,1N yang sedang diberi indikator
PhenolPtalein (pp) 1 % beberapa tetes. Distilasi diakhiri setelah distilat
tertampug sebanyak 150 ml atau setelah distilat yang keluar tak bersifat basis.
7. Kelebihan HCl 0,1 N dalam distilat dititrasi dengan larutan basa standar
(larutan NaOH 0,1 N)