ABSTRACT
THE EFFECT OF HEATING ON THE APPEARANCE OF STARCH GRANULES, ANTHOCYANIN CONTENT, ANTIOXIDANT CAPACITY
AND THE RATE OF
ENZIMATIC HYDROLYSIS OF MODIFIED PURPLE SWEET POTATO FLOUR
By
LELY SURYATI
Purple sweet potatoes (Ipomea batatas L. Poir) are rich in carbohydrate and anthocyanins. Anthocyanins are beneficial to health because they function as antioxidants. Processing purple sweet potato into flour is one alternative to preserve sweet potatoes. However native sweet potato flour has poor functional properties, therefore physical modification through heating at 90°C in a rotary cooker at 0, 15, 30, 45 60 and 75 min was aimed to improve its functionality. This experiment was arranged in a complete randomized design with four replications. The results showed that various heating time had influence the appearance of starch granule observed using SEM, the rate of enzymatic hydrolysis and anthocyanin content but did not affect the antioxidant capacity. The best treatment to maintain the content of anthocyanin was found on heating for 30 min treatment, and the anthocyanin cantent was 66,24%.
ABSTRAK
PENGARUH LAMA PEMANASAN DALAM PEMANAS BERPUTAR TERHADAP PENAMPAKAN GRANULA PATI, KANDUNGAN
ANTOSIANIN, KAPASITAS ANTIOKSIDAN DAN TINGKAT HIDROLISIS ENZIMATIS TEPUNG UBI JALAR UNGU
TERMODIFIKASI
Oleh
LELY SURYATI
Ubi jalar ungu (Ipomea batatas L. Poir) selain mengandung karbohidrat juga mengandung antosianin. Antosianin bermanfaat bagi kesehatan karena berfungsi sebagai antioksidan. Pemanfaatan ubi jalar ungu menjadi tepung merupakan salah satu alternatif penganekaragaman produk olahan ubi jalar. Modifikasi tepung secara fisik menggunakan pemanasan dalam pemanas berputar sebelum ubi jalar ditepungkan, ditujukan untuk memperbaiki sifat fungsional pati seperti penampakan granula dan tingkat hidrolisis enzimatis sekaligus untuk mempertahankan kandungan antosianin dan kapasitas antioksidan. Penelitian ini mengkaji pengaruh lama pemanasan terhadap penampakan granula pati dan tingkat hidrolisis enzimatis serta menentukan lama pemanasan yang terbaik untuk mempertahankan kandungan antosianin dan kapasitas antioksidan tepung ubi jalar ungu termodifikasi. Penelitian menggunakan Rancangan Acak Kelompok Lengkap (RAKL) dengan faktor tunggal dan 4 (empat) ulangan. Perlakuan adalah pemanasan pada suhu 90° selama 0, 15, 30, 45, 60, dan 75 menit. Hasil penelitian menunjukkan bahwa perlakuan pemanasan dalam pemanas berputar memberikan pengaruh terhadap penampakan granula pati, tingkat hidrolisis enzimatis dan kandungan antosianin, tetapi tidak berpengaruh nyata terhadap kapasitas antioksidan. Perlakuan lama pemanasan yang terbaik untuk mempertahankan kandungan antosianin adalah lama pemanasan 30 menit sebesar 66,24 %.
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 11 Oktober 1965, merupakan istri dari Bapak Rahmadi. S dan alhamdulilah dikarunia 4 orang putra putri yang pertama Perdana Agung Nugraha telah menyelesaikan pendidikan SI di Teknik Elektro UNILA, kedua Wahyuningrum Sekar Dwi Rani sebagai mahasisiwi semester V di UII Yogjakarta, ketiga Vito Savero Galih Gumilang mahasiswa semester III di Universitas Telkom Bandung dan yang keempat Muhammad Farid Arrafi sebagai siswa SMA Al Kautsar. Penulis dilahirkan sebagai anak ketiga dari delapan saudara dari pasangan Bapak Syamsuar (Alm) dan Ibu Nurbaiti.
Karya ini persembahan untuk :
Suami dan Anak-anak tersayang
Serta
SANWACANA
Puji syukur Penulis panjatkan ke hadirat Allah SWT atas nikmat dan ridho-Nya, sehingga penulis dapat menyelesaian tesis ini.
Tesis dengan judul “Pengaruh Lama Pemanasan dalam Pemanas Berputar Terhadap Penampakan Granula Pati, Kandungan Antosianin, Kapasitas Antioksidan dan Tingkat Hidrolisis Enzymatis Tepung Ubi Jalar Ungu
Termodifikasi” adalah salah satu syarat untuk memperoleh gelar pascasarjana Magister Teknologi Industri Pertanian di Universitas Lampung
Dalam kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang sedalam-dalamnya kepada :
1. Ibu Ir. Siti Nurdjanah, M.Sc., Ph.D. selaku pembimbing pertama atas bimbingan, motivasi dan kesabarannya dalam proses penelitian hingga penyelesaian tesis
4. Bapak Dr. Ir. Murhadi, M.Si. selaku pembimbing akademik atas kesediaan waktu dalam memberi saran serta bimbingannya selama ini.
5. Bapak dan Ibu dosen pengajar Program Studi Magister Teknologi Industri Pertanian yang dengan tulus ikhlas telah memberikan ilmu pengetahuan yang berharga bagi penulis.
6. Suami tercinta, anak dan anak-anakku tersayang yang selama ini telah membantu dan mendukung serta memberikan motivasi semangat penulis dalam penyelesaian tesis ini
7. Karyawan dan Staf Jurusan Teknologi Hasil Pertanian dan Magister Teknologi Industri Pertanian : Mbak Untari, Mas Joko, Mbak Desi, Mas Midi, Mas Hanafi dan Mbak Fizza atas bantuan yang telah diberikan kepada penulis. 8. Rekan mahasiswa MTIP (2011) yang telah bersama-sama berjuang dalam menempuh pendidikan di Magister Teknologi Industri Pertanian Universitas Lampung dan tim penelitian ubi jalar ungu Mbak Anjar, Pak Andre dan Mas Jeri atas bantuan dan kebersamaannya selama penelitian.
Semoga Allah SWT membalas semua kebaikan kalian dan semoga tesis ini dapat bermanfaat bagi penulis dan pihak-pihak yang memerlukannya. Amin.
Bandar Lampung, September 2014 Penulis,
DAFTAR ISI
A. Tempat dan Waktu Penelitian ... 35
B. Bahan dan Alat ... 35
D. Pelaksanaan Penelitian ... 37
1. Pembuatan Tepung Ubi Jalar Ungu ... 37
E. Pengamatan ... 39
1. Penampakan Granula Pati ... 39
2. Kandungan Antosianin ... 39
3. Kapasitas Antioksidan ... 40
a. Penentuan Absorbansi Kontrol ... 41
b. Penentuan Absorbansi Sampel ... 41
4. Tingkat Hidrolisis Dengan Enzym α- Amilase ... 43
IV. HASIL DAN PEMBAHASAN ... 46
A. Pembuatan Tepung Ubi Jalar Ungu ... 46
B. Penampakan Granula Pati ... 49
C. Kandungan Antosianin ... 54
D. Kapasitas Antioksidan ... 57
E. Tingkat Hidrolisis Dengan Enzym α- Amilase ... 61
V. KESIMPULAN ... 64
A. Kesimpulan ... 64
B. Saran ... 64
DAFTAR PUSTAKA ... 65
DAFTAR TABEL
Tabel Halaman
1. Kandungan kimia ubi jalar ungu varietas Ayammurasaki ... 12
2. Kompisisi kimia tepung ubi jalar ungu ... 13
3. Kandungan komponen kimia beberapa jenis granula pati ... 19
4. Data kandungan antosianin ubi jalar ungu termodifikasi ... 73
5. Uji homogenitas kandungan antosianin ubi jalar ungu termodifikasi ... 74
6. Uji keaditifan data (Tukey Test) terhadap kandungan antosianin tepung ubi jalar ungu termodifikasi ... 75
7. Uji sidik ragam kandungan antosianin tepung ubi jalar termodifikasi ... 76
8. Uji BNT terhadap kandungan antosianin tepung ubi jalar ungu termodifikasi…. ... 77
9. Hasil uji BNT kandungan antosianin tepung ubi jalar ungu termodifikasi……. ... 78
10. Data kapasitas antioksidan tepung ubi jalar ungu termodifikasi ... 79
11. Uji homogenitas kapasitas antioksidan tepung ubi jalar ungu termodifikasi…… ... 80
12. Uji keaditifan data (Tukey Test) terhadap kapasitas antioksidan tepung ubi jalar ungu termodifikasi ... 81
13. Uji sidik ragam kapasitas antioksidan tepung ubi jalar termodifikasi... 82
14. Uji BNT terhadap kapasitas antioksida tepung ubi jalar ungu termodifikasi ... 83
16. Uji Kehomogenitas tingkat hidrolisis enzimatis tepung ubi jalar ungu
termodifikasi …… ... 85 17. Uji keaditifan data (Tukey Test) terhadap timgkat hidrolisis enzimatis tepung
ubi jalar ungu termodifikasi ... 86 18. Uji sidik ragam tingkat hidrolisis enzimatis tepung ubi jalar ungu
termodifikasi ... 87 19. Uji BNT terhadap tingkat hidrolisis enzimatis tepung ubi jalar ungu
termodifikasi ... 88 20. Hasil Uji BNT tingkat hidrolisis enzimatis tepung ubi jalar ungu
DAFTAR GAMBAR
Gambar Halaman
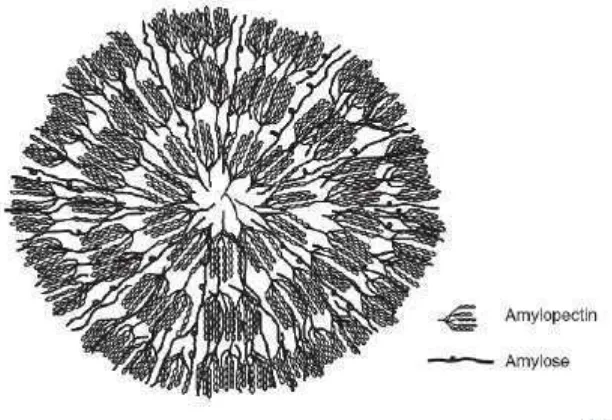
1. Skema penyusunan granula pati dari amilosa dan amilopektin ... 15
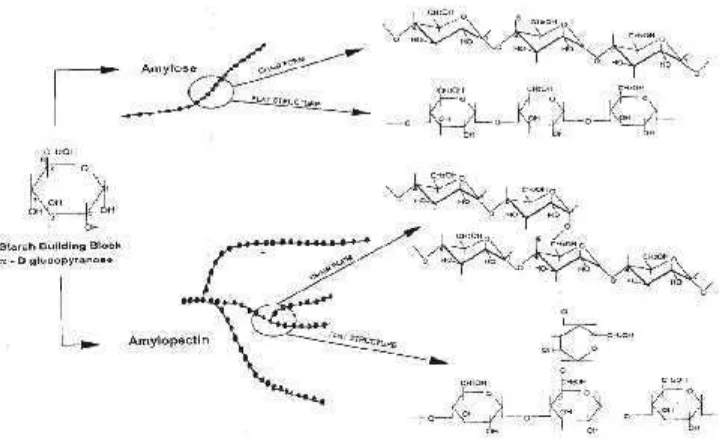
2. Struktur amilosa dan amilopektin ... 17
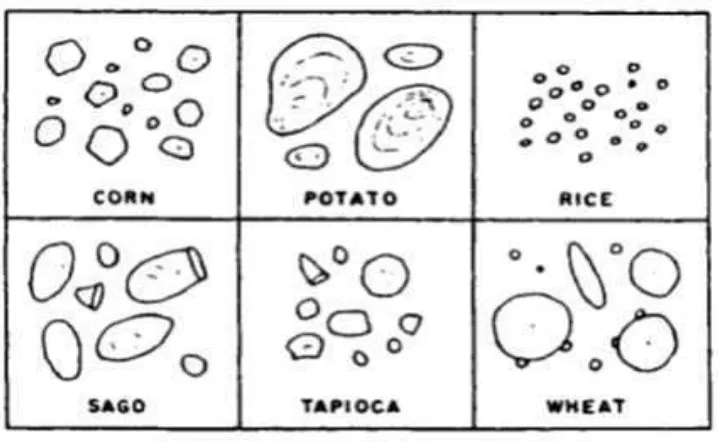
3. Bentuk beberapa granula pati ... 18
4. Skema pati tergelatinisasi ... 22
5. Struktur kimia dasar antosianin ... 26
6. Antosianidin yang umum ada di bahan pangan ... 26
7. Reaksi kimia hidrolisa pati menjadi glukosa ... 32
8. Diagram alir proses pembuatan tepung ubi jalar ungu termodifikasi ... 38
9. Diagram alir pengukuran kapasitas antioksidan ... 42
10. Prosedur pengujian daya cerna enzymatis metode invitro ... 44
11. Ubi jalar ungu varietas Ayamurasaki ... 46
12. Tepung ubi jalar ungu termodifikasi secara fisik ... 47
13. Penampakan granula SPS pembesaran 500x ... 49
14. Penampakan granula SPS pembesaran 2000x ... 49
15. Penampakan mikroskopis tepung ubi jalar tanpa pemanasan dengan pembesaran 500x ... 50
16. Penampakan mikroskopis tepung ubi jalar tanpa pemanasan dengan pembesaran 2000x ... 50
18. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 15
menit pada pembesaran 2000x ... 51
19. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 30 menit pada pembesaran 500x ... 51
20. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 30 menit pada pembesaran 2000x ... 51
21. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 45 menit pada pembesaran 500x ... 52
22. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 45 menit pada pembesaran 2000x ... 52
23. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 60 menit pada pembesaran 500x ... 53
24. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 60 menit pada pembesaran 2000x ... 53
25. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 75 menit pada pembesaran 500x ... 54
26. Penampakan mikroskopis tepung ubi jalar pemanasan 90o C selama 75 menit pada pembesaran 2000x ... 54
27. Grafik kandungan antosianin tepung ubi jalar ungu termodifikasi ... 55
28. Grafik kapasitas antioksidan tepung jalar ungu termodifikasi...58
29. Grafik tingkat hidrolisis enzimatis tepung ubi jalar ungu termodifikasi...62
30. Pengupasan ubi jalar ungu...90
31. Hasil penyawutan ubi jalar ungu...90
32. Pemanas berputar dan pengukuran suhu ...90
33. Ubijalar ungu setelah dipanaskan...91
34. Pengeringan dan penepungan ...91
35. Pengayakan dan sampel tepung ubi jalar ungu...91
36. Prosedur pengukuran kapasitas antioksidan .... ...92
I. PENDAHULUAN
A. Latar Belakang dan Masalah.
Produksi ubi jalar di Indonesia pada tahun 2013 dilaporkan sebesar 2.366.410 ton dari luas lahan 166.332 Ha (BPS, 2013). Ubi jalar ungu (Ipomea batatas) merupakan salah satu sumber karbohidrat utama di Indonesia yang menempati urutan ke empat setelah padi, jagung dan ubi kayu. Selain mengandung karbohidrat, kandungan antosianin ubi jalar ungu tergolong tinggi, sehingga hal ini merupakan salah satu keunggulan ubi jalar ungu dibandingkan jenis umbi yang lain. Antosianin bermanfaat bagi kesehatan karena berfungsi sebagai antioksidan, antihipertensi dan mencegah gangguan fungsi hati (Suda et al., 2003). Menurut Astawan dan Widowati (2005), ubi jalar ungu memiliki antosianin yang berkisar antara 51,5 sampai 174,7 mg/100gram.
Pengolahan ubi jalar menjadi tepung dapat dijadikan sebagai salah satu alternatif dalam rangka menganekaragamkan produk olahan ubi jalar. Selain itu tepung ubi jalar fleksibel dalam penggunaannya, mudah dicampur (dibuat komposit) dan
2
jalar dapat digunakan untuk produk rerotian, mie, makanan ringan, biskuit dan dapat mengurangi penggunaan tepung terigu.
Menurut Suprapti (2009) masalah yang timbul akibat proses pembuatan tepung ubi jalar ungu yaitu penurunan kandungan antosianin ubi jalar ungu dan reaksi pencoklatan enzimatik yang disebabkan oleh enzim fenolase. Selain itu, aplikasi tepung tepung ubi jalar pada produk pangan mempunyai beberapa kelemahan seperti sifat fisiko-kimia, sehingga perlu dilakukan modifikasi terhadap tepung ubi jalar ungu pada saat pengolahan, sehingga menghasilkan tepung ubi jalar yang memiliki yang sifat yang lebih baik dan dapat diterima oleh konsumen.
Modifikasi pati dapat dijadikan sebagai salah satu alternatif untuk memperbaiki sifat tepung ubi jalar, hal ini disebabkan tepung ubi jalar mengandung 60 % pati (Antarlina dan Utomo, 1999). Modifikasi pati dapat dilakukan secara fisik yaitu (gelatinisasi parsial) melalui pemanasan ubi jalar ungu sebelum ditepungkan menggunakan pemanasan drum berputar, pemanasan dapat menyebabkan sebagian pati tergradasi atau terfragmentasi menjadi polimer yang lebih pendek rantainya atau bahkan tergelatinisasi sebagian. Chung et al. (2006) melaporkan apabila pemanasan dilakukan dengan suhu dan air yang terbatas maka pati akan tergelatinisasi sebagian. Surfiana et al. (2013) melaporkan bahwa tapioka yang dipanaskan pada suhu 90o
memperbaiki sifat fungsional tepung ubi jalar ungu meliputi penampakan granula, kandungan antosianin, kapasitas antioksidan dan tingkat hidrolisis pati.
Penelitian ini mengkaji penampakan granula pati, kandungan antosianin, kapasitas antioksidan dan tingkat hidrolisis enzimatis tepung ubi jalar ungu yang dibuat melalui proses gelatinisasi parsial dengan menggunakan pemanasan berputar pada suhu 90o
C dengan lama pemanasan 0, 15, 30, 45, 60 dan 75 menit. Oleh karena itu masalah yang dikaji adalah berapa lama waktu pemanasan yang terbaik untuk mendapatkan tepung ubi jalar ungu termodifikasi secara fisik namun kandungan antosianin dan kapasitas antioksidan dapat dipertahankan.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengkaji pengaruh lama pemanasan terhadap penampakan granula pati, tingkat hidrolisis enzimatis, kandungan antosianin dan kapasitas antioksidan tepung ubi jalar ungu termodifikasi.
2. Menentukan lama pemanasan yang terbaik untuk mempertahankan kandungan antosianin dan kapasitas antioksidan tepung ubi jalar ungu termodifikasi
C. Kerangka Pemikiran
4
2007) dan modifikasi pati ubi jalar secara Heat Moisture Treatment (Pranoto et al., 2009), serta penambahan bahan kimia seperti sodium alginat. Metode modifikasi secara asetilasi maupun penambahan bahan kimia dapat memperbaiki sifat alami tepung dan pati ubi jalar, akan tetapi berpengaruh terhadap kestabilan antosianin ubi jalar ungu. Menurut Yadav et al. (2007), penggunaan enzim mampu memperbaiki karakteristik tepung ubi jalar ungu, tetapi metode ini kurang cocok diterapkan untuk industri rumah tangga dan industri kecil karena harus membeli enzim dengan harga yang relatif mahal, sehingga perlu dicari alternatif teknologi yang lebih sederhana.
Modifikasi tepung secara fisik merupakan salah satu teknologi yang dapat diterapkan yaitu menggunakan pemanasan dalam pemanas berputar. Penggunaan pemanasan dalam drum berputar telah dilaporkan dapat memperbaiki kualitas tepung ubi kayu (Hidayat et al., 2009), akan tetapi penggunaannya dalam memodifikasi tepung ubi jalar ungu untuk memperbaiki sifat fisik kimia dan untuk mempertahankan kandungan antosianin yang tinggi dan kapasitas antioksidan tepung ubi jalar ungu belum pernah dilaporkan.
karakteristik patinya. Salah satu metode untuk memperbaiki karakteristik pati adalah dengan proses gelatinisasi parsial.
Gelatinisasi pati dipengaruhi oleh suhu, ketersediaan air dan lama pemanasan (Beynum dan Roels, 1985). Proses gelatinisasi parsial dapat dilakukan dengan cara pemanasan dengan kebutuhan air yang terbatas (Chung et al., 2006). Umumnya makanan bertepung selama proses pengolahan sebagian pati tidak tergelatinisasi, karena kadar air dan pemanasan tidak mencukupi. Kisaran suhu gelatinisasi pada ubi jalar yaitu 75-88oC (Eliasson, 2004). Hidayatet al. (2009) melaporkan bahwa pembuatan tepung singkong menggunakan suhu 90 oC selama 90 menit dapat menggelatinisasi pati sebagian. Oleh karena itu suhu pemanasan yang ditetapkan pada penelitian ini yaitu suhu 90oC dengan pengaturan lama pemanasan. Hernanto (2014) melaporkan lama pemanasan mempengaruhi penampakan granula pati dan derajat gelatinisasi.
6
Menurut Yudiono (2011), semakin tinggi suhu akan mendorong terlepasnya bagian glikosil pada antosianin dengan menghidrolisis ikatan glikosidik, sehingga terbentuk aglikon tidak stabil dan selanjutnya antosianin kehilangan warna. Menurut Rhim (2002) stabilitas antosianin wortel pada pemanasan antara 70 oC dan 90 oC. Kumalaningsih (2006) mengatakan bahwa antosianin ubi jalar lebih stabil dibandingkan antosianin dari sumber lain seperti kubis merah,blueberriesdan
jagung merah. Khaldun et al. (2014) kestabilan warna ekstrak ubi jalar ungu mengalami penurunan terhadap lamanya waktu pemanasan pada suhu 100º C. Oleh karena itu, penelitian ini dilakukan untuk menentukan lama pemanasan dalam pemanas berputar yang terbaik pada suhu 90º C dengan 6 taraf waktu 0, 15, 30, 45, 60, dan 75 menit yang dapat digunakan untuk memodifikasi tepung ubi jalar ungu secara fisik agar pati ubi jalar tergelatinisasi sebagian, sedangkan kandungan antosianin dan kapasitas antioksidan dapat dipertahankan serta meningkatkan hidrolisis pati.
D. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah :
1. Lama pemanasan berpengaruh terhadap penampakan granula pati, tingkat hidrolisis enzimatis, kandungan antosianin dan kapasitas antioksidan tepung ubi jalar ungu termodifikasi.
Ubi jalar atau ketela rambat atau “sweet potato” diduga berasal dari benua Amerika. Para ahli botani dan pertanian memperkirakan daerah asal tanaman ubi jalar adalah Selandia Baru, Polinesia dan Amerika bagian tengah. Ubi jalar menyebar ke seluruh dunia terutama negara-negara beriklim tropika, diperkirakan pada abad ke-16. Orang-orang Spanyol dianggap berjasa menyebarkan ubi jalar ke kawasan Asia terutama Filipina, Jepang dan Indonesia (Direktorat Jendral Tanaman Pangan, 2014). Sistematika (taksonomi) tumbuhan, tanaman ubi jalar diklasifikasikan sebagai berikut (Rukmana, 1997):
Kingdom : Plantae
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledonae Ordo : Convolvulales Famili : Convolvulaceae Genus : Ipoemoea
Spesies : Ipoemoea batatas
II. TINJAUAN PUSTAKA
8
Ubi jalar menempati peringkat ke 7 dari tanaman pangan di dunia dan peringkat ke 5 diantara negara berkembang. Sampai saat ini China adalah produsen ubi jalar terbesar 90% di dunia dengan volume produksi sebesar 117 juta ton (Centro Internacional de la Papa, 2011).
Menurut Widodo (1989), ubi jalar memiliki kandungan nutrisi yang baik, umur yang
relatif pendek, dan produksi yang tinggi. Ubi jalar juga dianggap lebih murah, lebih
manis, dan banyak mengandung komponen kalori dan vitamin A jika dibandingkan
dengan tepung terigu (Villareal dan Griggs, 1982). Selain itu ubi jalar juga
merupakan salah satu komoditas lokal sumber serat pangan yang berpotensi sebagai
prebiotik (Lestari et al., 2013). Dari gambaran di atas terlihat bahwa ubi jalar
memiliki potensi yang sangat layak untuk dipertimbangkan dalam menunjang
program diversifikasi pangan yang berbasis pada tepung dan pati.
1. Jenis-Jenis Ubi Jalar
banyak, antara lain: Lampeneng, Sawo, Cilembu, Rambo, SQ-27, Jahe, Kleneng, Gedang, Tumpuk, Georgia, Layang-Layang, Karya, Daya, Borobudur, Prambanan, Mendut, Sari, Sukuh, dan Kalasan. Varietas yang digolongkan sebagai varietas unggul harus memenuhi persyaratan sebagai berikut:
a. Berdaya hasil tinggi, di atas 30 ton/hektar. b. Berumur pendek (genjah) antara 3-4 bulan. c. Rasa ubi enak dan manis.
d. Tahan terhadap hama penggerek ubi (Cylas sp.) dan penyakit kudis oleh cendawan Elsinoe sp.
e. Kadar karoten tinggi di atas 10 mg/100 gram. f. Keadaan serat ubi relatif rendah
Menurut Juanda dan Cahyono (2009) berdasarkan warna umbi, ubi jalar dibedakan menjadi beberapa golongan sebagai berikut :
a. Ubi jalar putih yakni ubi jalar yang memiliki daging umbi berwarna putih. Misalnya, varietas tembakur putih, varietas tembakur ungu,varietas Taiwan dan varietas MLG 12659-20P.
b. Ubi jalar kuning, yaitu jenis ubi jalar yang memiliki daging umbi berwarna kuning, kuning muda atau putih kekuningan. Misalnya,varietas lapis 34, varietas South Queen 27, varietas Kawagoya, varietas Cicah 16 dan varietas Tis 5125-27.
10
d. Ubi jalar ungu yakni ubi jalar yang memiliki daging umbi berwarna ungu hingga ungu muda misalnya varietas Ayamurasaki dan Yamagawamurasaki serta klon MSU 01022–12, Klon MSU 03028 -10, RIS 03063 05.
2. Ubi Jalar Ungu Ayamurasaki
Ubi jalar ungu (Ipomoea batatas) varietas Ayamurasaki biasa disebut Ipomoea batatas blackie karena memiliki kulit dan daging umbi yang berwarna ungu kehitaman (ungu pekat). Ubi jalar ungu Ayamurasaki merupakan jenis ubi jalar ungu yag ditanam di Jepang dan memiliki kandungan antosianin yang tinggi (Yamakawa et al., 1998). Ubi jalar ungu dapat dimanfaatkan sebagai pewarna alami karena sifat antosianinnya lebih stabil dengan kandungan yang lebih tinggi (Kano et al., 2005). Beberapa industri pewarna dan minuman beralkohol telah menggunakan ubi jalar ungu Ayamurasaki sebagai bahan baku penghasil antosianin.
A,B1,B2,C dan E, mineral (kalsium, kalium, magnesium, tembaga, seng) dan serat pangan.
Ubi jalar merupakan sumber karbohidrat dan sumber kalori yang cukup tinggi. Menurut Murtiningsih dan Suyanti (2011) nilai indeks glisemik ubi jalar ungu tergolong rendah yaitu sebesar 51, sehingga apabila dikonsumsi tidak akan menaikkan kadar gula darah secara drastis. Sebaliknya beras dan jagung mengandung nilai Indeks Glisemik tinggi, sehingga dapat menaikkan gula darah dengan cepat. Karena itu, ubi jalar sangat baik jika dikonsumsi penderita diabetes.
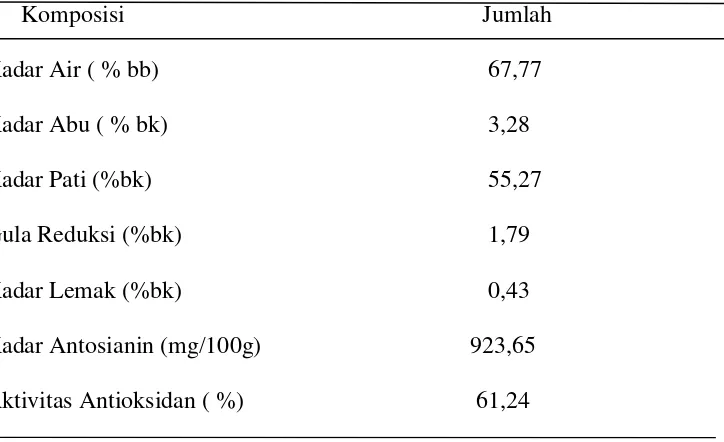
Beberapa tahun terakhir para peneliti telah mengembangkan budidaya ubi jalar ungu. Salah satu keunggulan ubi jalar berdaging ungu adalah kandungan antosianin yang tinggi, sehingga mempunyai potensi menyehatkan (Suda et al., 2003. Zhanget al., 2009,Hagiwaraet al., 2002 ). Total kandungan antosianin ubi jalar varietas Ayamurasaki bervariasi pada setiap tanaman, yaitu berkisar antara 20 mg/100 g sampai 924 mg/100 g berat basah (Widjanarko, 2008). Pigmen ubi jalar ungu lebih stabil dibanding antosianin dari sumber lain, seperti kubis merah, eldeberi, dan jagung merah (Kano et al.,2005). Kandungan kimia ubi jalar ungu varietas Ayamurasaki disajikan pada Tabel. 1.
12
untuk bahan baku industri pangan sebagai makanan yang sehat juga sebagai pewarna alami.
Tabel. 1. Kandungan kimia ubi jalar ungu varietas Ayamurasaki
Komposisi Jumlah
Kadar Air ( % bb) 67,77
Kadar Abu ( % bk) 3,28
Kadar Pati (%bk) 55,27
Gula Reduksi (%bk) 1,79
Kadar Lemak (%bk) 0,43
Kadar Antosianin (mg/100g) 923,65
Aktivitas Antioksidan ( %) 61,24
Sumber : Widjanarko (2008 )
B. Tepung Ubi Jalar Ungu
Salah satu potensi pengembangan ubi jalar adalah dengan mengolah ubi jalar
menjadi tepung. Proses pembuatan tepung cukup sederhana dan dapat dilakukan
dalam skala rumah tangga maupun industri kecil. Pembuatan tepung ubi jalar
meliputi pembersihan, pengupasan, pemarutan (pengirisan), dan pengeringan sampai
prospek cukup potensial dalam kegiatan agroindustri sebagai upaya peningkatan nilai tambah. Tepung ubi jalar dapat digunakan untuk bahan baku produk produk industri pangan seperti roti, cake, biskuit dan mie dengan tujuan mensubstitusi penggunaan terigu.
Dalam pembuatan tepung dari satu ton ubi jalar segar dapat diperoleh 200-260 kg tepung ubi jalar murni. Rendemen tepung ubi jalar dapat mencapai 20-30% tergantung pada varietas ubi jalar (Heriyanto et al., 1999). Besarnya rendemen tepung yang dihasilkan dari ubi jalar segar dapat diketahui dari kadar bahan keringnya. Semakin tinggi kadar bahan kering ubi jalar, maka semakin tinggi pula rendemen tepung yang dihasilkan. Besarnya kadar bahan kering tergantung pada varietas/klon, lingkungan (radiasi sinar matahari, suhu, pemupukan, kelembaban tanah) dan umur tanaman (Bradbury dan Holloway, 1988). Komposisi kimia tepung ubi jalar dapat dilihat pada Tabel. 2.
Tabel. 2. Komposisi kimia tepung ubi jalar ungu
Komponen Jumlah
Air (%) 7,00
Protein (%) 2,13
Lemak (%) 0,50
Karbohidrat (%) 85,26
Abu (%) 2,13
Kalori (kal/100 gram) 366,89
14
Masalah utama yang dihadapi dalam pembuatan tepung ubi jalar ungu adalah terjadinya reaksi pencoklatan, yaitu warna ubi ungu akan menjadi kusam karena reaksi pencoklatan enzimatik yang disebabkan oleh enzim fenolase. Untuk menghambat reaksi pencoklatan enzimatik, maka ubi ungu perlu dikukus untuk merusak struktur enzim fenolase, sehingga reaksi pencoklatan enzimatik pada ubi ungu dapat dihambat (Richana, 2009). Menurut Kadarisman dan Sulaeman (1993), kandungan gula yang tinggi pada ubi jalar dapat menyebabkan reaksi pencoklatan. Oleh karena itu pemanasan bertahap pada pemanas berputar sebelum dikeringkan ke cabinet dryer dilakukan untuk mengurangi reaksi pencoklatan.
Keunikan tepung ubi jalar adalah warnanya produk yang beraneka ragam, mengikuti warna daging umbi bahan bakunya. Proses yang tepat dapat menghasilkan tepung dengan warna yang sesuai warna umbi bahannya. Sebaliknya proses yang kurang tepat akan menurunkan mutu tepung, sebagian besar tepung ubi jalar adalah pati ( Antarlina dan Utomo, 1999).
C. Pati
tersebut. Struktur granula pati berbentuk sedemikian rupa sehingga terlihat melingkar. Bentuk granula pati dapat dilihat pada Gambar.1.
Pati adalah salah satu bahan penyusun yang paling banyak terdapat di alam, yang merupakan karbohidrat cadangan pangan pada tanaman. Sebagian besar pati di simpan dalam umbi (ubi kayu, ubi jalar, kentang, dll), biji (jagung, padi, gandum), batang (sagu) dan buah. Pati merupakan suatu karbohidrat yang tersusun atas atom-atom karbon, hidrogen dan oksigen dengan perbandingan : 6:10:5 (C6H10O5)n. Pati merupakan polimer kondensasi dari suatu glukosa yang tersusun dari unit-unit anhidroglukosa. Unit-unit glukosa terikat satu dengan lainnya melalui C1 Oksigen yang dikenal sebagai ikatan glikosida (Swinkels, 1985).
16
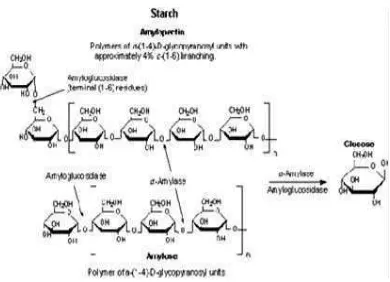
Pati banyak digunakan di dalam industri makanan, dan keberadaannya sangat penting dalam suatu struktur zat pangan. Pati merupakan jenis karbohidrat yang terutama dihasilkan oleh tanaman. Pati tersusun dari dua makromolekul polisakarida, yaitu amilosa dan amilopektin, yang keduanya tersimpan dalam bentuk butiran yang disebut granula pati. Amilosa tersusun dari molekul-molekul glukosa yang diikat dengan ikatan glikosidik α-1,4 yang membentuk struktur linear, sedangkan amilopektin di samping disusun oleh struktur utama linear juga memiliki struktur yang bercabang-cabang, di mana titik-titik percabangannya diikat dengan ikatan glikosidik α -1,6. Amilopektin memiliki struktur molekul yang lebih besar dibanding amilosa dan umumnya kandungannya di dalam granula pati lebih banyak dibanding amilosa. Kandungan amilosa dan amilopektin dan struktur granula pati berbeda-beda pada berbagai jenis sumber pati menyebabkan perbedaan sifat fungsional pati, seperti kemampuan membentuk gel dan kekentalannya (Whistler dan Daniel, 1984). Struktur kimia amilosa dan amilopektin dapat dilihat pada Gambar.2.
Pati merupakan homopolimer glukosa dengan ikatan glikosidik. Pati disusun oleh unit D-glukopiranosa. Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Pati lebih banyak berstruktur amilopektin, yaitu 80-90%, sedangkan sisanya 10% - 20% merupakan pola amilosa. Kedua tipe tersebut dapat dipisahkan, yaitu dengan melarutkannya ke dalam air mendidih, amilosa akan mengendap sedangkan amilopektin membentuk koloid yang kalau dibiarkan akan menarik air dan terbentuk pasta (Hawab, 2004). Fraksi terlarut disebut amilosa
Gambar.2. Struktur amilosa dan amilopektin Sumber : Taggart (2000)
18
1. Pati Ubi Jalar Ungu
Secara alami pati merupakan butiran-butiran kecil yang disebut granula. Pati dalam jaringan tanaman mempunyai bentuk granula (butiran) yang berbeda-beda. Penampakan mikroskopik dari granula pati seperti bentuk, ukuran, keseragaman, yang berbeda-beda bersifat khas untuk setiap jenis pati (Liu, 2005). Ukuran granula pati bervariasi dari 2-100 µm dan dapat berbentuk oval, bulat, atau tidak teratur. Bentuk dan ukuran granula tidak tergantung pada kandungan amilosa. Granula pati ubi jalar berdiameter 2-25 μ m. Granula pati ubi jalar berbentuk poligonal dengan kandungan amilosa dan amilopektin berturut-turut adalah 20 % dan 80 % (Swinkels, 1985). Pati ubi jalar memiliki viskositas dan karakteristik lain diantara pati kentang dan pati jagung atau pati tapioka. Bentuk granula pati ubi jalar dan beberapa pati lainnya dapat dilihat pada Gambar.3.
Kandungan pati dipengaruhi oleh umur tanaman dan lama penyimpanan setelah panen. Umur optimal ubi jalar tercapai apabila kandungan patinya maksimum dan kandungan seratnya rendah. Oleh karena itu, apabila dikehendaki kandungan patinya maksimum, ubi jalar hasil panen sebaiknya segera diolah dan tidak dilakukan penyimpanan. Toleransi penyimpanan setelah panen dapat dilakukan hingga maksimum tujuh hari (Antarlina dan Utomo, 1999). Komponen kimia yang terkandung di dalam pati ubi jalar dan beberapa jenis pati lain dapat dilihat pada Tabel. 3.
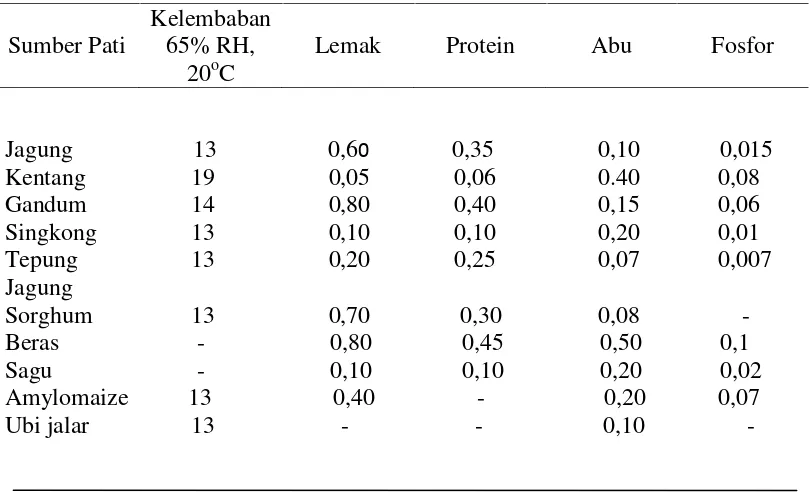
Tabel. 3. Kandungan komponen kimia beberapa jenis granula pati
Jagung 13 0,60 0,35 0,10 0,015
Kadar pati di dalam ubi jalar segar sekitar 20% (Santosa et al.,1997). Kualitas pati dan tepung ubi jalar tidak terlepas dari bahan baku yang bermutu termasuk ukuran
Sumber Pati
Kelembaban 65% RH,
20oC
20
umbi. Untuk tujuan konsumsi langsung, ukuran umbi yang diperlukan mempunyai bobot 100 - 200 g per umbi (sedang sampai besar), sementara untuk tujuan industri diperlukan umbi berukuran di atas 200 g per umbi. Umbi segar ubi jalar dari varietas yang berbeda dapat menghasilkan karakteristik pasta pati yang berbeda yang mempengaruhi mutu produk turunannya. Modifikasi pati dapat dilakukan secara kimia, enzimatis dan fisik. Salah satu modifikasi secara fisik yaitu dengan cara gelatinisasi parsial.
1. Gelatinisasi Parsial
Pati alami memiliki karakteristik yang kurang disukai oleh konsumen seperti mudah mengalami sineresis (pemisahan air dari struktur gelnya) dan tidak tahan pada pemanasan suhu tinggi, sehingga tidak flesibel dalam penggunaannya. Pati alami juga tidak larut dalam air yang bersuhu dingin serta tidak tahan panas. Kekurangan pati alami menyebabkan perlu dilakukan modifikasi pati terhadap struktur patinya. Tuntutan ini dipenuhi dengan memodifikasi pati asli dengan kimia, fisik, dan metode enzimatik. Menurut Glicksman (1969), pati termodifikasi adalah pati diberi perlakuan tertentu terhadap pati yang bertujuan untuk menghasilkan sifat yang lebih baik untuk memperbaiki sifat sebelumnya atau untuk mengubah beberapa sifat lainnya.
pemotongan ikatan α-1,4-glukosidik pada amilosa dan α-1,6-D-glukosidik dari amilopektin, sehingga amilopektin menjadi lebih sederhana dan meningkatkan kecenderungan pasta untuk membentuk gel. Modifikasi pati sering dilakukan oleh beberapa industri untuk memperbaiki kualitas dari produk yang menggunakan pati sebagai bahan dasarnya, dapat memperluas penggunaannya dalam proses pengolahan pangan serta menghasilkan karakteristik produk pangan yang diinginkan.
Modifikasi pati secara fisik dapat dilakukan melalui beberapa cara, antara lain pengeringan, ekstrusi, pemanasan, pendinginan, pemasakan maupun perlakuan fisik lainnya. Salah satu metode untuk memperbaiki karakteristik pati secara fisik adalah dengan proses gelatinisasi parsial. Proses gelatinisasi parsial dapat dilakukan dengan cara pemanasan dengan kebutuhan air yang terbatas (Chung et al., 2006). Menurut Hidayat et al. (2009), gelatinisasi pati secara fisik dapat memperbaiki kerakteristik pati yang dihasilkan yaitu kelarutan tepung, sweling power. Proses gelatinisasi parsial adalah proses modifikasi pati secara fisik menggunakan metode pemanasan pada suhu di atas titik gelatinisasi pati (Kearsley dan Dziedzic, 1995)
22
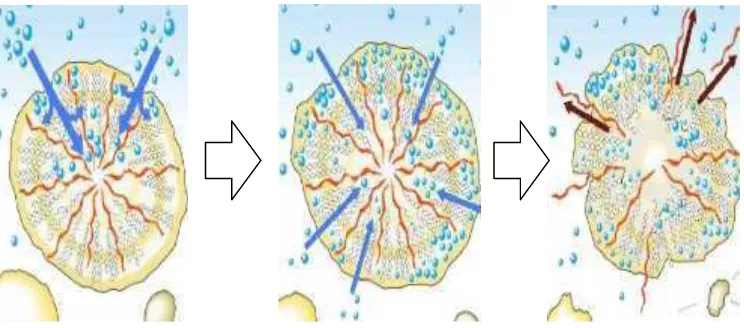
pembengkakan granula pati. Ukuran granula akan meningkat sampai batas tertentu sebelum akhirnya granula pati tersebut pecah. Pecahnya granula menyebabkan bagian amilosa dan amilopektin berdifusi keluar. Proses masuknya air ke dalam pati yang menyebabkan granula mengembang dan akhirnya pecah. Proses gelatinisasi dapat dilihat pada Gambar.4.
Gambar.4. Skema pati tergelatinisasi (Endrika, 2012)
Menurut Brooker et al. (1972), pengeringan adalah proses pindah panas dari udara
pengering ke bahan dan penguapan kandungan air dari bahan ke udara pengering
secara simultan. Pindah panas dapat berlangsung dengan cara konveksi, konduksi,
dan radiasi. Ada dua cara pengeringan yang biasa digunakan pada bahan pangan
yaitu pengeringan dengan penjemuran dan pengeringan dengan alat pengering.
Kandungan air bahan dikurangi sampai batas tertentu sehingga perkembangan mikroorganisme dan kegiatan enzim yang dapat menyebabkan pembusukan terhambat atau terhenti. Pengeringan dapat dilakukan secara alami dengan sinar matahari dan dengan menggunakan mesin pemanas.
D. Pemanas Berputar
24
Pemanasan berputar pada prinsipnya merubah struktur pati, menjadi polimer yang lebih pendek rantainya dan meningkatkan amilopektin berantai pendek dalam proporsi yang lebih banyak. Selama proses pemanasan, amilosa dan amilopektin yang terdapat pada bagian amorf pati akan terfragmentasi dan tergelatinisasi sebagian. Tujuan utama dari pemanasan ini adalah memecah struktur granula pati, sehingga meningkatkan daya larut (solubility) produk dan penyerapan air (water absorption) dalam air dingin pada pasta dari pati (Supprung dan Noomhorn, 2003).
E. Antosianin.
Antosianin merupakan senyawa flavonoid yang banyak ditemukan pada pangan nabati berwarna merah, ungu, merah gelap seperti pada beberapa buah, sayur, maupun umbi (Schewartz et al., 2007), yang memiliki kemampuan sebagai antioksidan. Antosianin mempunyai kapasitas sebagai antioksidan karena reaktifitasnya yang tinggi sebagai pendonor hidrogen atau elektron, dan kemampuan radikal turunan polifenol untuk menstabilkan dan mendelokalisasi elektron yang tidak berpasangan, serta kemampuannya mengkelat ion logam (terminasi reaksi Fenton)
26
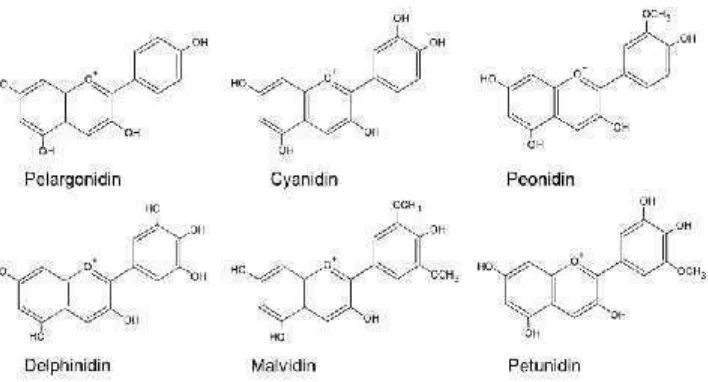
Gambar.5. Struktur kimia dasar dari antosianin Sumber : Fenema (1996)
Gambar.6.Antosianidin yang umum ada di bahan pangan Sumber : Rein (2005 )
lain seperti kubis merah, blueberries dan jagung merah (Kumalaningsih, 2006).
Beberapa industri pewarna dan minuman berkarbonat telah menggunakan ubi jalar ungu sebagai bahan mentah penghasil antosianin dan juga baik untuk mendorong kelancaran peredaran darah. (Kumalaningsih, 2006).
Kadar antosianin juga bisa menentukan warna dari tepung ubi jalar ungu. Stabilitas antosianin ini dipengaruhi adanya proses awal yaitu pencucian, pemanasan, maupun pengeringan (Patras et al., 2010). Menurut Winarno (1981) Antosianin tergolong pigmen yang disebut flavonoid yang pada umumnya larut dalam air. Sewaktu pemanasan dalam asam mineral pekat, antosianin pecah menjadi antosianin dan gula. Konsentrasi pigmen juga sangat berperan dalam menentukan warna.
1. Antioksidan
Antioksidan merupakan senyawa atau molekul yang dapat mencegah terjadinya proses oksidasi yang disebabkan oleh radikal bebas. Tubuh manusia sebenarnya dapat menghasilkan antioksidan tapi jumlahnya tidak mencukupi untuk menetralkan radikal bebas yang jumlahnya semakin menumpuk di dalam tubuh. Oleh karena itu, tubuh memerlukan antioksidan dari luar berupa makanan atau suplemen (Yanita 2011). Menurut Kumalaningsih (2006) antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya
28
Menurut Ardiansyah (2007), sumber-sumber antioksidan dapat dikelompokkan menjadi dua kelompok, yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesis reaksi kimia) dan antioksidan alami (antioksidan hasil ekstraksi bahan alami). Antioksidan alami dalam makanan dapat berasal dari (a) senyawa antioksidan yang sudah ada dari satu atau dua komponen makanan, (b) senyawa antioksidan yang terbentuk dari reaksi-reaksi selama proses pengolahan, (c) senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan ke dalam makanan sebagai bahan tambahan pangan.
Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan spesies oksigen reaktif, mampu menghambat terjadinya penyakit degeneratif serta mampu menghambat peroksidasi lipid pada makanan. Antioksidan alami umumnya mempunyai gugus hidroksi dalam struktur molekulnya (Sunarni, 2005). Senyawa antioksidan alami pada umumnya berupa vitamin C, vitamin E, karotenoid, senyawa fenolik, dan polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kuomarin, tokoferol, dan asam-asam organic polifungsional. Golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavonol, isoflavon, katekin, flavonol, dan kalkon.
Kapasitas antioksidan menggambarkan kemampuan suatu senyawa yang mengandung antioksidan untuk menghambat laju reaksi pembentukan radikal bebas. Eksplorasi bahan bahan alam terutama senyawa bioaktif yang terdapat pada tumbuh-tumbuhan dan mikroorganisme yang hidup di darat maupun di air secara terus menerus diteliti untuk mendapatkan senyawa antioksidan yang berfungsi untuk menjaga kesehatan tubuh manusia (Shahidi, 1997 ; Prakash, 2001).
30
Pengukuran aktivitas antioksidan menggunakan prinsip spektrofotometri. Senyawa DPPH (dalam metanol) berwarna ungu tua (deep violet) terdeteksi pada panjang gelombang sinar tampak sekitar 520 nm. Menurut Molyneux (2004), suatu senyawa dapat dikatakan memiliki aktivitas antioksidan apabila senyawa tersebut mampu mendonorkan atom hidrogennya untuk berikatan dengan DPPH membentuk DPP Hidrazin, ditandai dengan semakin hilangnya warna ungu (menjadi kuning pucat).
F. Tingkat Hidrolisis Pati Dengan Enzimα- Amilase
Karbohidrat dapat dibedakan menjadi karbohidrat yang dapat dicerna (digestable carbohydrate) dan karbohidrat yang tidak dapat dicerna (nondigestable carbohydrate). Karbohidrat yang dapat dicerna adalah karbohidrat yang dapat dihidrolisis oleh enzim α-amilase menjadi monosakarida di dalam sistem pencernaan manusia yang akan diserap oleh tubuh dan menyediakan energi untuk proses metabolisme. Salah satu karbohidrat yang dapat dicerna adalah pati (polisakarida). Sementara itu, karbohidrat yang tidak dapat dicerna adalah
karbohidrat yang tidak dipecah oleh enzim α-amilase yang terdapat di dalam
tubuh manusia. Serat pangan (dietary fiber) dan pati resisten (resistant starch) merupakan contoh dari karbohidrat yang tidak dapat dicerna.
Tingkat hidrolisis pati adalah tingkat kemudahan suatu jenis pati untuk dapat dihidrolisis oleh enzim pemecah pati menjadi unit-unit yang lebih sederhana. Pati murni diasumsikan dapat dicerna dengan sempurna dalam saluran pencernaan. Reaksi hidrolisa berlangsung lambat sehingga untuk mempercepat reaksi perlu menggunakan katalisator. Pada hidrolisa pati, katalisator yang biasa dipakai adalah katalis asam dan katalis enzim (Sherman, 1962). Enzim adalah zat organik yang dihasilkan oleh sel hidup baik tanaman, hewan maupun mikroorganisme. Effisiensi enzim sangat besar, satu bagian enzim amilase dapat menghidrolisis 20.000 bagian pati dan membentuk 10.000 bagian maltosa (Sherman, 1962).
Amilase merupakan enzim yang memecah pati atau glikogen, senyawa ini banyak terdapat dalam hasil tanaman dan hewan. Amilase dapat dibedakan menjadi 3 golongan enzim :
a. α- Amilase yaitu enzim yang memecah pati secara acak dari tengah atau bagian dalam molekul.
b. β- Amilase yaitu enzim yang memecah unit-unit gula dari molekul pati. c. Glukoamilase yaitu enzim yang dapat memisahkan glukosa dari terminal gula
non pereduksi substrat.
Enzim α-amylase akan memotong ikatan amilosa dengan cepat pada pati kental
32
Enzim α-amilase adalah salah satu enzim pemecah pati, Enzim α-amilase
menghidrolisis ikatan α- 1,4 glikosida baik pada amilosa maupun amilopektin secara acak. Karena pengaruh aktifitasnya, pati terputus-putus menjadi dekstrin dengan rantai sepanjang 6-10 unit glukosa. Jika waktu reaksi diperpanjang, dekstrin tersebut dapat dipotong-potong lagi menjadi campuran antara glukosa, maltosa, dan ikatan lain yang lebih panjang.
Gambar.7. Reaksi kimia hidrolisis pati menjadi glukosa
akhir secara tidak acak dan berjalan lebih lambat (Winarno, 1983). Kerja α -amilase pada molekul amilopektin akan menghasilkan glukosa dan oligosakarida
(Winarno, 1983). Dalam hidrolisa pati, α-amilase menghasilkan dekstrin yang
merupakan substrat untuk tahap selanjutnya, yaitu bagi enzim glukoamilase, sehingga dengan mudah enzim ini mengkatalisis hidrolisa untuk menghasilkan
glukosa.
Menurut Sajilata (2006) pati dikelompokkan menjadi pati yang dapat dicerna dengan cepat atau rapid digestible starch (RDS), dan pati yang memiliki daya cerna lambat atau slowly digestible starch (SDS), dan pati resisten (resistant starch atau RS). RDS merupakan fraksi pati yang menyebabkan terjadinya kenaikan glukosa darah setelah makanan masuk ke dalam saluran pencernaan, contoh RDS yaitu beras dan kentang yang telah dimasak serta beberapa sereal instan siap saji. Sedangkan SDS adalah fraksi pati yang dicerna sempurna dalam usus halus dengan kecepatan yang lebih lambat dibandingkan dengan RDS, contoh SDS adalah pati sereal, produk pasta, dan RS, yaitu pati yang sulit dicerna di dalam usus halus (Englystet al.,1992)
34
A. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Analisis Hasil Pertanian Jurusan THP Fakultas Pertanian Unila, Laboratorium Politeknik Negeri Lampung dan Laboratorium Biomassa Terpadu MIPA Unila. Penelitian dilaksanakan pada bulan September 2013 sampai bulan Desember 2013.
B. Bahan dan Alat
Bahan utama yang digunakan dalam penelitian adalah ubi jalar varietas Ayamurasaki yang diperoleh dari Balai Pelatihan Pertanian (BPP) Lampung. Bahan kimia yang digunakan antara lain : Asam sulfat pekat, asam formiat 5 %, fenol, aquades, MeOH, etanol 80 %, etanol 96 %, gas N2, larutan DPPH, fenol, asam sulfat pekat, enzim alfa amilase, alumunium foil, larutan bufer NA-Fosfat 0,1, fenol 5 % dan Larutan DPPH.
Peralatan yang digunakan dalam penelitian adalah pisau, pemarut, ayakan standar Tyler 80 mesh, alat penepung tipeHummer Mill, pemanas berputar, oven cabinet
36
dryer, spektrofotometer merk HACH, centrifuge (Thermo electron corporation), termometer, beaker glass (pyrex), kuvet,waterbath, vortek, Scanning Electron Microscope (SEM) (model EVO MA 10 Cambridge UK), neraca analitik, labu ukur, baki, Erlenmeyer (pyrex), pipet ukur, pipet tetes, Spectronic 200 (Thermoscientific),shaker water bath, lemari es dan mikro pipet.
C. Metode Penelitian
D. Pelaksanaan Penelitian
1. Pembuatan tepung ubi jalar ungu termodifikasi
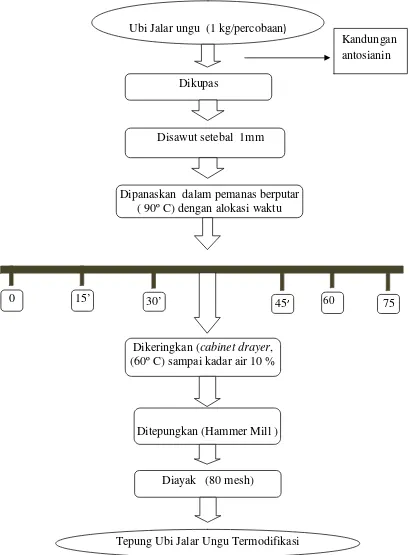
Pembuatan tepung ubi jalar ungu termodifikasi secara fisik melalui pemanasan dalam pemanas berputar dilakukan melalui tahapan sebagai berikut : untuk setiap satu satuan percobaan, satu kilogram ubi jalar ungu yang telah disortasi dan dikupas dicuci sampai bersih dan ditiriskan. Kemudian ubi disawut dan dilanjutkan dengan proses pemanasan menggunakan pemanas berputar pada suhu 90oC selama 0, 15, 30,45, 60 dan 75 menit. Setelah pemanasan, sampel dikeluarkan dan dikeringkan dalam cabinet drayerpada suhu 60oC sampai kadar air mencapai 10%. Penepungan dilakukan setelah sampel dingin (sesuai suhu ruang) menggunakan Hummer mill, dan diayak menggunakan ayakan dengan ukuran 80 mesh (Hidayat et al., 2009 yang dimodifikasi pada lama pemanasan dan alat yang digunakan). Diagram alir proses pembuatan tepung ubi jalar ungu termodifikasi dapat dilihat pada Gambar.8.
38
Gambar.8. Diagram alir proses pembuatan tepung ubi jalar termodifikasi Sumber : Hidayat et al. (2009) yang dimodifikasi
0 15’ 30’ 60
Ubi Jalar ungu (1 kg/percobaan)
Dikupas
Dipanaskan dalam pemanas berputar ( 90º C) dengan alokasi waktu
Dikeringkan (cabinet drayer, (60º C) sampai kadar air 10 %
Ditepungkan (Hammer Mill )
Tepung Ubi Jalar Ungu Termodifikasi Diayak (80 mesh)
Disawut setebal 1mm
Kandungan antosianin
E. Pengamatan
Pengamatan terhadap tepung ubi jalar ungu termodifikasi yang dihasilkan meliputi penampakan granula pati, kandungan antosianin, kapasitas antioksidan, dan tingkat hidrolisis enzimatis
1. Penampakan Granula Pati
Penampakan mikroskopis granula tepung ubi jalar diamati dengan menggunakan Scaning Electron Microscope (SEM) model EVO MA 10 dengan cara sebagai berikut:
Sample seberat 0,1 g pada specimen holder distage, kemudian tutupchamberdan tekanpumppadadocking panel vacuum dan tekanan dalamchamber< 1,10 mbar. Pilih docking panel gun dan beam state = on, tunggu hingga electron Gun menyala full dengan ditandai V pada gun. Proses mendapatkan Gambar menggunakan Prinsip SE (Secondary Electron), dipilih pembesaran yang diinginkan ( 500 x, 2000 x )
2. Kandungan Antosianin
40
Ekstraksi antosianin
Sebanyak 100 g sampel tepung diekstrak dengan 500 mL ethanol 96% . Sampel diinkubasi selama 24 jam pada 40° C dalam penangas air bergoyang (shaker water bath) kemudian disentrifugasi (3000 rpm, 10 menit, 4º C) . Sebanyak 2 ml larutan supernatan diambil dari sampel yang telah disentrifugasi, ditambah larutan etanol-1,5N HCL (85:15) hingga volume menjadi 100 ml. Larutan ini kemudian dibaca absorbansinya pada panjang gelombang 535 nm menggunakan Spectronic 200 (Thermoscientific). Kemudian antosianin dihitung menggunakan rumus :
Nilai 98,2 adalah
E
1cm% 535 ,1 , sedangkan factor pengenceran adalah 5/2 x 100
3. Kapasitas Antioksidan
Pengujian kapasitas dilakukan menggunakan metode DPPH menurut Molyneux (2004 ).
Faktor pengenceran X nilai absorbansi Total antosianin (%) =
a. Penentuan Absorbansi Kontrol
Larutan DPPH dengan konsentrasi 0,07M dalam etanol 96 % diambil 10 ml, kemudian diinkubasi pada suhu 37º C selama 30 menit. Setelah itu diukur absobansinya pada panjang gelombang 517 nm.
b. Penentuan Absorbansi Sampel
Tepung ubi jalar ungu ditimbang sebanyak 3 g ditambah 15 ml etanol 80% kemudian di vortek larutan didiamkan selama 15 menit, setelah 15 menit ambil cairan simpan (larutan A). Padatan ditambah 10 ml etanol 80 % kemudian divortek didiamkan selama 15 menit ambil cairan (larutan B). Gabungkan larutan A dan B menjadi larutan sampel kemudian divortek. Masing-masing sampel disentrifius dengan kecepatan 3500 rpm selama 15 menit. Setelah terpisah sampel cair dengan padatan diambil sampel cair sebanyak 7,5 ml dan ditambahkan larutan DPPH 0,07 mm dalam etanol 96 % v/v sebanyak 2,5 ml. Setelah itu diinkubasi pada suhu 37º C selama 30 menit, kemudian dimasukan kedalam kuvet untuk diukur absorbansinya pada panjang gelombang 517 nm. Diagram alir pembuatan dan pengukuran eksrak antosianin dapat dilihat pada Gambar. 5. Nilai % aktivitas antioksidan diperoleh dengan rumus. sebagai berikut :
Keterangan :
Ak = Absorbansi Kontrol As = Absorbansi Sampel (Ak-As)
42
Gambar.9. Diagram Alir pengukuran kapasitas antioksidan Tepung ubi jalar sebanyak 3 gr
Tambahkan etanol 80% 15 mL
Divortek selama 1 menit
Diamkan selama 15 menit di dalam lemari es
Divortek selama 1 menit Tambahkan etanol 80% 10 mL
Cairan (A) Padatan
Diamkan selama 15 menit di dalam lemari es
Ambil cairan
Disentrifugasi (3500 rpm selama 15 menit)
Cairan (B) Campurkan cairan
(A) dan(B)
Larutan Sampel
Tambahkan larutan DPPH sebanyak 2,5 mL
Inkubasi (T: 37oC, 30 menit) Ambil larutan sampel sebanyak 7,5 mL
4. Tingkat Hidrolisis Dengan Enzimα-Amilase
Penentuan tingkat hidrolisis pati dengan enzim α amilase dilakukan dengan cara pembuatan kurva standar yang dibuat untuk mendapatkan nilai regresinya. Penentuan tingkat hidrolisis enzymatis berdasakan kurva standar glukosa. Setelah didapatkan regresi dari kurva standar, sampel yang dianalisa dengan cara yang sama dengan kurva standar didapat nilai absorbansi yang kemudian diplotkan pada kurva standar.
Pengujian daya cerna pati dilakukan dengan metode invitro, yang ditentukan berdasarkan jumlah pati yang dapat dihidrolisis oleh enzim α- amilase menjadi gula-gula sederhana (glukosa dan maltosa) dan α- limit dekstrin. Semakin tinggi daya cerna suatu pati berarti semakin banyak pati yang dapat dihidrolisis dalam waktu tertentu yang ditunjukkan oleh semakin banyak glukosa dan maltosa yang dihasilkan yang diukur dengan spektrofotometer. Daya cerna pati sampel dihitung relatif terhadap pati murni (soluble starch).
44
selanjutkan diencerkan dan ukur absorbansi pada 520 nm. Penugujian daya cerna enzimatis metode invitro dapat dilihat pada Gambar. 10.
Gambar.10. Prosedur pengujian daya cerna enzimatis metode invitro Sumber : Dubois et al., (1956)
Suspensi 1% tepung (1 gr/100 mL air destilasi)
Dipanaskan hingga 90oC selama 30 menit (sambil diaduk dan ditutup aluminium foil)
Dinginkan segera setelah mencapai suhu 90oC
Ambil sebanyak 2 mL larutan tepung + 2 mL air + 5 mL larutan buffer NA-Fosfat 0,1 pH 7
Diinkubasi pada suhu 37oC selama 15 menit
Tambahkan enzim α-Amilase sebanyak 0,05 mL
Diinkubasi pada suhu 30oC selama 15 menit
Dipanaskan di dalam air mendidih selama 5 menit
Didinginkan dengan air mengalir
Ambil sebanyak 1 mL larutan + 5 mL asam sulfat + 1 mL fenol 5%
Diinkubasi pada suhu 30oC selama 20 menit
Diencerkan
Diukur absorbansinya dengan panjang gelombang 520 nm
Pembuatan kurva standar glukosa
Glukosa sebanyak 0,01 g di larutkan dengan air destilasi 100 ml kemudian buat larutan standar dengan konsentrasi yang berbeda (10, 20, 30, 40, 50 dan 60 ml), Ambil 1 ml masing –masing larutan ditambah 5 ml asam sulfat pekat dan fenol 5 % 1 ml. Larutan diinkubasi pada suhu 30 º C selama 20 menit kemudian larutan diencerkan sebanyak 5 kali. Absorbansi diukur pada gelombang 520.
Jumlah glukosa ditentukan berdasarkan OD larutan contoh dan kurva standar dapat dihitung berdasarkan rumus :
Keterangan :
A = Glukosa yang diperoleh dari kurva standar B = Volume sampel (ml).
A
1
A. Kesimpulan
Berdasarkan hasil penelitian kesimpulan yang dapat diambil adalah :
1. Perlakuan pemanasan memberikan pengaruh terhadap penampakan granula pati, tingkat hidrolisis enzimatis dan kandungan antosianin, tetapi tidak berpengaruh nyata terhadap kapasitas antioksidan.
2. Perlakuan lama pemanasan yang terbaik untuk mempertahankan kandungan antosianin adalah lama pemanasan 30 menit yang menghasilkan kadar antosianin sebesar 66,24 %.
B. Saran
Penelitian lanjutan, aplikasi penggunaan tepung ubi jalar ungu termodifikasi dalam pembuatan rerotian atau mie, karena selain mengurangi ketergantungan terhadap tepung terigu juga kaya antosianin.
DAFTAR PUSTAKA
Amarowicz, R., Naczk, M., and Shalhidi, F. 2000. Antioxidant Activity of Crude Tannins of Canola and Rapeseed Hulls. JAOCS77 :957-961.
Antarlina dan Utomo. 1999. Proses Pembuatan dan Pengembangan Tepung Ubi Jalar untuk Produk Pangan. Edisi Khusus Balitkabi No. 15. Balai Penelitian Tanaman Kacang-Kacangan dan Umbi-Umbian. Malang. Ardiansyah. 2007. Antioksidan dan Peranannya bagi Kesehatan. www.
chaptereislamicspace.wordpress.com/2007/01/24/antioksidan dan peranannya bagi-kesehatan/-32k. Diakses pada tanggal 29 Pebruari 2014. Astawan. M, dan S. Widowati. 2005. Evaluasi Mutu Gizi dan Indeks Glikemik
Ubi Jalar Sebagai Dasar Pengembangan Pangan Fungsional. Laporan Hasil Penelitian Rusnas Diversifikasi Pangan Pokok. IPB. Bogor.
Badan Pusat Statisik. 2013. Tabel. Luas Panen Produktifitas Produksi Tanaman Ubi Jalar Seluruh Provinsi. http://www.bps.go.id/tnm pgn/. Diakses pada tanggal 13 Pebruari 2014.
Beynum, G.M.A.V., and J.A. Roels. 1985. Starch Conversion Technology. Marcel Dekker. New York.
Bradbury, J.H. and W.D. Holloway. 1988. Chemistry of Tropical Root Crops: Significance for Nutrition and Agriculture in the Pasific. ACIAR Monograph Seri No. 6. Canberra.
Brooker, D. B., F. W. Arkema, and , C. W. Hall. 1972. Drying and Storage of Grainsand Oil Seeds. Van Nostrand Reinholl. New York.
Centro Internacional de la Papa. 2011. Sweet Potato. http://www.cipotato.org/sweetpotato/). Diakses pada tanggal 06 Maret 2014.
66
Direktorat Jendral Tanaman Pangan. 2014. Budidaya Aneka Kacang dan Umbi. http://www.tanamanpangan.deptan.go.id/akabi. Diakses pada tanggal 29 Februari 2014.
Dubois, M., K.A, Gilles, J.K, J.K, Hamilton Rebers, P.A and Smith F. 1956. Colorimetric Method For Determination of Sugar and Related Substances. Analytical Chemistry28 (3):350-356.
Eliasson, A. C. 2004. Starch in Food. Woodhead Publishing Limited. Cambridge. England.
Endrika, W. 2012. Modifikasi Pati. Universitas Brawijaya. Malang.
Englyst HN, SM. Kingman, Cummings JH. 1992. Klasifikasi dan Pengukuran Fraksi Pati. Journal Clinical Nutrition 46: 533-550.
Fellows, P.J. 2009. Food Processing Technology - Principle and Practice (3rd Eds). Woodhead Publishing Limited. Cambridge. England.
Fennema, O.R. 1996. Food Chemistry (Third Edition). Marcel Dekker. Inc. New York.
Ferlina. S. 2009. Khasiat Ubi Jalar Ungu. http://www.khasiatku.com/ubi-jalar ungu/. Diakses pada tanggal 08 Maret 2014.
Francis , F.J. 1982. Analysis of Anthocyanins . In Anthocyanins As Food Colors. Pericles Markakis. (Ed) ISBN: 978-0-12-472550-8. Academic Press. New York. Pp. 181-207
Glicksman, M. 1969. Gum Technology in The Food Industry. Academic Press. New York.
Greenwood, C.T. 1979. Observation on The Structure of The Starch Granules. In. Blanshard, M.A. and Mitchell, J.R., 1992. Polysaccharides in Food. Butterworth Published. Inc. Boston USA.
Hagiwara,A. H. Yosindo, T. Icihara, M. Kawabe, S. Tamano, H. Aoki, T. Koda, M. Nakamura, K. Imaida, N. Ito dan T. Shira. 2002. Prevention by Natural Food Anthocyanins, Purple Sweet Potato Color and Red Cabbage Color of 2-amino-1-methyl-6-pheniylimidazo (4,5-b) pyridene( Phip)-associated colorectal carcinogenesis in rats initiated with 1,2 dimethylhydrazine. Journal ofToxicologial Sciences27 (1): 57–68. Hawab, H. M. 2004. Biokimia.Andi Press. Jakarta.:
Hernanto, J. 2014. Sifat Fisikokimia Tepung Ubi Jalar Ungu Termodifikasi Secara Fisik pada Berbagai Lama Pemanasan (Skripsi). Jurusan Teknologi Hasil Pertanian Fakultas Pertanian. Universitas Lampung. Bandar Lampung.
Hidayat, B., N. Kalsum, dan Surfiana. 2009. Perbaikan Karakteristik Tepung Ubi Kayu Menggunakan Metode Pragelatinisasi Parsial. Jurnal Teknologi Industri dan Hasil Pertanian.14 (2) : 148–159.
Hutchings, John B. 1999. Food Color and Appearance 2nd Edition. A Chapman and Hall Food Science Book. Aspen Publication. Inc. Gaithersburg. Maryland.
Iversen, C.K. 1999. Black Currant Nectar: Effect of Processing and Storage on Anthocyanin and Ascorbic Acid Content. Journal of Food Science, 64 (1):37-41.
Jiao, Y., Y. Jiang, W. Zhai and Yang. 2012. Studies on Antioxidant Capacity of Anthocyanin Extract from Purple Sweet Potato (Ipomea Batatas L.). African Journal of Biotechnology11 (27) : 7046 -7054.
Juanda, D.J. dan B. Cahyono. 2009. Ubi Jalar: Budidaya dan Analisis Usaha Tani. Penerbit Kanisius. Yogyakarta.
Kadarisman, D., dan A. Sulaeman. 1993. Teknologi Pengolahan Ubi Kayu dan Ubi Jalar. PAU Pangan dan Gizi, IPB. Bogor.
Kano, M., T. Takayanagi, K. Harada, K. Makino, and F. Ishikawa. 2005. Antioxidativeactivity of anthocyanins from purple Sweet potato,Ipomoea batatas cultivar Ayamurasaki. Bioscience, Biotechnology and Biochemistry. 69(5): 979–988.
Karyadi, E. 2006. Antioksidan, Resep Sehat dan Umur Panjang. http://www gizi.net/cgi-bin/berita/fullnews?. Diakses pada tanggal 29 Pebruari 2014. Kearsley, M.W., and N.A. Dziedzic. 1995. Handbook of Starsch Hydrolysis
68
Kumalaningsih, S. 2006. Antioksidan Alami. Trubus Agrisarana. Surabaya. Kumaran, A. And R. J. Karunakaran. 2006. Antioxidant and Free Radical
Scavenging Activity of Aqueous Extract of Coleus Aromaticus. Journal. Food Science, 97, 109-114.
Kusnandar, F. 2010. Kimia Pangan Komponen Makro. PT Dian Rakyat. Jakarta.
Lestari, L.A., Soesatyo, M.H.N.E, Iravati, S and E. Harmayani. 2013. Characterization of Bestak Sweet Potato ( Ipomea batatas) Variety From Indonesia Origin an Prebiotic. International Food Research Jornal20 (5): 2241-2245.
Liu, Z., L. Peng, and J.F. Kennedy. 2005. The Technology of Molecular Manipulation and Modification. Asisted by microwaves as Applied to Starch Granules.Carbohydrate Polymers,61: 374−378.
Maccarone, E.A, and P. Rapisarda. 1985. Stabilization of Anthocyanins of Blood Orange Fruit Juice. Jurnal of Food Science,50: 901–904.
Molyneux, P. 2004. The use of The Stable Free Radical Diphenylpicrilhydrazyl (DPPH), for Estimating Antioxidant Activity. Songklanakarin Journal Science. Technology. 26(2):211–219.
Montilla, E.C., S. Hillebrand, and P. Winterhalter. 2011. Anthocyanins in Purple Sweet Potato (Ipomoea batatas L.) Varieties . Fruit, Vegetable and Cereal Science and Biotechnology. 5 (2):19-24
Murtiningsih dan Suyanti. 2011. Membuat Tepung Umbi dan Variasi Olahannya. Agromedia Pustaka. Jakarta.
Okos, M.R. G. Narsimhan, R.K. Singh and A. C. Weitnauer. 1992. Food
Dehydration. In : Handbook of Food Engineering. D.R. Heldman and D.B. Lund (ed). Marcel Dekker. Inc. New York.
Patras, A., N.P. Brunton, C. O’Donell and B.K. Tiwari. 2010. Effect of Thermal Processing on Anthocyanin Stability in Foods; Mechanisme and Kinetics of Degradation. Trends in Food Science and Tecnology21 : 3–11.
Paul, P.C. and H.H. Palmer. 1975. Food Theory and Application. Jhon Wiley and Sons. Inc. New York. 797 pp.
Pomeranz, Y. 1991. Functional Properties of Food Components. Academic Press Inc. San Diego. California.
Prakash, A. 2001. Antioxidant activity. Medallion Laboratories : Analytical Progres 19 ( 2): 1–4.
Pranoto, Y., Haryadi dan S.K. Rakshit. 2009. Karakterisasi Pati Ubi Jalar Varietas Tipikal lndonesia dan Modifikasi Sifat Reologisnya dengan Heat-Moisture Treatment (HMT) untuk Pembuatan Rerotian. Laporan Akhir Hasil Penelitian Hibah Pekerti (Tahun Kedua). Universitas Gajah Mada. Yogyakarta.
Rapaille, A., and J. Vanhelmerijk. 1994. Modified Starches. In: Imeson, A . (Ed). Thickening and gelling agents for food. Chapman and Hall. London.
Rein, M. 2005. Copigmentation Reactions and Color Stability of Berry Anthocyanin (Academic Dissertation). Helsinki: University of Heslinki.
Rhim, J.W. 2002. Kinetics of Thermal Degradation of Antochyanin Pigment Solution Driven from Red Flower Cabbage. Food Science and Biotechnology11:361-364.
Richana, N., dan Widaningrum. 2009. Penggunaan Tepung dan Pasta dari Beberapa Varietas Ubi Jalar Sebagai Bahan Baku Pembuatan Mie. Jurnal Pasca Panen6 (1) : 43–53.
Richana, N. 2012. Ubi Kayu dan Ubi Jalar. Nuansa. Bandung. 124 halaman. Rukmana, R. 1997. Budidaya dan Pasca Panen Ubi Jalar. Kanisius.
Yogyakarta.
Sajilata MG, Rekha S.S, RK. Kushpa. 2006. Resistant Starch- A Review. Comprehensive Reviews in Food Science and Food Safety, 5: Chicago: Institute of Food Technology.
Samsudin, A.M. dan Khoirudin. 2009. Ekstraksi Filtrasi Membran dan Uji Stabilitas Zat Warna dari Kulit Manggis (Garcinia mangostana). Jurnal Teknik Kimia. Fakultas Teknik. Universitas Diponegoro. Semarang. Pp 1-8.
Santosa, B.A., Narta dan S. Widowati. 1997. Studi Karakteristik Pati Ubi Jalar. Prosiding Seminar Nasional PATPI,16-17 Juli, Denpasar, Bali.
70
Schewartz, S.J., J. H.von Elbe, and M.M. Giusti. 2007. Colorants. In Fennema’s Food Chemistry. Fourth Ed. Edited by Srinivasan Damodaran, K.L. Parkin, and O.R. Fennema. CRC Press. Boca Raton. FL. Pp. 571-638. Shahidi, F. 1997. Natural Antioksidants. Departemnt of Biochemistry Memorial
University of Newfounland St. Jhon’s, Newfoundland. AOCS Press. Canada.
Sherman, H..C. 1962. Chemistry of Food and Nutrition.8thEd. The Macmillan company. New York
Suda, I., T. Oki, M. Masuda, M. Kobayashi, Y. Nishiba, and S. Furuta. 2003) Physiological Functionally of Purple-Fleshed Sweet Potatoes Containing Anthocyanins and Their Utilization in Foods. Japan Agricultural ResearchQuarterly. 37(3):167–173.
Sunarni,T. 2005. Aktivitas Antioksidan Penangkap Radikal Bebas Beberapa Kecambah dari Biji Tanaman Familia Papilionaceae. Jurnal Farmasi Indonesia2 (2): 53-61.
Supprung. P. and A. Noomhorm. 2003. Optimization of Drum Drying Parameters For Low Amylose Rice (KDML105) Starch and Flour. Drying Technology. 21(9): 1781-1795.
Suprapti. 2009. Tepung Ubi Jalar, Pembuatan dan Pemanfaatanya. Kanisius. Yogjakarta. 56 halaman.
Surfiana. S, Nurdjanah dan V, Liana. 2013. Produksi Dekstrin dari Tapioka Melalui Gelatinisasi Sebagian Menggunakan Rotary Drum. Jurnal Teknologi dan Industri Pertanian.18 (1):28-40.
Swinkels, J.J.M. 1985. Source of Starch, its Chemistry and Physics. In : G.M.A.V. Beynum dan J.A Roels (eds.). Starch Conversion Technology. Marcel Dekker. Inc. New York.
Taggart, P. 2000. Starch as an Ingridient : Manufacture and Applications. In: A.C.Eliasson (ed). Starch In Foods. Structure, Function and Applications. CRC Press LLC. USA.
Takashi. M and S, Takayumi. 1997. Antioxidant Activities of Natural Compound Found in Plants. Journal Agricultur Food Chemical45: 1819-1822. Tantituvanont A, Werawatganone P, Jiamchaisri P, Manopakdee K. 2008.
Preparation and Stability of Butterfly Pea Color Extract Loaded in Microparticles Prepared by Spray Drying. Thai J. Pharm. Sci.,32:59-69. Terahara, N., and T. Matsui. 2008. Structures and Functionalities of Acylated
Terahara, N., I. Konczak, H Ono, M. Yoshimoto, and O Yamakawa. 2004. Characterization of Acylated Anthocyanins in Callus Induced from Storage Root of Purple Sweet Potato (Ipomea batatas L.). Jurnal Biomed Biotechnology.5 : 279 - 286.
Truong ,V.D, R.F. Mc Feeters , R.T. Thompson , L.L. Dean, and B. Shofran . 2007. Phenolic Acid Content and Composition in Leaves and Roots of Common Commercial Sweet potato (Ipomea batatas L.) Cultivars in the United States. Journal of Food Science. 72(6):C 343-349.
Villareal. R.J., and T.D. Griggs. 1982. Sweet Potato Procesing. The International Symposium AVRDC. Philipines.
Whistler, R.L. and J.R. Daniel. Carbohydrates. 1984. In. O.R. (Ed).Food Chemistry. 2nd Edition. Marcel Dekker. Inc. New York.
Wholfe, J. A. 1993. Post Harvest Procedures: II. Processing. In Sweet Potato – an Untapped Food Source. Cambridge: UK University Press.
Widjanarko. 2008. Efek Pengolahan Terhadap Komposisi dan Fisik Ubi Jalar Ungu dan Kuning. http://simonbwidjanarko.wordpress.com/ 2008/06/19/ efek-pengolahan-terhadap-komposisi-kimia-fisik-ubi-jalar-ungu-dan-kuning/. Diakses pada tanggal 2 Maret 2014.
Widodo, Y. 1989. Prospek dan Strategi Pengembangan Ubi Jalar Sebagai Sumber Devisa. Jurnal Penelitian dan Pengembangan Pertanian 8 (4): 83-88.
Wijaya, L.S. 2001. Ekstraksi dan Karakterisasi Pigmen Dari Kulit Buah Rambuatan (Nephelium lappaceum) var Binjai.). Biosam.
Winarno, F.G dan W.M. Aman, 1981. Fisiologi Lepas Panen. Sastra Hudaya, Jakarta.
Winarno, F.G. 1983. Enzym Pangan. Gramedia Pustaka Utama. Jakarta.
Winarno, F.G. 2004. Kimia Pangan dan Gizi. Gramedia Pustaka Utama. Jakarta Yadav, A.R., S. Mahadevamma, R.N. Tharanatha, and R.S. Ramteke. 2007. Characteristics of Acetylated and Enzyme- Modified Potato and Sweet Potato Flours. Food Chemistry. 103:1119–1126.
Yamakawa. 1998. Radical Scavenging Activities of Sweet Potato Cultivar with Purple Flesh. Tokyo: Food Science Technology. Inc.
72
Yudiono, K. 2011. Ekstraksi Antosianin dari Ubi Jalar Ungu (Ipomoea Batatas Cv. Ayammurasaki) dengan Teknik Ekstraksi Subcritical Water. Jurnal Teknologi Pangan2 (1): 1-30.
Xu, J., And Q.Hu. 2004. Effect of Foliar Application of Selenium on the Antiokxidan Activity of Aqueous and Ethanolic Extracts of Selenium -Enriched Rice. Journal Agricultura Food Chemistry 52 : 1759-1763. Zhang. Z.F, F,Shao-Hua, Y, Lin Zheng, Jun Lu, Dong Mei Wu, Qun Shan, and