SKRIPSI
Oleh :
Bernadhita Nur Utami 20120210015
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA YOGYAKARTA
i SKRIPSI
Diajukan kepada Fakultas Pertanian Universitas Muhammadiyah Yogyakarta
sebagai syarat untuk memperoleh derajat Sarjana Pertanian
Oleh :
Bernadhita Nur Utami 20120210015
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA YOGYAKARTA
iii
1. Bapak Suparjan Sunarno Harjono dan Mamah tercinta Suwarniyati
2. Purnama Rangga Saputra, adikku satu-satunya
3. Sahabatku Siti Hanifah, Bangun Adi Purnomo, Mei Yuniati
4. Teman-teman Agroteknologi A 2012 UMY
5. Keluarga besar HIMAGRO Fakultas Pertanian UMY
6. Adik-adik tingkatku Agroteknologi angkatan 2013, 2014 dan pihak
lainnya yang tidak bisa penulis sebutkan satu per satu.
Terima kasih telah memberikan semua yang berharga untuk penulis baik
ilmu, doa, cinta, kasih sayang, semangat, pengorbanan, rasa persahabatan,
persaudaraan dan kekeluargaan, kebersamaan, kritik dan saran serta segala
dukungan secara moriil dan materiil sampai studi ini selesai, semoga penelitian ini
v
melimpahkan rahmat serta hidayah-Nya sehingga penulis dapat menyelesaikan
tugas akhir ini sebagai salah satu syarat yang diperlukan untuk pencapain gelar
Sarjana Pertanian di Universitas Muhammadiyah Yogyakarta. Skripsi yang disusun penuis ini berjudul “Pengaruh Bioaktivator Berbagai Mikroorganisme Lokal Terhadap Aktivitas Dekomposer Dan Kualitas Kompos Kulit Kakao“ .
Penulis menyadari bahwa dalam penyusunan proposal, pelaksanaan
penelitian sampai terselesaikannya penyusunan skripsi ini tidak dapat lepas dari
bantuan banyak pihak, untuk itu penulis menyampaikan terimakasih kepada :
1. Alloh SWT yang selalu melimpahkan kemudahan dan kelancaran atas
semua hal yang hamba kerjakan.
2. Ir. Agung Astuti, M.Si selaku Pembimbing Utama dan Dosen
Pembimbing Akademik yang dengan sabar dan teliti memberikan
bimbingan, saran, kritik dan arahan selama pelaksanaan penelitian dan
penyusunan skripsi ini.
3. Dr.Ir. Gatot Supangkat, MP selaku Dosen Pembimbing Pendamping
dan ayah yang selalu mengarahkan selama perkuliahan berlangsung
sampai penyusunan skripsi ini.
4. Ir. Mulyono, M.P. selaku Dosen Penguji dan juga pembimbing ketiga
yang selalu memberikan bimbingan dan arahan dalam penyusunan
skripsi ini.
5. Seluruh dosen dan karyawan Fakultas Pertanian Universitas
Muhammadiyah Yogyakarta, yang telah membantu mempelancar dan
memeberikan arahan kepada penulis sehingga terselesaikannya skripsi
vi
dapat dituliskan oleh penulis satu persatu yang telah membantu tenaga
maupun doa.
Semoga doa, bantuan dan bimbingan yang telah diberikan kepada penulis
mendapatkan balasan yang berlipat dari Alloh SWT. Penulis mengharapkan
skripsi ini dapat bermanfaat bagi semua pembacanya. Amin ya robbal’alamin Wassallamu’allaikum wr.wb.
Yogyakarta, 20 Desember 2016
vii
HALAMAN PENGESAHAN ... Error! Bookmark not defined.
HALAMAN PERSEMBAHAN ... iii
PERNYATAAN ... iv
KATA PENGANTAR ... v
DAFTAR ISI ... vii
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
ABSTRACT ... Error! Bookmark not defined. I. PENDAHULUAN ... Error! Bookmark not defined. A. Latar Belakang ... Error! Bookmark not defined. B. Rumusan Masalah ... Error! Bookmark not defined. C. Tujuan Penelitian ... Error! Bookmark not defined. II. TINJAUAN PUSTAKA ... Error! Bookmark not defined. A. Kulit Kakao ... Error! Bookmark not defined. B. Dekomposisi Bahan Organik ... Error! Bookmark not defined. C. Bioaktivator Mikroorganisme Lokal (MOL)Error! Bookmark not defined.
viii
ix
2. Skoring Perubahan Nilai Warna Kompos ... Error! Bookmark not defined. 3. Hasil Identifikasi Cendawan MOL Bonggol PisangError! Bookmark not defined.
4. Hasil Identifikasi Bakteri MOL Bonggol PisangError! Bookmark not defined.
5. Hasil Identifikasi Cendawan MOL Rebung BambuError! Bookmark not defined.
6. Hasil Identifikasi Bakteri MOL Bambu ... Error! Bookmark not defined. 7. Hasil Identifikasi Cendawan MOL Rumen Sapi Error! Bookmark not defined. 8. Hasil Identifikasi Bakteri MOL Rumen Sapi ... Error! Bookmark not defined. 9. Hasil Identifikasi Cendawan MOL ... Error! Bookmark not defined. 10. Hasil Identifikasi Bakteri MOL ... Error! Bookmark not defined. 11. Jumlah Bakteri Dan Cendawan Kompos Kulit Kakao Minggu Ke 4 Setelah Dilakukan Transformasi Data ... Error! Bookmark not defined. 12. Temperatur Kompos Kulit Kakao Minggu Ke 4Error! Bookmark not defined.
13. Perubahan Warna Kompos Selama Proses Dekomposisi Kulit Kakao .... Error! Bookmark not defined.
14. Tingkat Keasaman (pH) Kompos Kulit Kakao Minggu 4Error! Bookmark not defined.
15. Uji Kandungan Kompos Setelah Proses Dekomposisi Kulit Kakao ... Error! Bookmark not defined.
x
DAFTAR GAMBAR
Gambar Halaman
1. Identifikasi Cendawan pada MOL Bonggol PisangError! Bookmark not defined.
2. Identifikasi Bakteri pada MOL Bonggol Pisang Error! Bookmark not defined. 3. Identifikasi Cendawan pada MOL Bambu ... Error! Bookmark not defined. 4. Identifikasi Bakteri pada MOL Rebung Bambu Error! Bookmark not defined.
5. Identifikasi Cendawan pada MOL Rumen Sapi Error! Bookmark not defined.
6. Identifikasi Bakteri pada MOL Rumen Sapi ... Error! Bookmark not defined. 7. Pertumbuhan Cendawan selama Dekomposisi .. Error! Bookmark not defined. 8. Pertumbuhan Bakteri selama Dekomposisi ... Error! Bookmark not defined. 9. Perubahan Temperatur selama Dekomposisi ... Error! Bookmark not defined. 10. Perubahan Kandungan Serat Kompos selama DekomposisiError! Bookmark not defined.
xii Lampiran III. Perhitungan Kebutuhan Bahan
Lampiran IV. Skema Alat Penelitian (Fermentasi MOL)
Lampiran V. Kandungan Kulit Kakao; Hasil Analisis Kimia Kulit Kakao
Lampiran VI. Data Standarisasi Nasional Kompos SNI 19-7030-2004
Lampiran VII. Persyaratan Teknis Minimal Pupuk Organik Cair dan Kandungan Unsur Hara dalam Bonggol Pisang Apu
Lampiran VIII. Hasil Analisis Kompos Tandan Kosong Kelapa Sawit dengan Mikroorganisme Lokal Bonggol Pisang; Hasil Kompos Sampah Organik dengan Memanfaatkan Mikroorganisme Bonggol Pisang; Komposisi Unsur Hara Cairan MOL Rebung
Lampiran IX. Parameter Kualitas Limbah Padat RPH Tamangapa Kota Makasar; Perbandingan standar kualitas kompos SNI dengan kompos blotong menggunakan Kotoran Sapi; Perbandingan kompos ampas aren menggunakan Rumen Sapi
Lampiran X. Komposisi Aktivator EM4; Perbandingan standar kualitas kompos SNI dengan kompos blotong menggunakan EM4
Lampiran XI. Pengaruh Berbagai Dekomposer Terhadap Penurunan Rasio C/N Pada Pengomposan Jerami Padi; Komposisi Kimia Jerami Padi; Hasil Analisis Kompos Kulit Kakao Menggunakan Aktivator EM4
Lampiran XII. Hasil Sidik Ragam
Lampiran XIII. Munsell Soil Color Chart
Lampiran XIV. Sumber MOL, Hasil Fermentasi MOL, Sifat Aerobisitas MOL
Lampiran XV. Hasil Identifikasi Spora Cendawan
Lampiran XVI. Pelaksanaan Pengomposan, Pengamatan Mikrobiologi selama Dekomposisi, Pengamatan Temperatur, Pengamatan Asam Titrasi
Lampiran XVII. Pengujian Kadar Air, Pengamatan pH, Uji Daya Kecambah, Hasil Akhir Kompos
xiii
determine the most effective bioactivator of MOL to decompose the cacao skin. This research was done from May – September 2016, by using experimental method, arranged on RAL (Complete Random Arrangement) single factor with 4 treatments which were 1 liter/25kg of MOL of banana hump, 1 liter/25kg MOL of bamboo, 1 liter/25kg MOL of cow’s rumen contents and 50 ml/25kg EM4. Each of them was repeated 3 times so that there were 12 units of experiments. The parameters that were observed encompassing observation of changes in microbiological, physical, chemical and compost maturity test.
The microbe identification of banana hump MOL, MOL of bamboo and MOL of cow’s rumen content produced 13 varieties of bacteria and 3 varieties of fungi. The MOL bacteria was suspected as Bacillus sp. and Streptococcus sp. The MOL fungi was suspected as a group of Penicillium sp., Aspergillus sp. and Trichoderma sp. The bioactivator of MOL can be used as an alternative of EM4 on cacao skin decomposition. The banana hump MOL, MOL of bamboo, MOL of cow’s rumen content and EM4 experienced a change at the same time during compost maturation process. The cacao skin compost on MOL of banana hump, MOL of bamboo, MOL of cow’s rumen and EM4 had been appropriate with the standard of quality compost SNI 19-7030-2004, except C/N ratio.
1
I. PENDAHULUAN
A. Latar Belakang
Indonesia dikenal sebagai negara pengekspor biji kakao terpenting di
dunia. Tahun 2010 Indonesia menduduki posisi sebagai pengekspor biji kakao
terbesar ke tiga dunia dengan produksi biji kering 550.000 ton. Tahun 2010
tersebut dari luas 1.651.539 ha areal kakao, sekitar 1.555.596 ha atau 94% adalah
kakao rakyat (Rubiyo dan Siswanto, 2012). Data dari Badan PBB untuk Pangan
dan Pertanian (FAO) menyebutkan, Indonesia menyumbang sekitar 16 persen dari
produksi kakao secara global (Zakiya, 2012). Di Indonesia tanaman kakao
tersebar di beberapa pulau seluruh wilayah Indonesia yaitu diantaranya di pulau
Jawa, Sumatera, Kalimantan, Sulawesi, dan Papua. Coklat dihasilkan dari biji
buah Kakao, sedang daging buah dan kulitnya akan menghasilkan limbah.
Berdasarkan penelitian, kulit kakao mempunyai kandungan gizi yaitu 22%
protein, 3–9% lemak, bahan kering (BK) 88%, protein kasar (PK) 8%, serat kasar (SK) 40,15, dan TDN 50,8%, energi (K.kal) 2,1 dan pH 6,8, sehingga kulit kakao
memiliki kandungan gizi yang cukup tinggi dan dapat diolah menjadi limbah yang
bernilai jual tinggi (Anonim, 2010). Menurut Didiek dan Away (2004), kompos
kulit buah kakao mempunyai pH 5,4, N total 1,30%, C organik 33,71%, P2O5
0,186%, K2O 5,5%, CaO 0,23%, dan MgO 0,59%.
Kasus penanganan limbah pertanian dan perkebunan kakao sampai saat ini
masih merupakan kendala dalam program penanganan limbah di tingkat petani.
keterbatasan areal pembuangan. Di samping itu limbah pertanian dan perkebunan
belum banyak dimanfaatkan, walaupun dalam beberapa kondisi memiliki potensi
sebagai bahan pakan ternak maupun bahan baku pembuatan kompos. Untuk itu
perlu dilakukan pengamatan dalam mendukung program pemanfaatan limbah
potensial terutama limbah yang dihasilkan oleh tanaman kakao yaitu limbah kulit
kakao menjadi kompos yang dipercepat proses dekomposisinya menggunakan
bioaktivator. Pada dasarnya kompos yang menggunakan bioaktivator mudah
diproduksi sendiri, karena mikroorganisme-mikroorganisme yang berguna banyak
terdapat dialam sekitar kita. Mikroorganisme merupakan jasad hidup yang
mempunyai ukuran sangat kecil (Kusnadi, dkk, 2003). Setiap sel tunggal
mikroorganisme memiliki kemampuan untuk melangsungkan aktivitas kehidupan
antara lain dapat mengalami pertumbuhan, menghasilkan energi dan bereproduksi
dengan sendirinya. Salah satunya dapat dimanfaatkan untuk pembuatan kompos.
Proses pembuatan kompos ini salah satunya dapat menggunakan Mikro
Organisme Lokal (MOL). Mikro Organisme Lokal mengandung unsur hara makro
dan mikro dan juga mengandung bakteri yang berpotensi sebagai perombak bahan
organik, perangsang pertumbuhan dan sebagai agen pengendali hama dan
penyakit tanaman. Keunggulan penggunaan MOL yang paling utama adalah
murah bahkan tanpa biaya, dengan memanfaatkan bahan-bahan yang ada di
lingkungan sekitar (Purwasasmita, 2009).
Penelitian ini tentang teknik pengolahan limbah kulit kakao menjadi
bioaktivator dari berbagai sumber Mikro Organisme Lokal (MOL) yang ada di
lingkungan sekitar.
B. Rumusan Masalah
Komposisi mikrobia pada aktivator dan aktivitas mikrobia selama proses
dekomposisi pada berbagai macam bahan organik, sangat mempengaruhi lama
dekomposisi dan kualitas kompos yang dihasilkan (Badan Litbang Pertanian
Bengkulu, 2010). Mikroorganisme lokal yang akan digunakan dalam penelitian
ini adalah mikroba bioaktivator dari bonggol pisang, rebung bambu, isi rumen
sapi dan EM4. Adanya penambahan bioaktivator diharapkan mampu
mempercepat proses dekomposisi pada limbah kulit kakao dan berbagai macam
bioaktivator mikroorganisme lokal tersebut dapat diperoleh dengan mudah dan
murah. Penggunaan mikroba sebagai aktivator untuk memperoleh kompos limbah
kulit kakao yang berlangsung cepat dan kualitas yang baik sangat tergantung pada
jenis aktivator yang digunakan. Permasalahan utama yang dikaji dalam penelitian
ini yaitu:
1. Bagaimana pengaruh penambahan bioaktivator dari berbagai sumber
mikroorganisme lokal terhadap proses dekomposisi dan kualitas kompos
kulit kakao?
2. Bioaktivator dari berbagai sumber mikroorganisme lokal manakah yang
C. Tujuan Penelitian
Tujuan dari penelitian ini, yaitu:
1. Mengidentifikasi dan mengaji aktivitas dan perubahan kompos limbah
kulit kakao selama proses dekomposisi berlangsung;
2. Mengaji pengaruh beberapa bioaktivator MOL terhadap kualitas kompos
kulit kakao;
3. Menentukan bioaktivator MOL yang efektif dalam proses dekomposisi
5
II. TINJAUAN PUSTAKA
A. Kulit Kakao
Tanaman kakao yang mempunyai nama latin Theobroma cacao L. atau
biasa kita sebut dengan cokelat merupakan tanaman yang banyak ditemukan
tumbuh di daerah tropis (Roesmanto, 1991). Kakao secara umum adalah
tumbuhan menyerbuk silang dan memiliki sistem inkompatibilitas sendiri. Buah
tumbuh dari bunga yang diserbuki. Ukuran buah jauh lebih besar dari bunganya,
dan berbentuk bulat hingga memanjang. Buah terdiri dari 5 daun buah dan
memiliki ruang serta di dalamnya terdapat biji. Warna buah berubah-ubah.
Sewaktu muda berwarna hijau hingga ungu. Apabila masak kulit luar buah
biasanya berwarna kuning. Dari data yang diperoleh pada tahun 2005, Indonesia
merupakan penghasil kakao terbesar ke tiga setelah dua negara di benua Afrika
yaitu Pantai Gading dan Ghana. Di Indonesia tanaman kakao sendiri tersebar
sebagian besar di beberapa pulau seluruh wilayah Indonesia yaitu diantaranya di
pulau Jawa, Sumatera, Kalimantan, Sulawesi, dan Papua. Sampai tahun 2005
kakao yang telah ditanam di wilayah Indonesia seluas 668.919 Ha dan 57.930,82
Ha (7,25%) berada di Sumatera Utara dengan produksi buah segar 160.015,29
ton/tahun (Isroi, 2007).
Buah segar akan dihasilkan limbah kulit buah Kakao sebesar 75%.
Kandungan hara mineral kulit buah kakao cukup tinggi, khususnya hara Kalium
dan Nitrogen. Dilaporkan bahwa 61% dari total nutrien buah kakao disimpan di
(2007) menemukan bahwa kandungan hara kompos yang dibuat dari kulit buah
kakao adalah 1,81 % N, 26,61 % C-organik, 0,31% P2O5, 6,08% K2O, 1,22%
CaO, 1,37 % MgO, C/N rasio 14,70 dan 44,85 cMOL/kg KTK.
Penelitian yang dilakukan oleh R. Shepherd dan Yap Tuan Ngan di
Malaysia dalam Roesmanto (1991) menunjukkan bahwa kulit kakao dan sweating
yang ditimbulkan pada prosesing biji kakao dapat dimanfaatkan sebagai sumber
produk lain yang berguna. Kulit kakao dapat dimanfaatkan sebagai sumber
nutrien tanaman. Unsur – unsur yang terdapat dalam kulit kakao (basah) ini
adalah N, P2O5, K2O, MgO, CaO. Pada perusahaan perkebunan kakao umumnya
setelah buah – buah kakao dipanen dan dikupas, kulit – kulit buahnya dibiarkan
berserakan di tanah, atau kadang – kadang diletakkan ke dalam tanah. Di
Malaysia ada perusahaan perkebunan yang kemudian menerapkan sentralisasi
pengupasan buah kakao, distribusi yang terjadwal, yang pada gilirannya
memerlukan tambahan biaya transportasi.
Komponen utama dari buah kakao adalah kulit buah, plasenta, dan biji.
Kulit buah merupakan komponen terbesar dari buah kakao, yaitu lebih dari 70%
berat buah masak. Persentase biji kakao di dalam buah hanya sekitar 27-29%,
sedangkan sisanya adalah plasenta yang merupakan pengikat dari 30 sampai 40
biji (APED, 2011). Limbah kakao diantaranya terdiri dari kulit buah dan kulit biji
kakao. Kulit biji kakao mempunyai kandungan protein kasar 16,60% dan serat
kasarnya 25,10%. Kandungan lignin kulit buah kakao mencapai 38,78%. Kulit
buah kakao merupakan kulit bagian luar yang menyelubungi biji kakao dengan
pod) 73,73%, placenta 2,0% dan biji 24,2% (Wanti, 2008b). Penelitian Wanti
(2008) menyebutkan kandungan kulit kakao memiliki serat kasar 33,19-39,45%
(Lampiran V.a).
Ketersediaan kulit buah kakao cukup banyak karena sekitar 75% dari satu
buah kakao utuh adalah berupa kulit buah, sedangkan biji kakao sebanyak 23%
dan plasenta 2%. Ditinjau dari segi kandungan, kulit buah kakao mengandung
protein kasar 11,71%, serat kasar 20,79%, lemak 11,80%, dan BETN 34,90%
(Nuraini dan Maria, 2009). Pada areal satu hektar pertanaman kakao akan
menghasilkan limbah segar kulit buah sekitar 5,8 ton setara dengan produk tepung
limbah 812 kg. Potensi limbah kulit buah kakao dari suatu pabrik pengolahan
kakao sebesar 15-22 m3/ha/tahun (Darwin, 2010). Penelitian Fitriana (2011)
menyebutkan bahwa hasil analisis kimia kulit kakao memiliki serat kasar 6,095%,
hemiselulosa 2,946%, selulosa 0,333% dan lignin 0,482% (Lampiran V.b).
B. Dekomposisi Bahan Organik 1. Definisi Dekomposisi
Dekomposisi merupakan suatu rangkaian proses yang disebabkan proses
fragmentasi, perubahan kimia, serta peluluhan. Proses dekomposisi dikendalikan
oleh tiga tipe faktor, yaitu kondisi lingkungan fisik, kualitas dan kuantitas dari
substrat yang tersedia untuk dekomposer, serta karakteristik dari komunitas
mikroba (Anonim, 2010). Menurut Temperaturt dan Salundik (2006), proses
mempengaruhi mikroorganisme tanah akan mempengaruhi laju dekomposisi
tersebut.
2. Faktor-faktor yang mempengaruhi Dekomposisi
Faktor yang mempengaruhi proses dekomposisi dibagi menjadi dua
komponen yaitu faktor dalam dan faktor luar. Faktor dalam terdiri dari C/N rasio
bahan organik, jumlah dan jenis mikroorganisme yang terlibat. Sedangkan faktor
luar yang mempengaruhi proses dekomposisi adalah temperatur, tingkat keasaman
(pH), aerasi, kelembaban dan ukuran bahan baku (Temperaturt dan Salundik,
2006).
Laju dekomposisi bahan organik sebagai bahan baku kompos menjadi
kompos yang matang menurut Isroi (2008) tergantung pada beberapa faktor
sebagaimana terurai dibawah ini :
1. Faktor dalam
a. C/N rasio
Proses pengomposan akan berjalan baik jika C/N rasio bahan organik yang
dikomposkan sekitar 25-35. C/N rasio bahan organik yang terlalu tinggi
akan menyebabkan proses pengomposan berlangsung lambat. Begitu juga
sebaliknya. Setiap bahan organik memiliki C/N rasio yang berbeda, oleh
sebab itu dalam penggunaan sebagai bahan baku kompos harus dicampur
dengan bahan organik yang memiliki imbangan C/N tinggi sehingga dapat
b. Jumlah dan jenis Mikroorganisme yang terlibat
Berdasarkan temperatur mikroorganisme diklasifikasikan dalam tiga
kategori, yaitu psikofil, mesofil, dan termofil. Proses pengomposan bisa
dipercepat dengan penambahan starter atau aktivator. Beberapa jenis
mikroba dapat mempercepat proses dekomposisi adalah bakteri pelarut
phospat, Azotobacter, Actinomycetes.
2. Faktor Luar
Menurut Isroi (2008) dalam pengomposan juga dipengaruhi oleh faktor
luar antara lain :
a. Temperatur
Temperatur optimum bagi pengomposan adalah 40 – 600C dengan
maksimum 750C.
b. Tingkat Keasaman (pH)
Pengaturan pH perlu dilakukan karena merupakan salah satu faktor yang
kritis bagi pertumbuhan mikroorganisme yang terlibat dalam proses
pengomposan. Pada awal pengomposan cenderung agak asam. Namun
akan mulai naik sejalan dengan waktu pengomposan dan akan stabil pada
pH sekitar netral.
c. Aerasi
Pengomposan yang cepat dapat terjadi dalam kondisi yang cukup oksigen
(aerob). Aerasi ditentukan oleh porositas dan kandungan air bahan
d. Kelembaban (RH)
Kelembaban yang baik untuk berlangsungnya proses dekomposisi secara
aerobik adalah 50-60%
e. Ukuran Bahan Baku
Semakin kecil, ukuran bahan (5-10 cm), proses pengomposan
(dekomposisi) berlangsung semakin cepat. Hal ini terjadi karena adanya
peningkatan luas permukaan bahan untuk diserang mikroorganisme.
f. Tumpukan bahan
Syarat tumpukan bahan adalah 1 m3 dengan tujuan agar temperatur panas
yang dihasilkan itu menjadi optimal.
Proses pengomposan akan berlangsung ketika bahan – bahan mentah telah
dicampur. Proses pengomposan dapat dibagi menjadi dua tahap, yaitu tahap aktif
dan tahap pematangan. Dalam proses pengomposan, mikroba selulotik
mengeluarkan enzim selulase yang dapat menghidolisis selulosa menjadi
selobiosa lalu dihidrolisis lagi menjadi D-Glukosa dan difermentasikan menjadi
asam Laktat, Etanol, CO2, dan Amonia. Selama tahap awal proses, oksigen dan
senyawa – senyawa yang mudah terdegradasi akan segera dimanfaatkan oleh
mikroba mesofilik. Temperatur tumpukan kompos akan meningkat dengan cepat.
Demikian pula akan diikuti dengan peningkatan pH kompos. Temperatur akan
meningkat hingga di atas 500– 700 C. Temperatur akan tetap tinggi selama waktu
tertentu. Mikroba yang aktif pada kondisi ini adalah mikroba Termofilik, yaitu
bahan organik yang sangat aktif. Mikroba – mikroba di dalam kompos dengan
menggunakan oksigen akan menguraikan bahan organik menjadi CO2, uap air dan
panas. Setelah sebagian besar bahan telah terurai, maka temperatur akan
berangsur – angsur mengalami penurunan. Pada saat ini terjadi pematangan
kompos tingkat lanjut, yaitu pembentukan komplek liat humus. Selama proses
pengomposan akan terjadi penyusutan volume maupun biomasa bahan.
Penguraian ini dapat mencapai 30-40% dari volume/bobot awal bahan (Isroi,
2008).
Di dalam proses pengomposan terjadi perubahan seperti (1). Karbohidrat,
selulosa, hemiselulosa, lemak dan lignin menjadi CO dan HO; (2). Zat putih telur
menjadi amonia, CO dan HO; (3). Peruraian senyawa organik menjadi senyawa
yang dapat diserap oleh tanaman. Dengan perubahan tersebut kadar karbohidrat
akan hilang atau turun dan senyawa N yang larut (Amonia) akan meningkat.
Dengan demikian C/N rasio semakin rendah dan relatif stabil mendekati C/N rasio
tanah. Pengomposan berdasarkan kebutuhan oksigen diklasifikasikan menjadi
pengomposan aerob dan pengomposan anaerob. Pengomposan aerobik adalah
proses dekomposisi oleh mikroba yang memanfaatkan oksigen untuk
menghasilkan humus, karbondioksida, air dan energi. Beberapa energinya
digunakan untuk pertumbuhan mikroba dan sisanya dikeluarkan dalam bentuk
panas (Temperaturt dan Salundik, 2006). Menurut Gaur (1980), reaksi – reaksi
penting yang terjadi selama proses dekomposisi aerobik adalah sebagai berikut :
Gula
Hemiselulose
Protein (organik N) NH3 → NO2 → NO3 + E
Sulfur – organik S+ xO SO4
Phospat organik H3PO4 Ca (HPO4)2
Secara keseluruhan, reaksinya akan berlangsung seperti berikut :
Mikroba aerob
Bahan organik CO2 + H2O + unsur hara + humus + energi
Sedangkan pengomposan secara anaerob akan menghasilkan gas metana
(CH3), karbondioksida (CO2), dan asam organik yang memiliki bobot molekul
rendah (Temperaturt dan Salundik, 2006).
Rekasi biokimia yang terjadi pada proses dekomposisi anaerobik adalah
sebagai berikut :
(CH2O)x xCH3COOH
CH3COOH CH4 + CO2
N-organik NH3
2H2S + CO2 + sinar (CH2O)x + S2 +H2O
Menurut Yustianti (2013), prinsip-prinsip proses biologis yang terjadi
pada proses pengomposan meliputi:
a. Kebutuhan Nutrisi
Perkembangbiakan dan pertumbuhan mikroorganisme memerlukan
sumber energi, yaitu karbon untuk proses sintesa jaringan baru dan
elemen-elemen anorganik seperti Nitrogen, Fosfor, Kapur, Belerang dan Magnesium
memacu pertumbuhannya, mikroorganisme juga memerlukan nutrien organik
yang tidak dapat disintesa dari sumber-sumber karbon lain. Nutrien organik
tersebut antara lain asam amino, purin/pirimidin, dan vitamin.
b. Mikroorganisme
Mikroorganisme pengurai dapat dibedakan antara lain berdasarkan
kepada struktur dan fungsi sel, yaitu:
1. Eucaryotes, termasuk dalam dekomposer adalah eucaryotes bersel tunggal,
antara lain: ganggang, cendawan, protozoa.
2. Eubacteria, bersel tunggal dan tidak mempunyai membran inti, contoh:
bakteri. Beberapa hewan invertebrata (tidak bertulang belakang) seperti
cacing tanah, kutu juga berperan dalam pengurai sampah. Sesuai dengan
peranannya dalam rantai makanan, mikroorganisme pengurai dapat dibagi
menjadi 3 (tiga) kelompok, yaitu :
a. Kelompok I (Konsumen tingkat I) yang mengkonsumsi langsung
bahan organik dalam sampah, yaitu : cendawan, bakteri,
actinomycetes.
b. Kelompok II (Konsumen tingkat II) mengkonsumsi jasad kelompok I,
dan;
c. Kelompok III (Konsumen tingkat III), akan mengkonsumsi jasad
kelompok I dan Kelompok I. Kondisi Lingkungan Ideal Efektivitas
proses pembuatan kompos sangat tergantung kepada mikroorganisme
3. SNI kompos
Standar kualitas pupuk organik yang sesuai dengan SNI 19-7030-2004
adalah rasio C/N 10-20, kandungan Nitrogen minimal 0,40%, kandungan
Phosphor minimal 0,10%, kandungan Kalium minimal 0,20%, dan Kadar air
maksimum 50% (Kurniawan, 2013). Pupuk kompos tidak diberikan sepenuhnya
pada tanah sebagai pengganti pupuk anorganik, karena kandungan hara yang
dimiliki oleh pupuk kompos sangat rendah sehingga fungsinya hanya mengurangi
penggunaan pupuk anorganik. Meski begitu setidaknya pupuk kompos memiliki
empat manfaat, yakni sebagai sumber nutrisi, memperbaiki struktur fisik tanah,
memperbaiki kimia tanah, meningkatkan daya simpan air dan meningkatkan
aktivitas biologi tanah (Surtinah, 2013). Adapun standar kematangan kompos
berdasarkan (SNI 19 – 7030 – 2004) tersaji dalam Lampiran VI.
C. Bioaktivator Mikroorganisme Lokal (MOL)
Mikro Organisme Lokal (MOL) adalah mikroorganisme yang diperoleh
dari bahan – bahan alami sebagai medium berkembangnya mikroorganisme yang
berguna untuk mempercepat penghancuran bahan organik (proses dekomposisi
menjadi kompos/ pupuk organik) (Panudju, 2011). Menurut Firmansyah (2010)
mikroba yang berperanan dalam proses pengomposan ada dua jenis yang
dominan, yaitu: bakteri dan cendawan. Sedangkan menurut Krisno (2012) Secara
global terdapat 5 golongan yang pokok yaitu: Bakteri fotosintetik, Lactobacillus
sp, Streptomycetes sp, Ragi (yeast), Actinomycetes. Mikroba yang banyak
digunakan sebagai aktivator adalah cendawan dan bakteri, oleh sebab itu dalam
(Lactobacillus), bakteri penghancur (dekomposer) seperti, yeast atau ragi, spora
cendawan (Aspergilus dan Trichoderma), bakteri fotosintetik, serta bakteri
menguntungkan yang lain (bakteri penambat N, pelarut fosfat, dll) (Budiyanto,
2013).
Larutan Mikroorganisme Lokal adalah hasil fermentasi yang berbahan
dasar dari berbagai sumber daya yang tersedia setempat. Larutan MOL
mengandung unsur hara mikro dan makro dan juga mengandung bakteri yang
berpotensi sebagai perombak bahan organik, perangsang pertumbuhan, dan
sebagai agens pengendali hama dan penyakit tanaman, sehingga MOL dapat
digunakan baik sebagai dekomposer, pupuk hayati dan pestisida organik terutama
sebagai fungisida (Purwasasmita, 2009). Amalia (2008) juga melaporkan bahwa
keunggulan penggunaan MOL adalah dapat diperoleh dengan biaya murah bahkan
tanpa biaya. Dengan memanfaatkan bahan – bahan yang ada di lingkungan sekitar
seperti buah-buahan busuk (pisang, mangga, pepaya), limbah sayuran (bayam,
kangkung), rebung bambu, buah maja dan keong mas.
Peran MOL dalam kompos, selain sebagai penyuplai nutrisi juga berperan
sebagai komponen bioreaktor yang bertugas menjaga proses tumbuh tanaman
secara optimal. Fungsi bioreaktor antara lain penyuplai nutrisi melalui mekanisme
eksudat, kontrol mikroba sesuai kebutuhan tanaman, menjaga stabilitas kondisi
tanah menuju kondisi yang ideal bagi pertumbuhan tanaman dan kontrol terhadap
penyakit yang menyerang tanaman (Kurnia, 2009).
Pupuk organik adalah pupuk yang sebagian besar atau seluruhnya terdiri
mengalami rekayasa berbentuk padat atau cair yang digunakan untuk memasok
bahan organik, memperbaiki sifat fisik, kimia, dan biologi tanah (Peraturan
Mentan, No. 2/Pert/HK.060/2/2006). Berdasarkan hasil pembahasan para pakar
lingkup Puslitbangtanak, Direktorat Pupuk dan Pestisida, IPB Jurusan Tanah,
Depperindag, serta Asosiasi Pengusaha Pupuk dan Pengguna maka telah
disepakati persyaratan teknis minimal pupuk organik seperti tercantum dalam
Lampiran VII.a. Santi et al (2007) melaporkan, bahwa pemberian mikroorganisme
lokal pada tanaman jagung di Pelaihari, Kalimantan Selatan dapat menghemat
penggunaan pupuk kimia konvensional sebesar 25 - 75 % tanpa menimbulkan
pengaruh nyata pada hasil tanaman.
1. MOL Bonggol Pisang
Bonggol pisang mengandung mikrobia pengurai bahan organik. Mikrobia
pengurai tersebut terletak pada bonggol pisang bagian luar maupun bagian dalam
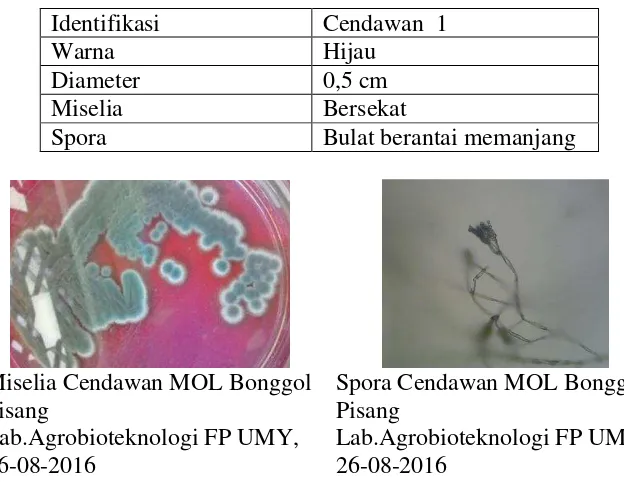
(Suhastyo, 2011). Jenis mikrobia yang telah diidentifikasi pada MOL bonggol
pisang antara lain Bacillus sp., Aeromonas sp., dan Aspergillus nigger.
Mikrobia inilah yang biasa menguraikan bahan organik (Suhastyo, 2011).
Mikrobia pada MOL bonggol pisang akan bertindak sebagai dekomposer bahan
organik yang akan dikomposkan. Menurut Wulandari dkk. (2009) bonggol pisang
mengandung karbohidrat 66,2%. Dalam 100 g bahan, bonggol pisang kering
mengandung karbohidrat 66,2 g dan pada bonggol pisang segar mengandung
karbohidrat 11,6 g. Kandungan karbohidrat yang tinggi akan memacu
perkembangan mikoorganisme. Kandungan karbohidrat yang tinggi dalam
Dengan MOL ini, pengomposan dapat selesai dalam waktu tiga minggu
(Wulandari dkk, 2009). Dalam proses fermentasi, karbohidrat akan diubah
menjadi gula oleh S. cerevisiae, gula diubah menjadi alkohol dan alkohol akan
diubah oleh A. aceti menjadi asam asetat. Selain potensi dalam fermentasi juga
berpotensi sebagai bioaktivator dalam pengomposan (Widiastuti, 2008).
Kandungan bakteri dalam MOL dapat dimanfaatkan sebagai starter
pembuatan kompos, pupuk hayati, bahkan pestisida organik. Dengan
menggunakan bahan yang tersedia di lingkungan sekitar, MOL murah (murah
karena estimasi harga adalah gula (Rp.7000/kg), dan bonggol pisang dan air beras
yang tidak perlu dibeli, sehingga dalam pembuatan hanya membutuhkan
±Rp.7000) sehingga menghemat biaya produksi tanaman. Pemakaian pupuk
organik yang dikombinasikan dengan MOL dapat menghemat penggunaan pupuk
kimia hingga 400 kg per musim tanam pada 1 ha sawah. Waktu pembuatan relatif
singkat dan cara pembuatannya pun mudah. Selain itu, MOL juga ramah
lingkungan (Panudju, 2011). Kandungan unsur hara dalam bonggol pisang
meliputi unsur hara makro maupun unsur hara mikro seperti disajikan pada
Lampiran VII.b. Menurut Rohmawati (2015), pengomposan dengan
memanfaatkan mikroorganisme lokal (MOL) dari bonggol pisang dilakukan
dengan cara mencampurkan larutan MOL dengan perbandingan 1 : 5 (1 liter
larutan MOL : 5 liter air) kemudian ditambahkan 1 ons gula merah.
Kompos dengan menggunakan mikroorganisme lokal dari bonggol pisang
sudah diaplikasikan pada pengomposan tandan kosong kelapa sawit memiliki C/N
Benediktus (2013) penggunaan MOL bonggol pisang diaplikasikan pada sampah
organik dinyatakan bahwa hasil kompos yang menggunakan MOL bonggol pisang
raja mendekati kompos dengan menggunakan EM4 menunjukkan C/N rasio 18
(Lampiran VIII.b).
2. MOL Rebung Bambu
Bambu biasanya tumbuh subur sekalipun didaerah tandus dan mampu
tumbuh begitu cepat walaupun tanpa pupuk sama sekali. Dan yang lebih hebat,
bambu mampu mengubah tanah tandus menjadi subur. Maka dari itu tanah
disekitar perakaran pohon bambu biasa digunakan untuk medium pembibitan.
Oleh karena itu kita manfaatkan rebung sebagai MOL. Rebung bambu
mengandung C Organik, Giberellin, Azotobacter dan Azospirillium yang tinggi
untuk merangsang pertumbuhan tanaman secara cepat dan sangat bagus
digunakan untuk pengomposan (Maspary, 2012). MOL rebung mengandung
cendawan Fusarium dan Tricoderma serta bakteri Lactobacillus dan
Streptococcus (Atman dan Nurnayetti, 2016).
Kandungan kimiawi rebung mentah bambu betung per 100 gram terdiri
dari air (91 gram), protein (2,6 gram), karbohidrat (5,20 gram), lemak (0,90
gram), serat kasar (1,00 gram), vitamin A (20 SI), kalium (533 mg), fosfor (53
mg), abu (0,90 mg) serta unsur-unsur mineral lain seperti riboflavin, niasin,
thiamin, kalsium, dan besi dalam jumlah kecil (Watt dan Merill 1975) dalam Dea
Tino Maretza dan Supriyanto (2009). Hersanti (2007) menyatakan bahwa dari
hasil mengisolasi bakteri dari berbagai larutan MOL terdapat 1 jenis isolat yang
Setianingsih (2009), larutan MOL rebung berguna untuk membantu perkecambahan
dan kekokohan batang tanaman padi.
Menurut Azzamy (2015), pengomposan dengan memanfaatkan
mikroorganisme lokal (MOL) dari rebung bambu dilakukan dengan cara
mencampurkan larutan MOL dengan perbandingan 1 : 5 (1 liter larutan MOL : 5
liter air) kemudian disiramkan ke bahan kompos. Menurut Tukimun (2016)
Kompos dari kotoran ternak dan hijauan yang dicampurkan dengan aktivator dari
akar bambu menunjukkan hasil yang baik dan dapat jadi kompos matang dalam
waktu kurang lebih 28 hari atau 4 minggu. Semakin banyak pemeberian aktivator
akar bambu maka kompos semakin cepat jadi (Komunikasi Pribadi).
3. MOL Rumen Sapi
Lambung ruminansia terdiri atas 4 bagian, yaitu rumen, retikulum,
omasum, dan abomasum dengan ukuran yang bervariasi sesuai dengan umur dan
makanan alamiahnya. Kapasitas rumen 80%, retikulum 5%, omasum 7-8%, dan
abomasum 7-8%. Mikroorganisme utama yang terdapat dalam rumen adalah
bakteri, protozoa, dan cendawan (yeast). Bakteri yang ada di dalam rumen antara
lain bakteri selulolitik, Hemiselulolitik, Acid Utilizer Bacteria (bakteri pemakai
asam), Bakteri Amilolitik, Sugar Untilizer Bacteria (bakteri pemakai gula),
Bakteri Proteolitik, Bakteri Methanogenik, Bakteri Lipolitik, Bakteri Ureolitik.
Sedangkan protozoa yang ada pada rumen adalah cilliata dan flagellata. Dan
perombak selulosa, cendawan perombak hemiselulosa (Siswanto dan Suwiti,
2013).
Limbah ternak adalah buangan dari suatu kegiatan usaha peternakan
seperti usaha pemeliharaan ternak, rumah potong hewan dan pengolahan produk
ternak. Limbah tersebut meliputi limbah padat dan cair seperti feses, urin, sisa
makan, embrio, kulit telur, lemak, darah, bulu, kuku, tulang, tanduk, dan isi rumen
(Temperaturt dan Salundik, 2006). Dengan semakin berkembangnya usaha
peternakan dan kebutuhan manusia akan hasil ternak maka limbah yang
dihasilkan semakin meningkat. Di dalam rumen ternak ruminansia terdapat
mikrobia, yang terdiri dari protozoa, bakteri dan fungi (Sudaryanto, 2002).
Salah satu kelompok bakteri yang sangat penting di dalam rumen adalah
bakteri selulolitik. Enzim selulase yang dihasilkan bakteri selulolitik mampu
memecah selulosa sehingga ternak ruminansia dapat hidup dengan hijauan
berkualitas rendah (Arora, 1992). Proses biodegradasi bahan yang mengandung
selulosa sangat ditentukan oleh kemampuan mikrobia selulolitik untuk
menghasilkan enzim selulase yang mempunyai aktivitas tinggi (Asenjo et al.,
1986). Populasi bakteri pada usus besar dan feses ternak ruminansia termasuk
golongan spesies bakteri yang juga terdapat di dalam rumen, yaitu termasuk
dalam famili Bacteriodes, Fusobacterium, Streptococcus, Eubacterium,
Ruminococcus dan Lactobacillus (Omed et al., 2000).
Bakteri merupakan penghuni terbesar dalam rumen (1010-1012/ml cairan
oleh tipe pakan yang dikonsumsi ternak dan perubahan pakan akan
mengakibatkan perubahan populasi dan proporsi dari spesies mikroba untuk
mencapai keseimbangan yang baru, karena masing-masing mikroba rumen
memiliki spesifikasi dalam menggunakan bahan pakan. Fibrobacter succinogenes
dan Ruminococcus albus merupakan bakteri selulotik anaerob yang paling banyak
terdapat dalam rumen dan yang menghasilkan enzim yang memecah selulosa
menjadi gula-gula bebas yang selanjutnya digunakan untuk fermentasi anaerob.
Namun bila bahan pakan diganti menjadi ransum tinggi pati, maka bakteri yang
berkembang adalah Bacteroides amylophilus, Succinomonas amylolytica yang
tadinya merupakan mikroba minoritas, atau Lactobacilii dan Streptococcus.
Sedangkan bila ternak diberi ransum tinggi pektin melalui pemberian hay
leguminosa, maka bakteri Lachnospira multiparus akan berkembang dalam
rumen. Masing-masing spesies bacteria rumen memerlukan substrat dan nutrisi
yang khusus, bahkan hasil fermentasinya juga berbeda (Suharyono, 2016).
Menurut Sembiring dkk (2010), dilihat dari fungsinya, mikroorganisme
dalam rumen terdiri atas beberapa kelompok yang berperan dalam
memfermentasikan bahan makanan ialah :
a. Kelompok Pencerna Selulosa
Bakteri ini menghasilkan enzim yang dapat menghidrolisis ikatan
glukosida β 1,4, selulosa dan dimer selobiosa. Sepanjang yang diketahui tak
satupun hewan yang mampu memproduksi enzim selulosa sehingga pencernaan
perncernaan. Beberapa bakteri selulolitik antara lain adalah Bacteriodes
succinogenes, Ruminicoccus flavefaciens, Ruminicoccus albus, Cillobacterium
cellulosolvens.
b. Kelompok Bakteri Pencerna Hemiselulosa
Hemiselulosa merupakan struktur polisakrida yang penting dalam dinding
sel tanaman. Mikroorganisme yang dapat menghidrolisis selulosa biasanya juga
dapat menghidrolisa hemiselulosa sedangkan mikroorganisme yang mampu
menghidrolisa hemiselulosa belum tentu mampu menghidrolisa selulosa. Bakteri
yang mencerna hemiselulosa ialah Butyrivibrio fibrisolvens, Lachnospira
multiparus, dan Bactroides ruminicola.
c. Kelompok Bakteri Pencerna Pati
Pada ruminansia tidak terlalu banyak mikroorganime amilolitik dalam
rumen. Bakteri amilolitik akan menjadi dominan dalam jumlahnya apabila
makanan mengandung pati tinggi. Bakteri amilolitik yang terdapat dalam rumen
antara lain : Bacteroides amylophillus, Bacteroides ruminicola, Bacteroides
alactacidigens, Butyrivibrio fibrisolvens. Beberapa kelompok bakteri lain adalah
kelompok bakteri pemakai gula, bakteri proteolitik, bakteri methanogenik, bakteri
lipolitik dan bakteri pembentuk amonia.
d. Protozoa Rumen
Protozoa rumen umumnya adalah ciliata, namun terdapat pula beberapa
anaerobic michroorganism. Dari hasil serangkaian studi, diperoleh informasi
bahwa diduga ciliata mempunyai peranan sebagai sumber protein dengan
keseimbangan kandungan asam amino yang lebih baik dibandingkan dengan
bakteri sebagai makanan ternak ruminansia.
e. Fungi Rumen
Beberapa spesies fungi telah ditemukan dalam rumen. Signifikasi fungi
dalam proses pencernaan atau habitat ekologi belum ditemukan dengan baik
seperti pada bakteri. Beberapa fungi tidak melakukan pencernaan, namun terbawa
serta dalam pakan. Beberapa spesies fungi telah diketahui mencerna serat kasar
dan lignin misalnya Pleurotus sajor-keju, Pleurotus florida atau Pleurotus
ostreatus. Fungi rumen sangat menarik karena dapat memanfaatkan enzim dengan
variasi yang luas. Diantara enzim yang sangat potensial dihasilkan oleh fungi
ialah Xylanase yang dapat mendegradasi cellulose dan hemicellulose sangat
sempurna.
Menurut Hartono, dkk (2014), penggunaan isi rumen ternak untuk
mendekomposisikan limbah padat rumah potong hewan di kota Makasar
dinyatakan bahwa hasil komposnya sesuai dengan SNI kompos yang dinyatakan
bahwa kompos limbah padat memiliki C/N rasio 14 (Lampiran IX.a). Penelitian
Pratama (2013) menyatakan bahwa kotoran sapi biasa juga digunakan untuk
dekomposer pengomposan karena mengandung mikroba pendekomposisi
selulolitik. Perbandingan kompos blotong dengan EM4 memiliki C/N rasio 20,44
Menurut penelitian Pratama (2013) pengomposan menggunakan kotoran
sapi untuk blotong sudah mampu menghasilkan kompos sesuai SNI (Lampiran
IX.b), sehingga diduga penggunaan MOL isi rumen sapi memiliki kemampuan
lebih baik mendekomposisikan limbah kulit kakao. Penggunaan MOL rumen sapi
yang digunakan untuk dekomposisi pada penelitian Larasati (2016) yang
menyatakan bahwa C/N rasio kompos ampas aren yaitu 12,72 (Lampiran IX.c).
4. Effective Microorganism (EM)
Effectife Microorganism 4 (EM4) merupakan suatu cairan berwarna
kecoklatan dan beraroma manis asam (segar) yang di dalamnya berisi campuran
beberapa mikroorganisme hidup yang menguntungkan bagi proses
penyerapan/persediaan unsur hara dalam tanah. Mikroorganisme fermentasi dan
sintetik yang terdiri dari asam laktat (Lactobacillus sp), Actinomycetes sp,
Streptomycetes sp, dan yeast (ragi). Mikroorganisme menguntungkan tersebut
(EM4) telah lama ditemukan, diteliti dan diseleksi terus menerus oleh seorang ahli
pertanian bernama Profesor Teruo Higa dari Universitas Ryukyu Jepang. Dengan
demikian EM4 bukan merupakan bahan kimia yang berbahaya seperti pestisida,
obat serangga atau pupuk kimia lainnya (Widiastuti, 2008).
Menurut Indriani (1999) jumlah mikroorganisme fermentasi di dalam EM4
sangat banyak, dari sekian banyak mikroorganisme ada lima golongan yang
pokok, yaitu :
Bakteri ini adalah mikroorganisme mandiri dan swasembada. Bakteri ini
membentuk senyawa-senyawa bermanfaat dari sekresi akar tumbuhan, bahan
organik dan gas-gas berbahaya dengan sinar matahari dan panas bumi sebagai
sumber energi. Zat-zat bermanfaat yang terbentuk anatara lain, asam amino asam
nukleik, zat bioaktif dan gula yang semuanya berfungsi mempercepat
pertumbuhan.
b. Bakteri asam laktat ( Lactobacillus spp. )
Bakteri asam laktat (Lactobacillus spp.) dapat mengakibatkan kemandulan
(sterilizer) oleh karena itu bakteri ini dapat menekan pertumbuhan
mikroorganisme yang merugikan; meningkatkan percepatan perombakan bahan
organik; menghancurkan bahan organik seperti lignin dan selulosa serta
memfermentasikannya tanpa menimbulkan senyawa beracun yang ditimbulkan
dari pembusukan bahan organik Bakteri ini dapat menekan pertumbuhan
fusarium, yaitu mikroorganime merugikan yang menimbukan penyakit pada
lahan/ tanaman yang terus menerus ditanami (Widyastuti, dkk., 2009).
c. Ragi / Yeast ( Saccharomyces spp. )
Melalui proses fermentasi, ragi menghasilkan senyawa-senyawa
bermanfaat bagi pertumbuhan tanaman dari asam amino dan gula yang
dikeluarkan oleh bakteri fotosintetik atau bahan organik dan akar-akar tanaman.
Ragi juga menghasilkan zat-zat bioaktif seperti hormon dan enzim untuk
meningkatkan jumlah sel aktif dan perkembangan akar. Sekresi Ragi adalah
d. Actinomycetes
Actinomycetes menghasilkan zat-zat anti mikroba dari asam amino yang
dihasilkan bakteri fotosintetik. Zat-zat anti mikroba ini menekan pertumbuhan
cendawan dan bakteri. Actinomycetes hidup berdampingan dengan bakteri
fotosintetik bersama-sama menongkatkan mutu lingkungan tanah dengan cara
meningkatkan aktivitas anti mikroba tanah.
e. Cendawan Fermentasi
Cendawan fermentasi ( Aspergillus dan Penicilium ) menguraikan bahan
secara cepat untuk menghasilkan alkohol, ester dan zat-zat anti mikroba.
Pertumbuhan cendawan ini membantu menghilangkan bau dan mencegah serbuan
serangga dan ulat-ulat merugikan dengan cara menghilangkan penyediaan
makanannya. Tiap species mikroorganisme mempunyai fungsi masing-masing
tetapi yang terpenting adalah bakteri fotosintetik yang menjadi pelaksana kegiatan
EM4 terpenting. Bakteri ini disamping mendukung kegiatan mikroorganisme
lainnya dan juga memanfaatkan zat-zat yang dihasilkan mikroorganisme lain.
Pedoman dosis penggunaan EM4 yaitu 1 liter EM4 untuk 1 ton campuran
bahan kompos atau setara 1 ml EM4 untuk 1 kg bahan kompos (Temperaturt dan
Salundik, 2006). Menurut Lab. MIPA IPB 026/IPBCC/An-Mik/6/11, aktivator
EM4 memiliki kadungan yang lengkap dan memiliki mikroba spesifik
dekomposer yaitu Lactobacillus, Bakteri Pelarut Fosfat, Yeast/Ragi,
Actinomycetes dan Bakteri Fotosintetik (Lampiran X.a). Adapun hasil kompos
dengan menggunakan aktivator EM4 yang diaplikasikan pada kompos pada
sebesar 15,80 (Lampiran X.b). Hasil penelitian lain terkait kompos dengan
menggunakan aktivator EM4 dilakukan dengan bahan baku jerami padi dalam
Suhartatik, dkk (2001); Gunarto, dkk (2002); Husein, E. dan Irawan (2008);
Nuraini (2009) dalam Juwita (2014), menyatakan bahwa kompos jerami memiliki
C/N rasio 11 (Lampiran XI.a). Menurut Indriyati (2006), jerami padi memiliki
beberapa kandungan sifat kimia yaitu selulosa (43-49%), hemiselulosa (23-28%),
lignin (12-16%), abu dan silika (Lampiran XI.b). Pada penelitian Yangoritha
(2013) menyatakan perlakuan yang menunjukkan hasil terbaik adalah dengan
aktivator EM4 yang dibandingkan dengan standar SNI kompos yang memiliki
C/N rasio 20,33 (Lampiran XI.c).
D. Hipotesis
Diduga penambahan bioaktivator dari MOL rumen sapi memiliki
pengaruh paling baik terhadap aktivitas dekomposer dan kualitas kompos kulit
28
III. TATA CARA PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Agrobioteknologi, Laboratorium
Tanah, Laboratorium Proteksi Fakultas Pertanian Universitas Muhammadiyah
Yogyakarta dan di Dusun Paten, Sumberagung, Jetis, Bantul Yogyakarta.
Penelitian ini dilakukan dari bulan Mei sampai bulan September 2016.
B. Bahan dan Alat Penelitian
Bahan – bahan yang digunakan dalam penelitian ini, antara lain kulit
kakao, EM4, MOL Bonggol Pisang, MOL Rebung dan Akar Bambu, MOL
Rumen Sapi dari RPH Groso (Lampiran XIV.a), gula jawa, Sukrosa / Dextrose,
agar, ekstrak kentang, ekstrak daging, aquades, pepton, desinfektan (alkohol
70%), ekstrak jerami, yeast ekstrak, K2HPO4, KH2PO4, KOH, (NH4)2SO4,
FeSO4.7H2O, MgSO4.7H2O, Glukosa, KCl, H2O (Aquades), NaOH 0,01 N,
Indikator Phenolptalein (PP), air, benih jagung, dedak, kapur dan kapas.
Alat – alat yang digunakan adalah dalam penelitian ini, yaitu aerator
(airpump), selang, wadah pembuatan MOL, tabung reaksi, erlenmeyer, beaker
gelas, gelas ukur, pengaduk, corong gelas, kertas saring, gelas arloji / botol
timbang, sendok, pisau, autoklaf, timbangan analitik, petridish, pH stik, jarum ose,
C. Metode Penelitian
Penelitian dilaksanakan menggunakan metode eksperimen yang disusun
dalam RAL (Rancangan Acak Lengkap) dengan rancangan percobaan faktor
tunggal yang terdiri dari empat perlakuan. Adapun perlakuannya sebagai yaitu (A)
MOL Bonggol Pisang 1 liter/ 25 kg, (B) MOL Rebung Bambu 1 liter/ 25 kg, (C)
MOL Isi Rumen Sapi 1 liter/ 25 kg, (D) Aktivator EM4 50 ml/ 25 kg (lay out pada
Lampiran II.a).
Masing-masing perlakuan diulang tiga kali, sehingga ada 12 unit
percobaan. Tiap unit percobaan berupa karung yang berisi masing – masing 25 kg
limbah kulit kakao. Setiap ulangan diambil tiga sampel yaitu pada bagian atas,
tengah, bawah (lay out pada Lampiran II.b).
D. Cara Penelitian
Pelaksanaan penelitian dibagi menjadi tiga tahap yaitu tahap persiapan,
tahap pelaksanaan, tahap pengambilan sampel dan analisis (Lampiran I).
1. Tahap Persiapan a. Pembuatan MOL
Persiapan pembuatan MOL dilakukan dengan cara menfermentasikan
bahan – bahan (bonggol pisang, rebung bambu dan rumen sapi) selama 15 hari.
Lama proses fermentasi bahan-bahan MOL kurang lebih 10-15 hari (Santosa,
1) MOL Bonggol Pisang
MOL bonggol pisang dibuat dengan cara mengambil bonggol pisang
berserta tanah rizhosfer di sekitar perakarannya. Bonggol pisang dipotong –
potong untuk memperkecil ukuran agar mudah terurai. Bonggol pisang yag sudah
dicacah kemudian dimasukkan ke dalam wadah dan dan didiamkan selama 4 hari.
Setelah itu disaring dan ditambahkan dengan gula jawa, air kelapa dan air cucian
beras, kemuidan semua dicampur sampai merata. Campuran bahan MOL tersebut
didiamkan selama 15 hari. Setelah 15 hari didiamkan atau difermentasikan
kemudian diperas dan diambil sarinya, air hasil fermetasi tersebut siap digunakan
sebagai MOL untuk bioaktivator.
2) MOL Rebung dan Akar Bambu
Pembuatan MOL rebung dilakukan dengan cara mengambil rebung dan
akar bambu disekitar perakaran rebung sedalam ±10 cm kebawah kemudian
rebung beserta rizhosfernya direndam dalam air selama 4 hari. Setelah 4 hari
perendaman air hasil rendaman tersebut digunakan sebagai bahan mol. Air hasil
rendaman tersebut dicampurkan ke dalam air cucian beras, air kelapa, dan gula
jawa yang sudah direbus terlebih dahulu dan didinginkan barulah dicampurkan
dengan air hasil rendaman tersebut. Setelah itu hasil campuran bahan – bahan
tersebut difermentasikan selama 15 hari disaring untuk memisahkan padatan dan
cairan MOL, kemudian setelah 15 hari barulah MOL rebung dapat digunakan
3) MOL Rumen Sapi
MOL rumen sapi dibuat dengan cara mengambil cairan dan padatan
kotoran pada usus sapi kemudian dicampurkan dengan air kelapa, air cucian beras
dan gula jawa. Pembuatan MOL rumen sapi dilakukan dengan memfermentasikan
campuran bahan – bahan MOL tersebut selama 15 hari. Setelah 15 hari
difermentasikan campuran bahan tersebut disaring, kemudian MOL rumen sapi
siap digunakan untuk bioaktivator.
Masing – masing bahan MOL yang digunakan dalam penelitian ini
sebanyak 3 kg ditambahkan 2,5 liter air kelapa, 2,5 liter air cucian beras dan 150
gram gula jawa (Isroi, 2015) dan masing – masing pembuatan MOL diulang tiga
kali kemudian jika sudah jadi ke tiga MOL tersebut dihomogenkan kemudian
baru diaplikasikan dalam pengomposan.
b. Isolasi dan Karakterisasi Mikroorganisme Lokal (MOL) (i) Sterilisasi
Semua alat yang digunakan (petridish, erlenmeyer, botol suntik)
dimasukkan ke dalam autoklaf dan disterilkan pada temperatur 121°C dengan
tekanan 1 atm selama 25 menit. Setalah steril, alat – alat tersebut dimasukkan
dalam ruang penyimpanan.
(ii) Pembuatan medium
Medium yang digunakan sebagai medium isolasi adalah medium
yang digunakan untuk perbanyakan dan perhitungan jumlah mikrobia adalah
medium Potato Dextrose Agar (PDA) untuk cendawan dan Nutrien Agar (NA)
untuk perbanyakan bakteri.
1) Medium Dickerman
Pembuatan medium Dickerman dimulai dengan menimbang bahan :
K2HPO4 (0,8 g), KH2PO4 (0,2 g), MgSO4.7H2O (0,2 g), Yeast Ekstrak (0,01 g),
(NH4)2SO4 (1 g), selulosa (20 g), agar (15 g), aquades 1000 ml dan pH 7. Larutan
tersebut kemudian dicampur dan dipanaskan hingga homogen lalu dimasukkan
dalam tabung reaksi dan Erlenmeyer. Selanjutnya medium disterilkan
menggunakan autoklaf pada temperatur 121° C dengan tekanan 1 atm selama 15
menit.
2) Medium Czapek
Pembuatan Czapek dimulai dengan menimbang bahan : (NH4)2SO4 (2 g),
KCl (0,5 g), MgSO4.7H2O (0,5 g), K2HPO4 (1 g), FeSO4.7H2O (0,001 g), selulosa
(10 g), aquades 1000 ml, agar (15 g) dan pH 6,4 – 7. Larutan tersebut kemudian
dicampur dan dipanaskan hingga homogen lalu dimasukkan dalam tabung reaksi
dan Erlenmeyer. Selanjutnya medium disterilkan menggunakan autoklaf pada
temperatur 121° C dengan tekanan 1 atm selama 15 menit.
3) Medium Potato Dextrose Agar (PDA)
Pembuatan medium Potato Dextrose Agar (PDA) dimulai dengan
mengupas kentang, kemudian kentang dipotong – potong dan ditimbang sebanyak
lembek sehingga menghasilkan ekstrak 1000 ml. Ekstrak kentang selanjutnya
disaring menggunakan penyaring. Setelah itu, sukrosa / dextrose 15 g dilarutkan
dalam aquades dalam ekstrak kentang. Larutan kemudian dipanaskan dalam
penangas air untuk mempercepat kelarutan dan ditambahkan agar 15 g. Larutan
dijadikan 1000 ml dengan menambahkan aquades, setelah itu larutan dimasukkan
dalam tabung reasksi, dan erlenmeyer. Selanjutnya larutan disterilkan dengan
autoklaf pada temperatur 121° C dengan tekanan 1 atm selama 15 menit.
4) Medium Nutrien Agar (NA)
Pembuatan medium Nutrien Agar dimulai dengan melarutkan ekstrak
daging 3 g dalam aquades dan pepton 5 g. Larutan dipanaskan dalam penangas air
untuk mempercepat kelarutan dan ditambahkan agar 15 g. Kemudian larutan
dijadikan 1000 ml dengan menambahkan aquades, setelah itu larutan dimasukkan
dalam tabung reaksi, dan erlenmeyer. Selanjutnya larutan disterilkan dengan
autoklaf pada temperatur 121° C dengan tekanan 1 atm selama 15 menit.
(iii) Isolasi dan Karakterisasi Mikroba Bioaktivator
Isolasi dilakukan pada masing – masing bioaktivator dari MOL Bonggol
Pisang, MOL Rebung Bambu, MOL Rumen Sapi, dan EM4. Isolasi dilakukan
dengan cara mengambil masing – masing 1 ml MOL, kemudian dimasukkan ke
dalam 99 ml air steril dan digojok. Suspensi masing – masing diambil 1 ose untuk
di streak pada medium Dickermam dan Czapek. Kemudian diinkubasi dalam
temperatur kamar selama 48 jam. Inokulasi dilakukan untuk memperbanyak isolat
mengambil suspensi sebanyak 0,1 ml untuk di surface diatas medium Dickerman
dan Czapek didalam petri dengan menggunakan drigalsky. Kemudian diinkubasi
secara terbalik dalam temperatur kamar selama 48 jam. Pada akhir inkubasi akan
tumbuh koloni cendawan dan bakteri pada masing – masing biaktivator dalam
medium. Selanjutnya dilakukan pemindahan cendawan pada medium PDA dan
bakteri pada medium NA dengan cara diambil 1 ose pada masing – masing koloni
untuk di streak pada masing – masing medium PDA (cendawan) dan NA (bakteri)
kemudian diinkubasi selama 24 – 48 jam. Setelah itu dilakukan identifikasi, jika
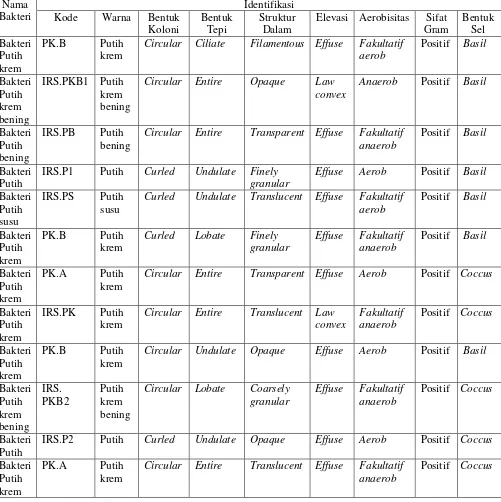
bakteri diamati bentuk koloni, elevasi, bentuk tepi, struktur dalam, sifat
aerobisitas (Lampiran XIV.c), bentuk sel dan sifat gram bakteri. Jika cendawan
diidentifikasi warna, diameter dan bentuk spora.
(iv) Pengamatan Perubahan Bau MOL selama Fermentasi
Pengamatan perubahan bau atau aroma MOL selama fermentasi dilakukan
setiap hari selama 15 hari sesuai dengan waktu fermentasi MOL. Pengamatan bau
dilaksanakan untuk mengetahui adanya tidaknya perubahan bau selama proses
fermentasi yang dilakukan dengan cara mencium bau atau aroma masing-masing
perlakuan MOL.
(v) Pengamatan Perubahan Warna MOL selama Fermentasi
Pengamatan perubahan warna pada masing-masing MOL dilakukan
dengan cara melihat warna awal sampai akhir. Pengamatan dilakukan setiap hari
2. Tahap Pelaksanaan
a. Pencacahan Kulit Kakao
Kulit kakao dicacah dengan menggunakan mesin pencacah terlebih dahulu
dengan ukuran ± 2 cm agar lebih mudah dalam proses dekomposisi (Lampiran
XVI.a).
b. Pengenceran Bioaktivator
Sebelum pengomposan dilakukan, maka bioaktivator harus diencerkan
terlebih dahulu kemudian baru ditambahkan pada bahan dasar yaitu kulit kakao.
Dosis penggunaan EM4 yaitu 1 liter untuk 1 ton bahan kompos atau setara dengan
1 ml untuk 1 kg bahan kompos dengan konsentrasi larutan 10 ml/ liter air.
Kebutuhan air untuk pengomposan 25 kg bahan adalah 5 liter sehingga kebutuhan
larutan untuk masing – masing perlakuan adalah 50 ml. Pada perlakuan
penggunaan MOL juga diencerkan yaitu 1 liter MOL dilarutkan dalam 4 liter air
(perhitungan kebutuhan air dan kebutuhan aktivator terlampir pada Lampiran III).
c. Pencampuran Bahan (Pengomposan)
Pengomposan dilakukan dengan cara pencampuran bahan yang berupa
kulit kakao sebanyak 25 kg, bioaktivator MOL, EM4 (sesuai dengan perlakuan
masing – masing) dengan bahan tambahan yaitu dedak 400 gram, 50 gram gula
jawa dan 100 gram kapur. Setelah semua sesudah tercampur bahan kompos
tersebut dimasukkan ke dalam karung (Lampiran XVI.a). Kemudian bahan
minggu. Selama proses penyimpanan setiap minggunya kompos tersebut
dikeluarkan dari dalam karung dan dibalik. Pengomposan ini dilakukan sesuai
perlakuan (Lampiran III) yaitu :
1) Pengomposan dengan MOL Bonggol Pisang
2) Pengomposan dengan MOL Rebung Bambu
3) Pengomposan dengan MOL Rumen Sapi
4) Pengomposan dengan EM4
3. Tahap Pengamatan, Pengambilan Sampel Dan Analisis
i. Pengamatan Harian
Pengamatan temperatur. Pengamatan ini dilakukan setiap hari
selama proses pengomposan berlangsung sampai 4 minggu. Pengukuran
temperatur dilakukan menggunakan alat Thermometer derajat Celcius (0C)
dengan melihat skala yang ditunjukan pada alat tersebut. Pengamatan
temperatur pada bahan kompos dilakukan dengan cara menancapkan
thermometer pada lapisan bahan kompos melalui tiga lubang dibagian sisi
tengah karung kompos. Cara pengambilan sampel dapat dilihat pada
Lampiran II.b.
ii. Pengamatan Per Tiga Hari
1) Penetapan tingkat kematangan berdasarkan kandungan serat: Tingkat
kematangan atau pelapukan bahan organik dibedakan berdasarkan tingkat
dekomposisi dari bahan (serat) tanaman asalnya. ke tiga macam tingkat
kematangan tersebut adalah : Fibrik, Hemik dan Saprik. Tingkat
minggu. Kematangan secara fisik pada bahan organik yang dikomposkan
dengan cara berikut: Mengambil segenggam bahan kompos, kemudian
diperas menggunakan telapak tangan secara pelan, sisa serat yang
tertinggal ditelapak tangan kemudian diamati dengan kriteria kematangan
kompos. Adapun ketentuannya adalah : Fibrik, kandungan serat yang
tertinggal dalam telapak tangan setelah diperas adalah ≥ ¾ bagian atau ≥
75%. Hemik, kandungan serat yang tertinggal dalam telapak tangan
setelah diperas adalah kurang dari tiga perempat sampai seperempat
bagian atau lebih ( < ¾ - ≥ ¼ atau 75% - ≥ 25%) dan Saprik kandungan
serat yang tertinggal dalam telapak tangan setelah diperas adalah kurang
dari seperempat bagian (< ¼ atau 25%).
2) Pengamatan warna: Pengamatan perubahan warna kompos menggunakan
Munsell Soil Color Chart (Lampiran XIII). Warna dinyatakan dalam tiga
satuan, yaitu Kilap (Hue), Nilai (Value), dan Kroma (Chroma). Menurut
nama yang tercantum dalam jalur yang bersangkutan, kilap berhubungan
dengan panjang gelombang cahaya, nilai berhubungan dengan
keberhasilan warna dan kroma adalah kemurnian relatif dari spectrum
warna. Jenis fibrik akan memperhatikan warna hitam muda (agak terang),
kemudian disusul hemik dengan warna agak gelap dan selanjutnya masuk
pada saprik yang berwarna hitam gelap. Perubahan warna diamati setelah
kompos berumur satu minggu, dengan pengamatan tiap tiga hari sekali
hingga minggu ke empat. Pengamatan warna pada bahan kompos
tengah dan bawah) kemudian diletakkan dibawah kertas munsell
menggunakan jari. Kemudian warna kompos tersebut dicocokkan dengan
warna – warna yang terdapat dalam lembaran buku Munsell Soil Color
Chart.
iii. Pengamatan Mingguan
1) Kadar Air (AOAC atau Analysis of Analytical Chemis1984). Pengukuran
kadar air bahan kompos dilakukan dengan mengambil sampel sebanyak ±5
gram. Cawan kosong ditimbang terlebih dahulu untuk mendapatkan berat
awal, kemudian cawan diberi bahan seberat 5 gram, hasil timbangan
cawan + bahan dicatat. Setelah itu cawan beserta bahan dioven hingga
bobotnya konstan (Lampiran XVII.a).
2) Pengukuran pH (AOAC 1995). Pengkuran derajat kemasaman
menggunakan pH stik. pH diukur dengan cara memasukan 2,5 g contoh
bahan kompos pada masing – masing perlakuan dengan ulangan cepuk,
kemudian ditambah 12,5 ml aquades. Setelah itu, cepuk ditutup dan
dikocok sampai homogen. Larutan didiamkan sampai mengendap selama
15 menit. Selanjutnya dicek menggunakan pH stik (Lampiran XVII.b).
3) Asam total (AOAC 1984). Total asam ditentukan oleh metode titrasi.
Sebanyak 20 g sampel dimasukkan ke dalam gelas kemudian
dihomogenkan dan disaring lalu dimasukkan ke dalam labu takar 250 ml
dan ditambahkan dengan aquades sampai tanda tera. Filtrat yang diperoleh
sebanyak 25 ml masing-masing dalam 3 kali ulangan, ditetesi dengan
dititrasi dengan larutan NaOH 0,01 N sampai terbentuk warna merah
muda yang stabil (Lampiran XVI.d).
4) Mikrobiologi (Cendawan dan Bakteri). Pengamatan mikrobiologi
cendawan dan bakteri pada bahan kompos dilakukan satu kali dalam
seminggu. Adapun langkah pengamatannya adalah dengan mengambil
satu gram bahan kompos kemudian dimasukkan pada 99 ml akuades,
kemudian dilakukan pengenceran hingga 10-9. Variabel yang diamati
adalah jumlah cendawan maupun bakteri dari masing – masing perlakuan.
Metode perhitungan jumlah mikroba dengan menggunakan metode plate
count pada medium NA dan PDA dengan seri pengenceran 10-7, 10-8, 10-9
(Lampiran XVI.b) dengan memenuhi syarat sebagai berikut :
a) Jumlah koloni tiap cawan petri antara 30-300 koloni (CFU/ml)
b) Tidak ada koloni yang menutupi lebih dari setengah luas cawan
(Spreader) perbandingan jumlah koloni dari pengenceran
berturut – turut antara pengenceran yang lebih besar dengan
pengenceran sebelumnya. Jika sama atau lebih kecil dari 2 maka
hasilnya dirata – rata, dan jika lebih besar dari 2 maka yang
dipakai adalah jumlah dari hasil pengenceran sebelumnya.
c) Jika ulangan telah memenuhi syarat maka hasilnya dirata – rata.
iv. Analisis Hasil (Akhir)
1) Analisis Hasil Kompos (Akhir). Setelah minggu ke empat pembuatan
kompos, pengambilan sampel kompos kulit kakao dari masing – masing
beberapa titik, yaitu bagian atas, tengah dan bawah. Analisis akhir pada
hasil pengomposan yaitu analisis kadar karbon (C), bahan organik
(BO), kadar nitrogen (N), serta C/N rasio. Data pengamatan yang
diperoleh kemudian dianalisis untuk melihat perbedaan diantara
perlakuan.
2) Uji kematangan kompos pada perkecambahan. Untuk menguji
kematangan kompos, maka dilakukan uji perkecambahan pada benih
jagung disetiap perlakuannya. Sebelum pengujian, benih direndam
dalam air terlebih dahulu. Pengujian dilakukan dengan cara meletakkan
pada petridish yang telah diisi masing – masing kompos sebagai
medium. Setiap petridish diletakkan masing – masing 20 benih. Pada
saat yang bersamaan dikecambahkan juga masing – masing benih pada
kapas basah. Pengujian dilakukan selama 5 hari dengan menghitung
presentase daya berkecambah pada masing – masing benih. Rancangan
uji perkecambahan dapat dilihat pada Lampiran II bagian d.
3) Uji persentase ukuran partikel kompos. Untuk menguji persentase
ukuran kompos dilakukan dengan saringan berdiameter 2 mm. Kompos
ditimbang sebanyak 100 gram kemudian disaring menggunakan
saringan berdiameter 2 mm, jumlah yang lolos kemudian ditimbang dan
E. Parameter yang diamati
Parameter yang diamati dalam penelitian ini meliputi pengamatan
perubahan mikrobiologi, perubahan fisik dan perubahan kimia selama proses
dekomposisi.
1. Pengamatan mikrobiologi selama proses dekomposisi
Pengujian mikrobiologi bertujuan guna mengetahui dinamika aktivitas
populasi mikroba selama proses dekomposisi. Pengamatan mikrobiologi
dilakukan dengan metode total plate count-surface platting untuk menghit