ABSTRAK
PEMBUATAN KATALIS Fe3O4 DENGAN METODE SOL-GEL DAN UJI AKTIVITASNYA UNTUK REAKSI KONVERSI CO2 MENJADI
METANOL Oleh
Sarah Aliana
Seiring dengan semakin meningkatnya pemanasan global sebagai akibat dari efek reumah kaca, mendorong pengembangan teknologi untuk mengurangi kadar gas CO2 di udara. Salah satu cara yang menjanjikan adalah dengan reaksi konversi gas CO2 menjadi metanol. untuk mendukung reaksi konversi tersebut, berbagai jenis katalis telah dikembangkan. Maka pada kesempatan ini dilakukan pembuatan katalis dengan logam aktif Fe dalam bentuk oksidanya dengan metode sol-gel
Metode pembuatan Fe3O4 yang dilakukan pada penelitian ini merupakan pengembangan dari dua metode penelitian sebelumnya, diawali dengan pembuatan katalis Fe2O3 dengan metode sol-gel kemudian disertakan perlakuan reduksi untuk mengkonversinya menjadi Fe3O4. Katalis yang telah dibuat dikarakterisasi dengan Spektrofotometer Infra Merah (IR) untuk mengevaluasi keasaman katalis, untuk melihat struktur kristal dan analisis fasa katalis dianalisis menggunakan X-Ray Difraktometer (XRD), untuk melihat morfologi permukaan dan analisis komposisi unsur permukaan sampel katalis menggunakan Scanning Electron Microscope-Energy Dispersive X-Ray Spectrometer (SEM-EDX), serta
hasil uji aktivitas katalis diukur dengan menggunakan Kromatografi Gas.
I. PENDAHULUAN
A. Latar Belakang
Dalam beberapa dasawarsa terakhir ini, masalah lingkungan hidup seperti
pemanasan global telah menjadi pusat perhatian masyarakat dunia karena
dampak negatif yang ditimbulkan bersifat global. Seiring dengan semakin
meningkatnya pemanasan global sebagai akibat dari efek rumah kaca,
mendorong pengembangan teknologi untuk mengurangi kadar gas CO2 di udara. Salah satu cara yang menjanjikan adalah dengan reaksi konversi gas
CO2 menjadi metanol dan senyawa hidrokarbon lain seperti etanol, alkana,
alkena, dan asam karboksilat. Reaksi konversi sangat menjanjikan karena
tidak hanya dapat mengurangi dampak buruk keberadaan gas CO2, tetapi juga
karena metanol merupakan bahan baku utama untuk menghasilkan beberapa
senyawa organik seperti formaldehida, alkilhalida, dan asam asetat. Proses
konversi tersebut membutuhkan katalis. Oleh karena itu, untuk mendukung
reaksi konversi tersebut, berbagai jenis katalis telah dikembangkan (Joep et
al., 2004).
Secara umum diketahui bahwa karakteristik suatu katalis sangat ditentukan
oleh tiga faktor, yakni jenis logam, penyangga katalis, dan metode preparasi.
Berdasarkan faktor tersebut, beberapa jenis logam telah diteliti untuk
logam Ni dengan konversi gas CO2 menjadi metanol mencapai 84% pada
temperatur 500oC (Kim et al., 1994).
Berdasarkan fakta tersebut, maka pada kesempatan ini dilakukan pembuatan
katalis dengan logam aktif Fe dalam bentuk oksidanya dengan metode sol-gel.
Katalis Fe diketahui telah digunakan secara luas karena dapat lebih
meningkatkan produksi metanol (Haider et al., 2009). Berdasarkan
mekanisme reaksi Fischer-Tropsch dengan Fe sebagai logam aktif (Blanchard
et al., 1982), tingkat oksidasi logam Fe mempengaruhi aktivasi logam Fe
dalam reaksi tersebut. Selain itu, diketahui bahwa logam Fe dalam bentuk
Fe3O4 lebih aktif bila dibandingkan dengan logam Fe pada keadaan tingkat
oksidasinya +2.
Pembuatan katalis dengan metode sol-gel mempunyai beberapa keunggulan,
yaitu distribusi situs aktif akan tersebar secara merata sehingga dihasilkan
katalis yang bersifat homogen, kemudian tekstur porinya memberikan
kemudahan difusi dari reaktan untuk masuk ke dalam situs aktif (Lecloux and
Pirard., 1998). Atas dasar beberapa keunggulan tersebut, maka metode yang
dipilih untuk pembuatan katalis Fe3O4 pada penelitian kali ini adalah metode sol-gel.
Metode pembuatan Fe3O4 yang dilakukan pada penelitian ini merupakan
pengembangan dari dua penelitian sebelumnnya. Pada penelitian yang
dilakukan Cao et al., (1997), Fe2O3 dapat dikonversi menjadi Fe3O4 dengan
senyawa Fe(CO)5. Sedangkan pada penelitian yang dilakukan Akbar et al.,
(2004), pembuatan katalis nanopartikel Fe2O3 dilakukan dengan metode sol-gel menggunakan senyawa Fe(NO3)3.9H2O. Oleh karena itu, pada
penelitian ini dilakukan pembuatan katalis Fe2O3 menggunakan senyawa Fe(NO3)3.9H2O dengan metode sol-gel seperti pada penelitian yang dilakukan oleh Akbar et al., (2004) dan disertakan perlakuan seperti pada penelitian Cao
et al., (1997), tetapi gas yang digunakan untuk mengkonversi Fe2O3 menjadi Fe3O4 adalah gas H2.
Aspek lain yang terkait dengan pemanfaatan katalis adalah adanya hubungan
antara unjuk kerja dan karakteristiknya. Atas dasar ini, katalis yang dibuat
dikarakterisasi dengan beberapa metode untuk merumuskan hubungan antara
reaktivitas dan karakteristik katalis. Katalis yang telah dibuat dikarakterisasi
dengan Spektrofotometer Infra merah (IR) untuk mengevaluasi keasaman
katalis, untuk melihat struktur kristal dan analisis fasa katalis dianalisis
menggunakan X-Ray Difraktometer (XRD), untuk melihat morfologi permukaan dan analisis komposisi unsur permukaan sampel katalis
menggunakan Scanning Electron Microscope-Energy Dispersive X-Ray
Spectrometer (SEM-EDX), serta hasil uji aktivitas katalis diukur dengan
menggunakan Kromatografi Gas.
Berdasarkan paparan di atas, maka pada kesempatan ini dipelajari pembuatan
katalis Fe3O4 dengan metode sol-gel dan aplikasinya dalam mengkonversi
CO2 menjadi metanol, untuk menjawab beberapa masalah, meliputi (1) apakah Fe2O3 yang dibuat dari senyawa Fe(NO3)3.9H2O dengan metode
mereduksinya menggunakan gas H2, (2) apakah Fe3O4 yang dihasilkan
memiliki unjuk kerja terhadap konversi gas CO2 menjadi metanol.
B. Tujuan Penelitian
Sesuai dengan latar belakang yang telah dipaparkan di atas, penelitian ini
dilakukan dengan tujuan untuk mempelajari perilaku katalis Fe3O4 dengan metode sol-gel, dan untuk mengetahui aktivitasnya pada proses konversi gas
CO2 menjadi metanol pada temperatur 100, 200, 300, dan 400 oC.
C. Manfaat Penelitian
Dari penelitian ini diharapkan akan diperoleh pengetahuan tentang pembuatan
katalis Fe3O4 dengan metode sol-gel terhadap karakteristiknya dalam konversi gas CO2 menjadi metanol dan memberikan masukan untuk riset
II. TINJAUAN PUSTAKA
A. Penanganan CO2
Akhir-akhir ini, kegiatan manusia dalam kehidupan modern telah
mengganggu komposisi udara yang menyebabkan masalah-masalah
lingkungan yang cukup serius, seperti hujan asam dan pemanasan global.
Pemanasan global adalah istilah yang digunakan untuk menjelaskan
terjadinya kenaikan suhu atmosfir bumi secara bertahap. Dewasa ini
pemanasan global menjadi isu internasional karena selain mengakibatkan
terjadinya kenaikan suhu sebagai dampak langsung, pemanasan global
ternyata juga mengakibatkan terjadinya perubahan iklim di permukaan bumi.
Pemanasan global merupakan dampak dari gas rumah kaca yang terdiri dari
karbon dioksida, metana, dinitrogen oksida, dan senyawa fluorin seperti
hidrofluorokarbon, perfluorokarbon, serta sulfur heksafluorida, karena gas
tersebutlah yang paling dianggap sebagai penyebab pemanasan global. Dari
berbagai jenis gas rumah kaca tersebut, gas CO2 mendapat perhatian paling besar (World Health Organization (WHO), 2003).
Secara garis besar, gas CO2 di atmosfir bumi berasal dari dua sumber utama,
secara umum sebagai siklus karbon. Dalam siklus ini, gas CO2 dilepaskan ke
atmosfir ketika tanaman maupun hewan melakukan proses respirasi, yakni
proses oksidasi nutrien menghasilkan gas CO2 dan energi. Gas CO2 yang
dilepaskan oleh tanaman dan hewan selanjutnya akan diserap oleh tanaman
ketika tanaman melakukan proses fotosintesis. Dengan adanya siklus tersebut,
jumlah gas CO2 di atmosfir secara praktis dapat dianggap tetap.
Gas CO2 merupakan gas dengan kestabilan yang tinggi serta memiliki kapasitas panas yang cukup besar, yakni 37 J K-1 mol-1. Kapasitas panas ini
menunjukkan bahwa molekul gas CO2 mempunyai kemampuan untuk menyimpan panas (kalor) dalam jumlah yang cukup besar. Hal ini berarti
pula bahwa jika gas CO2 melepaskan kalor yang dikandungnya ke lingkungan
sekitarnya akan mengakibatkan kenaikan suhu lingkungan yang cukup berarti.
Dua sifat yang dipaparkan di atas merupakan alasan utama mengapa gas CO2
bersifat sebagai gas rumah kaca penyebab pemanasan global (National
Research Council (NRC), 2001).
Pemanasan global terjadi akibat jumlah gas CO2 di atmosfir telah melebihi
jumlah yang diperlukan oleh siklus karbon. Gas CO2 di udara telah meningkat sekitar 30% akibat dari kegiatan manusia sejak awal revolusi
industri (Ikhsan dkk., 2008). Tindakan manusia dalam mengkonversi lahan
secara besar-besaran, baik untuk perluasan sektor pertanian, permukiman, dan
kawasan industry telah menggusur lahan lestari sehingga jumlah tanaman
yang dibutuhkan untuk menyerap gas CO2 dari atmosfir menurun tajam. Sektor industri membutuhkan energi dalam jumlah sangat besar, yang salah
minyak bumi dan batubara. Penggunaan kedua jenis bahan bakar di atas akan
menghasilkan gas CO2 dalam jumlah yang sangat besar dan diemisikan ke atmosfir. Penggunaan bahan bakar fosil yang sangat luas, telah menyebabkan
kenaikan konsentrasi gas CO2 dan gas rumah kaca yang lain di udara.
Salah satu usaha memperkecil masalah tersebut adalah dengan penggunaan
bioenergi sebagai pengganti bahan bakar fosil sehingga dapat mengurangi
emisi gas CO2. Meskipun penggunaan bioenergi telah banyak dikembangkan, namun ternyata penggunaan bahan bakar fosil belum sepenuhnya
ditinggalkan. Oleh karena itu, tantangan selanjutnya adalah bagaimana
menyikapi emisi gas CO2 yang tetap dihasilkan sehingga tidak menyebabkan masalah lingkungan. Dalam usaha menjawab tantangan tersebut, salah satu
gagasan yang dari dulu telah dilakukan adalah dengan mengkonversi gas
CO2 menjadi senyawa hidrokarbon contohnya metanol melalui reaksi
katalitik (Kim et al., 1994)
Konversi gas CO2 yang terjadi dimungkinkan berdasarkan reaksi sebagai
berikut:
→
Reaksi diatas sebenarnya melibatkan beberapa tahapan, yaitu difusi reaktan
ke permukaan katalis yang berlangsung cepat, disusul dengan penyerapan
(adsorbsi) reaktan pada permukaan katalis.
Penyerapan (adsorbsi) reaktan pada permukaan katalis diikuti dengan difusi
reaktan ke situs aktif katalis. Tahap selanjutnya yaitu terjadi reaksi dari spesi
yang diserap, menghasilkan produk, yang selanjutnya terjadi pelepasan
(desorpsi) produk dari permukaan katalis.
(Nakatsuji and Hu, 1999)
Akibat terjadinya adsorpsi kimia, aktivitas molekul mengalami perubahan.
Atom yang teradsorpsi menjadi lebih reaktif dibandingkan molekul bebasnya,
karena mengalami pemutusan ikatan kovalen atau ikatan hidrogen. Proses
adsorpsi menyebabkan berkurangnya energi bebas (G) sistem sehingga
entropi (S) juga berkurang. Berdasarkan persamaan 1,
∆G = ∆H –T . ∆S ... 1)
maka dapat dikatakan bahwa proses adsorpsi tersebut adalah eksotermik
(Adamson, 1990).
Dalam suatu reaksi katalitik, katalis merupakan kebutuhan utama. Oleh
karena itu, pengembangan katalis masih dilakukan dewasa ini dalam upaya
B. Katalis
Katalis merupakan zat yang mampu meningkatkan laju suatu reaksi kimia
untuk meningkatkan rendemen produk. Dalam suatu reaksi sebenarnya
katalis ikut terlibat, tetapi pada akhir reaksi terbentuk kembali seperti
bentuknya semula. Dengan demikian, katalis tidak memberikan tambahan
energi pada sistem dan secara termodinamika tidak dapat mempengaruhi
keseimbangan. Katalis mempercepat reaksi dengan cara menyediakan
mekanisme alternatif yang mempunyai energi aktivasi lebih rendah. Katalis
menyediakan situs-situs aktif yang berperan dalam proses reaksi. Situs-situs
aktif ini dapat berasal dari logam-logam yang terdeposit pada pengemban
atau dapat pula berasal dari pengemban sendiri. Logam-logam tersebut
umumnya adalah logam-logam transisi yang menyediakan orbital d kosong
atau elektron tunggal yang akan disumbangkan pada molekul reaktan
sehingga terbentuk ikatan baru dengan kekuatan ikatan tertentu (Campbell,
1998).
Katalis dapat berwujud gas, cair, atau padat. Berdasarkan perbedaan fasa dari
katalis yang digunakan dengan fasa reaktannya, maka katalis dapat
dikelompokkan ke dalam dua kelompok besar, yaitu katalis homogen dan
katalis heterogen.
1. Katalis Homogen
Katalis homogen merupakan katalis yang mempunyai fasa yang sama
menjadi nitrogen (N2) dan oksigen (O2) menggunakan katalis nitrogen
pentaoksida (N2O5) dimana O3 dan N2O5 ada dalam fase yang sama (gas).
2. Katalis Heterogen
Katalis heterogen merupakan katalis yang mempunyai fasa yang berbeda
dengan fasa reaktan yaitu katalis yang digunakan dalam fasa padat yang
dapat mengikat sejumlah reaktan dalam fasa cair atau gas pada
permukaannya berdasarkan adsorpsi dan akhirnya menghasilkan produk.
Misalnya pada reaksi dekomposisi senyawa fenol (cair), katalis yang
dapat digunakan adalah Fe(III)-HY (padat) (Noorjahan et al., 2005)
karena fasa keduanya berbeda maka katalis Fe(III)-HY merupakan katalis
heterogen.
Dari kedua kelompok katalis yang telah dipaparkan di atas, katalis heterogen
merupakan sistem katalis yang luas digunakan dalam bidang industri. Hal ini
dikarenakan katalis heterogen memiliki banyak keunggulan dibandingkan
dengan katalis homogen, antara lain: dapat digunakan pada suhu tinggi
sehingga dapat dioperasikan pada berbagai kondisi (Andriani, 2005),
kemudahan pemisahan katalis dari campuran reaksi, kemudahan untuk
digunakan dalam berbagai media, dan penggunaan ulang katalis (Moffat,
1990; Frenzer and Maier, 2006). Persyaratan utama suatu katalis heterogen
adalah permukaan yang aktif dan mampu menyerap (adsorpsi) reaktan.
Situs-situs aktif memegang peranan utama dalam proses katalitik. Dalam
pembuatan katalis, pemilihan situs yang tepat akan menghasilkan suatu
maupun bahan mineral sintetik maupun semi sintetik. Logam-logam tersebut
umumnya adalah logam-logam transisi yang menyediakan orbital d kosong
atau elektron tunggal yang akan disumbangkan pada molekul reaktan
sehingga terbentuk ikatan baru dengan kekuatan ikatan tertentu (Campbell,
1998).
Berdasarkan fakta tersebut, maka pada penelitian ini akan dilakukan
pembuatan katalis heterogen dengan logam aktif Fe dalam bentuk oksidanya
dengan metode sol-gel. Katalis Fe diketahui telah digunakan secara luas
karena dapat lebih meningkatkan produksi metanol (Haider et al., 2009).
Berdasarkan mekanisme reaksi Fischer-Tropsch dengan Fe sebagai logam
aktif (Blanchard et al., 1982), tingkat oksidasi logam Fe mempengaruhi
aktivasi logam Fe dalam reaksi tersebut. Selain itu, diketahui bahwa logam
Fe dalam bentuk Fe3O4 lebih aktif bila dibandingkan dengan logam Fe pada
keadaan tingkat oksidasinya +2.
Beberapa tahun terakhir, Fe3O4 menjadi bahan kajian yang menarik perhatian para ahli karena peluang aplikasinya yang luas. Dilaporkan bahwa Fe3O4
memiliki aplikasi pada bidang industri seperti; keramik, katalis, ferofluida,
serta biomedis (Bakar et al., 2007). Bahkan kajian mutakhir yang sampai
detik ini masih terus dikembangkan adalah pemanfaatan Fe3O4 pada sistem penyebaran obat-obatan dalam tubuh manusia atau yang biasa dikenal dengan
Drug Delivery System (DDS) (Iida et al., 2007).
magnetit mempunyai struktur kristal spinel dengan sel unit kubik yang terdiri
dari 32 ion oksigen, dimana celah-celahnya ditempati oleh ion Fe2+ dan ion Fe3+. Delapan ion Fe3+ dalam tiap sel berada pada bagian tetrahedral, karena
berlokasi di tengah sebuah tetrahedron yang keempat sudutnya ditempati ion
oksigen. Sisanya delapan ion Fe3+ dan delapan ion Fe2+ berada pada bagian oktahedral, karena ion-ion oksigen sekitarnya menempati sudut-sudut sebuah
oktahedron yang sudut-sudutnya ditempati oleh enam atom oksigen (Perdana
F.A., 2010).
C. Metode Preparasi Katalis
Karakteristik katalis sangat dipengaruhi metode preparasi yang digunakan.
Pemilihan metode preparasi yang tepat akan memberikan karakteristik katalis
yang diinginkan seperti mempunyai aktivitas, selektivitas dan stabilitas yang
tinggi. Tujuan utama dari metode preparasi katalis adalah mendapatkan
struktur definit, stabil, mempunyai luas permukaan yang tinggi dan situs aktif
yang lebih terbuka.
Dewasa ini ada beberapa metode preparasi katalis yang dikenal, yaitu
sonochemical, ultrasonic spray pyrolysis, microwave plasma (Grabis et al.,
2008), co-precipitation (Sun et al., 2006), dan salah satunya adalah sol-gel.
1. Metode Sol-gel
Sol-gel adalah suatu suspensi koloid dari partikel yang digelkan ke
bentuk padatan. Proses ini melibatkan perubahan jaringan-jaringan
anorganik melalui reaksi polimerisasi kondensasi. Pada proses sol-gel,
sol merupakan partikel halus dari senyawa hidroksida atau senyawa
oksida logam dalam suatu larutan. Sol selanjutnya mengalami proses
gelasi untuk membentuk jaringan dalam suatu fasa cair yang kontinyu,
sehingga terbentuk gel (Sopyan dkk, 1997).
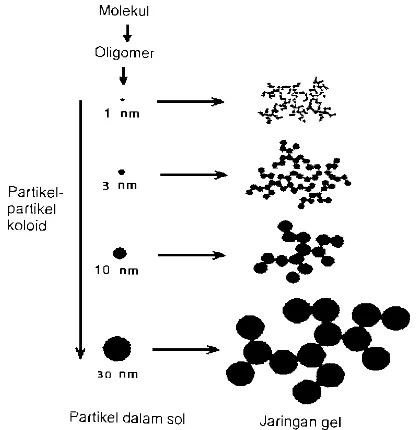
Proses yang mungkin terjadi pada saat sol mengalami proses gelasi
membentuk suatu gel, disajikan pada Gambar 2.
Pada proses sol-gel, suhu berpengaruh pada kecepatan pembentukan gel.
Proses sol-gel yang dilakukan pada suhu lebih tinggi dari suhu kamar
menyebabkan laju hidrolisis yang lebih cepat sehingga pembentukan gel
terjadi lebih cepat (Meacanizie and Ultrych, 1984).
Metode sol-gel digunakan secara luas dalam pembuatan katalis
berpendukung logam. Dalam penelitian ini, metode sol-gel dipilih
karena metode ini diketahui memiliki sejumlah keunggulan dibandingkan
dengan metode lain. Keuntungan dari metode ini meliputi : dispersi yang
tinggi dari spesi aktif yang tersebar secara homogen pada permukaan
katalis, tekstur porinya memberikan kemudahan difusi dari reaktan untuk
masuk ke dalam situs aktif (Lecloux and Pirard, 1998), luas permukaan
yang cukup tinggi (Lambert and Gonzalez, 1998), produk yang
dihasilkan memiliki kehomogenan dan kemurnian yang tinggi, tidak
bereaksi dengan senyawa sisa (Lambert and Gonzalez, 1998), dan suhu
pengerjaan relatif rendah sehingga kehilangan bahan akibat penguapan
dapat diperkecil (Jamarun, 2000).
Metode sol-gel yang dilakukan pada penelitian ini, merujuk pada
penelitian sebelumnya yang telah dilakukan oleh Akbar et al (2004),
yaitu menggunakan senyawa Fe nitrat (Fe(NO3)3.9H2O) dan asam sitrat dalam pelarut air. Dari metode sol-gel tersebut, akan diperoleh Fe2O3 yang kemudian diberi perlakuan dengan mengalirkan gas H2 sehingga
2. Pengeringan dan kalsinasi
Pengeringan umumnya dilakukan di dalam oven dengan temperatur
rendah. Pada saat pengeringan berlangsung, volume pelarut semakin
berkurang sehingga sedikit demi sedikit gel menyusut atau berkondensasi.
Dalam gel yang belum dikeringkan, partikel-partikel kecil hasil
kondensasi atau reaksi berikatan saling-silang membentuk struktur
jaringan dimana di dalam struktur tersebut terdapat pori-pori yang
dipenuhi oleh pelarut. Ketika gel dikeringkan, proses hilangnya pelarut
dimulai dari ukuran pori yang besar dan selanjutnya ke pori yang kecil
hingga akhirnya terbentuk gel yang bebas pelarut. Oleh karena itu pada
prinsipnya, pengeringan dilakukan dengan tujuan untuk menghilangkan
cairan sebelum dikonversi ke produk akhir melalui tahapan kalsinasi.
Kalsinasi dilakukan pada temperatur tinggi dengan tujuan untuk
mendekomposisi komponen prekursor. Pada penelitian ini, kalsinasi
akan dilakukan sampai temperatur 350oC dalam lingkungan oksigen untuk membentuk fase oksidanya (Pinna, 1998). Aspek lain yang terkait
dengan pemanfaatan katalis adalah adanya hubungan antara unjuk kerja
dan karakteristiknya.
D. Karakterisasi Katalis
Aspek lain yang terkait dengan pemanfaatan katalis adalah adanya hubungan
antara unjuk kerja dan karakteristiknya, karena hubungan tersebut
Karakterisasi katalis dilakukan untuk mendapatkan sifat-sifat katalis meliputi
sifat fisik dan sifat kimia. Sifat fisik antara lain adalah luas permukaan, volum
pori, diameter pori, kekerasan dan distribusi logam. Karakterisasi kimia
antara lain adalah jumlah kandungan logam, keasaman, kristalinitas dan
ikatan kimia. Pada penelitian ini karakterisasi kimia ditinjau yaitu kristalinitas,
morfologi permukaan dan keasaman dari katalis yang dibuat.
1. Keasaman Katalis
Keasaman suatu katalis memegang peranan yang cukup penting dalam
mempengaruhi aktivitas katalis. Keasaman suatu katalis dapat diukur
dengan menghitung jumlah asam atau basa yang teradsorpsi secara kimia
(kemisorpsi) dalam fase gas oleh katalis. Basa yang dapat digunakan
sebagai adsorbat sebagai penentu keasaman katalis antara lain adalah
NH3, piridin, piperidin, quinolin, trimetil amin dan pirol (Richardson,
1989). Pada penelitian ini basa yang digunakan adalah piridin dengan
asumsi bahwa ukuran molekul piridin yang relatif besar sehingga hanya
dapat teradsorbsi pada permukaan katalis (Rodiansono et al., 2007).
Metode yang biasa dipakai untuk mengukur keasaman atau kebasaan
suatu katalis adalah metode gravimetri, yaitu dengan menghitung daya
adsorpsi katalis terhadap basa ataupun asam adsorbat. Banyaknya mol
basa yang teradsorbsi pada situs asam menyatakan kekuatan asam dari
katalis (Richardson, 1989).
Pada penelitian ini sifat keasaman dari katalis kemudian dievaluasi untuk
2. Spektroskopi Infra Merah
Metode yang biasa dipakai untuk mengukur keasaman katalis adalah
metode gravimetri dan metode spektrofotometri inframerah. Pada metode
gravimetri dapat diukur jumlah gas yang teradsorpsi pada permukaan
katalis. Sedangkan pada metode spektrofotometri inframerah, dari
spektra yang dihasilkan dapat diketahui jenis situs asam
(Bronsted-Lowry atau Lewis) yang terdapat dalam katalis. Jenis situs
asam tersebut dapat diketahui melalui puncak-puncak serapan yang
dihasilkan dari interaksi basa adsorbat dengan situs–situs asam tersebut.
Pada penggunaan piridin sebagai basa adsorbat, situs asam
Bronsted-Lowry akan ditandai dengan puncak serapan pada
bilangan-bilangan gelombang 1485-1500, ~1620, dan ~1640 cm-1. Sedangkan untuk situs asam Lewis ditandai dengan puncak-puncak
serapan pada bilangan-bilangan gelombang 1447-1460, 1448-1503,
~1580, dan 1600-1633 cm-1 (Tanabe,1981).
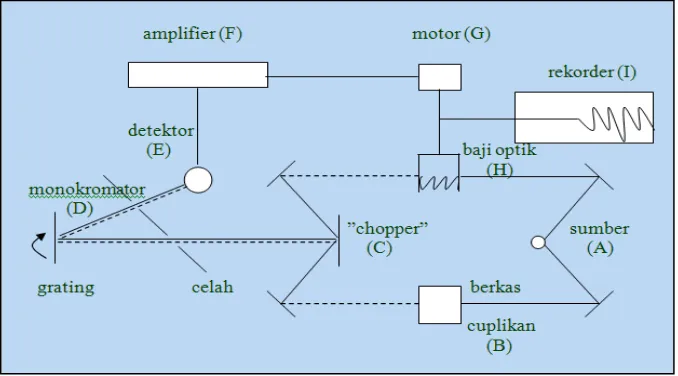
Berdasarkan Gambar 3, prinsip kerja spektrofotometer IR adalah sebagai
berikut: sinar dari sumber (A) dibagi menjadi dua berkas, yakni satu
berkas (B) melalui cuplikan (berkas cuplikan) dan satu berkas lainnya (H)
sebagai baku. Kedua berkas itu dipantulkan oleh chopper (C) yang
berupa cermin berputar (~10 x per detik). Hal ini menyebabkan berkas
cuplikan dan berkas baku dipantulkan secara bergantian ke kisi difraksi
(D). Kisi difraksi berputar lambat, dan setiap frekuensi dikirim ke
Jika pada suatu frekuensi cuplikan menyerap sinar, detektor akan
menerima intensitas berkas baku yang besar dan berkas cuplikan yang
lemah secara bergantian. Hal ini menimbulkan arus bolak-balik dalam
detektor lalu akan diperkuat oleh amplifier. Arus bolak-bolak yang
terjadi digunakan untuk menjalankan suatu motor (G) yang dihubungkan
dengan suatu alat penghalang berkas sinar yang disebut baji optik (H).
Gerakan baji dihubungkan pena alat rekorder (I) sehingga gerakan baji
ini merupakan pita serapan pada spektra (Sudjadi, 1983).
Daerah infra merah dari spektrum elektromagnetik terdiri dari panjang gelombang antara 0,7 dan 500 m atau pada bilangan gelombang 14000
cm-1 sampai 20 cm-1. Daerah spektra yang menjadi perhatian untuk
analisis kimia berada dalam mid-infra merah yang frekuensinya meliputi
bilangan gelombang 4000 cm-1 sampai 200 cm-1 atau 2,5 m sampai 50 m (Willard et al., 1988).
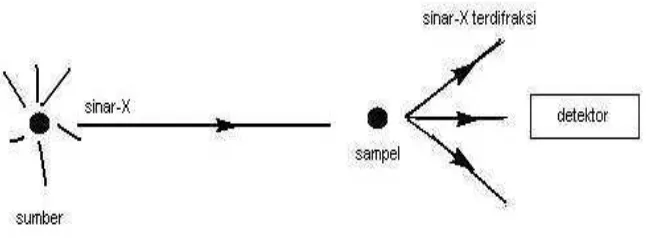
3. X-Ray Diffraction (XRD)
Karakterisasi struktur kristal dan fasa kristalin dapat ditentukan dengan
alat difraktometer sinar-X (XRD) karena setiap fasa kristal memiliki sifat
pola difraksi sinar-X spesifik yang dapat digunakan sebagai jejak
(fingerprint) untuk identifikasinya. Penampakan tiga dimensi suatu bahan
bukan amorf diperlihatkan secara jelas dan teratur berdasarkan
pengulangan lapisan permukaan atom yang membentuk kisi kristal.
Ketika berkas sinar-X berinteraksi dengan lapisan permukaan kristal,
sebagian sinar-X ditransmisikan, diserap, direfleksikan dan sebagian lagi
dihamburkan serta didifraksikan. Pola difraksi yang dihasilkan analog
dengan pola difraksi cahaya pada permukaan air yang menghasilkan
sekelompok pembiasan.
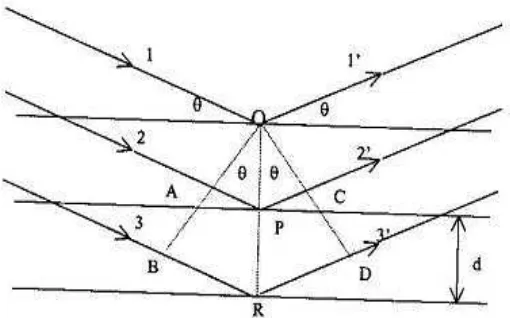
Sinar-X yang didifraksikan oleh setiap kristal mineral bersifat spesifik,
dan bergantung bagaimana atom menyusun kisi kristal mineral tersebut
serta bagaimana atom sejenis tersusun. Ketika sinar-X menumbuk
kristal dapat ditentukan berdasarkan hukum Bragg pada Persamaan 2,
yaitu :
n = 2 d sin Ө ………. 2)
n adalah bilangan bulat dan merupakan tingkat difraksi sinar-X, adalah
panjang gelombang yang dihasilkan oleh katoda yang digunakan, seperti Cu Kα = 1,5414 Å, sedangkan d merupakan jarak antara batas lapisan
permukaan, dan Ө merupakan sudut difraksi sinar-X terhadap permukaan
kristal.
Selanjutnya, secara kualitatif ditentukan struktur kristal atau fasa kristal
yang dapat dilakukan dengan cara sederhana, yaitu dengan cara
membandingkan nilai d atau 2ϴ yang terukur dengan nilai d atau 2ϴ
pada data standar. Data standar didapat melalui Joint Committee On
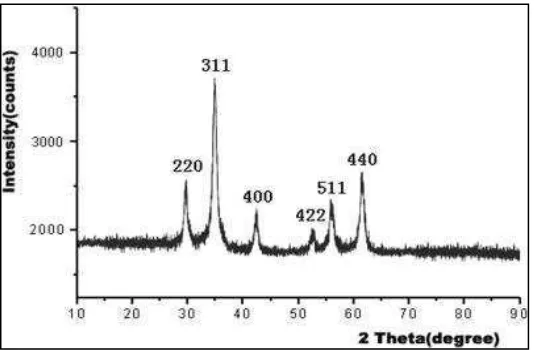
Powder Diffraction Standard (JCPDS). Gambar 6 menunjukkan
difraktogram dari nanopartikel Fe3O4 murni.
4. Scanning Electron MicroscopeEnergy Dispersive X-Ray Spectrometer
(SEM-EDX)
Untuk melakukan karakterisasi material yang heterogen pada permukaan
bahan pada skala mikrometer atau bahkan submikrometer serta
menentukan komposisi unsur sampel secara kualitatif maupun kuantitatif
dapat dilakukan dengan menggunakan satu perangkat alat SEM
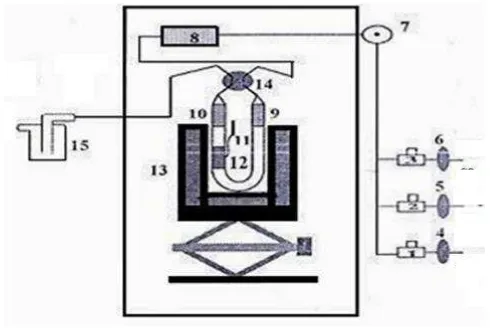
(Scanning Electron Microscope). Pada SEM (Scanning Electron
Microscope) dapat diamati karakteristik bentuk, struktur, serta distribusi
pori pada permukaan bahan (Sartono, 2007).
Karakterisasi menggunakan SEM dilakukan melalui adsorpsi isotermis
gas oleh padatan sampel. Jumlah molekul gas yang diadsorpsi pada
permukaan luar padatan sampel sangat sedikit dibandingkan dengan yang
diadsoprsi oleh porinya. Alat ini dilengkapi sumber cahaya yang berupa
suatu filamen dan biasanya suatu kawat tungsten.
Gambar 7. Skema alat Scanning Electron Microscope
Prinsip kerja Scanning Electron Microscope, dengan cara mengalirkan
arus pada kawat filamen tersebut dan perlakuan pemanasan, sehingga
dihasilkan elektron. Elektron tersebut dikumpulkan dengan tegangan
tinggi dan berkas elektron difokuskan dengan sederetan lensa
elektromagnetik. Ketika berkas elektron mengenai target, informasi
dikumpulkan melalui tabung sinar katoda (CRT) yang mengatur
intensitasnya.
Setiap jumlah sinar yang dihasilkan dari CRT dihubungkan dengan
jumlah target, jika terkena berkas elektron berenergi tinggi dan
menembus permukaaan target, elektron kehilangan energi, karena terjadi
ionisasi atom dari cuplikan padatan. Elektron bebas ini tersebar keluar
dari aliran sinar utama, sehingga tercipta lebih banyak elektron bebas,
dengan demikian energinya habis lalu melepaskan diri dari target.
Elektron ini kemudian dialirkan ke unit demagnifikasi dan dideteksi oleh
detektor dan selanjutnya dicatat sebagai suatu foto (Wagiyo dan
EDX merupakan seperangkat alat yang dirangkai dengan SEM untuk
menghasilkan gambar yang menyatakan perbedaan unsur kimia, yang
ditandai dengan warna gelap dan terang. Warna terang menunjukkan
adanya unsur kimia yang lebih tinggi nomor atomnya. Proses
memperoleh hasil gambar EDX diperoleh dari elektron terhambur balik
yang intensitasnya tergantung pada nomor atom unsur yang ada pada
permukaan sampel.
Radiasi yang penting pada EDX adalah sinar-X, karakteristik yang
diemisikan sebagai akibat tumbukan elektron pada atom-atom bahan
pada sampel. Radiasi karakteristik sinar-X dapat menghasilkan informasi
kualitatif dan kuantitatif tentang komposisi dari bagian tertentu dari
sampel, dengan diameter beberapa mikrometer (Anonim F., 2007).
E. Uji Aktivitas
Untuk menentukan hasil kuantitatif dan kualitatif uji katalitik, digunakan
Kromatografi Gas (GC). Dasar pemisahan secara kromatografi gas adalah
penyebaran cuplikan diantara dua fase. Salah satu fase adalah fase diam yang
permukaan nisbinya luas, dan fase yang lain ialah gas yang melewati fase
diam. Berdasarkan kombinasi fasa diam dan fasa gerak, kromatografi gas
dapat dibagi menjadi dua macam yaitu kromatografi gas padatan yang
disusun dari fasa diam berupa padatan dan fasa gerak berupa gas, yang
prinsipnya berdasarkan pada perbedaan absorbsi suatu komponen,
kromatografi gas-cair, fasa diamnya berupa cairan dan fasa geraknya berupa
. .
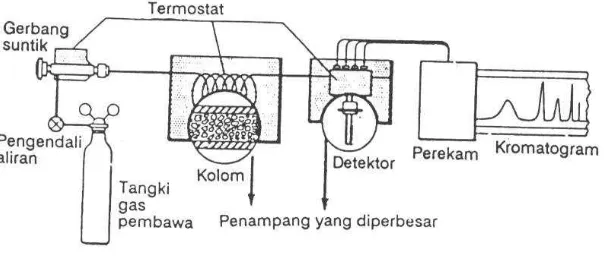
Komponen penting dalam kromatografi gas adalah:
1. Tangki pembawa gas yang dilengkapi dengan pengatur tekanan
2. Tempat injeksi sampel
3. Kolom
4. Detektor yang dilengkapi termostat
5. Pemerkuat arus (amplifyer)
6. Rekorder atau integrator
Fungsi gas pembawa adalah mengangkut cuplikan dari kolom menuju
detektor, gas tersebut haruslah inert dan murni, gas pembawa yang sering
digunakan adalah nitrogen, hidrogen, helium, dan argon. Kolom
kromatografi terdiri dari tiga bagian yaitu wadah luar, isi kolom yang
terdiri dari padatan pendukung dan fasa cairan. Jenis kolom ada 2 macam
yaitu kolom packing dan kolom kapiler, kolom packing lebih besar dari
kolom kapiler (Wikipedia, 2005). Detektor pada kromatografi gas harus
dapat mendeteksi secara terus-menerus, cepat dan dengan sensitifitas yang
tinggi terhadap komponen-komponen yang terdapat dalam gas pembawa Gambar 8. Bagian dasar kromatografi
ketika keluar dari kolom (Brewer., 1998). Detektor berinteraksi dengan
komponen-komponen sampel berdasarkan sifat-sifat fisika dan/atau kimia.
Interaksi tersebut menghasilkan sinyal elektrik yang ukurannya sebanding
dengan jumlah atau kuantitas dari komponen tersebut. Sinyal-sinyal yang
dihasilkan detektor kemudian dikirim ke alat perekam (Rood., 2007).
Kromatografi gas dalam hal ini sangat efektif berfungsi sebagai pemisah
berbagai komponen-komponen sampel tetapi mempunyai kelemahan
III. METODOLOGI PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Biomassa, Lembaga Penelitian
Universitas Lampung. Analisis difraksi sinar-X (XRD), morfologi
permukaan (SEM), dan analisis komposisi unsur (EDX) dilakukan di
Laboratorium Pusat Teknologi Bahan Industri Nuklir (PTBIN) Batan Serpong,
analisis keasaman dilakukan di Laboratorium Kimia Lembaga Ilmu
Pengetahuan (LIPI) Serpong, dan analisis menggunakan Kromatografi Gas
dilakukan di Laboratorium Afiliasi Departemen Kimia Universitas Indonesia,
dari bulan November 2009 sampai bulan Maret 2010.
B. Alat dan Bahan
Peralatan yang akan digunakan dalam penelitian ini antara lain adalah:
reaktor katalis, furnace Lenton 3508, Spektrofotometer Infra Merah (IR)
Shimadzu IrPrestige-21, X-Ray Diffraction (XRD) Philips PW1710, GC
Varian Cp3800 GC, Scanning Electron Microscopy-Energy Dispersive X-Ray
Spectrometer (SEM-EDX), magnetic stirrer, desikator, dan peralatan gelas.
C. Cara Kerja
1. Pembuatan Katalis dengan Metode Sol-gel
Sebanyak 25,28 gram Fe3(NO3)3.9H2O ditambahkan ke dalam 100 mL
pelarut asam sitrat/H2O (perbandingan asam sitrat : Fe3(NO3)3.9H2O = 2:1), larutan kemudian diaduk dengan pengaduk magnetik pada temperatur
±70oC agar logam terdistribusi merata dalam larutan, sampai diperoleh gel. Kemudian gel dikeringkan dalam oven dengan suhu 60oC selama 24 jam untuk menghilangkan air, lalu ditimbang dan dihitung rendemen yang
terbentuk.
2. Kalsinasi
Proses kalsinasi dilakukan dengan menggunakan furnace yang diprogram
sesuai dengan perlakuan yang diinginkan, dengan langkah-langkah sebagai
berikut:
a. Sampel disiapkan.
b. Sampel dimasukkan ke dalam tungku pemanas (furnance).
c. Alat tungku dihubungkan dengan sumber tegangan, kemudian setting
alat dalam keadaan hidup atau "ON".
d. Tungku diatur setting sesuai dengan perlakuan pada sampel.
e. Tungku pemanas dimatikan ketika proses telah selesai.
f. Sampel dikeluarkan dari tungku pemanas.
Pemanasan sampel terbagi menjadi 3 segment, yaitu kenaikan (run),
penahanan (dwell), dan pengakhiran (end). Pertama-tama sampel
dengan penaikan temperatur 1oC/menit. Setelah mencapai temperatur target (120oC) temperatur ditahan selama 2 jam (120 menit), kemudian
temperatur dinaikkan kembali hingga mencapai temperatur 350 oC dengan penaikan temperatur 1oC/menit. Setelah mencapai temperatur 350 oC,
temperatur ditahan selama 3 jam (180 menit). Selanjutnya alat furnace
akan menghentikan pemicu kenaikan dan penahanan suhu, dan secara
otomatis suhu di dalam furnace akan turun kembali secara perlahan hingga
mencapai suhu kamar (30oC).
3. Reduksi
Sebanyak 35,5 mg katalis yang telah melewati proses kalsinasi
ditempatkan pada tabung reaktor. Katalis dipanaskan sampai temperatur
reaksi yaitu 500 oC dan ditahan pada temperatur tersebut selama 30 menit.
Kemudian dialirkan gas H2 dengan laju alir tertentu pada temperatur penahanan tersebut. Laju alir gas H2 yang digunakan adalah 1,6 L/jam,
1,8 L/jam, dan 2,0 L/jam.
4. Karakterisasi
a. Karakterisasi dengan difraksi sinar-X (XRD)
Pada penelitian ini karakterisasi dengan XRD dilakukan untuk
menganalisis pengaruh variasi laju alir gas H2 terhadap fasa kristalin
yang terbentuk pada tahapan reduksi maupun fasa kristalin pada katalis
diidentifikasi menggunakan metode Search Match dengan standar File
data yang terdapat dalam program PCPDFWIN 1997.
b. Penentuan Keasaman Katalis
Metode yang digunakan untuk menentukan keasaman dari Fe3O4 adalah metode gravimetri. Katalis diambil sebanyak 0,25 gram
dimasukkan ke dalam wadah dan diletakkan dalam desikator yang di
dalamnya terdapat absorbat piridin (p.a). Desikator ditutup selama 24
jam, kemudian dikeluarkan dan dibiarkan selama 2 jam pada tempat
terbuka untuk melepaskan basa yang teradsorpsi fisik. Berat katalis
yang telah mengadsorpsi basa diukur untuk mendapatkan mol basa
yang teradsorpsi pada silika-katalis dengan persamaan di bawah ini
Dengan W1 adalah berat wadah kosong, W2 berat wadah dan cuplikan,
W3 berat wadah dan cuplikan yang telah mengadsorpsi piridin dan berat molekul piridin.
Untuk mengetahui jenis asam yang ada pada katalis digunakan metode
spektrofotometri infra merah. Beberapa mg cuplikan katalis yang
telah dijenuhkan dengan piridin diletakkan pada wadah sampel
spektrofotometer infra merah untuk dianalisis. Sinyal spektrum pada
bilangan gelombang ± 1450 cm-1 dan bilangan gelombang ±1630 cm-1
masing-masing merujuk pada situs asam Brønsted-Lowry dan situs
c. Karakterisasi dengan SEM-EDX
Untuk melakukan karakterisasi permukaan katalis Fe3O4 pada skala mikrometer atau bahkan submikrometer serta menentukan komposisi
unsur sampel secara kualitatif maupun kuantitatif dapat dilakukan
dengan menggunakan satu perangkat alat SEM yang dirangkaikan
dengan EDX (Energy Dispersive X-Ray Spectrometer). Pada SEM
(Scanning Electron Microscope) dapat diamati karakteristik bentuk,
struktur, serta distribusi pori pada permukaan bahan. Sedangkan pada
EDX (Energy Dispersive X-Ray Spectrometer) analisis kualitatifnya
adalah proses identifikasi unsur-unsur yang ada dalam sampel dan
analisis kuantitatifnya adalah untuk mengetahui kadar unsur yang
terkandung dalam sampel. Tahapan analisisnya yaitu sejumlah sampel
diletakkan dalam wadah sampel kemudian dilakukan proses coating
(pelapisan) karbon pada sampel lalu dianalisis.
5. Uji Aktivitas Katalis
Aktivitas katalis diuji pada reaktor dengan skema kerja reaktor untuk
konversi gas CO2 menjadi metanol pada Gambar 9.
Sampel katalis sebanyak 20 mg ditempatkan pada tabung reaktor, katalis
dipanaskan sampai temperatur 500oC dan ditahan pada suhu tersebut
selama satu jam. Selama waktu penahanan, katalis direduksi
menggunakan gas hidrogen dan gas argon dengan laju alir 1,8 L/jam untuk
gas hidrogen dan 1,2 L/jam untuk gas argon. Setelah reduksi selesai,
kemudian dipertahankan selama 30 menit. Kemudian dialirkan gas CO2, H2 dan Ar selama waktu penahanan tersebut dengan laju alir total adalah
50 mL/menit, dan perbandingan gas CO2 : H2 adalah 1:4. Variasi temperatur yang dilakukan adalah 100, 200, 300, dan 400oC. Hasil
katalisis keluar dari tabung reaktor kemudian ditampung dalam wadah
penampung. Hasil dari uji aktivitas ini selanjutnya dianalisis
menggunakan kromtografi gas.
Keterangan :
1-3 = Regulator (flowmeter), 4-6 = Pengatur aliran gas, 7 = Tempat injeksi CO2, 8 = Wadah pencampur, 9-10 = Penghubung swagelock, 11 = Termokopel, 12 = Wadah katalis, 13 = furnace, 14 = Valve, 15 = Kantong penampung hasil analisis.
IV. HASIL DAN PEMBAHASAN
A. Pengantar
Penelitian ini pada intinya dilakukan dengan dua tujuan utama, yakni
mempelajari pembuatan katalis Fe3O4 dari substrat Fe2O3 dengan metode
sol-gel, dan mempelajari aktivitas katalitik Fe3O4 untuk reaksi konversi gas CO2 menjadi metanol.
Secara garis besar, penelitian ini mencakup tiga lingkup kegiatan yakni
pembuatan katalis, karakterisasi katalis, dan uji aktivitas katalis. Pembuatan
katalis diawali dengan pembuatan Fe2O3 dengan metode sol-gel, dilanjutkan dengan kalsinasi pada temperatur 350oC. Fe2O3 yang telah dikalsinasi kemudian direduksi menggunakan gas H2 untuk mengubah Fe2O3 menjadi
Fe3O4. Percobaan ini dilakukan dengan laju alir gas H2 yang berbeda yakni 1,6 L/jam; 1,8 L/jam; dan 2,0 L/jam untuk mendapatkan konversi Fe2O3 menjadi katalis Fe3O4 paling tinggi. Persen konversi ini ditentukan
berdasarkan análisis menggunakan X-Ray Diffractometer (XRD). Katalis
dengan kandungan fasa kristalin Fe3O4 paling tinggi selanjutnya
dikarakterisasi dengan Scanning Electron Microscope-Energy Dispersive
X-Ray Spectrometer (SEM-EDX) untuk melihat morfologi permukaan dan
analisis komposisi unsur permukaan, serta metode adsorbsi basa piridin untuk
dikonfirmasi dengan analisis fungsionalitas menggunakan Spektrofotometer
Infra Merah.
Tahap terakhir adalah pengujian aktivitas katalis terbaik untuk reaksi
konversi gas CO2 menjadi metanol pada temperatur 100, 200, 300, dan 400 oC. Produk reaksi selanjutnya dianalisis menggunakan kromatografi gas dan keadaan katalis setelah uji aktivitas dimonitor kembali menggunakan
X-Ray Diffractometer (XRD) dan Scanning Electron Microscope-Energy
Dispersive X-Ray Spectrometer (SEM-EDX).
B. Pembuatan Katalis dengan Metode Sol-gel
Pada penelitian ini, pembuatan Fe2O3 menggunakan metode Sol-gel, mengikuti penelitian sebelumnya oleh Akbar et al., (2004). Fe2O3 disiapkan
dengan cara melarutkan prekursor Fe-nitrat ke dalam larutan asam sitrat.
Larutan asam sitrat dibuat dengan melarutkan kristal C6H8O7. H2O ke dalam
aquades, reaksi yang terjadi adalah endoterm. Larutan Fe-nitrat dalam asam
sitrat berwarna merah, seperti yang disajikan pada Gambar 10 berikut:
Larutan tersebut dipanaskan pada temperatur 80oC sambil diaduk dengan
magnetic stirrer agar homogen. Pada proses pemanasan tersebut terjadi
penguapan air dan pelepasan sedikit gas NO2 yang ditandai dengan keluarnya
gas berwarna kuning kecoklatan.
Dari hasil pemanasan tersebut diperoleh gel yang berwarna merah, seperti
yang disajikan dalam Gambar 11 berikut.
Gel tersebut kemudian dikeringkan di dalam oven pengering dengan
temperatur 60oC selama 24 jam, selanjutnya dilakukan kalsinasi untuk mengubah Fe menjadi oksidanya, karena oksida dari Fe ini akan berperan
sebagai situs aktif dalam proses katalitik.
Kalsinasi dilakukan dalam beberapa tahap. Pada tahap pertama dilakukan
pemanasan dari temperatur ruang (temperatur 30oC) hingga mencapai
temperatur 120oC dengan kenaikan temperatur 1oC/menit, kemudian ditahan selama dua jam. Pada tahap pertama ini, yang terjadi adalah penghilangan
kadar air yang masih terkandung di dalam gel. Tahap kedua, temperatur
selama tiga jam. Pada tahap ini, terjadi pembebasan gugus nitrat dan mulai
terbentuk fase oksida seperti pada persamaan reaksi berikut:
Kalsinasi dilakukan pada temperatur 350oC karena diharapkan fase oksida yang terbentuk belum cukup stabil, sehingga masih cukup reaktif untuk
melewati tahap selanjutnya. Setelah dilakukan kalsinasi, warna yang
terbentuk adalah merah bata seperti yang dapat dilihat dalam Gambar 12.
Rendemen Fe2O3 yang dihasilkan sebesar94,5 % dari hasil stokiometri.
Fe2O3 yang telah diperoleh kemudian dikonversi menjadi katalis Fe3O4
melalui tahapan reduksi. Pada penelitian ini, reduksi dilakukan dengan laju
alir gas H2 yang bervariasi, yaitu: 1,6 L/jam; 1,8 L/jam; dan 2,0 L/jam. Variasi dilakukan untuk mengetahui laju alir gas H2 optimal yang diperlukan
untuk mereduksi Fe2O3 menjadi katalis Fe3O4. Hasil reduksi dari setiap laju alir gas H2 dimonitor fasa kristalinnya menggunakan difraksi sinar-X yang
alir gas H2, menghasilkan produk dengan warna berbeda, yang
mengindikasikan kemungkinan perbedaan komposisi.
Perubahan warna katalis yang telah direduksi dengan masing-masing laju alir
gas H2 dapat dilihat seperti yang disajikan dalam Gambar 13.
Hasil yang disajikan dalam Gambar 13 menunjukkan bahwa secara visual ada
pengaruh yang cukup jelas dari laju alir gas H2. Pada katalis yang direduksi
menggunakan laju alir gas H2 sebesar 1,6 L/jam tidak terlihat perubahan warna yang cukup berarti, dibandingkan dengan warna Fe2O3 sebelum direduksi. Tidak terjadinya perubahan warna mengindikasikan bahwa dengan
laju alir 1,6 L/jam jumlah gas H2 yang diasup belum mampu mereduksi Fe2O3 menjadi Fe3O4. Hasil percobaan menggunakan laju alir gas H2 sebesar
1,8 L/jam dan 2,0 L/jam menunjukkan bahwa jumlah gas H2 yang diasup sudah cukup mereduksi Fe2O3 menjadi Fe3O4. Hal ini terlihat dari perubahan warna dari merah bata menjadi hitam. Karena secara visual produk yang
dihasilkan dari percobaan dengan laju alir 1,8 L/jam dan 2,0 L/jam adalah
sama, maka kedua sampel selanjutnya dianalisis menggunakan XRD. Gambar 13. Katalis hasil reduksi menggunakan laju alir gas H2 sebesar
C. Karakterisasi Katalis
1. Analisis Struktur Kristal menggunakan XRD
Karakterisasi sampel menggunakan sinar-X dilakukan untuk memonitor
hasil reduksi katalis pada setiap variasi laju alir gas H2. Data difraksi yang dihasilkan memberikan informasi berdasarkan sudut 2θ (dalam derajat)
dan intensitas relatif. Hasil pengukuran pola difraksi sinar-X pada katalis
yang direduksi menggunakan laju alir gas H2 sebesar 1,6 L/jam, dapat dilihat dalam Gambar 14. Untuk analisis kualitatif pada setiap sampel
hasil reduksi, digunakan metode pencocokan (search match analysis)
menggunakan program PCPDFWIN 1997 atau JCPDS (International
Center for Diffraction Data)
Hasil analisis kualitatif difraksi sinar-X seperti yang disajikan pada
Gambar 14 menunjukkan bahwa hasil reduksi menggunakan laju alir gas
H2 sebesar 1,6 L/jam masih berupa Fe2O3. Hal ini dapat diketahui jika
melihat puncak-puncak difraktogram sampel hasil reduksi (B), yang
bersesuaian dengan puncak-puncak pada difraktogram standar yang
mengacu pada PCPDF 33-0664. Identifikasi dilakukan dengan
membandingkan tiga puncak berintensitas tertinggi dari sampel terhadap
data rujukan (Gooden and Mc Carthy, 1972). Kecocokan puncak-puncak
fasa kristalin Fe2O3 terhadap rujukan dapat dilihat pada Tabel 1 di bawah ini.
Untuk sampel katalis yang direduksi menggunakan laju alir gas H2 sebesar 1,8 L/jam dan 2,0 L/jam terlihat memberikan perubahan warna yang sama,
akan tetapi sebenarnya kedua laju alir gas H2 tersebut memberikan hasil yang berbeda. Hal ini dapat terlihat dari difraktogram kedua sampel yang
memiliki pola berbeda. Difraktogram kedua sampel seperti yang
ditunjukkan dalam Gambar 15.
Hasil analisis kualitatif difraktogram yang terlihat pada Gambar 15
menunjukkan bahwa reduksi Fe2O3 dengan menggunakan laju alir gas H2 sebesar 1,8 L/jam (B) terbentuk fasa kristalin Fe3O4, terlihat dari pola puncak-puncak difraktogram hasil analisis yang bersesuaian dengan pola
puncak-puncak difraktogram standar PCPDF 19-0629 untuk Fe3O4. Akan tetapi, pada difraktogram tersebut juga terlihat dua puncak yang tidak
bersesuaian dengan pola difraktogram standar Fe3O4 yaitu pada 2θ = 44,63 dan 2θ = 64,99. Melalui metode pencocokan (search match analysis),
diketahui kedua puncak tersebut cocok dengan puncak difraktogram
standar PCPDF 06-0696 untuk fasa kristalin Fe.
Data Rujukan Hasil Penelitian
Sedangkan pada pola difraktogram katalis yang direduksi menggunakan
laju alir gas H2 sebesar 2,0 L/jam (C), puncak-puncak difraktogram yang
menunjukkan adanya fasa kristalin Fe yaitu pada 2θ = 44,63 dan
2θ = 64,99 mengalami kenaikan intensitas yang cukup tinggi dan
puncak-puncak difraktogram yang menunjukkan adanya fasa kristalin
Fe3O4 terlihat mengalami penurunan intensitas.
Data Rujukan Hasil Penelitian
Keasaman turut memegang peranan yang cukup penting dalam
mempengaruhi aktivitas katalis. Keasaman suatu katalis atau suatu
material dapat ditentukan dengan menggunakan metode gravimetri, yaitu
dengan menghitung daya adsorbsi katalis terhadap basa yang mana dalam
penelitian ini yang digunakan adalah piridin. Banyaknya mol piridin yang
teradsorbsi pada situs asam menyatakan kekuatan asam dari katalis
(Richardson., 1989). Pada penelitian ini, berdasarkan hasil perhitungan
yang disajikan dalam Lampiran 3, dengan menggunakan metode
gravimetri diketahui keasaman per-satu gram katalis Fe3O4 adalah sebesar
1,116 mmol piridin.
Metode spektrofotometri inframerah merupakan data penunjang bagi
metode gravimetri untuk mengetahui sisi asam manakah yang berperan
dalam mengikat basa dalam hal ini piridin.
Spektrum IR katalis Fe3O4 setelah uji keasaman menggunakan basa piridin
seperti yang disajikan dalam Gambar 16.
Pada spektrum infra merah situs asam Brønsted-Lowry ditunjukkan pada
daerah bilangan gelombang 1485-1500 cm-1, sedangkan situs asam Lewis ditunjukkan pada daerah bilangan gelombang 1447-1460 cm-1 (Tanabe., 1981). Dalam Gambar 16 terlihat adanya puncak serapan dari ion
piridinium, yaitu pada 1487,12 cm-1 yang mengindikasikan adanya situs asam Brønsted-Lowry yang berperan pada permukaan katalis. Selain situs
asam Brønsted-Lowry, situs asam Lewis (serapan piridin yang berikatan
dengan logam) juga berperan pada permukaan katalis Fe3O4, yaitu dengan
adanya puncak serapan pada 1448,54 cm-1.
Adsorbsi piridin pada permukaan katalis Fe3O4 terlihat dengan adanya
serapan vibrasi tarik C-H pada daerah 3020-3070 cm-1, serapan vibrasi tarik C-C pada daerah 1590-1660 cm-1, dan serapan vibrasi untuk C-N
pada daerah 1000-1250 cm-1. Kemudian pada daerah 3400-3500 cm-1 menunjukkan serapan vibrasi N-H yang bertumpangsuh dengan serapan
O-H akibat adsorbsi piridin pada permukaan katalis Fe3O4. Sedangkan
serapan pada daerah sekitar 559,36 cm-1 menunjukkan adanya serapan vibrasi untuk Fe-O yang merupakan karakteristik adanya Fe3O4
(Barizuddin. S., 2006).
Keasaman situs aktif katalis dapat dijelaskan sebagai berikut: gugus
hidroksil dari katalis berikatan kovalen koordinasi dengan piridin
membentuk ion piridinium sehingga membentuk pusat aktif
Brønsted-Lowry. Reaksi yang terjadi adalah:
H
O M O + O M O--- H
Sedangkan pusat aktif asam Lewis pengikatan gugus piridin dapat dilihat
pada reaksi berikut :
O
O M O + O M
M merupakan logam besi (Fe) mempunyai situs asam yang dapat
mengadsorbsi basa piridin. Logam Fe merupakan unsur golongan transisi
Dominasi antara situs asam Brønsted-Lowry dengan Lewis dapat dilihat
pada spektra analisis. Dari spektrum dapat dilihat bahwa katalis Fe3O4 relatif didominasi oleh situs asam Brønsted-Lowry. Hal ini ditunjukkan
dengan lebih kecilnya % transmitan pada daerah serapan 1487,12 cm-1 bila dibandingkan dengan % transmitan pada daerah 1448,54 cm-1.
3.Analisis SEM-EDS
Analisis menggunakan SEM dilakukan untuk mengevaluasi morfologi
permukaan katalis yang telah dihasilkan. Agar morfologi permukaan ini
dapat terungkap dengan lebih jelas, analisis dilakukan dengan tiga
perbesaran, yakni 1500x, 2000x, dan 20000x. Mikrograf sampel disajikan
dalam Gambar 17.
Hasi analisis dengan perbesaran 1500x (Gambar 17A) menunjukkan
bahwa partikel-partikel Fe3O4 membentuk kelompok-kelompok (cluster) Gambar 17. Struktur mikro katalis Fe3O4 (A) dengan perbesaran
dengan struktur polimorf (tidak homogen). Diduga pembentukan cluster
ada kaitannya dengan sifat magnet Fe3O4 sehingga partikel condong mengelompok. Untuk memperjelas profil cluster yang teramati, dilakukan
analisis SEM dengan perbesaran 2000x. Hasil analisis dengan perbesaran
yang lebih tinggi menunjukkan cluster ini cukup homogen tetapi belum
memberikan informasi tentang bentuk dan ukuran partikelnya. Atas dasar
itulah, analisis dilakukan dengan perbesaran 20000x seperti yang disajikan
dalam Gambar 18.
Mikrograf dengan perbesaran 20000x seperti yang dapat dilihat dalam
Gambar 18 mampu menunjukkan dua informasi penting yakni bentuk
partikel dan ukuran partikel yang berada dalam rentang mikron. Dalam
Gambar 18 partikel Fe3O4 terlihat tersebar merata dengan bentuk dan ukuran partikel yang kurang homogen, ada yang memiliki bentuk agak
bulat memanjang dan ada yang agak bulat hampir membentuk struktur
kubik.
Analisis EDX pada sampel Fe3O4 yang diperoleh dari reduksi Fe2O3
menggunakan laju alir gas H2 sebesar 1,8 L/jam dilakukan untuk mengetahui komposisi unsur di dalam sampel. Hasil analisis EDX
disajikan dalam Gambar 19.
Berdasarkan hasil analisis EDX dalam Gambar 19, diketahui bahwa
struktur mikro sampel hasil reduksi Fe2O3 menggunakan laju alir gas H2 sebesar 1,8 L/jam mengandung komposisi unsur Fe, O, C dan F dengan
persen massa relatif unsur Fe sebesar 81,64%, unsur O sebesar 9,97%, Gambar 19. Spektrum EDX dan komposisi sampel Fe3O4 hasil reduksi
unsur C sebesar 7,26%, dan unsur F sebesar 1,13%. Unsur C dan F
kemungkinan besar berasal dari kontaminasi peralatan analisis karena
kedua unsur tersebut tidak ada digunakan dalam preparasi sampel. Unsur
C kemungkinan berasal dari proses coating (pelapisan) yang dikenakan
pada sampel sebelum dianalisis, sedangkan unsur F diduga berasal dari
wadah sampel pada perangkat SEM/EDX.
Berdasarkan komposisi unsur ini dapat diketahui bahwa katalis terdiri dari
Fe3O4 sebesar 64,74% dan Fe 35,24%. Cara perhitungan disajikan dalam
Lampiran 4.
D. Uji Aktivitas Katalis
Dalam penelitian ini, uji aktivitas katalis dilakukan menggunakan reaktor
seperti disajikan dalam Gambar 9 pada bagian metode percobaan.
Percobaan uji aktivitas katalis ini diawali dengan proses reduksi katalis
pada temperatur 500oC selama satu jam dengan menggunakan gas H 2 dengan laju alir 1,8 L/jam dan gas Ar dengan laju alir 1,2 L/jam.
Selanjutnya katalis yang telah tereduksi tersebut dialiri dengan campuran
gas CO2, H2 dan Ar dengan laju alir total 50 mL/menit dan perbandingan gas CO2 : H2 adalah 1:4. Gas CO2 yang terdapat dalam campuran tersebut
akan mengoksidasi katalis tereduki sekaligus menghasilkan gas CO,
Fe3O4 + H2 FeO/Fe + H2O (1)
FeO/Fe + CO2 Fe3O4 + CO (2)
CO2 + H2 CO + H2O
Gas CO yang terbentuk kemudian diharapkan akan bereaksi dengan gas H2 untuk menghasilkan metanol, sesuai dengan persamaan reaksi berikut ini.
CO + 2H2 CH3OH (3)
Dalam kimia, salah satu faktor termodinamis yang sangat berperan
menentukan reaksi adalah temperatur. Atas dasar ini, dalam penelitian ini
uji aktivitas katalis dilakukan pada empat temperatur yang berbeda, yakni
100, 200, 300, dan 400oC. Hasil percobaan dianalisis dengan kromatografi
gas.
Analisis dengan kromatografi gas menghasilkan kromatogram tanpa
adanya pita serapan untuk semua keadaan temperatur, seperti yang
disajikan dalam Lampiran 6. Hasil ini menunjukkan bahwa tidak terjadi
reaksi konversi menjadi metanol, seperti yang diharapkan. Tidak
berlangsungnya reaksi seperti yang diharapkan diduga terdapat beberapa
alasan yang melatarbelakanginya. Alasan pertama adalah kemungkinan
reaksi yang berlangsung hanya sampai pada konversi gas CO2 menjadi gas
CO, sementara reaksi antara gas CO dan gas H2 tidak berlangsung. Kemungkinan ini didukung oleh hasil analisis katalis dengan XRD, seperti
disajikan dalam Gambar 20.
+
Difraktogram sampel pada Gambar 20 menunjukkan kristalinitas sampel
sebelum diuji (B) dan setelah diuji (C), serta difraktogram standar (A).
Sampel sebelum digunakan diketahui terdiri dari fasa kristalin Fe3O4 dan Fe. Ini mengindikasikan bahwa proses pembuatan katalis berhasil
dilakukan hingga 64,74%, sementara 35,24% tereduksi hingga menjadi Fe.
Difraktogram untuk sampel yang sudah diuji menunjukkan adanya tiga
fasa kristalin yaitu Fe2O3, Fe3O4, dan Fe, dengan data kecocokan terhadap
standar seperti disajikan dalam Tabel 4 berikut. +
Data Rujukan Hasil Penelitian
Komposisi masing-masing fase kristalin pada katalis setelah uji aktivitas
tersebut dapat diketahui berdasarkan hasil analisis EDX seperti yangg
disajikan pada Gambar 21.
aktivitas dengan data standar Fe2O3, Fe3O4 dan Fe sebagai rujukan.
Mengacu pada hasil analisis EDX dalam gambar 21, diketahui bahwa
komposisi unsur Fe dan O pada sampel katalis setelah melalui proses uji
katalitik secara berturut-turut adalah sebesar 95,63% dan 2,82%.
Berdasarkan komposisi unsur ini dapat diketahui bahwa katalis terdiri dari
Fe3O4 sebesar 7,5%, Fe2O3 sebesar 6,32%, dan Fe sebesar 81,8%.
Terlihat persentase Fe sebelum dan sesudah uji aktivitas mengalami
kenaikan sebesar 46,56%. Hal ini memperlihatkan bahwa katalis
mempunyai afinitas yang lebih besar terhadap gas H2 dari pada gas CO2
sehingga cenderung mengalami reduksi. Walaupun diketahui reaksi
reduksi lebih dominan, tetapi terbentuknya fase kristalin Fe2O3 pada sampel setelah uji aktivitas, menunjukkan bahwa juga terjadi reaksi
oksidasi katalis oleh gas CO2 seperti yang ditunjukkan dengan Persamaan (2). Namun demikian, gas CO yang dihasilkan tidak bereaksi dengan gas
H2, terlihat dari tidak adanya metanol yang terdeteksi dengan kromatografi gas seperti telah dipaparkan sebelumnya. Kegagalan reaksi antara gas CO
dan H2 kemungkinan diakibatkan oleh pengikatan gas CO oleh permukaan
katalis yang tidak mantap sehingga interaksinya dengan gas H2 menjadi sangat terbatas.
Kemungkinan lain yang patut dipertimbangkan adalah karaktersitik katalis,
terutama luas permukaan yang belum mampu mendukung reaksi katalitik
dengan efisien. Dugaan ini didasarkan padaa data analisis dengan SEM
yang menunjukkan bahwa partikel-partikel katalis Fe3O4 membentuk suatu
cluster-cluster yang menyebabkan berkurangnya luas permukaan katalis
Kemungkinan terakhir adalah reaksi yang berlangsung tidak menghasilkan
metanol, tetapi produk lain yang tidak terdeteksi dengan kondisi metode
analisis yang diterapkan untuk analisi metanol. Beberapa contoh senyawa
yang mungkin terbentuk tetapi tidak dianalisis pada penelitian ini adalah
formate, dioximetilen, formaldehida dan senyawa metoksi (Nakatsuji N.,
1999).
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat diambil beberapa
simpulan sebagai berikut:
1. Dengan metode yang digunakan, katalis Fe2O3 dapat tereduksi menjadi
Fe3O4 dengan tingkat capaian persen konversi sebesar 64,74% dan sisanya adalah Fe dengan tingkat capaian persen konversi sebesar
35,24% pada saat diberi asupan gas H2 dengan laju alir sebesar 1,8 L/jam.
2. Situs asam dari katalis Fe3O4 terdiri dari asam Brønsted-Lowry dan
asam Lewis, dengan situs asam Brønsted-Lowry lebih mendominasi.
3. Uji aktivitas katalis menunjukkan konversi gas CO2 menjadi metanol tidak dapat dicapai dengan katalis yang dibuat.
4. Meskipun gagal menghasilkan metanol, dari data penelitian dapat
disimpulkan bahwa katalis yang dibuat mampu mengkonversi gas CO2
menjadi gas CO.
5. Reaksi yang dominan terjadi pada uji aktivitas adalah reaksi reduksi,
B. Saran
Pada penelitian lebih lanjut disarankan untuk:
1. Melakukan penelitian lebih lanjut dengan metode sintesis lain untuk
mendapatkan katalis Fe3O4 dengan pencapaian tingkat konversi dan karakteristik katalis yang lebih baik.
2. Melakukan penelitian lebih lanjut mengenai penggunaan promotor
dan/atau pengemban untuk mendukung kinerja katalis dalam
mengkonversi gas CO2 menjadi metanol.
3. Melakukan analisis produk-produk lain yang mungkin terbentuk,
PEMBUATAN KATALIS Fe
3O
4DENGAN METODE
SOL-GEL DAN UJI AKTIVITASNYA UNTUK KONVERSI
CO
2MENJADI METANOL
(Skripsi)
Oleh
Sarah Aliana
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS LAMPUNG
BANDAR LAMPUNG
PEMBUATAN KATALIS Fe
3O
4DENGAN METODE
SOL-GEL DAN UJI AKTIVITASNYA UNTUK KONVERSI
CO
2MENJADI METANOL
Oleh
SARAH ALIANA
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Judul Skripsi : PEMBUATAN KATALIS Fe3O4 DENGAN METODE SOL-GEL DAN UJI
AKTIVITASNYA UNTUK KONVERSI CO2 MENJADI METANOL
Nama Mahasiswa : Sarah Aliana
Nomor Pokok Mahasiswa : 0517011016
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Dr. Rudy T.M. Situmeang, M.Sc Wasinton Simanjuntak, Ph.D NIP 19600616198811 1001 NIP 19590706198811 1001
2. Ketua Jurusan Kimia
MENGESAHKAN
1. Tim Penguji
Ketua : Dr. Rudy T.M. Situmeang, M.Sc. ...
Sekretaris : Wasinton Simanjuntak, Ph.D ...
Penguji
Bukan Pembimbing : Dra. Ilim, M.S ...
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Sutyarso, M.Biomed NIP 19570424198703 1001
PENDIDIKAN FORMAL (SD s.d S1)
Tahun 2005 – 2010 : Jurusan Kimia FMIPA, Universitas Lampung
Periode 2006-2007 : Anggota Bidang Sains dan Penalaran Ilmu Kimia HIMAKI UNILA
Periode 2007-2008 : Anggota Biro Penerbitan HIMAKI UNILA
NAMA
: Sarah Aliana
Tempat, Tanggal Lahir : Kota Agung, 24 Januari 1987
Jenis Kelamin : Perempuan
Agama : Islam
Status Penikahan : Belum menikah
Tinggi / Berat Badan : 158 cm/ 42 Kg
NPM : 0517011016
Nama Orang Tua : Ali Ahmad-Ermalina, S.Pd
Kewarganegaraan : Indonesia
Alamat Rumah Telp.
: Jl. Kelapa Tujuh, Lingkungan III. RT 007 RW 003, Bandar Jaya Barat, Lampung Tengah Alamat Saat Ini
Telp.
: Jl. Jend Sudirman No. 120 Rawa Laut, Pahoman, Bandar Lampung.
No. HP : 081279566699
Tgl. Wisuda : 15 Desember 2010
IPK : 3,30
Nilai EVT (TOEFL) : 440
ASISTEN PRAKTIKUM YANG PERNAH DIJABAT
HOBI
PENELITIAN DAN TUGAS AKHIR
PELATIHAN YANG PERNAH DIIKUTI PENGALAMAN KERJA
Tahun 2005-2006 : Beasiswa BBM Tahun 2008-2009 : Beasiswa BBM
Pembuatan Katalis Fe3O4 dengan Metode Sol-Gel dan Uji Aktivitasnya untuk Konversi CO2 menjadi Metanol
Kimia Dasar I dan 2 untuk Fakultas Pertanian dan MIPA Teknik Pengendalian Dampak Lingkungan untuk D3 Kimia Kimia Fisik untuk Fakultas MIPA
Membaca
Karya Wisata Ilmiah (BEM FMIPA UNILA, 2006) Mengoprasikan Komputer
Safety in Laboratory (Biomassa)
Tgl. UP : 22 Oktober 2009
Tgl. HP : 25 Oktober 2010
DAFTAR GAMBAR
Gambar Halaman
1. Unit sel Fe3O4 ... 12
2. Pertumbuhan ukuran partikel dalam sintesis sol-gel ... 13
3. Skema spektrofotometer IR ... 18
4. Skema alat XRD ... 19
5. Difraksi sinar-X oleh kristal ... 20
6. Difraktogram nanopartikel Fe3O4 ... 21
7. Skema alat Scanning Electron Microscope ... 22
8. Bagian dasar kromatografi gas ... 24
9. Reaktor katalis ... 31
10. Larutan Fe-nitrat dalam asam nitrat ... 33
11. Gel yang terbentuk ……… 34
12. Katalis Fe2O3 yang telah dikalsinasi kemudian digerus ... 35
13. Katalis hasil reduksi menggunakan laju alir gas H2 sebesar 1,6 L/jam; 1,8 L/jam; dan 2,0 L/jam ... 36
PCPDF 06-0696 untuk Fe dan PCPDF 19-0629 untuk Fe3O4 ... 39
16. Spektrum IR katalis Fe3O4 setelah uji keasaman ... 42
17. Struktur mikro katalis Fe3O4 dengan perbesaran 1500x dan 2000x ... 44
18. Struktur mikro katalis Fe3O4 dengan perbesaran 20000x ... 45
19. Spektrum EDX dan komposisi sampel Fe3O4 hasil reduksi Fe2O3 dengan laju alir gas H2 sebesar 1,8 L/jam ... 46
20. Difraktogram dari katalis setelah uji aktivitas, sebelum uji aktivitas, dan difraktogram stándar untuk Fe2O3, Fe3O4 dan Fe ………. 49
21. Spektrum EDX dan komposisi sampel Fe3O4 setelah uji aktivitas ... 50