UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIBIOFILM IN VITRO MINYAK
ATSIRI HERBA KEMANGI TERHADAP BAKTERI
Escherichia coli, Pseudomonas aeruginosa, DAN
Staphylococcus aureus
SKRIPSI
MOHAMMAD AL FATTAH
NIM.1111102000053
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIBIOFILM IN VITRO MINYAK
ATSIRI HERBA KEMANGI TERHADAP BAKTERI
Escherichia coli, Pseudomonas aeruginosa, DAN
Staphylococcus aureus
SKRIPSI
MOHAMMAD AL FATTAH
NIM.1111102000053
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
vi ABSTRAK
Penelitian ini dilakukan untuk menguji aktivitas antibiofilm minyak atsiri dari herba kemangi (Ocimum americanum L.). Minyak atsiri herba kemangi diperoleh dengan menggunakan metode destilasi uap-air. Metode uji aktivitas antibiofilm herba kemangi yang digunakan adalah microtitter plate assay. Hasil uji aktivitas antibiofilm yang dilakukan menunjukkan minyak atsiri dari kemangi mampu mencegah, menghambat, dan menghancurkan biofilm dari bakteri Escherichia coli, Pseudomonas aeruginosa, dan Staphylococcus aureus. Aktivitas terbaik minyak atsiri kemangi terjadi pada proses penghancuran biofilm Staphylococcus aureus dengan persentase penghancuran 58,10% pada konsentrasi 0,25% (v/v). Aktivitas terbaik minyak atsiri kemangi dilakukan optimasi dengan menggunakan respon surface analysis (RSA). Hasil optimasi RSA menunjukan kondisi penghancuran biofilm bakteri Staphylococcus aureus dengan perlakuan konsentrasi 0,25%, suhu 50oC, dan waktu kontak ekstrak dengan biofilm 48 menit. Kondisi aktivitas terbaik minyak atsiri dilakukan uji kembali untuk dibandingkan dengan kontrol positif (Biorem). Hasil uji menunjukan persentase penghancuran biofilm dengan minyak atsiri dan Biorem bereturut-turut adalah 65,79% dan 75,59%. Berdasarkan penelitian ini, minyak atsiri herba kemangi memiliki potensi sebagai antibiofilm.
Kata Kunci : Minyak atsiri herba kemangi (Ocimum americanum L.), antibiofilm, microtitter plate assay, respon surface analysis (RSA)
Nama : Mohammad Al Fattah ProgramStudi : Farmasi
Judul : UJI AKTIVITAS ANTIBIOFILM IN VITRO MINYAK ATSIRI HERBA KEMANGI TERHADAP BAKTERI
Escherichia coli, Pseudomonas aeruginosa, DAN
vii ABSTRACT
This study was conducted to test the antibiofilm activity of herbs basil essential oils (Ocimum americanum L.). Herb basil essential oil was obtained by hydro distillation. Microtitter plate method was used to test antibiofilm activity of herb basil essential oil. Antibiofilm activity test results have shown that herbs basil essential oil was able to prevent, inhibit, and destroy biofilm of bacteria Escherichia coli, Pseudomonas aeruginosa, and Staphylococcus aureus. The best activity of herbs basil essential oil occurred in the process of Staphylococcus aureus’s biofilm destruction with the 0.25% v/v concentration. The percentage of Staphylococcus aureus’s biofilm destruction was 58.10%. The best activity of herbs basil essential oils was optimized by using response surface analysis (RSA). The result of the RSA optimization at the best condition of Staphylococcus aureus’s biofilm destruction process was by using 0.25% of herb basil essential oil at the temperature of 50oC, and using 48 minutes for contacting time of essential oil with the biofilm. The optimal condition of herbs basil essential oils was tested to compare the antibiofilm activity with the control positive (Biorem) . The test results showed the percentage of biofilm destruction of essential oils and Biorem in a row were 65.79% and 75.59%. Based on this research, herbs basil essential oil has potential as an antibiofilm.
Key Word : Minyak atsiri herba kemangi (Ocimum americanum L.), antibiofilm, microtitter plate assay, respon surface analysis (RSA)
Nama : Mohammad Al Fattah Study Program : Pharmacy
Title : IN VITRO ANTIBIOFILM ACTIVITY TEST OF HERB BASIL ESSENTIAL OIL TO BACTERIA
Escherichia coli, Pseudomonas aeruginosa,
viii
KATA PENGANTAR
Assalamu ‘alaikum warahmatullahi wabarakatuh
Alhamdulillahirabbil’alamin, puji syukur selalu terpanjatkan atas kehadirat Allah subhanahu wa ta’ala atas segala berkah dan kasih sayang-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Shalawat serta salam senantiasa tercurahkan kepada keharibaan junjungan Nabi Besar Muhammad SAW, beserta keluarga, sahabat, dan para pengikutnya hingga hari akhir zaman.
Skripsi dengan judul “Uji Aktivitas Antibiofilm in Vitro Minyak Atsiri
Herba Kemangi Terhadap Bakteri Escherichia coli, Pseudomonas aeruginosa,
dan Staphylococcus aureus” ini disusun dalam rangka memenuhi salah satu syarat
menempuh ujian akhir guna mendapatkan gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri
(UIN) Syarif Hidayatullah Jakarta.
Selama proses penelitian dan penyusunan skripsi ini, penulis menyadari begitu banyak bantuan dari berbagai pihak yang telah meluangkan waktunya, mendidik dan membimbing, memberikan secercah harapan, dan mendoakan yang terbaik kepada penulis. Maka pada kesempatan ini, penulis menyampaikan penghargaan setinggi-tingginya dan rasa terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. H. Arif Sumantri, SKM., M. Kes. selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Bapak Yardi, Ph. D., Apt. selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
ix
4. Bapak dan Ibu Dosen Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta yang
telah memberikan ilmunya kepada penulis, semoga ilmu yang diberikan berkah dan menjadi ilmu yang bermanfaat. Aamiin.
5. Ibunda tercinta Hj. Ellya Dewi yang selalu memberikan cinta dan kasih sayang, semangat, dukungan, doa, dan nasihatnya yang tak akan pernah mampu penulis membalas itu semua. Penulis hanya bisa berdo’a kepada Allah yang maha pengasih lagi maha penyayang agar kiranya dengan segala kebesaran-Nya mengasihi dan melindungi Ibunda tercinta, melimpahkan rezeki, dan memberikan keselamatan di dunia dan di akhirat kelak. Aamiin
6. Firda, Resky, dan Rika sebagai teman seperjuangan penelitian biofilm di LIPI Bogor yang selalu memberikan semangat dan dukungan selama penelitian hingga penulisan skripsi ini.
7. Adit, Ambar, Ana, Askandari, Elsa, Faradhila, Khaerunisa, Miyadah, dan Niekha sebagai teman yang seperjuangan yang selalu memberikan semangat, dukungan, dan kebersamaan selama kuliah di farmasi ini dan semoga terus berlanjut hingga seterusnya.
8. Teman-teman seperjuangan Farmasi Angkatan 2011 “Effervescence” yang selalu memberikan warna baru dalam hidup penulis, kebersamaan yang
begitu indah, dan ilmu tentang hidup dan kehidupan yang begitu berharga. 9. Serta semua pihak yang telah membantu penulis selama ini yang tidak
dapat penulis sebutkan satu per satu.
Semoga Allah SWT memberikan balasan yang berlipat ganda atas segala bantuan dan dukungannya kepada penulis. Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak kelemahan dan kekurangan. Maka dari itu, dengan segala kerendahan hati penulis sangat mengharapkan kritik dan saran pembaca agar lebih sempurnanya skripsi ini.
Jakarta, 17 Juni 2015
xi DAFTAR ISI
Halaman
JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vi
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS ... x
DAFTAR ISI ... xi
1.3. Tujuan Penelitian ... 3
1.5. Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1. Infeksi ... 4
2.2. Biofilm ... 4
2.2.1. Tahap Perkembangan Biofilm ... 4
2.2.2. Resistensi Biofilm Terhadap Antibiotik ... 5
2.3. Kontrol Biofilm ... 7
2.4. Kultur Biofilm in Vitro Static Microtiter Plate Assays ... 8
2.5. Tanaman Kemangi (Ocimum americanum Linn.) ... 9
2.5.1. Klasifikasi ... 9
2.5.2. Sinonim ... 10
2.5.3. Morfologi... 10
2.5.4. Kandungan Kimia... 10
xii
2.6. Sitral ... 11
2.7. Destilasi Uap ... 12
2.8. Tinjauan Bakteri Uji ... 12
2.8.1. Escherichia coli ... 12
2.8.2. Pseudomonas aeruginosa ... 13
2.8.3. Staphylococcus aureus ... 13
2.9. Gas Chromatography-Mass Spectrophotometer (GC-MS) ... 14
2.10. Analisis Respon Permukaan (Respon Surface Analysis) ... 14
BAB III METODOLOGI PENELITIAN ... 16
3.1. Tempat dan Waktu Penelitian ... 16
3.2. Alat dan Bahan ... 16
3.2.1. Alat ... 16
3.2.2. Bahan ... 16
3.3. Ekstraksi Minya Atsiri ... 17
3.4. Penetuan Komponen Minyak Atsiri ... 17
3.5. Penyiapan Larutan Uji ... 18
3.6. Pembuatan Media ... 18
3.7. Kultur Escherichia coli ... 19
3.8. Kultur Pseudomonas aeruginosa ... 20
3.9. Kultur Staphylococcus aureus ... 20
3.10. Penyiapan Suspensi Bakteri Uji ... 21
3.11. Uji Pertumbuhan Biofilm Bakteri Uji ... 21
3.12. Uji Antibiofilm Minyak Atsiri Herba Kemangi ... 21
3.12.1. Uji Aktivitas Pencegahan Biofilm ... 21
3.12.2. Uji Aktivitas Penghambatan Biofilm ... 22
3.12.3. Uji Aktivitas Penghancuran Biofilm ... 23
3.13. Analisa Data Uji Terseleksi ... 24
BAB IV HASIL DAN PEMBAHASAN ... 25
4.1. Hasil ... 25
4.1.1. Determinasi... 25
4.1.2. Hasil Penyiapan Sampel ... 25
4.1.3. Analisis Komponen Kimia dengn GCMS ... 25
4.1.4. Hasil Kultur Bakteri ... 26
xiii
4.1.6. Hasil Uji Aktivitas Antibiofilm ... 29
4.1.7. Hasil Uji Pertumbuhan Biofilm Staphylococcus aureus ... 31
4.1.8. Hasil Uji Aktivitas Terseleksi Penghancuran Biofilm ... 31
4.2. Pembahasan ... 33
BAB V KESIMPULAN DAN SARAN ... 45
DAFTAR PUSTAKA ... 46
xiv
DAFTAR TABEL
Halaman
Tabel 4.1. Hasil Analisis GCMS Komponen Kimia Minyak Atsiri ... 26
Tabel 4.2. Kultur Bakteri Escherichia coli ... 26
Tabel 4.3. Kultur Bakteri Pseudomonas aeruginosa ... 27
Tabel 4.4. Kultur Bakteri Staphylococcus aureus... 27
xv
DAFTAR GAMBAR
Halaman
Gambar 2.1. Mekanisme Pembentukan Biofilm ... 4
Gambar 2.2. Resistensi Biofilm Terhadap Antibiotik ... 6
Gambar 2.3. Tumbuhan Kemangi ... 9
Gambar 2.4. Struktur Kimia Sitral ... 11
Gambar 4.1. Grafik Uji Pertumbuhan Biofilm Bakteri ... 29
Gambar 4.2. Aktivitas Antibiofilm Minyak Atsiri Kemangi Terhadap Bakteri Escherichia coli ... 29
Gambar 4.3. Aktivitas Antibiofilm Minyak Atsiri Kemangi Terhadap Bakteri Pseudomonas aeruginosa ... 30
Gambar 4.4. Aktivitas Antibiofilm Minyak Atsiri Kemangi Terhadap Bakteri Staphylococcus aureus ... 30
Gambar 4.5. Densitas Optik Pertumbuhan Biofilm Staphylococcus aureus ... 31
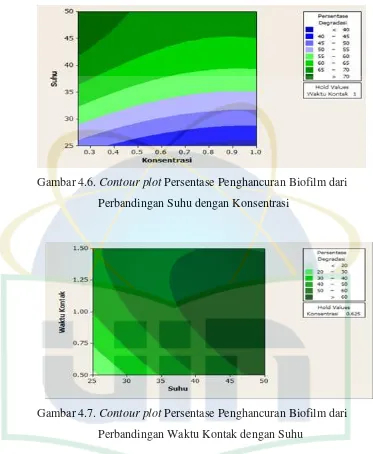
Gambar 4.6. Contour plot Persentase Penghancuran Biofilm dari Perbandingan Suhu dengan Konsentrasi. ... 32
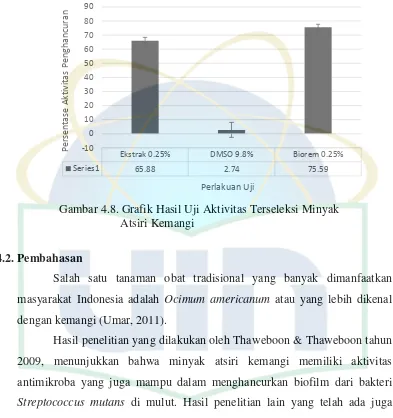
Gambar 4.7. Contour plot Persentasi Penghancuran Biofilm dari Perbandingan Waktu Kontak dengan Suhu... 32
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Alur Kerja ... 49
Lampiran 2. Hasil Determinasi ... 53
Lampiran 3. Hasil Destilasi Minyak Atsiri Herba Kemangi ... 54
Lampiran 4. Alat dan Bahan ... 55
Lampiran 5. Hasil Pembuatan Larutan Uji ... 57
Lampiran 6. Hasil Uji Pertumbuhan Biofilm Bakteri Uji ... 57
Lampiran 7. Hasil Uji Antibiofilm Terhadap Escherichia coli ... 58
Lampiran 8. Hasil Uji Antibiofilm Terhadap Pseudomonas aeruginosa ... 59
Lampiran 9. Hasil Uji Antibiofilm Terhadap Staphylococcus aureus ... 60
Lampiran 10. Hasil Uji Statistika Aktivitas Pencegahan Biofilm Escherichia coli…….. ... 61
Lampiran 11. Hasil Uji Statistika Aktivitas Penghambatan Biofilm Escherichia.coli ... 64
Lampiran 12. Hasil Uji Statistika Aktivitas Penghancuran Biofilm Escherichia.coli ... 67
Lampiran 13. Hasil Uji Statistika Aktivitas Pencegahan Biofilm Pseudomonas aeruginosa ... 69
Lampiran 14. Hasil Uji Statistika Aktivitas Penghambatan Biofilm Pseudomonas aeruginosa ... 72
Lampiran 15. Hasil Uji Statistika Aktivitas Penghancuran Biofilm Pseudomonas aeruginosa ... 75
Lampiran 16. Hasil Uji Statistika Aktivitas Pencegahan Biofilm Staphylococcus aureus…. ... 78
Lampiran 17. Hasil Uji Statistika Aktivitas Penghambatan Biofilm Staphylococcus aureus ... 81
Lampiran 18. Hasil Uji Statistika Aktivitas Penghancuran Biofilm Staphylococcus aureus….. ... 84
Lampiran 19. Hasil Uji Aktivitas Penghancuran Biofilm Menggunakan Respon Surfacce Analysis ... 87
Lampiran 20. Hasil Uji Aktivitas Penghancuran Biofilm Staphylococcus aureus Pada Kondisi Respon Surface Analysis ... 88
Lampiran 21. Hasil Uji Aktivitas Penghancuran Biofilm Kondisi optimal ... 90
1 UIN Syarif Hidayatullah Jakarta 1.1.Latar belakang
Infeksi adalah invasi tubuh oleh mikroorganisme patogen yang
mampu menyebabkan sakit (Potter et al, 2005). Mikroorganisme mampu
berdiferensiasi dan berkembang dengan cara yang kompleks dalam
membentuk morfologi baru yang tumbuh pada permukaan dikenal sebagai biofilm (O’toole et al, 2000).
Bakteri memiliki dua formasi kehidupan, yaitu fomasi sel planktonik
bebas dan biofilm. Sekitar 99% bakteri berada dalam bentuk biofilmnya dan
hanya 1 % dalam bentuk planktonik. Diperkirakan 65% kasus infeksi
berkaitan dengan biofilm. Penting untuk menangani permasalahan biofilm
karena bakteri biofilm yang tumbuh dapat menyebabkan infeksi kronis yang
resisten terhadap terapi antibiotik dan stressor lainnya (Paraje, 2011).
Indonesia adalah negara megabiodiversity yang kaya akan tumbuhan
obat, dan sangat potensial untuk dikembangkan (Pers, 2010). Salah satu
tanaman obat tradisional yang banyak dimanfaatkan masyarakat Indonesia
adalah kemangi (Ocimum americanum L) (Umar, 2011). Minyak atsiri
merupakan komponen utama pada kemangi (Sarma et al, 2011). Senyawa
minyak atsiri kemangi yang paling utama adalah kamfor, metil sinamat, dan
sitral (Siemonsma, J.S & Piluek, K., 1994, Verma & Kotyal, 2012). Minyak
atsiri kemangi juga mengandung metil kavikol, linalool, eugenol, metil
eugenol, dan limonene (Shadia et al, 2007 & J. Wungsintaweekul et al,
2009).
Strategi yang dapat dilakukan dalam mengatasi permasalah biofilm
adalah dengan menggabungkan agen antimikroba dengan zat yang mampu
merusak lapisan permukaan pertumbuhan bakteri. Permasalahan biofilm
dapat dikendalikan dengan strategi antimikroba secara kimia, fisika, dan
biologi (Cortés et al, 2011). Minyak atsiri herba kemangi dalam hal ini
digunakan sebagai zat kimia yang diharapkan mampu mengatasi
2
UIN Syarif Hidayatullah Jakarta Pada penelitian yang dilakukan oleh Thaweboon & Thaweboon pada
tahun 2009, berkaitan dengan pemanfaatan minyak atsiri kemangi sebagai
antibakteri dan antibiofilm. Hasil penelitian tersebut menunjukkan bahwa
minyak atsiri kemangi selain mampu menghambat pertumbuhan bakteri
Streptococcus mutans, Lactobacillus casei, dan pertumbuhan jamur Candida
albicans dalam bentuk planktoniknya, minyak atsiri juga menunjukkan
aktivitas dalam menghambat pertumbuhan bakteri dan jamur tersebut dalam
bentuk biofilmnya. Penelitian uji aktivitas antibakteri dari minyak atsiri
kemangi yang lain dilakukan oleh Wungsintaweekul et al tahun 2009 dan
Parida et al tahun 2014. Hasil dari penelitian tersebut menunjukkan minyak
atsiri kemangi mempunyai aktivitas antibakteri terhadap Aspergillus flavus,
Bacillus subtilis, Escherichia coli, Mycobacterium phlei, Pseudomonas
aeruginosa, Proteus mirabilis, Staphylococcus aureus, Staphylococcus
epidermidis dan antijamur terhadap Candida albicans, Candida parapilosis,
Candida tropicalis.
Hasil penelitian uji antibakteri minyak atsiri kemang sebelumnya
menunjukkan adanya aktivitas minyak atsri terhadap bakteri planktonik
Escherchia coli, Pseudomonas aeruginosa, dan Staphylococcus aureus.
Namun, seperti yang sudah dikatakan sebelumnya yaitu permasalahan infeksi
lebih banyak disebabkan oleh bakteri dalam formasi biofilm dan ketiga
bakteri tersebut dapat membentuk biofilm sebagai mekanisme pertahanannya
(Bjarnsholt et al, 2011).
Berdasarkan latar belakang yang telah diuraikan di atas dan belum
adanya laporan mengenai aktivitas antibiofilm minyak atsiri kemangi
terhadap bakteri Escherichia coli, Pseudomonas aeruginosa, dan
Staphylococcus aureus, sehingga dilakukanlah penelitian uji aktivitas
antibiofilm in vitro minyak atsiri herba kemangi terhadap bakteri Escherichia
UIN Syarif Hidayatullah Jakarta 1.2.Perumusan masalah
Belum adanya informasi mengenai aktivitas antibiofilm minyak atsiri
kemangi terhadap bakteri Escherichia coli, Pseudomonas aeruginosa, dan
Staphylococcus aureus.
1.3.Tujuan Penelitian
Mendapatkan data dan informasi dari kemampuan minyak atsiri herba
kemangi dalam mencegah, menghambat dan menghancurkan biofilm bakteri
Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus.
1.4.Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi yang
cukup dari pemanfaatan minyak atsiri herba kemangi sebagai antibiofilm
4 UIN Syarif Hidayatullah Jakarta BAB II
TINJAUAN PUSTAKA
2.1.Infeksi
Infeksi merupakan invasi tubuh oleh mikroorganisme patogen yang
mampu menyebabkan sakit (Potter et al, 2005). Infeksi disebabkan
pembiakan mikroorganisme pada jaringan tubuh, terutama yang
menyebabkan cedera selular lokal akibat kompetisi metabolisme, toksin,
replikasi intra selular, atau respon antigen-antibodi (Dorland, 1998).
Mikroorganisme penyebab terjadi infeksi adalah bakteri, virus, jamur
dan protozoa. Mikroorganisme dapat masuk ke tubuh inangnya melalui
saluran pernapasan, saluran pencernaan, kulit dan rongga mulut (Pratiwi,
2008).
2.2.Biofilm
Biofilm merupakan bentuk dari pola hidup multiseluler mikroba dan
didefinisikan sebagai komunitas bakteri yang terorganisir, saling
berkomunikasi dan melekat pada permukaan inert atau hidup.
Mikroorganisme dalam biofilm terdapat di dalam matriks polimer yang
diproduksinya sendiri dengan bahan utamanya eksopolisakarida. Matriks
biofilm tersusun atas polisakarida, protein dan DNA yang berasal dari
mikroba (Paraje, 2011).
2.2.1.Tahap Perkembangan Biofilm
UIN Syarif Hidayatullah Jakarta
1. Perekatan Bakteri ke Permukaan
Bakteri planktonik bebas menuju suatu permukaan dan
melekat. Penempelan awal ini didasarkan pada daya tarik fisik dan
gaya elektrostatik tetapi belum ada penempelan secara kimia
(Paraje, 2011).
2. Perekatan Bakteri Secara Permanen
Beberapa dari sel reversibel yang teradsorpsi ini mulai
membuat persiapan untuk penempelan yang lebih kuat dengan
membentuk struktur tetap yang kemudian secara permanen
mengikat ke permukaan (Paraje, 2011).
3. Pembentukan Koloni
Sel-sel perintis biofilm akan memproduksi dan membuat
sel anakan yang akan membentuk mikrokoloni di permukaan
beberapa jam kemudian setelah penempelan permanen (Paraje,
2011).
4. Akumulasi Sel Biofilm
Biofilm yang terbentuk akan semakin banyak dan mulai
menghasilkan matriks polimer di sekitar mikrokoloni sebagai
langkah untuk penempelan yang ireversibel (Paraje, 2011).
5. Pelepasan Biofilm
Pada tahap berikutnya biofilm yang sudah matang akan
pecah dan sel-sel bakteri dibebaskan kemudian dapat menyebar ke
lokasi lain untuk membentuk biofilm yang baru (Paraje, 2011).
2.2.2.Resistensi Biofilm Terhadap Antibiotik
Satu aspek terpenting dari pembentukan biofilm bakteri
adalah peningkatan resistensi mikroba terhadap antibiotik dan
stressor lainnya. Sifat struktural dan karakteristik sel biofilm
menghasilkan resistensi terhadap agen antimikroba dan stressor
lainnya yang berkaitan dengan mekanisme perlindungan dan
6
UIN Syarif Hidayatullah Jakarta Gambar 2.2. Resistensi Biofilm Terhadap Antibiotik (Keller, 2014)
Faktor intrinsik dari resistensi merupakan bagian dari perkembangan biofilm yang disebabkan dari struktur biofilm dan sifat fisiologi hasil dari perubahan pola hidup biofilm. Pengaruh dari beberapa faktor intrinsik biofilm yang berbeda mempengaruhi resistensi antibiotik telah diidentifikasi. Berikut ini adalah mekanisme pertahanan yang menyebabkan resistensi :
1. Matriks biofilm dapat bertindak sebagai penghalang difusi Biofilm sebagai penghalang difusi fisik untuk mencegah antibiotik mencapai target. Antibiotik mampu menembus struktur campuran eksopolisakarida, DNA, dan protein untuk mencapai target tetapi tidak mampu mencapai
konsentrasi efektif disemua bagian (Paraje, 2011). 2. Pembentukan lingkungan mikro dalam biofilm
Menipisnya jumlah nutrisi dan oksigen di dalam biofilm dapat menyebabkan aktivitas metabolisme diubah dan menyebabkan perlambatan pertumbuhan bakteri (Paraje, 2011). 3. Diferensiasi menjadi sel persister
UIN Syarif Hidayatullah Jakarta 4. Peningkatan produksi tekanan oksidatif
Tekanan oksidatif yang disebabkan oleh
ketidakseimbangan antara jumlah oksidan, seperti radikal bebas, peroksida dan oksida nitrat, dengan antioksidannya. Gangguan keseimbangan prooksidan-antioksidan menyebabkan kelebihan produksi senyawa oksigen reaktif (SOR) yang dapat mengakibatkan kerusakan pada komponen seluler, termasuk DNA, protein dan lipid. Bakteri akan membentuk senyawan antioksidan sebagai respon fisiologis terhadap SOR, sehingga bakteri dapat beradaptasi terhadap tekanan oksidatif yang menyebabkan perubahan metabolik yang cepat. Enzim utama yang terlibat dalam system pertahanan antioksidan dan detoksifikasi SOR adalah superoksida dismutase (SOD) dan katalase (CAT) (Paraje, 2011).
5. Aksi antagonis antibiotik dan mekanisme degradasi aktif di beberapa bagian biofilm
Microenvironments dapat melawan aksi dari antibiotik dengan mekanisme degradasi aktif dibeberapa bagian biofilm. Bakteri saling berkomunikasi dan mengaktifkan gen-gen tertentu sehingga menghasilkan enzim atau toksin yang dapat
mendegradasi antibiotik (Paraje, 2011).
2.3.Kontrol Biofilm
Sterilisasi merupakan proses penghilangan semua jenis organisme
hidup yang terdapat pada suatu benda. Proses ini melibatkan aplikasi Biocidal
agent atau proses fisik dengan tujuan untuk membunuh atau menghilangkan
mikroorganisme (Pratiwi, 2008). Strategi yang dilakukan dalam mengkontrol
biofilm dapat dengan menggunakan metode kimia, fisika, dan biologi (Rai,
2013).
a. Fisik ; metode dengan sterilisasi panas merupakan cara yang paling
dipercaya dan banyak digunakan. Sterilisasi panas dibagi dua yaitu
8
UIN Syarif Hidayatullah Jakarta
b. Kimia ; metode yang dilakukan dengan menggunakan suatu bahan kimia
yang dapat membunuh atau menghilangkan mikroorganisme. Senyawa
kimia antibiofilm ini dapat menghambat quorum sensing sehingga
mengganggu pertukaran sinyal kimia antara sel-sel dalam sebuah proses
dan dapat merusak matriks biofilm sel-sel bakteri dalam koloni, sehingga
mendegradasi matriks yang menyebabkan pelepasan sel dari koloni dan
pembebasan sel ke lingkungan (Pratiwi, 2008 & Rai, 2013).
c. Biologi (Bakteriofage) ; Strategi dengan memanfaatkan virus tertentu
yang menginfeksi bakteri. Virus akan menghancurkan bakteri dengan
cara masuk ke sel inang dan melekat pada reseptor spesifik pada
permukaan bakteri, termasuk lipopolisakarida, protein, atau bahkan
flagella. Sehingga bakteri akan mati dan terjadinya penurunan biofilm
(Esperanza et al, 2011).
2.4.Kultur Biofilm in Vitro dengan Metode Static Microtiter Plate Assays
Metode ini dirancang untuk mengukur kemampuan mikroba yang dapat
menempel ke permukaan abiotik dalam waktu inkubasi berkisar 1-2 jam
sebagai inisiasi penempelan awal ke permukaan yang sudah dapat dinilai,
sedangkan untuk waktu inkubasi lebih lama dari 20 jam memungkinkan
untuk mengukur pembentukan biofilm (Bjarnsholt et al, 2011).
Keuntungan utama dari metode ini adalah hasil penepelan yang relatif
tinggi, memungkinkan perlindungan untuk bakteri yang kurang sempurna
dalam penempelan atau evaluasi perbedaan efek dari perlakuan atau senyawa
pada penempelan atau pembentukan biofilm. Kekurangan dari metode
mikrotiter adalah sulit dalam mempelajari struktur biofilm atau sifat
resistensi antimikroba. Hal ini disebabkan sulitnya dalam menvisualisasikan
biofilm secara mikroskopis dan dalam membedakan antara sel-sel hidup dan
UIN Syarif Hidayatullah Jakarta 2.5.Tumbuhan Kemangi (Ocimum americanum Linn)
(Sumber : Koleksi Pribadi)
Gambar 2.3. Tumbuhan Kemangi (Ocimum americanum L.)
2.5.1.Klasifikasi (Tjitrosoepomo, 2002).
Kingdom : Plantae
Division : Spermatophyta
Sub Division : Angiospermae
Class : Dicotyledonae
Order : Tubiflorae
Family : Lamiaceae
Genus : Ocimum
Species :Ocimum americanum L.
2.5.2.Sinonim
Ocimum americanum L. di kenal dengan hoary basil, wild
10
UIN Syarif Hidayatullah Jakarta
selaseh, kemangi, ruku-ruku. Thailand: Maenglak. (Siemonsma et al,
1994; Pitojo, 1996).
2.5.3.Morfologi
Karakteristik kemangi yaitu perawakan : herba tegak/semak,
tajuk membulat, bercabang banyak, sangat harum, tinggi 0,3 m-1,5 m;
batang : batang pokok tidak jelas, bercabang banyak, hijau, berambut
atau tidak; daun : tunggal, berhadapan, helaian daun bulat elips
memanjang, ujung meruncing-runcing, tangkai daun 0,25-3 cm,
pangkal bangun pasak sampai membulat, dikedua permukaan
berambut halus, berbintik-bintik, tepi daun bergerigi lemah –
bergelombang rata; bunga : susunan majemuk berkarang/tandan,
terminal, 2,5-14 cm, diketiak daun ujung, daun pelindung elip/bulat
telur, panjang 0,5-1 cm; kelopak : berjumlah 5 saling berlekatan
membentuk bibir, 1 membentuk bibir atas, bentuk bulat telur 2-3,5mm,
1 bibir buah membentuk 4 gigi, sisi luar berambut kelenjar, ungu atau
hijau; mahkota : berbibir, 3 bibir atas, 2 bibir bawah, panjang tabung
1,5-2mm, cuping mahkota 3-5mm, putih; benang sari : berjumlah 4,
tersisip di dasar mahkota, ada 2 yang panjang; putik : kepala putik
bercabang dua, tidak sama; buah : kelopak ikut menyusun buah, buah
tegak dan tertekan. (Sudarsono et al, 2002).
2.5.4.Kandungan Kimia
Ocimum americanum L. mengandung senyawa kimia alami
antara lain, minyak atsiri, karbohidrat, alkaloid, senyawa fenolik,
fitosterol, tanin, lignin, pati, saponin, flavonoid, terpenoid dan
antrakuinon. Minyak atsiri merupakan komponen kimia utama pada
Ocimum americanum L (Dhale et al, 2010; Sarma et al, 2011).
Senyawa kimia minyak atsiri yang paling utama pada kemangi adalah
kamfor, metil sinamat, sitral, metil cavikol, linalool, eugenol, metil
eugenol, dan limonene (Siemonsma et al, 1994; Verma et al, 2012;
UIN Syarif Hidayatullah Jakarta 2.5.5.Khasiat dan Kegunaan
Hasil penelitian yang telah ada menyebutkan bahwa minyak
atsiri dari kemangi memiliki efek antibakteri, antituberkolosis,
antijamur, dan antibiofilm (Sabra et al, 2007; Ntezurubanza et al,1986 ;
Thaweboon, 2009).
2.6.Sitral
Gambar 2.4. Struktur Kimia Sitral (Hamdard, 2007)
Sitral adalah salah satu komponen minyak atsiri yang banyak
ditemukan dalam berbagai tanaman aromatik dan memiliki bau lemon yang
khas. Sitral atau 3,7-dimetil-2,6 octadienal merupakan campuran dari dua
monoterpen asiklik yaitu geranial (trans-sitral atau sitral A) dan neral
(cis-sitral atau (cis-sitral B) dengan rumus molekul C10H16O (Chaimovitsh et al, 2010
& Shahzadi et al, 2014).
Sitral telah diketahui memiliki aktivitas sebagai antijamur, antibakteri,
dan insektisida. Sitral disebutkan juga merupakan senyawa alelopati aktif
(Chaimovitsh et al, 2010).
Sejumlah turunan monoterpene sendiri menunujukkan kemampuan
yang efektif sebagai kemoprevensi dan kemoterapi kanker pada tingkat sel
hewan uji maupun dalam uji klinis pada manusia. Senyawa terpen tak jenuh
mampu mengikat spesies oksigen aktif in vivo untuk memberikan epoksida
intermediet yang dapat mengalkilasi DNA, protein, dan bimolekular lainnya
12
UIN Syarif Hidayatullah Jakarta 2.7.Destilasi uap
Distilasi uap merupakan suatu metode untuk isolasi minyak atsiri dari
bahan tanaman. Bahan tanaman ditempatkan dalam alembik untuk diekstraksi
dengan uap-air tanpa menggunakan maserasi dalam air. Uap air dikeluarkan
melewati tanaman dari bagian dasar alembik lalu menuju ke atas. Uap yang
bercampur dengan minyak atsiri mengalir melalui saluran kolom dan
kemudian dikondensasikan sebelum didekantasi dan dikumpulkan dalam
suatu tabung. Minyak atsiri yang massa jenisnya lebih ringan daripada air
akan membentuk dua fase yang tidak bercampur yang dapat dengan mudah
dipisahkan. Prinsip dari teknik ini adalah menggabungkan kesetaraan tekanan
uap dengan dengan tekanan lingkungan di sekitar 100°C sehingga komponen
volatil dengan titik didih mulai dari 150-300°C dapat menguap pada suhu
yang mendekati titik didih air (Y. Li et al, 2014).
2.8.Tinjauan Bakteri Uji
2.8.1.Escherichia coli
Kingdom : Bacteria
Filum : Proteobacteria
Kelas : Gamma Proteobacteria
Ordo : Enterobacteriales
Famili : Enterobacteriaceae
Genus : Escherichia
Species : Escherichia coli (Todar, 2008)
Escherichia coli adalah bakteri batang Gram negatif fermentatif
dengan panjang 0,4–0,7 μm, lebar 1–3 μm, dan dapat berupa satu
individu maupun berpasangan (Gyles et al. 2010; Songer dan Post
2005). Bakteri ini dapat menyebabkan diare enterik/hemoragik, infeksi
UIN Syarif Hidayatullah Jakarta 2.8.2.Pseudomonas aeruginosa
Kingdom : Bacteria
Phylum : Proteobacteria
Class : Proteobacteria
Ordo : Pseudomonadales
Family : Pseudomonadaceae
Genus : Pseudomonas
Species : Pseudomonas aeruginosa (Holt et al, 1994)
Bakteri berbentuk batang, berukuran 0,6-2 μm, bergerak aktif
dengan flagel monotrika (flagel tunggal pada kutub), tidak berspora,
tidak mempunyai selubung, dan bersifat Gram negatif. Bakteri ini
dapat menyebabkan infeksi pada luka, meningitis, dan infeksi saluran air kemih (ISK) akibat pemakaian kateter dan alat-alat medis yang ditumbuhi biofilm bakteri (Jawetz, et al, 1996).
2.8.3.Staphylococcus aureus
Family : Staphylococcaceae Genus : Staphylococcus
Species : Stapylococcus aureus (Rosenbach, 1884)
Staphylococcus aureus adalah bakteri berbentuk bulat, bersifat Gram
positif, biasanya tersusun dalam rangkaian tidak beraturan seperti buah
anggur (Jawetz, 2005). Bakteri ini ditemukan secara alami pada kulit
dan dalam nasofaring dari tubuh manusia. Bakteri ini dapat
menyebabkan infeksi lokal pada kulit, hidung, uretra, vagina dan
14
UIN Syarif Hidayatullah Jakarta 2.9.Gas Chromatography-Mass Spectrophotometer (GC-MS)
Kromatografi gas merupakan salah satu metode pemisahan yang
berdasarkan partisi cuplikan antara fase gerak yang berupa gas pembawa dan fase diam yang menahan cuplikan secara selektif (Sastrohamidjojo dan Pranowo, 1985). Metode spektrometri massa didasarkan pada pengubahan molekul netral menjadi ion-ion bermuatan positif dan memisahkannya berdasarkan perbandingan massa terhadap muatan elektron (m/e) (Hendayana, 1994).
Pemisahan komponen senyawa dengan menggunakan GC (Chromatography Gas) terjadi di dalam kolom dengan melibatkan dua fase yaitu fase diam dan fase gerak. Fase diam adalah zat di dalam kolom sedangkan fase gerak adalah gas pembawa (Helium atau Hidrogen). GC (Chromatography Gas) adalah teknik pemisahan dimana larutan yang mudah menguap dan stabil terhadap pemanasan akan bermigrasi melalui kolom yang merupakan fase diam dengan suatu kecepatan yang tergantung pada rasio distribusinya. Pada umumnya larutan akan terelusi berdasarkan pada peningkatan titik didihnya (kecuali jika terjadi interaksi khusus antara solut dengan fase diam). Pemisahan pada kromatografi gas didasarkan pada titik didih suatu senyawa dikurangi dengan semua interaksi yang mungkin terjadi antara larutan dengan fase diam. Fase gerak
yang berupa gas akan mengelusi larutan dari ujung kolom yang akan dihantarkan ke detektor. Penggunaan suhu yang meningkat bertujuan untuk menjamin bahwa larutan akan menguap dan akan cepat terelusi, suhu yang digunakan 50-350⁰C (Sudjadi, 2007).
2.10.Analisis Respon Permukaan (Respon Surface Analysis)
Optimasi adalah sebuah proses yang bertujuan untuk mendapatkan kondisi dari suatu penerapan prosedur untuk menghasilkan respon terbaik.
Optimasi mengacu pada peningkatkan kinerja sistem, proses, atau produk hasil yang maksimal (Bezerra et al. 2008).
UIN Syarif Hidayatullah Jakarta data eksperimen yang diperoleh dalam kaitannya dengan desain eksperimental. Desain eksperimental adalah seperangkat spesifik
eksperimen ditentukan oleh matriks penyusunnya dengan kombinasi tingkat yang berbeda dari variabel yang diteliti (Bezerra et al. 2008). Tahap penerapan RSM sebagai teknik optimasi yaitu
Pemilihan variabel independen yang menghasilkan efek paling utama
pada wilayah eksperimental, sesuai dengan tujuan penelitian.
Pemilihan desain eksperimental dan melaksanakan eksperimen sesuai dengan matriks eksperimental yang dipilih.
Pengolahan secara matematika dan statistik dari data eksperimen yang
diperoleh dicocokan ke fungsi polinomial.
Evaluasi kecocokan model.
Verifikasi dari kebutuhan dan kemungkinan untuk melakukan
perubahan data ke wilayah yang optimal.
Memperoleh nilai optimum untuk masing-masing variabel (Bezerra et
16 UIN Syarif Hidayatullah Jakarta BAB III
METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan dari Maret sampai dengan Mei 2015 di
Laboratorium Genetika, Bidang Botani, Pusat Penelitian Biologi, Lembaga
Ilmu Pengetahuan Indonesia (LIPI) Cibinong.
3.2.Alat dan Bahan
3.2.1. Alat
Peralatan gelas, jarum ose, kapas, kain kasa, kertas saring, spatula,
mikropipet, bunsen, pinset, alumunium foil, plastik wrap, neraca analitik,
autoklaf, oven, inkubator, microwave, Laminar Air flow (LAF), lemari
pendingin, vial, vortex, microtiterplate flat-bottom polystyrene 96 wells,
iMark Bio-Rad microplate reader.
3.2.2. Bahan
1) Tanaman
Tumbuhan yang digunakan pada penelitian ini adalah
herba kemangi (Ocimum americanum L.) yang didapat di
Kampung Grogol. Kemangi dipanen pada umur 3 bulan dengan
kondisi tanah gembur, tanpa pestisida, dan pengairan dilakukan
menggunakan air hujan dan air kali di dekat kebun. Tanaman ini
telah dideterminasi di Herbarium Bogoriense, LIPI, Cibinong,
Bogor.
2) Bahan Uji
Aquadest, DMSO (Dimethy Sulfoxide), Heterotrof Agar
(HTR Agar), Heterotrof Cair (HTR Cair), Eosin Methyl Blue
Agar (EMB), Pseudomonas Isolation Agar (PIA), Etanol 70%,
UIN Syarif Hidayatullah Jakarta
3) Bakteri Uji
Escherichia coli DM6101 dan Pseudomonas aeruginosa
PMG203 didapatkan dari koleksi laboratorium mikrobiologi
kesehatan LIPI Cibinong dan Staphylococcus aureus didapatkan
dari hasil isolasi dari kulit manusia yang dilakukan di
laboratorium mikrobiologi kesehatan LIPI Cibinong, Bogor.
3.3.Ekstraksi Minyak Atsiri
Herba kemangi (batang, daun, dan bunga tanpa akar) diambil dalam keadaan segar kemudian ditimbang sebanyak 25 kg. Herba kemangi selanjutnya dicuci bersih untuk menghilangkan kotoran dan bahan asing yang menempel. Herba kemangi yang sudah dicuci bersih lalu dirajang dan dikeringkan dalam suhu ruangan tanpa terkena sinar matahari langsung selama 48 jam untuk mengurangi kadar airnya. Proses selanjutnya adalah destilasi minyak atsiri dengan menggunakan metode destilasi uap air.
Destilasi minyak atsiri dilakukan selama 4 jam. Minyak atsiri yang telah
didapatkan dibebas-airkan dengan penambahan natrium sulfat (Na2SO4)
anhidrat untuk menghilangkan kadar airnya. Minyak atsiri yang masa
jenisnya berbeda dengan air sehingga akan membentuk dua fase yang tidak
bercampur dapat dipisahkan (Parida et al, 2014). Minyak atsiri yang
dihasilkan dihitung nilai rendemennya berdasarkan perbandingan volume
minyak yang dihasilkan dari penyulingan dengan bobot sampel.
3.4.Penentuan Komponen Minyak Atsiri
18
UIN Syarif Hidayatullah Jakarta suhu dipertahankan selama 1 menit dan selanjutnya dinaikkan menjadi 250⁰C dengan kecepatan 4⁰C/menit. Kondisi pada suhu 250⁰C ini dipertahankan
selama 4,5 menit. Suhu injektor selama analisis berlangsung diprogram konstan pada suhu 225⁰C, sedangkan suhu detektor (Elektron Impact) dibuat
konstan pada suhu 250⁰C. Proses analisa ini memakan waktu 68 menit. Spektrum massa masing-masing puncak senyawa hasil kromatogram GC-MS selanjutnya dibandingkan dengan spektrum massa autentik yang ada pada bank NIST (National Institute of Standard Technology) library (Sulianti, Sri Budi., 2008).
1) Heterotrof Agar (HTR Agar)
Media Heterotrof Agar dibuat dengan melarutkan 15 g Bacto
Agar, Pepton 15 g, Tripton, 3 g, NaCl 5 g, dan K2HPO4 2,5 g dalam 1 L
aquadest dengan cara dipanaskan menggunakan microwave dan
dihomogenkan dengan sesekali digoyangkan.
Larutan media disterilisasi dengan autoclave pada 121ºC, 15
menit. Media ini digunakan sebagai media peremajaan Escherichia coli
dan Pseudomonas aeruginosa.
2) Heterotrof Cair (HTR Cair)
Media Heterotrof cair dibuat dengan melarutkan Pepton 15 g,
Tripton, 3 g, NaCl 5 g, K2HPO4 2,5 g, dan Glukosa 2.5 g dalam 1 L
aquadest dengan cara dipanaskan menggunakan microwave dan
UIN Syarif Hidayatullah Jakarta
Larutan media disterilisasi dengan autoclave pada 121ºC, 15
menit. Media ini digunakan sebagai media untuk menumbuhkan biofilm
bakteri uji.
3) Eosin methyl Blue Agar (EMB Agar)
Media Eosin methyl Blue Agar (EMB Agar) dibuat dengan
melarutkan media EMB Agar 24 g dalam 1 L aquades dengan cara
dipanaskan menggunakan microwave dan dihomogenkan dengan sesekali
digoyangkan.
Larutan media disterilisasi dengan autoclave pada 121ºC, 15
menit. Media ini digunakan sebagai media differensiasi untuk
Escherichia coli.
4) Luria Bertani Agar (LB)
Media LB dibuat dengan melarutkan melarutkan Bacto Agar 2,25
g, Yeast ekstrak 0,75 g, Tripton, 1,5 g, dan NaCl 0,75 g dalam dalam 150 ml aquadest. dengan cara dipanaskan menggunakan microwave dan dihomogenkan dengan sesekali digoyangkan.
Larutan disterilisasi dengan autoclave pada 121ºC, 15 menit.
Media ini digunakan sebagai peremajaan Staphylococcus aureus.
5) Pseudomonas Isolation Agar (PIA)
Media Pseudomonas Isolation Agar (PIA) dibuat dengan
melarutkan media PIA 4,5 g dan Bacto Agar dalam 1 L aquadest dengan
cara dipanaskan menggunakan microwave dan dihomogenkan dengan
sesekali digoyangkan.
Larutan disterilisasi dengan autoclave pada 121ºC, 15 menit.
Media ini digunakan sebagai selektif untuk Pseudomonas aeruginosa.
3.7.Kultur Escherichia coli
Escherichia coli diinokulasi pada media Eosin Metyl Blue Agar
dengan metode streak dan diinkubasi selama 24 Jam pada suhu 37o C. Bakteri
20
UIN Syarif Hidayatullah Jakarta 3.8.Kultur Pseudomonas aeruginosa
Pseudomonas aeruginosa ditumbuhkan pada media PIA dengan
metode streak dan diinkubasi selama 24 jam pada suhu 37oC. Bakteri hasil
inokulasi selanjutnya diberikan pewarnaan Gram untuk melihat bentuk mikroskopisnya.
3.9.Kultur Staphylococcus aureus
a) Isolasi Bakteri
Permukaan kulit digoreskan dengan menggunakan ose, kemudian ose tersebut digoreskan ke media Brain Heart Infusion (BHI). Inkubasi media BHI selama 24 jam pada suhu 37oC. Bakteri hasil inokulasi selanjutnya diberikan pewarnaan Gram. Bakteri yang memiliki karakteristik Gram positif dan berbentuk Staphylococcus dikarakterisasi menggunakan H2O2 3%, media pelarut fosfat, media Klingler Iron Agar (KIA), dan susu skim 20%.
b) Karakterisasi dengan Penambahan H2O2 3%
Satu ose bakteri uji digoreskan pada kaca objek, selanjutnya ditambahkan satu tetes H2O2 3%.
c) Karakterisasi Bakteri dengan Media Pelarut Fosfat
Media Brain Heart Infusion ditambahkan Ca3(PO4)2 dan NaCl
sebagai media selektif untuk Staphylococcus aureus. Media dimasukkan ke dalam cawan petri dan tunggu hingga mengeras. Satu ose bakteri diambil dengan menggunakan ose berbentuk jarum lalu ose tersebut ditusukkan ke media fosfat yang sudah mengeras. Inkubasi media selama 24 jam pada suhu 370C.
d) Karakterisasi Bakteri dengan Media Klingler Iron Agar (KIA)
UIN Syarif Hidayatullah Jakarta e) Karakterisasi Bakteri dengan Susu Skim 20%
Susu skim dibuat dengan konsentrasi 20%, setelah itu susu
disterilisasi dengan cara pasteurisasi selama 30 menit pada suhu 90oC. Sebanyak 2 ose kultur bakteri disuspensikan dalam 1 mL aquadest dalam tabung appendorf dan divortex untuk menghomogenkannya. Susu hasil pasteurisasi sebanyak 2 mL dimasukkan ke dalam tabung reaksi dan ditambahkan 500 µL kultur bakteri uji. Inkubasi selama 24 jam pada suhu 37oC.
spektrofotometer dengan densitas optik 600nm (Bjarnsholt et al, 2011).
3.11.Uji Pertumbuhan Biofilm Bakteri Uji
Suspensi bakteri sebanyak 200 µL dimasukkan ke dalam mikroplat.
Mikroplat ditutup dan diinkubasi pada 37oC dengan waktu 24, 48, 72, dan 96
jam. Setelah diinkubasi, isi mikroplat dikeluarkan dan dicuci dengan air.
Mikroplat selanjutnya diberikan pewarna dengan cara dimasukkan 200 µL
larutan kristal violet 1% dan diinkubasi selama 15 menit pada suhu ruang.
Pewarna dicuci dengan air dan dibiarkan kering pada suhu ruang. Setelah
mikroplat kering, sebanyak 200 µL Etanol 96% dimasukkan ke dalam
mikroplat dan inkubasi selama 15 menit pada suhu ruang. Mikroplat
selanjutnya diukur menggunakan microplate reader pada densitas optik
595nm (Bjarnsholt et al, 2011).
3.12.Uji Aktivitas Antibiofilm Minyak Atsiri Herba Kemangi
3.12.1.Uji Aktivitas Pencegahan Penempelan Biofilm
Sebanyak 200 µL seri konsentrasi minyak atsri yang sudah
22
UIN Syarif Hidayatullah Jakarta mikroplat ditutup dan diinkubasi pada suhu 27ºC selama 1 jam.
Setelah diinkubasi, seluruh isi mikroplat dikeluarkan dan dimasukkan
200 µL suspensi bakteri ke dalam mikroplat yang tadi lalu mikroplat
ditutup dan diinkubasi pada suhu 37oC dengan waktu 24, 48, 72, dan
96 jam (Bjarnsholt et al, 2011). Mikroplat yang sudah diinkubasi
dikeluarkan isinya dan dicuci dengan air. Mikroplat diberikan
pewarna dengan cara dimasukkan sebanyak 200 µL larutan kristal
violet 1% dan diinkubasi selama 15 menit pada suhu ruang. Pewarna
selanjutnya dicuci dengan air bersih dan dibiarkan kering pada suhu
ruang. Setelah mikroplat kering, sebanyak 200 µL etanol 96%
dimasukkan kedalam mikroplat dan diinkubasi selama 15 menit pada
suhu ruang. Setelah itu mikroplat diukur pada densitas optik 595nm
menggunakan microplate reader (Bjarnsholt et al, 2011). Pengujian
dilakukan triplo dan persentase penghambatan biofilm dihitung
dengan menggunakan rumus berikut (Nikolićet al. 2014):
*Ket : DO (Densitas Optik)
3.12.2.Uji Aktivitas Penghambatan Pembentukan Biofilm
Suspensi bakteri dicampurkan dengan minyak atsiri.
Konsentrasi suspensi bakteri-minyak atsiri dibuat menjadi 0,25%,
0,5%, 0,75%, dan 1% dan suspensi bakteri saja sebagai kontrol
negatif. Sebanyak 200 µL suspensi uji dan suspensi bakteri
dimasukkan ke dalam mikroplat, mikroplat ditutup dan diinkubasi
pada 37o C dengan waktu waktu 24, 48, 72, dan 96 jam. Setelah
diinkubasi, isi mikroplat dikeluarkan dan dicuci dengan air. Mikroplat
diberikan pewarna dengan cara dimasukkan 200 µL larutan kristal
violet 1% dan diinkubasi selama 15 menit pada suhu ruang. Pewarna
selanjutnya dicuci dengan air bersih dan dibiarkan kering pada suhu
ruang. Setelah mikroplat kering, sebanyak 200 µL etanol 96%
UIN Syarif Hidayatullah Jakarta
suhu ruang. Mikroplat diukur menggunakan microplate reader pada
densitas optik 595nm (Bjarnsholt et al, 2011). Pengujian dilakukan
triplo dan persentase penghambatan biofilm dihitung dengan
menggunakan rumus berikut (Nikolićet al. 2014):
*Ket : DO (Densitas Optik)
3.12.3.Uji Aktivitas Penghancuran Biofilm
Suspensi bakteri sebanyak 200 µL dimasukkan ke dalam
mikroplat, mikroplat ditutup, dan diinkubasi pada 37oC dengan waktu
24, 48, 72, dan 96 jam. Mikroplat yang sudah diinkubasi dikeluarkan
isinya lalu sebanyak 200 µL seri konsentrasi minyak atsiri
dimasukkan ke dalam mikroplat, kontrol negatif diisikan DMSO 9.8%
dan kontrol positif diisikan dengan Biorem, mikroplat ditutup dan
diinkubasi pada suhu dan waktu yang sudah ditentukan. Setelah
diinkubasi, isi mikroplat dikeluarkan, dicuci dengan air, dan mikroplat
diberikan pewarna. Pewarnaan dilakukan dengan cara dimasukkan
sebanyak 200 µL larutan kristal violet 1% dan diinkubasi selama 15
menit pada suhu ruang. Pewarna dicuci dengan air bersih dan
dibiarkan kering pada suhu ruang. Setelah mikroplat kering,
dimasukkan sebanyak 200 µL etanol 96% kedalam mikroplat dan
diinkubasi selama 15 menit pada suhu ruang. Setelah itu mikroplat
diukur pada densitas optik 595nm menggunakan microplate reader
(Bjarnsholt et al, 2011). Pengujian dilakukan triplo dan persentase
penghambatan biofilm dihitung dengan menggunakan rumus berikut
(Nikolićet al. 2014):
24
UIN Syarif Hidayatullah Jakarta 3.13.Analisa Data Uji Terseleksi
Metode analisis respon permukaan digunakan untuk membuat
25 UIN Syarif Hidayatullah Jakarta 4.1.Hasil
4.1.1. Determinasi
Hasil determinasi sampel tumbuhan dari Herbarium Bogoriense LIPI bogor pada tanggal 29 Desember 2014 membuktikan bahwa sampel yang digunakan dalam penelitian ini adalah benar jenis Ocimum americanum L., suku Lamiaceae, Kemangi. (lampiran 2)
4.1.2.Hasil Penyiapan Sampel
Herba kemangi basah dengan bobot 25 kg yang sudah
dikeringkan lalu ditimbang dan didapatkan berat kering sebanyak 20
kg. Herba kemangi selanjutnya dilakukan proses destilasi. Minyak
atsiri yang didapat dari hasil destilasi 20 kg herba kemangi adalah 35
mL. Rendemen minyak atsiri kemangi yang didapatkan yaitu 0,18 %
v/b (lampiran 3).
4.1.3.Analisis Komponen Kimia Minyak Atsiri Kemangi dengan GCMS
26
UIN Syarif Hidayatullah Jakarta Tabel 4.1. Hasil Analisis GCMS Komponen Kimia Minyak Atsiri
NO Waktu
10 38,211 1,165 Trans-,alpha,-Bergamotene 91
11 38,857 0,398 Humulene 99
12 40,565 0,161 beta-Bisabolene 98
13 41,618 3,300 Cis-alpha-Bisabolene 90
4.1.4.Hasil Isolasi dan Karakterisasi Bakteri Tabel 4.2. Kultur Bakteri Escherichia coli
Koloni Pertumbuhan Penampakan Mikroskopis Perbesaran 100x
Koloni hitam dengan pinggiran berwarna emas metalik pada EMB
UIN Syarif Hidayatullah Jakarta Tabel 4.3. Kultur Bakteri Pseudomonas aeruginosa
Koloni Pertumbuhan Penampakan Mikroskopis Perbesaran 100x
Koloni tumbuh pada media PIA menghasilkan warna kehijauan
Gram negatif, batang pendek, warna kemerahan
Tabel 4.5. Kultur Bakteri Staphylococcus aureus murni
Koloni Pertumbuhan Bakteri Uji S.aureus no 6
Penampakan Mikroskopis Perbesaran 100x
Koloni padat, bulat, halus, dan berwarna putih kekuningan
28
UIN Syarif Hidayatullah Jakarta Tabel 4.4. Uji Kultur Bakteri Staphylococcus aureus
Uji H2O2 3% Uji pada Media Pelarut Fosfat
Menghasilkan gelembung yang banyak
pada kaca objek no 6 Melarutkan fosfat paling banyak
Uji pada Media KIA (Kingler Iron
Agar) Koagulasi Susu Skim 20%
Terdapat warna kehitaman di titik tempat penusukan tabung no 6
Penggumpalan dan pengendapan sempurna dari susu pada tabung no 6
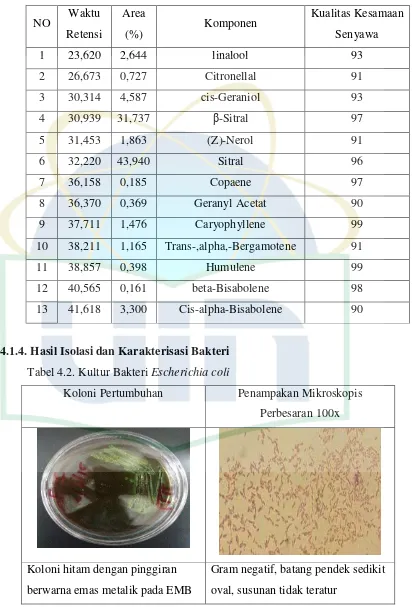
4.1.5.Hasil Uji Pertumbuhan Biofilm Bakteri
Pertumbuhan biofilm bakteri uji yang diinkubasi pada suhu
UIN Syarif Hidayatullah Jakarta Gambar 4.1. Grafik Uji Pertumbuhan Biofilm Bakteri Uji
(OD595nm)
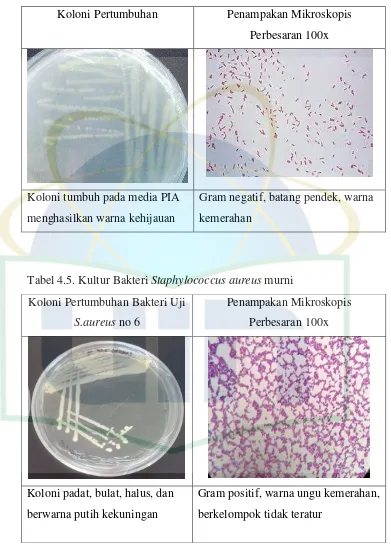
4.1.6.Hasil Uji Aktivitas Antibiofilm Minyak Atsiri Herba Kemangi Uji aktivitas antibiofilm minyak atsiri terhadap biofilm Escherichia coli, Pseudomonas aeruginosa, dan Staphylococcus aureus. Grafik persentase hasil uji aktivitas antibiofilm minyak atsiri dapat diliat pada gambar dibawah.
30
UIN Syarif Hidayatullah Jakarta Gambar 4.3. Aktivitas Antibiofilm Minyak Atsiri Terhadap Bakteri
Pseudomonas aeruginosa
UIN Syarif Hidayatullah Jakarta 4.1.7.Hasil Uji Pertumbuhan Biofilm Staphylococcus aureus
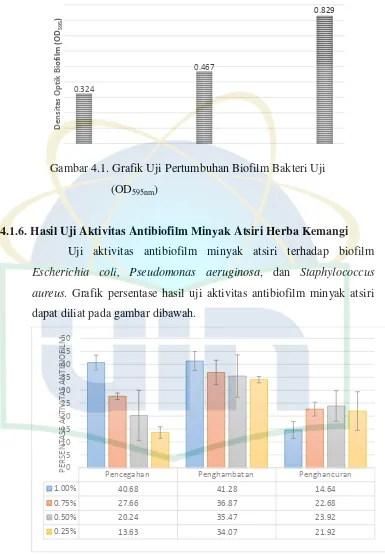
Uji pertumbuhan biofilm Staphylococcus aureus dilakukan
berdasarkan perbedaan waktu pertumbuhan. Densitas optik bakteri yang digunakan sebagai inisiasi untuk penumbuhan biofilm adalah 0,5 (DO = 0,5) dan suhu inkubasi bakteri adalah 37 oC.
Gambar 4.5. Densitas Optik Pertumbuhan Biofilm Staphylococcus aureus (OD595nm)
4.1.8.Hasil Uji Aktivitas Terseleksi Penghancuran Biofilm Staphylococcus aureus
Uji aktivitas terseleksi penghancuran biofilm Staphylococcus
32
UIN Syarif Hidayatullah Jakarta Gambar 4.6. Contour plot Persentase Penghancuran Biofilm dari
Perbandingan Suhu dengan Konsentrasi
Gambar 4.7. Contour plot Persentase Penghancuran Biofilm dari Perbandingan Waktu Kontak dengan Suhu
Contour plot di atas menunjukkan aktivitas penghancuran biofilm Staphylococcus aureus berdasarkan perbandingan pengaruh konsentrasi dengan suhu dan waktu kontak dengan suhu. Hasil pengolahan data dengan menggunakan respon surface analysis bertujuan untuk mendapatkan konsentrasi, suhu, dan waktu kontak terbaik untuk penghancuran biofilm Staphylococcus aureus. Saat data kondisi optimal untuk penghancuran biofilm sudah didapatkan, maka selanjutnya dilakukan kembali uji pada kondisi optimal penghancuran
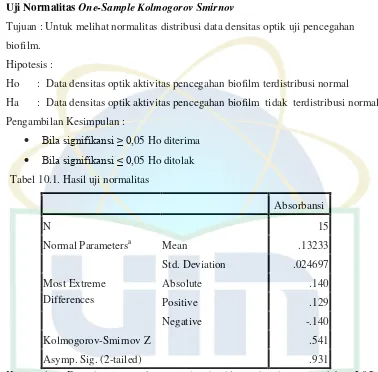
UIN Syarif Hidayatullah Jakarta Hasil uji aktivitas optimal minyak atsiri kemangi yang dibandingkan dengan kontrol positif yaitu Biorem dan kontrol
pelarut minyak atsiri dengan DMSO 9,8%.
Gambar 4.8. Grafik Hasil Uji Aktivitas Terseleksi Minyak Atsiri Kemangi
4.2.Pembahasan
Salah satu tanaman obat tradisional yang banyak dimanfaatkan masyarakat Indonesia adalah Ocimum americanum atau yang lebih dikenal dengan kemangi (Umar, 2011).
Hasil penelitian yang dilakukan oleh Thaweboon & Thaweboon tahun 2009, menunjukkan bahwa minyak atsiri kemangi memiliki aktivitas antimikroba yang juga mampu dalam menghancurkan biofilm dari bakteri Streptococcus mutans di mulut. Hasil penelitian lain yang telah ada juga menyebutkan bahwa minyak atsiri dari kemangi memiliki efek antibakteri, antituberkolosis, dan antijamur (Sabra et al, 2007; Ntezurubanza et al,1986;
Wungsintaweekul et al, 2009; Parida et al, 2014).
Bahan utama yang digunakan pada penelitian adalah minyak atsiri dari herba kemangi (Ocimum americanum L.), dan telah di determinasi di
Herbarium Bogoriense Pusat Penelitian Botani, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bogor.
Minyak atsiri herba kemangi didapat dengan cara destilasi uap-air dengan menggunakan destilasi uap-air yang prosesnya dilakukan selama 4
Ekstrak 0.25% DMSO 9.8% Biorem 0.25%
34
UIN Syarif Hidayatullah Jakarta jam. Metode destilasi uap dipilih karena merupakan salah satu metode yang sudah lama disetujui dan resmi untuk isolasi minyak atsiri dari bahan tanaman
(Y. Li et al, 2014). Metode ini juga sudah dilakukan oleh Parida et al tahun 2014 untuk mengekstraksi minyak atsiri dari daun kemangi. Hasil rendemen minyak atsiri kemangi yang didapat pada penelitian Parida et al adalah 0.2%
v/b sedangkan penelitian yang saat ini dilakukan menghasilkan rendemen
yang lebih rendah yaitu 0,18 % v/b. Perbedaan dapat disebabkan oleh faktor
lingkungan yaitu suhu udara dan tanah, intensitas cahaya dan kondisi
kelembaban. Sintesis metabolit sekunder sangat berkaitan dengan jumlah
cahaya yang dapat diterima oleh tumbuhan. Namun, faktor lingkungan
sepertinya yang paling berpengaruh pada akumulasi total minyak atsiri
(Shadia et al. 2007).
Minyak atsiri yang didapat selanjutnya dianalisis komponen kimianya dengan menggunakan GCMS (Gas Chromatography-Mass Spectrophotometer). Tujuannya adalah untuk mengetahui komponen-komponen kimia yang terdapat didalam minyak atsiri. Hasil analisis kimia minyak atsiri menunjukkan terdapat 13 komponen senyawa didalamnya. Senyawa yang paling dominan diantaranya Sitral (43,94%) dan β-Sitral ( 31,737%). Hasil jumlah komponen kimia yang didapat lebih rendah dibandingkan jumlah komponen minyak atsiri pada penelitian Parida et al
tahun 2014 yang menunjukkan terdapat 18 komponen kima dari minyak
atsirinya. Perbedaan jumlah komponen ini kemungkinan penyebabnya sama
dengan perbedaan jumlah rendemen minyak atsiri yang sebelumnya dibahas.
Perbedaan ini juga kemungkinan dapat terjadi akibat perbedaan teknik
analisis komponen kimia yang dilakukan oleh Parida et al tahun 2014 yang
menggunakan kormatografi gas-cair sedangkan pada penelitian ini
menggunakan kromatografi gas-spektroskopi massa. Meskipun jumlah
UIN Syarif Hidayatullah Jakarta dan 36,57% sedangkan pada penelitian ini didapatkan kadar masing-masing yaitu 43,94% dan 31,73%.
Minyak atsiri kemangi yang digunakan memiliki komponen kimia terbesarnya yaitu sitral. Sitral merupakan monoterpen yang sudah diketahui memiliki aktivitas farmakologi, termasuk didalamnya sebagai antibakteri, antijamur, antibakteri, insektisida, dan antibiofilm (Lima et al. 2012; Kalia, 2015; Chaimovitsh et al, 2010). Sitral sebagai antibiofilm dengan menghambat quorum sensing (QS) sehingga pembentukan biofilm terhambat. Pada penelitian oleh Dalleau tahun 2007, menunjukkan sitral dapat menghambat secara signifikan dari aktivitas metabolik ragi yang termasuk dalamnya Candida albicans biofilm ketika ditambahkan pada konsentrasi kurang dari 2,25 mg/mL pada saat awal pertumbuhan biofilm jamur. Mekanisme yang mungkin terjadi saat penghambatan QS yaitu persaingan pengikatan molekul sinyal pada reseptor, degradasi sinyal enzimatik seperti pada asil homoserine lakton (AHL) acylases (Sistem komunikasi sel-sel yang memungkinkan untuk mengkoordinasikan ekspresi gen), dan penghambatan penerimaan molekul sinyal (Verbel et al, 2012). Sitral sebagai antibakteri dan antibiofilm dapat mengikat oksigen saat didalam tubuh untuk membuat epoksida intermediet yang dapat mengalkilasi DNA, protein dan sejumlah biomolekular yang lainnya (Kalia, 2015 & Saddiq, 2010). Selain itu pada
penelitian yang dilakukan Thaweboon tahun 2012, menunjukkan minyak atsiri kemangi secara keseluruhan juga dapat bekerja sebagai antibiofilm dengan cara menghancurkan biofilm dari Streptococcus mutans yang sudah terbentuk.
36
UIN Syarif Hidayatullah Jakarta Pada penelitian ini minyak atsiri dilakukan uji aktivitas antibiofilm terhadap bakteri Escherichia coli, Pseudomonas aeruginosa, dan Staphylococcus aureus menggunakan metode Microtitter Plate Biofilm Assay. Pengujian ini dilakukan terhadap tiga aktivitas antibiofilm yaitu
pencegahan pertumbuhan biofilm, penghambatan pertumbuhan biofilm dan penghancuran biofilm.
Bakteri yang digunakan dalam penelitian ini adalah Escherichia coli, Pseudomonas aeruginosa yang didapat dari koleksi laboratorium mikrobiologi LIPI dan Staphylococcus aureus hasil isolasi. Ketiga bakteri yang digunakan ini dapat menyebabkan infeksi pada manusia. Escherichia coli merupakan flora normal di dalam usus tetapi dapat menjadi patogen jika jumlah bakteri ini dalam saluran pencernaan meningkat atau berada di luar usus. Escherichia coli dapat menghasilkan enterotoksin yang menyebabkan beberapa kasus diare, sepsis bila bakteri dapat memasuki aliran darah, infeksi saluran kemih, dan penyebab utama meningitis pada bayi (Jawetz et al, 1996). Pseudomonas aeruginosa dapat menyebabkan infeksi pada luka, membentuk nanah yang berwarna biru hijau, meningitis, dan infeksi saluran air kemih akibat pemakaian kateter dan alat-alat medis yang ditumbuhi biofilm bakteri (Jawetz, et al, 1996). Infeksi oleh Staphylococcus aureus ditandai dengan kerusakan jaringan yang disertai abses bernanah. Beberapa
penyakit infeksi yang disebabkan oleh bakteri ini adalah bisul, jerawat, impetigo, dan infeksi luka. Infeksi yang lebih berat diantaranya pneumonia, mastitis, plebitis, meningitis, infeksi saluran kemih, dan osteomielitis (Ryan et al, 1994; Warsa, 1994).
UIN Syarif Hidayatullah Jakarta pewarnaan Gram untuk melihat bentuk mikroskopisnya. Hasil dari inokulan menunjukkan ciri dari Pseudomonas aeruginosa yaitu pada media PIA
inokulan yang terbentuk menghasilkan warna hijau yang merupakan ciri khasnya dan bentuk mikroskopisnya batang pendek, warna kemerahan, dan tidak teratur. Hasil dari inokulan Staphylococcus aureus menunjukkan ciri khasnya yaitu secara makroskopis koloni padat, bulat, halus, dan berwarna putih kekuningan dan secara mikroskopis sel yang berbentuk bulat berwarna ungu dan berkoloni seperti buah anggur. Uji biokimia dilakukan untuk memastikan bahwa inokulan adalah spesies Staphylococcus aureus dengan menggunakan larutan H2O2 3%, media pelarut fosfat, media KIA, dan susu skim 20%. Bakteri hasil inokulasi dapat dipastikan Staphylococcus aureus jika pada uji H2O2 3% menghasilkan gelembung gas yang banyak, uji dengan susu skim 20% menyebabkan menggumpalnya susu, positif melarutkan fosfat pada media fosfat, dan terdapatnya titik kehitaman pada dasar penusukan di media KIA. Dari keseluruhan uji yang dilakukan terhadap tujuh jenis bakteri yang diuga Staphylococcus aureus menunjukkan bahwa bakteri nomor 6 positif merupakan Staphylococcus aureus.
Setelah semua bakteri uji dipastikan sesuai, maka selanjutnya dilakukan uji pembentukan biofilm. Hal ini bertujuan untuk mengetahui kemampuan bakteri uji yang digunakan dalam membentuk biofilm. Suspensi
bakteri dengan densitas optik 0.2 (DO600) pada masing-masing bakteri dimasukkan ke dalam mikroplat yang berbeda dan diinkubasi pada suhu 370C selama 72 jam. Densitas optik biofilm Escherichia coli, Pseudomonas aeruginosa, dan Staphylococcus aureus yang terbentuk masing-masing adalah 0,324, 0,66, dan 0,829. Grafik pertumbuhan dapat dilihat pada gambar 4.1. Hal ini menunjukkan bahwa bakteri dapat membentuk biofilm yang baik, sehingga metode dan bakteri yang digunkan sudah cocok dan dapat digunakan untuk uji aktivitas antibiofilm.
38
UIN Syarif Hidayatullah Jakarta pencegahan biofilm seiring dengan meningkatnya konsentrasi minyak atsiri. Hasil tertinggi ditunjukan pada konsentrasi 1% dengan persentase
pencegahan sebesar 40,68% dan yang terendah pada konsentrasi 0,25% dengan persentase pencegahan 13,63%. Hasil uji statistik pencegahan biofilm Escherichia coli dapat dilihat pada lampiran 10. Uji normalitas menunjukkan data pencegahan biofilm terdistribusi normal (p ≥ 0,05) dan pada uji homogenitas menunjukkan data pencegahan biofilm tidak terdistribusi homogen (p ≤ 0,05) sehingga dilanjutkan ke uji Kruskal Wallis. Hasil uji Kruskal Wallis (p ≤ 0,05) menunjukkan terdapat perbedaan yang bermakna pada data uji pencegahan biofilm Escherichia coli sehingga dilanjutkan ke uji Post Hoc untuk melihat perbedaanya. Hasil uji post hoc menunjukkan densitas optik kontrol negatif berbeda secara bermakna terhadap masing-masing konsentrasi uji.
Persentase aktivitas penghambatan Eschercia coli dapat dilihat pada gambar 4.2. Grafik pada gambar menunjukkan grafik eksponensial dimana terjadi peningkatan aktivitas penghambatan biofilm seiring dengan meningkatnya konsentrasi minyak atsiri. Penghambatan biofilm tertinggi ditunjukkan pada konsentrasi 1% dengan persentase penghambatan sebesar 41,28% dan yang terendah pada konsentrasi 0,25% dengan persentase pencegahan 34,07%. Hasil uji statistik penghambatan biofilm Escherichia coli dapat dilihat pada lampiran 11. Uji normalitas menunjukkan pencegahan
biofilm terdistribusi normal (p ≥ 0,05) dan pada uji homogenitas menunjukkan penghambatan biofilm terdistribusi homogen (p ≥ 0,05). Sehingga analisa dilanjutkan dengan uji Anova. Hasil uji Anova (p ≤ 0,05) menunjukkan terdapat perbedaan yang bermakna pada data uji penghambatan biofilm Escherichia coli sehingga dilanjutkan ke uji post hoc untuk melihat perbedaanya. Hasil uji Post Hoc menunjukkan densitas optik kontrol negatif berbeda secara bermakna terhadap masing-masing konsentrasi uji.
UIN Syarif Hidayatullah Jakarta aktivitas penghancuran 23,92% dan turun kembali pada konsentrasi 0,25% dengan persentase aktivitas penghancuran sebesar 21,92%. Aktivitas
penghancuran tersendah pada konsentrasi 1% dengan aktivtas penghancuran sebesar 14,64%. Hasil uji statistik penghancuran biofilm Escherichia coli dapat dilihat pada lampiran 12. Hasil uji normalitas menunjukkan pencegahan biofilm terdistribusi normal (p ≥ 0.05) dan pada uji homogenitas menunjukkan pencegahan biofilm terdistribusi homogen (p ≥ 0.05) sehingga memenuhi persyataran untuk uji Anova. Hasil uji Anova (p ≥ 0.05) menunjukkan tidak terdapat perbedaan yang bermakna.
Uji aktivitas antibiofilm minyak atsiri selanjutnya dilakukan terhadap pencegahan, penghambatan, dan penghancuran biofilm Pseudomonas aeruginosa. Persentase pencegahan biofilm Pseudomonas aeruginosa pada gambar 4.3. Grafik pada gambar menunjukkan peningkatan aktivitas pencegahan biofilm seiring dengan meningkatnya konsentrasi minyak atsiri. Pencegahan biofilm tertinggi ditunjukkan pada konsentrasi 1% dengan persentase pencegahan sebesar 34,89% dan yang terendah pada konsentrasi 0,25% dengan persentase pencegahan 20,54%. Hasil uji statistik pencegahan biofilm Pseudomonas aeruginosa dapat dilihat pada lampiran 13. Hasil uji normalitas menunjukkan pencegahan biofilm Pseudomonas aeruginosa terdistribusi normal (p ≥ 0,05) tetapi uji homogenitas (p ≤ 0,05)
menunjukkan pencegahan biofilm Pseudomonas aeruginosa tidak terdistribusi homogen, sehingga analisa dilanjutkan dengan uji Kruskal-Wallis. Hasil uji Kruskal-Wallis (p ≤ 0,05) menunjukkan terdapat perbedaan yang bermakna, maka dilakukan uji post hoc. Hasil uji post hoc menunjukkan densitas optik kontrol negatif berbeda secara bermakna terhadap masing-masing konsentrasi uji.