IMMUNOMODULATOR EKSTRAK
DAUN KUMIS KUCING (
Orthosiphon stamineus
Benth)
DAN BUNGA KNOP (
Gomphrena globosa
L.)
TRI HARI AQUARINI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kajian Keamanan dan Aktivitas Immunomodulator Ekstrak Daun Kumis Kucing (Orthosiphon stamineus Benth) dan Bunga Knop (Gomphrena globosa L.) adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2006
Tri Hari Aquarini NIM P09500014
ABSTRAK
TRI HARI AQUARINI. Kajian Keamanan dan Aktivitas
Immunomodulator Ekstrak Daun Kumis Kucing (
Orthosiphon
stamineus
Benth) Dan Bunga Knop (
Gomphrena globosa
L.)
.
Di
bawah bimbingan FRANSISKA RUNGKAT ZAKARIA dan
MAGGY THENAWIJAYA SUHARTONO
Daun kumis kucing (Orthosiphon stamineus Benth) dan bunga knop (Gomphrena globosa L.) telah lama digunakan secara tradisional untuk mencegah atau mengobati berbagai macam penyakit. Daun kumis biasa digunakan untuk mencegah infeksi kandung kemih, kencing batu, infeksi saluran kemih dan mengobati diabetes melitus, rematik, dan asam urat. Bunga knop biasa digunakan untuk mengobati sesak napas karena asma, batuk rejan, radang saluran napas, disentri dan sakit panas. Walaupun demikian, belum ada informasi ilmiah mengenai keamanan kedua produk ini untuk dikonsumsi. Tujuan dari penelitian ini adalah menentukan metode pengeringan terbaik untuk membuat bubuk daun kumis kucing dan bunga knop dan untuk menguji pengaruh ekstrak kedua produk ini terhadap proliferasi sel limfosit manusia. Metode pengeringan terbaik untuk kumis kucing adalah pengeringan dengan sinar matahari, ditunjukkan oleh nilai rataan konsentrasi total fenol sebesar 123.434 + 12.159 mg fenolik/g berat kering yang lebih tinggi dari pada nilai rataan total fenol pada pengeringan dengan oven sebesar 16.918 + 0.174 mg fenolik/g berat kering dan oleh nilai rataan aktivitas antioksidan yang dinyatakan sebagai Trolox Equivalent Antioxidant Capacity (TEAC) sebesar 1354.756 + 1.515 mM/g berat kering dan 470.441 + 61.670 mM/g berat kering. Metode pengeringan terbaik untuk bunga knop adalah pengeringan dengan oven ditunjukkan oleh nilai rataan konsentrasi total fenolnya 3.069 + 0.168 mg fenolik/g berat kering yang lebih tinggi dari pada nilai rataan total fenol pada pengeringan dengan sinar matahari sebesar 2.239+0.055 mg fenolik/g berat kering dan oleh nilai rataan aktivitas antioksidannya berturut-turut sebesar nilai TEAC 108.346+14.166 mM/g berat kering dan 56.070 + 7.085 mM/g berat kering. Pengujian keamanan ekstrak air daun kumis kucing dan bunga knop dilakukan menggunakan sel limfosit manusia yang dikultur dengan menambahkan ekstrak keduanya dan atau mitogen. Untuk ekstrak daun kumis kucing peningkatan konsentrasi dari 1.203 mg/ml menjadi 2.406 mg/ml kemudian menjadi 4.812 mg/ml meningkatkan rataan indeks stimulasi (IS) berturut-turut sebesar 1.518 + 0.124 menjadi 1.819+0.031 kemudian menjadi 2.389+0.148. Untuk bunga knop peningkatan konsentrasi dari 0.4115 mg/ml menjadi 0.823 mg/ml juga meningkatkan rataan IS berturut-turut sebesar 1.011+0.082 dan 1.071 + 0.122. Sebaliknya, peningkatan konsentrasi menjadi 1.646 mg/ml kemudian menjadi 3.292 mg/ml menghambat proliferasi sel limfosit sebesar 0.938 + 0.041 dan 0.780 + 0.142. Tampaknya bubuk daun kumis kucing tidak bersifat racun terhadap sel limfosit, sebaliknya mempunyai aktivitas imunomodulator. Bubuk bunga knop pada konsentrasi yang lebih tinggi tampaknya bersifat racun.
© Hak cipta milik Tri Hari Aquarini, tahun 2006 Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam
bentuk apapun, baik cetak, fotokopi, mikrofilm dan sebagainya
KAJIAN KEAMANAN DAN AKTIVITAS
IMMUNOMODULATOR EKSTRAK
DAUN KUMIS KUCING (
Orthosiphon stamineus
Benth)
DAN BUNGA KNOP (
Gomphrena globosa
L.)
TRI HARI AQUARINI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Keamanan dan Aktivitas Immunomodulator Ekstrak Daun Kumis Kucing (Orthosiphon stamineus Benth) dan Bunga Knop (Gomphrena globosa L.)
Nama : Tri Hari Aquarini NIM : P09500014
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Fransiska R. Zakaria, M.Sc. Prof. Dr. Ir. Maggy T. Suhartono Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, M.S. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
PRAKATA
Alhamdulillah segala puji bagi Allah yang dengan seizinnya penulis dapat menyelesaikan penelitian dan penulisan tesis ini, yang berjudul Kajian keamanan dan aktivitas immunomodulator ekstrak daun kumis kucing (Orthosiphon stamineus Benth) dan bunga knop (Gomphrena globosa L.).
Pada kesempatan ini, penulis menyampaikan terima kasih kepada :
1. Prof. Dr. Ir. Fransiska R. Zakaria selaku ketua komisi pembimbing yang selalu memberi semangat, motivasi dan bimbingan pada penulis dalam melaksanakan penelitian dan penulisan tesis ini.
2. Prof. Dr. Maggy T. Suhartono, selaku anggota komisi pembimbing yang juga selalu memberi semangat dan bimbingan selama penelitian dan penulisan tesis ini.
3. Ir. Didah Nur Faridah, MSi., atas segala bantuan dan bimbingannya selama penelitian dan penulisan tesis ini.
4. Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS, selaku ketua Program Studi Ilmu Pangan.
5. Program Hibah B Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian IPB yang telah mensponsori penelitian ini.
6. Ibu Prof. Dr. Aisjah Girindra yang terus memberi semangat agar penulis dapat menyelesaikan studinya.
7. Teman-teman di LPPOM-MUI atas segala dukungan dan doanya.
8. Laboran dan pegawai di Lab. PAU BIOTEK, Mbak Ika, Mbak Eni dan Novi yang selalu memberi semangat dan bantuan bila ada kesulitan selama penulis bekerja di laboratorium.
9. Teman-teman di Lab. Mikrobiologi PAU BIOTEK, Mbak Eko, Mbak Yuyun, Emma, Dina, Siti, Agnes, Rudi, Bobby, Eni dan Darta yang selalu berbagi ilmu dan saling mendukung.
10.Adik-adik satu penelitian Nora dan Inggrid yang selalu saling menyemangati dan bekerja sama.
11.Teman-teman pada Program Studi Ilmu Pangan yang selalu bersedia membantu dan memberi semangat kepada penulis untuk menyelesaikan penelitian.
12. Papa dan Mama juga Bapak (Soedibjo N.H) dan Ibu (Sumarti) atas segala dukungan dan bantuannya.
13. Suamiku tercinta Mas Upi dan anak-anakku tersayang Mbak Ima, Mbak Ifa, Mas Fawzan dan Adek Ira atas segala pengorbanan dan pengertiannya selama Ibu kuliah.
14. Kakak-kakakku Mas Eko, Bu Nien, Mbak Yanti dan Aa Bagus serta adik-adikku De Ida dan Joko, De Ika dan Gandjar, De Dewi, dan De Rudi dan Fika atas segala doa dan dukungannya.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan tesis ini, oleh karena itu penulis mohon kritik dan saran untuk kesempurnaan tesis ini. Semoga penelitian ini bermanfaat bagi kita semua. Amin.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, pada tanggal 18 Februari 1969 sebagai anak terakhir dari tiga bersaudara putra Bapak Prof. Dr. Harimurti Martojo dan Ibu Rastini Rasjid, MSc. Penulis menempuh pendidikan SD sampai SMA di Bogor. Tahun 1987 diterima di Institut Pertanian Bogor dan tahun 1988 diterima di Jurusan Teknologi Industri Pertanian, Fateta IPB. Penulis menyelesaikan studi Sarjananya pada tahun 1992.
Sejak 1993 sampai sekarang penulis bekerja paruh waktu di Lembaga Pengkajian Pangan dan Obat-obatan-MUI (LPPOM-MUI). Penulis telah menikah dengan dr. Supriyadi Bektiwibowo SpA dan dikaruniai empat orang anak, Fathimah Hanun Syifaul Jannah, Hanifah Sakinatun Khalidah, Muhammad Khalid Fawzan ’Adziima dan Khadijah Zhafirah Nurul Ramadhani.
DAFTAR ISI
Halaman
DAFTAR TABEL ... 11
DAFTAR GAMBAR ... 12
DAFTAR LAMPIRAN ... 13
PENDAHULUAN ... 14
Latar Belakang ... 14
Tujuan ... 15
TINJAUAN PUSTAKA ... 16
Kumis Kucing (Orthosiphon stamineus Benth) ... 16
Bunga Knop (Gomphrena globosa L.) ... 18
Pengeringan ... 21
Senyawa Fenolik ... 23
Keamanan Pangan ... 25
Limfosit dan Proliferasi Sel Limfosit ... 26
Immunomodulator ... 29
Kultur Sel ... 30
BAHAN DAN METODE ... 32
Bahan dan Alat ... 32
Metode Penelitian ... 33
Pembuatan Bubuk Daun Kumis Kucing dan Bubuk Bunga Knop ... 33
Metode Pengeringan Oven ... 33
Metode Pengeringan Sinar Matahari ... 33
Pembuatan Ekstrak Air Daun Kumis Kucing dan Bunga Knop Segar dan Bubuk ... 33
Analisa Total Fenol modifikasi metode Chandler dan Dodds (Shetty et al. 1995)... 34
Analisa Aktivitas Antioksidan (Kubo et al. 2002) ... 34
Analisa Proksimat (Apriyantono et al. 1989)... 35
Analisa Proliferasi Limfosit ... 37
Persiapan Larutan Ekstrak Daun Kumis Kucing dan Bunga Knop Serta Larutan Mitogen ………... 37
Persiapan Medium Kultur Sel Limfosit (Koesitoresmi 2002), Isolasi Limfosit (Nurrahman 1999) dan Penghitungan Sel ... 38
Kultur Limfosit ... 40
HASIL DAN PEMBAHASAN... 42
Daun Kumis Kucing ... 42
Metode Pengeringan ... 42
Total Fenol dan Aktivitas Antioksidan... 44
Analisa Proksimat Bubuk Daun Kumis Kucing Hasil Pengeringan Dengan Sinar Matahari ... 49
Bunga Knop... 53
Metode Pengeringan... 53
Total Fenol dan Aktivitas Antioksidan... 55
Analisa Proksimat Bubuk Bunga Knop Hasil Pengeringan Dengan Oven ... 59
Pengujian Ekstrak Bunga Knop Terhadap Proliferasi Sel Limfosit Dengan Metode MTT... 60
SIMPULAN DAN SARAN ... 65
Simpulan ... 65
Saran ... 65
DAFTAR PUSTAKA... 66
DAFTAR TABEL
Halaman
1 Mitogen-mitogen ”nonspecific” yang mengaktivasi sel limfosit manusia ... 28
2 Bahan-bahan yang ditanam ke dalam kultur sel... 41
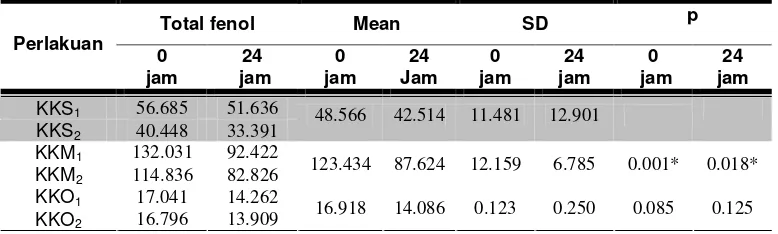
3 Perbandingan total fenol pada 0 jam dan 24 jam antara ekstrak air masing-masing perlakuan dengan ekstrak air daun kumis kucing segar ... 45
4 Perbandingan aktivitas antioksidan pada 0 jam dan 24 jam antara ekstrak air masing-masing perlakuan dengan ekstrak air daun kumis kucing segar ...…... 47
5 Hasil analisa proksimat bubuk daun kumis kucing hasil pengeringan dengan sinar matahari ... 49
6 Perbandingan indeks stimulasi antara kultur yang ditambah ekstrak daun kumis kucing dengan mitogen (Con A, LPS dan PK) dengan yang ditambah ekstrak daun kumis kucing saja pada konsentrasi C2 (1.203 mg/ml) ,C4 (2.406 mg/ml) dan C8 (4.812 mg/ml) ... 50
7 Perbandingan total fenol pada 0 jam dan 24 jam antara ekstrak air masing-masing perlakuan dengan ekstrak air bunga knop segar... 54
8 Perbandingan aktivitas antioksidan pada 0 jam dan 24 jam antara ekstrak air masing-masing perlakuan dengan ekstrak air bunga knop segar...…… 57
9 Hasil analisa proksimat bubuk bunga knop hasil pengeringan dengan oven ... 59
10 Perbandingan indeks stimulasi antara kultur yang ditambah ekstrak bunga knop dengan mitogen (Con A, LPS dan PK) dengan yang ditambah ekstrak bunga knop saja pada konsentrasi C1 (0.4115 mg/ml), C2 (0.8230 mg/ml), C4 (1.646 mg/ml) dan C8 (3.292 mg/ml)... 60
11 Perbandingan hasil penelitian ekstrak daun kumis kucing dengan bunga knop ... 64
12 Hasil analisa total fenol dan aktivitas antioksidan... 77
13 Hasil analisa MTT ekstrak bunga knop ... 77
14 Hasil analisa MTT ekstrak daun kumis kucing... ... 78
15 Absorbansi untuk Trolox (mM)... ... 79
DAFTAR GAMBAR
Halaman
1 Tanaman kumis kucing (Orthosiphon stamineus Benth) ... 16
2 Tanaman bunga knop (Gomphrena globosa L.) ... 19
3 Pengambilan darah secara aseptis... 39
4 Bubuk daun kumis kucing ... 43
5 Ekstrak air bubuk daun kumis kucing... 43
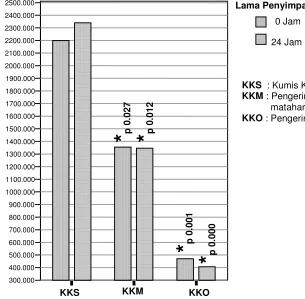
6 Perbandingan total fenol ekstrak air masing-masing perlakuan pada daun kumis kucing ... 46
7 Perbandingan analisa aktivitas antioksidan masing-masing perlakuan pada daun kumis kucing ... 47
8 Perbandingan indeks stimulasi antara kultur yang ditambah ekstrak daun kumis kucing saja dengan yang ditambah mitogen (Con A, LPS dan PK ) saja dan dengan ekstrak daun kumis kucing ditambah mitogen ... 52
9 Bubuk bunga knop ... 54
10 Ekstrak air bubuk bunga knop... ... 54
11 Perbandingan total fenol ekstrak air masing-masing perlakuan pada bunga knop ... 57
12 Perbandingan analisa aktivitas antioksidan masing-masing perlakuan pada Bungaknop... 58
13 Perbandingan indeks stimulasi antara kultur yang ditambah ekstrak bunga knop saja dengan yang ditambah mitogen (Con A, LPS dan PK ) saja dan dengan ekstrak bunga knop ditambah mitogen ... 61
14 Kurva standar Trolox ... 79
DAFTAR LAMPIRAN
Halaman
1 Dosis dasar jumlah penggunaan daun segar dan bubuk daun kumis
kucing untuk membuat ekstrak air …..………. 72
2 Dosis dasar jumlah penggunaan bunga segar dan bubuk bunga knop untuk membuat ekstrak air ...……… 73
3 Contoh Perhitungan Konsentrasi Ekstrak Daun Kumis Kucing ... 74
4 Contoh Perhitungan Konsentrasi Ekstrak Bunga Knop ... 75
5 Penentuan konsentrasi larutan mitogen (LPS, Con A dan Pokeweed) ... 76
6 Master tabel data penelitian ... 77
7 Tabel absorbansi dan kurva standar trolox ... 79
8 Tabel absorbansi dan kurva standar asam tanat... 80
9 Daftar singkatan ... 81
10 Hasil uji statistik (ANOVA) kadar total fenol ekstrak air daun kumis Kucing ...….... . 82
11 Hasil uji statistik (ANOVA) aktivitas antioksidan ekstrak air daun kumis Kucing ... 84
12 Hasil uji statistik (ANOVA) indeks stimulasi ekstrak daun kumis kucing ....86
13 Hasil uji statistik (ANOVA) kadar total fenol ekstrak air bunga knop ...….90
14 Hasil uji statistik (ANOVA) aktivitas antioksidan ekstrak air bunga knop.... 92
PENDAHULUAN
Latar Belakang
Seiring dengan semboyan kembali ke alam, akhir-akhir ini minat
masyarakat untuk menggunakan bahan-bahan alami semakin meningkat. Hal ini
terbukti dengan semakin banyaknya industri-industri baik industri kecil maupun
besar yang menggunakan tumbuh-tumbuhan yang banyak terdapat di Indonesia.
Kenyataan ini mendorong dilakukannya penelitian-penelitian tentang
tumbuhan-tumbuhan yang secara tradisional sering digunakan untuk mencegah atau
mengobati berbagai penyakit.
Di hutan tropik Indonesia terdapat sekitar 30.000 spesies tumbuhan
berbunga. Dari jumlah tersebut, diperkirakan tidak kurang dari 9.606 spesies
diketahui berkhasiat obat (Mahendra dan Fauzi 2005), diantaranya kumis kucing
dan bunga knop (Dalimartha 2000). Dalam kehidupan sehari-hari, masyarakat
biasa mengkonsumsi kumis kucing dan bunga knop dalam bentuk air rebusan.
Kumis kucing secara tradisional biasa digunakan untuk mencegah infeksi
kandung kemih, kencing batu, infeksi saluran kemih dan mengobati diabetes
melitus, rematik, batu kemih, batu ginjal dan asam urat (Mahendra dan Fauzi
2005). Bunga knop secara tradisional biasa digunakan untuk mengobati sesak
napas karena asma, batuk rejan (pertusis), radang saluran napas, radang mata,
sakit kepala, disentri dan sakit panas (Dalimartha 2000).
Daun kumis kucing dan bunga knop segar mempunyai kandungan air yang
tinggi, sehingga tidak dapat disimpan dalam waktu yang relatif lama.
Berdasarkan kenyataan tersebut, perlu dilakukan pengawetan terhadap kedua
komoditas ini yaitu dalam bentuk bubuk. Penelitian perlu dilakukan untuk
membuat bubuk dengan metode terbaik, sehingga komponen-komponen penting
yang terkandung di dalam daun kumis kucing dan bunga knop tidak banyak yang
hilang.
Produk dalam bentuk bubuk ini dapat dikembangkan sebagai suatu produk
minuman seduhan, sehingga dapat memberi nilai tambah terhadap daun kumis
minuman seduhan kedua komoditas tersebut dapat dijadikan sebagai minuman
fungsional.
Sebelum dapat dikonsumsi secara aman, minuman seduhan daun kumis
kucing dan bunga knop terlebih dahulu harus diuji keamanannya ddan fungsi
biologis lainnya. Untuk itu perlu diketahui dosis yang aman untuk dikonsumsi
sehari-hari dengan cara pengujian secara in vitro terhadap proliferasi sel limfosit
manusia. Penggunaan sel limfosit manusia adalah karena limfosit merupakan sel
yang sangat rentan terhadap bahan kimia, sehingga pengujian dengan limfosit ini
dapat memberikan hasil yang akurat dan sensitif. Di samping itu, penggunaan sel
limfosit dapat menggambarkan adanya aktifitas immunomodulator, yaitu memacu
atau menekan respon imun (Pranoto 2003 ; Wahyuni 2004 ; Lin et al. 2005).
Penelitian-penelitian yang menggunakan sel limfosit untuk pengujian keamanan
pangan antara lain cincau hijau (Zakaria dan Prangdimurti 2001 ; Koesitoresmi
2002), jahe (Tejasari et al. 2000 ; Nurrahman 1998) dan makanan jajanan (Zakaria
et al. 1997).
Tujuan
Tujuan penelitian ini adalah 1) memilih metode pengeringan terbaik untuk
membuat bubuk seduhan daun kumis kucing dan bunga knop 2) menentukan
dosis yang aman dari kedua komoditas tersebut dengan pengujian secara in vitro
terhadap proliferasi sel limfosit manusia 3) Menunjukkan adanya aktivitas
TINJAUAN PUSTAKA
Kumis Kucing (Orthosiphon stamineus Benth)
Tanaman kumis kucing (Orthosiphon stamineus Benth) diduga berasal dari
daerah Afrika tropik, kemudian menyebar ke wilayah Georgia (Kaukasus), Kuba,
Asia dan Australia Tropik. Penyebarannya di Indonesia, yaitu di Jawa sejak 1928,
India, Malaysia, Vietnam dan Thailand (de Padua et al. 1999).
Gambar 1 Tanaman kumis kucing (Orthosiphon stamineus Benth)
Menurut Dalimartha (2000) kumis kucing tersebar di Sumatera dengan
nama daerah kumis kucing (bahasa Melayu), di Jawa dengan nama daerah kumis
kucing (bahasa Sunda) atau remujung (bahasa Jawa) dan soengoet koceng (bahasa
Madura). Sentra produksi kumis kucing yaitu Jawa Tengah (Ambarawa, Kopeng
dan Blora), Jawa Barat (Sukabumi dan Bogor), Jawa Timur, Sumatera Barat,
Sumatera Utara, Aceh dan Sulawesi Utara (Mahendra dan Fauzi 2005).
Berdasarkan ilmu taksonomi (Mahendra dan Fauzi 2005) tata nama kumis
kucing adalah sebagai berikut.
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Tubiflorae
Famili : Labitae (Laminaceae)
Genus : Orthosiphon
Spesies : Orthosiphon stamineus Benth
Tanaman kumis kucing berakar tunggang, termasuk tanaman tahunan,
tumbuh tegak dengan tinggi mencapai 100-150 cm. Batang berbentuk persegi
empat agak beralur, bercabang-cabang, berambut pendek atau gundul, berwarna
hijau atau keunguan dan berdiameter sekitar 1.5 cm. Daun berbentuk bulat telur,
lonjong, lanset atau belah ketupat dengan permukaan berbintik-bintik dan licin
karena adanya kelenjar dalam jumlah banyak dan berwarna hijau keunguan.
Panjang daun sekitar 10 cm dan lebar 3-5 cm (Mahendra dan Fauzi 2000). Bunga
majemuk dalam tandan yang keluar di ujung percabangan, berwarna ungu pucat
atau putih, benang sari lebih panjang dari tabung bunga. Buah berupa buah kotak,
bulat telur, masih muda berwarna hijau, setelah tua berwarna coklat. Biji kecil,
masih muda berwarna hijau, setelah tua berwana hitam Kumis kucing biasa
tumbuh liar di sepanjang anak sungai dan selokan atau ditanam di pekarangan
sebagai tumbuhan obat. Tumbuhan ini dapat ditemukan di daerah dataran rendah
sampai ketinggian 700 m diatas permukaan laut (Dalimartha 2000).
Menurut Mahendra dan Fauzi (2005) serta Dalimartha (2000), kumis kucing
mengandung banyak komponen bioaktif seperti orthosiphon glikosida, tanin,
minyak atsiri, minyak lemak, saponin, sapofonin, garam kalium (0.6-3.5%) ,
myoinositol dan sinensetin. Berdasarkan hasil penelitian Olah et al. (2003),
kumis kucing mengandung polifenol yaitu polymethoxylated flavonoid dan
turunan caffeic acid. Identifikasi lebih lanjut menunjukkan adanya kandungan
caffeic acid, cichoric acid, rosmarinic acid, sinensetin dan eupatorine. Loon et
al. (2005) melakukan penentuan tiga jenis flavonoid dari kumis kucing di dalam
plasma mencit dengan metode HPLC dan deteksi dengan sinar ultraviolet.
Ketiga jenis flavonoid tersebut adalah sinensetin, eupatorin dan
3’-hydroxy-5,6,7,4’tetramethoxyflavone. Kumis kucing rasanya manis sedikit pahit dan
sifatnya sejuk. Penelitian yang dilakukan terhadap efek yang ditimbulkan setelah
asam urat dan terbentuknya batu yang mengandung asam urat dalam kandung
kemih. Hal ini disebabkan oleh meningkatnya alkalinitas urin (Nirdnoy dan
Muangman 1991). Hasil penelitian Isparyanto (1999) menunjukkan bahwa
pemberian infus daun kumis kucing berdosis 12.85 g/kg bobot badan selama 7
hari dapat menurunkan asam urat darah tikus dengan efek yang sama dengan
pemberian obat kimia Alopurinol 42.85 mg/kg bobot badan.
Efek diuretik dari ekstrak air kumis kucing pada mencit menunjukkan
adanya peningkatan pengeluaran urin (Casadebaig-Lafon et al. 1989; Beaux et al.
1999) . Kandungan Natrium dalam urin mencit juga meningkat dengan
pemberian ekstrak air kumis kucing (Beaux et al. 1999). Berdasarkan penelitian
Sari (1985) efek maksimal terhadap sifat diuretikum dari rata-rata 1 ml infus
dengan kandungan 5%, 10% dan 20% daun kumis kucing berturut-turut adalah
275.22%, 376.64% dan 646.12%. Hasil penelitian ini juga menunjukkan bahwa
kumis kucing mengandung Kalium yang berfungsi sebagai pelarut batu ginjal dan
batu saluran kemih. Dibandingkan dengan batangnya potensi diuretikum daun
kumis kucing lebih baik. Volume urin rata-rata kelinci yang diberi infus daun
kumis kucing sebesar 27.0 ml sedangkan volume urin rata-rata kelinci yang
diberi infus batang sebesar 22.4 ml (Garnadi 1998).
Daun kumis kucing juga dapat berfungsi sebagai anti bakteri. Hasil
penelitian Sofiani (2003) menunjukkan adanya sifat anti bakteri dari ektrak daun
kumis kucing terhadap bakteri Staphylococcus epidermidis dan Eschericia coli
dengan daya penghambatan yang berbeda. Sinensetin yang terkandung di dalam
daun kumis kucing juga menghambat relatif besar terhadap Staphylococcus
epidermidis. Tanaman ini yang biasa digunakan adalah daun atau seluruh bagian
tanamannya, baik segar maupun sudah dikeringkan (Anonim 2005).
Bunga Knop (Gomphrena globosa L.)
Bunga knop (Gomphrena globosa L.) berasal dari Amerika (Dalimartha
2000 ; Anonim 2005) dan Asia (Anonim 2005). Tanaman ini tumbuh liar di
ladang yang cukup mendapat sinar matahari dan dapat ditemukan pada ketinggian
1- 1.300 m di atas permukaan laut (Dalimartha 2000).
Gambar 2 Tanaman bunga knop (Gomphrena globosa L.)
Di Indonesia, bunga knop tersebar di Sumatera dengan nama daerah bunga
knop, kembang puter dan ratnapakaja. Nama daerahnya di Jawa adalah
adas-adasan, kembang gundul dan bunga kancing Selain itu dikenal pula di Bali
dengan nama daerah ratna serta di Gorontalo dengan nama daerah taimantulu
(Dalimartha 2000).
Berdasarkan ilmu taksonomi (Anonim 2000), tata nama bunga knop adalah
sebagai berikut :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledonae
Bangsa : Caryophyllales
Suku : Amaranthaceae
Marga : Gomphrena
Jenis : Gomphrena globosa L.
Tanaman ini berupa perdu dengan batang hijau kemerahan, berambut dan
bercabang-cabang serta tinggi mencapai 60 cm (Anonim 2005). Daun tunggal,
telur sungsang sampai memanjang, ujung meruncing, tepi rata, berwarna hijau,
berambut kasar berwarna putih di permukaan atas dan berambut halus di
permukaan bawah. (Dalimartha 2000). Bunga bentuk bonggol seperti bola,
berwarna merah tua keunguan, putih (Anonim 2005) atau merah muda
(Dalimartha 2000). Bijinya banyak dengan ukuran kecil-kecil panjang (Anonim
2005), sedang buahnya buah kotak berbentuk segi tiga terbungkus oleh lapisan
tipis berwarna putih, berbiji satu (Dalimartha 2000).
Menurut Mahendra dan Fauzi (2005) serta Dalimartha (2000), bunga knop
mengandung gomphrenin I, II, III, V dan VI, amaranthin, minyak atsiri, saponin
dan flavon. Menurut Cai et al (2001), bunga knop banyak mengandung
komponen pigmen alami yaitu dari kelompok betasianin sebesar 1.3 mg/g sampel
segar. Betasianin ini terdiri dari komponen gomphrenin I (betanidin 6-0-â
-glukosida) sebesar 16.9%, isogomphrenin I (isobetanidin 6-0-â-glukosida)
sebesar 8.8%, gomphrenin II (betanidin 6-0-(6’-0-E-4-coumarooyl)-â-glukosida)
sebesar 11.1%, isogomphrenin II (isobetanidin 6-0-(6’-0-E-4-coumarooyl)-â
-glukosida) sebesar 3.5%, gomphrenin III (betanidin 6-0-(6’-0-E-4-feruroyl)-â
-glukosida) sebesar 40.8% dan isogomphrenin III (isobetanidin
6-0-(6’-0-E-4-feruroyl)-â-glukosida). Menurut Cai et al (2001), betasianin merah yang terdiri
dari betanin dan amaranthin bersifat tahan terhadap panas dalam sistem buffer,
tetapi bersifat tidak stabil pada suhu di atas 40oC dan bersifat lebih stabil pada
suhu 40oC tanpa adanya udara dan sinar.
Penelitian yang dilakukan terhadap Amaranthus spinosus L., yaitu tanaman
yang biasa digunakan sebagai obat di Afrika menunjukkan adanya kandungan
betalain utama yang diidentifikasi sebagai amaranthin dan isoamaranthin. Selain
itu tanaman ini juga mengandung hidroksisinamat, quersetin dan kaempferol
glikosida yang semuanya merupakan senyawa fenolik (Stintzing et al. 2004).
Warna bunga dan buah tanaman dari famili Caryophyllales berasal dari betalain
yang berwarna merah-ungu untuk betasianin dan kuning untuk betaxanthin,
keduanya menggantikan anthosianin. Betalain biasa digunakan sebagai pewarna
makanan dan mempunyai sifat antioksidan yang dapat mencegah stress oksidatif
(Strack et al. 2003). Pengujian terhadap kandungan polifenol Amaranthus sp.
polifenol sampai dengan 0.2 µg/ml dapat meningkatkan perlindungan terhadap
stress oksidatif oleh H2O2 yang menginduksi kerusakan DNA dari limfosit
(Kapiszewska et al. 2005).
Aurone I (E) 3’ –O ß D glucopyranosy l4,5, 6,4’ tetrahydroxy 7,2’
-dimethoxyaurone dan dua senyawa lain yaitu aurantiamide acetate dan tiliroside
diisolasi dari ekstrak etanol Gomphrena agretis. Evaluasi terhadap aktivitas
biologis ekstrak etanol Gomphrena agretis dan ketiga senyawa di atas
menunjukkan adanya penghambatan terhadap pertumbuhan Staphylococcus
aureus, Staphylococcus epidermidis dan Pseudomonas aeruginosa (Ferreira et al.
2004). Ekstrak petroleum eter dari Gomphrena martiana dan Gompohrena
boliviana yang kemudian difraksinasi menghasilkan lima jenis 5,6,7-trisubstituted
flavon. Pengujian secara terpisah terhadap hasil fraksinasi ini menunjukkan
aktivitas antimikrobial yang tinggi terhadap M. Phlei dengan minimum inhibitory
concentration (MIC) 15, 20 dan 75 µ/ml, mendekati hasil yang didapat dengan
bakterisida komersial (Pomilio et al. 1992).
Kultur sel dari sel endotel tali pusat manusia (HUVEC) yang diberi ekstrak
Amaranthus sp. menunjukkan tidak dihasilkannya IL-1 sebagai proinflamatory
sitokin yang menginduksi aktivasi AP-1. Mekanisme aktivitas penghambatan ini
belum jelas, tetapi kemungkinan kandungan polifenol dari tanaman merupakan
salah satu mediatornya (Stalinska et al. 2005).
Bunga knop rasanya manis, sifatnya netral dan biasa digunakan sebagai obat
batuk, obat sesak, obat astma, obat bronkhitis kronis, peluruh dahak, panas pada
anak, disentri dan penambah nafsu makan. Tanaman ini yang biasa digunakan
adalah bunga atau seluruh bagian tanamannya baik segar maupun sudah
dikeringkan (Anonim 2005).
Pengeringan
Pengeringan bahan-bahan pertanian seperti sayuran dan buah-buahan adalah
suatu cara untuk mengawetkan bahan-bahan pertanian (Imre 1995). Produk
pertanian yang sudah dikeringkan berkurang kadar air dan kelembabannya,
kapang untuk hidup (Sokhansanj dan Jayas 1999; Jayaraman dan Das Gupta
1995).
Menurut Jayaraman dan Das Gupta (1995), faktor-faktor yang mempengaruhi
pemilihan metode pengeringan adalah bentuk dari bahan mentah dan
sifat-sifatnya, karakteristik dan bentuk fisik yang diinginkan untuk produk akhirnya
dan biaya operasional. Tiga cara yang biasa digunakan untuk mengeringkan
buah-buahan dan sayur-sayuran adalah pengeringan dengan sinar matahari,
pengeringan atmosfirik baik secara batch (tower atau cabinet dryers) atau
kontinyu (tunnel, belt, Spray atau pemanasan dengan microwave) serta dehidrasi
subatmosfir (vacuum shelf belt dan freeze dryer).
Perubahan warna, aroma dan penampakan terjadi pada produk yang
dikeringkan. Pengeringan dapat pula meningkatkan kualitas dan nilai nutrisi suatu
produk pangan dan pakan, seperti rasa yang lebih enak dan daya cerna serta
perubahan metabolik yang meningkat (Sokhansanj dan Jayas 1995). Selama
pengeringan terjadi degradasi senyawa-senyawa yang terkandung dalam daun
seperti klorofil yang memberi warna hijau pada daun. Degradasi klorofil
tergantung pada ph, waktu, kerja enzim, oksigen dan cahaya (Jayaraman dan Das
Gupta 1995).
Pengeringan dengan sinar matahari adalah suatu metode pengeringan
tradisional yang telah berabad-abad dilakukan. Pengeringan ini dilakukan pada
waktu matahari bersinar dengan suhu produk sewaktu dikeringkan berkisar antara
5-15oC di atas suhu ambient (Sokhansanj dan Jayas 1999). Masalah yang
mungkin timbul pada pengeringan dengan sinar matahari antara lain adalah
terjadinya hujan atau mendung, kontaminasi oleh debu, serangga, burung dan
binatang lainnya, kurangnya pengawasan sehinga terjadi pengeringan melewati
batas dan kemungkinan terjadi pembusukan baik secara kimiawi, enzimatis atau
mikrobiologis karena waktu pengeringan yang lama (Jayaraman dan Das Gupta
1995). Selain itu dapat terjadi penurunan mutu selama penyimpanan karena
terjadi ketidakseragaman pengeringan (Imre 1995). Menurut Mahendra dan Fauzi
(2005) pengeringan daun kumis kucing dengan sinar matahari dilakukan selama
2-3 hari (bila matahari bersinar penuh) dan dapat pula dilakukan dengan
Senyawa Fenolik
Senyawa fenolik dalam bahan pangan meliputi asam-asam fenolik, polimer
fenolik yang dikenal sebagai tanin dan flavonoid. Asam-asam fenolik terdiri dari
kelompok asam hidroksibenzoat dan asam hidroksisinamat. Senyawa polimer
fenolik adalah senyawa dengan berat molekul tinggi seperti tanin. Flavonoid
adalah kelompok fenolik terbanyak yang terkandung dalam tanaman dan biasanya
ditemukan dalam bentuk glikosida.
Fenol adalah antioksidan terbanyak dalam tumbuhan yang berperan sebagai
antioksidan pemutus rantai. Hal ini disebabkan oleh adanya gugus –OH yang
menghalangi senyawa radikal yang reaktif seperti radikal peroksil (RO2’)
-OH + RO2’ R-O’ + ROOH
Hasil reaksi di atas menghasilkan radikal fenoksil yaitu R-O’ yang cenderung
mempunyai sifat kurang reaktif karena terjadi delokalisasi elektron ke cincin
aromatik. Hal ini menyebabkan radikal reaktif RO2’ berkurang kereaktifannya.
Fenol kadangkala mempunyai mekanisme reaksi antioksidan tambahan seperti
reaksi mengkelat ion logam transisi (Halliwell 2002). Penelitian yang dilakukan
Cai et al. (2004) terhadap 112 tanaman yang biasa digunakan dalam pengobatan
kanker secara tradisional di Cina menunjukkan adanya hubungan yang positif dan
berbanding lurus antara aktivitas antioksidan dengan kandungan total fenolik
dalam tanaman-tanaman tersebut. Nilai TEAC tanaman-tanaman tersebut berkisar
antara 46.7 sampai 17,323 µM dan GAE sebesar 0.22 sampai 50.3 g GAE/100g
berat kering. Hal ini menunjukkan bahwa senyawa- senyawa fenolik merupakan
senyawa antioksidan yang dominan dalam tanaman-tanaman tersebut.
Senyawa-senyawa fenolik utama yang terkandung di dalam tanaman-tanaman tersebut
yang telah diidentifikasi dan dianalisa adalah asam-asam fenolik, flavonoid, tanin,
coumarin, lignan, quinon, stilbene dan curcuminoid. Tanaman-tanaman tersebut
dengan demikian kemungkinan merupakan sumber potensial antioksidan alami
dan kemopreventif untuk mencegah kanker.
Penelitian yang dilakukan terhadap aktivitas antioksidan pigmen betalain
dari beberapa tanaman yang termasuk famili Amaranthaceae dengan
menggunakan metode DPPH (1,1-diphenyl-2-picryhydrazyl) yang dimodifikasi
diteliti. Betasianin tipe gomphrenin rata = 3.7 µM) dan betaxanthin
(rata-rata = 4.2 µM) menunjukkan aktivitas antioksidan tertinggi, 3-4 kali lebih tinggi
dari asam askorbat (13.9 µM) dan lebih tinggi dari rutin (6.1 ì M) dan catechin
(7.2 µM). Penelitian ini juga mempelajari hubungan antara struktur kimia
dengan aktivitas antioksidan betalain. Aktivitas antioksidan dari betalain
biasanya meningkat dengan meningkatnya jumlah gugus hidroksil/imino dan juga
tergantung dari posisi gugus hidroksil dan glikosilasi dari aglikon dalam
molekulnya (Cai et al. 2003). Aktivitas radical scavenging beberapa senyawa
terhadap DPPH memberikan hasil sebagai berikut aktivitas asam kafeat > asam
sinapat > asam ferulat > ester asam ferulat > asam p-kumarat (Kwon et al. 2003).
Aktivitas antioksidan biasanya meningkat dengan adanya peningkatan jumlah
gugus hidroksil dan menurun dengan adanya glikosilasi (Fukumoto dan Mazza
2000). Penelitian yang dilakukan dengan membandingkan tiga metode yaitu
metode DPPH, static headspace gas chromatography (HS-GC) dan beta-carotene
bleaching test (BCBT) untuk menentukan aktivitas antioksidan menunjukkan
bahwa metode DPPH paling cocok digunakan uintuk menentukan aktivitas
antioksidan karena dapat dilakukan dengan cepat, mudah dan tidak tergantung
pada kepolaran sampel (Koleva et al. 2002).
Flavonoid bukan hanya dapat dianggap sebagai antioksidan, karena pada
kondisi reaksi tertentu dapat pula menunjukkan aktivitas prooksidan. Sifat yang
tidak diinginkan ini dapat dijadikan penjelasan terhadap toksisitas dari beberapa
flavonoid secara in-vivo (Kessler et al. 2003). Penelitian Kang et al. (2003)
terhadap ekstrak heksan, etilasetat, n-butanol dan air dari 10 herbal yang biasa
digunakan sebagai obat di Korea menunjukkan bahwa aktivitas antioksidan
ekstrak dengan pelarut yang bersifat lebih polar (n-butanol dan air) relatif lebih
tinggi dari aktivitas antioksidan ekstrak dengan pelarut bersifat non-polar (heksan
dan etil asetat).
Penggunaan asam tanat sebagai standar untuk memenentukan total fenol
menggunakan metode Folin-Ciocalteau berdasarkan reaksi reduksi asam
fosfomolibdat oleh fenol dalam larutan alkali. Metode ini menentukan total
gugus fenolik bebas dengan demikian juga menentukan total fenolik terlarut.
lain yang bukan tanin. Senyawa seperti asam askorbat, tirosin dan mungkin juga
glukosa ikut terukur (Waterman dan Mole 1994).
Keamanan Pangan
Keamanan pangan adalah suatu kebijakan yang menentukan keamanan
suatu bahan pangan untuk dapat dikonsumsi. Suatu bahan pangan diminimalkan
resikonya yang dapat menyebabkan sesuatu yang mambahayakan bagi kesehatan,
karena tidak ada bahan pangan yang 100% bebas dari kontaminan (Finley dan
Robinson 1992).
Untuk mengevaluasi resiko atau keamanan dari suatu bahan pangan atau
bahan yang digunakan sebagai komposisi dalam bahan pangan yang baru, maka
perlu dilakukan penentuan tipe bahaya potensial yang dapat ditimbulkan oleh
bahan tersebut. Sebagai contoh, untuk suatu bahan yang merupakan komposisi
dalam suatu bahan pangan harus ditentukan bahaya potensial baik yang bersifat
kimiawi maupun biologis yang berhubungan dengan bahan tersebut. Bila ada
bahaya yang dikandung suatu bahan, perlu ditentukan konsentrasi dimana bahan
tersebut dapat bersifat toksik. Hal lain yang perlu juga diperhatikan adalah
pengaruh bahan tersebut terhadap nilai nutrisi bahan pangan dan pengaruhnya
terhadap penyerapan nutrien-nutrien lainnya (Finley dan Robinson 1992).
Bahan pangan yang aman tidak dapat mengesampingkan adanya toksikan
alami baik yang terkandung secara alami dalam bahan maupun yang diinduksi
karena adanya bahan-bahan lainnya. Makrokomponen di dalam suatu bahan
pangan terutama lemak dan protein serta komponen-komponen anti kanker dan
penghambat kanker yang banyak terdapat dalam bahan pangan tampaknya
berinteraksi dengan komponen-komponen bahan pangan lainnya yang dapat
memodulasi resiko kanker. Komponen-komponen yang secara alami terkandung
dalam bahan pangan pada konsentrasi tertentu mempunyai aktivitas anti kanker,
tetapi pada konsentrasi yang lebih tinggi menjadi bersifat toksik dan seringkali
batas antara konsentrasi yang menguntungkan dan yang toksik sangat kecil
(Shank dan Carson 1992).
Penentuan dosis merupakan suatu hal yang kritis untuk menguji
toksisitas atau menurunnya berat badan harus dicegah, sebaliknya dosis terlalu
rendah yang menyebabkan stress dan malnutrisi sehingga memodulasi fungsi
imun tertentu juga harus dicegah (Dean et al. 1989).
Penelitian untuk mengetahui efek immunomodulator suatu komponen
dapat dilakukan dengan menggunakan limfosit darah tepi manusia. Limfosit ini
diisolasi kemudian diinkubasikan secara in vitro dalam kultur yang telah banyak
digunakan untuk menguji fungsi immun. Komponen yang akan diuji efek
immunomodulatornya kemudian ditambahkan ke dalam kultur ini (Dean et al.
1989). Hasil penelitian Duthil et al. (2003) menunjukkan bahwa beberapa
polifenol dapat bersifat toksik dan mutagenik di dalam suatu sistem kultur sel
tertentu.
Limfosit dan Proliferasi Sel Limfosit
Sistem yang berfungsi melindungi tubuh manusia dari unsur-unsur patogen
disebut sistem imun. Sistem imun terdiri dari komponen genetik, molekuler dan
seluler yang berinteraksi secara luas dalam merespon antigen endogenus dan
eksogenus. Salah satu jenis sel yang berfungsi dalam merespon antigen adalah sel
darah putih (Baratawidjaja 2000). Leukosit atau sel darah putih merupakan salah
satu bagian dalam sistem imun yang ukurannya lebih besar dari eritrosit dan bebas
bergerak (Roitt 1991). Menurut Baratawidjaja (2000) leukosit terdiri dari 75% sel
granulosit dan 25% sel agranulosit yang terbentuk di dalam sumsum tulang.
Granulosit terdiri dari sel limfosit dan monosit sedang agranulosit terdiri dari
basofil, neutrofil dan eusinofil (Roitt 1991).
Limfosit adalah kunci pengatur sistem imun dan merupakan 20% dari semua
leukosit dalam sirkulasi darah orang dewasa. Sel limfosit dibentuk dalam kelenjar
timus dan sumsum tulang, merupakan sel nongranulosit berukuran kecil,
berbentuk bulat dengan diameter 7 – 15 µm. Sel limfosit selain dalam darah
terdapat pula paada organ limfoid seperti limpa, kelenjar limfe dan timus
(Baratawidjaja 2000).
Sel limfosit terdiri atas sel T dan sel B. Sel T yang dibentuk di dalam
sumsum tulang, tetapi berproliferasi dan berdiferensiasi di dalam kelenjar timus
yang hidup intraseluler, virus, jamur parasit dan kanker (Baratawidjaja 2000).
Sel T merupakan 65-80% dari jumlah sel limfosit yang ada di dalam sirkulasi
darah (Kresno 1991). Sel T terdiri dari tiga populasi utama yaitu sel Thelper (Th),
sel Tsupressor (Ts) dan Tcytotoxic (Tc). Masing-masing populasi sel T
mengekspresikan pertanda permukaan atau Cluster Determinant (CD) berupa
molekul glikoprotein yang berbeda-beda. Subset Th ditandai oleh glikoprotein
CD4, sel Tc oleh glikoprotein CD8, sedangkan semua subset sel T ditandai oleh
molekul CD3. Sel Th membantu sel B dalam memproduksi antibodi, sel Ts
menekan pembentukan antibodi dan sel Tc berfungsi menghancurkan sasaran
(Roitt 1991). Sel T berproliferasi menjadi sel T memori dan berbagai sel efektor
yang mensekresi berbagai limfokin. Limfokin ini dapat mengaktivasi sel B, sel
Tc, sel NK (Natural Killer) dan sel lain yang terlibat dalam respon imun (Roitt
1991).
Sel B yang berasal dari sel asal multipoten berperan dalam sistem imun
spesifik humoral. Bila sel B dirangsang oleh benda asing, maka sel tesebut akan
berproliferasi dan berkembang menjadi sel plasma yang dapat menghasilkan
antibodi. Antibodi inilah yang mempunyai fungsi utama melawan infeksi
ektraseluler virus dan bakteri serta menetralisir toksinnya (Baratawidjaja 2000).
Sel B merupakan 5-15% dari limfosit dalam sirkulasi darah (Kresno 1991).
Proliferasi sel limfosit dapat distimulasi oleh bahan-bahan alamiah yang
disebut mitogen. Glikoprotein (lectin) asal tanaman yaitu concanavalin A (Con A)
dan phytohemaglutinin (PHA) merupakan mitogen poten untuk sel T dan berguna
untuk identifikasi dan mempelajari fungsi sel tersebut. Lipopolisakarida (LPS)
yang diperoleh dari dinding sel bakteri gram-negatif mempunyai efek mitogen
terhadap sel B sedangkan pokeweed merupakan mitogen baik untuk sel B maupun
sel T (Baratawidjaja 2000). Macam-macam mitogen yang biasa digunakan untuk
menentukan fungsi limfosit manusia dapat dilihat pada Tabel 1.
Sebanyak 50-60% limfosit T mampu memberikan respon terhadap stimulasi
dengan mitogen misalnya Phytohemaglutinin (PHA) dan concanavalin A (Con A).
Respon terhadap mitogen dianggap menyerupai respon terhadap antigen, sehingga
untuk menguji fungsi limfosit. Stimulasi limfosit dengan antigen atau mitogen
menimbulkan berbagai reaksi biokimia di dalam sel, diantaranya fosforilasi
nukleoprotein, pembentukan DNA dan RNA serta peningkatan metabolisme
Tabel 1. Mitogen-mitogen ”nonspecific” yang mengaktivasi sel limfosit manusia
Mitogen Singkatan Sumber biologis Spesifisitas relatif
Phytohemaglutinin PHA Phaseolus vulgaris sel T
Concanavalin A Con A Canavalia ensiformis sel T (subset yang berbeda dengan PHA)
Antilympcyte globulin ALG Heterologous antisera sel T dan sel B
Staphylococcus protein A SpA S aureus sel B sel T-independent
Pokeweed mitogen
PWM Phytolacca americana sel B sel T-independent
Stites (1991)
lemak dan lain-lain. Secara morfologik perubahan tersebut tampak menyerupai
sel blast yaitu sel bersitoplasma biru dengan zone perinuklear yang terang, berinti
besar dan beranak inti. Sel ini pada umumnya dapat dibedakan dengan limfosit
yang tidak terangsang, namun kadang-kadang sulit membedakan sel yang
terangsang dengan limfosit besar, sehingga penilaian morfologik kadang-kadang
meragukan. Puncak respon limfosit normal terjadi pada hari ketiga setelah
rangsangan. Limfosit B juga dapat memberi respon terhadap rangsangan mitogen,
tetapi puncak respon limfosit B biasanya terjadi lebih lambat yaitu pada hari
kelima atau keenam (Kresno 1991). Fungsi sel imun ditentukan oleh
keseimbangan oksidan-antioksidan terutama untuk memelihara integritas dan
fungsi lipida membran, protein selular dan asam-asam nukleat serta untuk
pengaturan signal transduksi dan ekspresi gen di dalam sel-sel imun (Wu dan
Meydani 1998).
Tejasari (2000) melakukan pengujian efek komponen oleoresin jahe
terhadap respon proliferatif limfosit (sel B dan T). Pada kondisi tanpa stress
oksidatif penambahan senyawa oleoresin dengan konsentrasi 50 µg/ml
meningkatkan proliferasi sel B tertingi sebesar 456%, sedangkan penambahan
senyawa gingerol dengan konsentrasi 150 µg/ml secara nyata meningkatkan
Pengaruh aktivitas ekstrak tanaman cincau hijau terhadap proliferasi sel
limfosit manusia menunjukkan adanya proliferasi sel limfosit yang ditunjukkan
oleh nilai indeks stimulasi. Penambahan ekstrak air akar heksan daun kultur
dengan konsentrasi 0.13655 mg/ml memberikan nilai indeks stimulasi sebesar
1.03, sedangkan penambahan ekstrak heksan akar dengan konsentrasi 0.08683
mg/ml dan sebesar 0.34732 mg/ml memberikan indeks stimulasi berturut-turut
sebesar 1.31 dan 1.06 (Pandoyo 2000).
Immunomodulator
Immunonodulator adalah senyawa-senyawa yang secara langsung merubah
fungsi imun spesifik atau memberikan efek baik positif maupun negatif terhadap
aktivitas sistem imun (Jaffe dan Sherwin 1991). Menurut Baratawidjaja (2000)
Immunomodulator bekerja menurut 3 cara, yaitu melalui immunorestorasi,
immunostimulasi dan immunosupresi. Immunorestorasi dan immunostimulasi
disebut immunopotensiasi atau up regulation, sedangkan immunosupresi disebut
juga down regulation.
Penggunaan immunomodulator yang memberikan efek positif (stimulasi)
terhadap aktivitas sistem imun diantaranya adalah untuk mengobati defisiensi
imun seperti pada pengobatan penderita AIDS, sedangkan yang memberikan efek
negatif (menekan) terhadap fungsi imun yang normal atau berlebihan seperti pada
pengobatan penyakit autoimun (Jaffe dan Sherwin 1991).
Faktor-faktor yang mempengaruhi suatu komponen bersifat
immunomodulator antara lain adalah dosis, cara dan waktu pemberian. Bentuk
dan lokasi terjadinya mekanisme immunomodulasi juga berperan terhadap sifat
immunomodulator suatu komponen (Tzianabos 2000).
Pengujian ekstrak air dari Amaranthus sp. terhadap sel splenosit dari mencit
BALB/c menunjukkan kemampuan ekstrak ini untuk menstimulasi proliferasi sel
splenosit. Sel B yang diisolasi dapat distimulasi juga oleh ekstrak ini. Pemurnian
ekstrak air dari Amaranthus sp menghasilkan protein (GF1) dengan berat molekul
313kDa. GF1 mempunyai aktivitas immunomodulator 309 kali ekstrak air yang
belum dimurnikan. Hasil penelitian ini menunjukkan bahwa ekstrak air
menstimulasi aktivitas proliferasi sel B dan proliferasi subset sel T secara in vitro
(Lin et al. 2005). Penelitian terhadap aktivitas immunomodulator dari suatu
polisakarida tertentu menunjukkan adanya pengaruh terhadap respon imun selama
proses penyembuhan penyakit infeksi. Polimer-polimer ini dapat mempengaruhi
imunitas spesifik dan non spesifik melalui interaksinya dengan sel T, monosit,
makrofag dan limfosit polimorfonuklear (Tzianabos 2000).
Penelitian mengenai aktivitas immunomodulator dari ekstrak akar Echinacea
spp. menunjukkan bahwa ekstrak Echinacea spp. dapat menstimulasi proliferasi
sel mononuklear darah tepi manusia, tetapi aktivitas immunomodulator ini dapat
berubah bila sebelumnya Echinacea spp. ini disimpan pada 40C selama 4 hari.
(Senchina et al. 2005).
Kultur Sel
Kultur sel adalah suatu teknik untuk memelihara atau mengembangbiakkan
sel di luar tubuh (in vitro). Tujuan dari pemeliharaan sel atau jaringan ini adalah
untuk mempelajari sifat-sifat sel di luar tubuh. Kultur sel mempunyai beberapa
keuntungan antara lain dapat dikontrolnya lingkungan tempat hidup sel, seperti
pH, tekanan osmosis, tekanan CO2 dan O2 yang menjadikan kondisi fiologis
kultur relatif konstan. Selain itu kultur sel juga mempunyai kelemahan, seperti
hilanganya spesifisitas sel, karena sel di luar tubuh bekerja sendiri-sendiri sedang
di dalam tubuh (in vivo) bekerja secara terintegrasi di dalam satu jaringan
(Freshney, 1995).
Kondisi kultur harus disesuaikan dengan kondisi di dalam tubuh untuk
menunjang pertumbuhan sel yang optimal. Kultur sebaiknya berada pada pH
sekitar 7.4 dan tidak di bawah 7.0, karena pH di bawah 6.8 akan menghambat
pertumbuhan sel. Sistem buffer dalam kultur biasanya menggunakan sistem CO2
-bikarbonat yang analog dengan sistem dalam darah. Sistem ini masih berada di
bawah kondisi optimum fisiologis sehingga masih diperlukan tambahan CO2 5%
pada bagian headspace kultur untuk menjaga stabilitas pH. Stabilitas pH juga
dapat dijaga dengan menggunakan buffer yang bersifat zwitterion seperti buffer
bikarbonat dan HEPES (N-2-hidroksimetil-piperazin-N-2-etan-sulphonic acid)
Medium standar yang biasa digunakan untuk kultur sel adalah Dulbecco’s
modified Eagle’s (DME) dan RPMI 1640. Medium ini diperkaya dengan 10%
Fetal Bovine Serum (FBS). FBS digunakan karena mengandung molekul IgG
dengan konsentrasi yang sangat rendah. Suplemen pertumbuhan lainnya tidak
diperlukan kecuali bila jumlah sel yang tumbuh sangat rendah (kira-kira di bawah
103 sel/ml). Antibiotik yang biasa ditambahkan ke dalam medium adalah
penisilin dan streptomisin. Penisilin efektif untuk membunuh bakteri gram positif
sedang streptomisin efektif membunuh bakteri gram negatif (Harlow dan Lane
1988).
BAHAN DAN METODE
Bahan dan Alat
Pada penelitian ini, bahan-bahan yang digunakan adalah daun kumis kucing
dari kebun di Kampus IPB Darmaga, bunga knop kebun Tanaman Obat Karyasari,
Leuwiliang Bogor dan darah manusia dari responden terpilih. Bahan-bahan
kimia yang digunakan adalah K2SO4 (Kanto Chemical, Jepang), HgO (Merck,
Jerman), H2SO4 pekat (Kanto Chemical, Jepang), batu didih, H3BO3 (Kanto
Chemical, Jepang), metilen merah (Kanto Chemical, Jepang) metilen biru (Kanto
Chemical, Jepang), NaOH-Na2S2O3, (Merck, Jerman), HCl (Merck, Jerman), dietil
eter (Merck, Jerman), air bebas ion, buffer asetat (Merck, Jerman), akuades, air
bebas pirogen, standar asam tanat (Merck, Jerman), Na2CO3 (Merck, Jerman),
folin-ciocalteau 50% (Sigma, USA), etanol 95% (Merck, Jerman), metanol p.a.
(Merck, Jerman), DPPH (1,1-diphenyl-2-picryl hydrazyl) (Sigma, USA), trolox®
(Sigma, USA), tryphan blue (Wako, Jepang), larutan Ficoll-histopaque (Sigma,
USA), phosphat buffer saline (PBS) (Sigma, USA), medium RPMI-1640 (Gibco,
USA), NaHCO3 (Merck, Jerman), fetal bovine serum (FBS) (Sigma, USA),
penicillin-streptomycin (Sigma, USA), concanavalin A (Sigma, USA), pokeweed
(Sigma,USA), lipopolisakarida S. typhosa (Sigma, USA), MTT
(3(4,5-dimethylthiazol-2-5-diphenyl-tetrazolium bromide)) (Sigma, USA) dan
HCl-isopropanol (Merck, Jerman).
Alat-alat yang digunakan adalah wadah seng, oven, timbangan, neraca
analitik, hot plate, cawan alumunium, desikator, alat destilasi, labu kjeldahl, labu
lemak, alat ekstraksi soxhlet, kondensor, cawan porselen, tanur, blender, vortek,
pH-meter, alat-alat gelas, , saringan vakum, kertas saring Whatman no. 41,
stop-watch, mortar, freeze drier, alumunium foil, sentrifuse, pipet mikro, tip,
hemasitometer, mikroskop Zeiss Germany ID 03, spektrofotometer, vacutainer,
filter 0.2 µm, pipet pasteur, micro plate, laminar flow, inkubator (5% CO2, RH
Metode Penelitian
Pembuatan Bubuk Daun Kumis Kucing dan Bubuk Bunga Knop
Metode Pengeringan Oven
Daun kumis kucing segar dicuci bersih kemudian dikeringanginkan,
sedangkan untuk bunga knop segar tidak perlu dicuci. Setelah itu dikeringkan
dengan oven pada suhu 50oC sampai kadar airnya mencapai 7%. Produk yang
telah dikeringkan kemudian diblender selama 2 menit untuk menghasilkan bubuk.
Bubuk ini kemudian dianalisa proksimat.
Metode Pengeringan Sinar Matahari
Daun kumis kucing segar dicuci bersih kemudian dikeringanginkan,
sedangkan untuk bunga knop segar tidak perlu dicuci. Setelah itu dikeringkan di
bawah sinar matahari tetapi tidak secara langsung sampai kadar airnya mencapai
7%. Produk yang telah dikeringkan kemudian diblender selama 2 menit untuk
menghasilkan bubuk. Bubuk ini kemudian di analisa proksimat.
Pembuatan Ekstrak Air Daun Kumis Kucing dan Bunga Knop Segar dan Bubuk
Daun kumis kucing segar dan bunga knop segar dihaluskan dengan mortar
kemudian diekstraksi dengan akuades mendidih dengan perbandingan
berturut-turut sebesar (1.1835 g : 220 ml) dan (3.6720 g : 80 ml) dan didiamkan selama 5
menit. Hasil ekstraksi diaduk kemudian disaring menggunakan saringan vakum
dengan kertas saring Whatman no. 41. Dasar penggunaan perbandingan antara
daun kumis kucing segar dengan akuades dapat dilihat pada Lampiran 1 dan untuk
bunga knop segar pada Lampiran 2. Ekstrak air daun kumis kucing dan bunga
knop dianalisa total fenol dan aktivitas antioksidannya.
Bubuk daun kumis kucing dan bubuk bunga knop diekstraksi dengan
menggunakan akuades mendidih dengan perbandingan sebesar (1 g : 257 ml) dan
(0.8667 g : 80 ml) dan didiamkan selama 5 menit. Pembuatan ekstrak air ini
dilakukan dengan perbandingan yang sama, baik untuk bubuk hasil pengeringan
oven maupun bubuk hasil pengeringan sinar matahari. Hasil ekstraksi diaduk
kemudian disaring menggunakan saringan vakum dengan kertas saring Whatman
dengan akuades dapat dilihat pada Lampiran 1 dan untuk bubuk bunga knop pada
Lampiran 2. Ekstrak air daun kumis kucing dan bunga knop dianalisa total fenol
dan aktivitas antioksidannya.
Analisa Total Fenol modifikasi metode Chandler dan Dodds (Shetty et al. 1995)
Ekstrak air daun kumis kucing dan bunga knop baik segar maupun bubuk
sebanyak 1 ml dimasukkan ke dalam tabung reaksi yang sudah berisi 1 ml etanol
95%. Setelah itu 5 ml air bebas ion ditambahkan ke dalam 50%, divortek dan
didiamkan selama 5 menit. Kemudian 1ml Na2CO3 5% ditambahkan ke dalam
tabung reaksi tersebut, divortek dan disimpan delam ruang gelap selama 60 menit.
Selanjutnya sampel divortek kembali dan diukur absorbansinya pada panjang
gelombang 725 nm. Kurva standar dipersiapkan dengan menggunakan asam tanat
standar yang dilarutkan dengan etanol 95%. Sebagian ektrak air sampel disimpan
dalam ruang gelap pada suhu kamar untuk dianalisa lagi kandungan total fenol
sampel setelah penyimpanan 24 jam.
Analisa Aktivitas Antioksidan (Kubo et al. 2002)
Buffer asetat 0.1M (pH 5.5) sebanyak 1 ml dimasukkan ke dalam tabung
reaksi. Kemudian ditambahkan 1.87 ml etanol p.a. dan 0.15 ml senyawa radikal
bebas DPPH (1,1-diphenyl-2-picryl hydrazyl) 3mM dalam metanol. Campuran ini
divortek. Sebanyak 0.03 ml ekstrak air daun kumis kucing dan bunga knop baik
segar maupun bubuk dimasukkan ke dalam tabung reaksi tersebut kemudian di
vortek dan disimpan dalam ruang gelap pada suhu kamar (25oC) selama 20 menit.
Setelah 20 menit absorbansi yang dihasilkan dibaca pada 517 nm. Untuk blanko
digunakan akuades sebagai pengganti sampel, sedangkan untuk kontrol DPPH
diganti dengan metanol dan sampel diganti akuades. Penurunan absorbansi
menunjukkan adanya aktivitas scavenging atau aktivitas antioksidan. Untuk
pembuatan kurva standar digunakan Trolox®, dengan satuan TEAC (Trolox
Equivalent Antioxidant Capacity). Sebagian ekstrak air sampel disimpan dalam
ruang gelap pada suhu kamar untuk dianalisa lagi aktivitas antioksidan sampel
Analisa Proksimat (Apriyantono et al. 1989)
Analisa kadar air yang dilakukan dengan metode oven adalah sebagai
berikut. Cawan aluminium dikeringkan dalam oven selama 15 menit dan
didinginkan dalam desikator selama 10 menit, kemudian ditimbang. Bubuk daun
kumis kucing dan bubuk bunga knop ditimbang kurang lebih 5 gram dalam
cawan. Selanjutnya cawan beserta isinya ditempatkan dalam oven selama 6 jam.
Kemudian cawan dipindahkan ke desikator, lalu didinginkan. Setelah dingin
ditimbang kembali dan proses pengeringan dalam oven diulang sampai diperoleh
berat yang tetap. Perhitungan :
Berat sampel (g) = W1
Berat sampel setelah dikeringkan (g) = W2
Kehilangan berat (g) = W3
Kadar air (basis kering) (%) = W3 x 100% W2
Kadar air (basis basah) (%) = W3 x 100% W1
Pengukuran Kadar Protein dilakukan dengan cara menimbang sejumlah
bubuk daun kumis kucing dan bubuk bunga knop dan dimasukkan ke dalam labu
Kjeldahl lalu ditambahkan 2 g K2SO4, 50 mg HgO, 2 ml H2SO4 pekat dan batu
didih. Sampel didekstruksi selama 1-1.5 jam hingga jernih, lalu didinginkan.
Secara perlahan ditambahkan 2ml air dan didinginkan kembali. Cairan hasil
dekstruksi (cairan X) dipindahkan ke dalam alat destilasi dan labu dibilas dengan
air. Erlenmeyer berisi 5 ml H3BO3 dan 2 tetes indikator (metilen merah : metilen
biru = 2:1) diletakkan di ujung kondensor alat destilasi. Cairan X ditambah
dengan 10 ml NaOH-Na2S2O3 dan didestilasi sampai larutan dalam erlenmeyer ±
5 ml. Kemudian larutan dalam erlenmeyer dititrasi dengan HCl 0.02 N.
Perhitungan :
Volume HCl untuk titrasi sampel (ml) = Vs
Volume HCl untuk titrasi blanko (ml) = Vb
Konsentrasi HCl (N) = C
Kadar N (%) = (Vs-Vb)x N x 14.007 x 100% W
Kadar protein (%) = % N x 6.25
Pengukuran Kadar Lemak dilakukan dengan cara sebagai berikut. Labu
lemak yang telah bebas lemak dikeringkan di dalam oven. Setelah kering labu
didinginkan kemudian ditimbang. Bubuk daun kumis kucing dan bubuk bunga
knop dibungkus dalam kertas saring dan dimasukkan ke dalam alat ekstraksi
soxhlet, kemudian kondensor dan labu lemak dipasang pada ujung-ujungnya.
Pelarut dietil eter dimasukkan ke dalam alat lalu sampel direfluks selama 5 jam.
Setelah itu pelarut didestilasi dan ditampung di dalam wadah lain. Lemak dan
labu lemak dikeringkan di dalam oven pada suhu 105oC. Labu lemak kemudian
dipindahkan ke desikator, lalu didinginkan. Setelah dingin labu lemak ditimbang
kembali dan diulang proses pengeringan dalam oven sampai diperoleh berat yang
tetap. Perhitungan :
Berat sampel (g) = W1
Berat lemak (g) = W2
Kadar lemak (%) = W2 x 100% W1
Pengukuran Kadar Abu dilakukan dengan cara sebagai berikut. Cawan
porselin dibakar dalam tanur selama 15 menit kemudian didinginkan di dalam
desikator. Setelah dingin cawan ditimbang. Bubuk daun kumis kucing dan bubuk
bunga knop sebanyak 5 g ditimbang di dalam cawan lalu diabukan di dalam tanur
sampai didapatkan abu berwarna abu-abu dan beratnya tetap. Pengabuan
dilakukan dalam 2 tahap, yaitu : tahap pertama suhu 400oC lalu dilanjutkan pada
suhu 550oC. Cawan kemudian didinginkan di dalam desikator lalu ditimbang.
Perhitungan :
Berat sampel (g) = W1
Berat abu (g) = W2
Analisa Proliferasi Limfosit
Persiapan Larutan Ekstrak Daun Kumis Kucing dan Bunga Knop Serta Larutan Mitogen
Persiapan ekstrak daun kumis kucing dan bunga knop dilakukan dengan cara
terlebih dahulu membuat stock ekstrak Pembuatan stock ekstrak adalah dengan
cara membuat ekstrak air bubuk hasil pengeringan terbaik yang dibuat sesuai
dengan perbandingan pada Lampiran 1 untuk daun kumis kucing dan Lampiran 2
untuk bunga knop. Hasil ekstraksi disaring menggunakan saringan vakum
dengan kertas saring Whatman no. 41. Setelah itu hasil ektraksi dikeringbekukan
dengan freeze drier. Tabung freeze drier ditimbang (X1), setelah itu hasil
ekstrak air dimasukkan ke dalam tabung dan dikeringbekukan menggunakan
freeze drier selama 48 jam. Selama dikeringbekukan tabung freeze drier ditutup
dengan alumunium foil untuk menghindari terjadinya oksidasi. Hasil freeze dry
(X2) ditimbang untuk menentukan rendemen. Rendemen didapatkan dari
perhitungan :
Berat bubuk sampel awal (g) = W1
Berat hasil freeze dry (g) = X2 - X1 = W2
Rendemen sampel (basis basah) (%) = W2 x 100% W1
Rendemen yang didapat merupakan dasar untuk menghitung konsentrasi
ekstrak yang akan dimasukkan ke dalam kultur sel. Perhitungan selengkapnya
dapat dilihat pada Lampiran 3 untuk daun kumis kucing dan Lampiran 4 untuk
bunga knop. Rendemen ini adalah stock ekstrak yang digunakan untuk membuat
larutan stock ekstrak daun kumis kucing dan bunga knop
Pembuatan Larutan Stock Ekstrak (Daun Kumis Kucing dan Bunga Knop)
dan Larutan Stock Mitogen (LPS, ConA dan pokeweed) dilakukan dengan cara :
1. Pembuatan larutan stock ekstrak (daun kumis kucing dan bunga knop)
Sebanyak 0.2 g hasil freeze dry dilarutkan dengan sedikit medium
RPMI-1640 (medium pencuci), kemudian dimasukkan ke dalam labu
takar 5 ml. Medium RPMI-1640 (medium pencuci) ditambahkan sampai
2. Pembuatan larutan stock LPS dan Con A
Sebanyak 1 mg bubuk mitogen dilarutkan dengan sedikit medium RPMI-
1640, kemudian dimasukkan ke dalam labu takar 5 ml. Medium RPMI-1640
ditambahkan sampai tanda tera, sehingga didapatkan larutan stock dengan
konsentrasi 200 µg/ml.
3. Pembuatan larutan stock Pokeweed
Sebanyak 0.005 g bubuk pokeweed dimasukkan ke dalam tabung
eppendorf dan dilarutkan dengan medium RPMI-1640 sampai volume
eppendorf 1 ml, sehingga didapatkan larutan stock dengan konsentrasi
5000 µg/ml.
Larutan-larutan stock ini kemudian diencerkan sesuai dengan konsentrasi larutan
ekstrak (daun kumis kucing dan bunga knop) serta larutan mitogen yang
diinginkan.
Pembuatan larutan ekstrak (daun kumis kucing dan bunga knop) yang akan
diuji serta larutan mitogen (LPS, Con A dan Pokeweed) dari larutan Stock
dilakukan dengan cara mengencerkan larutan stock dengan medium RPMI-1640
sesuai dengan konsentrasi ekstrak yang diujikan dan konsentrasi larutan mitogen
yang diinginkan. Misal untuk membuat 5 ml (V2) ekstrak kumis kucing
dengan konsentrasi 0.6015 mg/ml (M2), maka larutan stock dengan konsentrasi
40 mg/ml (M1) yang harus diambil (V1) adalah :
V1 x M1 = V2 x M2
V1 x 40 mg/ml = 5 ml x 0.6015 mg/ml
V1 = 0.075 ml = 75 µl
Jadi sebanyak 75 µl larutan stock diambil dan dimasukkan ke dalam labu takar 5
ml dan ditambah dengan medium RPMI-1640 sampai tanda tera.
Persiapan Medium Kultur Sel Limfosit (Koesitoresmi 2002), Isolasi Limfosit (Nurrahman 1999) dan Penghitungan Sel
Medium yang digunakan untuk kultur dan pemeliharaan sel limfosit adalah
16.2 g RPMI-1640 bubuk yang telah mengandung L-glutamin dan 0.25 mM
HEPES. Bubuk ini dilarutkan dengan air bebas pirogen sehingga diperoleh 1 liter
penicillin-streptomycin. Medium yang telah diperkaya ini kemudian disterilisasi
kering dengan membran filter 0.2 µm dan digunakan sebagai medium pencuci.
Untuk medium kultur sel limfosit digunakan medium RPMI-1640 di atas dengan
penambahan fetal bovine serum (FBS) 10% steril. Pembuatan medium dan
tahap-tahap selanjutnya dalam isolasi limfosit dilakukan di dalam laminar flow yang
steril dengan sistem pengaliran udara laminar. Sebelum digunakan, laminar flow
[image:39.612.187.453.236.369.2]ini disinari dahulu dengan sinar UV selama 15 menit.
Gambar 3 Pengambilan darah secara aseptis
Darah seorang wanita sehat berusia 22 tahun diambil secara aseptis
sebanyak 50 ml dengan menggunakan needle dan vacutainer yang telah
mengandung heparin. Darah dari dalam vacutainer dipindahkan ke dalam tabung
sentrifuse steril, kemudian di sentrifuse dengan kecepatan 1500 rpm selama 10
menit. Bagian tengah (lapisan buffycoat) yang berisi sel-sel limfosit diambil
perlahan-lahan dengan pipet pasteur steril kemudian ditambah dengan 5 ml
medium RPMI-1640.
Larutan Ficoll-histopaque dimasukkan ke dalam tabung sentrifuse,
kemudian dimasukkan perlahan-lahan campuran lapisan buffycoat dan medium
RPMI di atasnya dengan perbandingan 1: 1. Selanjutnya disentrifuse dengan
kecepatan 2500 rpm selama 30 menit. Hasil sentrifuse didapatkan lapisan putih
seperti cincin antara larutan ficoll-histopaque dan RPMI-1640.
Lapisan putih tersebut diambil dengan pipet pasteur ke dalam tabung
disentrifuse dengan kecepatan 2000 rpm selama 10 menit. Supernatan diambil
dan ditambahkan RPMI-1640 (medium pencuci), disentrifuse pada 2000 rpm
selama 10 menit. Pencucian limfosit ini dilakukan 2 kali sehingga diperoleh
kemurnian suspensi sel limfosit yang tinggi.
Sebelum dilakukan kultur sel limfosit, terlebih dahulu dilakukan
penghitungan sel limfosit dengan menggunakan pewarna tryphan blue. Sejumlah
sel ditempatkan ke dalam sumur microplate dan ditambah dengan tryphan blue.
Penghitungan sel limfosit dilakukan dengan menggunakan hemasitometer di
bawah mikroskop cahaya Zeiss Germany ID 03 dengan perbesaran 10 kali.
Untuk dapat dikultur, jumlah sel limfosit yang dapat dihitung harus lebih
besar dari 95% berupa sel limfosit hidup yang berwarna terang. Limfosit yang
diperoleh akan digunakan untuk pengujian proliferasi sel B dan sel T.
Penghitungan sel limfosit dengan hemasitometer dapat dilakukan dengan
menggunakan rumus sebagai berikut :
N = A x FP x 104 sel/ml
Keterangan : N = jumlah sel limfosit/ ml
A = jumlah sel hidup rata-rata per bidang pandang
FP = faktor pengenceran
104 = jumlah sel per luas bidang pandang (1.0 mm x 1.0 mm x 0.1 mm)
Kultur Limfosit
Jumlah sel limfosit dari responden ditepatkan menjadi 2 x 106 sel/ml dengan
medium RPMI-1640. Untuk microplate 96 sumur, agar volume total
masing-masing sumur menjadi 100 µl, maka bahan-bahan yang dipersiapkan untuk
ditanam ke dalam kultur dapat dilihat pada pada Tabel 2. Setiap perlakuan
dilakukan tiga kali ulangan. Penentuan konsentrasi mitogen dapat dilihat pada
Lampiran 5. Kultur diinkubasi selama 72 jam dalam inkubator bersuhu 37oC
Pengujian proliferasi sel limfosit dilakukan dengan menggunakan metode
MTT. Enam jam sebelum masa inkubasi berakhir, ke dalam masing-masing
[image:41.612.129.514.175.354.2]sumur ditambahkan 10 ì l pewarna MT T 0.5% dan diinkubasi kembali pada
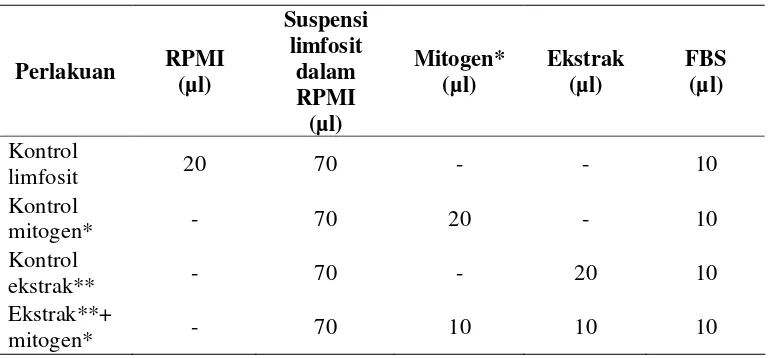
Tabel 2. Bahan-bahan yang ditanam ke dalam kultur sel
Perlakuan RPMI (µl)
Suspensi limfosit
dalam RPMI
(µl)
Mitogen* (µl)
Ekstrak (µl)
FBS (µl)
Kontrol
limfosit 20 70 - - 10
Kontrol
mitogen* - 70 20 - 10
Kontrol
ekstrak** - 70 - 20 10
Ekstrak**+
mitogen* - 70 10 10 10
*Mitogen : Lipopolisakarida (LPS), concanavalin A (conA) dan pokeweed (PK)
** Ekstrak : Ekstrak daun kumis kucing dan bunga knop dengan konsentrasi Sesuai dengan Lampiran 3 untuk daun kumis kucing dan Lampiran 4 untuk bunga knop
kondisi yang sama selama 6 jam. Pada akhir masa inkubasi, ditambahkan 80 ì l
HCl-isopropanol 0.04 N, setelah itu dilakukan pembacaan sel dengan alat
microplate reader pada panjang gelombang 570 nm.
- Nilai indeks stimulasi (IS) untuk semua perlakuan penambahan ekstrak
daun kumis kucing, bunga knop maupun mitogen :
IS = OD perlakuan OD kontrol
Pengujian ekstrak kumis kucing dan bunga knop dalam kultur sel limfosit
ini menggunakan Rancangan Acak Kelompok (RAK). Hasil pengujian dianalisis
dengan Analisis Sidik Ragam Satu Arah (ANOVA) dengan menggunakan
HASIL DAN PEMBAHASAN
Daun Kumis Kucing
Metode Pengeringan
Daun kumis kucing setelah dikering