CATATAN PENELITIAN
Potensi Enzim Dekstranase dari
Arthrobacter
sp.
Galur B7
sebagai Penghambat Plak Gigi
The Potency of Dextranase from Arthrobacter sp. Strain B7
as Dental Plaque Removal
AFAF BAKTIR1*, NOOR CHOLIES ZAINI2, UNTUNG MURDIYATMO4, KUNTAMAN3
1Fakultas MIPA, 2Fakultas Farmasi, 3Fakultas Kedokteran, Universitas Airlangga, Jalan Mulyorejo, Kampus C, Surabaya 60115
4Staf Ahli Direksi, PTP Nusantara XI, Jalan Merak, Surabaya 60175
Diterima 31 Januari 2005/Disetujui 24 Oktober 2005
Dextranase of Arthrobacter sp.strain B7 (B7DEX enzyme) was characterized in this study. This enzyme hydrolyzed sucrose and dextran, but not other glucans (starch, nigeran, cellulose, βββββ-soluble glucan). It also hydrolyzed glucan from dental plaque with the activity of 7.38 + 0.66 U/ml, where the activity toward dextran was 31.88 + 1.24 U/ml. The enzyme exhibited the pH optimum of 7 and the temperature optimum of 50 oC. Its optimum stability was at pH 7 and 50 oC.
The enzyme was inhibited by Fe3+, Cu2+, Zn2+, and Ag+, but not by the anionic detergent (SDS) and the nonionic detergent
(Triton-X). The enzyme was activated by Ca2+, Na+, Mg2+, and saliva.
___________________________________________________________________________
_________________
∗ ∗∗
∗∗Penulis untuk korespondensi, Tel./Fax. +62-31-5922427,
E-mail: afafi2001@yahoo.com
Enzim dekstranase adalah enzim yang dapat menghidrolisis ikatan glikosida α-1,6 pada glukan, dan digunakan untuk mengatasi permasalahan yang ditimbulkan oleh dekstran selama proses produksi gula tebu (Clarke et al. 1997). Untuk memenuhi kebutuhan enzim yang mempunyai nilai ekonomi tinggi ini, telah dicoba memproduksi dekstranase di dalam negeri dari mikrob yang diisolasi dari tanah di perkebunan tebu Indonesia, yaitu Arthrobacter sp. galurB7. Enzim ini dinamakan B7DEX, dan sudah diuji coba aplikasinya sebagai bahan unggul penghidrolisis glukan dalam nira tebu (dekstran) di industri gula (Murdiyatmo 1996).
Glukan yang terdapat di pabrik gula dinamakan dekstran, adalah sekelompok polisakarida bakteri yang disintesis dari sukrosa. Glukan terdiri dari rantai panjang glukosa yang dihubungkan oleh ikatan glikosida α-1,6, dan sedikit percabangan melalui beberapa ikatan glikosida α-1,2, α-1,3, atau α-1,4 (Robyt 1986). Adapun glukan yang terdapat di rongga mulut adalah glukan plak gigi berupa water insoluble
glucan (WIG) dan glukan saliva berupa water soluble glucan
(WSG). Keduanya tersusun dari rantai utama glukosa berikatan glikosida α-1,3 dan percabangan berupa rantai glukosa berikatan glikosida α-1,6 (Cury et al. 2000). Terdapat kesamaan antara glukan dalam industri gula dan glukan di rongga mulut, yaitu keduanya memiliki ikatan glikosida α-1,6. Glukan di rongga mulut merupakan komponen plak gigi yang menyebabkan karies gigi, suatu penyakit infeksi yang paling banyak dijumpai dan merupakan penyebab utama gigi tanggal pada anak-anak dan orang dewasa.
Berdasarkan kemiripan penyusun molekul antara glukan plak gigi dan glukan yang ada di industri gula, maka pada penelitian ini akan diteliti kemampuan enzim B7DEX dalam menghidrolisis glukan yang berasal dari plak gigi. Apabila enzim B7DEX dapat menghidrolisis glukan plak gigi dan memiliki penciri yang mendukung aktivitas ini, maka pada kesempatan penelitian selanjutnya akan dilakukan kloning gen penyandi enzim ini.
Komposisi ikatan glikosida α-1,6 dan α-1,3 pada glukan plak gigi bervariasi bergantung jenis mikrob yang berkembang di rongga mulut. Oleh karena itu, untuk kesempurnaan hidrolisis glukan plak gigi perlu dilakukan fusi gen B7DEX dengan gen penyandi enzim mutanase (enzim yang menghidrolisis ikatan glikosida α-1,3 pada glukan). Apabila fusi kedua gen ini diekspresikan dalam flora normal rongga mulut, akan diperoleh mikrob rekombinan penghasil enzim dekstranase dan mutanase ekstrasel yang dapat menghidrolisis glukan plak gigi. Mengingat mikrob rekombinan ini berasal dari flora normal rongga mulut, maka diharapkan dapat tumbuh dengan baik apabila diimplantasikan kembali ke rongga mulut. Visi penelitian ini adalah memperoleh sistem sinambung pensekresi enzim dekstranase dan mutanase dalam rongga mulut. Diharapkan hasil penelitian ini dapat memberikan solusi bagi problema karies gigi, karena prevalensinya di negara berkembang semakin meningkat (Lehner 1995).
Contoh enzim B7DEX, diproduksi dan diisolasi dari
Arthrobacter sp. galur B7 yang berasal dari penelitian sebelumnya (Murdiyatmo 1996; Baktir & Murdiyatmo 2003). Penentuan pH optimum adalah dengan cara mengukur aktivitas dekstranase contoh terhadap substrat dekstran, pada variasi pH 2, 3, 4, 5, 5.5, 6, 7, dan 8 menggunakan bufer fosfat sitrat 40 mM, pada suhu 40 oC selama 30 menit. Gula pereduksi
yang terbentuk ditentukan dengan metode Somogyi-Nelson (Nelson 1944; Somogyi 1945). Percobaan ini dilakukan secara triplo.
Pengaruh pH terhadap stabilitas enzim ditentukan menurut metode Hayashi et al. (1993), dengan cara mengukur aktivitas dekstranase contoh yang telah mengalami inkubasi pada pH tertentu (pH 2, 3, 4, 5, 6, dan 7) menggunakan bufer fosfat sitrat 40 mM, pada 30 oC selama 1 jam. Aktivitas dekstranase
ditentukan terhadap dekstran dalam bufer fosfat sitrat 40 mM pH 7, suhu 50 oC. Prosedur penentuan stabilitas pH ini diulang
dengan adanya 80 µl larutan BSA 0.05%. Percobaan
penentuan stabilitas pH ini dilakukan secara triplo.
Suhu optimum ditentukan dengan cara mengukur aktivitas dekstranase contoh terhadap substrat dekstran, pada pH optimum menggunakan bufer fosfat sitrat 40 mM, dengan variasi suhu 40, 50, 60, 70, dan 80 oC selama 30 menit. Gula
pereduksi yang terbentuk ditentukan dengan metode Somogyi-Nelson (Nelson 1944; Somogyi 1945). Percobaan ini dilakukan secara triplo.
Penentuan pengaruh suhu terhadap stabilitas enzim berdasarkan metode Hayashi et al. (1993) dan Hiraoka et al. (1972), dengan cara mengukur aktivitas dekstranase contoh yang telah mengalami inkubasi pada suhu 0, 30, 40, 50, 60, 70,
dan 80 oC selama 1 jam dalam bufer fosfat 40 mM pH 7.
Aktivitas dekstranase ditentukan terhadap dekstran dalam bufer fosfat sitrat 40 mM pH 7, suhu 50 oC. Prosedur penentuan
stabilitas suhu ini diulang dengan adanya 80 µl larutan BSA 0.05%. Percobaan ini dilakukan secara triplo.
Percobaan penentuan aktivitas dekstranase dilakukan menurut metode Kosaric et al. (1973). Dilakukan penentuan aktivitas dekstranase terhadap substrat dekstran dalam bufer asetat 0.1 M pH 7, pada 50 oC selama 30 menit, tanpa adanya
kation dan dengan adanya CaCl2 0.1, 1.0, dan 10 mM; NaCl 50, 100, 200, dan 400 mM; EDTA 0.1, 1.0, dan 10 mM; MgCl2 1.0
dan 10 mM; FeCl3 1.0 dan 10 mM; CuSO4 1.0 dan 10 mM;
ZnCl2 1.0 dan 10 mM; AgNO3 1.0 dan 10 mM. Kadar gula
pereduksi yang terbentuk ditentukan dengan menggunakan metode Somogyi-Nelson (Nelson 1944; Somogyi 1945). Percobaan ini dilakukan secara triplo.
Prosedur pengumpulan plak gigi dikerjakan menurut metode Cury et al. (2000). Plak gigi dikumpulkan dari semua gigi 15 orang relawan melalui prosedur standar di Laboratorium Periodonsia, Fakultas Kedokteran Gigi Universitas Airlangga, Surabaya.
Prosedur preparasi glukan ini dilakukan untuk mendapatkan glukan WIG dalam bentuk preparat kasar (crude), dilakukan sesuai dengan metode Cury et al. (2000).
Uji aktivitas B7DEX terhadap substrat glukan WIG dilakukan menggunakan bufer fosfat sitrat 40 mM, pH 7 pada suhu optimumnya selama 30 menit, dengan dan tanpa aktivator logam maupun nonlogam. Kekeruhan campuran reaksi diamati sebelum dan setelah inkubasi. Gula pereduksi yang terbentuk ditentukan dengan metode Somogyi-Nelson. Prosedur ini dilakukan pula untuk substrat dekstran. Percobaan ini dilakukan secara triplo.
Penentuan kespesifikan enzim dilakukan dengan cara mereaksikan enzim seperti pada prosedur penentuan pH optimum menggunakan kondisi pH 7 terhadap beberapa substrat, meliputi dekstran, pati, sukrosa, selulosa, nigeran, dan β-soluble glucan. Kespesifikan substrat disimpulkan dari ada atau tiadanya aktivitas enzim B7DEX terhadap setiap substrat yang dicoba (Igarashi et al. 1992).
Penentuan aktivitas dekstranase contoh terhadap substrat dekstran dengan dan tanpa saliva 25% dilakukan menggunakan campuran reaksi yang mengandung bufer fosfat sitrat 40 mM, pH 7. Kadar gula pereduksi yang terbentuk pada setiap tabung ditentukan dengan menggunakan metode Somogyi-Nelson (Nelson 1944; Somogyi 1945). Percobaan ini dilakukan secara triplo.
Pengukuran aktivitas dekstranase terhadap substrat dekstran dilakukan menggunakan bufer asetat 0.1 M, pH 7, pada 50 oC selama 30 menit, tanpa deterjen dan dengan adanya
sodium dodesil sulfat (SDS) kadar 0.01, 0.03, dan 0.05%; Triton-X 0.01, 0.03, dan 0.05%. Kadar gula pereduksi yang terbentuk ditentukan dengan menggunakan metode Somogyi-Nelson (Somogyi-Nelson 1944; Somogyi 1945). Percobaan ini dilakukan secara triplo.
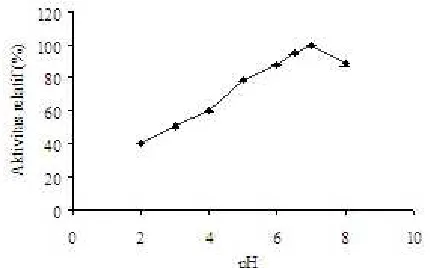
Enzim B7DEX aktif pada kisaran pH 5-8 dengan pH optimum 7 (Gambar 1). Enzim ini menunjukkan kestabilan tinggi pada pH 5-8 maupun pH terendah di rongga mulut, yaitu pH 4. Inkubasi satu jam pada kisaran pH 2-8 tampak bahwa aktivitas yang masih dipertahankan adalah > 50% (Gambar 2). Penambahan BSA 0.05% menyebabkan peningkatan kestabilan pada pH 8, yaitu terlihat peningkatan aktivitas sebesar 15% dibanding tanpa penambahan BSA. Adapun pada pH di bawah 8, penambahan BSA tidak memberikan pengaruh yang berarti (Gambar 2).
Aktivitas enzim B7DEX optimum pada suhu 50 oC, namun
pada suhu 37 oC masih menunjukkan aktivitas relatif yang
cukup tinggi sebesar 83% (Gambar 3). Enzim B7DEX yang diinkubasi pada suhu 0 oC pH 7 selama satu jam, aktivitasnya
masih dipertahankan 100%. Inkubasi pada suhu di atas 0 oC
menyebabkan penurunan aktivitas enzim. Inkubasi pada 55
oC (suhu optimum) dan 37 oC (suhu rongga mulut)
menunjukkan bahwa 95% aktivitas masih dipertahankan.
Adapun inkubasi pada suhu 60 oC sampai dengan 80 oC
aktivitas yang dipertahankan sekitar 25% (Gambar 4). Penambahan BSA 0.05% menyebabkan peningkatan kestabilan pada inkubasi enzim suhu 60-80 oC, yaitu terlihat
peningkatan aktivitas sebesar 10-13% dibanding tanpa
penambahan BSA. Adapun pada suhu di bawah 50 oC
penambahan BSA tidak memberikan pengaruh yang berarti (Gambar 4).
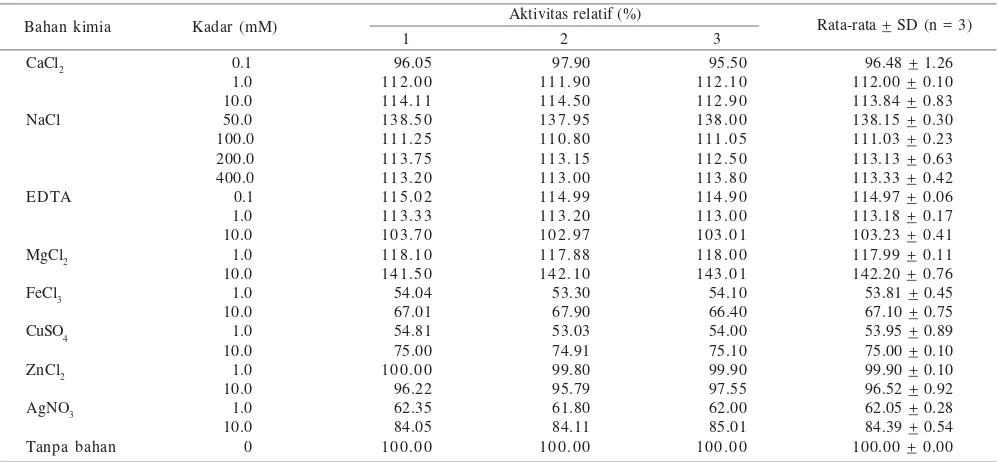
Penambahan kation Ca2+, Na+, dan Mg2+ pada kadar yang
semakin tinggi meningkatkan aktivitas relatif enzim B7DEX kecuali Na+. Kation Fe2+, Cu2+, Zn2+, dan Ag+ pada kadar 1.0
dan 10.0 M berpengaruh menurunkan aktivitas relatif enzim B7DEX. Adapun keberadaan pengkelat EDTA meningkatkan aktivitas enzim B7DEX (Tabel 1).
Aktivitas sisa (%)
Gambar 2. Hasil penentuan pengaruh pH terhadap stabilitas enzim B7DEX pada suhu 30 oC.
Suhu (oC)
Gambar 3. Hasil penentuan suhu optimum enzim B7DEX pada pH 7.
Aktivitas sisa (%)
Suhu (oC)
Gambar 4. Hasil penentuan pengaruh suhu terhadap stabilitas enzim B7DEX pada pH 7.
Tabel 1. Pengaruh kation logam terhadap aktivitas enzim B7DEX
Aktivitas relatif (%)
Aktivitas enzim B7DEX terhadap glukan plak gigi adalah 7.38 + 0.66 U/ml, dan aktivitas terhadap substrat dekstran adalah 31.88 + 1.24 U/ml (Tabel 2). Sebelum diinkubasi pada
suhu optimum (50 oC), campuran reaksi tampak keruh, dan
juga dapat menghidrolisis sukrosa. Namun enzim ini tidak dapat menghidrolisis pati, nigeran, selulosa, dan β-solubleglucan. Penambahan saliva meningkatkan aktivitas relatif enzim B7DEX
(Tabel 3). Adanya aktivator SDS, Ca2+, dan Mg2+ dalam
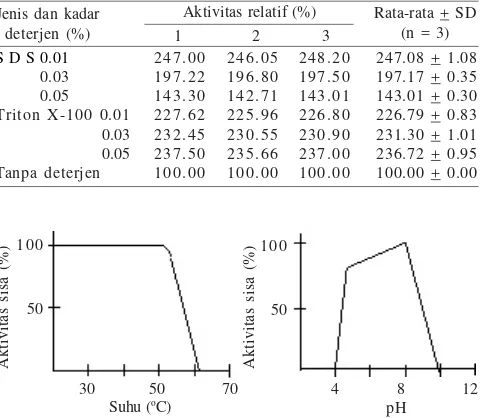
campuran reaksi menyebabkan peningkatan aktivitas tersebut lebih besar (Tabel 4). SDS dan Triton X-100 dapat meningkatkan aktivitas relatif enzim B7DEX dari kadar 0.01 hingga 0.05% (Tabel 5). Pada kadar SDS 0.01% kenaikan aktivitasnya lebih tinggi daripada 0.01%.
Penentuan aktivitas enzim B7DEX terhadap substrat glukan tak larut (water insoluble glucan) yang berasal dari plak gigi, dan penentuan penciri yang mendukung aktivitas tersebut, merupakan langkah awal untuk mengembangkan enzim B7DEX sebagai bahan pencegah karies gigi melalui kemampuannya menghidrolisis glukan plak gigi. Enzim B7DEX memiliki pH optimum 7, adalah sesuai dengan pH saliva secara umum. Pada pH 4.5-5.0 aktivitas enzim B7DEX masih dipertahankan > 75%, pada pH 4 aktivitas yang dipertahankan 60% (Gambar 1). Dengan demikian enzim B7DEX senantiasa aktif bekerja pada kondisi fluktuasi pH sebagai akibat fermentasi oleh mikrob yang ada di rongga mulut. Hasil penentuan stabilitas pH menunjukkan bahwa enzim B7DEX
pada pH 2 suhu 37 oC selama 1 jam aktivitas yang tersisa
sekitar 50%. Pada pH lebih tinggi aktivitas yang dipertahankan semakin tinggi sampai pada pH optimumnya (pH 7) aktivitas masih dipertahankan 100%. Dengan demikian enzim B7DEX memiliki stabilitas tinggi pada kondisi pH dan suhu yang ada di rongga mulut pada umumnya, dan diharapkan dapat berfungsi dengan optimal dalam saliva maupun dalam plak
gigi. Tabel 5. Pengaruh deterjen terhadap aktivitas enzim B7DEX
Aktivitas relatif (%)
Tabel 3. Pengaruh saliva terhadap aktivitas enzim B7DEX Aktivitas relatif (%)
Tabel 4. Pengaruh saliva terhadap aktivitas enzim B7DEX dengan dan tanpa adanya aktivator SDS, CaCl2, dan MgCl2
Aktivator Aktivitas relatif (%)
Kekuatan kerja enzim juga ditentukan oleh suhu, yaitu enzim B7DEX merupakan dekstranase termolabil dengan suhu optimum 50 oC. Pada suhu tubuh (37 oC) masih menunjukkan
aktivitas yang cukup tinggi, yaitu 83% dari aktivitas optimumnya. Pada pH rongga mulut, yaitu pH 7, enzim B7DEX dapat mempertahankan seluruh aktivitasnya selama 1 jam pada
kenaikan suhu sampai 40 oC (Gambar 4). Enzim dekstranase
termolabil yang lain, misalnya yang dihasilkan oleh Aspergillus corneus (Gambar 5), pada kenaikan suhu hingga 50 oC selama
15 menit aktivitasnya masih dipertahankan 100% (Hiraoka et
al. 1972). Dekstranase dari Streptococcus sobinus
menunjukkan suhu optimum 39 oC dan pada suhu rongga mulut
aktivitas yang dipertahankan hanya 60% (Wanda & Curtiss 1994). Dekstranase termolabil dari Penicillium funiculosum
menunjukkan suhu optimum 55 oC, dan pada suhu 37 oC
aktivitasnya tinggal 45% (Kosaric et al. 1973).
Larutan enzim yang sangat encer dapat mengalami penurunan aktivitas yang sangat cepat, terutama bila berada dalam kondisi suhu atau pH yang tidak sesuai (Scopes 1987). Penambahan BSA 0.05% ke dalam larutan enzim B7DEX dapat meningkatkan stabilitas enzim terhadap peningkatan suhu maupun pH yang tinggi. Sedang pada kondisi suhu atau pH yang sedang, pengaruh penambahan BSA terhadap peningkatan aktivitas cukup kecil (sebesar 2%). Berdasarkan data pada Gambar 2 dan 4, peningkatan stabilitas maksimum yang dapat dicapai dengan penambahan BSA adalah 15% untuk suhu 60 oC, dan 13% untuk pH 8.
Tabel 2. Kespesifikan enzim B7DEX terhadap substrat Aktivitas (U/ml)* 1 2 3
Substrat Rata-rata + SD (n = 3) *1 U = jumlah enzim B7DEX per ml yang membebaskan 1 µmol glukosa per menit dalam kondisi percobaan
30 50 70 4 8 12 1 0 0
50
1 0 0 50
Aktivitas sisa (%) Aktivitas sisa (%)
Gambar 5. Stabilitas suhu dan pH enzim dekstranase dari Aspergillus corneus (Hiraoka et al. 1972).
Suhu (oC)
Berdasarkan data aktivitas enzim B7DEX terhadap glukan plak gigi dan pengamatan hilangnya kekeruhan setelah reaksi hidrolisis berlangsung, dapat disimpulkan bahwa enzim B7DEX mampu menghidrolisis plak gigi. Selain menghidrolisis ikatan glikosida α-1,6 pada dekstran, enzim B7DEX juga dapat menghidrolisis ikatan glikosida α-1,4 pada sukrosa, tetapi tidak dapat menghidrolisis ikatan glikosida α-1,6 maupun α-1,4 pada pati. Enzim B7DEX juga tidak dapat menghidrolisis ikatan glikosida β-1,6 pada selulosa, nigeran dan solubleglucan. Karakter ini berbeda dengan karakter enzim dekstranase yang dihasilkan oleh Streptococcus mutans Ingbritt (Igarashi et al. 1992) dan bakteri termofilik Rt364 (Wynter et al. 1996) yang tidak dapat menghidrolisis sukrosa walau keduanya dapat menghidrolisis glukan WIG.
Aktivitas enzim B7DEX terhadap sukrosa cukup tinggi, yaitu 96.72 + 0.95 U/ml (Tabel 2). Kemampuan enzim B7DEX menghidrolisis sukrosa merupakan potensi unggulan enzim B7DEX sebagai bahan anti plak gigi, karena sukrosa adalah senyawa utama dan pertama yang menjadi penyebab karies gigi.
UCAPAN TERIMA KASIH
Penelitian ini merupakan bagian dari Penelitian Hibah Bersaing XI, yang didanai oleh Proyek Pengkajian dan Penelitian Ilmu Pengetahuan Terapan dari Direktorat Pembinaan Penelitian dan Pengabdian pada Masyarakat, Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional.
DAFTAR PUSTAKA
Baktir A, Murdiyatmo U. 2003. Identifikasi mikrob penghasil dekstranase dari tanah. J MIPA 8:45-50.
Clarke MA, Edye LA, Cole F, Kitchar JL. 1997. Sugarcane factory trials with dextranase enzyme. Sugar J 12:50-55.
Cury JA et al. 2000. Biochemical composition and cariogenicity of dental plaque formed in the presence of sucrose or glucose and fructose. Caries Res 34:491-497.
Hayashi S, Hayashi T, Takasaki Y, Imada K. 1993. Purification and properties of glucosyltransferase from Aureobasidium. J Indust Microbiol 13:5-9.
Hiraoka N, Fukumoto J, Tsuru D. 1972. Purification and some enzymatic properties of Aspergillus corneus dextranase. J Biochem 71:57-64.
Igarashi T, Yamamoto A, Goto N. 1992. Characterization of the dextranase purified from Streptococcus mutans ingbritt. Microbiol Immunol 36:969-976.
Kosaric N, Yu K, Zajic JE, Rozanis J. 1973. Dextranase production from Penicillium funiculosum. Biotechnol Bioeng 15:729-741. Lehner T. 1995. Immunology of Oral Disease. Ed ke-3. Jakarta:
Erlangga.
Murdiyatmo U. 1996. Isolasi dan identifikasi parsial bakteri penghasil enzim dekstranase. Majalah Penelitian Gula 32:1-7.
Nelson N. 1944. A photometric adaptation of the Somogyi method for the determination of glucose. J Biol Chem 153:375-381. Robyt JF. 1986. Dextran. Di dalam: Mark HF, Bikales NM, Overberger
CG, Menges G (ed). Encyclopedia of Polymer Sciense and Engineering. Vol IV. New York: John Wiley and Sons. hlm 752-767.
Scopes RK. 1987. Protein Purification, Principle and Practice. Ed ke-3. New York: Springer-Verlag Inc.
Somogyi M. 1945. A new reagent for the determination of sugars. J Biol Chem 160:61-73.
Wanda SY, Curtiss R III. 1994. Purification and characterization of
Streptococcus sobrinus dextranase produced in recombinant E. coli and sequence analysis of the dextranase gene. J Bacteriol
176:3839-3850.
Wynter C et al. 1996. A novel dextranase from a thermoanaerobacter