PENGARUH BERBAGAI KONSENTRASI METOPREN TERHADAP
LARVA NYAMUK
Aedes aegypti
NORA SAIDUL FATIMAH BINTI YASSIN
DEPARTEMEN ILMU PENYAKIT HEWAN DAN KESEHATAN MASYARAKAT VETERINER
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Berbagai Konsentrasi Metopren terhadap Larva Nyamuk Aedes aegypti adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan di dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Nora Saidul Fatimah Binti Yassin
ABSTRAK
NORA SAIDUL FATIMAH BINTI YASSIN. Pengaruh Berbagai Konsentrasi Metopren terhadap Larva Nyamuk Aedes aegypti. Dibimbing oleh Prof Dr Drh Upik Kesumawati Hadi, MS dan Drh Supriyono, MSi.
Demam Berdarah Dengue dan Chikungunya merupakan penyakit yang ditransimisikan oleh vektor Ae. aegypti yang menjadi masalah kesehatan masyarakat di Indonesia. Metopren adalah insektisida Insect Growth Regulator
yang berperan sebagai senyawa analog hormon juvenile yang bekerja semasa stadium pradewasa nyamuk. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh berbagai konsentrasi metopren pada larutan berumur 24 jam dan metopren pada larutan berumur 720 jam (30 hari) terhadap larva nyamuk Ae. aegypti serta bentuk kelainan morfologi stadium pradewasa nyamuk Ae. aegypti
yang terpapar metopren. Pengujian dilakukan terhadap larva Ae. aegypti instar ketiga dengan konsentrasi bertahap mulai dari 0.0108 g/L, 0.0217 g/L, 0.0325 g/L, 0.0433 g/L, dan 0.0541 g/L. Hasil penelitian menunjukkan bahwa persentase mortalitas larva/pupa Ae. aegypti setelah terpapar metopren pada larutan berumur 24 jam adalah 71.6% pada konsentrasi 0.0108 g/L, 81.6% (0.0217 g/L), 90.8% (0.0325 g/L), 100% (0.0433 g/L), dan 100% (0.0541 g/L). Hal ini menunjukkan bahwa konsentrasi efektif metopren adalah antara 0.0217 g/L-0.0541 g/L. Pengamatan metopren pada larutan berumur 720 jam adalah 44.8% pada konsentrasi 0.0108 g/L, 57.6% (0.0217 g/L), 75.2% (0.0325 g/L), 79.2% (0.0433 g/L), dan 85.2% (0.0541 g/L). Hal ini menunjukkan bahwa konsentrasi efektif metopren untuk membunuh larva/pupa adalah 0.0541 g/L. Metopren efektif membunuh larva nyamuk Ae. aegypti pada konsentrasi 0.0541 g/L sebesar 85.2% selama 30 hari. Stadium pradewasa Ae. aegypti yang terpapar metopren mengalami kelainan morfologi berupa (1) kerusakan tubuh larva sebanyak (2%), (2) kerusakan abdomen pupa (8%), (3) kekakuan pada tubuh pupa (78%), dan (4) kegagalan eklosi pada pupa (12%).
ABSTRACT
NORA SAIDUL FATIMAH BINTI YASSIN. Effect of Various Concentration of Methoprene against Aedes aegypti Larvae. Supervised by Prof Dr Drh Upik Kesumawati Hadi, MS and Drh Supriyono, MSi.
Dengue Hemorrhagic Fever and Chikungunya are diseases transmitted by vector Ae. aegypti which is public health problem in Indonesia. Methoprene is Insect Growth Regulator insecticide that act as juvenile hormone analog that work during the pre-adult stages of mosquito. The aim of this study are to determine an effect of various concentration of methoprene 24 hours age residual solution and methoprene 720 hours (30 days) age residual solution against Ae. aegypti larvae also the morphological abnormalities of the pre-adult stages of Ae. aegypti after methoprene exposure. The test conducted against Ae. aegypti third instar larvae by gradual concentrations started from 0.0108 g/L, 0.0217 g/L, 0.0325 g/L, 0.0433 g/L, to 0.0541 g/L respectively. The result showed that the mortality percentage of Ae. aegypti larvae/pupae after methoprene 24 hours age residual solution exposure were 71.6% at 0.0108 g/L concentration, 81.6% (0.0217 g/L), 90.8% (0.0325 g/L), 100% (0.0433 g/L), and 100% (0.0541 g/L). This suggests that the effective concentration of methoprene was raging from 0.0217 g/L-0.0541 g/L. The observation of mortality percentage after methoprene 720 hours age residual solution exposure were 44.8 % at a concentration of 0.0108 g/L, 57.6 % (0.0217 g/L), 75.2 % (0.0325 g/L), 79.2 % (0.0433 g/L), and 85.2 % (0.0541 g/L) respectively. This suggests that the most effective concentration of methoprene was 0.0541 g/L. Methoprene effectively could kill 85.2% Ae. aegypti larvae at a concentration of 0.0541 g/L for 30 days. The morphological abnormalities of the larvae and pupae after methoprene exposure were (1) damaged of larvae bodies was 2%, (2) damaged of pupae abdomen (8%), (3) pupae with a rigid body (78%), and (4) failed eclotion of pupae (12%).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
PENGARUH BERBAGAI KONSENTRASI METOPREN
TERHADAP LARVA NYAMUK
Aedes aegypti
NORA SAIDUL FATIMAH BINTI YASSIN
DEPARTEMEN ILMU PENYAKIT HEWAN DAN KESEHATAN MASYARAKAT VETERINER
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2014 yaitu Pengaruh Berbagai Konsentrasi Metopren terhadap Larva Nyamuk Aedes aegypti.
Selama penulisan skripsi ini, penulis banyak mendapat bimbingan dan masukan serta bantuan dari banyak pihak. Dengan tersusunnya skripsi ini, penulis mengucapkan ribuan terima kasih kepada Prof Dr Drh Upik Kesumawati Hadi, MS dan Drh Supriyono, MSi sebagai dosen pembimbing skripsi atas segala bimbingan, ilmu, waktu dan kesabaran yang diberikan selama penelitian dan penyusunan skipsi ini. Penulis juga berterima kasih kepada Drh Nastiti Kusumorini sebagai dosen pembimbing akademik atas bimbingan dan nasihat selama ini dan ucapan terima kasih kepada Bapak Edie, Bapak Opik, dan Bapak Nanang dari UKPHP yang telah memberi banyak masukan dan saran selama penelitian ini berjalan. Ribuan terima kasih yang tidak terhingga penulis sampaikan kepada keluarga tercinta mama, abah, dan saudara kandung serta teman seperjuangan skripsi saya Iwan Saepudin, Shuffur Husna Hermawan, dan Agitsnissalimah atas segala dukungan, kasih sayang, dan semangat yang selalu diberikan. Terima kasih juga penulis sampaikan kepada Mahasiswa PKPMI Bogor, dan teman-teman Acromion 47 atas segala kebersamaan.
Penulis menyadari adanya kekurangan dan keterbatasan dalam skripsi ini. Oleh kerena itu, segala kritik dan saran terhadap skripsi ini sangat diharapkan. Semoga penulisan ini bermanfaat bagi pembaca dan yang berkepentingan.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Zat Pengatur Tumbuh Serangga (Insect Growth Regulator) 2
Struktur Kimia Metopren 3
Metode Kerja (Mode of Action) Metopren sebagai Insektisida 4
Penggunaan Metopren dalam Pengendalian Vektor 4
METODE PENELITIAN 5
Tempat dan Waktu Penelitian 5
Metode Penelitian 5
Pengolahan Data 6
Analisis Data 6
HASIL DAN PEMBAHASAN 7
Mortalitas Larva/Pupa Ae. aegypti terhadap Metopren yang Dilarutkan
Selama 24 Jam 7
Mortalitas Larva/Pupa Ae. aegypti terhadap Metopren yang Dilarutkan
Selama 720 Jam (30 Hari) 8
Bentuk Kelainan Morfologi Stadium Pradewasa Nyamuk Ae. aegypti
yang Terpapar Metopren 10
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
DAFTAR TABEL
1. Rata-rata Persentase Mortalitas Larva/Pupa Ae. aegypti Setelah
Terpapar Metopren pada Larutan Berumur 24 Jam 7 2. LT50 dan LT90 Metopren pada Larutan Berumur 24 Jam terhadap
Larva/Pupa Ae.aegypti 8
3. Rata-rata Persentase Mortalitas Larva/Pupa Ae. aegypti Setelah
Terpapar Metopren pada Larutan Berumur 720 Jam (30 Hari) 8 4. LT50 dan LT90 Metopren pada Larutan Berumur 720 Jam (30 Hari)
terhadap Larva/Pupa Ae. aegypti 9
DAFTAR GAMBAR
1. Struktur Kimia Metopren 3
2. Bentuk-bentuk Larva dan Pupa Ae. aegypti normal, serta Kelainan
PENDAHULUAN
Latar Belakang
Nyamuk merupakan serangga yang banyak terdapat di lingkungan sekitar permukiman. Keberadaan nyamuk dalam jumlah besar dapat mengganggu masyarakat karena mengisap darah dan berperan sebagai vektor penyakit. Jenis-jenis nyamuk tersebut diantaranya adalah Aedes sp., Culex sp., dan Anopheles sp..
Nyamuk Ae. aegypti merupakan vektor utama penyakit demam berdarah dengue dan chikungunya. Kasus penyakit DBD di Indonesia muncul sejak tahun 1968 di Surabaya. Belakangan ini, DBD telah menjadi masalah klasik yang kejadiannya muncul setiap tahun terutama pada awal musim hujan (DEPKES 2005). Penyakit chikungunya di Indonesia dilaporkan pertama kali di Samarinda pada tahun 1973, kemudian berjangkit di Kuala Tungkal, Jambi tahun 1980. Seterusnya, pada tahun 1983 merebak di Martapura, Ternate, dan Yogyakarta. Kejadian luar biasa (KLB) chikungunya terjadi pada awal tahun 2001 di Muara Enim, Sumatera Selatan dan Aceh (Widoyono 2005).
Ae. aegypti merupakan nyamuk yang mempunyai aktivitas menggigit pada siang dan sore hari dengan dua puncak waktu yaitu setelah matahari terbit (8.00-10.00) dan sebelum matahari terbenam (15.00-17.00). Pengendalian nyamuk Ae. aegypti dapat dilakukan secara mekanik, biologis dan kimiawi. Pengendalian secara mekanik dapat dilakukan dengan cara mencegah nyamuk kontak dengan manusia misalnya memasang kawat kasa pada lubang ventilasi rumah serta menggalakkan gerakan 3 M yaitu menguras tempat-tempat penampungan air, menutup rapat tempat penampungan air sehingga tidak dapat diterobos oleh nyamuk dewasa, dan mengubur barang-barang bekas yang dapat menampung air hujan. Pengendalian secara biologis dapat menggunakan musuh alami atau predator sebagai pemangsa, sedangkan pengendalian secara kimiawi dengan menggunakan insektisida kimia. Pengendalian menggunakan insektisida kimia banyak dilakukan karena mudah didapat dan bekerja cepat membunuh serangga sasaran.
Beberapa golongan insektisida kimia yang sering digunakan dalam pengendalian nyamuk adalah organofosfat, karbamat, piretroid, dan Insect growth regulator (IGR) (Hadi dan Koesharto 2006). Senyawa yang termasuk ke dalam IGR satu di antaranya adalah metopren. IGR merupakan zat pengatur tumbuh serangga yang berperan dalam mengganggu atau menghambat pertumbuhan normal serangga. Pertumbuhan yang tidak normal ditandai dengan perpanjangan stadium larva atau kegagalan menjadi pupa atau dewasa mandul. IGR sering digunakan dalam pengendalian serangga karena toksisitas pada mamalia umumnya sangat rendah. Selain itu, kerja IGR adalah menggaggu proses pertumbuhan yang spesifik pada serangga sasaran. Senyawa IGR bekerja dengan menghambat sintesa khitin dan hormon juvenoid. Hormon ini merupakan senyawa yang menghambat proses pergantian kulit (molting) pada stadium pradewasa (Wirawan 2006).
serangga sasaran. Penelitian ini bertujuan mengetahui pengaruh berbagai konsentrasi metopren pada larutan berumur 24 jam dan metopren pada larutan berumur 720 jam (30 hari) terhadap larva nyamuk Ae. aegypti serta bentuk kelainan morfologi stadium pradewasa nyamuk Ae. aegypti yang terpapar metopren, sehingga hasil penelitian ini diharapkan dapat memberikan informasi efektivitas insektisida IGR sebagai larvasida nyamuk Ae. aegypti.
TujuanPenelitian
Penelitian ini bertujuan untuk mengetahui pengaruh berbagai konsentrasi metopren pada larutan berumur 24 jam dan metopren pada larutan berumur 720 jam (30 hari) terhadap larva nyamuk Ae. aegypti serta bentuk kelainan morfologi stadium pradewasa nyamuk Ae. aegypti yang terpapar metopren.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi efektivitas insektisida IGR sebagai larvasida nyamuk Ae. aegypti.
TINJAUAN PUSTAKA
Zat Pengatur Tumbuh Serangga (Insect Growth Regulator)
Insect growth regulator atau disebut sebagai zat pengatur tumbuh serangga merupakan insektisida mirip hormon tiruan yang mengatur pertumbuhan pada siklus hidup pradewasa serangga. IGR terbagi ke dalam dua kelas yaitu: (1)
Juvenile hormone analog dan (2) Chitin synthesis inhibitor (Wirawan 2006). Sebagian komponen dari senyawa IGR adalah hormon kemudaan (juvenile hormone) yang disekresi oleh sepasang kelenjar di otak serangga yang dikenal sebagai corpora allata. Hormon Juvenile berfungsi untuk memerintahkan serangga agar tetap pada stadium pradewasa. Ketika serangga sudah mencapai ukuran yang optimal yang juga dikenal sebagai critical weight, hormon
prothoracicotropic (PTTH) akan dilepaskan dan merangsang sekresi hormon
ecdyson yang bekerja untuk memicu proses pergantian kulit. Mekanisme yang mengendalikan sekresi PTTH berbeda antara spesies serangga. Serangga hemiptera seperti Rhodnius prolixus dan Oncopelitus fasciatus akan mengalami peregangan perut setelah mengisap darah sebagai signal terjadinya sekresi PTTH dan pergantian kulit berikutnya (Minakuchi dan Riddiford 2006). Pada kondisi pertumbuhan serangga normal, ketika pertumbuhan serangga sudah dianggap cukup maka produksi hormon juvenile akan berhenti dan memicu serangga untuk berganti kulit menjadi stadium dewasa. Pemberian juvenile hormone analog
mengakibatkan kegagalan larva serangga untuk berganti kulit sehingga terjadi perpanjangan stadium larva atau pupa. Senyawa-senyawa yang termasuk ke dalam
Senyawa IGR selain mengganggu sistem endokrin juga menghambat produksi kutikula. Khitin adalah lapisan utama penyusun tubuh serangga (eskoskleton). Khitin terdiri dari protein dan fraksi khitin yang terbagi menjadi
tiga bentuk yaitu khitin α, , dan . Sintesa khitin tergantung oleh kerja enzim
sintesis khitin yang berada di plasma membran. Bagaimanapun enzim ini diproduksi sebagai zymogen (inaktif) di dalam retikulum endoplasma epidermis dan harus diaktifkan oleh protease untuk sintesa khitin. Senyawa Chitin synthesis inhibitor dapat mengganggu enzim yang merangsang proses sintesa khitin (chitin biosynthesis inhibitor). Serangga yang terpapar senyawa ini juga tidak mampu mengganti kulit (molting) sehingga siklus pertumbuhan dari serangga dihambat. Senyawa-senyawa yang termasuk ke dalam Chitin synthesis inhibitor adalah adalah bistfluron, buprofezin, cyromazine, diflubenzuron, hexaflumuron, lufenuron, dan penfluron (Tunaz dan Uygun 2004).
Struktur Kimia Metopren
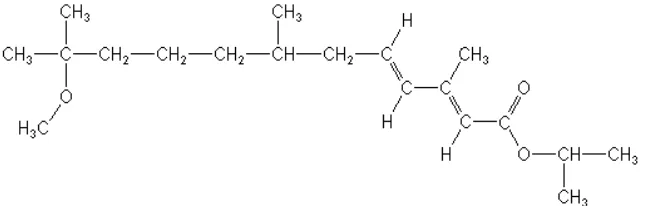
Senyawa metopren merupakan insektisida yang berfungsi sebagai juvenile hormone analog. Senyawa ini mengatur pertumbuhan siklus pradewasa nyamuk sehingga menyebabkan kelainan struktur morfologi dan kematian pada berbagai spesies nyamuk. Metopren dengan rumus kimianya C19H34O3 merupakan hormon juvenoid pertama yang digunakan di Amerika sejak tahun 1975. Secara kimia rumus molekul metopren terdiri dari Isopropil (2E,4E)-11-Metoksi-3,7,11-trimetil-2, 4-dodekadienoate dengan bobot molekul sebesar 310.48 g/mol (Bahri 2010).
Gambar 1 Struktur Kimia Metopren (Sumber: Kamita dan Hammock 2010)
pada anjing adalah 5000-10000 mg/kgBB. Toksisitas dermal metopren pada kelinci adalah 3000-10000 mg/kgBB sedangkan pada tikus adalah 5000 mg/kgBB (Henrick et al. 2002). Metopren terurai dalam air dan cahaya matahari secara cepat, sehingga sesuai untuk penggunaan dalam ruangan (Wirawan 2006).
Metode Kerja (Mode of Action) Metopren sebagai Insektisida
Metopren merupakan satu contoh juvenile hormone analog yang bekerja pada nyamuk. Mekanisme kerja hormon ini tidak mematikan larva secara langsung tetapi mengacaukan proses perubahan bentuk larva menjadi pupa dan nyamuk (development inhibitor). Metopren dapat memasuki tubuh larva nyamuk melalui proses makan atau penyerapan melalui eksoskeleton. Di dalam tubuh larva, metopren akan bertahan dan mempengaruhi proses diferensiasi serta maturasi larva sehingga masa perkembangan larva menjadi lebih lama dan perubahan larva menjadi pupa terhambat. Metopren tidak seperti hormon juvenile
alami, yang dipengaruhi oleh enzim degeneratif (hormon juvenile spesifik esterase) yang memecah hormon secara normal. Metopren memperpanjang aktivitas hormon juvenile melebihi batas normal dengan menekan aktivitas esterase. Larva yang berhasil menjadi pupa akan mengalami kematian dan kegagalan eklosi karena metopren menghambat kerja hormon ecdyson. Kegagalan pupa untuk melakukan eklosi dikarenakan menurunnya kandungan hormon
ecdyson dalam tubuh pupa setelah terpapar dengan metopren selama beberapa hari (CEQGs 2007).
Penggunaan Metopren dalam Pengendalian Vektor
Metopren banyak digunakan untuk program pengendalian nyamuk, pinjal, semut, dan serangga hama gudang. Metopren sangat cocok diaplikasikan pada awal musim atau pada saat populasi masih sedikit untuk mencegah meningkatnya populasi serangga. Metopren diaplikasikan secara admixture pada pengendalian hama gudang yaitu dicampur dengan biji-bijian, misalnya pada gandum sedangkan untuk pengendalian nyamuk diaplikasikan pada perairan atau penampungan air di sekitar rumah (Wirawan 2006). Penggunaan zat aktif metopren sebagai insektisida diformulasikan dalam bentuk cairan, pellet,
briquette, dan granul. Metopren yang berbentuk granul berisi zat arang (charcoal)
yang melindungi zat aktif dari sinar matahari agar tetap efektif pada serangga yang resisten terhadap organofospat, karbamat, dan piretroid, serta efektif pada air dengan tingkat polusi tinggi seperti septic tank. Bentuk briquette pula dibungkus dengan kain berpori atau jaring yang diikat pada tiang kemudian dimasukkan ke dalam air yang diketahui sebagai tempat potensial nyamuk (Wellmark 2005).
Namun penelitian yang dilakukan oleh Miccuci (2004) menunjukkan metopren dalam bentuk formulasi pellet dan granul efektif mengurangi pemunculan nyamuk vektor West Nile Virus di Ontario sebesar 86% selama 30 hari. Efektifitas metopren dipengaruhi oleh spesies nyamuk, kondisi cuaca, kualitas dan kuantitas air, formulasi produk dan konsentrasi yang digunakan. Namun kebanyakan kasus kegagalan metopren untuk menghambat pemunculan nyamuk dewasa disebabkan oleh aplikasi metopren yang tidak lengkap atau terjadi perubahan kuantitas air dan udara (Micucci 2004). Sementara itu, Silva dan Mendes (2007) melaporkan metopren efektif untuk mengendalikan nyamuk vektor dengue (Ae. aegypti) di Uberlandia (Brazil) dengan LC50 dan LC95 masing-masing sebesar 19.95 dan 72.08 ppb.
Resistensi metopren sangat rendah karena mekanisme kerja metopren yang menyerupai hormon juvenile alami dan bekerja dalam siklus hidup pradewasa nyamuk sehingga metopren terus menerus digunakan sebagai insektisida dalam pengendalian nyamuk (Shinta et al. 2011). Namun berbeda dengan penelitian yang dilakukan oleh Cornel et al. (2002) menunjukkan bahwa telah terjadi perkembangan resistensi metopren di lapangan terhadap nyamuk Ochlerotatus nigromaculis setelah 20 tahun metopren diaplikasi di California. Hal ini memperlihatkan bahwa suatu populasi nyamuk dapat mengembangkan resistensi setelah paparan metopren yang berulang.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Entomologi Kesehatan, Bagian Parasitologi dan Entomologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, dan Unit Kajian Pengendalian Hama Permukiman, Fakultas Kedokteran Hewan, Institut Pertanian Bogor pada bulan Juli 2014 sampai dengan bulan Oktober 2014.
Metode Penelitian
Pemeliharaan Nyamuk dan Penyediaan Larva Uji
Telur nyamuk Ae. aegypti dari satu indukan nyamuk dipindahkan dari
ovitrap untuk ditetaskan ke dalam tray pemeliharaan yang terpisah berukuran 20x15x10 cm3 yang berisi satu liter air. Telur yang telah menetas menjadi larva diberi makan tepung hati ayam ditambah cat food (1:1) yang telah dihaluskan. Air di dalam nampan tersebut diganti setiap dua hari sekali sampai menjadi larva instar IV. Pupa dikumpulkan dalam wadah (cup) yang kemudian dimasukkan ke dalam kandang hingga menjadi dewasa. Selanjutnya nyamuk jantan dan betina melakukan perkawinan dan nyamuk betina diberi makan darah marmot lalu dibiarkan bertelur. Pengujian insektsida dilakukan pada larva generasi F1 instar ke III.
Aplikasi Insektisida
Aplikasi insektisida dilakukan dengan lima tingkatan konsentrasi yaitu 0.0108 g/L, 0.0217 g/L, 0.0325 g/L, 0.0433 g/L, dan 0.0541 g/L, serta kontrol. Insektisida yang telah ditimbang ditaburkan ke dalam tray yang berisi air sebanyak satu liter dan didiamkan selama 24 jam. Sebanyak 50 ekor larva dimasukkan ke dalam tray tersebut dan diberi pakan secukupnya. Sedangkan pada
tray kontrol tidak ditaburkan insektisida. Pengujian dilakukan di dalam ruangan berukuran 4x4x3 m3. Pengujian dilakukan dengan 5 kali ulangan, di mana setiap ulangan terdiri dari satu tray berisi 50 ekor larva Ae. aegypti. Pengujian juga dilanjutkan pada 720 jam setelah aplikasi insektisida menggunakan larva Ae. aegypti instar ke III yang baru dengan jumlah larva, waktu pengamatan, konsentrasi, dan jumlah pengulangan yang sama.
Pengamatan Kematian Larva/Pupa
Banyaknya larva/pupa nyamuk Ae. aegypti yang mati pada setiap pengujian dihitung pada jam ke-1, 2, 3, 4, 5, 6, 24, 48, 72, 96, dan 120 jam setelah perlakuan. Pengamatan larva nyamuk Ae. aegypti dilakukan sampai terjadi eklosi yaitu keluarnya nyamuk dewasa dari pupa.
Pengamatan Morfologi larva/Pupa
Larva/pupa yang mengalami kematian diamati secara mikroskopis dengan menggunakan mikroskop stereo, selanjutnya gambar diambil dengan menggunakan kamera optilab®.
Pengolahan Data
Koreksi Angka Kematian
Apabila angka kematian pada kelompok kontrol diantara 5-15%, maka angka kematian pada kelompok perlakuan dikoreksi menurut rumus Abbot, yaitu :
(A - C)
AI = x 100%
(100 - C)
Keterangan :
AI = Angka kematian setelah dikoreksi A = Angka kematian pada perlakuan
C = Angka kematian pada kontrol
Analisis Data
HASIL DAN PEMBAHASAN
Mortalitas Larva/Pupa Ae. aegypti terhadap Metopren yang dilarutkan selama 24 Jam
Metopren ditaburkan ke dalam tray yang berisi air sebanyak satu liter pada setiap tingkatan konsentrasi yaitu 0.0108 g/L, 0.0217 g/L, 0.0325 g/L, 0.0433 g/L, dan 0.0541 g/L. Insektisida metopren dalam bentuk granul ini didiamkan selama 24 jam. Hasil pengamatan jam ke-1 hingga jam ke-24 tidak terjadi kematian larva pada semua tingkat konsentrasi. Hal ini dapat disebabkan oleh mekanisme kerja metopren yang bekerja mempengaruhi dan mengganggu perkembangan larva sehingga larva tidak mengalami kematian secara langsung.
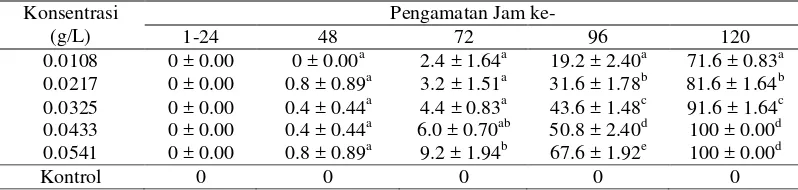
Tabel 1 Rata-rata persentase mortalitas larva/pupa Ae. aegypti setelah terpapar metopren pada larutan berumur 24 jam.
Konsentrasi
Keterangan: Huruf superskrip yang berbeda pada kolum yang sama menunjukkan uji berbeda nyata pada taraf 5% (p<0.05).
yang digunakan. Persentase kematian larva/pupa pengamatan jam ke-120 pada konsentrasi 0.0325 g/L menunjukkan kematian di atas 90%, sedangkan persentase kematian larva/pupa pada konsentrasi 0.0433 g/L dan 0.0541 g/L menunjukkan kematian sebesar 100% (Tabel 1). Hal ini sesuai dengan penelitian yang dilakukan oleh Septiana (2000) bahwa metopren efektif menghambat pertumbuhan larva nyamuk menjadi dewasa antara 90-100%. banyak terjadi pada stadium pupa dibanding stadium larva. Hasil analisis menggunakan probit didapatkan waktu yang diperlukan untuk membunuh 50% larva/pupa (LT50) dan 90% larva/pupa (LT90) yang paling lama terdapat pada konsentrasi 0.0108 g/L yaitu 110.299 jam dan 133.288 jam, sedangkan LT50 dan LT90 yang paling cepat terdapat pada konsentrasi 0.0541 g/L yaitu 89.125 jam dan 106.327 jam (Tabel 2). Hal ini menunjukkan bahwa semakin besar konsentrasi metopren maka semakin cepat pula waktu untuk larva/pupa mencapai kematian.
Mortalitas Larva/Pupa Ae.aegypti terhadap Metopren yang Dilarutkan selama 720 Jam (30 Hari)
Metopren yang didiamkan selama 720 jam (30 hari) bertujuan untuk mengukur sejauh mana tingkat efektivitas residu metopren. Pengujian ini dilakukan untuk mengetahui lama waktu aktivitas residu metopren terhadap larva/pupa Ae. aegypti.
Tabel 3 Rata-rata persentase mortalitas larva/pupa Ae. aegypti setelah terpapar metopren pada larutan berumur 720 jam (30 hari).
Konsentrasi
Keterangan: Huruf superskrip yang berbeda pada kolum yang sama menunjukkan uji berbeda nyata pada taraf 5% (p<0.05).
Rata-rata persentase kematian larva/pupa terendah terjadi pada konsentrasi 0.0108 g/L sebesar 44.8% (27.6 ekor), sedangkan rata-rata persentase kematian
larva/pupa tertinggi terjadi pada konsentrasi 0.0541 g/L sebesar 85.2% (42.6 ekor) (Tabel 3). Angka kematian larva/pupa pada residu metopren 720 jam menurun secara signifikan jika dibandingkan dengan metopren 24 jam. Hal ini menunjukkan bahwa terjadi penurunan efektifitas dari metopren setelah dilarutkan 720 jam karena kematian menurun dari 100% menjadi 85.2%. Menurut Jai et al. (2002) efektifitas dan aktivitas residu metopren menurun apabila metopren ini dilarutkan di dalam air dalam jangka waktu panjang karena penurunan aktivitas residu dari waktu ke waktu berkorelasi dengan berkurangnya konsentrasi dari metopren. Hasil analisis statistik pada Tabel 2 menunjukkan bahwa pada jam ke-48 dan ke-72 kematian larva/pupa tidak berbeda nyata pada semua tingkatan konsentrasi (P>0.05). Pengamatan pada jam ke-96 menunjukkan kematian larva/pupa berbeda nyata pada konsentrasi 0.0108 g/L dan 0.0217 g/L (P<0.05), sedangkan kematian larva/pupa tidak berbeda nyata antara konsentrasi 0.0325 g/L, 0.0433 g/L, dan 0.0541 g/L (P>0.05). Hal ini dapat disebabkan rata-rata kematian larva/pupa pada konsentrasi 0.0108 g/L dan 0.0217 g/L yang dilarutkan selama 720 jam sangat rendah jika dibandingkan dengan konsentrasi yang lebih tinggi.
Peningkatan kematian larva/pupa pada jam ke-120 berbeda nyata antara konsentrasi 0.0108 g/L, 0.0217 g/L, dan 0.0541 g/L (P<0.05) namun tidak berbeda nyata pada konsentrasi 0.0325 g/L dan 0.0433 g/L (P>0.05). Persentase kematian larva/pupa pengamatan jam ke-120 pada konsentrasi 0.0108 g/L, 0.0217 g/L, 0.0325 g/L, dan 0.0433 g/L berada di bawah 80%, sedangkan pada konsentrasi 0.0541 g/L persentase kematian adalah 85.2%. Hal ini menunjukkan bahwa metopren masih efektif untuk mematikan larva/pupa pada konsentrasi 0.0541 g/L. Menurut WHO (2005) larvasida dikatakan efektif jika kematian larva/pupa berada di atas 80%.
Tabel 4 Nilai LT50 dan LT90 metopren pada larutan berumur 720 jam (30 hari) terhadap larva/pupa Ae. aegypti.
Konsentrasi (g/L) LT50 LT90
Bentuk Kelainan Morfologi Stadium Pradewasa Nyamuk Ae. aegypti
yang Terpapar Metopren
Berbagai abnormalitas morfologi dari 50 larva/pupa Ae. aegypti yang diamati setelah terpapar metopren selama 120 jam disajikan pada Gambar 2.
Gambar 2 Bentuk-bentuk larva dan pupa Ae.aegypti normal, serta kelainan yang terjadi setelah terpapar metopren. A:Larva normal, B:Pupa normal, C:Kerusakan dan pembesaran tubuh larva, D:Kerusakan tubuh pupa, E:Kekakuan dan perubahan warna tubuh pupa, F:Kegagalan eklosi pupa.
(12%). Perkembangan larva yang normal ditunjukkan oleh Gambar 2A dan perkembangan pupa yang normal ditunjukkan oleh Gambar 2B. Kelainan yang terlihat pada larva yang terpapar metopren berupa pembesaran pada daerah toraks dan abdomen (Gambar 2C).
Pupa yang terpapar metopren menunjukkan kelainan berupa kerapuhan pada eksoskeleton dan pecahnya abdomen (Gambar 2D). Hal ini dikarenakan kerja metopren yang merangsang keluarnya hormone juvenile secara terus menerus sehingga hormon ini terus dipertahankan di dalam tubuh dan tidak seimbang dengan perkembangan eksoskeleton dari tubuh pupa. Menurut Shinta et al. (2011) kerapuhan pada eksoskeleton dan pecahnya abdomen pupa disebabkan oleh tekanan perkembangan dari dalam tubuh yang sangat besar sehingga abdomen pupa pecah akibat ketidakmampuan menahan tekanan yang terlalu besar tersebut. Kelainan lain yang terlihat pada pupa berupa kekakuan pada bagian abdomen sehingga pupa tidak dapat melingkar seperti pupa normal dan perubahan warna tubuh menjadi putih (Gambar 2E). Menurut Achmadi (2011) bagian kepala dan dada (cephalothorax) dari pupa normal lebih besar dibanding bagian perut serta
melingkar sehingga pupa terlihat seperti tanda baca ‘koma’. Ketika pertama kali
muncul pupa Ae. aegypti berwarna putih, akan tetapi dalam waktu yang singkat akan berubah menjadi coklat gelap akibat adanya pigmen melanin. Perubahan warna menjadi putih setelah terpapar metopren diduga oleh hilangnya pigmen melanin. Menurut Braga et al. (2005) perubahan warna tubuh menjadi putih disebabkan oleh hilangnya pigmen melanin pada tubuh pupa. Pupa juga mengalami kelainan berupa kegagalan untuk melakukan eklosi yang dicirikan dengan gagalnya pupa keluar dari kulitnya (Gambar 2F). Kegagalan pupa untuk melakukan eklosi dikarenakan menurunnya kandungan hormon ecdyson dalam tubuh pupa setelah terpapar dengan metopren selama beberapa hari.
Menurut Shinta et al. (2011) apabila pupa yang terpapar metopren kemudian berkembang menjadi nyamuk dewasa maka nyamuk tersebut akan menjadi nyamuk dewasa yang berkurang kemampuan reproduksinya termasuk kehilangan kemampuan untuk mengisap darah, pematangan telur yang tidak sempurna, dan dikeluarkannya telur yang steril. Pemunculan nyamuk dewasa abnormal juga terjadi karena memiliki tarsus yang bengkok, ujung tarsus dan abdomen melekat pada kulit pupa, bentuk sayap tidak sempurna, sayap yang melengket pada bekas kulit pupa, sehingga akibat kecacatan ini nyamuk tidak bisa terbang dan akhirnya mati.
Pada perkembangan normal, hormon yang bekerja pada saat larva adalah hormon juvenile yang berfungsi untuk memerintahkan serangga untuk terus berada pada stadium larva sedangkan hormon yang bekerja pada saat pupa adalah hormon ecdyson yang berfungsi dalam proses eklosi pupa untuk menjadi nyamuk dewasa. Kerja metopren menyebabkan hormon juvenile dipertahankan di dalam tubuh sehingga larva tidak dapat tumbuh menjadi pupa. Namun larva tetap tumbuh menjadi pupa dikarenakan oleh rendahnya konsentrasi metopren yang mempengaruhi larva tersebut. Pupa kemudian mengalami kematian atau gagal eklosi dikarenakan oleh metopren yang menghambat kerja hormon ecdyson. Saepudin (2014) melaporkan bahwa stadium pradewasa Cx. quinquefasciatus
(12%), kekakuan dan peregangan pada tubuh pupa (76%), serta kegagalan eklosi pada pupa (10%).
Kematian larva/pupa pada penelitian ini dipengaruhi oleh beberapa faktor yaitu insektisida yang digunakan, fisiologis dari larva/pupa, faktor lingkungan, dan faktor kecepatan aktivasi bahan aktif metopren dari formulasinya yaitu granul. Berdasarkan hal-hal yang telah dibahas di atas metopren dapat digunakan sebagai larvasida untuk diaplikasikan di lapangan. Hal tersebut dikarenakan metopren bekerja secara tepat sasaran dan tidak bersifat toksik terhadap mamalia maupun invertebrata lainnya (Silva dan Mendes 2007), sehingga metopren aman digunakan untuk pengendalian stadium pradewasa nyamuk Ae. aegypti.
SIMPULAN DAN SARAN
Simpulan
Angka kematian larva Ae. aegypti terhadap larutan metopren berumur 24 jam terbukti efektif karena menyebabkan kematian di atas 80% dengan konsentrasi 0.0217 g/L, 0.0325 g/L, 0.0433 g/L, dan 0.0541 g/L. Larutan metopren berumur 720 jam pada konsentrasi 0.0541 g/L terbukti masih efektif karena angka kematian larva Ae. aegypti di atas 80%. Stadium pradewasa Ae. aegypti yang terpapar metopren mengalami kelainan morfologi berupa kerusakan tubuh larva sebanyak (2%), kerusakan abdomen pupa (8%), kekakuan pada tubuh pupa (78%), dan kegagalan eklosi pada pupa (12%).
Saran
Perlu dilakukannya pengujian insektisida metopren di lapangan terhadap larva nyamuk Ae. aegypti. Hasil di lapangan pasti akan berbeda dengan hasil pengujian di laboratorium karena banyak faktor yang dapat mempengaruhi keefektifan insektisida metopren.
DAFTAR PUSTAKA
Achmadi. 2011. Dasar-dasar Penyakit Berbasis Wilayah. Jakarta (ID): Rajawali Pres.
Bahri S. 2010. Efektivitas s-methoprene dan bacillus thuringiensis. [Skripsi]. Medan (ID): Universitas Sumatera Utara.
Braga IA, Mello CB, Peixoto AA, Valle D. 2005. Evaluation of methoprene effect on Aedes aegypti (Diptera: Culicidae) development in laboratory conditions.
[CEQGs] Canadian Environmental Quality Guidelines. 2007. Methoprene. Canadian water quality guidelines for the protection of aquatic life. Canadian Council of Minister of the Environment.
Cornel AJ, Stanich MA, McAbee RD, Mulligan FS. 2002. High level methoprene resistance in the mosquito Ochlerotatus nigromaculis (Ludlow) in central California. Pest Manag Sci. 58:791-798.
[DEPKES] Departemen Kesehatan. 2005. Kajian Masalah Kesehatan Demam Berdarah Dengue. Jakarta (ID): Badan Litbang dan Pengembangan Kesehatan.
Hadi UK, Koesharto FX. 2006. Nyamuk dalam Hama Pemukiman Indonesia: Pengenalan, Identifikasi, Pengendalian. Sigit HS, Hadi UK, editor. Bogor (ID): Unit Kajian Pengendalian Hama Pemukiman.
Henrick CA, Ko J, Nguyen J, Burleson J, Lindahl G, D. Gundy GD, Edge JM. 2002. Investigation of the relationship between s-methoprene and deformities in anurans. J. Amer. Mosq. Control Assoc. 18(3):214-221.
Herms W. 2006. Medical Entomology. United States of America (US): The Macmillan Company.
Jai KN, Arshad A, Morteza Z. 2002. Effectiveness and residual activity comparison of granular formulations of insect growth regulators pyriproxyfen and s-methoprene against Florida mosquitoes in laboratory and outdoor conditions. American Mosquito Control Association 18(3): 196-201. Kamita SG, Hammock BD. 2010. Juvenile hormone esterase: biochemistry and
structure. J Pestic Sci. 35(3):265-274.
Lila KH. 2009. Gambaran epidemiologi demam berdarah dengue [skripsi]. Jakarta (ID): Universitas Indonesia.
Lim SP, Lee CY. 2005. Effect of juvenile hormone analogs on new reproductive and colony growth of pharaoh ant (Hymenopthera: Formicidae). Malaysia (MY): Entomological Society of America.
Margo U, Sayono, Haryanto. 2007. Efikasi berbagai dosis methoprene sebagai insect growth regulator terhadap pertumbuhan larva Ae. aegypti. Bul. Penelit. Kesehat. 4(2): 61-66.
Metcalf RL. 1982. Insecticide in Pest management Introduction to Insect Pest Management. New York (US): Jhon Willen and Sons.
Micucci S. 2004. Effectiveness of methoprene for controlling mosquito populations in Ontario that can carry west nile virus. Public Health and Community Services Department. Canada: City of Hamilton. Effective Public Health Practice Project.
Minakuchi C, Riddiford LM. 2006. Insect juvenile hormone action as a potential target of pest management. J Pestic Sci.31(2):77-84.
Natadisastra D, Agoes R. 2009. Parasitologi Kedokteran Ditinjau dari Organ Tubuh yang Diserang. Jakarta (ID): EGC. hlm. 315-318.
Saepudin I. 2014. Efektivitas Metopren dan Kelainan Morfologi pada Larva Culex quinquefasciatus. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sembel DT. 2009. Entomologi Kedokteran. Yogyakarta (ID): Penerbit ANDI. Septiana W. 2000. Uji efektivitas insect growth regulator Altosid 1.3 G terhadap
Silva JJ, Mendes J. 2007. Susceptibility of Aedes aegypti (L) to the insect growth regulators diflubenzuron and methoprene in Uberlandia, State of Minas Gerais. Revta. Soc. Bras. Med. Trop. 40(6): 612-616.
Shinta, Ariati Y, Wigati, Sukowati S. 2011. Efektivitas larvasida Altosid 1.3 G terhadap Aedes aegypti di laboratorium. Bul. Penelit. Kesehat. 39(3): 110-118.
Soegijanto S. 2006. Demam Berdarah Dengue Edisi 2. Surabaya (ID): Airlangga University Pr.
Tunaz H, Uygun N. 2004. Insect growth regulators for insect pest control. Turk J Agric. 28: 377-387.
[UF] University of Florida. 2009. Adult female yellow fever mosquito, Aedes aegypti (Linnaeus). http//www.ufl.edu [30 Oktober 2014].
Wanamaker BP, Massey LK. 2009. Applied Pharmacology for Veterinary Technicians. Missouri (US): Elseivier. pp. 273-274.
Wellmark International. 2005. Altosid briquets; A sustained release mosquito growth regulator to prevent adult mosquito emergence specimen label. Shaumburg Illionos USA.
Widoyono. 2005. Penyakit Tropis (Epidemiologi, Penularan, Pencegahan, dan Pemberantasannya). Jakarta (ID): Erlangga.
Wirawan IA. 2006. Insektisida Permukiman dalam Hama Pemukiman Indonesia: Pengenalan, Identifikasi, Pengendalian. Sigit HS, Hadi UK, editor. Bogor (ID): Unit Kajian Pengendalian Hama Pemukiman.
[WHO] World Health Organization. 2005. Guidelines for Laboratory and Field Testing of Mosquito Larvacides. Jenewa (SZ): World Health Organization. Yotopranoto S, Subekti S, Rosmanida, Salamun. 1998. Analisis dinamika
RIWAYAT HIDUP
Nora Saidul Fatimah Binti Yassin dilahirkan di Beaufort, Sabah, Malaysia pada tanggal 27 Mei 1991 dari pasangan Yassin Nasah dan Maimunah Binti Hj. Lamri. Penulis merupakan anak pertama dari enam bersaudara.
Penulis menyelesaikan pendidikan awal (TK) dan sekolah dasar (SD) di Sekolah Kebangsaan Mempagar, Beaufort sampai tahun 2003. Kemudian melanjutkan pendidikan di Sekolah Menengah Kebangsaan Beaufort, Sabah sehingga tahun 2008. Pada tahun 2010 penulis diterima sebagai mahasiswa Fakultas Kedokteran Hewan, Institut Pertanian Bogor.