TERUMBU KARANG UNTUK PENGENDALIAN
VIBRIOSIS PADA LARVA UDANG WINDU
(Penaeus monodon)
ADE DWI SASANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
i
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Penapisan Bakteri Probiotik Asal Terumbu Karang Untuk Pengendalian Vibriosis Pada Larva Udang Windu (Penaeus monodon) adalah benar hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2008
ii
Pengendalian Vibriosis pada Larva Udang Windu (Penaeus monodon). Dibimbing oleh WIDANARNI dan SUKENDA.
Vibrio patogen, khususnya Vibrio harveyi berpendar, dapat menyebabkan kematian massal pada budidaya udang windu. Salah satu alternatif untuk menghambat Vibrio harveyi berpendar adalah dengan menggunakan bakteri probiotik yang dapat menekan pertumbuhan Vibrio tersebut. Penelitian ini bertujuan untuk mendapatkan isolat bakteri dari terumbu karang yang potensial menghambat pertumbuhan V. harveyi. Total 110 isolat diisolasi dari Acropora sp, Merulina sp., Hystrix sp., Poecillophora sp., Porites sp. dan Haliophora sp., dan dilakukan penapisan untuk melihat aktivitas kemampuannya melawan V. harveyi MR 5339 RfR dalam uji in vitro dan uji in vivo. Dua isolat (13G1, 13B) diisolasi dari Poecillophora sp. dan dua isolat lainnya (8A, 1C) diisolasi dari Acropora sp., memiliki aktivitas probiotik melawan V. harveyi MR 5339 RfR pada uji in vitro dan in vivo. Isolat 13G1 merupakan isolat yang paling efektif menghambat pertumbuhan V. harveyi MR 5339 RfR dan secara signifikan mengurangi kematian larva pada uji in vivo. Sekuensing sebagian gen 16S-rRNA isolat 13G1 menunjukkan bahwa 13G1 memiliki kemiripan dengan V. alginolyticus.
iii ABSTRACT
ADE DWI SASANTI. Screening of Probiotic Bacteria from Coral Reef for Controlling Vibriosis in Tiger Shrimp Penaeus monodon. Under the direction of WIDANARNI and SUKENDA.
Pathogenic species of Vibrio genus, especially luminous Vibrio harveyi, could cause mass mortality in tiger shrimp culture. One of the technique to work against luminous Vibrioharveyi is, using probiotic bacteria to inhibit the luminous Vibrio growth. This study was carried out to obtain bacteria isolates from coral reef which potentially inhibit V. harveyi MR 5339 RfR growth. A total of 110 isolates were isolated from Acropora sp., Merulina sp., Hystrix sp., Poecillophora sp., Porites sp. and Haliophora sp., and were screened for their antagonistic activity against V. harveyi MR 5339 RfRin in vitro and in vivo test. Two isolates (13G1, 13B) isolated from Poecillophora sp. and two other isolates (8A, 1C) isolated from Acropora sp., have probiotic activity against V. harveyi MR 5339 RfR in in vitro and in vivo test. 13G1 isolate was the most effective isolate in inhibiting growth of V. harveyi MR 5339 RfR and significantly reduced larval mortality in in vivo test. Partial sequencing of 16S-rRNA gen of 13G1 isolate showed that 13G1 similarity to V. alginolyticus.
iv
VIBRIOSIS PADA LARVA UDANG WINDU
(
Penaeus monodon
)
ADE DWI SASANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Perairan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
v
Judul Tesis : Penapisan Bakteri Probiotik asal Terumbu Karang untuk Pengendalian Vibriosis pada Larva Udang Windu (Penaeus monodon)
Nama : Ade Dwi Sasanti NIM : C151050041
Disetujui
Komisi Pembimbing
Dr. Widanarni Dr. Sukenda Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Perairan
Prof. Dr. Enang Harris,M.S. Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
vi
Puji dan syukur penulis panjatkan kepada Alloh SWT atas segala
karuniaNya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih
dalam penelitian yang dilaksanakan sejak Agustus 2006 ini adalah probiotik
dengan judul Penapisan Bakteri Probiotik asal Terumbu Karang untuk
Pengendalian Vibriosis pada Larva Udang Windu (Penaeus monodon).
Sebagian dari penelitian ini didanai melalui Proyek Hibah Bersaing Tahun
2007 atas nama Dr. Widanarni dengan judul Bakteri Probiotik dalam Budidaya
Udang : Seleksi, Mekanisme Aksi, Karakterisasi dan Aplikasinya sebagai Agen
Biokontrol.
Ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada Ibu
Dr. Widanarni dan Bapak Dr. Sukenda selaku pembimbing, Bapak Dr. Chairul
Muluk dan Bapak Dr. Murjani yang telah banyak memberikan masukan dan
referensi, Staff di Laboratorium Kesehatan Ikan, Laboratorium Genetika dan
Pengembangbiakan Ikan serta Laboratorium Lingkungan yang telah membantu
selama proses penelitian. Ungkapan terima kasih juga disampaikan kepada suami,
ananda Adzkia, ayah, ibu dan seluruh keluarga atas doa, dukungan dan kasih
sayangnya serta rekan-rekan mahasiswa AIR 2005 dan adik-adik mahasiswa BDP
39, 40 atas kerja samanya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2008
vii
RIWAYAT HIDUP
Penulis dilahirkan di Serang pada tanggal 30 Desember 1976, merupakan
anak ke dua dari ayah H. Abu Sairi, dan ibu Enung Hayati. Penulis merupakan
putri kedua dari dua bersaudara.
Tahun 1995 penulis lulus dari SMA Negeri 1 Serang dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis
memilih Program Studi Budidaya Perairan, Jurusan Budidaya Perairan, Fakultas
Perikanan dan Ilmu Kelautan. Tahun 2000 penulis berhasil menyelesaikan studi
S-1 dan mendapatlan gelar Sarjana Perikanan (S.Pi). Mulai tahun 2001 hingga
kini penulis bekerja sebagai staf dosen di Program Studi Budidaya Perairan,
Fakultas Pertanian, Universitas Sriwijaya. Kesempatan untuk melanjutkan studi
ke Program Magister diperoleh pada tahun 2005 dengan beasiswa dari Dirjen
viii
Manfaat Penelitian ... 2
TINJAUAN PUSTAKA ... 3
Vibrio harveyi dan Vibriosis pada Udang ... 3
Udang Windu Penaeus monodon ... 4
Probiotik Akuakultur ... 5
Mekanisme Kerja dan Seleksi Bakteri Probiotik ... 5
Resistensi Antibiotik ... 9
Identifikasi Bakteri dengan Teknik Molekuler ... 9
Terumbu Karang ... 10
BAHAN DAN METODE ... 12
Waktu dan Tempat ... 12
Media, Antibiotik dan Bahan Kimia ... 12
Isolasi Bakteri Probiotik dari Terumbu Karang ... 12
Uji in vitro Bakteri Kandidat Probiotik ... 13
Uji Patogenisitas Bakteri Kandidat Probiotik ... 13
Pembuatan Mutan Bakteri Kandidat Probiotik ... 14
Uji in vivo Bakteri Kandidat Probiotik ... 14
Identifikasi Bakteri Probiotik Terpilih ... 15
Rancangan Penelitian dan Teknik Analisa ... 17
Parameter yang Diamati ... 17
HASIL DAN PEMBAHASAN ... 19
Isolasi Bakteri Kandidat Probiotik ... 19
Uji in vitro Bakteri Kandidat Probiotik ... 20
Uji Patogenisitas Bakteri Kandidat Probiotik ... 26
Ciri Fisik Isolat Terpilih ... 27
Mutan Resisten Rifampisin ... 28
Uji in vivo Bakteri Kandidat Probiotik ... 29
Identifikasi Bakteri Terpilih ... 46
KESIMPULAN DAN SARAN ... 47
Kesimpulan ... 47
Saran ... 47
DAFTAR PUSTAKA ... 48
ix
DAFTAR TABEL
No. Teks Halaman
x
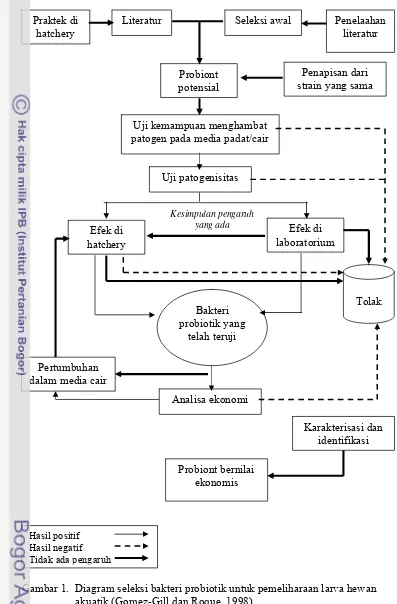
1. Diagram seleksi bakteri probiotik untuk pemeliharaan larva hewan akuatik (Gomez-Gill dan Roque, 1998) ... 8
2. Terumbu karang yang diisolasi bakterinya ... 19
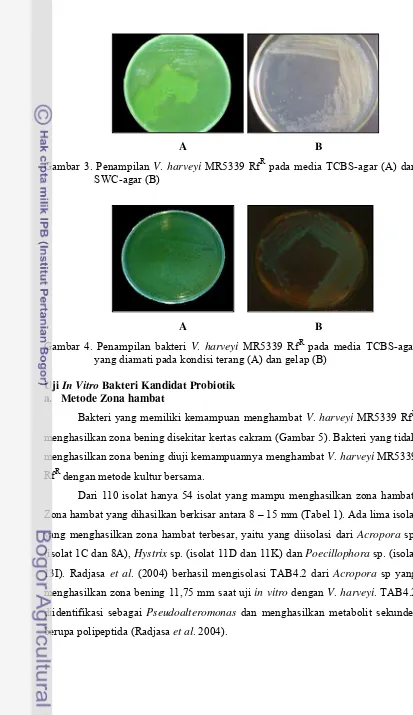
3. Penampilan V. harveyi MR5339 RfR pada media TCBS-agar (A) dan SWC-agar (B) ……… 20
4. Penampilan V. harveyi MR5339 RfR pada media TCBS-agar yang diamati pada kondisi terang (A) dan gelap (B) ... 20
5. Zona hambat yang dihasilkan bakteri kandidat probiotik terhadap V. harveyi MR5339 RfR ... 21
6. Penghambatan V. harveyi MR5339 RfR oleh bakteri kandidat probiotik pada media SWC-agar + rifampisin 50 µg/ml ... 24
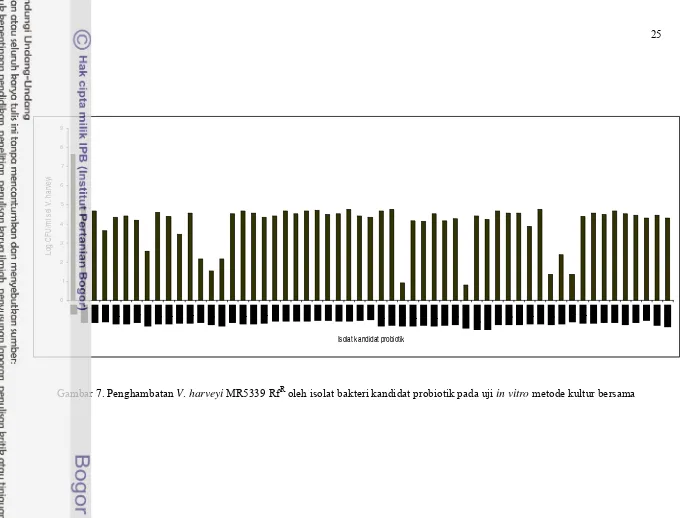
7. Penghambatan V. harveyi MR5339 RfR oleh bakteri kandidat probiotik pada uji in vitro metode kultur bersama ... 25
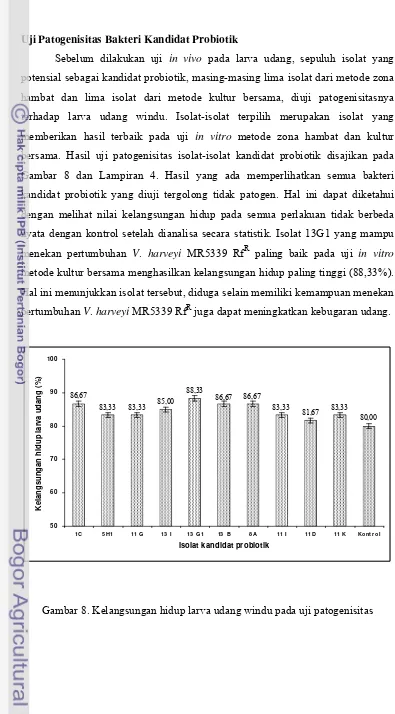
8. Kelangsungan hidup larva udang windu pada uji patogenisitas ... 26
9. Penampilan isolat 13G1 pada media SWC-agar (A) dan TCBS-agar (B) ... 27
10. Penampilan isolat 13B pada media SWC-agar (A) dan TCBS-agar (B)... 27
11. Penampilan isolat 8A pada media SWC-agar (A) dan TCBS-agar (B).. 28
12. Penampilan isolat 1C pada media SWC-agar (A) dan TCBS-agar (B).. 28
13. Perbandingan pertumbuhan bakteri kandidat probiotik resisten rifampisin dengan tipe liarnya ... 29
14. Kelangsungan hidup larva udang windu yang diberi bakteri kandidat probiotik tipe liar pada uji in vivo ... 31
15. Kelangsungan hidup larva udang windu yang diberi bakteri kandidat probiotik tipe mutan pada uji in vivo ... 31
xi
17. Populasi total bakteri, jumlah bakteri probiotik dan V. harveyi MR5339 RfR pada air media pemeliharaan larva udang windu yang diberi bakteri kandidat probiotik tipe mutan ... 34
18. Populasi total bakteri, jumlah sel Vibrio sp dan V. harveyi MR5339 RfR pada larva hidup yang diberi bakteri kandidat probiotik tipe liar...
36
19. Populasi total bakteri, jumlah bakteri probiotik dan V. harveyi MR5339 RfR pada larva hidup yang diberi bakteri kandidat probiotik tipe mutan ...
38
20. Populasi total bakteri, jumlah sel Vibrio sp dan V. harveyi MR5339 RfR pada larva mati yang diberi bakteri kandidat probiotik tipe liar...
40
21. Populasi total bakteri, jumlah bakteri probiotik dan V. harveyi MR5339 RfR pada larva mati yang diberi bakteri kandidat probiotik tipe mutan ...
41
22. Pertumbuhan panjang larva udang windu yang diberi bakteri kandidat probiotik tipe liar ... 44
23. Pertumbuhan panjang larva udang windu yang diberi bakteri kandidat probiotik tipe mutan ... 44
24. Pertumbuhan bobot larva udang windu yang diberi bakteri kandidat probiotik tipe liar ... 45
25. Pertumbuhan bobot larva udang windu yang diberi bakteri kandidat probiotik tipe mutan... 45
26. DNA hasil PCR yang akan dipotong (A) dan (B) agarose gel yang sudah dipotong ... 55
xii
(Thiosulphate Citrate Bile sucrose)-agar ... 54
2. Proses gene clean ... 55
3. Asal dan kode isolat bakteri kandidat probiotik yang digunakan dalam penelitian ini ... 56
4. Kelangsungan hidup larva udang windu pada uji patogenisitas... 57
5. Kelangsungan hidup larva udang windu pada uji in vivo bakteri kandidat probiotik tipe liar ... 58
6. Kelangsungan hidup larva udang windu pada uji in vivo bakteri kandidat probiotik tipe mutan ... 59
7. Populasi V. harveyi MR5339 RfR dan bakteri kandidat probiotik pada air media pemeliharaan ... 60
8. Populasi V. harveyi MR5339 RfR dan bakteri kandidat probiotik pada larva hidup ... 61
9. Populasi V. harveyi MR5339 RfR dan bakteri kandidat probiotik pada larva mati ... 62
10. Populasi total bakteri pada air media pemeliharaan ... 63
11. Populasi total bakteri pada larva hidup ... 64
12. Populasi total bakteri pada larva mati ... 65
13. Pertumbuhan panjang larva udang windu yang diberi bakteri kandidat probiotik tipe liar ... 66 14. Pertumbuhan panjang larva udang windu yang diberi bakteri kandidat probiotik tipe mutan ... 67 15. Pertumbuhan bobot larva udang windu yang diberi bakteri kandidat probiotik tipe liar ... 68 16. Pertumbuhan bobot larva udang windu yang diberi bakteri kandidat probiotik tipe mutan ... 69 17. Hasil elektropherogram 63f dari gen 16S-rRNA isolat 13G1 ... 70
Latar Belakang
Vibriosis merupakan salah satu penyakit pada udang yang dapat
menyebabkan kematian massal (Karunasagar et al. 1994; Lightner 1996).
Vibriosis dapat menyerang udang pada berbagai stadia mulai dari nauplius, zoea,
mysis dan post larva di hatchery hingga udang dewasa di tambak pembesaran
(Goarant et al. 1998; Saulnier et al. 2000). Penyakit ini disebabkan oleh infeksi
bakteri Vibrio berpendar (luminescent Vibrio), yang diidentifikasi sebagai Vibrio
harveyi patogen (Abraham & Palaniappan, 2004).
V. harveyi dapat diisolasi dari udang sakit maupun sehat (Lavilla-Pitogo et
al. 1990; Vandenberghe et al. 2003), air laut sekitar lokasi budidaya udang
(Abraham & Palaniappan, 2004) dan sedimen (Vandenberghe et al. 2003).
Berdasarkan hal tersebut V. harveyi merupakan bakteri yang dapat hidup bebas
atau berasosiasi dengan organisme laut seperti ikan dan udang. Namun dalam
kondisi tertentu yaitu bila populasinya > 104 CFU/ml dapat bersifat patogen bagi
udang (Saulnier et al. 2000) sehingga menyebabkan vibriosis.
Salah satu alternatif pencegahan vibriosis adalah dengan menghambat
pertumbuhan V. harveyi patogen di tubuh udang. Gullian et al. (2004) menyatakan
bahwa populasi V. harveyi di udang dapat ditekan dengan cara mengintroduksikan
bakteri tertentu yang diisolasi dari hepatopankreas udang sehat. Populasi V.
harveyi patogen digantikan oleh populasi bakteri lain yang menguntungkan bagi
udang (Moriarty 1999). Dalam hal ini bakteri probiotik dapat mensubstitusi
keberadaan bakteri patogen melalui competitive exclusion (Fuller 1992;
Verschuere et al. 2000) atau dengan memproduksi senyawa antimikrob yang
dapat menghambat pertumbuhan bakteri lain (Vijayan et al. 2006; Lategan et al.
2006).
Bakteri yang digunakan sebagai probiotik dapat diisolasi dari air laut
(Chytanya et al. 2002), sedimen laut (Muliani 2002) atau invertebrata laut seperti
sponge (Suryati et al. 2004). Sumberdaya laut lainnya yang diduga menyimpan
potensi sebagai sumber bakteri probiotik adalah terumbu karang. Terumbu karang
2
tinggi dibandingkan air laut maupun sedimen laut (Rheinheimer 1991). Terumbu
karang juga merupakan habitat asli bagi beberapa jenis udang (Dahuri, 2003).
Dengan mengisolasi bakteri asal terumbu karang diharapkan dapat ditemukan
bakteri yang mampu menghambat kolonisasi dan pertumbuhan V. harveyi patogen
pada larva udang windu.
Tujuan
Penelitian ini bertujuan untuk :
1. Mendapatkan bakteri asal terumbu karang yang potensial menghambat
pertumbuhan V. harveyi patogen.
2. Mempelajari efektifitas isolat potensial asal terumbu karang dalam
menghambat pertumbuhan V. harveyi patogen pada larva udang windu.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai potensi
isolat asal terumbu karang dalam menghambat pertumbuhan V. harveyi patogen
Vibrio harveyi dan Vibriosis pada Udang
V. harveyi adalah bakteri gram negatif, berluminesen, dapat hidup bebas
atau berasosiasi dengan organisme laut seperti ikan dan udang (Aguirre-Guzman
et al. 2001). V. harveyi pada umumnya bersifat patogen oportunistik pada infeksi
sekunder atau dapat juga bersifat patogen sejati penyebab penyakit (Goarant et al.
1998; Saulnier et al. 2000). Pada sistem budidaya udang, V. harveyi sering
ditemukan di hatchery (Sung et al. 1999) dan dapat diisolasi dari air laut yang
masuk (Vandenberghe et al. 2003), induk, larva dan air tanki pembesaran larva
(Sung et al. 2001). V. harveyi juga dapat diisolasi dari tambak pembesaran udang
(Karunasagar et al. 1994; Alapide-Tendencia & Dureza, 1997). Karunasagar et al.
(1996) menyatakan bahwa, V. harveyi dapat bertahan di lingkungan hatchery
dengan membentuk semacam lapisan biofilm pada berbagai permukaan.
Larva udang yang terserang V. harveyi pada kondisi gelap tampak
berpendar, sedangkan udang yang dipelihara di tambak seperti ada cahaya jika
tambak ditiup angin. Udang yang terserang V. harveyi sering ditemukan berenang
di tepi pematang, dengan tanda-tanda kulit badan rusak dan berwarna gelap atau
merah, bagian ekor dan kaki renangnya berwarna merah, insang berwarna coklat,
otot atau dagingnya berwarna suram dan ususnya kosong, gerakannya lemah dan
menyentak-nyentak (Rukyani 1993; Jiravanichpaisal et al. 1994).
V. harveyi dapat menyebabkan vibriosis dikarenakan sifat
patogenisitasnya. Sifat patogenisitas ini berkaitan erat dengan fenomena
kemampuan berluminesensi yang dikontrol oleh suatu sistem quorum sensing.
Apabila quorum tercapai, maka V. harveyi dapat mengeluarkan faktor-faktor
virulensinya (Karunasagar et al. 1994). V. harveyi mengeluarkan suatu senyawa
ke dalam medium selama masa pertumbuhan, senyawa ini berfungsi sebagai
autoinduser yang akan menginduksi terjadinya luminescens (Manefield et al.
2000).
Berdasarkan Pizutto & Hirst (1995), beberapa strain V. harveyi mampu
menghasilkan protein ekstraseluler yang dikenal sebagai toksin T1 dengan berat
4
menyatakan bahwa beberapa strain V. harveyi menghasilkan semacam protein
yang bersifat toksin yang dapat menyebabkan kematian pada tikus dan P.
monodon pada dosis 3.1 dan 2.2 µg/g bobot tubuh.
Ciri-ciri morfologi dan fisiologi V. harveyi pada medium Nutrien Agar
dengan NaCl 1,5% dan Seawater complete-agar (SWC-agar) adalah : bentuk
koloni bulat dengan elevasi cembung, berwarna krem, berdiameter 2-3 mm
setelah inkubasi 24 jam pada suhu 280C. Pada medium selektif untuk genus
Vibrio, yaitu TCBS-agar (Tiosulfate Citrate Bile Sucrose), koloni V. harveyi
berwarna hijau dan berpendar bila diamati di ruang gelap. Demikian pula halnya
koloni V. harveyi yang ditumbuhkan di medium Nutrien Agar dengan NaCl 1,5%
dan SWC-agar akan berpendar jika diamati di ruang gelap (Lavilla-Pitogo et al.
1990). V. harveyi berupa sel tunggal berbentuk batang pendek, motil, oksidase
positif, tidak membentuk gas dari fermentasi terhadap D-glukosa, tidak
memproduksi H2S dan memiliki flagela pada salah satu kutub selnya (Baumann et
al. 1994).
Udang Windu Penaeus monodon
Morfologi udang windu dicirikan oleh warna karapas dan bagian tubuh
bergaris-garis tebal melintang berwarna coklat keabuan, kaki jalan (periopod) dan
kaki renang (pleiopod) berwarna coklat dan setae berwarna merah di bagian
pinggirnya. Tubuh udang terdiri dari cephalothorax (bagian kepala dan dada) dan
bagian abdomen (perut). Bagian cephalothorax diselaputi oleh kulit kitin yang
tebal atau karapas. Cephalothorax dan abdomen terdiri dari segmen-segmen atau
ruas-ruas yang umumnya berjumlah 20 buah (Martosoedarmo dan Ranoemihardjo
1980).
Selama masa stadia larva, udang windu mengalami beberapa kali
perubahan bentuk atau pergantian stadia. Dimulai dengan menetasnya telur
menjadi larva dan melalui stadia nauplius yang mempunyai 6 substadia, zoea dan
mysis masing-masing 3 substadia. Telur menetas setelah 10-12 jam, nauplius (2
hari), zoea (3-5 hari). Stadia mysis akan berkembang menjadi postlarva dan
seterusnya menjadi juvenil dan akhirnya tumbuh menjadi dewasa (Martosoedarmo
Probiotik Akuakultur
Berdasarkan Fuller (1992) probiotik adalah mikrob hidup yang
ditambahkan ke dalam pakan yang dapat memberikan pengaruh menguntungkan
bagi hewan inang dengan memperbaiki keseimbangan mikrob ususnya. Tetapi
bagi hewan-hewan akuatik selain saluran pencernaan, air di sekelilingnya juga
memegang peranan penting. Dengan demikian probiotik untuk hewan akuatik
adalah agen mikrob hidup yang memberikan pengaruh menguntungkan pada
inang dengan memodifikasi komunitas mikrob atau berasosiasi dengan inang,
menjamin perbaikan dalam penggunaan pakan atau memperbaiki nutrisinya,
memperbaiki respon inang terhadap penyakit atau memperbaiki kualitas
lingkungannya (Verschuere et al. 2000).
Penggunaan bakteri probiotik sebagai biokontrol terhadap V. harveyi telah
banyak dilakukan (Chythanya et al. 2002; Gullian et al. 2004; Vijayan et al.
2006). Bakteri yang digunakan sebagai biokontrol dapat diisolasi dari perairan
laut di sekitar tambak atau pembenihan udang (Haryanti et al. 2000; Chytanya et
al. 2002), lumpur dan air tambak (Rengpipat et al. 1998), air pemeliharaan larva
(Rosa et al. 1997; Li et al. 2006) dan dari larva udang sehat (Rengpipat et al.
2000; Widanarni et al. 2003). Menurut Verschuere et al. (2000) probiotik dapat
diaplikasikan di lapangan dengan cara : (1) ditambahkan pada pakan buatan; (2)
ditambahkan pada media kultur; (3) perendaman; (4) diberikan melalui pakan
hidup.
Mekanisme Kerja dan Seleksi Bakteri Probiotik
Berdasarkan Verschuere et al. (2000) mekanisme kerja probiotik dapat
dibagi menjadi beberapa cara yaitu : (1) produksi senyawa inhibitor seperti
siderophores, lysozymes, protease, antibiotik; (2) kompetisi terhadap senyawa
kimia atau sumber energi seperti besi atau nutrien yang diambil dari inang; (3)
kompetisi terhadap tempat pelekatan; (4) peningkatan respon imun (kekebalan);
(5) perbaikan kualitas air dan (6) interaksi dengan fitoplankton.
Vine et al. (2004) menyatakan bahwa probiotik yang bekerja di dalam
mukosa usus inang harus mampu bertahan hidup dan berkembangbiak dengan
cepat. Dengan demikian probiotik tersebut tidak terbawa keluar bersama sisa
6
menghambat pertumbuhan bakteri patogen, tetapi bila tidak dapat bertahan hidup
dalam mukosa usus kemungkinan besar probiotik yang menghambat pertumbuhan
patogen tidak ditemukan pada uji in vivo.
Chytanya et al. (2002) menunjukkan, Pseudomonas I-2 menghasilkan
senyawa penghambat berberat molekul rendah, stabil terhadap panas, terlarut
dalam klorofom dan resisten enzim proteolitik. Senyawa ini berhasil menghambat
pertumbuhan Vibrio patogen. Vine et al. (2004) melaporkan lima kandidat
probiotik (AP1 – AP5) yang diisolasi dari ikan badut Amphiprion percula
(Lacepede) berhasil melekat dan berkolonisasi pada mukus ikan. Sehingga dapat
mengurangi populasi bakteri patogen Aeromonas hydrophila dan Vibrio
alginolyticus. Gullian et al. (2004) berhasil mengisolasi tiga isolat potensial
probiotik (Vibrio P62, Vibrio P63 dan Bacillus P64) asal udang sehat yang
mampu berkolonisasi hingga 83% pada hepatopankreas udang uji.
Gullian et al. (2004), juga menyatakan bahwa bakteri probiotik yang
diisolasi dari hepatopankreas udang sehat mampu meningkatkan respon
immunitas udang. Hal yang sama juga dilaporkan oleh Rengpipat et al. (1998)
mengenai penggunaan Bacillus S11 pada udang windu (Penaeus monodon).
Udang yang mendapat perlakuan Bacilus S11 tingkat kelangsungan hidupnya
mencapai 100% saat diinfeksi denganVibrio harveyi sedangkan kontrol hanya 26
%. Hasil serupa juga ditunjukkan oleh Vaseeharan & Ramasamy (2003) yang
menyatakan bahwa larva udang windu yang diberi Bacilus subtilis BT23 tingkat
kelangsungan hidupnya mencapai 100% saat diinfeksi dengan V. harveyi
dibandingkan dengan kontrol positif yang hanya 50% tingkat kelangsungan
hidupnya. Bakteri probiotik juga dapat memperbaiki kualitas air. Berdasarkan Li
et al. (2006), bakteri Arthrobacter XE-7 memiliki efek antagonis terhadap V.
parahaemolyticus, V. anguillarum dan V. nereis. Arthrobacter XE-7 juga mampu
mengoksidasi ammonia menjadi nitrit.
Tahapan seleksi bakteri probiotik untuk kegiatan pemeliharaan larva
hewan akuatik mencakup beberapa tahap berikut : (1) pengumpulan informasi
dasar yang didapat dari studi pustaka maupun di lapangan; (2) pengumpulan
probiotik potensial meliputi kelangsungan hidup bakteri probiotik dan
potensial berkompetisi dengan galur patogen meliputi kemampuan hidup
probiotik pada inang atau lingkungannya, kemampuan melekat pada permukaan
tubuh inang, kemampuan membentuk koloni dan mencegah perkembangan bakteri
patogen baik dengan memproduksi senyawa inhibitor maupun berkompetisi
tempat perlekatan dan nutrien; (4) pendugaan patogenisitas probiotik potensial
yang meliputi probiotik tidak boleh patogen pada inang; (5) evaluasi pengaruh
probiotik potensial pada larva dengan hasil terbaik yang dilihat dari nilai
kelangsungan hidup tertinggi, penambahan bobot terbesar, peningkatan daya
tahan tubuh inang terhadap stress dan serangan patogen terendah; dan (6) analisis
ekonomi biaya laba (Gomez-Gill dan Roque, 1998). Diagram seleksi bakteri
probiotik disajikan pada Gambar 1.
Evaluasi kemampuan probiotik potensial berkompetisi dengan galur
patogen dapat dilakukan melalui tes antagonis secara in vitro. Uji in vitro dapat
berupa uji tantang antara bakteri kandidat probiotik dengan bakteri patogen dalam
media cair maupun padat. Pada media padat dapat berupa disk difussion method
untuk melihat kemampuan kandidat probiotik dalam menghasilkan senyawa
antibakterial. Zona bening yang dihasilkan menunjukkan bahwa bakteri tersebut
mampu mensekresikan suatu senyawa antimikrob (Chytanya et al. 2002).
Menurut Verschuere et al. (2000), uji in vitro pada media cair dapat dilakukan
dengan metode kultur bersama. Melalui metode ini dapat diuji kemampuan
kandidat probiotik bersaing dengan bakteri patogen dalam memanfaatkan nutrien
yang sama. Kompetisi terhadap bahan kimia atau sumber energi yang sama dapat
menunjukkan bagaimana populasi mikrob yang berbeda dapat hidup dalam relung
8
Gambar 1. Diagram seleksi bakteri probiotik untuk pemeliharaan larva hewan akuatik (Gomez-Gill dan Roque, 1998)
Praktek di hatchery
Literatur Seleksi awal Penelaahan
literatur
Probiont potensial
Penapisan dari strain yang sama
Uji kemampuan menghambat patogen pada media padat/cair
Uji patogenisitas
Efek di laboratorium
Pertumbuhan dalam media cair
Resistensi Antibiotik
Menurut Chytanya et al. (1999) beberapa organisme secara alami resisten
terhadap beberapa antibiotik. Hal ini disebabkan oleh beberapa faktor, antara lain
karena (1) organisme tersebut tidak memiliki dinding sel sehingga menjadi
resisten terhadap antibiotik yang bekerja dengan cara merusak dinding sel, (2)
organisme mungkin tidak permeabel terhadap beberapa jenis antibiotik, (3)
mikroorganisme mempunyai kemampuan untuk menginaktifkan
komponen-komponen dalam antibiotik, (4) mikroorganisme memiliki sistem metabolisme
yang dapat memblokir antibiotik tertentu sehingga resisten terhadap antibiotik
tersebut, (5) mikroorganisme memiliki kemampuan untuk memompa antibiotik
tertentu keluar dari dinding sel sehingga resisten terhadap antibiotik tersebut.
Penanda resisten terhadap antibiotik digunakan untuk membedakan antara
bakteri kandidat probiotik dengan bakteri alami yang telah ada pada tubuh udang.
Pada umumnya kelompok Vibrio bersifat sensitif terhadap antibiotik rifampisin
(Tendencia & de la Pena 2001). Dengan penanda molekuler tersebut, bakteri
kandidat probiotik dapat dibedakan dengan bakteri alami yang sebelumnya telah
ada pada tubuh udang, sehingga penghambatan V. harveyi dapat diamati.
Identifikasi Bakteri dengan Teknik Molekuler
Identifikasi bakteri dapat dilakukan menggunakan analisis fenotipik
dengan mempelajari sifat fisiologis atau biokimianya (Hadioetomo 1993) maupun
analisis genotipik secara molekuler. Seringkali hasil uji biokimia atau fisiologi
tersebut berbeda karena perbedaan ekspresi gen. Untuk karakterisasi galur-galur
dalam satu spesies perlu dilihat sifat yang paling mendasar dan relatif stabil yaitu
dengan analisis genotipik (Singleton, 1995).
Sudeesh et al. (2002) menggunakan 16S-rRNA sebagai gen target untuk
menganalisa keragaman genom di antara V. parahaemolyticus dan V. alginolyticus
yang diisolasi dari tambak udang, sedangkan Schulze et al. (2006) menggunakan
16S-rRNA untuk identifikasi keragaman bakteri di lingkungan hatchery.
Digunakannya 16S-rRNA sebagai gen target karena (1) bersifat universal : protein
synthesis machinery; (2) sekuen basa-basanya bersifat konservatif; (3) jumlahnya
melimpah dalam sel; (4) memenuhi ukuran untuk perhitungan secara statistika
10
bank/database di GenBank) (Madigan et al. 1997). Proses amplifikasi 16S-rRNA
dapat dilakukan melalui teknik PCR.
Teknik PCR (Polymerase Chain Reaction) adalah suatu teknik biologi
molekuler untuk memperbanyak sekuen DNA tertentu (lebih dari 100 juta kopian)
dalam waktu hanya beberapa jam, oleh karena itu teknik ini disebut pula
amplifikasi DNA. Dengan PCR, molekul DNA dapat diperbanyak sampai jutaan
kopi dalam tabung reaksi. Teknik ini terdiri dari beberapa siklus yang setiap
siklusnya terdiri atas 3 tahap yaitu tahap denaturasi, pelekatan primer (primer
anealling) dan pemanjangan (elongasi) (Griffin and Griffin, 1993).
Berdasarkan Marchesi et al. (1998) tersedia beberapa primer yang dapat
digunakan untuk mengamplifikasi gen 16S-rRNA. Diantaranya adalah 27f dan
149r. Namun kedua primer tersebut belum dapat mengamplifikasi sampel bakteri
yang berasal dari beragam sumber seperti sedimen laut dalam, bakteri rongga
mulut, dan bakteri yang diisolasi deri epilithon (bakteri yang berasosiasi dengan
batu pada habitat air mengalir). Selain itu ada pula primer 63f dan 1387r yang
telah diuji coba berhasil mengamplifikasi gen 16S-rRNA dari berbagai sumber
diantaranya sedimen laut dalam.
Terumbu Karang
Ekosistem terumbu karang atau coral reefs adalah suatu sistem habitat
kehidupan biota laut yang hangat, jernih, tidak dalam dan kaya dengan
keanekaragaman hayati. Daerah habitat karang memiliki produktivitas dan
keanekaragaman jenis fauna yang tinggi. Ekosistem terumbu karang juga
merupakan tempat hidup, mencari makan (feeding ground), daerah asuhan
(nursery ground), pelindung (shelter) dan tempat memijah (spawning ground)
untuk berbagai organisme laut (Murdiyanto, 2003). Terumbu karang juga
merupakan habitat asli bagi beberapa jenis udang dan ikan (Dahuri, 2003).
Organisme yang hidup di terumbu karang tidak hanya makroorganisme,
tetapi juga mikroorganisme. Terumbu karang merupakan suatu ekosistem yang
memiliki keragaman mikroorganisme lebih tinggi dibandingkan air laut maupun
sedimen laut. Hal ini disebabkan permukaan karang dilapisi oleh semacam
bagi pertumbuhan bakteri sehingga tercipta lapisan komunitas bakteri pada
permukaan karang (Rheinheimer, 1991).
Individu karang pada dasarnya adalah hewan yang hidup di laut.
Hewan-hewan ini dapat berasosiasi dengan tanaman maupun Hewan-hewan laut lainnya.
Termasuk dalam kelompok hewan karang adalah hewan dari filum Porifera dan
filum Coelenterata (Sugiri, 2000). Beberapa penelitian menunjukkan bahwa
hewan karang juga memiliki bahan aktif anti bakteri. Proksch (2000) menyatakan
sponge dari jenis Oceanapia sp. dan Aplysina aerophoba mampu menghasilkan
senyawa antimikrob. Sutedja et al. (2000) melaporkan bahwa sponge jenis
Petrosia contignata mampu menghasilkan senyawa antimikroba yang mampu
menghambat Staphylococcus aureus, Bacillus subtilis dan Escherichia coli.
Radjasa et al. (2004) berhasil mengisolasi senyawa antimikrob dari Acropora sp.
yang dapat menghambat V. harveyi. Suryati et al. (2004) menyatakan ada tiga
spesies sponge yang aktif menghambat pertumbuhan bakteri yaitu Halichondria
sp., Auletta sp., dan Callyspongia pseudoreticulata yang mengandung bahan aktif
sterol, steroid dan asam fenolat.
Mikroorganisme yang hidup berasosiasi dengan hewan karang, juga dapat
menghasilkan bahan aktif anti bakteri. Berdasarkan Webster et al. (2001)
diketahui bahwa bakteri yang berasosiasi dengan sponge menghasilkan komponen
bahan aktif anti bakteri. Lee et al. (2001) menyatakan bahwa Micrococcus sp.
yang hidup pada sponge jenis Tedania ignis menghasilkan komponen
diketopiperazin, sedangkan Vibrio sp. pada hewan karang jenis Dysidea
memproduksi bifenil eter bromina dan Vibrio sp. yang berasosiasi dengan
BAHAN DAN METODE
Waktu dan Tempat
Penelitian berlangsung dari bulan Agustus 2006 sampai dengan Juli 2007.
Sampel terumbu karang berasal dari perairan di sekitar Pulau Jukung, Kepulauan
Seribu. Isolasi bakteri, uji in vitro dan uji in vivo dilaksanakan di Laboratorium
Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu
Kelautan, Institut Pertanian Bogor. Tahap sekuensing untuk identifikasi bakteri
dilakukan di Laboratorium Bioteknologi PUSPIPTEK Serpong.
Media, Antibiotik dan Bahan Kimia
Media yang digunakan untuk mengisolasi bakteri adalah SWC-agar (Sea
Water Complete agar) (Lampiran 1). Selain itu digunakan juga media selektif
TCBS-agar (Thiosulphate Citrate Bile Sucrose agar) untuk menumbuhkan Vibrio
sp. (Lampiran 1).
Antibiotik yang digunakan adalah Rifampisin. Bahan kimia yang
digunakan untuk ekstraksi DNA terdiri dari : 1X TE buffer (10 mM Tris-HCl pH
8.0 dan 1 mM EDTA pH 8.0), lysozyme 50 mg/ml (50 mg lysozyme, 30 µl NaCl
5M, 200 µl EDTA 0.5 M, 770 µl ddH2O), 10% SDS (Sodium Dodecyl Sulfate), 10
mg/ml Proteinase-K, 5 M NaCl, 10% CTAB/NaCl, phenol:chloroform:
isoamylalcohol (25:24:1,v/v), chloroform:isoamylalcohol (24:1, v/v), isopropanol
absolute, 70% ethanol dan aquabidest steril. Proses elektroforesis menggunakan
bahan kimia sebagai berikut : 1% agarose, 1X TBE buffer dan loading dye (0.25%
Bromphenol blue, 0.25% xylene cyanol, 50% glycerol, 6 mM EDTA pH 8).
Amplifikasi gen 16S-rRNA dengan PCR (Polymerase Chain Reaction)
menggunakan bahan-bahan sebagai berikut : aquabidest steril 15.1 µl, primer 63f
1 µl, primer 1387r µl, dNTP 2.5 µl, Taq DNA polymerase 0.4 µl, polymerase
buffer 2.5 µl, MgCl2 2.0 µl dan template DNA 0.5 µl. Untuk gene clean
digunakan Gel/PCR DNA Fragments Extraction Kit Geneaid.
Isolasi Bakteri Kandidat Probiotik dari Terumbu Karang
Sampel terumbu karang dikemas dalam kantong plastik steril yang telah
diberi air laut dan oksigen. Kantong plastik disusun di dalam wadah stereofoam
ditimbang sebanyak 1 gram kemudian dibilas dengan air laut steril sebanyak 1-2
kali untuk mencegah kontaminan. Sampel selanjutnya dihaluskan dan disebar
sebanyak 100 µl pada media Sea Water Complete agar (SWC-agar) lalu
diinkubasi pada suhu ruang (28-310C) selama 24 jam. Koloni yang tumbuh
kemudian digunakan dalam uji in vitro.
Uji in vitroBakteri Kandidat Probiotik
a. Metode Zona Hambat
Isolat V. harveyi MR5339 RfR dan bakteri kandidat probiotik berumur 24
jam diencerkan hingga memiliki tingkat kekeruhan yang sama dengan konsentrasi
biakan dalam suspensi sekitar 109 sel/ml. Selanjutnya V. harveyi MR5339 RfR
disebar pada media SWC-agar sebanyak 50µl. Kertas cakram (Whatman antibiotic
assay paper) berdiameter 6 mm ditetesi suspensi bakteri kandidat probiotik
sebanyak 10 µl, kemudian ditaruh di atas media SWC-agar yang telah diberi V.
harveyi MR5339 RfR. Sebagai kontrol digunakan larutan garam fisiologis. Setelah
diinkubasi selama 24 jam pada suhu ruang, diameter zona bening yang dihasilkan
diukur menggunakan penggaris pada 3 posisi dari setiap kertas cakram, kemudian
dirata-ratakan.
b. Metode Kultur Bersama
Isolat-isolat yang tidak menghasilkan zona hambat diuji kemampuannya
melawan V. harveyi MR5339 RfR dengan metode kultur bersama. Isolat–isolat
tersebut ditumbuhkan pada media SWC-cair dengan kepadatan 102 CFU/ml. Pada
tabung yang sama ditambahkan 102 CFU/ml V. harveyi MR5339 RfR kemudian
diinkubasi semalam pada inkubator bergoyang dengan suhu 280C. Kultur
selanjutnya disebar pada media SWC+Rf sehingga hanya V. harveyi MR5339 RfR
yang tumbuh. Apabila V. harveyi MR5339 RfR pada tabung kontrol (tanpa isolat
bakteri kandidat probiotik) tumbuh jauh lebih banyak dibandingkan dengan kultur
campuran (V. harveyi MR5339 RfR dicampur dengan isolat bakteri kandidat
probiotik), berarti bakteri kandidat probiotik mampu menghambat pertumbuhan V.
harveyi MR5339 RfR.
Uji Patogenisitas Bakteri Kandidat Probiotik
Sebelum dilakukan uji in vivo pada udang, sepuluh isolat masing-masing
14
diuji patogenisitasnya pada udang. Satu lup dari masing-masing isolat
ditumbuhkan dalam media SWC-cair secara terpisah. Kultur ditempatkan pada
inkubator bergoyang selama 10 jam pada suhu ruang. Selanjutnya disentrifugasi
dengan kecepatan 3000 rpm pada suhu ruang. Pellet sel yang terbentuk kemudian
diresuspensikan dalam larutan fisiologis dan ditambahkan pada media
pemeliharaan larva udang hingga mencapai konsentrasi akhir 106 CFU/ml. Larva
udang dipelihara dalam toples yang diisi air laut steril 2 liter dengan kepadatan 10
ekor/l dan diberi pakan Artemia 3-5 individu/ml. Patogenisitas bakteri kandidat
probiotik diamati melalui kematian larva selama 5 hari pemeliharaan. Pada akhir
percobaan dihitung kelangsungan hidup (SR) larva udang dan dibandingkan
dengan kontrol, yakni perlakuan tanpa penambahan bakteri kandidat probiotik.
Pembuatan Mutan Bakteri Kandidat Probiotik
Isolat-isolat yang menghasilkan kelangsungan hidup terbaik pada uji
patogenisitas, sebelum uji in vivo pada larva udang diberi penanda resisten
rifampisin (RfR) terlebih dahulu. Pemberian penanda RfR pada bakteri kandidat
probiotik dilakukan melalui mutasi spontan dengan menumbuhkan bakteri
tersebut pada media SWC-agar yang telah mengandung rifampisin 50 µg/ml
(SWC+Rf). Pemberian penanda RfR pada bakteri probiotik dimaksudkan agar
keberadaan bakteri tersebut pada larva udang dan lingkungan pemeliharaannya
dapat dimonitor.
Uji in vivo Bakteri Kandidat Probiotik
Isolat-isolat bakteri kandidat probiotik yang paling potensial dan tidak
bersifat patogen diuji efektifitasnya dalam menghambat serangan V. harveyi
MR5339 RfR pada larva udang. Isolat bakteri kandidat probiotik diinokulasikan ke
dalam wadah pemeliharaan udang hingga mencapai konsentrasi akhir 106 CFU/ml
sehari setelah larva udang dimasukkan. Setelah kokultivasi dengan larva udang
selama 6 jam, V. harveyi MR5339 RfR diinokulasikan ke dalam wadah
pemeliharaan udang hingga mencapai konsentrasi akhir 106 CFU/ml. Percobaan
dilakukan dengan tiga ulangan termasuk kontrol (kontrol positif : hanya
diinokulasi V. harveyi MR5339 RfR, kontrol negatif : tanpa penambahan V.
harveyi MR5339 RfR maupun bakteri kandidat probiotik). Pengamatan dilakukan
bakteri baik dari larva udang maupun dari media airnya setiap tiga hari. Selama
percobaan larva udang diberi pakan Artemia sebanyak 3-5 individu/ml.
Identifikasi Bakteri Probiotik Terpilih
Identifikasi isolat terpilih dilakukan berdasarkan hasil sekuensing gen 16S
r RNA (Marchesi et al., 1998). Sekuensing gen 16S-rRNA terdiri dari tahapan
ekstraksi DNA, amplifikasi gen 16S-rRNA dengan PCR (Suwanto, 2002), gene
clean menggunakan Gel/PCR DNA Fragments Extraction KIT Geneaid dan
sekuensing dengan mesin Sequenser.
a. Ekstraksi DNA
Bakteri kandidat probiotik ditumbuhkan dalam media SWC-cair. Kultur
diinkubasi dalam shaker water bath pada suhu 28-290C, 130 rpm selama 24 jam.
Sel bakteri dipanen dengan mengambil 1.5 ml suspensi biakan bakteri lalu
dimasukkan ke dalam eppendorf dan disentrifugasi dengan kecepatan 6000 rpm
selama 2 menit. Selanjutnya supernatan dibuang. Tahap ini diulang sebanyak tiga
kali. Pellet bakteri yang terbentuk diresuspensi dengan 1 ml buffer TE 1X dan
disentrifugasi 6000 rpm 2 menit. Setelah disentrifugasi, supernatan yang ada
dibuang.
Pellet yang tertinggal diresuspensi dengan 500 µl buffer TE 1X,
selanjutnya ditambahkan 100 µl lysozyme 50 mg/ml lalu diinkubasi selama 1 jam
pada suhu 37 0C. Setelah diinkubasi ditambahkan 100 µl SDS 10% dan 10 µl
proteinase-K lalu dibolak-balik perlahan-lahan hingga tercampur. Selanjutnya
diinkubasi kembali pada suhu 37 0C selama 1 jam. Selanjutnya ditambahkan 100
µl 5 M NaCl dan 100 µl 10% CTAB/NaCl yang telah dihangatkan terlebih dahulu
(65 0C) selanjutnya diinkubasi selama 20 menit pada suhu 65 0C. Kemudian
ditambahkan 500 µl campuran phenol:chloroform:isoamylalcohol (25:24:1) lalu
divortex hingga tercampur. Selanjutnya disentrifugasi selama 10 menit dengan
kecepatan 10.000 rpm.
Cairan yang terbentuk yang berada pada lapisan teratas dipindahkan ke
dalam eppendroff baru lalu ditambahkan 0.6 volum isopropanol dingin. Tabung
eppendorf dibolak-balik secara perlahan supaya tercampur selanjutnya selama 20
menit disimpan di suhu -20 0C. Kemudian disentrifugasi pada kecepatan
16
Selanjutnya ditambahkan 1 ml etanol 70% dingin lalu disentrifugasi lagi pada
kecepatan maksimum selama 2 menit. Supernatan dibuang kembali, lalu disimpan
di suhu ruang hingga etanol menguap habis. Sebelum disimpan DNA ditambah
dengan elution buffer atau aquabidest steril serta dilakukan pengecekan dengan
elektroforesis.
b. Amplifikasi gen 16S-rRNA dengan PCR
Primer yang digunakan adalah primer universal untuk domain bakteri
berupa forward primer 63f (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan
reverse primer 1387r (5’-GGG CGG WGT GTA CAA GGC-3’) (Marchesi et al.,
1998). Semua komponen reaksi dicampur dalam microtube dan dimasukkan
dalam mesin PCR. Tahapan PCR terdiri dari pre start 94 0C, 2 menit; tahap
denaturasi 92 0C, 30 detik; tahap annealing 55 0C, 30 detik, tahap elongasi 72 0C
selama 1 menit. Proses PCR terdiri dari 30 siklus. Selanjutnya post PCR pada
suhu 75 0C 20 menit dan tahap stop PCR pada suhu 4 0C. Kemudian hasil PCR
disimpan pada suhu -20 0C.
c. Gene clean
DNA produk PCR dimurnikan menggunakan Gel/PCR DNA Fragments
Extraction Kit, Geneaid. Sebanyak 300 mg agarose (hasil pemotongan pada
elektroforesis) dimasukkan dalam eppendorf. Kemudian ditambahkan 500 µl DF
buffer dan divortex. Selanjutnya diinkubasi pada suhu 55-60 0C selama 15 menit
hingga agarose terlarut sempurna. Kemudian 800 µl sampel dimasukkan ke dalam
DFcolumn dan disentrifugasi 13000 rpm selama 30 detik dan supernatan dibuang.
Selanjutnya ditambahkan 600 µl wash buffer yang telah ditambahkan etanol ke
dalamnya, lalu disentrifugasi 13000 rpm selama 30 detik. Supernatan yang ada
dibuang lalu disentrifugasi kembali selama 3 menit pada kecepatan penuh. DF
column dipindahkan pada eppendorf baru dan ditambahkan 15-50 µl aquabidest
steril pada bagian tengahnya. Selanjutnya didiamkan selama 2 menit lalu
disentrifugasi pada kecepatan penuh selama 2 menit. Kemudian DNA yang
terbentuk disimpan pada suhu -20 0C. Untuk pengecekan dapat dilakukan running
Rancangan Penelitian dan Teknik Analisa
Penelitian dirancang menggunakan Rancangan Acak Lengkap (RAL),
sebelas perlakuan dengan tiga ulangan pada saat uji patogenisitas dan dua belas
perlakuan dengan tiga ulangan pada uji in vivo. Parameter yang diamati dianalisa
keragamannya dengan ANOVA dan untuk mengetahui pengaruh perlakuan
dilakukan uji lanjut. Variabel yang dianalisa secara statistik meliputi
kelangsungan hidup larva udang baik pada uji patogenisitas maupun uji in vivo
serta laju pertumbuhannya. Sedangkan nilai zona hambat dan populasi bakteri
dianalisa secara deskriptif.
Parameter yang diamati
a. Tingkat Kelangsungan Hidup Larva Udang Windu
Tingkat kelangsungan hidup larva udang windu dihitung menggunakan
rumus :
SR=Nt x 100% (Effendie, 1997)
No
Keterangan :
SR : tingkat kelangsungan hidup (%)
Nt : jumlah udang yang hidup pada akhir pengamatan (ekor)
No : jumlah udang pada awal pengamatan
b. Laju Pertumbuhan Panjang dan Bobot Harian Larva Udang Windu
Pertumbuhan panjang dan bobot total diamati pada awal dan akhir
penelitian. Pertumbuhan larva udang windu dihitung berdasarkan pertambahan
bobot dan panjang berdasarkan rumus berikut :
⎪⎭
α (Effendie, 1997)
Keterangan :
α : Laju pertumbuhan harian udang (%) t : Lama waktu pemeliharaan udang (hari)
Wt : Bobot rata-rata akhir udang (mg)
Wo : Bobot rata-rata awal udang (mg)
Lt : Panjang rata-rata akhir udang (mm)
18
c. Populasi Bakteri
Populasi bakteri yang dihitung pada uji in vitro metode kultur bersama
adalah jumlah V. harveyi MR5339 RfR pada tabung kontrol dan kultur campuran
probiotik. Pada uji in vivo populasi bakteri yang dihitung meliputi total bakteri,
jumlah bakteri probiotik, jumlah V. harveyi MR5339 RFR, baik pada media
pemeliharaan, larva udang mati dan udang hidup. Jumlah bakteri dihitung
berdasarkan rata-rata jumlah koloni yang tumbuh dan dikalikan dengan faktor
Isolasi Bakteri Kandidat Probiotik
Terumbu karang yang diisolasi bakterinya terdiri dari 6 jenis yaitu
Acropora sp., Merulina sp., Hystrix sp., Poecillophora sp., Porites sp. dan
Haliophora sp. (Gambar 2). Identifikasi terumbu berdasarkan Veron (1986).
Bakteri kandidat probiotik yang berhasil diisolasi dari terumbu karang ada 110
isolat (Lampiran 3). Dari jumlah tersebut 43 isolat berasal dari Acropora sp., 9
isolat dari Merulina sp., 12 isolat dari Hystrix sp., 14 isolat dari Poecillophora sp.,
22 isolat dari Porites sp. dan 10 isolat dari Haliophora sp.. Dari total 110 isolat,
82 isolat termasuk golongan Vibrio sp dan 28 isolat dari golongan non Vibrio.
Koloni 82 isolat Vibrio berwarna kuning pada media TCBS-agar, tidak berpendar
dan bersifat menyebar pada media SWC-agar. Sedangkan 17 isolat non Vibrio
menghasilkan koloni berwarna krem dan 11 isolat menghasilkan koloni berwarna
putih pada media SWC-agar.
V. harveyi yang digunakan dalam penelitian ini adalah V. harveyi MR5339
RfR, merupakan koleksi Balai Penelitian Perikanan Pantai (Balitkanta) Maros,
Sulawesi Selatan. Bakteri tersebut telah diuji bersifat patogen pada larva udang
windu. Koloni V. harveyi MR5339 RfR berwarna hijau pada media TCBS-agar
dan putih kekuningan pada media SWC-agar (Gambar 3) serta berpendar bila
diamati pada ruang gelap (Gambar 4).
Acropora sp. Merulina sp. Hystrix sp.
Poecillophora sp. Porites sp. Haliophora sp.
20
A B
Gambar 3. Penampilan V. harveyi MR5339 RfR pada media TCBS-agar (A) dan SWC-agar (B)
A B
Gambar 4. Penampilan bakteri V. harveyi MR5339 RfR pada media TCBS-agar yang diamati pada kondisi terang (A) dan gelap (B)
Uji In Vitro Bakteri Kandidat Probiotik a. Metode Zona hambat
Bakteri yang memiliki kemampuan menghambat V. harveyi MR5339 RfR
menghasilkan zona bening disekitar kertas cakram (Gambar 5). Bakteri yang tidak
menghasilkan zona bening diuji kemampuannya menghambat V. harveyi MR5339
RfR dengan metode kultur bersama.
Dari 110 isolat hanya 54 isolat yang mampu menghasilkan zona hambat.
Zona hambat yang dihasilkan berkisar antara 8 – 15 mm (Tabel 1). Ada lima isolat
yang menghasilkan zona hambat terbesar, yaitu yang diisolasi dari Acropora sp.
(isolat 1C dan 8A), Hystrix sp. (isolat 11D dan 11K)dan Poecillophora sp. (isolat
13I). Radjasa et al. (2004) berhasil mengisolasi TAB4.2 dari Acropora sp yang
menghasilkan zona bening 11,75 mm saat uji in vitro dengan V. harveyi. TAB4.2
diidentifikasi sebagai Pseudoalteromonas dan menghasilkan metabolit sekunder
Kontrol
A1
A2
A3
Kontrol
Kontrol
B3
C3
B2
B1
C2
22
Keterangan :
A : isolat 1C C : isolat 13I E : isolat 11K B : isolat 8A D : isolat 11D
Gambar 5. Zona hambat yang dihasilkan bakteri kandidat probiotik terhadap V. harveyi MR5339 RfR
Kontrol Kontrol
D3
E2
D2
D1
E3
Tabel 1. Zona hambat yang dihasilkan oleh bakteri kandidat probiotik
No Kode isolat Zona hambat (mm) No Kode isolat Zona hambat (mm)
1 Acp 1C 13.8 28 Lam 4I 9
Zona bening yang timbul di sekitar kertas cakram menunjukkan adanya
kemampun bakteri kandidat probiotik dalam menghambat pertumbuhan V. harveyi
MR5339 RfR. Berdasarkan Verschuere et al. (2000) populasi mikroba dapat
melepaskan substansi kimia yang memiliki kemampuan bakterisidal atau
bakteriostasis yang dapat mempengaruhi populasi mikroba lain. Secara umum
kemampuan menghambat pertumbuhan bakteri lain dikarenakan satu atau
kombinasi dari beberapa faktor seperti: produksi antibiotik, bakteriosin,
siderophores, lysozymes, protease dan atau hidrogen peroksida atau
mempengaruhi pH media dengan menghasilkan asam organik tertentu.
24
Hasil uji penghambatan in vitro dari 56 isolat bakteri kandidat probiotik
terhadap V. harveyi MR5339 RfR disajikan pada Gambar 6 dan 7. Uji in vitro
bakteri kandidat probiotik dengan metode kultur bersama dilakukan dengan
membandingkan jumlah koloni V. harveyi MR5339 RfR yang tumbuh di tabung
kontrol dengan kultur campurannya (Gambar 6). Lima isolat kandidat probiotik
yaitu isolat 5H1 diisolasi dari Acropora sp., isolat 11I dan 11G diisolasi dari
Hystrix sp. serta isolat 13B dan 13G1 yang diisolasi dari Poecillophora sp.,
mampu menekan pertumbuhan V. harveyi MR5339 RfR hingga 101 – 102 CFU/ml
sedangkan pada tabung kontrol populasi V. harveyi mencapai 7 x 108 CFU/ml.
Isolat-isolat yang lain juga mampu menghambat pertumbuhan V. harveyi MR5339
RfR meskipun dengan daya hambat yang berbeda-beda (Gambar 7). Hal ini
terlihat dari jumlah koloni V. harveyi MR5339 RfR yang tumbuh pada biakan
yang dicampur dengan bakteri kandidat probiotik lebih rendah dibanding kontrol.
Hal tersebut menunjukkan bahwa ke-56 isolat yang ada, sebenarnya potensial
menghambat pertumbuhan V. harveyi MR5339 RfR.
Penghambatan pertumbuhan bakteri tidak selalu dapat diamati dengan
melihat adanya zona bening pada media padat. Komposisi media yang digunakan
mungkin mempengaruhi jumlah senyawa antimikrob yang dihasilkan atau
dilepaskan ke media. Selain itu, penghambatan pertumbuhan tidak selalu
berkaitan dengan produksi senyawa antimikrob tetapi dapat juga karena adanya
kompetisi terhadap bahan kimia atau energi yang tersedia. Hal ini
menggambarkan bagaimana populasi bakteri yang berbeda menempati ekosistem
yang sama (Verschuere et al. 2000).
Hasil penelitian Riquelme et al. (1997) menunjukkan bahwa dari 57 isolat
bakteri yang diisolasi dari air laut, 3 diantaranya (5%) potensial menghambat
pertumbuhan V. anguillarum. Isolat SV1 yang tidak memperlihatkan adanya zona
penghambatan pada uji in vitro ternyata juga dapat meningkatkan kelangsungan
Gambar 6. Penghambatan V. harveyi MR5339 RfR oleh bakteri kandidat probiotik pada media SWC-agar + rifampisin 50 µg/ml
Kontrol (V. harveyi)
Kultur campuran (V. harveyi + isolat 11I)
Kontrol
(V. harveyi) (V. harveyi)Kontrol
Kontrol
(V. harveyi) (V. harveyi)Kontrol
Kultur campuran
(V. harveyi + isolat 5H1) Kultur campuran
(V. harveyi + isolat 13B)
Kultur campuran (V. harveyi + isolat 11G)
25
Gambar 7. Penghambatan V. harveyi MR5339 RfR oleh isolat bakteri kandidat probiotik pada uji in vitro metode kultur bersama
0 1 2 3 4 5 6 7 8 9
Isolat kandidat probiotik
Lo
g C
F
U
/m
l s
el V.
harv
ey
Uji Patogenisitas Bakteri Kandidat Probiotik
Sebelum dilakukan uji in vivo pada larva udang, sepuluh isolat yang
potensial sebagai kandidat probiotik, masing-masing lima isolat dari metode zona
hambat dan lima isolat dari metode kultur bersama, diuji patogenisitasnya
terhadap larva udang windu. Isolat-isolat terpilih merupakan isolat yang
memberikan hasil terbaik pada uji in vitro metode zona hambat dan kultur
bersama. Hasil uji patogenisitas isolat-isolat kandidat probiotik disajikan pada
Gambar 8 dan Lampiran 4. Hasil yang ada memperlihatkan semua bakteri
kandidat probiotik yang diuji tergolong tidak patogen. Hal ini dapat diketahui
dengan melihat nilai kelangsungan hidup pada semua perlakuan tidak berbeda
nyata dengan kontrol setelah dianalisa secara statistik. Isolat 13G1 yang mampu
menekan pertumbuhan V. harveyi MR5339 RfR paling baik pada uji in vitro
metode kultur bersama menghasilkan kelangsungan hidup paling tinggi (88,33%).
Hal ini menunjukkan isolat tersebut, diduga selain memiliki kemampuan menekan
pertumbuhan V. harveyi MR5339 RfR juga dapat meningkatkan kebugaran udang.
Gambar 8. Kelangsungan hidup larva udang windu pada uji patogenisitas
27
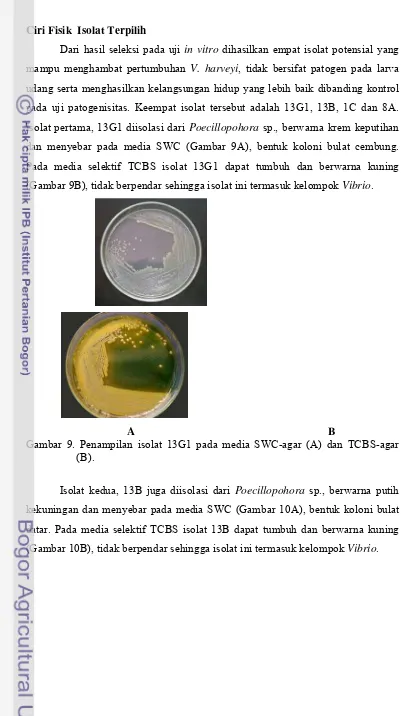
Ciri Fisik Isolat Terpilih
Dari hasil seleksi pada uji in vitro dihasilkan empat isolat potensial yang
mampu menghambat pertumbuhan V. harveyi, tidak bersifat patogen pada larva
udang serta menghasilkan kelangsungan hidup yang lebih baik dibanding kontrol
pada uji patogenisitas. Keempat isolat tersebut adalah 13G1, 13B, 1C dan 8A.
Isolat pertama, 13G1 diisolasi dari Poecillopohora sp., berwarna krem keputihan
dan menyebar pada media SWC (Gambar 9A), bentuk koloni bulat cembung.
Pada media selektif TCBS isolat 13G1 dapat tumbuh dan berwarna kuning
(Gambar 9B), tidak berpendar sehingga isolat ini termasuk kelompok Vibrio.
A B
Gambar 9. Penampilan isolat 13G1 pada media SWC-agar (A) dan TCBS-agar (B).
Isolat kedua, 13B juga diisolasi dari Poecillopohora sp., berwarna putih
kekuningan dan menyebar pada media SWC (Gambar 10A), bentuk koloni bulat
datar. Pada media selektif TCBS isolat 13B dapat tumbuh dan berwarna kuning
A B
Gambar 10. Penampilan isolat 13B pada media SWC-agar (A) dan TCBS-agar (B).
Isolat ketiga, 8A diisolasi dari Acropora sp., berwarna putih kekuningan
dan menyebar pada media SWC (Gambar 11A), koloni berbentuk bulat kecil-kecil
Gambar 8. Pada media selektif TCBS isolat 8A dapat tumbuh dan berwarna
kuning (Gambar 11B), tidak berpendar sehingga isolat ini termasuk kelompok
Vibrio.
A B
Gambar 11. Penampilan isolat 8A pada media SWC-agar (A) dan TCBS-agar (B).
Isolat keempat, 1C juga diisolasi dari Acropora sp., berwarna putih
kekuningan pada media SWC (Gambar 12A), bentuk koloni bulat cembung. Pada
media selektif TCBS isolat 1C dapat tumbuh dan berwarna kuning (Gambar 12B),
29
Gambar 12. Penampilan isolat 1C pada media SWC-agar (A) dan TCBS-agar (B).
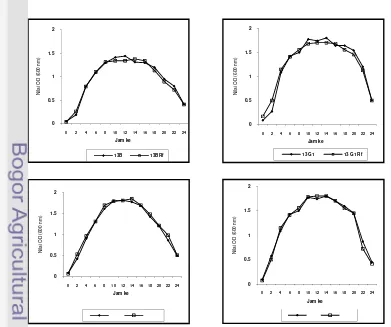
Mutan Resisten Rifampisin
Empat isolat terbaik hasil uji patogenisitas yaitu 13G1, 13B, 1C dan 8A
dibuat mutan resisten rifampisin dengan cara menumbuhkan isolat-isolat tersebut
pada media SWC-agar yang mengandung rifampisin 50 µg/ml. Morfologi koloni
mutan maupun pola pertumbuhannya sama dengan tipe liarnya (Gambar 13),
sehingga mutan tersebut dapat digunakan untuk mengamati penghambatan
pertumbuhan V. harveyi oleh bakteri kandidat probiotik. Pemberian penanda RfR
pada bakteri probiotik bertujuan untuk membedakan antara bakteri probiotik
dengan bakteri alami yang telah ada pada tubuh udang, sehingga dapat dimonitor
Gambar 13. Perbandingan pertumbuhan bakteri kandidat probiotik resisten rifampisin dengan tipe liarnya.
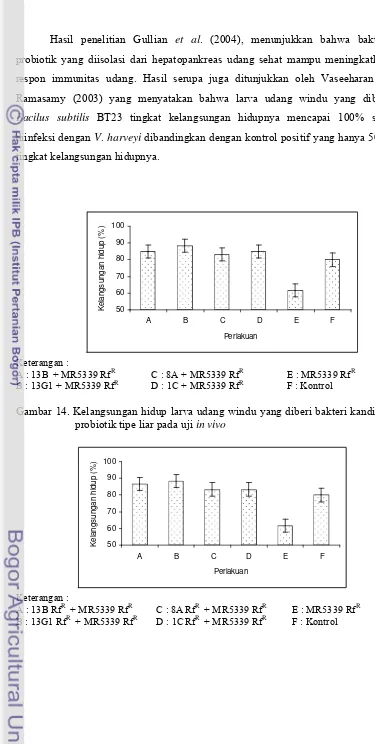
Uji in vivo Bakteri Kandidat Probiotik
Empat isolat bakteri kandidat probiotik yang paling potensial berdasarkan
uji in vitro metode zona hambat dan kultur bersama serta tidak bersifat patogen
terhadap larva udang diuji efektivitasnya dalam menghambat pertumbuhan
V. harveyi MR5339 RfR pada larva udang windu. Pengamatan dilakukan terhadap
kelangsungan hidup larva, total bakteri, populasi V. harveyi MR5339 RfR dan
bakteri kandidat probiotik baik pada air media pemeliharaan, larva hidup maupun
larva mati. Penanda RfR pada V. harveyi dan probiotik yang digunakan bertujuan
untuk mengamati perbandingan populasi keduanya
Hasil pengujian menunjukkan keempat isolat tersebut, baik tipe liar
(Gambar 14, Lampiran 5) maupun tipe mutannya (Gambar 15, Lampiran 6),
secara signifikan (p<0.05) dapat meningkatkan kelangsungan hidup larva udang.
Isolat-isolat tersebut diduga dapat menghambat pertumbuhan V. harveyi MR5339
RfR. Hal ini terlihat dari nilai kelangsungan hidup larva pada kontrol positif
(hanya diinokulasi V. harveyi MR5339 RfR) lebih rendah (61,67% dan 68,33%)
dibanding perlakuan dengan penambahan isolat probiotik (83,33% - 88,33%).
Selain itu isolat-isolat tersebut juga diduga dapat meningkatkan kebugaran larva
udang.
Berdasarkan Verschuere et al. 2000, bakteri probiotik dapat menjamin
perbaikan dalam penggunaan pakan atau memperbaiki nutrisinya juga
memperbaiki respon inang terhadap penyakit. Kedua hal tersebut diduga menjadi
penyebab meningkatnya kebugaran larva udang. Hal ini terlihat dari nilai
kelangsungan hidup larva pada kontrol negatif (tanpa inokulasi bakteri probiotik
maupun V. harveyi) lebih rendah (80,00%) dibanding perlakuan dengan
31
Hasil penelitian Gullian et al. (2004), menunjukkan bahwa bakteri
probiotik yang diisolasi dari hepatopankreas udang sehat mampu meningkatkan
respon immunitas udang. Hasil serupa juga ditunjukkan oleh Vaseeharan &
Ramasamy (2003) yang menyatakan bahwa larva udang windu yang diberi
Bacilus subtilis BT23 tingkat kelangsungan hidupnya mencapai 100% saat
diinfeksi dengan V. harveyi dibandingkan dengan kontrol positif yang hanya 50%
tingkat kelangsungan hidupnya.
Keterangan :
A : 13B + MR5339 RfR C : 8A + MR5339 RfR E : MR5339 RfR B : 13G1 + MR5339 RfR D : 1C + MR5339 RfR F : Kontrol
Gambar 14. Kelangsungan hidup larva udang windu yang diberi bakteri kandidat probiotik tipe liar pada uji in vivo
Gambar 15. Kelangsungan hidup larva udang windu yang diberi bakteri kandidat probiotik tipe mutan pada uji in vivo
Peningkatan nilai kelangsungan hidup larva karena adanya penghambatan
pertumbuhan V. harveyi MR5339 RfR oleh bakteri probiotik ditunjukkan dengan
menurunnya jumlah sel V. harveyi MR5339 RfR baik pada air pemeliharaan
maupun pada larva hidup bila dibandingkan dengan perlakuan kontrol positif.
Gambar 16 menunjukkan populasi total bakteri, jumlah total Vibrio sp. dan
jumlah V. harveyi MR5339 RfR pada air media pemeliharaan larva udang windu
yang diberi bakteri kandidat probiotik tipe liar.
13B + MR5339 RfR
0
13G1 + MR5339 RfR
33
V. harveyi Total Vibrio sp Total bakteri
Gambar 16. Populasi total bakteri, jumlah sel Vibrio sp dan V. harveyi MR5339 RfR pada air media pemeliharaan larva udang windu yang diberi bakteri kandidat probiotik tipe liar
Pada perlakuan pemberian bakteri kandidat probiotik tipe liar, tidak dapat
dibedakan antara Vibrio kandidat probiotik dengan Vibrio yang telah ada
sebelumnya pada tubuh udang, sehingga pada perlakuan ini yang dihitung adalah
total Vibrio sp.. Keempat isolat kandidat probiotik (13B, 13G1, 8A dan 1C)
menunjukkan pengaruh yang tidak berbeda nyata. Keempatnya dapat menekan
jumlah sel V. harveyi MR5339 RfR pada air pemeliharaan hingga 103 CFU/ml
pada hari kedua. Sedangkan total Vibrio sp pada masing-masing perlakuan
nilainya masih lebih tinggi (105 – 106 CFU/ml) dibandingkan kontrol positif
(populasi total Vibrio sp hanya 105 CFU/ml). Hal ini menunjukkan media
pemeliharaan larva udang didominasi oleh Vibrio yang bersifat menguntungkan
bagi inang yang dapat menghambat pertumbuhan V. harveyi MR5339 RfR.
Gambar 17 menunjukkan populasi total bakteri, jumlah bakteri probiotik
dan jumlah V. harveyi MR5339 RfR pada air media pemeliharaan larva udang
windu yang diberi bakteri kandidat probiotik tipe mutan. Bakteri kandidat
probiotik pada perlakuan ini telah dimutasi menjadi resisten rifampisin sehingga
keberadaannya di media pemeliharaan dapat dimonitor. Dari Gambar 17 terlihat
penurunan jumlah sel V. harveyi MR5339 RfR pada air pemeliharaan hingga 103
CFU/ml pada hari kedua dan sudah tidak terdeteksi lagi keberadaannya pada hari
keenam. Keempat isolat kandidat probiotik (13B RfR, 13G1 RfR, 8A RfR dan 1C
RfR) memberikan pengaruh yang tidak berbeda nyata (Gambar 17, Lampiran 7).
Jumlah sel bakteri kandidat probiotik rata-rata menurun pada hari kedua (104
CFU/ml) dan tidak terdeteksi lagi pada hari keenam. Adanya penurunan jumlah
sel V. harveyi MR5339 RfR dan lebih tingginya jumlah sel bakteri probiotik
menunjukkan adanya penghambatan pertumbuhan V. harveyi MR5339 RfR oleh
bakteri probiotik.
Sung et al. (1999) menyatakan apabila terjadi penurunan keragaman
Vibrio sp. pada air media pemeliharaan udang dan didominasi oleh komunitas
Vibrio patogen biasanya terjadi vibriosis yang diikuti oleh penurunan populasi
udang di tambak. Pada penelitian ini, perlakuan kontrol positif didominasi oleh V.
harveyi MR5339 RfR dengan jumlah larva mati lebih banyak dibanding perlakuan
penambahan probiotik baik tipe liar maupun tipe mutan. Pada perlakuan dengan
V. harveyi Probiotik Total bakteri
Gambar 17. Populasi total bakteri, jumlah bakteri probiotik dan V. harveyi MR5339 RfR pada air media pemeliharaan larva udang windu yang diberi bakteri kandidat probiotik tipe mutan
13B RfR + MR5339 RfR
0
13G1 RfR + MR5339 RfR
37
Gambar 18 memperlihatkan populasi total bakteri, jumlah total Vibrio sp.
dan jumlah V. harveyi MR5339 RfR pada larva hidup yang diberi bakteri kandidat
probiotik tipe liar. Pada Gambar 18 terlihat bahwa populasi V. harveyi MR5339
RfR pada larva hidup dengan perlakuan penambahan bakteri probiotik lebih
rendah (102 CFU/larva) dibanding perlakuan tanpa probiotik (103 CFU/larva),
bahkan pada hari ke-4, V. harveyi MR5339 RfR sudah tidak terdeteksi lagi. Tidak
terdeteksinya V. harveyi MR5339 RfR pada hari keempat diduga karena telah
terjadi penurunan populasi V. harveyi MR5339 RfR di media pemeliharaan (akibat
dihambat pertumbuhannya oleh bakteri probiotik) sehingga peluang untuk
berkolonisasi di tubuh udang semakin kecil bila dibandingkan bakteri kandidat
probiotik. Pada perlakuan kontrol positif, V. harveyi MR5339 RfR masih
terdeteksi hingga hari keempat. Hal ini dimungkinkan karena tidak adanya
persaingan antara V. harveyi MR5339 RfR dengan bakteri kandidat probiotik pada
media pemeliharaan sehingga peluang untuk menempel di tubuh udang lebih
besar.
Pada Gambar 18 dapat diketahui bahwa jumlah sel Vibrio sp. yang
ditemukan pada larva hidup lebih banyak dibandingkan jumlah sel V. harveyi
MR5339 RfR. Hal ini menunjukkan larva udang didominasi oleh Vibrio sp.. Hasil
penelitian Gullian et al. (2004) menyatakan isolat Vibrio potensial probiotik asal
udang sehat mampu berkolonisasi hingga 83% pada hepatopankreas udang uji.
Karunasagar et al. (1994) dan Manefield et al. (2000) menyatakan V.
harveyi dapat menyebabkan vibriosis dikarenakan sifat patogenisitasnya. Sifat
patogenisitas ini berkaitan erat dengan fenomena kemampuan berluminesensi
yang dikontrol oleh suatu sistem quorum sensing. Apabila quorum tercapai, maka
V. harveyi dapat mengeluarkan faktor-faktor virulensinya. Pada penelitian ini,
tubuh udang didominasi oleh Vibrio sp. dan hanya sedikit V. harveyi MR5339 RfR
yang berkoloni sehinggga V. harveyi MR5339 RfR tidak dapat mencapai quorum
untuk mensekresikan faktor-faktor virulensinya. Dengan demikian V. harveyi
MR5339 RfR tidak dapat mengakibatkan kematian pada larva udang sehingga
tingkat kelangsungan hidup larva yang diberi probiotik lebih besar dibanding
39
Vibrio harveyi Total Vibrio sp Total bakteri
Gambar 18. Populasi total bakteri, jumlah sel Vibrio sp dan V. harveyi MR5339 RfR pada larva hidup yang diberi bakteri kandidat probiotik tipe liar. 13B + MR5339 RfR
0
13G1 + MR5339 RfR