OPTIMALISASI PRODUKSI EMBRIO DOMBA
SECARA
IN VITRO
: PENGGUNAAN MEDIUM CR1aa DAN
PENGARUH STATUS REPRODUKSI OVARIUM
YULNAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
YULNAWATI. Optimalisasi Produksi Embrio Domba Secara In Vitro: Penggunaan Medium CR1aa dan Pengaruh Status Reproduksi Ovarium. Dibimbing oleh ARIEF BOEDIONO dan MOHAMAD AGUS SETIADI.
Penelitian dilakukan untuk mengetahui kemampuan CR1aa sebagai medium sederhana dalam proses pematangan, fertilisasi dan kultur embrio domba dan mengkaji pengaruh status reproduksi ovarium terhadap jumlah folikel, kualitas oosit, pematangan inti, tingkat fertilisasi dan pembelahan embrio pada proses produksi embrio domba in vitro. Pada percobaan I, oosit dimatangkan dalam Tissue Culture Medium (TCM)-199 sebagai kontrol atau CR1aa sebagai perlakuan. Ke dalam masing-masing medium maturasi tersebut ditambahkan
Fetal Bovine Serum (FBS) 10%, Follicle Stimulating Hormone (FSH) 10 IU/ml,
Luteinizing Hormone (LH) 10 IU/ml, Estradiol 1 ìg/ml and penicillin-streptomycin 100 IU/ml. Oosit matang selanjutnya difertilisasi dalam medium BO atau CR1aa yang disuplementasi dengan caffeine benzoate 2.5 mM dan heparin 20 µg/ml. Zigot dikultur dalam medium TCM-199 atau CR1aa yang disuplementasi dengan FBS 5%, insulin 5 µg/ml, penicillin streptomycin 100 IU/ml. Pada percobaan II, pasangan ovarium dipisahkan menjadi empat kelompok, yaitu: 1) ovarium dengan Corpus Luteum (CL) dan Folikel Dominan (FD), 2) ovarium dengan CL tanpa FD, 3) ovarium dengan FD tanpa CL dan 4) ovarium tanpa CL dan FD.
Hasil penelitian pada percobaan pertama menunjukkan tingkat maturasi dari oosit yang dimatangkan dalam medium TCM -199 (73.27%) lebih tinggi (P<0.05) daripada CR1aa (52.88%). Tingkat fertilisas i dalam medium CR1aa (67.59%) lebih tinggi (P<0.05) daripada medium BO (52.94%). Tidak ada perbedaan nyata (P>0.05) dalam tingkat pembelahan embrio dalam medium TCM-199 maupun CR1aa (39.45%; 43/109 vs 50.94%; 54/106).
Pada percobaan kedua, tidak terdapat perbedaan nyata dalam jumlah folikel dari keempat kelompok pasangan ovarium. Jumlah oosit dengan kualitas baik yang layak untuk digunakan dalam proses produksi embrio in vitro dari pasangan ovarium yang memiliki CL dan FD sebesar 7.94 ± 2.59 dan berbeda nyata (P<0.05) dengan pasangan ovarium dengan FD tanpa CL (4.40 ± 1.50). Tingkat maturasi inti dari oosit dengan kualitas baik adalah sebesar 75.51% dari kelompok pasangan ovarium yang memiliki CL dan FD lebih tinggi (P<0.05) daripada kelompok pasangan ovarium dengan FD tanpa CL (42.86%). Tingkat fertilisasi dan pembelahan embrio tidak berbeda nyata (P>0.05) dari keempat kelompok pasangan ovarium.
ABSTRACT
YULNAWATI. Optimalization of Ovine In Vitro Embryo Production: The Uses of CR1aa Medium and The Effect of Ovarian Reproductive Status. Under supervision of ARIEF BOEDIONO and MOHAMAD AGUS SETIADI.
The aim of this study was to investigate the capacity of CR1aa as a simple medium for in vitro maturation, fertilization and culture of ovine embryo and to determine whether the ovarian reproductive status influenced the number of follicles, oocytes quality, nuclear maturation, fertilization and cleavage rates for ovine in vitro embryo production. In first experiment, oocytes were matured in Tissue Culture Medium (TCM)-199 as control and CR1aa as treatment. Both maturation medium were supplemented with 10% Fetal Bovine Serum (FBS), 10 IU/ml Follicle Stimulating Hormone (FSH), 10 IU/ml Luteinizing Hormone (LH), 1 ìg/ml Estradiol and 100 IU/ml penicillin-streptomycin. Matured oocytes were fertilized in BO or CR1aa medium, supplemented with 2.5 mM caffeine benzoate and 20 µg/ml heparin. Zygotes were cultured in TCM-199 or CR1aa medium, supplemented with 5% FBS, 5 µg/ml insulin, 100 IU/ml penicillin streptomycin. In second experiment, the pairs of ovary was classified into four groups: 1) ovaries with Corpus Luteum (CL) and Dominant Follicle (DF), 2) ovaries with CL, without DF, 3) ovaries with DF, without CL, 4) ovaries without both CL and DF.
Results showed that in first experiment, the highest maturation rate was found in TCM -199 medium (73.27%) and significantly different (P<0.05) from CR1aa (52.88%). Fertilization rate in CR1aa medium (67.59%) was higher (P<0.05) than in BO medium (52.94%). Furthermore, there was no significant difference (P>0.05) between cleavage rate of ovine embryos in TCM-199 or CR1aa medium (39.45%; 43/109 vs 50.94%; 54/106).
In second experiment, there was no significant different (P>0.05) in the number of follicles were found from all groups of ovaries. The number of oocytes with good quality from pairs of ovary with CL and DF was 7.94 ± 2.59, significantly different (P<0.05) with pairs of ovary with DF without CL (4.40 ± 1.50). The maturation rate of oocytes with good quality were 75.51% from pairs of ovary with CL and DF and significantly different (P<0.05) with pairs of ovary with DF without CL (42.86%). Fertilization and cleavage rates were similar (P>0.05) from all groups of ovaries.
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa Tesis yang berjudul “Optimalisasi Produksi Embrio Domba Secara In Vitro: Penggunaan Medium CR1aa dan Pengaruh Status Reproduksi Ovarium”, adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir dari tesis ini.
Bogor, Januari 2006
OPTIMALISASI PRODUKSI EMBRIO DOMBA
SECARA
IN VITRO
: PENGGUNAAN MEDIUM CR1aa DAN
PENGARUH STATUS REPRODUKSI OVARIUM
YULNAWATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Optimalisasi Produksi Embrio Domba Secara In Vitro:
Penggunaan Medium CR1aa dan Pengaruh Status Reproduksi Ovarium
Nama : Yulnawati NIM : B651024011
Disetujui
Komisi Pembimbing
drh. Arief Boediono, PhD Dr.drh. Mohamad Agus Setiadi Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Biologi Reproduksi
Dr.drh. Tuty L. Yusuf, M.S. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc
RIWAYAT HIDUP
Penulis dilahirkan di Pe kanbaru pada tanggal 19 Oktober 1980 sebagai anak ketiga dari tiga bersaudara dari pasangan Yusnizar (alm) dan Hj. Yusri A.M.
Pada tahun 1998 penulis lulus dari Sekolah Menengah Umum (SMU) Negeri 1 Padang dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Gelar Sarjana Strata 1 diraih dari Fakultas Kedokteran Hewan Institut Pertanian Bogor pada tahun 2002 dan penulis terpilih sebagai lulusan terbaik. Tahun 2003, penulis terdaftar sebagai mahasiswa program master (Strata 2) pada Program Studi Biologi Reproduksi, Sekolah Pascasarjana, Institut Pertanian Bogor.
PRAKATA
Puji syukur penulis ucapkan kehadirat ALLAH SWT atas berkat rahmat dan karunia -Nya sehingga penelitian dan penulisan tesis ini dapat diselesaikan dengan baik. Tesis ini memuat hasil penelitian mengenai metode produksi embrio domba secara in vitro. Penelitian dimaksudkan sebagai upaya untuk meningkatkan produktivitas dan perbaikan mutu genetik ternak domba dengan menerapkan salah satu teknologi reproduksi yakni produksi embrio secara in vitro.
Penulis mengucapkan terimakasih dan penghargaan yang tinggi kepada Bapak drh. Arief Boediono, PhD dan Dr. drh. M. Agus Setiadi sebagai ketua dan anggota komisi pembimbing yang telah meluangkan waktu untuk memberikan arahan, bimbingan, dorongan semangat dan nasehat mulai dari proses perancangan dan pelaksanaan penelitian hingga penulisan tesis. Kepada Dr.drh. Tuty L. Yusuf, M.S.,selaku ketua Program Studi Biologi Reproduksi dan penguji luar komisi, penulis mengucapkan terimakasih atas segala saran, kritik dan masukan yang diberikan untuk kesempurnaan tesis ini.
Ucapan terimakasih juga penulis sampaikan kepada tim manajemen Hibah Pascasarjana (HPTP) Angkatan II/2004, Laboratorium IVF, Bagian Reproduksi, Departemen Klinik, Reproduksi dan Patologi FKH IPB, Laboratorium Embriologi, Departemen Anatomi, Fisiologi dan Farmakologi FKH IPB, Badan Pengkajian dan Penerapan Teknologi (BPPT) Jakarta, Peternakan domba laga Lesan Putra PT. Sarbi Moerhani Lestari Bogor, atas bantuan fasilitas pendukung sehingga penelitian ini dapat berlangsung dengan baik.
Kepada pimpinan Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia dan Ketua Kelompok Penelitian Reproduksi dan Genetika Ternak penulis mengucapkan terimakasih atas izin yang diberikan sehingga penulis dapat menyelesaikan penelitian dan pendidikan S2 di Sekolah Pascasarjana IPB.
mahasiswa Program Studi Biologi Reproduksi dan berbagai pihak yang tidak dapat disebutkan satu persatu, atas bantuannya selama penelitian dan penulisan tesis. Kepada karyawan rumah pemotongan hewan Ciampea, penulis mengucapkan terimakasih atas penyediaan materi (ovarium) untuk penelitian ini.
Kepada yang tercinta (alm) papa, ibu, kakak, paman dan seluruh keluarga besar Hj. Nurlilah Amini, Hj. Ruqayah Amini dan H. Abdul Madjid, terimakasih atas segala doa, pengorbanan, dukungan moril dan materil yang tak henti-hentinya diberikan kepada penulis selama ini.
Akhirnya penulis berharap semoga apa yang telah dihasilkan ini dapat bermanfaat bagi pengembangan ilmu pengetahuan dan peternakan Indones ia dimasa datang.
Bogor, Januari 2006
DAFTAR ISI
3 PENGGUNAAN MEDIUM CR1aa UNTUK PRODUKSI EMBRIO DOMBA IN VITRO………. 16
6 KESIMPULAN UMUM dan SARAN ……… 51
Kesimpulan Umum ………. 51
Saran ……… 51
DAFTAR TABEL
Halaman
3.1 Tingkat pematangan inti oosit domba dalam medium TCM-199 dan CR1aa ……….
23
3.2 Tingkat fertilisasi oosit domba dalam medium BO dan CR1aa … 28 3.3 Perkembangan embrio in vitro dalam medium TCM-199 dan
CR1aa ………
29
4.1 Jumlah folikel dan oosit yang terkoleksi dari pasangan ovarium dengan status reproduksi berbeda ……….
40
4.2 Tingkat kematangan inti oosit dari pa sangan ovarium dengan status reproduksi berbeda ………..
43
4.3 Tingkat fertilisasi oosit kualitas baik dari pasangan ovarium dengan status reproduksi berbeda ……….
45
4.4 Perkembangan embrio in vitro dari pasangan ovarium dengan status reproduksi berbeda ………..
DAFTAR GAMBAR
Halaman
2.1 Skema gelombang pertumbuhan folikel ……….. 6 3.1 Status inti oosit setelah pematangan in vitro ………... 22 3.2 Morfologi oosit domba sebelum dan sesudah maturasi in vitro... 25 3.3 Status inti oosit setelah fertilisasi in vitro……….... 26 3.4 Oosit setelah 18 jam IVF ………. 27 3.5 Perkembangan embrio domba in vitro ……… 30 4.1 Pengelompokkan ovarium berdasarkan status reproduksi
individu ………
DAFTAR LAMPIRAN
Halaman
1. PENDAHULUAN
Latar Belakang
Upaya peningkatan produktivitas hewan dapat dilakukan dengan menerapkan berbagai macam teknologi reproduksi seperti Inseminasi Buatan (IB), Produksi Embrio In Vitro (PEIV) dan Transfer Embrio (TE). Produksi embrio in vitro merupakan salah satu teknologi reproduksi yang terdiri dari proses pematangan (In Vitro Maturation, IVM), fertilisasi (In Vitro Fertilization, IVF) dan kultur embrio (In Vitro Culture, IVC) secara in vitro. Dengan teknik PEIV, materi genetik dari hewan yang mati mendadak atau sakit sehingga fungsi reproduksinya tidak dapat berjalan sebagaimana mestinya masih dapat diselamatkan. Disamping itu, PEIV dapat diguna kan untuk mempelajari berbagai teknologi reproduksi bantuan lainnya seperti kloning, stem cell untuk tujuan terapi dan lain sebagainya.
Banyak faktor yang mempengaruhi keberhasilan proses PEIV. Materi genetik yang digunakan dan sistim kultur sangat mene ntukan kualitas dan kuantitas embrio yang dihasilkan. Sistim kultur seperti pemilihan jenis medium yang digunakan untuk setiap tahapan produksi embrio yang berkaitan dengan pH, suhu dan osmolaritas, lingkungan untuk PEIV, lama inkubasi dan sebagainya akan sangat berpengaruh terhadap keberhasilan produksi embrio.
Ada banyak jenis medium yang digunakan untuk proses PEIV. Dalam proses produksi embrio in vitro, penggunaan medium yang sesuai sangat mempengaruhi kualitas embrio yang akan dihasilkan. Pada prinsipnya, medium yang digunakan untuk produksi embrio mengandung zat-zat yang dibutuhkan sebagai sumber energi, protein dan garam elektrolit dengan pH dan tekanan osmotik tertentu, sehingga dapat mendukung perkembangan oosit dan embrio secara in vitro.
Medium 199 (TCM-199) digolongkan ke dalam kelompok medium kompleks yang telah umum digunakan untuk produksi embrio sapi dan domba secara in vitro. Berdasa rkan komposisi bahan penyusunnya, medium sederhana terdiri dari larutan fisiologis yang mengandung garam-garam anorganik dan natrium bicarbonat sebagai penyangga serta pyruvat, laktat dan glukosa sebagai sumber energi (Gordon 1994). Medium Charles Rosenkrans 1 (CR1) merupakan salah satu contoh medium sederhana yang terdiri dari NaCl, KCl, NaHCO3 dan
selanjutnya mengalami penambahan komponen sumber energi yakni asam laktat, sodium piruvat dan glutamin serta asam-asam amino yang diperlukan untuk pertumbuhan embrio (Rosenkrans et al. 1993; Rosenkrans dan First 1994). Dengan adanya modifikasi dan penambahan substrat energi serta asam amino ke dalam medium CR1, maka selanjutnya medium ini disebut dengan medium CR1aa. CR1aa telah digunakan sebagai medium kultur embrio pada sapi (Rosenkrans et al. 1993; Rosenkrans dan First 1994), kucing (Fahrudin 2001), sebagai medium untuk ketiga tahapan produksi embrio kambing (Rusiyantono dan Boediono 2003) dan medium untuk fertilisasi dan kultur embrio domba (Djuwita
et al. 2005). Medium CR1aa relatif mudah dibuat, praktis dan berdasarkan komposisi bahan penyusunnya maka diharapkan medium ini dapat digunakan sebagai medium alternatif dalam proses produksi embrio in vitro. Oleh karena itu perlu dilakukan penelitian untuk membandingkan kemampuan medium CR1aa dengan TCM-199 dalam keseluruhan tahapan produksi embrio domba in vitro.
tidak terdapat corpus luteum (CL). Sisa folikel dominan yang telah ovulasi akan membentuk CL. Corpus luteum terdiri dari sel-sel yang akan menghasilkan hormon progesteron dan berguna dalam proses implantasi dan pemeliharaan kebuntingan. Keberadaan folikel dominan dan corpus luteum dalam ovarium akan memberikan pengaruh terhadap perkembanga n folikel dan status ovarium. Untuk mengetahui pengaruh keberadaan CL dan FD pada pasangan ovarium perlu dilakukan penelitian dengan melakukan pematangan oosit dan perkembangan embrio secara in vitro dengan memisahkan setiap pasangan ovarium berdasarkan status reproduksi dari masing-masing individu dengan melihat keberadaan CL dan FD pada ovarium.
Tujuan Penelitian
1. Mengkaji kemampuan medium TCM-199 dan CR1aa dalam proses pematangan oosit secara in vitro.
2. Mengkaji kemampuan medium BO dan CR1aa dalam proses fertilisasi in vitro.
3. Mengkaji kemampuan TCM -199 dan CR1aa dalam proses perkembangan embrio in vitro.
4. Mengkaji pengaruh keberadaan CL dan FD pada pasangan ovarium individu terhadap jumlah folikel dan jumlah oosit dengan berbagai kualitas yang terkoleksi.
5. Mengkaji pengaruh keberadaan CL dan FD terhadap tingkat pematangan, fertilisasi dan perkembangan embrio secara in vitro.
Manfaat Penelitian
Hasil penelitian diharapkan dapat memberi informasi mengenai jenis medium yang tepat dan status ovarium yang sebaiknya digunakan sebagai sumber oosit potensial untuk proses produksi embrio domba secara in vitro.
Hipotesis
Hipothesis yang dikemukakan untuk untuk mendahului penelitian ini adalah : 1. Medium CR1aa mempunyai potensi yang sama atau lebih baik daripada
medium standar dalam proses produksi embrio domba in vitro.
2. TINJAUAN PUSTAKA
Pertumbuhan dan Perkembangan Folikel
Satu siklus estrus terdiri dari fase folikular dan fase luteal. Fase folikular ditandai dengan pertumbuhan dan perkembangan folikel ovarium yang berlangsung selama 3-4 hari (Gordon 1997). Pada domba, sebanyak satu atau dua folikel besar menghasilkan estrogen yang dapat menekan pertumbuhan folikel kecil lainnya (Hafez dan Hafez 2000). Fase luteal berlangsung selama kurang lebih 13 hari dan ditandai dengan pematangan corpus luteum yang menghasilkan progesteron dengan konsentrasi yang mencapai puncak pada hari ke-6 setelah ovulasi. Selama periode siklus estrus tidak ada perbedaan nyata antara jumlah folikel yang terdapat pada ovarium kiri dan kanan (Gordon 1997). Setiap folikel sehat yang berdiameter 2 mm memiliki kesempatan untuk tumbuh menjadi folikel dominan yang siap untuk diovulasikan.
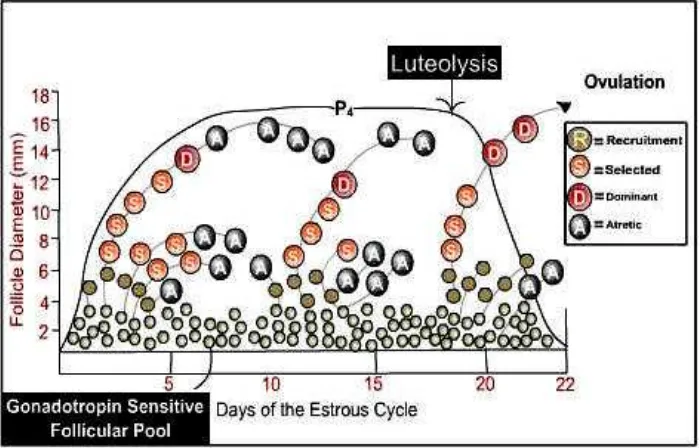
Gambar 2.1. Skema Gelombang Pertumbuhan Folikel (Sumber : Rasby dan Vinton 2001)
Proses pertumbuhan folikel, ovulasi dan pembentukan CL sangat dipengaruhi oleh sirkulasi hormon reproduksi dalam tubuh. Gonadotrophin Releasing Hormone (GnRH) yang dihasilkan oleh hypothalamus berfungsi menstimulasi pengeluaran Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH) oleh hipofisa anterior sebagai respons terhadap estrogen atau progesteron. Ketika proses pertumbuhan folikel kecil (recruitment) berlangsung, mRNA untuk P450 aromatase meningkat. Pada saat seleksi morfologis, folikel dominan mengandung estrogen dengan konsentrasi tinggi dalam cairan folikel dan segera setelah proses seleksi berakhir, maka folikel dominan banyak mengandung mRNA untuk reseptor gonadotrophin dan hormon steroid (Fortune et al. 2001).
progesteron (Binelli et al. 1999) dan terbatasnya frekuensi LH sehingga terjadilah atresi folikel dominan tersebut. Folikel besar yang muncul pada saat luteolisis akan menjadi folikel dominan dan selanjutnya mengalami ovulasi pada fase folikular (Inskeep 2004). Pada domba dan kambing, folikel dominan dari gelombang folikel kedua yang dapat melakukan ovulasi (Evans 2003b).
Fase folikular dimulai dengan penghilangan efek negatif dari progester on sehingga konsentrasi GnRH kembali meningkat. Peningkatan konsentrasi GnRH akan menyebabkan peningkatan produksi FSH dan LH sehingga dapat mendukung pertumbuhan folikel. Folikel de Graaf akan menghasilkan lebih banyak estrogen. Jika estrogen telah menc apai batas ambang maksimal, maka akan memicu pengeluaran LH sehingga terjadilah ovulasi. Pada fase luteal, konsentrasi LH tidak dapat mencapai batas ambang maksimal, sehingga folikel dominan akan mengalami regresi dan penurunan sekresi estradiol dan inhibin menyebabkan terbentuknya gelombang folikel baru. Folikel dominan yang mengandung estradiol dan inhibin dengan konsentrasi tinggi berhubungan dengan penekanan konsentrasi FSH dalam sirkulasi darah (Parker et al. 2002; Adams et al. 1992).
Pematangan Oosit In Vitro
singkat yaitu sekitar 14-18 jam setelah inkubasi. Selanjutnya oosit akan mencapai tahap metafase II (M-II) yang ditandai dengan terbentuknya badan kutub I sebagai oosit matang yang siap untuk difertilisasi (Pawshe et al. 1994). Banyak oosit yang mati pada tahap GV, sebelum terjadinya pertumbuhan folikel akibat abnormalitas kromosom maupun kerusakan mitokondria (Cecconi 2002). Pematangan sitoplasma yang sangat mempengaruhi proses produksi embrio normal secara in vitro (Lonergan et al. 1994), ditandai dengan perpindahan granula korteks ke arah perifer, terjadi peningkatan jumlah dan perubahan morfologi mitokondria, modifikasi ultrastruktur dari kompleks golgi, serta terjadi akumulasi ribosom (Fulka et al. 1998).
Oosit yang dimatangkan secara in vitro dapat mengalami perkembangan yang menyerupai in vivo dengan menggunakan media yang mengandung komposisi dan keadaan yang meniru kondisi in vivo. Oosit dapat diambil langsung dengan berbagai cara seperti aspirasi, puncture dan penyayatan (slicing) (Wani et al. 1999) dari folikel berdiameter 3-5 mm (Moor et al. 1997) dan dimatangkan dalam media yang sesuai untuk kebutuhan metabolisme oosit selama proses pematangan. Oosit yang berasal dari folikel dengan diameter <2 mm akan mencapai metafase II dengan persentase yang rendah. Oosit dengan diameter 110-120 µm, memiliki kemampuan mencapai tahap M-II lebih tinggi dan dapat dikoleksi dari folikel berukuran 3-4 dan > 4 mm (Fair et al. 1995). Oosit dengan diameter <100 µm tidak dapat melakukan sintesis RNA maternal dan beberapa protein esensial dengan sempurna sehingga tidak dapat mencapai tahap M-II (Otoi
et al. 1997).
Ekspansi sel kumulus berguna untuk memfasilitasi pelepasan Cumulus Oocyte Complex (COC) dari dinding folikel, sehingga terjadi ovulasi dan juga mempercepat terjadinya reaksi akrosom spermatozoa. Ekspansi sel kumulus selama proses maturasi in vitro dipengaruhi oleh hormon gonadotrophin dan berguna untuk meningkatkan kemampuan fertilisasi dan perkembangan embrio selanjutnya, sehingga ekspansi sel kumulus dijadikan sebagai salah satu parameter keberhasilan IVM dan kriteria pemilihan oosit yang akan digunakan untuk IVF.
Medium yang diguna kan untuk pematangan oosit dapat memberikan pengaruh tidak hanya untuk proses pematangan oosit tetapi juga untuk perkembangan embrio. Berbagai medium yang telah umum digunakan untuk pematangan oosit adalah seperti Tissue Culture Medium 199 (TCM-199),
Potassium Simplex Optimized Medium (KSOM), Human Tubal Fluid (HTF) dan sebagainya (Gardner dan Lane 2000). Ke dalam media tersebut juga perlu ditambahkan serum, hormon gonadotrophin, serta antibiotik yang dapat membantu memaksimalkan hasil pematangan (Goto dan Iritani 1992).
Penambahan 1 µg/ml estradiol ke dalam medium TCM-199 tanpa serum dapat menurunkan persentase M-II dan tingkat blastosis secara nyata serta meningkatkan kerusakan inti (Beker et al. 2002). Penambahan LH ke dalam medium maturasi menyebabkan peningkatan persentase metafase II pada oosit sapi (Nakagawa dan Leibo 1997). Kombinasi rekombinan human FSH dan LH dalam medium maturasi terbukti dapat meningkatkan tingkat kematangan oosit domba (Accardo et al. 2004).
kehadiran serum sebagai sumber nitrogen juga menyebabkan perbedaan morfologis blastosis dari bentuk normal yang ditandai dengan adanya vesikel-vesikel seperti lemak dalam sitoplasma (Gardner et al. 1994).
Metabolisme oksidatif oosit meningkat selama proses pematangan. Hal ini ditandai dengan peningkatan metabolisme piruvat, glycine dan glutamin pada jam ke 12 dan 18 kultur. Namun metabolisme glukosa sangat rendah selama proses maturasi (Rieger 1996). Penambahan cysteine sebagai prekursor glutathion yang mengalami reduksi (GSH) ke dalam medium maturasi dapa t meningkatkan aktivitas sel kumulus untuk membentuk glutathion. Disamping itu, taurin dan hypotaurin juga akan meningkatkan synthesis GSH selama proses pematangan oosit (Wang et al. 1997; Niwa 1993). Oosit yang matang akan memiliki konsentrasi GSH yang lebih tinggi sehingga akan meningkatkan kemampuan pembentukan pronukleus jantan dalam oosit tersebut. Sintesis GSH selama pematangan oosit sangat berguna bagi proses dekondensasi kromatin spermatozoa untuk membentuk pronukleus jantan (Yoshida et al. 1992).
Disamping hal tersebut diatas, keberhasilan pematangan oosit in vitro juga dipengaruhi oleh lamanya waktu inkubasi pada inkubator CO2 5%. Pada
kambing, lamanya pematangan in vitro dilakukan selama 24-26 jam. Jika waktunya kurang dari 24 jam, maka oosit umumnya baru berada pada tahap GV dan belum mencapai tahap metafase II. Sedangkan jika lebih dari 30 jam inkubasi, akan terjadi proses parthenogenesis spontan (Boediono et al. 2000). Pada domba, tingkat maturasi oosit tidak mengalami perbedaan yang nyata setelah inkubasi selama 20, 24, 28 maupun 32 jam. Meskipun periode inkubasi 32 jam ditemukan adanya oosit yang mengalami kelainan kromatin (Jaswandi et al. 2001). Komposisi gas dalam lingkungan kultur juga berpengaruh terhadap keberhasilan pematangan oosit dan kultur embrio. Jika tekanan oksigen diturunkan (CO2 5%; O2 5%; N2 90%), maka daya tahan embrio lebih baik pada
embrio yang dikultur tanpa co-culture dan ditambahkan serum. Namun jika dikultur pada CO2 5%, maka persentase blastosis tertinggi diperoleh dari
penggunaan co-culture dan tanpa serum (Watson et al. 1994). Perkembangan blastosis menurun jika dikultur dalam kondisi CO2 5%, O2 7% dan N2 88%
dengan konsentrasi CO2 5% menghasilkan persentase morula dan blastosis yang
lebih tinggi dan berbeda nyata dengan oosit yang dikultur dalam lingkungan dengan kombinasi gas CO2 5%, O2 5% dan N2 90% (De Azambuja et al. 1993).
Osmolaritas medium yang dipengaruhi oleh konsentrasi garam anorganik yang terkandung dalam medium dapat mempengaruhi tingkat pematangan oosit (Mc Gaughey 1977) dan perkembangan embrio (Galvin et al. 1993). Oosit dan embrio mencit dan hamster dapat berkembang dalam medium dengan osmolaritas 200-350 mOsM, namun pe rkembangan lebih baik dalam medium dengan osmolaritas 275-295 mOsM (Gardner dan Lane 2000). Medium dengan konsentrasi NaCl yang tinggi dengan osmolaritas 355 mOsM menyebabkan banyak oosit matang dengan degenerasi kromosom (Mc Gaughey 1977).
Kapasitasi dan Fertilisasi In Vitro
Kapasitasi merupakan syarat mutlak bagi spermatozoa untuk dapat membuahi sel telur, baik secara in vivo maupun in vitro. Selama kapasitasi terjadi perubahan pada membran plasma dan pelepasan enzim hyaluronidase serta zona lysin dari akrosom. Proses kapasitasi in vitro menyebabkan terjadinya peningkatan motilitas spermatozoa yang dikenal dengan ‘hyperaktivasi’. Akibat dari proses ini adalah terjadinya peningkatan motilitas spermatozoa dan reaksi akrosom sehingga spermatozoa mampu menembus corona radiata dan zona pellusida sel telur.
Perubahan molekuler yang terjadi selama proses kapasitasi meliputi perubahan konsentrasi kalsium intraseluler, perubahan distribusi dan komposisi lemak serta perubahan pada fosforilasi protein dan aktivitas kinase (Baldi et al. 1996). Selama kapasitasi berlangsung, kalsium ekstraseluler akan masuk ke dalam sel sehingga konsentrasi kalsium intraseluler meningkat. Disamping kalsium, juga terjadi perubahan konsentrasi K+, Na+ dan Cl- intraseluler.
Disamping itu, ke dalam medium BO juga ditambahkan sodium piruvat dan lactat sebagai sumber energi, bovine serum albumin (BSA) serta caffeine dan heparin. Medium BO sudah digunakan sebagai medium IVF pada berbagai species seperti sapi (Boediono et al. 1994), kambing (Boediono et al. 2000) dan babi (Yang et al.
1995).
Secara in vitro, kapasitasi biasanya dapat diinduksi dengan penambahan
calcium ionophores, kafein maupun heparin ke dalam medium atau dapat juga dilakukan dengan memaparkan spematozoa ke dalam tripsin dan pada suhu 5ºC dalam pengencer kuning telur (Uguz et al. 1994). Disamping itu penambahan kombinasi kafein dan heparin dapat meningkatkan kemampuan spermatozoa untuk melakukan penetrasi ke dalam sel telur. Heparin dapat meningkatkan kemampuan spermatozoa sapi berikatan dengan protein zona pellusida (Watanabe
et al. 1997). Heparin sangat dibutuhkan untuk proses kapasitasi yakni 4-6 jam sebelum spermatozoa memiliki kemampuan untuk melakukan fertilisasi.
Fertilisasi merupakan proses kompleks yang menghasilkan penggabungan dua gamet, restorasi jumlah kromosom somatik dan mulainya perkembangan suatu individu baru (Gordon 1994). Fertilisasi secara in vitro hanya dapat terjadi setelah didahului oleh proses kapasitasi spermatozoa. Penetrasi spermatozoa ke dalam oosit akan menyebabkan oosit menyelesaikan pembelahan meiosis II yang ditandai dengan terbentuknya badan kutub II. Selanjutnya kromosom oosit akan membentuk pronukleus betina dan kromatin yang terdapat pada kepala spermatozoa akan mengalami dekondensasi dan kemudian membentuk pronukleus jantan (Cleine 1996).
Segera setelah penetrasi spermatozoa, maka konsentrasi cytostatic factor
Periode inkubasi spermatozoa dan oosit untuk fertilisasi in vitro tidak mempengaruhi perkembangan embrio pada tahap berikutnya (Sumantri et al.
1997). Inkubasi spermatozoa dan oosit untuk keperluan IVF dilakukan selama 17-24 jam pada kambing (Boediono et al. 2000), 18 jam pada domba (Jaswandi et al. 2001) dan 5-15 jam pada sapi (Sumantri et al. 1997). Keadaan abnormal dapat terjadi apabila hanya salah satu pronukleus yang berkembang (haploid) maupun adanya kejadian polispermia sehingga akan terbentuk embrio yang memiliki lebih dari dua pronukleus.
Perkembangan Embrio In Vitro
Zigot yang terbentuk dari hasil fertilisasi in vitro dapat tumbuh dan membelah menjadi 2, 4, 8 dan 16 sel sampai membentuk morula dan blastosis dalam medium kultur seperti TCM-199, Ham’s F-10, HTF, KSOM dan lain sebagainya (Gardner dan Lane 2000) yang mengandung protein, sumber energi dan buffer. Disamping itu, kultur embrio perlu dilakukan dalam kondisi CO2 5%
agar sel dapat tumbuh dan membelah secara normal. Metode kultur embrio secara in vitro sangat mempengaruhi keberhasilan perkembangan embrio lebih lanjut dan proses implantasi pada tubuh resipien (Petters 1992).
amino dalam medium juga dapat meningkatkan level amonium yang dapat menghambat perkembangan blastosis dan pembelahan sel. Disamping itu, kehadiran asam amino dalam medium dapat meningkatkan kejadian fragmentasi sitoplasma pada embrio domba. Untuk mengatasi hal tersebut medium kultur harus diganti dengan medium baru setiap 48-72 jam (Gardner et al. 1994).
Perkembangan embrio tahap awal sering mengalami hambatan. Embrio mencit dan tikus sering mengalami hambatan pada tahap dua sel, sedangkan embrio sapi dan domba pada tahap delapan sel (Gordon 1994). Keadaan tersebut dapat diatasi dengan mengganti glukosa sebagai sumber energi dengan piruvat dan laktat di dalam medium kultur yang digunakan. Leese et al. (1993) melaporkan adanya korelasi antara perkembangan blastosis dengan penggunaan glukosa. Glukosa lebih dibutuhkan selama perkembangan blastosis sedangkan piruvat digunakan oleh embrio selama tahap preimplantasi sebelum mencapai blastosis. Pada perkembangan embrio sapi tahap awal, terjadi peningkatan metabolisme glutamin dan piruvat namun metabolisme glukosa yang terjadi sangat rendah. Metabolisme glukosa baru mengalami peningkatan setelah tahap 8-16 sel, yang berhubungan dengan aktivasi genom embryonic (Rieger 1996). Glukosa akan digunakan oleh embrio domba untuk diubah menjadi laktat dan dikeluarkan dari sel (Gardner et al. 1993).
Hambatan perkembangan pada tahap 8 sel pada sapi berhubungan dengan kualitas sitoplasma oosit. Oosit menggunakan seluruh mRNA dan protein untuk mencapai tahap 4 atau 5 sel, meskipun embrio yang gagal untuk melakukan transkripsi genomnya sendiri akan gagal untuk berkembang (Meireless et al.
3. PENGGUNAAN MEDIUM CR1aa UNTUK PRODUKSI
EMBRIO DOMBA
IN VITRO
ABSTRACT
The aim of this study was to investigate the capacity of CR1aa as a simple medium for maturation, fertilization and culture of ovine embryo in vitro. Oocytes were collected by slicing method in Phosphate Buffer Saline (PBS) supplemented with 5% Fetal Bovine Serum (FBS) and 100 IU/ml penicillin streptomycin. Oocytes were matured in Tissue Culture Medium (TCM)-199 as control or CR1aa as treatment medium. Both maturation medium were supplemented with 10% Fetal Bovine Serum (FBS), 10 IU/ml Follicle Stimulating Hormone (FSH), 10 IU/ml Luteinizing Hormone (LH), 1 ìg/ml Estradiol and 100 IU/ml penicillin-streptomycin. Oocytes were incubated in 5% CO2 incubator,
38 C for 24 h. Matured oocytes were fertilized in BO or CR1aa medium. Both fertilization medium were supplemented with caffeine benzoate and heparin to improve motility and capacitation of spermatozoa. After 18 h in vitro fertilization, oocytes were cultured in TCM -199 or CR1aa medium, both supplemented with 5% FBS, 5 µg/ml insulin and 100 IU/ml penicillin streptomycin. Results showed that the highest maturation rate was found in TCM -199 medium (73.27%) and significantly different (P<0.05) from CR1aa (52.88%). Fertilization rate in CR1aa medium (67.59%) was higher (P<0.05) than in BO medium (52.94%). Furthermore, there was no significant difference (P>0.05) between cleavage rate of ovine embryos in TCM -199 or CR1aa medium (39.45%; 43/109 vs 50.94%; 54/106). In conclusion, optimum result on ovine in vitro embryo production can be achieved from a combination of TCM -199 as maturation medium and CR1aa as fertilization and culture medium.
ABSTRAK
Penelitian dilakukan untuk mengetahui kemampuan CR1aa sebagai semi-defined media dalam proses pematangan, fertilisasi dan kultur embrio domba secara in vitro. Oosit dikoleksi dengan teknik pencacahan dalam medium
Phosphate Buffer Saline (PBS) yang disuplementasi dengan Fetal Bovine Serum
(FBS) 5% dan penicilin streptomycin 100 IU/ml. Selanjutnya oosit dimaturasi dalam dua medium pematangan yaitu Tissue Culture Medium (TCM)-199 sebagai kontrol atau CR1aa sebagai perlakuan dan disuplementasi dengan FBS 10%,
Follicle Stimulating Hormone (FSH) 10 IU/ml, Luteinizing Hormone (LH) 10 IU/ml, Estradiol 1 µg/ml dan penicillin streptomycin 100 IU/ml. Pematangan oosit dilakukan selama 24 jam dalam inkubator CO2 5%, 38°C. Selanjutnya oosit
difertilisasi dalam medium BO atau CR1aa. Ke da lam masing-masing medium ditambahkan kafein 2.5 mM dan heparin 20 µg/ml untuk meningkatkan motilitas dan kapasitasi spermatozoa. Setelah 18 jam fertilisasi dalam inkubator CO2 5%,
penelitian menunjukkan bahwa tingkat maturasi dari oosit yang dimatangkan dalam medium TCM-199 (73.27%) lebih tinggi (P<0.05) daripada CR1aa (52.88%). Tingkat fertilisasi dalam medium CR1aa (67.59%) lebih tinggi (P<0.05) daripada medium BO (52.94%). Tingkat pembelahan embrio dalam medium TCM -199 tidak berbeda (P>0.05) dengan CR1aa (39.45%; 43/109 vs 50.94%; 54/106). Dari hasil penelitian dapat disimpulkan bahwa untuk mendapatkan hasil yang optimal dalam proses produksi embrio domba in vitro
dapat dilakukan dengan menggunakan kombinasi medium TCM-199 sebagai medium pematangan dan CR1aa sebagai medium fertilisasi dan kultur.
PENDAHULUAN
Keberhasilan proses produksi embrio in vitro dipengaruhi oleh berbagai hal, seperti jenis medium yang digunakan pada tiap tahapan (maturasi, fertilisasi dan kultur), pH dan osmolaritas medium, serta lingkungan kultur yang meliputi suhu, kelembaban dan keseimbangan gas O2 dan CO2. Ada banyak jenis medium
yang telah umum digunakan untuk produksi embrio. Medium komersial seperti
Tissue Culture Medium-199 (TCM -199) merupakan salah satu contoh jenis medium yang sering dipakai pada proses produksi embrio sapi (Gandhi et al. 2000; Kochhar et al. 2003), babi (Wang et al. 1997), domba (O’Brien et al. 1996), kambing (Boediono et al. 2000), manusia (Roberts et al. 2002), kuda (Shabpareh
et al. 1993). Komposisi bahan penyusun TCM-199 terdiri dari garam anorganik untuk mengatur osmolaritas medium, asam amino yang mendukung proses pematangan dan perkembangan sel oosit, vitamin, glukosa dan beberapa bahan lain yang mendukung proses pematangan inti oosit dan perkembangan embrio selanjutnya serta natrium bicarbonat yang akan mempertahankan derajat keasaman (pH) medium.
babi (Wang et al. 1997), Charles Rosenkrans (CR) 1aa untuk embrio pada sapi (Rosenkrans et al. 1993; Rosenkrans dan First 1994), oosit onta (Abdoon 2000), oosit dan embrio kerbau (Abdoon et al. 2001), embrio kucing (Fahrudin 2001), oosit dan embrio kambing(Rusiyantono dan Boediono 2003). Medium sederhana tersebut juga dikenal dengan defined medium karena komposisinya diketahui dengan jelas dan dapat dibuat sendiri. Hal tersebut akan memudahkan dan menurunkan biaya proses produksi embrio secara in vitro.
Komposisi medium CR1aa terdiri dari garam anorganik (NaCl, KCl),
buffer (NaHCO3) dan sumber energi yakni asam laktat, sodium piruvat dan
BAHAN DAN METODE
Pematangan Oosit In Vitro
Oosit dikoleksi dari ovarium yang diperoleh dari rumah potong hewan (RPH) dan ditempatkan dalam medium transportasi NaCl fisiologis pada suhu 30 C. Ovarium tersebut dibawa ke laboratorium dalam waktu kurang dari tiga jam setelah pemotongan. Oosit dikoleksi menurut metode Jaswandi et al. (2001) dengan mencacah bagian korteks ovariu m menggunakan pisau bedah steril ukuran 20. Koleksi oosit dilakukan menggunakan larutan dulbecco’s Phosphate Buffer Solution (dPBS; Gibco,Grand Island, NY, USA) yang disuplementasi dengan
Fetal Bovine Serum (FBS; Gibco,Grand Island, NY, USA) 5% dan penicillin-streptomycin (Gibco,Grand Island, NY, USA) 100 IU/ml. Oosit yang digunakan adalah oosit yang memiliki sitoplasma yang homogen, kompak dan memiliki lebih dari dua lapis sel kumulus. Oosit hasil koleksi dicuci dalam medium koleksi dan medium maturasi masing-masing sebanyak dua kali. Selanjutnya oosit dimatangkan dalam medium TCM-199 (Sigma, USA) atau CR1aa yang disuplementasi dengan FBS 10%, Follicle Stimulating Hormone (FSH; Antrin®, Denka Pharmaceutical Co., Kawasaki, Japan) 10 IU/ml, Luteinizing Hormone
(LH; Chorulon®, Intervet International B.V., Boxmer, Holland) 10 IU/ml, Estradiol (Oestradiol Benzoate®, Intervet International B.V., Boxmer, Holland) 1 ìg/ml dan penicillin-streptomycin (Gibco, Grand Island, NY, USA) 100 IU/ml. Pematangan oosit dilakukan dalam medium maturasi dalam bentuk drop masing-masing 50 µl untuk 10-15 oosit dan ditutup dengan mineral oil (Sigma Chemical Co. St. Louis MO, USA) dalam inkubator CO2 5%, 38 C selama 24 jam.
Kapasitasi Spermatozoa dan Fertilisasi In Vitro
Kemudian dilakukan swim-up untuk menyeleksi spermatozoa berdasarkan motilitasnya dalam inkubator CO2 selama 60 menit. Spermatozoa yang terseleksi
diencerkan dalam medium fertilisasi yang mengandung caffeine benzoate 2.5 mM dan heparin (Shimizu, Japan) 20 µg/ml. Konsentrasi spermatozoa yang digunakan untuk keperluan IVF adalah sebesar 2.106 spermatozoa/ml.
Spermatozoa disiapkan dalam bentuk drop masing-masing sebanyak 100 ì l dalam cawan petri untuk 20-25 oosit dan ditutup dengan mineral oil (Boediono
et al. 2003). Oosit yang telah dicuci dalam medium fertilisasi sebanyak dua kali untuk keperluan fertilisasi kemudian diequilibrasi selama 30 menit sebelum IVF. Oosit kemudian dipindahkan ke dalam drop spermatozoa dan diinkubasi selama 18 jam dalam inkubator CO2 5%, 38 C.
Perkembangan Embrio In Vitro
Setelah 18 jam, oosit dicuci dalam medium kultur sebanyak dua kali dan dipindahkan ke dalam 100 ìl medium kultur (TCM-199 atau CR1aa) yang disuplementasi dengan FBS 10%, insulin (Sigma, USA) 5 µg/ml dan penisillin-streptomisin 100 IU/ml. Perkembangan embrio diamati sampai hari kelima. Penggantian medium IVC dilakukan setiap 48 jam.
Evaluasi
diberi larutan kuteks bening untuk selanjutnya dilakukan pengamatan morfologi inti dengan mikroskop fase kontras.
Evaluasi tingkat kematangan inti dinilai dengan cara menghitung jumlah oosit pada setiap tahap pembelahan meiosis. Pada penelitian ini status inti oosit dikelompokkan menjadi Germinal Vesicle Break Down (GVBD), Metaphase I (M I) dan Metaphase II (M II). GVBD ditandai dengan robeknya membran inti dan inti sudah tidak terlihat jelas, M I ditandai dengan adanya kromosom homolog yang berderet di bidang ekuator serta M II ditandai dengan adanya badan kutub I dan susunan kromosom yang sama dengan tahap M I. Oosit yang telah matang akan berada pada tahap Metaphase II.
Proses fertilisasi yang diamati meliputi dekondensasi kepala spermatozoa dan pembentukan pronukleus (PN) jantan. Sel telur yang telah mengalami fertilisasi ditandai dengan terbentuknya dua pronukleus (jantan dan betina, 2 PN) atau lebih (>2PN) dalam sitoplasma sel telur. Tingkat fertilisasi merupakan perbandingan antara jumlah sel telur yang dibuahi (membentuk dua atau lebih pronukleus) dengan jumlah keseluruhan sel telur yang difertilisasi.
Tingkat pembelahan dan perkembangan embrio diketahui dengan pengamatan menggunakan mikroskop inverted pada hari kedua hingga kelima. Tingkat pembelahan diperoleh dengan menghitung persentase jumlah zigot yang berhasil membelah dibandingkan dengan keseluruhan jumlah zigot yang dikultur. Sedangkan tingkat perkembangan embrio diperoleh dengan menghitung jumlah embrio yang mencapai tahap 4 dan 8 sel serta morula dibandingkan dengan keseluruhan jumlah zigot yang membelah.
Analisis Data
Data dianalisis dengan analisis sidik ragam (ANOVA) dalam bentuk rancangan acak lengkap masing-masing dua perlakuan dan tujuh kali ulangan. Uji terhadap perbedaan perlakuan dilakukan dengan Duncan’s Multiple Range Test
HASIL DAN PEMBAHASAN
Hasil penelitian ini terdiri dari tiga bagian, yaitu: 1) Tingkat pematangan inti oosit dalam medium TCM -199 dan CR1aa, 2) Tingkat fertilisasi oosit dalam medium BO dan CR1aa, 3) Tingkat perkembangan embrio in vitro.
Tingkat Pematangan Inti Oosit
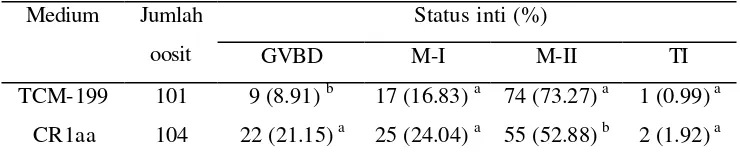
Pematangan oosit bertujuan untuk menghasilkan oosit sekunder haploid yang memiliki komponen sel yang diperlukan dalam proses fertilisasi dan perkembangan embrio. Tahapan pematangan inti yang diamati pada penelitian ini dikelompokkan menjadi tiga ta hap yakni GVBD (Germinal Vesicle Break Down), M-I (Metafase I) dan M-II (Metafase II) (Gambar 3.1).
Gambar 3.1. Status inti oosit setelah pematangan in vitro. Tanda panah menunjukkan status inti pada tahap: A. GVBD (Germinal Vesicle Break Down), B. M-I (Metafase I), C. M-II (Metafase II). Bar = 50
µm.
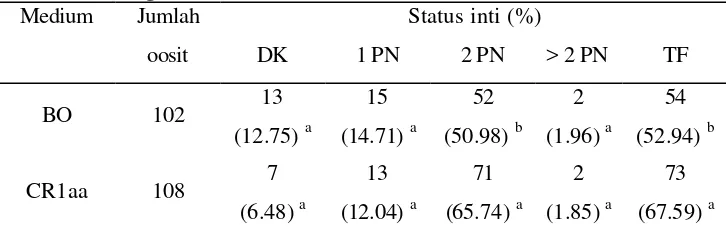
Hasil pematangan inti oosit domba in vitro dalam medium TCM-199 dan CR1aa terlihat pada Tabel 3.1. Oosit yang dimatangkan dalam medium TCM-199 mencapai tingkat pematangan yang lebih tinggi (P<0.05) dibandingkan dengan medium CR1aa. Oosit yang mencapai tahap metafase II setelah dimatangkan selama 24 jam dalam TCM -199 mencapai 73.27%, sedangkan dalam medium CR1aa hanya 52.88%. Hal ini diduga karena perbedaan komponen penyusun kedua jenis medium yang berpengaruh terhadap tekanan osmotik medium serta metabolisme sel secara keseluruhan.
GVBD
M-I
M-II
B
Tabel 3.1 Tingkat pematangan inti oosit domba dalam medium TCM-199 Ket. GVBD: Germinal Vesicle Break Down; M -I: Metafase I; M -II: Metafase II. Huruf berbeda dalam kolom yang sama menunjukkan perbedaan nyata (P<0.05).
Hasil yang diperoleh berbeda dengan laporan Rusiyantono dan Boediono (2003) yang juga menggunakan medium CR1aa sebagai medium maturasi bagi oosit kambing. Setelah dimatangkan selama 26 jam in vitro dalam medium CR1aa, oosit kambing yang mencapai tahap M-II adala h sebanyak 88% dan tidak berbeda nyata dengan oosit yang dimatangkan dalam medium TCM-199 (82.3%). Jaswandi et al. (2001) yang menggunakan TCM -199 sebagai medium pematangan oosit domba selama 24 jam memperoleh persentase M-II sebesar 71%. Abdoon (2001) melaporkan bahwa oosit onta yang dimatangkan selama 36 jam dalam medium CR1aa dapat mencapai tahap M-II sebanyak 85.4%. Perbedaan hasil yang diperoleh ini diduga karena perbedaan jenis hewan yang digunakan dan perbedaan lamanya proses pematangan oosit in vitro yang dilakukan.
Jumlah oosit yang tertahan pada fase GVBD dalam medium CR1aa lebih tinggi dan berbeda nyata dengan TCM-199 (P<0.05). Komposisi bahan penyusun TCM-199 sebagai medium komersial lebih kompleks karena terdiri dari sumber energi, garam anorganik, buffer, asam amino dan vitamin yang akan mendukung pematangan inti oosit secara in vitro. Sehingga kemungkinan proses metabolisme sel menjadi lebih optimal dan oosit dapat mencapai tahapan metafase II sebagai oosit matang. Tidak diketahui secara pasti apakah keseluruhan komponen yang terdapat dalam TCM -199 tersebut dibutuhkan atau bahkan memberikan efek inhibitor pada konsentrasi tertentu (Yang et al. 1995).
Sodium piruvat sebagai sumber energi utama selama proses maturasi oosit diketahui berguna untuk meningkatkan kemampuan pematangan oosit sapi (Geshi
mempengaruhi tingkat pematangan inti oosit. Penggunaan piruvat dan produksi laktat pada tiap oosit berbeda tergantung pada tahapan pematangan inti, dimana penggunaan piruvat dan produksi laktat akan lebih tinggi pada saat GVBD daripada tahap pengeluaran polar body (Roberts et al. 2002).
Medium CR1aa merupakan semi -defined media yang terdiri dari NaCl dan KCl sebagai garam anorganik, sodium piruvat, asam laktat dan glutamin sebagai sumber energi dan NaHCO3 sebagai buffer serta asam amino esensial dan
nonesensial yang diperlukan bagi metabolisme embrio pre dan pasca implantasi. Glutamin dapat dimetabolisme oleh sel oosit yang dimatangkan dengan ataupun tanpa sel kumulus (Rieger 1996). Glutamin merupakan substrat sumber energi sebagai pengganti glukosa yang berguna bagi perkembangan embrio sapi tahap awal (Moore dan Bandioli 1993) dan berguna untuk mengatasi hambatan perkembangan tahap dua sel pada embrio hamster (Barnett dan Bavister 1996). Pada pematangan oosit sapi in vitro, metabolisme piruvat, glutamin dan glycin meningkat secara nyata setelah 12-18 jam kultur. Disamping itu metabolisme glutamin semakin meningkat bersama dengan adanya suplementasi LH ke dalam medium (Rieger 1996). Kombinasi piruvat dan laktat dapat meningkatkan perkembangan embrio sapi in vitro (Rosenkrans et al. 1993). Walaupun tingkat kematangan inti dalam medium CR1aa dapat mencapai angka 52.88%, namun tidak cukup mampu mengimbangi kemampuan TCM-199 dalam mematangkan inti oosit domba.
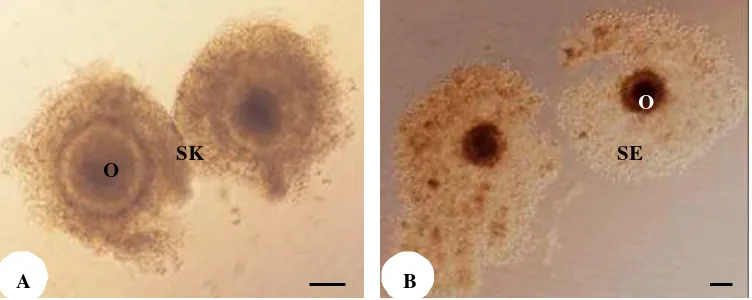
Tingkat pematangan oosit secara in vitro juga dipengaruhi oleh kualitas oosit yang digunakan. Bilodeau-Goeseels dan Panich (2002) menyatakan persentase tingkat pembelahan sel yang berasal dari oosit yang memiliki lebih dari lima lapis sel kumulus mencapai angka yang lebih tinggi dan berbeda nyata daripada tingkat pembelahan sel yang berasal dari oosit dengan lapisan sel kumulus kurang dari lima lapis, walaupun sitoplasmanya homogen. Keberadaan sel kumulus dapat mendukung pematangan oosit melalui zat metabolit yang dihasilkan dan disekresikan melalui mekanisme gap junction ke sel oosit. Ekspansi kumulus dapat didukung oleh penambahan sel granulosa dari folikel, walaupun menurut penelitian Setiadi (2002) tidak terdapat perbedaan nyata pada tingkat pematangan inti antara oosit yang dimatangkan dengan co-culture sel granulosa folikel dengan yang tidak. Pada penelitian ini sel-sel kumulus dalam medium TCM -199 dan CR1aa sama-sama mengalami ekspansi setelah 24 jam proses maturasi oosit (Gambar 3.2).
Gambar 3.2 Perkembangan oosit domba in vitro. A. oosit sebelum mengalami pematangan yang ditandai dengan adanya sel-sel kumulus yang kompak, B. oosit setelah proses maturasi in vitro ditandai dengan terjadinya ekspansi sel-sel kumulus. O: oosit, SK: sel kumulus, SE: sel kumulus ekspansi. Bar = 100 µm.
Oosit yang tidak matang dapat disebabkan karena degenerasi dan juga karena berasal dari folikel berdiameter kurang dari 2 mm. Hal tersebut dimungkinkan karena metoda koleksi oosit yang digunakan dengan cara pencacahan mengakibatkan semua folikel dengan berbagai ukuran menjadi ikut
O SK
O
SE
tersayat. Sebagian besar oosit yang berasal dari folikel berdiameter kurang dari 2 mm akan terhenti pada tahap M-I (de Smedt et al. 1992).
Tingkat Fertilisasi Oosit
Oosit hasil pematangan dalam medium TCM-199, selanjutnya difertilisasi secara in vitro dalam dua jenis medium yaitu BO (Brackett dan Oliphant 1975) atau CR1aa yang disuplementasi dengan caffeine dan heparin. Pengamatan terhadap perkembangan inti oosit dan spermatozoa setelah fertilisasi dilakukan dengan membedakan menjadi tiga tahap yaitu dekondensasi kepala spermatozoa (DK), satu pronukleus (1PN), dua pronukleus (2PN) dan lebih dari 2 pronukleus (>2PN) (Gambar 3.3). Tingkat fertilisasi ditandai dengan terbentuknya dua atau lebih pronukleus dalam oosit. Sel-sel kumulus yang mengalami ekspansi pada saat pematangan terlepas akibat adanya enzim hyaluronidase yang dilepaskan oleh spermatozoa pada saat fertilisasi (Gambar 3.4).
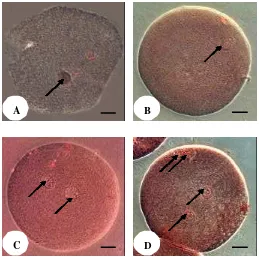
Gambar 3.3. Status inti oosit setelah fertilisasi in vitro. Tanda panah menunjukkan status inti pada tahap: A. Dekondensasi Kepala (DK) spermatozoa, B. 1 Pronukleus (PN), C. 2 PN, D. 4 PN. Bar = 50 µm.
B
C D
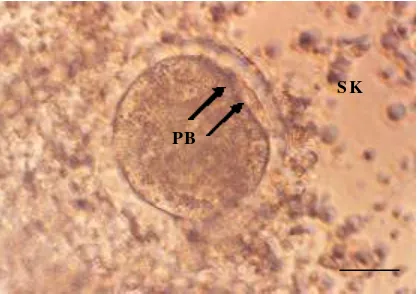
Gambar 3.4 Oosit setelah 18 jam IVF. Terlihat sel kumulus (SK) tidak lagi kompak dan tampak adanya 2 polar body (PB) yang keluar akibat adanya aktivasi spermatozoa ke dalam oosit. Bar = 50 µm.
Oosit yang mencapai tingkat fertilisasi tertinggi diperoleh dari medium CR1aa dan berbeda nyata dengan medium BO (P<0.05) (Tabel 3.2). Oosit yang dapat membentuk 2 PN dalam medium CR1aa mencapai 65.74% sedangkan dalam medium BO adalah sebesar 50.98%. Perbedaan ini diduga karena adanya perbedaan komposisi bahan penyusun yang terkandung sehingga berpengaruh pada osmolaritas dari kedua jenis medium tersebut. Rata-rata osmolaritas medium yang dipakai dalam penelitian ini adalah sebesar 320 mOsM untuk medium BO dan 282 mOsM untuk medium CR1aa. Osmolaritas medium CR1aa yang digunakan masih berada dalam kisaran normal (275-295 mOsM) untuk mendukung perkembangan embrio (Gardner dan Lane 2000) dan lebih rendah daripada medium BO. Hal tersebut diduga menjadi penyebab perbedaan tingkat fertilisasi dalam kedua jenis medium. Osmolaritas medium ternyata memegang peranan penting dalam menjaga keseimbangan ion intra dan ekstraseluler dan berpengaruh pada metabolisme sel secara umum.
PB
Tabel 3.2 Tingkat fertilisasi oosit domba dalam medium BO dan CR1aa Ket. DK: Dekondensasi; PN: Pronukleus; TF: Tingkat Fertilisasi. Huruf berbeda dalam kolom yang sama menunjukkan perbedaan nyata (P<0.05).
Tingkat fertilisasi oosit kambing dalam medium CR1aa adalah sebesar 54.5% (Rusiyantono dan Boediono 2003). Sedangkan tingkat fertilisasi oosit domba dalam medium CR1aa yang dilaporkan oleh Djuwita et al. (2005) adalah sebesar 84%. Perbedaan hasil yang diperoleh diduga akibat perbedaan jenis hewan dan spermatozoa yang digunakan. Dalam penelitian ini spermatozoa yang digunakan adalah spermatozoa domba garut, sementara sel telur berasal dari bukan domba garut sehingga terbentuk embrio yang hibrid.
Perubahan pH intraseluler juga terjadi selama kapasitasi berlangsung. Medium kapasitasi yang mengandung natrium bicarbonat, disamping untuk menjaga kestabilan pH juga berguna untuk menstimulasi aktivitas adenylate cyclase. Inkubasi spermatozoa dalam medium yang mengandung zinc dapat menyebabkan hambatan terhadap proses kapasitasi karena zinc me mpengaruhi ketidakstabilan membran plasma spermatozoa (Baldi et al. 1996).
Perkembangan Embrio
Tingkat perkembangan embrio setelah mengalami pematangan dan fertilisasi in vitro terlihat pada Tabel 3.3. Kemampuan embrio berkembang dalam medium kultur ditunjukkan dengan kemampuan embrio membelah dan berkembang hingga tahap morula.
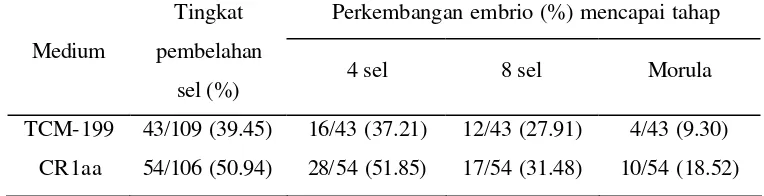
Tabel 3.3 Tahapan perkembangan embrio in vitro dalam medium TCM -199 dan CR1aa TCM-199 43/109 (39.45) 16/43 (37.21) 12/43 (27.91) 4/43 (9.30)
CR1aa 54/106 (50.94) 28/54 (51.85) 17/54 (31.48) 10/54 (18.52)
Oosit yang telah dimatangkan dalam medium TCM -199 dan difertilisasi dalam medium CR1aa selanjutnya dikultur dalam medium TCM-199 atau CR1aa. Kemampuan embrio membelah dalam kedua medium tersebut tidak menunjukkan adanya perbedaan yang nyata (P>0.05). Namun terdapat kecenderungan tingkat pembelahan (embrio 2-8 sel) dan perkembangan embrio yang mencapai morula (Gambar 3.5) lebih tinggi dalam medium CR1aa daripada dalam medium TCM-199. Hal ini diduga karena adanya kandungan glukosa sebanyak 1 gr/l dalam TCM-199 yang dapat menghambat pertumbuhan embrio tahap awal. Glukosa lebih dibutuhkan selama perkembangan blastosis sedangkan piruvat digunakan oleh embrio selama tahap preimplantasi sebelum mencapai blastosis.
domba in vitro dalam medium CR1aa sebesar 70%. Perbedaan hasil yang diperoleh karena perbedaan jenis hewan yang digunakan. Boediono da n Suzuki (1996) melaporkan bahwa kemampuan perkembangan embrio yang dikultur secara in vitro mencapai blastosis berbeda untuk setiap jenis hewan, dimana dalam penelitian tersebut terlihat bahwa jumlah blastosis yang terbentuk dari sapi jenis Japanese Black lebih tinggi daripada sapi jenis Holstein.
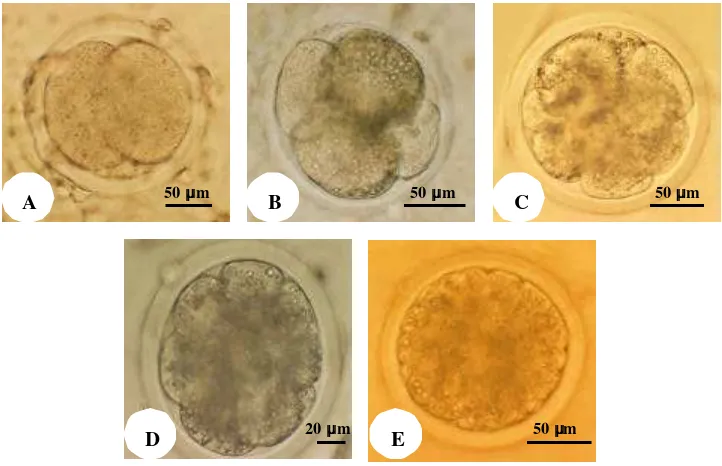
Gambar 3.5. Perkembangan embrio domba in vitro. Embrio berkembang mencapai tahap: A. 2 sel, B. 4 sel, C. 8 sel, D. 16 sel dan E. morula.
Perkembangan embrio sapi dan domba tahap awal sering terhenti pada tahap 8-16 sel. Hambatan perkembangan embrio in vitro merupakan suatu fenomena yang umum terjadi pada embrio dari berbagai species (Peters 1992; Barnett dan Bavister 1993). Kejadian tersebut berhubungan dengan konsentrasi glukosa dalam medium. Salah satu upaya untuk mengatasinya adalah dengan co-culture menggunakan sel kumulus, sel oviduct dan sebagainya. Faktor biologis yang terdapat pada cairan sel epithelial oviduct diduga juga dapat mengatasi persoalan tersebut. Sistim semi defined sequential media dapat bekerja efektif seperti halnya menggunakan co-culture maupun media yang disuplementasi
50 µm µ
50 µm µ 50 µµm 50 µm µ
20 µm µ E D
C B
dengan serum (Gandhi et al. 2000). Medium CR1aa tidak mengandung glukosa dan mengalami penambahan asam amino esensial dan nonesensial. Selama perkembangan dari tahap 8 sel menuju blastosis, asam amino nonesensial dan glutamin berfungsi untuk menstimulasi pembentukan blastosis dan hatching serta asam amino esensial berguna untuk meningkatkan jumlah sel pada blastosis dan membantu proses diferensiasi sel membentuk Inner Cell Mass (ICM) (Steeves dan Gardner 1999). Oleh karena itu, maka diduga hal tersebut menjadi salah satu penyebab mengapa CR1aa dapat mendukung perkembangan embrio domba in vitro lebih baik daripada TCM-199.
Metabolisme piruvat meningkat setelah terbentuknya morula. Hal ini menunjukkan bahwa metabolisme oksidatif memainkan peranan penting dalam pembentukan blastosis, terutama sebagai sumber energi. Sedangkan metabolisme glukosa tidak memegang peranan penting baik melalu i siklus Krebs maupun proses metabolisme lain pada tiap tahap pembelahan embrio. Peningkatan aktivitas glikolisis mengakibatkan keterlambatan sel mencapai tahap blastosis, menurunkan jumlah sel yang terbentuk dan menurunkan daya hidup embrio (Krisher et al. 1999). Pada sapi, glukosa dalam konsentrasi tinggi (>3 mmol/l) pada tahap awal pembelahan bersifat menghambat (inhibisi), namun kebutuhan glukosa baru mengalami peningkatan hingga 5 mmol/l untuk menstimulasi pembentukan blastosis setelah hari keempat kultur (Gandhi et al. 2000).
Insulin dapat meningkatkanpenggunaan glukosa sebagai sumber energi. Karena reseptor insulin baru muncul pada tahap 8 sel embrio rodensia maka penggunaan glukosa sebagai sumber enegi utama juga baru akan efektif setelah 8 sel. Sebelumnya embrio akan menggunakan piruvat dan laktat sebagai sumber energi utama (Schultz et al. 1992).
Penggunaan bicarbonat dalam medium dengan konsentrasi CO2 yang
konstan dalam lingkungan kultur akan memberikan pengaruh terhadap pH medium. Namun bicarbonat hanya mampu menjaga kestabilan pH dalam interval pH yang cukup jauh (6.8-7.8) sehingga tidak mampu menjaga embrio dari kerusakan akibat perubahan pH (Barnett dan Bavister 1996).
Medium TCM-199 sebagai medium kultur juga terbukti dapat mendukung perkembangan embrio. Jaswandi (2002) melaporkan tingkat pembelahan embrio domba dalam TCM-199 sebesar 57.54%. Penggunaa n TCM -199 yang disuplementasi dengan serum sebagai medium IVM terbukti dapat meningkatkan jumlah blastosis yang mengalami hatching daripada dalam medium SOF, namun jumlah sel yang terbentuk dari kedua jenis medium ini tidak berbeda nyata (Gandhi et al. 2000; Van Langendonckt et al. 1997). Hal tersebut menunjukkan bahwa komponen yang terkandung dalam TCM-199 memberikan efek positif terhadap peningkatan jumlah blastosis yang mengalami hatching.
Fetal Calf Serum (FCS) dapat mengatasi masalah rendahnya jumlah pronukleus jantan yang terbentuk (Wang et al.1997). Kultur oosit dengan FCS pada 24 jam pertama dan dilanjutkan dengan penambahan BSA untuk 24 jam kedua terbukti dapat menurunkan tingkat kejadian polyspermia in vitro (Niwa 1993). Penambahan Superovulated Cow Serum (SCS) ke dalam medium IVM dan IVC dapat meningkatkan jumlah blastosis pada hari kesembilan kultur lebih tinggi daripada jumlah blastosis dari medium yang sama yang mengalami penambahan FCS. Penggunaan SCS dari hari ke -0 dan ke-7 akan meningkatkan persentase pembelahan dan perkembangan blastosis jika konsentrasi glukosa, asam lemak dan kolesterol dalam medium maturasi dan kultur rendah (Boediono
et al. 1994). Disamping itu serum yang berasal dari sapi estrus (Estrus Cow Serum / ECS) terbukti juga dapat meningkatkan pembelahan dan perkembangan embrio mencapai tahap morula maupun blastosis (Setiadi et al. 1995).
yang efektif dalam 48 jam kultur ya kni dari tahap 2 sel. Penambahan insulin dapat meningkatkan jumlah blastosis dan jumlah sel yang terbentuk dalam penelitian in vitro. Insulin lebih berpengaruh terhadap pertambahan jumlah sel ICM daripada sel trophoblast. Pada fetus yang dihasilkan dari embrio yang dikultur dalam medium yang mengandung insulin akan memiliki berat badan lahir yang lebih besar daripada yang tidak, sehingga dikenal adanya istilah giant calves
untuk anak sapi baru lahir yang terbentuk dari proses produksi in vitro (Kaye et al.
1992).
KESIMPULAN
Berdasarkan hasil yang diperoleh dapat disimpulkan bahwa pemilihan jenis medium sangat mempengaruhi hasil yang diperoleh pada setiap tahapan produksi embrio domba in vitro. Medium maturasi oosit yang lebih baik untuk mendapatkan tingkat maturasi yang tinggi pada embrio domba adalah TCM-199 (P<0.05). Medium fertilisasi CR1aa yang disuplementasi dengan caffeine benzoate dan heparin terbukti menghasilkan tingkat fertilisasi yang lebih tinggi (P<0.05) daripada medium BO. Untuk medium kultur embrio, CR1aa dan TCM-199 menunjukkan kemampuan yang sama dalam mencapai tingkat pembelahan dan perkembangan embrio (P>0.05).
SARAN
4. PRODUKSI EMBRIO DOMBA
IN VITRO
MENGGUNAKAN
OOSIT DARI OVARIUM DENGAN STATUS REPRODUKSI
BERBEDA
ABSTRACT
The aim of the present study was to investigate whether the reproductive status influenced the number of follicles, oocytes quality, nuclear maturation, fertilization and cleavage rates for ovine in vitro embryo production. The pairs of ovary were classified into four groups: 1) ovaries with Corpus Luteum (CL) and Dominant Follicle (DF), 2) ovaries with CL, without DF, 3) ovaries with DF, without CL, 4) ovaries without both CL and DF. Oocytes were collected by slicing method in Phosphate Buffer Saline (PBS) medium supplemented with 5% Fetal Bovine Serum (FBS) and 100 IU/ml penicillin streptomycin. Oocytes were matured in Tissue Culture Medium (TCM)-199 supplemented with 10% Fetal Bovine Serum (FBS), 10 IU/ml Follicle Stimulating Hormone (FSH), 10 IU/ml Luteinizing Hormone (LH), 1 ìg/ml Estradiol and 100 IU/ml penicillin-streptomycin. Oocytes were matured in 5% CO2 incubator, 38 C for 24 h.
Matured oocytes were fertilized 18 h in CR1aa supplemented with 0.6 % BSA, 2.5 mM caffeine benzoate and 20 µg/ml heparin. Zygotes were cultured in CR1aa supplemented with 10% FBS, 5 µg/ml insulin and 100 IU/ml penicillin-streptomycin. Result of the experiments showed that there was no significant different (P>0.05) in the number of follicles were found from all groups of ovaries. The number of oocytes with good quality from pairs of ovary with CL and DF was 7.94 ± 2.59, significantly different (P<0.05) with pairs of ovary with DF without CL (4.40 ± 1.50). The maturation rate of oocytes with good quality were 75.51% from pairs of ovary with CL and DF and significantly different (P<0.05) with pairs of ovary with DF without CL (42.86%). Fertilization and cleavage rates were similar (P>0.05) from all groups of ovaries. In conclusion, the reproductive status has significant effect in the number of good quality oocytes and on nuclear maturation rate, but not in fertilization and cleavage rate.
ABSTRAK
Penelitian dilakukan untuk mengetahui pengaruh status reproduksi ovarium yang ditandai dengan keberadaan corpus luteum (CL) dan folikel dominan (FD) terhadap jumlah folikel, kualitas oosit, tingkat pematangan inti, tingkat fertilisasi dan kemampuan pembelahan sel serta perkembangan embrio domba in vitro. Pasangan ovarium dari rumah potong hewan (RPH) dipisahkan menjadi empat kelompok, yaitu: 1) ovarium dengan CL dan FD, 2) ovarium dengan CL tanpa FD, 3) ovarium dengan FD tanpa CL dan 4) ovarium tanpa CL dan FD. Oosit dikoleksi dengan teknik pencacahan dalam medium Phosphate Buffer Saline (PBS) yang disuplementasi dengan Fetal Bovine Serum (FBS) 5% dan penicilin streptomycin 100 IU/ml. Oosit dimatangkan selama 24 jam, 38°C dalam inkubator CO2 5%, menggunakan medium TCM -199 yang disuplementasi
IU/ml, Luteinizing Hormone (LH) 10 IU/ml, Estradiol 1 µg/ml dan penicilin streptomycin 100 IU/ml. Fertilisasi oosit dilakukan selama 18 jam dalam inkubator CO2 5% menggunakan medium CR1aa yang disuplementasi dengan
Bovine Serum Albumin (BSA) 0.6%, caffeine benzoate 2.5 mM dan heparin 20
µg/ml. Selanjutnya oosit dikultur dalam medium CR1aa yang disuplementasi dengan FBS 10%, insulin 5 µg/ml dan 100 IU/ml penicilin streptomycin. Hasil penelitian menunjukkan bahwa jumlah folikel tertinggi diperoleh dari kelompok ovarium dengan CL saja sebanyak 15.88 ± 10.68. Tidak terdapat perbedaan yang nyata (P>0.05) antara jumlah folikel dari masing-masing kelompok ovarium. Jumlah oosit dengan kualitas baik yang terkoleksi dari kelompok ovarium dengan CL dan FD sebesar 7.94 ± 2.59 berbeda nyata (P<0.05) dengan kelompok ovarium dengan FD tanpa CL (4.40 ± 1.50). Tingkat pematangan inti oosit dengan kualitas baik dari kelompok ovarium dengan CL dan FD (75.51%) lebih tinggi (P<0.05) daripada kelompok ovarium dengan FD tanpa CL (42.86%). Tidak ada perbedaan nyata (P>0.05) pada tingkat fertilisasi dan pembelahan serta perkembangan embrio dari keempat kelompok pasangan ovarium. Dari hasil penelitian dapat disimpulkan bahwa status repr oduksi ovarium mempengaruhi jumlah oosit dengan kualitas baik dan tingkat pematangan inti oosit domba in vitro, namun tidak pada tingkat fertilisasi dan pembelahan embrio.
PENDAHULUAN
Banyak faktor yang mempengaruhi keberhasilan proses produksi embrio secara in vitro. Kondisi kultur, jenis medium, penambahan serum betina estrus, cairan folikel, fetal bovine serum (FBS), penambahan hormon estradiol dan gonadotrophin, maupun menggunakan co-culture dengan sel granulosa atau sel oviduct sangat mempengaruhi keberhasilan fertilisasi dan perkembangan embrio pada tahap selanjutnya (Machatkova et al. 1996).
Keberhasilan proses produksi embrio secara in vitro juga sangat tergantung dari sumber oosit yang digunakan. Oosit tumbuh dalam lingkungan folikel yang berada pada ovarium dan mengikuti suatu siklus pertumbuhan tertentu. Pada sapi dan domba dapat terjadi beberapa kali gelombang folikel dalam satu siklus estrus. Umumnya pada domba terjadi dua hingga tiga kali gelombang folikel yang masing-masing dapat menghasilkan lebih dari satu folikel dominan / FD (Souza et al. 1998; Evans et al. 2002).
BAHAN DAN METODE
Pematangan Oosit In Vitro
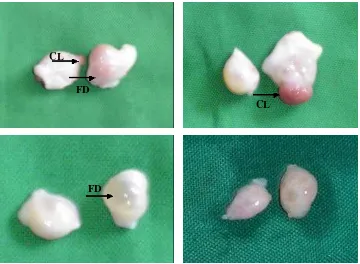
Ovarium yang diperoleh dari rumah potong hewan (RPH) ditempatkan dalam medium transportasi NaCl fisiologis pada suhu 30 C dan dipisahkan dengan membedakan status reproduksi dari masing-masing pasangan ovarium. Pasangan ovarium dikelompokkan sebagai berikut: (1) ovarium dengan corpus luteum (CL) dan folikel dominan (FD), (2) ovarium dengan CL tanpa FD, (3) ovarium dengan FD tanpa CL dan (4) ovarium tanpa CL dan FD (Gambar 4.1).
Gambar 4.1 Pengelompokkan ovarium berdasarkan status reproduksi individu. A. ovarium dengan CL dan FD, B. ovarium dengan CL tanpa FD, C. ovarium dengan FD tanpa CL dan D. ovarium tanpa CL dan FD. Ovarium tersebut dibawa ke laboratorium dalam waktu kurang dari tiga jam setelah pemotongan. Koleksi oosit dilakukan mengikuti metode Jaswandi et al. (2001) seperti halnya pada bab 3 (hal 18). Selanjutnya oosit dimatangkan dalam medium TCM -199 (Sigma, USA) yang disuplementasi dengan FBS 10 %,
Follicle Stimulating Hormone (FSH; Antrin®, Denka Pharmaceutical Co.,
CL
FD
CL
Kawasaki, Japan) 10 IU/ml, Luteinizing Hormone (LH; Chorulon®, Intervet
International B.V., Boxmer, Holland) 10 IU/ml, Estradiol (Oestradiol Benzoate®, Intervet International B.V., Boxmer, Holland) 1 ìg/ml dan penicillin-streptomycin (Gibco, Grand Island, NY, USA) 100 IU/ml. Pematangan oosit dilakukan dalam medium maturasi dalam bentuk drop masing-masing 50 µl untuk 10-15 oosit dan ditutup dengan mineral oil (Sigma Chemical Co. St. Louis MO, USA) dalam inkubator CO2 5%, 38 C selama 24 jam.
Kapasitasi Spermatozoa dan Fertilisasi In Vitro
Kapasitasi dan fertilisasi dilakukan mengikuti metode penelitian pada bab 3 (hal 18-19). Medium fertilisasi yang digunakan dalam penelitian ini adalah CR1aa yang disuplementasi dengan caffeine benzoate 2.5 mM dan heparin 20
µg/ml (Shimizu, Japan). Konsentrasi spermatozoa yang digunakan untuk keperluan IVF adalah sebesar 2.106 spermatozoa/ml.
Spermatozoa disiapkan dalam bentuk drop masing-masing seba nyak 100 ìl dalam cawan petri untuk 20-25 oosit dan ditutup dengan mineral oil (Boediono
et al. 2003). Oosit yang telah dicuci dalam medium fertilisasi sebanyak dua kali untuk keperluan fertilisasi kemudian diequilibrasi selama 30 menit sebelum IVF. Oosit kemudian dipindahkan ke dalam drop spermatozoa dan diinkubasi selama 18 jam dalam inkubator CO2 5%, 38 C.
Perkembangan Embrio In Vitro
Setelah 18 jam, oosit dicuci dalam medium kultur sebanyak dua kali dan dipindahkan ke dalam 50 ìl medium kultur CR1aa yang disuplementasi dengan FBS 10%, insulin (Sigma, USA) 5 µg/ml dan penisillin-streptomisin 100 IU/ml. Perkembangan embrio diamati sampai hari kelima. Penggantian medium kultur dilakukan setiap 48 jam.
Evaluasi
dan tidak baik. Oosit dengan kualitas baik merupakan oosit yang memiliki lebih dari dua lapis sel kumulus dan memiliki sitoplasma yang homogen sedangkan kelompok oosit dengan kualitas tidak baik merupakan oosit yang memiliki selapis atau tidak memiliki sel kumulus dan sitoplasma yang tidak homogen, sehingga tidak layak digunakan untuk produksi embrio in vitro.
Pengamatan status inti oosit setelah maturasi dan fertilisasi in vitro
dilakukan mengikuti metode penelitian bab 3 (hal 19-20). Tingkat kematangan inti dihitung dengan membandingkan jumlah oosit yang mencapai M-II dengan jumlah oosit yang dimaturasi.
Proses fertilisasi yang diamati meliputi dekondensasi kepala spermatozoa dan pembentukan pronukleus (PN) jantan. Sel telur yang telah mengalami fertilisasi ditandai dengan terbentuknya dua pronukleus (jantan dan betina, 2 PN) atau lebih (>2PN) dalam sitoplasma sel telur. Tingkat fertilisasi merupakan perbandingan antara jumlah sel telur yang dibuahi (membentuk dua atau lebih pronukleus) dengan jumlah keseluruhan sel telur yang difertilisasi.
Tingkat pembelahan dan perkembangan embrio diketahui dengan pengamatan menggunakan mikroskop inverted pada hari kedua hingga kelima. Tingkat pembelahan diperoleh dengan menghitung persentase jumlah zigot yang berhasil membelah dibandingkan dengan keseluruhan jumlah zigot yang dikultur. Sedangkan tingkat perkembangan embrio diperoleh dengan menghitung jumlah embrio yang mencapai tahap 4 dan 8 sel serta morula dibandingkan dengan keseluruhan jumlah zigot yang membelah.
Analisis Data