NUNUKLISTIYOWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
DAN IMUNITAS TIGA VARIETAS IKAN NILA
Dengan ini saya menyatakan bahwa tesis berjudul Pemberian Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang terhadap Respons Pertumbuhan dan Imunitas Tiga Varietas Ikan Nilaadalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Nunuk Listiyowati
NUNUK LISTIYOWATI. Pemberian Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang terhadap Respons Pertumbuhan dan Imunitas Tiga Varietas Ikan Nila. Dibimbing oleh ALIMUDDIN dan SUKENDA.
Ikan nila Oreochromis niloticusmerupakan komoditas budidaya andalan di Indonesia dan dunia, dengan produksi global sebesar 4.85 juta ton pada tahun 2014. Peningkatan produksi dapat ditempuh dengan berbagai cara, salah satu alternatif cara yang digunakan adalah dengan aplikasi bioteknologi. Penelitian ini bertujuan mengevaluasi penambahan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dalam pakan terhadap performa pertumbuhan dan imunitas tiga varietas ikan nila terhadap infeksi bakteriStreptococcus agalactiae. Penelitian ini dilaksanakan pada bulan Januari 2013 sampai Agustus 2014 bertempat di hatchery komoditas ikan nila dan Laboratorium Genetika, Balai Penelitian Pemuliaan Ikan, Sukamandi.
Penelitian ini terdiri atas dua tahap. Pada tahap pertama dilakukan uji pertumbuhan yang terdiri atas persiapan bak fiber kapasitas 1.5 ton air sebanyak 9 buah, persiapan hewan uji (benih ikan nila biru, srikandi dan nirwana dengan rerata bobot 0.32 ± 0.14 g/ekor dan panjang 2.1 ± 0.32 cm/ekor), benih ditebar dengan kepadatan 200 ekor/bak. Pembuatan pakan uji dilakukan dengan mencampurkan pakan komersial berkadar protein 40% dengan rElGH dosis 2 mg/kg yang sudah dilarutkan dalam 15 mL PBS dicampur dengan 2 mg kuning telur ayam untuk 100 g pakan. Pakan mengandung rElGH diberikan dua hari sekali, selama dua minggu dengan frekuensi tiga kali sehari (pagi, siang dan sore) secara at satiation (sampai kenyang). Efektivitas pemberian rElGH dalam meningkatkan pertumbuhan ikan nila ditentukan berdasarkan pertambahan bobot rata-rata (W), laju pertumbuhan harian (LPH), dan sintasan. Analisis proksimat daging dilakukan setelah 50 hari pemeliharaan.
Pada tahap kedua dilakukan uji tantang terhadap penyakit streptococcosis dengan menggunakan bakteri S. agalactiae tipe non-hemolitik (NK1) dosis 107
memberikan pengaruh nyata terhadap peningkatan bobot tubuh pada ikan nila srikandi, sedangkan pada ikan nila nirwana tidak berpengaruh (P>0.05). Bobot mutlak ikan nila srikandi dan nirwana yang diberi rElGH adalah lebih tinggi (P<0.05) dibandingkan dengan kontrolnya. Hasil ini selaras pula dengan nilai laju pertumbuhan hariannya yang lebih tinggi dibandingkan kontrol. Berbeda dengan kedua varietas tersebut, pertumbuhan mutlak dan laju pertumbuhan harian ikan nila biru kontrol lebih tinggi (P<0.05) dibandingkan dengan yang diberi rElGH. Berdasarkan uji statistik, interaksi antara varietas ikan dengan rElGH memberikan pengaruh yang nyata (P<0.05), baik terhadap panjang standar maupun panjang total ikan pada waktu pemeliharaan 50 hari. Populasi ikan nila biru dan nirwana yang mengonsumsi pakan rElGH memiliki nilai sintasan yang lebih tinggi (81 dan 83%) dibandingkan dengan kontrol, sedangkan pada ikan srikandi antara perlakuan dan kontrol relatif sama. Penambahan rElGH pada pakan ikan nila meningkatkan kadar protein dalam tubuh ikan nila biru dan srikandi, namun tidak terjadi pada ikan nila nirwana.
Ikan nila yang mendapatkan perlakuan rElGH pada pakan menunjukkan ketahanan tubuh yang berbeda ketika diuji tantang dengan bakteri S. agalactiae. Berdasarkan hasil uji statistik diketahui bahwa varietas ikan memberikan pengaruh yang nyata (P<0.05) terhadap jumlah kematian ikan akibat infeksi S. agalactiae. Ikan nila nirwana memiliki jumlah kematian yang paling sedikit (P<0.05) dibandingkan dengan ikan nila srikandi dan nila biru. Nilai MTD ikan nila nirwana perlakuan rElGH dan kontrol adalah 174.3 jam dan 217.7 jam. Nilai RPS sebesar 14.26% dan 30.03% pada ikan nila biru dan srikandi pada minggu pertama masa infeksi menunjukkan adanya tingkat ketahanan tubuh yang lebih baik pada ikan yang mengonsumsi pakan dengan tambahan rElGH dibandingkan dengan kontrol.
Sebagai kesimpulan, varietas ikan nila sangat mempengaruhi efektivitas pemberian rElGH dalam memacu pertumbuhan dan imunitasnya. Pemberian pakan dengan rElGH dosis 2 mg/kg selama dua minggu mampu meningkatkan performa pertumbuhan dan respons imunitas terhadap infeksi bakteriS. agalactiae pada ikan nila srikandi.
NUNUK LISTIYOWATI. Growth Response and Immunity of Three Tilapia Strains Fed on Diet Containing Recombinant Giant Grouper Growth Hormone. Supervised by ALIMUDDIN and SUKENDA.
Nile tilapia Oreochromis niloticus is one of the main aquaculture commodities in Indonesia and the world, with global production of 4.85 million tons in 2014. Increased production capacity can be reached by various ways, one of the alternative means is application of biotechnology. This study was aimed to evaluate the effect of recombinant giant grouper growth hormone (rElGH) supplementation in diet on growth performance and immunity of three strains of tilapia against Streptococcus agalactiae infection. The research was conducted from January 2013 to August 2014 in the tilapia hatchery and Genetics Laboratory, Research Institute of Fish Breeding, Sukamandi.
This study consisted of two steps, namely growth and disease challenge tests. In the first stage, the activities consisted of preparation of 9 fiber tanks of 1.5 tons volume, preparation of fish (blue tilapia, srikandi and nirwana strains with the mean of weight 0.32±0.14 g/fish and standard length 2.1±0.32 cm/fish), and stocking at a density of 200 fish/tank. Test diet preparation was mixed commercial feed (crude protein content 40%) with rElGH that have been dissolved in 15 mL of PBS and mixed with 2 mg of chicken egg yolk, homogenized using a vortex, then sprayed evenly on 100 g of feed. Feed containing rElGH was given twice a day, for two weeks with a frequency of three times a day (morning, afternoon and evening) at satiation. The effectiveness of rElGH in enhancing the growth of tilapia was determined based on the average weight gain (W), daily growth rate (DGR) and survival rate. Proximate analysis was performed after 50 days of maintenance to determine the nutrient content of blue tilapia, srikandi and nirwana strains.
In the second stage of experiment, challenge test was performed by injecting 0.1 mL/fish the non-hemolytic (NK1) S. agalactiae at a dose of 107CFU/mL on
with its control (P<0.05), while it did not affect body weight of nirwana strain (P>0.05). Absolute growth of srikandi and nirwana fed on rElGH were higher (P<0.05) than their controls. These results were in line with the increased in daily growth rate. In contrast to these two strains, absolute growth and the daily growth rate of blue tilapia control without rElGH treatment was higher (P<0.05) than those given rElGH. Result of statistical test showed that interaction between fish strains and rElGH treatment significantly affected (P<0.05) the standard body length. The blue tilapia and nirwana fish strains fed on rElGH showed higher survival (81 and 83%, respectively) compared to their controls, while a similar effect was not observed in srikandi strain. Feeding fish with rElGH supplemented diet increased crude protein content in the body of the blue tilapia and srikandi, but not in nirwana strain.
Fish treated with rElGH showed a different resistance to S. agalactiae infection. Based on the results of statistical analysis, number of fish deaths caused by S. agalactiaeinfection was correlated to fish strains (P<0.05). Nirwana strain has the lowest number of deaths (P<0.05). MTD value of rElGH-treated nirwana and control fish was 174.3% and 217.7%, respectively. RPS value of the rEl GH-treated blue tilapia (14.26%) and srikandi strain (30.03%) in the first week challenge test indicated better immunity than the controls.
As conclusion, tilapia strains greatly affected the effectiveness of rElGH in increasing growth and immunity. Feeding diet containing rElGH at a dose of 2 mg/kg for two weeks improved growth performance and immune response to S. agalactiaeinfections in srikandi fish strain.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
DAN IMUNITAS TIGA VARIETAS IKAN NILA
NUNUK LISTIYOWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Nama : Nunuk Listiyowati
NIM : C151110311
Disetujui oleh
Komisi Pembimbing
Dr Alimuddin, SPi MSc Ketua
Dr Ir Sukenda, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya, sholawat serta salam penulis sampaikan kepada kanjeng nabi Muhammad SAW, sehingga karya ilmiah yangberjudul “Pemberian Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang terhadap Respons Pertumbuhan dan Imunitas Tiga Varietas Ikan Nila” berhasil diselesaikan. Penelitian ini dilakukan pada bulan Januari 2013 sampai Agustus 2014 bertempat di hatchery komoditas ikan nila dan Laboratorium Genetika, Balai Penelitian Pemuliaan Ikan, Sukamandi.
Terima kasih penulis ucapkan kepada Bapak Dr Alimuddin, SPi MSc dan Bapak Dr Ir Sukenda, MSc selaku pembimbing yang telah banyak memberi saran. Dr Sri Nuryati, SPi MSi dan Dr Ir Mia Setiawati, MSi selaku penguji atas bimbingan dan saran yang diberikan, Dr Ir Widanarni, MSi selaku Ketua Program Studi atas dukungan dan doanya.Ungkapan terima kasih juga disampaikan kepada suami tercinta, putri kecilku, bapak dan ibu mertua, ibuku tersayang beserta seluruh keluarga, atas segala doa, kesabaran dan kasih sayangnya. Penulis sampaikan pula terima kasih dan penghargaan kepada teman-temanthe great team nila, mas Hari Krettiawan, teh Devi, mbak Wiwik, seluruh pegawai BPPI dan kepada Bapak Dr. Imron, S.Pi M.Sc selaku Ka. BPPI atas kesabaran, dukungan dan doanya. Penulis sampaikan pula terima kasih kepada teman-teman mahasiswa Program Studi Ilmu Akuakultur IPB khususnya angkatan 2011 dan Dendi Hidayatullah atas bantuan dan dukungan dan doanya, serta semua pihak yang telah membantu secara langsung maupun tidak langsung.
Akhir kata, penulis berharap semoga karya ilmiah ini dapat bermanfaat. Penulis menyadari hasil penelitian dalam karya ilmiah ini bukanlah sebuah kebenaran mutlak karena sangat mungkin berubah seiring berkembangnya ilmu pengetahuan.
Bogor, Agustus 2015
DAFTAR TABEL...iv
DAFTAR GAMBAR...iv
DAFTAR LAMPIRAN...v
1 PENDAHULUAN...1
Latar Belakang...1
Perumusan Masalah...222 Tujuan Penelitian...3
Manfaat penelitian...3
2 TINJAUAN PUSTAKA...4
3 MATERI DAN METODE...13
Uji Pertumbuhan...13
Parameter Pertumbuhan...13
Analisis Proksimat...14
Uji Tantang BakteriStreptococcus agalactiae...14
Parameter Gambaran Darah...15
Histopatologi dan Gejala Klinis...15
Kualitas Air...15
Analisis Data...15
4. HASIL DAN PEMBAHASAN...16
Hasil ...16
Proksimat Daging...18
Uji Tantang BakteriStreptococcus agalactiae...19
Pembahasan...24
5. SIMPULAN DAN SARAN...32
Simpulan ...32
Saran...32
DAFTAR PUSTAKA...33
LAMPIRAN...vii
1 Karakteristik Streptococcus agalactiae yang menyerang ikan nila
Oreochromissp...9
2 Perlakuan pemberian rElGH dan uji tantang...14
3 Pertumbuhan bobot mutlak, laju pertumbuhan harian dan sintasan tiga strain ikan nila yang diberi pakan mengandung rElGH dan tanpa rElGH ...17
4 Kadar proksimat daging tiga strain ikan nila diberi pakan mengandung rElGH dan tanpa rElGH (kontrol)...18
5 Kisaran data kualitas air selama 50 hari pemeliharaan...19
6 Nilai RPS tiga strain ikan nila diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang terinfeksi bakteriS. agalactiae...21
7 Kisaran data kualitas air media uji tantang penyakit...22
DAFTAR GAMBAR
1 Calon induk ikan nila Nirwana F6 Betina...42 Calon induk ikan nila Nirwana F6 Jantan...4
3 Ikan nila Biru hasil seleksi di BPPI, Sukamandi...5
4 Ikan nila SRIKANDI hasil pemuliaan di BPPI, Sukamandi...5
5 Distribusi globalStreptococcus agalactiaebiotipe 1 dan biotipe 2, sertaS. iniae...11
6 Bobot rata-rata ikan nila biru (kiri), ikan nila srikandi (tengah) dan ikan nila nirwana (kanan) yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol). Ikan dipelihara selama 50 hari....16
7 Bobot ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol). Ikan dipelihara selama 50 hari...16
8 Pertumbuhan panjang standar (cm) ikan nila biru (kiri), ikan nila srikandi (tengah) dan ikan nila nirwana (kanan) yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol). Ikan dipelihara selama 50 hari...17
9 Panjang standar (cm) ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol). Ikan dipelihara selama 50 hari...18
10 Kematian kumulatif (%) ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang diuji tantang dengan bakteriS. agalactiae...19 11 Kematian ikan (%) selama 7 hari ikan nila strain biru, srikandi
diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang
diuji tantang dengan bakteriS. agalactiae...21 13 Gambaran darah (total eritrosit, total leukosit, hematokrit, total
antibodi) hari ke- 3, 10 dan 30 pada ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa
rElGH (kontrol) yang diuji tantang dengan bakteriS. agalactiae...22 14 Gejala klinis pada ikan nila strain biru, srikandi dan nirwana yang
diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang
diuji tantang dengan bakteriS. agalactiae...23 15 Histopatologi organ limpa pada ikan nila strain biru, srikandi dan
nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH
(kontrol) yang diuji tantang dengan bakteriS. agalactiae...24
DAFTAR LAMPIRAN
1 Hasil uji statistik dengan SPSS terhadap pertumbuhan bobot (g) ikan nila strain biru, srikandi dan nirwana yang diberi pakan
mengandung rElGH dan tanpa rElGH (kontrol)...42 2 Hasil uji statistik dengan Excel terhadap rerata bobot (g) ikan nila
strain biru, srikandi dan nirwana yang diberi pakan mengandung
rElGH dan tanpa rElGH (kontrol)...42 3 Hasil uji statistik dengan SPSS terhadap pertumbuhan bobot
mutlak (g) dan laju pertumbuhan harian ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan
tanpa rElGH (kontrol). ...44 4 Hasil uji statistik dengan SPSS terhadap panjang standar (PS) dan
panjang total (PT) ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH (RGH) dan tanpa rElGH
(kontrol)...46 5 Hasil uji statistik dengan SPSS terhadap kematian kumulatif (%)
ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang diuji tantang
dengan bakteriS. agalactiae...47 6 Hasil uji statistik dengan SPSS terhadap kematian kumulatif (%)
pada minggu pertama (masa infeksi) ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa
rElGH (kontrol) yang diuji tantang dengan bakteriS. agalactiae...48 7 Hasil analisis molekuler penyebab kematian ikan nila strain biru,
1 PENDAHULUAN
Latar Belakang
Ikan nila Oreochromis niloticus merupakan komoditas budidaya air tawar andalan di Indonesia dan dunia, dengan produksi global sebesar 4.85 juta ton pada tahun 2014. Data statistik FAO (2014) menunjukkan Indonesia sebagai produsen ikan nila terbesar ketiga di dunia setelah China dan Mesir, dengan kapasitas produksi sekitar 700.000 ton. Pengembangan dan penerapan teknologi untuk meningkatkan efisiensi produksi ikan nila berkaitan dengan upaya peningkatan pertumbuhan telah banyak dilakukan, yaitu teknologi budidaya, pakan dan rekayasa genetika seperti seleksi, hibridisasi, triploidisasi, dan transgenesis. Aplikasi metode seleksi membutuhkan waktu yang relatif lama untuk mencapai hasil yang signifikan karena peningkatan kecepatan tumbuh yang dihasilkan per generasi relatif rendah. Sebagai contoh, Bolivar et al. (2002) melaporkan bahwa seleksi membutuhkan waktu selama 10 tahun untuk menghasilkan 12 generasi dengan kecepatan tumbuh 12,4% per generasi pada ikan nila. Penerapan teknologi hibridisasi dan triploidisasi terbatas pada ikan budidaya yang sudah diketahui teknik pemijahan buatannya secara baik. Begitu pula dengan metode transgenesis masih menimbulkan kontroversi dan kekhawatiran akan keamanan pangan (food safety) dalam mengonsumsi organisme transgenik tersebut, meskipun laju pertumbuhan ikan transgenik 30 kali lebih cepat (Nam et al. 2001). Salah satu alternatif yang bisa dilakukan untuk mengatasi masalah tersebut adalah penggunaan protein hormon pertumbuhan rekombinan (recombinant growth hormone, rGH) ikan.
Efektivitas pemberian rGH dalam meningkatkan pertumbuhan tergantung pada jenis rGH, dosis, umur dan jenis ikan uji yang digunakan (Hertz et al. 1991). Hasil penelitian Irmawati et al. (2012) menunjukkan bahwa tingkat produksi dalam pembuatan rGH ikan kerapu kertang Epinephelus lanceolatus (rElGH) lebih tinggi dibandingkan rGH ikan mas Cyprinus carpio (rCcGH) dan rGH ikan gurami Osphronemus goramy (rOgGH). Bioaktivitas rElGH juga lebih tinggi; untuk menghasilkan peningkatan pertumbuhan yang sama pada ikan gurami, dibutuhkan rElGH lebih rendah dibandingkan rCcGH sehingga penggunaan rElGH lebih efisien dibandingkan rCcGH. Beberapa penelitian telah mampu membuktikan kemampuan rElGH dalam meningkatkan pertumbuhan ikan target. Handoyo et al. (2012) menguji rElGH pada ikan sidat menggunakan metode perendaman, oral dan kombinasi perendaman dan oral, masing-masing dapat meningkatkan pertumbuhan sebesar 37,4%; 65,7% dan 102,9% lebih tinggi dibandingkan kontrol. Metode aplikasi yang sama dengan Handoyo et al. (2012) juga digunakan oleh Subaidah et al. (2012) pada udang putih vaname, masing-masing dapat meningkatkan pertumbuhan sebesar 109,9%; 17,7% dan 40,1% lebih tinggi dibandingkan kontrol.
antara ikan nila nirwana dan ikan nila biru O. aureus. Strain ikan yang lebih cepat tumbuh atau telah mengalami seleksi peningkatan pertumbuhan mampu memproduksi GH endogen dan insulin-like growth faktor lebih tinggi sehingga responsnya terhadap GH eksogen menjadi lebih rendah (Le Bail et al. 1993).
Studi tentang kaitan antara pemberian rGH dengan peningkatan kapasitas sistem imun telah dilakukan oleh Acosta et al. (2008) yang menemukan adanya peningkatan respons imunitas bawaan pada larva ikan nila yang direndam dengan recombinant truncated GH ikan nila. Aktivitas lisozim dan haemaglutinasi lektin pada kelompok ikan nila meningkat secara signifikan dibandingkan kelompok ikan kontrol. Studi lain menunjukkan bahwa injeksi GH alami dan rGH dari ikan chum salmon dapat meningkatkan kelangsungan hidup ikan rainbow trout terhadap infeksi bakteri patogen Vibrio anguilarum sebesar 10 kali lebih tinggi dibandingkan kelompok ikan kontrol (Sakai et al. 1997). Efek rGH terhadap kelangsungan hidup larva juga telah dievaluasi oleh Acosta et al. (2009) pada larva ikan koki. rGH diberikan melalui perendaman tiga kali seminggu selama 75 hari dapat meningkatkan kelangsungan hidup 22% lebih tinggi dibandingkan kelompok larva ikan koki yang tidak mendapatkan perlakuan (Acosta et al. 2009).
Peningkatan produksi ikan nila dalam beberapa tahun terakhir disebabkan antara lain melalui intensifikasi budidaya. Tingkat kepadatan yang tinggi menyebabkan ikan lebih rentan terhadap stres dan penyakit (Iwana dan Nakanishi 1996). Bakteri pada umumnya berhubungan dengan berbagai macam penyakit, yang menyebabkan kematian dan kerugian pada budidaya ikan (Inglis et al. 1993; Plumb 1999; Yin 2004). Penyakit streptococcosis atau streptococciasis pada ikan, yang disebabkan oleh bakteri S. iniae dan S. agalactiae merupakan salah satu penyakit bakterial yang menginfeksi ikan yang ada di alam dan ikan budidaya, baik pada lingkungan air tawar, payau maupun laut. Streptococcosis dapat menyebabkan kerugian besar bagi pembudidaya ikan intensif, dengan tingkat kematian ikan >50% dalam waktu sekitar satu minggu (Inglis et al. 1993; Yanong dan Francis-Floyd 2006).
S. agalactiae diklasifikasikan sebagai Lancefield's group B Streptococcus (GBS), termasuk bakteri non-motil, tidak menghasilkan spora, Gram positif, katalase negatif dan oksidase negatif (Evans et al. 2002). Gejala klinis ikan yang terinfeksi streptococcosis antara lain tingkah laku berenang yang berputar-putar dan tidak menentu, nafsu makan menurun, uni atau bilateral exophthalmia (mata bengkak), corneal opacity dan pembengkakan rongga perut (Salvador et al. 2005; Suanyuk et al. 2005). Tingkat luka dan gejala klinis pada ikan nila yang disebabkan oleh S. agalactiae tergantung pada tingkat dosis infektif, volume air, suhu, biomassa dan handling (Chang dan Plumb 1996).
Perumusan Masalah
peningkatan sistem kekebalan tubuh atau imunitas ikan sudah dilakukan pada udang putih vaname (Subaidah 2012), dan ikan kerapu bebek Cromileptes altivelis (Antoro 2014). Penelitian tentang pemberian rElGH dalam peningkatan imunitas untuk melawan infeksi streptococcosis pada ikan nila perlu dilakukan untuk mendukung peningkatan produksi ikan nila. Penelitian ini dilakukan untuk mengevaluasi efektivitas rElGH dalam memacu pertumbuhan dan imunitas pada tiga strain ikan nila.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi penambahan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dalam pakan terhadap performa pertumbuhan dan imunitas tiga strain ikan nila akibat infeksi S. agalactiae.
Manfaat Penelitian
2 TINJAUAN PUSTAKA
Ikan Nila NIRWANA
Berdasarkan data Rencana Strategis Kementerian Kelautan dan Perikanan Republik Indonesia tahun 2010, ikan nila menempati urutan ketiga sebagai komoditas utama dalam target produksi perikanan budidaya nasional. Target produksinya pada tahun 2010 adalah sebesar 491.800 ton, tahun 2011 sebesar 639.300 ton, tahun 2012 sebesar 850.000 ton, tahun 2013 sebesar 1.105.000 ton, dan tahun 2014 sebesar 1.242.900 ton. Ikan nila nirwana merupakan salah satu ikan nila hasil pemuliaan yang mulai banyak dibudidayakan oleh masyarakat setelah dirilis tahun 2006 (F3) dan hasil pemuliaan generasi selanjutnya (F6) dirilis tahun 2011. Pemuliaan ikan nila nirwana mulai dilakukan tahun 2003 oleh Balai Pengembangan Benih Ikan (BPBI) Wanayasa dengan menyilangkan antara ikan nila GIFT (genetic improvement of farmed tilapia) dengan ikan nila GET (genetically enhanced of tilapia).
Gambar 1 Induk ikan Nila Nirwana F6 Betina
Gambar 2 Induk ikan Nila Nirwana F6 Jantan
Sumber: Makalah rilis Nirwana II, BPBI Wanayasa. 2011.
Ikan Nila Biru
Balai Penelitian Pemuliaan Ikan, Sukamandi pada tahun 2007 mendatangkan indukan ikan nila biru dari pelaku usaha perikanan (CP Prima) untuk kemudian dipijahkan, hasil pemijahan tersebut selanjutnya dijadikan indukan untuk kegiatan seleksi famili yang menjadi program riset BPPI mulai tahun 2009 dalam rangka mendapatkan induk dan benih unggulan untuk budidaya ikan nila pada media bersalinitas.
Gambar 3 Ikan nila biru hasil seleksi di BPPI, Sukamandi
Ikan Nila Srikandi
Ikan nila srikandi (salinity resistant improvement from Sukamandi) berdasarkan KEP.09/MEN/2012, tanggal 1 Mei 2012 merupakan ikan nila hasil pemuliaan dengan jalur hibridisasi antara ikan nirwana dan ikan nila biru dengan target utama daya adaptasi terhadap salinitas tinggi. Budidaya ikan nila srikandi masa pendederan dan pembesaran dilakukan pada media bersalinitas 20-30 g/L. Hasil penelitian uji tantang ikan nila srikandi dengan S. agalactiae tipe non-hemolitik (N14G) dosis 104 CFU/mL selama 14 hari pada media air tawar dan
salinitas 20 g/L menunjukkan hasil sintasan yang moderat (54.67% dan 35%) dibandingkan dengan tetua pembentuknya yaitu nirwana (70% dan 50%) (Febrianti et al. 2012; Robisalmi et al. 2011)
Gambar 4 Ikan nila srikandi hasil pemuliaan di BPPI, Sukamandi
Hormon Pertumbuhan
pertumbuhan tubuh, khususnya merangsang pelepasan somatomedin, dan mempengaruhi metabolisme protein, karbohidrat, dan lipid. GH bekerja dengan merangsang sintesis protein dan pemecahan lemak (untuk energi). Sekresi hormon pertumbuhan dikendalikan oleh hipotalamus. Somatotropin menggambarkan hormon pertumbuhan yang biasa diproduksi di pituitari, sedangkan somatropin menggambarkan hormon pertumbuhan yang diproduksi menggunakan teknologi DNA rekombinan pada bioreaktor/fermentasi (Lindholm 2006).
Sekresi GH dirangsang oleh growth hormone releasing hormone (GHRH), ghrelin, protein pakan, kandungan gula darah yang rendah, peningkatan sekresi androgen, dan arginin, sedangkan yang menghambat antara lain somatostatin, konsentrasi hormon pertumbuhan dan insulin-like growth factor-1 (IGF-1) yang bersirkulasi, kandungan gula darah yang tinggi, glukokortikoid, dan estradiol ataupun estrogen lainnya. Fungsi GH yang sangat penting adalah memperbaiki dan memacu pertumbuhan somatik (Moriyama dan Kawauchi 2001). Pada ikan, GH memiliki beberapa fungsi antara lain merangsang pertumbuhan gonad (Wong et al. 2006), otot dan tulang (Debnanth 2010). Selain itu, GH pada ikan juga berperan dalam proses osmoregulasi (Sakamoto et al. 1997), meningkatkan nafsu makan/metabolisme (Rousseau dan Dufour 2007), proses metamorfosis dan perkembangan (Anathy et al. 2009), merangsang hati untuk mengeluarkan IGF-1 (Moriyama et al. 2000), efisiensi pemberian pakan, menjaga keseimbangan/homeostasis energi, tingkah laku ketika bermigrasi, proses gametogenesis puberitas, perkembangan embrio (Debnanth 2010), serta meningkatkan sistem imunitas tubuh (Sakai et al. 1997; Yada et al. 1999).
Efek rGH pada Pertumbuhan Ikan
Level GH alami relatif rendah dan metode isolasinya relatif rumit sehingga tidak ekonomis dan tidak praktis, maka digunakan teknologi DNA rekombinan untuk memproduksi GH rekombinan (Sekine et al. 1985). Hormon pertumbuhan rekombinan (rGH) dari berbagai spesies vertebrata, termasuk ikan telah dapat diproduksi dalam jumlah banyak menggunakan bioreaktor berupa bakteri Escherichia coli (Promdonkoy et al. 2004, Sørensen dan Kim 2005, Alimuddin et al. 2010), dan ragi Pichia pastoris (Acosta et al. 2007,Weidner et al. 2010).
Bioaktivitas rGH dalam memacu pertumbuhan telah diuji pada udang (Santiesteban et al. 2010), ikan (Moriyama dan Kawauchi 2001; Alimuddin et al. 2010) dan kekerangan (Acosta et al. 2007). Selanjutnya, metode pemberian rGH juga telah dikembangkan pada ikan nila (Li et al. 2003; Acosta et al. 2007; Alimuddin et al. 2010; Hardiantho et al. 2012; Latar 2013), salmonids (Sekine et al. 1985), rainbow trout (Moriyama et al. 1993), black seabream (Tsai et al. 1997), ikan koki (Promdonkoy et al. 2004), ikan baronang (Funkenstein et al. 2005), ikan flounder Jepang (Liu et al. 2008), ikan sidat (Handoyo 2012), ikan gurami (Irmawati et al. 2012; Safir 2012), dan udang putih Litopenaeus vannamei (Subaidah et al. 2012).
Pemanfaatan rGH telah banyak digunakan untuk memacu pertumbuhan ikan. Pemberian rGHikan mas yang diproduksi dalam Pichia pastoris sebanyak
53,1% dibandingkan dengan kontrol (Li et al. 2003). Pemberian rGH tersebut dapat dilakukan melalui injeksi (Sekine et al. 1985; Tsai et al. 1995; Li et al. 2003; Funkenstein et al. 2005; Lesmana 2010), melalui perendaman (Acosta et al. 2007; Putra 2010; Syazili et al. 2011) serta melalui pakan (Tsai et al. 1997; Handoyo 2012).
Pemberian 0,5% rGH per kg pakan yang diberikan selama 12 minggu pada juvenil ikan sea bream hitam menunjukkan perbedaan bobot sebesar 60% dari perlakuan kontrol setelah pemeliharaan selama 16 minggu (Tsai et al. 1997). Menurut Sekine et al. (1985), pemberian rGH pada ikan rainbow trout dapat meningkatkan pertumbuhan sebesar 50% dibandingkan dengan ikan rainbow trout yang tidak diberi perlakuan rGH. Pemberian rGH pada benih ikan
beronang dengan dosis 0,5 μg/g bobot tubuh sebanyak 1 kali per minggu selama
4 minggu dapat meningkatkan bobot tubuh sebesar 20% dari kontrol (Funkenstein et al. 2005). Selanjutnya, pemberian rGH pada benih ikan nila dengan dosis 30 mg/kg pakan dengan frekuensi pemberian 2 kali seminggu selama 3 minggu terbukti meningkatkan bobot tubuh sebesar 214,7% dari kontrol (Hardiantho et al. 2012).
Studi tentang kaitan antara pemberian rGH dengan peningkatan kapasitas sistem imun telah dilakukan oleh Acosta et al. (2008) yang menemukan peningkatan respons imunitas bawaan pada larva ikan tilapia yang di immersi dengan recombinant truncated tGH. Aktivitas lisozim dan haemaglutinasi lektin pada kelompok ikan eksperimental meningkat secara signifikan dibandingkan kelompok ikan kontrol. Studi lain menunjukkan bahwa injeksi nGH dan rGH dari ikan chum salmon, dapat meningkatkan kelangsungan hidup ikan rainbow trout terhadap infeksi bakteri patogen Vibrio anguilarum sebesar 10 kali lebih tinggi dibandingkan kelompok ikan kontrol (Sakai et al. 1997). Efek rGH terhadap kelangsungan hidup larva juga telah dievaluasi oleh Acosta et al. (2009) pada larva ikan koki, melalui perendaman tiga kali seminggu selama 75 hari dapat meningkatkan kelangsungan hidup 22% lebih tinggi dibandingkan kelompok larva yang tidak mendapatkan perlakuan.
Streptococcosis
Infeksi streptococcal pada ikan merupakan infeksi bakteri yang dapat mempengaruhi patologi dari varietas budidaya ikan di seluruh dunia (Romalde dan Toranzo 2002; Toranzo et al. 2005). Sebanyak 45 spesies ikan yang hidup di perairan tawar, payau maupun laut di Afrika, Amerika, Asia, Australia dan Eropa sudah terserang streptococcosis (Conroy 2009). Streptococcosis pada ikan disebabkan oleh 6 spesies bakteri Gram positif yang berbeda termasuk streptococci, lactococci dan vagocci (Bercovier et al. 1997). Spesies utama penyebab streptococcosis yang bersifat patogenik adalah Streptococcus parauberis, S. iniae, S. agalactiae, Lactococcus garviae, L. piscium, Vagococcus salmoninarum, dan Carnobacterium piscicola (Bercovier et al. 1997; Eldar et al. 1997; Eldar dan Ghittino 1999).
streptococcosis pada ikan pertama kali dilaporkan menyerang ikan rainbow trout (Oncorhynchus mykiss) yang dibudidayakan di Shizouka, Jepang pada April 1957 (Hoshina et al. 1958). Spesies patogenik S. agalactiae terdokumentasi pada awal 1966, ketika bakteri group B streptococcus teridentifikasi sebagai penyebab dua epizootik pada ikan “golden shiner” Notemigonus crysoleucas (Robinson dan Meyer 1966).
Sekalipun infeksi S. agalactiae bayak dilaporkan menyerang berbagai spesies ikan dan menjangkau berbagai lingkungan perairan, namun lebih dikenal sebagai patogen mematikan untuk spesies ikan perairan tropis (Eldar et al. 1994; Evans et al. 2002). Streptococcosis biasa muncul waktu perairan mencapai suhu >15°C, dan sering terjadi wabah ketika memasuki musim panas (Eldar et al. 1994; Kawamura et al. 2005; Siti-Zahrah et al. 2008). Dua spesies streptococcus, S. agalactiae dan S. iniae merupakan agen utama penyebab penyakit streptococcus pada ikan nila, dari 500 isolat bakteri streptococcus yang menyerang ikan nila sebanyak 82% teridentifikasi sebagai S. agalactiae dan 18% teridentifikasi sebagai S. iniae. Saat ini streptococcosis menyerang budidaya ikan nila hampir di setiap negara Asia seperti di Cina, Vietnam, Filipina, Thailand dan Indonesia, sedangkan di negara Amerika Latin ditemukan di Ekuador, Honduras, Meksiko dan Brazil (Sheehan et al. 2009). Streptococcosis merupakan penyakit septikemia yang menyebabkan banyaknya kematian pada budidaya ikan nila. Ikan nila sangat rentan terhadap infeksi streptococcosis yang dapat menimbulkan wabah yang sangat mematikan dan kerugian besar secara finansial (Eldar et al. 1994; Salvador et al. 2005; Suanyuk et al. 2005; Mian et al. 2009; Abuseliana et al. 2010; Zamri-Saad et al. 2010; Pretto-Giardano et al. 2010).
Penyebaran S. agalactiae ke dalam organ ikan melalui darah, dapat tumbuh dan berkembangbiak serta menyebar melalui darah (Hardi 2011).
Streptococcus agalactiae
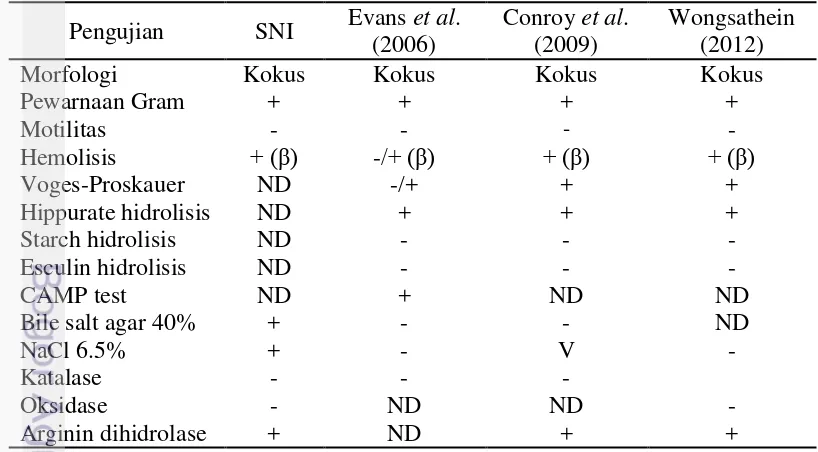
Karakteristik umum Streptococcus agalactiae adalah Gram positif, bentuk kokus baik berpasangan maupun berantai pendek, katalase negatif , oksidase negatif, CAMP (Christie, Atkins dan Munch-Petersen) positif dan mampu menghidrolisis hipurat. Bentuk koloni putih keabu-abuan, berlendir, seukuran ujung jarum, bulat dan cembung serta dapat tumbuh pada beberapa media termasuk golongan bakteri group B Streptococcus (GBS), yaitu bakteri streptococcal yang hanya membawa antigen dari grup B, sesuai metode Lancefield serogrouping (Devriese 1991; Facklam 2002). Berdasarkan komposisi antigen kapsul polisakarida, organisme GBS diklasifikasikan dalam 10 jenis serotipe (Ia, Ib dan II sampai IX) (Chaffin et al. 2000; Persson et al. 2004; Slotved et al. 2007). Strain GBS dengan serotipe molekul Ia, Ib, II dan III dilaporkan teridentifikasi pada ikan nila O. niloticus di Thailand dan China, ikan nila merah Oreochromis spp. di Thailand (Suanyuk et al. 2008; Ye et al. 2011). Identifikasi strain S. agalactiae berdasarkan kemampuannya menghemolisis darah pada media agar darah terbagi menjadi 3 tipe yaitu alpha (a-), beta (ß-) dan non ( -) hemolitik (Kitao et al. 1981; Buller 2004). Karakteristik bakteri S. agalactiae yang diisolasi dari ikan nila disajikan pada Tabel 1.
Tabel 1 Karakteristik S. agalactiae yang menyerang ikan nila Oreochromis sp.
Tabel 1 Lanjutan
Keterangan : SNI: Standar Nasional Indonesia 7545:2009; ND: tidak dilakukan; v: variasi
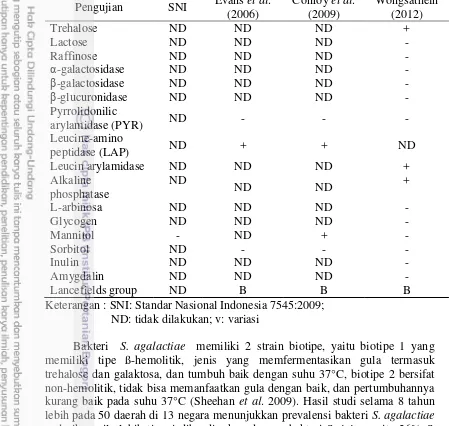
Bakteri S. agalactiae memiliki 2 strain biotipe, yaitu biotipe 1 yang memiliki tipe ß-hemolitik, jenis yang memfermentasikan gula termasuk trehalose dan galaktosa, dan tumbuh baik dengan suhu 37°C, biotipe 2 bersifat non-hemolitik, tidak bisa memanfaatkan gula dengan baik, dan pertumbuhannya kurang baik pada suhu 37°C (Sheehan et al. 2009). Hasil studi selama 8 tahun lebih pada 50 daerah di 13 negara menunjukkan prevalensi bakteri S. agalactiae pada ikan nila lebih tinggi dibandingkan dengan bakteri S. iniae, yaitu 26% S. agalactiae biotipe 1, dan 56% S. agalactiae biotipe 2, sedangkan 18% sisanya diidentifikasi sebagai S. iniae. Daerah prevalensi bakteri penyebab streptococcosis di berbagai negara disajikan pada Gambar 2.
Streptococcus memproduksi beberapa jenis toksin protein dan enzim yang mampu membunuh atau menghancurkan susunan sel inang yang memungkinkan bakteri memanfaatkan nutrisi inang untuk berkembangbiak. Pada beberapa kasus, toksin protein dan enzim tersebut berperan penting dalam resistensi terhadap sistem imun inang, baik komponen itu sendiri ataupun kombinasi dengan faktor virulen pada sel seperti kapsul atau protein permukaan. Segura dan Gottschalk (2004) menjelaskan faktor virulensi ekstraseluler pada bakteri ini terdiri dari kapsul polisakarida, hemolisin, pirogenik eksotoksin, hialuronidase, CAMP-faktor, superoksida dismutase dan bakteriosin. Glaser et al. (2002) menjelaskan faktor virulensi bakteri ini terdapat pada produk ekstraseluler diantaranya adalah kapsul polisakarida, protein permukaan dan protein hasil metabolisme. Selain faktor virulensi yang menjelaskan karakteristik interistik dari bakteri ini, patogenesitas S. agalactiae merupakan hal penting untuk diketahui terkait dengan proses perjalanan bakteri dari awal infeksi hingga menyebabkan kematian pada inang dalam upaya pengendalian penyakit. Hardi (2011) menyatakan bahwa tipe non hemolitik lebih virulen dibandingkan dengan tipe ß hemolitik dilihat dari jumlah kematian yang lebih cepat dan banyak, perubahan pola renang, pola makan dan patologi anatomi secara makroskopis dan mikroskopis.
Gambar 5 Distribusi global S. agalactiae biotipe 1, dan biotipe 2, serta S. iniae Sumber: Sheehan et al. (2009).
Sistem Imun Pada Ikan
GALT yaitu gut associated limfoid tissue. Produk jaringan limfoid adalah sel-sel darah dan respons imunitas baik sel-seluler maupun humoral. Respons pertahanan seluler ikan merupakan respons yang bersifat nonspesifik (Anderson, 1974). Respons ini meliputi pertahanan mekanik dan kimiawi (mukus, kulit, sisik dan insang) dan pertahanan seluler (sel makrofag, leukosit seperti monosit, netrofil, eosinofil dan basofil).
3 MATERI DAN METODE
Uji Pertumbuhan Pembuatan pakan uji
Pakan komersial yang memiliki kandungan protein 40% dicampur dengan rElGH dosis 2 mg/kg pakan. Pencampuran pakan dilakukan berdasarkan metode Hardiantho et al. (2012), yaitu rElGH dilarutkan dalam 15 mL PBS dicampur dengan 2 mg kuning telur ayam, dihomogenkan menggunakan vorteks, kemudian disemprotkan secara merata pada 100 g pakan. Selanjutnya pakan dikeringudarakan sebelum diberikan ke ikan. Pakan diberikan dengan frekuensi tiga kali sehari (pagi, siang dan sore) secara at satiation (sampai kenyang). Pakan mengandung rElGH diberikan dua hari sekali, selama dua minggu pemberian. Penyifonan dan pergantian air sebanyak 25-50% dilakukan dua kali per minggu untuk menjaga kestabilan kualitas air.
Persiapan wadah dan media pemeliharaan
Wadah yang digunakan berupa fiber bulat dengan kapasitas air 1,5 ton sebanyak 9 buah (6 bak perlakuan dan 3 bak kontrol). Bak fiber yang akan digunakan terlebih dahulu dibersihkan dengan menggunakan detergen lalu dikeringkan. Selanjutnya didesinfeksi menggunakan klorin dosis 30 mg/L selama 24 jam, setelah itu bak fiber dibersihkan dan dikeringkan kembali. Bak fiber kemudian diisi air dengan volume 1 ton, dan dipasang aerasi sebanyak dua titik per bak.
Persiapan hewan uji
Hewan uji yang digunakan pada penelitian ini adalah ikan nila biru, srikandi dan nirwana. Ikan diadaptasikan dengan kondisi pemeliharaan, kemudian diseleksi untuk mendapatkan ukuran yang relatif seragam dengan bobot 0.32±0.14 g/ekor dan panjang 2.1±0.32 cm/ekor. Benih dipelihara dalam bak fiber dengan kepadatan 200 ekor per bak.
Parameter Pertumbuhan
Analisis Proksimat
Analisis proksimat dilakukan setelah akhir pemeliharaan untuk membandingkan kandungan nutrien ikan nila biru, srikandi dan nirwana. Parameter protein, lemak, abu dan BETN diukur sesuai dengan metode analisis proksimat menurut Takeuchi (1988) pada sampel daging ikan sebanyak 10 ekor per strain (Lampiran 8).
Uji Tantang Bakteri S. agalactiae
Rancangan perlakuan disajikan pada Tabel 2. Setiap perlakuan diberi 3 kali pengulangan. Uji tantang dilakukan pada wadah akuarium (604050 cm3)
dengan padat tebar 20 ekor ikan. Ikan uji berukuran 10-15 g/ekor merupakan ikan hasil uji pertumbuhan. Masing-masing perlakuan diinjeksi dengan suspensi bakteri S. agalactiae tipe non-hemolitik (NK1) dosis 107 CFU/mL (LD50 pada
ikan nirwana) sebanyak 0.1 mL per ekor. Bakteri S. agalactiae yang digunakan berasal dari koleksi Laboratorium Kesehatan Ikan Balai Penelitian Perikanan Air Tawar Bogor. Sebagai kontrol negatif ikan diinjeksi dengan larutan PBS (phosphate buffer saline) sebanyak 0.1 mL per ekor. Uji tantang penyakit dilakukan selama 1 bulan.
Tabel 2. Perlakuan pemberian rElGH dan uji tantang
Perlakuan Keterangan
A Ikan nila biru, pakan + rElGH diuji tantang B Ikan nila biru, pakan non-rElGH diuji tantang C Ikan nila srikandi, pakan + rElGH diuji tantang D Ikan nila srikandi, pakan non-rElGH diuji tantang E Ikan nila nirwana, pakan + rElGH diuji tantang F Ikan nila nirwana, pakan non-rElGH diuji tantang
Parameter Gambaran Darah
Parameter gambaran darah yang diamati pada penelitian ini meliputi total eritrosit, total leukosit, hematokrit dan titer antibodi (Lampiran 9).
Kematian ikan
Pengamatan mean time to death(MTD) dilakukan untuk mengetahui rerata waktu kematian ikan uji yang terinfeksi S. agalactiae dihitung menurut Kamiso (2001) dengan rumus:
Keterangan: MTD = Mean Time to Death (rerata waktu kematian) a = waktu kematian (jam)
b = jumlah ikan mati setiap waktu pengamatan
Histopatologi dan Gejala Klinis
Pengamatan histopatologi ikan dilakukan untuk mengetahui kerusakan jaringan ikan yang terinfeksi S. agalactiae yaitu jaringan pada organ mata, otak, limpa, hati dan ginjal ikan.
Analisis perubahan tingkah laku dan anatomi tubuh
Perubahan pola berenang yang diamati adalah perubahan gerakan pada kolom air (berenang di permukaan, melayang atau di dasar akuarium), perpindahan badan (lemah atau agresif), bentuk cara berenang (berulang, berputar dan tidak beraturan) dan gerakan operkulum. Tingkah laku makan diamati dengan mengamati respons ikan terhadap pakan yang diberikan. Perubahan anatomi organ luar dan organ dalam. Perubahan yang diamati pada anatomi luar berupa kondisi mata, warna tubuh, pendarahan dan adanya kelainan lain dalam tubuh, sedangkan perubahan anatomi organ dalam berupa perubahan warna, bentuk dan konsistensi organ otak dan ginjal ikan.
Kualitas Air
Parameter kualitas air yang diukur pada penelitian ini adalah oksigen terlarut, derajat keasaman (pH), amonia dan nitrit yang diukur pada awal dan akhir penelitian. Suhu diukur setiap 7 hari sekali.
Analisis Data
4 HASIL DAN PEMBAHASAN
Hasil
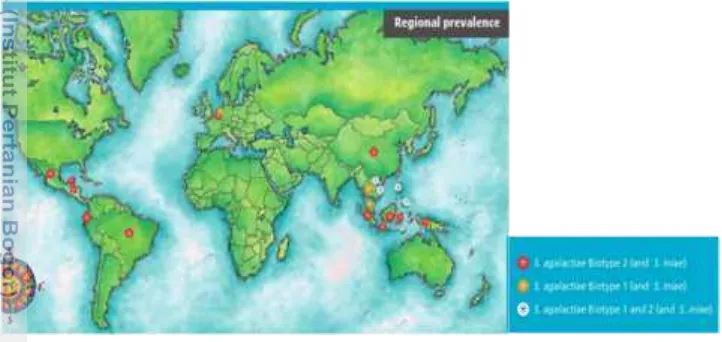
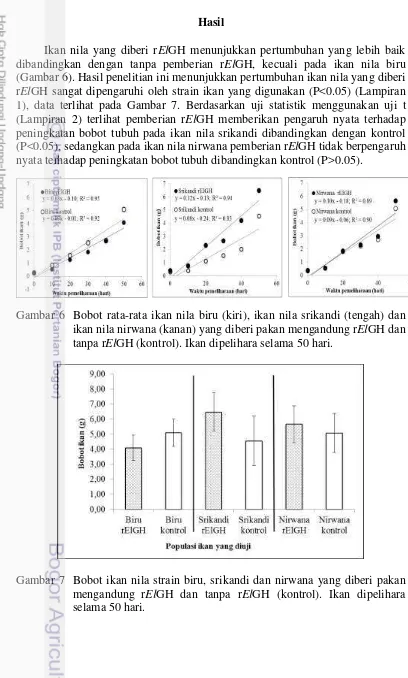
Ikan nila yang diberi rElGH menunjukkan pertumbuhan yang lebih baik dibandingkan dengan tanpa pemberian rElGH, kecuali pada ikan nila biru (Gambar 6). Hasil penelitian ini menunjukkan pertumbuhan ikan nila yang diberi rElGH sangat dipengaruhi oleh strain ikan yang digunakan (P<0.05) (Lampiran 1), data terlihat pada Gambar 7. Berdasarkan uji statistik menggunakan uji t (Lampiran 2) terlihat pemberian rElGH memberikan pengaruh nyata terhadap peningkatan bobot tubuh pada ikan nila srikandi dibandingkan dengan kontrol (P<0.05), sedangkan pada ikan nila nirwana pemberian rElGH tidak berpengaruh nyata terhadap peningkatan bobot tubuh dibandingkan kontrol (P>0.05).
Gambar 6 Bobot rata-rata ikan nila biru (kiri), ikan nila srikandi (tengah) dan ikan nila nirwana (kanan) yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol). Ikan dipelihara selama 50 hari.
Bobot akhir ikan nila srikandi dan nirwana yang diberi rElGH adalah lebih tinggi (P<0.05) dibandingkan dengan kontrolnya, masing-masing sebesar 6.08±1.26 g dan 5.32±1.31 g (Tabel 3). Hasil ini selaras pula dengan nilai laju pertumbuhan hariannya yang lebih tinggi dibandingkan kontrol. Berbeda dengan kedua strain tersebut, pertumbuhan mutlak dan laju pertumbuhan harian ikan nila biru kontrol lebih tinggi (P<0.05) dibandingkan dengan yang diberi rElGH. Hal tersebut diduga sebagai akibat dari sintasan yang rendah (Tabel 3), dan kepadatan ikan lebih rendah sehingga pertumbuhan lebih tinggi daripada ikan perlakuan rElGH. Ikan nila srikandi yang diberi rElGH memiliki pertumbuhan mutlak dan LPH tertinggi, hal ini diduga karena ikan srikandi merupakan hasil pemuliaan melalui jalur hibridisasi antara ikan nila nirwana dan ikan nila biru (KEP.09/MEN/2012). Dengan demikian, respons pertumbuhan ikan nila srikandi yang lebih tinggi daripada kedua strain lainnya diduga sebagai efek hibridisasi.
Tabel 3 Pertumbuhan bobot mutlak, laju pertumbuhan harian dan sintasan tiga strain ikan nila yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) Srikandi control 0.30±0.18 4.55±1.66 4.25±1.61 0.09±0.03 84.5 Nirwana rElGH 0.34±0.17 5.67±1.23 5.32±1.31 0.11±0.03 83.0 Nirwana control 0.37±0.18 5.26±1.29 4.89±1.30 0.10±0.03 78.0 Keterangan: biru= ikan nila biru, srikandi= ikan nila srikandi, nirwana= ikan nila
nirwana
Pertumbuhan ikan nila berdasarkan nilai panjang standar (Gambar 3 dan 4) menunjukkan pola yang sama dengan pertumbuhan bobot tubuh. Nilai rerata panjang standar akhir tertinggi terdapat pada ikan nila srikandi yang diberi rElGH (5.5 cm). Berdasarkan uji statistik, interaksi antara ikan dengan rElGH memberikan pengaruh yang nyata (P<0.05), baik terhadap panjang standar maupun panjang total ikan pada waktu pemeliharaan 50 hari (Lampiran 4).
Gambar 9 Panjang standar (cm) ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol). Ikan dipelihara selama 50 hari.
Salah satu parameter keberhasilan kegiatan budidaya adalah sintasan ikan. Nilai sintasan selama pemeliharaan 50 hari tersaji pada Tabel 4 menunjukkan adanya pengaruh pemberian rElGH pada ikan nila. Ikan nila biru dan nirwana yang mengonsumsi pakan rElGH memiliki nilai sintasan yang lebih tinggi (81 dan 83%) dibandingkan dengan kontrol, sedangkan pada ikan nila srikandi antara perlakuan dan kontrol relatif sama.
Proksimat Daging
Hasil analisis proksimat daging ikan nila tersaji pada Tabel 4. Penambahan rElGH pada pakan ikan nila meningkatkan kadar protein dalam tubuh ikan nila biru dan srikandi, namun tidak terjadi pada ikan nila nirwana.
Tabel 4 Kadar proksimat daging tiga strain ikan nila diberi pakan mengandung rElGH dan tanpa rElGH (kontrol)
Perlakuan Abu Protein Lemak BETN
Biru rElGH 14.73 58.04 26.96 0.27 Biru kontrol 13.97 56.04 29.81 0.18 Srikandi rElGH 18.27 60.37 20.21 1.14 Srikandi kontrol 17.82 56.85 25.08 0.24 Nirwana rElGH 17.06 55.04 27.59 0.30 Nirwana kontrol 22.02 57.39 20.31 0.22 Keterangan: serat kasar tidak terdeteksi
pada budidaya ikan nila (Ariyanto et al. 2010) dan kualitas air optimal untuk budidaya ikan (Boyd 1990) adalah suhu (28.3-30 dan 25-32oC), oksigen terlarut (1.67-5.48 dan > 5 mg/L), pH (7.29-7.8 dan 6.5-9), amonia (0.1-0.29 mg/L dan < 1 mg/L) dan nitrit (0.04-0.07 dan < 0.5 mg/L).
Tabel 5 Kisaran data kualitas air selama 50 hari pemeliharaan
Perlakuan Suhu (oC) pH Oksigen terlarut
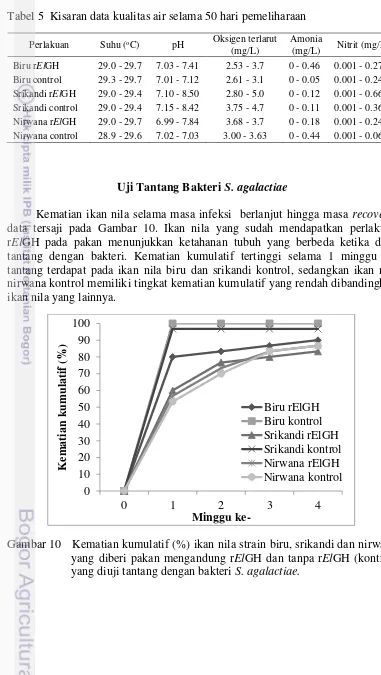
Kematian ikan nila selama masa infeksi berlanjut hingga masa recovery, data tersaji pada Gambar 10. Ikan nila yang sudah mendapatkan perlakuan rElGH pada pakan menunjukkan ketahanan tubuh yang berbeda ketika diuji tantang dengan bakteri. Kematian kumulatif tertinggi selama 1 minggu uji tantang terdapat pada ikan nila biru dan srikandi kontrol, sedangkan ikan nila nirwana kontrol memiliki tingkat kematian kumulatif yang rendah dibandingkan ikan nila yang lainnya.
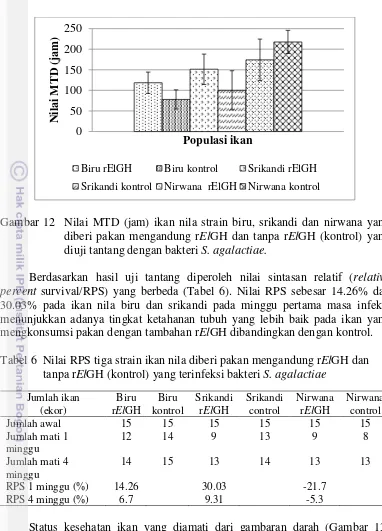
Gambar 10 Kematian kumulatif (%) ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang diuji tantang dengan bakteri S. agalactiae.
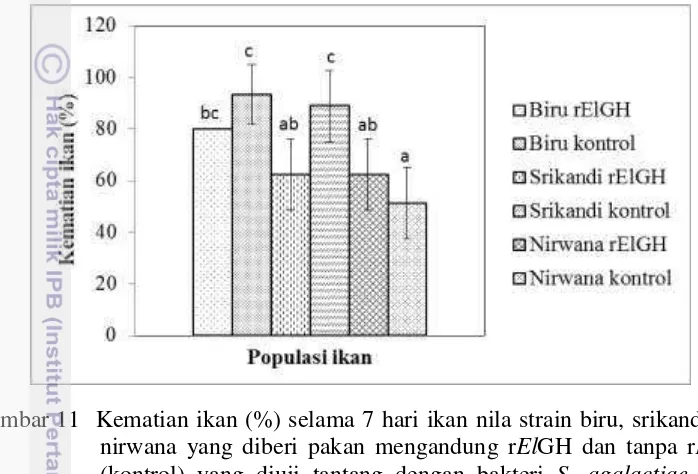
Persentase kematian ikan yang terlihat pada Gambar 11 saat 1 minggu pascatantang menunjukkan adanya pengaruh penambahan rElGH dalam pertahanan melawan infeksi S. agalactiae pada ikan nila biru dan srikandi. Berdasarkan hasil uji statistik diketahui bahwa strain ikan memberikan pengaruh yang nyata (P<0.05) terhadap jumlah kematian ikan akibat infeksi bakteri S. agalactiae (Lampiran 5). Berdasarkan hasil uji lanjut Duncan diketahui bahwa ikan nila nirwana memiliki jumlah kematian yang paling sedikit (P<0.05) dibandingkan dengan nila srikandi dan nila biru (Lampiran 6).
Gambar 11 Kematian ikan (%) selama 7 hari ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang diuji tantang dengan bakteri S. agalactiae. Data (mean ± SE) dengan huruf berbeda pada bar menunjukkan berbeda nyata antar perlakuan (Duncan; P<0.05).
Gambar 12 Nilai MTD (jam) ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang diuji tantang dengan bakteri S. agalactiae.
Berdasarkan hasil uji tantang diperoleh nilai sintasan relatif (relative percent survival/RPS) yang berbeda (Tabel 6). Nilai RPS sebesar 14.26% dan 30.03% pada ikan nila biru dan srikandi pada minggu pertama masa infeksi menunjukkan adanya tingkat ketahanan tubuh yang lebih baik pada ikan yang mengkonsumsi pakan dengan tambahan rElGH dibandingkan dengan kontrol.
Tabel 6 Nilai RPS tiga strain ikan nila diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang terinfeksi bakteri S. agalactiae
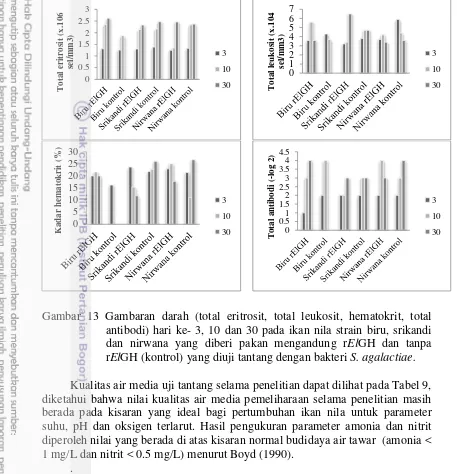
Jumlah ikan menjelaskan pada hari ke-3 setelah uji tantang kondisi fisiologi ikan terganggu akibat infeksi bakteri. Kisaran nilai eritrosit, leukosit, hematokrit dan titer antibodi pada ikan kontrol negatif berturut-turut adalah 1.24-2.74x106 sel/mm3, 2.4-4x104 sel/mm3, 11-46% dan 1-2. Penurunan hematokrit dan meningkatnya jumlah leukosit pada ikan perlakuan menunjukkan bahwa ikan sedang mengalami infeksi dan tubuh ikan mengantisipasi kondisi tersebut dengan memproduksi leukosit lebih banyak sebagai respons imunitas. Total eritrosit ikan perlakuan meningkat sampai akhir pemeliharaan ikan. Peningkatan total eritrosit berkaitan dengan kemampuan ikan dalam memproduksi hemoglobin yang berfungsi mengikat oksigen dan mengedarkan ke seluruh tubuh. Nilai antibodi perlakuan berkisar antara 1-4. Antibodi yang jumlah dan konsentrasinya
0
lebih banyak dalam serum darah merupakan penangkal serangan agen penyakit yang masuk ke dalam tubuh.
Gambar 13 Gambaran darah (total eritrosit, total leukosit, hematokrit, total antibodi) hari ke- 3, 10 dan 30 pada ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang diuji tantang dengan bakteri S. agalactiae.
Kualitas air media uji tantang selama penelitian dapat dilihat pada Tabel 9, diketahui bahwa nilai kualitas air media pemeliharaan selama penelitian masih berada pada kisaran yang ideal bagi pertumbuhan ikan nila untuk parameter suhu, pH dan oksigen terlarut. Hasil pengukuran parameter amonia dan nitrit diperoleh nilai yang berada di atas kisaran normal budidaya air tawar (amonia < 1 mg/L dan nitrit < 0.5 mg/L) menurut Boyd (1990).
.
Tabel 7 Kisaran data kualitas air media uji tantang penyakit
Gambar 14 menunjukkan beberapa gejala klinis ikan nila yang teramati pasca infeksi dengan bakteri S. agalactiae. Gejala klinis yang timbul meliputi respon terhadap pakan lemah, warna tubuh pucat, garis vertikal tubuh menghitam, pembengkakan pada mata (exopthalmia), kekeruhan pada mata (opacity), mata memutih (purulens), mata mengkerut, perubahan pola renang (whirling, berenang lemah), penjernihan operkulum (clear operculum), pembengkakan bagian perut dan pembengkokan bagian tubuh.
Keterangan: (1) ikan nila normal; (2) sirip punggung tegak; (3) ikan bergerombol dan memojok; (4) tubuh menghitam; (5) garis vertikal tubuh menghitam dan bibir putih; (6) berenang lemah dan whirling; (7) mata membengkak (exopthalmia); (8 atas) mata berkabut (opacity), perut membengkak dan warna tubuh pucat; (8 bawah) pelepasan sisik dan mata lisis serta penjernihan operkulum; (9) tubuh membengkok.
Gambar 14 Gejala klinis pada ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang diuji tantang dengan bakteri S. agalactiae
Limpa ikan nila yang diinjeksi dengan S. agalactiae menunjukkan adanya kerusakan struktural, yaitu adanya hipertropi, hemorrhagi, nekrosa dan pusat melano makrofag. Perubahan yang terjadi pada limpa ikan nila pasca diinjeksi dengan S. agalactiae terlihat pada Gambar 15.
Keterangan : a. Normal; b. Nila Biru; c. Nila Srikandi; d. Nila Nirwana; Hp hiperplasia; Hr hemorrhage; mmc melano macrofage centre; N degenerasi dan nekrosis.
Gambar 15 Histopatologi organ limpa pada ikan nila strain biru, srikandi dan nirwana yang diberi pakan mengandung rElGH dan tanpa rElGH (kontrol) yang diuji tantang dengan bakteri S. agalactiae
PEMBAHASAN
pemberian melalui injeksi, imersi, oral, atau kombinasi imersi dan oral (Handoyo 2012).
Tingginya performa pertumbuhan pada ikan nila srikandi merupakan salah satu keunggulan dari ikan hasil hibridisasi di mana persilangan antar strain merupakan salah satu cara untuk mendapatkan strain dengan keragaan budidaya yang meningkat. Ikan nila srikandi merupakan benih hasil persilangan antara nila nirwana dan nila biru. Menurut Noor (2000) hibridisasi juga dapat meningkatkan proporsi gen-gen yang heterozigot dan menurunkan proporsi gen yang homozigot, keturunannya cenderung menampilkan keragaan yang lebih baik dari rataan keragaan salah satu atau kedua tetuanya untuk sifat-sifat tertentu. Berdasarkan keunggulan yang dimiliki sebagai ikan nila hibrida, maka pertumbuhan ikan nila srikandi dapat lebih dipacu dengan penambahan rElGH yang terbukti memberikan pengaruh positif pada pertumbuhannya. Muhammad (2014) menyatakan bahwa pemberian rElGH secara oral pada dosis 0.03 sampai 3.00 mg/kg pakan memberikan respons pertumbuhan yang sama (p>0.05) dan dapat meningkatkan pertumbuhan sebesar 24.07 sampai 31.68%, dan pada fase pembesaran diketahui nila Srikandi memiliki laju pertumbuhan spesifik sebesar 3.36%. Hasil penelitian ini menunjukkan ikan nila srikandi memberikan respons positif terhadap pemberian rElGH pada pakan dengan nilai respons relatif pertumbuhan bobot sebesar 42.26% dan panjang standar sebesar 12.10%. Berdasarkan uji T hasil tersebut berbeda nyata dibandingkan dengan srikandi kontrol (P<0.05). Peningkatan tersebut disebabkan karena hormon rGH yang diberikan melalui pakan ini diduga dapat diterima oleh reseptor dalam tubuh sehingga memberikan pengaruh yang terjadi melalui mekanisme secara langsung. Pemberian rGH dalam bentuk protein total menunjukkan bahwa peningkatan bobot ikan nila yang dinjeksi dengan rElGH (20,94%) lebih tinggi daripada yang diinjeksi dengan rCcGH (18.09%), dan rOgGH (16.99%) (Alimuddin et al. 2010). Efektivitas pemberian rElGH pada ikan nila juga dilaporkan oleh Hardiantho et al. (2012) bahwa pemberian rGH ikan kerapu kertang lebih efektif dan efisien sehingga dapat diturunkan 10 dan 100 kali lebih rendah dibandingkan dengan rGH ikan mas yang diberikan pada ikan nila. Menurut Irmawati et al. (2012) tingkat produksi dalam pembuatan rGH ikan kerapu kertang Epinephelus lanceolatus (rElGH) lebih tinggi dibandingkan rGH ikan mas Cyprinus carpio (rCcGH) dan rGH ikan gurami Osphronemus goramy (rOgGH).
meregulasi pertumbuhan baik secara langsung maupun tidak langsung. Mekanisme secara langsung adalah GH akan langsung mempengaruhi pertumbuhan organ tanpa perantara IGF-1 di dalam hati. Mekanisme tidak langsung adalah mekanisme GH dalam mempengaruhi pertumbuhan yang dimediasi oleh IGF-1 dalam hati ikan. Ada beberapa faktor lain yang berperan dalam mekanisme ini, yaitu: reseptor GH (GHr), GH binding proteins (GHBPs), IGF binding proteins (IGFBPs), dan reseptor IGF. GHr berfungsi dalam menangkap sinyal GH yang disekresikan oleh pituitari, GHBPs berfungsi dalam melindungi dan pengangkutan GH dari pituitari di dalam darah. IGFBPs berfungsi dalam melindungi dan mengangkut IGF-1 di dalam darah menuju ke organ target. Reseptor IGF-1 berfungsi untuk menangkap sinyal IGF-1 dalam organ-organ yang menjadi target (Wong et al. 2006; Debnanth 2010).Sementara itu GH secara langsung juga merangsang pertumbuhan somatik melalui metabolisme protein, lemak, karbohidrat dan mineral (Moriyama dan Kawauchi 2001).
Ikan nila srikandi yang diberi tambahan rElGH dalam pakan menunjukkan pertumbuhan panjang dan bobot terbaik. Hasil ini mengindikasikan bahwa pemberian rElGH mempengaruhi nafsu makan ikan terhadap pakan perlakuan, namun tidak semua ikan yang diberi pakan rElGH menunjukkan hasil yang positif, seperti pada ikan nila biru yang memiliki performa paling rendah. Menurut Volkoff et al. (2005) dan Debnanth (2010), peningkatan nafsu makan ikan diduga dipengaruhi oleh peningkatan hormon ghrelin yang diinduksi hormon pertumbuhan. Pemberian pakan seperti itu bisa memaksa ikan untuk memakan pakan yang lebih banyak, sehingga kerja sistem pencernaan lebih berat. Hal ini menyebabkan jumlah energi yang dibutuhkan mencerna makanan dan menguraikan protein meningkat pula. Akibatnya energi yang semestinya digunakan untuk tumbuh dipakai untuk mencerna dan menguraikan protein tersebut (Rustidja, 1996). Berdasarkan hasil penelitian diketahui bahwa kandungan protein ikan perlakuan lebih tinggi dibandingkan dengan kontrol (Tabel 3), sebaliknya kandungan lemak ikan kontrol lebih tinggi dibandingkan ikan perlakuan. Pemberian rElGH melalui pakan pada penelitian ini diduga menyebabkan terjadinya peningkatan sintesis protein. Seperti yang dilaporkan oleh beberapa peneliti bahwa dengan pemberian rGH dapat meningkatkan sintesis protein dan menurunkan sintesis lemak pada mamalia (Pell et al. 1990; Johnsson et al. 1987) dan menstimulasi anabolisme dalam meningkatkan penggantian dan sintesis protein pada ikan, yang terjadi pada hati dan otot dengan menstimulasi efisiensi dari translasi ribosom melalui peningkatan konsentrasi mRNA dan ribosom (Foster et al. 1991; Herbert et al. 2001). Mekanisme tersebut diduga melalui optimasi pemanfaatan protein sebagai sumber energi untuk pertumbuhan. Selanjutnya, penurunan kadar lemak tubuh pada ikan perlakuan diduga berkaitan dengan aktivitas enzim lipase, sesuai yang dikemukakan oleh Irmawati et al. (2012) bahwa aktivitas enzim lipase ikan gurame yang diberi rGH lebih tinggi dibandingkan dengan ikan kontrol.
rendah pada ikan kontrol terutama pada ikan nila srikandi dan nirwana. Walaupun ukuran dan umur ikan, jenis pakan, dan beberapa faktor eksperimental dapat mempengaruhi komposisi kimia tubuh; penyebab berbedanya hasil penelitian-penelitian tersebut lebih disebabkan karena perbedaan respons spesies, jenis rGH dan dosis yang berbeda-beda (Liu et al. 2008).
GH secara tidak langsung terlibat di dalam pertumbuhan linier skeleton melalui (IGF-1) dan secara langsung mempengaruhi pertumbuhan somatik dengan cara merangsang pelepasan somatomedin dan metabolisme protein, lipid, karbohidrat dan mineral (Moriyama dan Kawauchi 2001; Bolander 2004). GH juga mempunyai peranan penting dalam proses-proses reproduksi, osmoregulasi, nafsu makan dan perilaku (Reinecke et al. 2005). Di samping itu GH merupakan salah satu modulator penting bagi sistem imun ikan (Harris dan Bird 2000). Berdasarkan hasil penelitian diperoleh peningkatan nilai sintasan ketiga strain ikan nila yang diberi pakan tambahan rElGH dibandingkan dengan ikan nila biru kontrol yaitu nila biru (23.66%), srikandi (28.24%) dan nirwana (26.72%). Peningkatan sintasan pada ikan yang diberi perlakuan rElGH membuktikan bahwa rGH mampu meningkatkan kekebalan tubuh/imunitas pada ikan dari stres akibat kondisi lingkungan yang tidak sesuai.
Studi tentang kaitan antara pemberian rGH dengan peningkatan kapasitas sistem imun telah dilakukan oleh Acosta et al. (2008) yang menemukan peningkatan respons imunitas bawaan pada larva ikan tilapia yang direndam dengan recombinant truncated tiGH. Aktivitas lisozim dan haemaglutinasi lektin pada kelompok ikan eksperimental meningkat secara signifikan dibandingkan kelompok ikan kontrol. Studi lain menunjukkan bahwa injeksi nGH dan rGH dari ikan chum salmon, dapat meningkatkan kelangsungan hidup ikan rainbow trout terhadap infeksi bakteri patogen Vibrio anguilarum sebesar 10 kali lebih tinggi dibandingkan kelompok ikan kontrol (Sakai et al. 1997). Efek rGH terhadap sintasan larva juga telah dievaluasi oleh Acosta et al. (2009) pada larva ikan koki, melalui perendaman tiga kali seminggu selama 75 hari dapat meningkatkan sintasan 22% lebih tinggi dibandingkan kelompok larva yang tidak mendapatkan perlakuan.
Kisaran data kualitas air seperti pada Tabel 5 menggambarkan bahwa kondisi lingkungan pemeliharaan masih mendukung untuk pertumbuhan, sehingga tidak menjadi pemicu stres pada ikan. Kualitas air seperti suhu, oksigen terlarut, amonia, pH dan nitrit pada semua perlakuan berada dalam kisaran normal untuk budidaya ikan nila, sehingga perbedaan hasil penelitian yang meliputi data bobot, panjang tubuh, proksimat dan sintasan disebabkan oleh perbedaan perlakuan dan bukan karena pengaruh kualitas air yang berbeda. Konsentrasi kandungan oksigen terlarut yang rendah (2.5 mg/L) pada hasil penelitian ini masih mampu mendukung untuk pertumbuhan ikan nila. Ikan nila
masih dapat bertahan pada konsentrasi oksigen terlarut yang sangat rendah (≤
0.3 mg/L) untuk beberapa jam, meskipun demikian konsentrasi oksigen terlarut pada budidaya ikan nila diusahakan di atas 1 mg/L. Metabolisme, pertumbuhan dan resistensi penyakit akan menurun ketika konsentrasi oksigen terlarut turun pada level rendah dalam waktu yang cukup lama (Popma dan Masser 1999).
sampai mencapai bobot 10-15 g/ekor. Kemudian semua ikan diuji tantang streptococcosis, bakteri yang digunakan adalah S. agalactiae tipe non-hemolitik (NK1) dengan dosis 107 CFU/mL selama 1 bulan. Hari pertama pasca uji tantang
pada ikan nila biru dan srikandi kontrol sudah terjadi kematian ikan sebanyak 20-25% per ulangannya. Sedangkan pada perlakuan rElGH, masing-masing strain ikan nila mulai banyak mengalami kematian setelah tiga hari pasca uji tantang. Tingginya tingkat kematian ikan pada semua perlakuan disebabkan oleh tingginya virulensi dan dosis bakteri yang digunakan untuk penginfeksian. Salah satu faktor virulensi S. agalactiae adalah kandungan eksotoksin yang terlarut pada extracellular product (ECP). Diduga ECP S. agalactiae yang terdiri dari kapsular polisakarida, protein permukaan dan beberapa sekresi protein inilah yang membantu bakteri menempel pada sel epitel inang serta menghindari mekanisme pertahanan tubuh inang (Glaser et al. 2002). ECP merupakan salah satu faktor virulensi S. agalactiae. Menurut Hardi (2011) bakteri S. agalactiae tipe non-hemolitik memiliki tingkat virulensi yang lebih tinggi karena konsentrasi protein pada ECP-nya lebih tinggi yaitu 13,64 ppm sedangkan tipe -hemolitik 8,18 ppm. Hasil studi selama 8 tahun lebih yang dilakukan oleh Sheehan et al. (2009) menyatakan bahwa pada 50 daerah di 13 negara termasuk Indonesia menunjukkan prevalensi bakteri S. agalactiae pada ikan nila lebih tinggi dibandingkan dengan bakteri S. iniae, yaitu 26% S. agalactiae tipe ß-hemolitik dan 56% S. agalactiae tipe non-hemolitik sedangkan 18% sisanya diidentifikasi sebagai S. iniae.
Bakteri S. agalactiae menyebabkan penyakit septikemia pada ikan nila, merusak organ otak, ginjal, usus, dan organ lainnya. Penyakit ini biasanya ditandai dengan gejala anoreksia, eksoptalmia, dan gerakan renang tak menentu. Percobaan infeksi buatan pada ikan mullet dan seabream menggunakan isolat S. agalactiae dari otak ikan nila Oreochromis niloticus menyebabkan kematian 100% dan 90%, dengan masa pascainfeksi selama 7 hari, hal ini menandakan bahwa S. agalactiae bersifat virulen yang menyebabkan penyakit epizootik (Evans et al. 2002).
Infeksi streptococcosis pada ikan nila berlangsung selama 2 minggu, pada masa infeksi minggu pertama didapatkan hasil yang berbeda nyata (P<0.05) antar perlakuan (Gambar 11). Hasil penelitian ini mengindikasikan adanya pengaruh rElGH pada peningkatan imunitas tubuh ikan nila yang mendapatkan penambahan rElGH. Hasil penelitian sebelumnya membuktikan bahwa penambahan rElGH mampu meningkatkan sistem imunitas pada udang vannamei dan kerapu bebek. Menurut Subaidah et al. (2012) pada hari ke-8 udang perlakuan perendaman dan dilanjutkan secara oral 50 mg kg-1 pakan rElGH menunjukkan kelangsungan hidup 37,5% lebih tinggi dibandingkan perlakuan kontrol yang diinfeksi. Ikan kerapu bebek yang mendapat aplikasi harian dosis oral 50 mg rElGH-HP55 kg-1 pakan, tingkat kematian setelah uji
tantang LD50 bakteri patogen Vibrio fulnificus 61.53% lebih rendah
dibandingkan kelompok kontrol negatif (Antoro 2014).