PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG
SITI SUBAIDAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul “Respons Pertumbuhan dan Imunitas Udang Vaname Litopenaeus vannamei Terhadap Pemberian Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Siti Subaidah
SITI SUBAIDAH. Respons Pertumbuhan dan Imunitas Udang Vaname
Litopenaeus vannamei Terhadap Pemberian Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang. Dibimbing oleh ODANG CARMAN, KOMAR SUMANTADINATA, ALIMUDDIN dan SUKENDA.
Udang vaname (Litopenaeus vannamei) adalah salah satu komoditas utama dalam program industrialisasi perikanan budidaya tahun 2009-2014. Produksi udang vaname diproyeksikan meningkat sebesar 16% setiap tahun dengan target produksi 500 ribu ton pada tahun 2014. Peningkatan produksi dapat ditempuh dengan berbagai cara, salah satu cara yang efektif adalah dengan aplikasi bioteknologi. Penelitian ini bertujuan untuk mengkaji bioaktivitas hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) pada udang vaname dalam meningkatkan pertumbuhan dan imunitas, khususnya dalam mencari metode aplikasi pemberian rElGH.
Penelitian pertama bertujuan mengkaji respons pertumbuhan udang vaname setelah direndam dengan rElGH. Dosis yang digunakan yaitu 150; 15; 1,5; 0,15; 0,015; 0,0 mgL-1dengan lama perendaman 1 jam dan dipelihara sampai PL14. Hasil penelitian menunjukkan bahwa dosis 15 mgL-1 memberikan peningkatan bobot tubuh, panjang tubuh dan kelangsungan hidup tertinggi (P<0,05) masing-masing sebesar 37,77%; 12,75% dan 9,45% dibandingkan dengan kontrol. Selanjutnya, pemberian rElGH dosis 15 mgL-1dikembangkan dengan lama waktu perendaman 3 jam dapat meningkatkan bobot tubuh sebesar 109,9%; panjang tubuh 26,0%, dan biomassa 66,0% lebih tinggi daripada kontrol. Ekspresi gen
single insulin binding domain (SIBD) pada PL14 yang dianalisis dengan real-time
PCR menunjukkan kenaikan sebesar 3,3 kali pada udang yang direndam rElGH dibandingkan dengan kontrol, dan dapat dinyatakan bahwa SIBD berperan penting dalam induksi pertumbuhan. Tingkat ekspresi moult inhibiting hormone
(MIH) meningkat sekitar 1,3 kali, crustacean hyperglycemia hormone (CHH) meningkat sekitar 5,5 kali, sementara ekspresi cyclopilin A (CypA) pada udang yang direndam rElGH sama dengan kontrol.
Gen yang terkait pertumbuhan udang vaname diantaranya SIBD, CHH, MIH, CypA, sedangkan gen yang terkait imunitas diantaranya lektin dan proPO, adalah gen yang dianalisis dalam penelitian ini, oleh sebab itu harus diuji kebenarannya. Tujuan penelitian tahap ini adalah identifikasi dan analisis ekspresi gen tersebut pada udang vaname. Tingkat ekspresi gen dianalisis menggunakan
perendaman. Pakan perlakuan adalah pakan yang dicampur dengan rElGH yang telah disalut dengan hypromellose phthalate (HP55) dengan dosis rElGH 50 mg kg-1pakan (P1), 5 mg kg-1pakan (P2) dan 0,5 mg kg-1pakan (P3). Sebagai pakan kontrol adalah pakan dicampur dengan HP55 tanpa rElGH (K+), dan pakan tidak dicampur HP55 (K). Pakan perlakuan dan kontrol K+ diberikan 1 kali sehari dengan interval 3 hari. Hasil penelitian menunjukkan bahwa pertumbuhan terbaik (P<0,05) diperoleh pada perlakuan P3. Peningkatan bobot tubuh udang perlakuan P3 sebesar 17,7% dan biomassa sebesar 16,6% dibandingkan dengan kontrol. Panjang tubuh dan kelangsungan hidup udang perlakuan dan kontrol tidak berbeda nyata (P>0,05). Ekspresi SIBD pada P3 meningkat 2,1 kali lipat dibandingkan kontrol. Level ekspresi CypA dan MIH kecil dan cenderung menurun. Berdasarkan hasil peningkatan pertumbuhan yang didukung oleh pola ekspresi gen SIBD, CypA, dan MIH dapat disimpulkan bahwa pemberian rElGH pada fase pasca larva, lebih efektif melalui perendaman dibandingkan oral.
Setelah diketahui metode yang efektif pada fase pembenihan, selanjutnya pada penelitian keempat dilakukan evaluasi respons pertumbuhan udang vaname yang direndam satu kali dengan rElGH pada pasca larva 2 (PL2) dan pada PL14 diberi pakan buatan mengandung rElGH, serta menentukan dosis optimal rElGH dalam pakan. Pemberian pakan buatan mengandung rElGH dilakukan satu kali sehari, 2 kali seminggu selama 4 minggu. Hasil penelitian menunjukkan bahwa perlakuan perendaman PL2 dan dilanjutkan dengan pemberian rElGH secara oral dengan dosis 0,5 mg kg-1 pakan memberikan respons pertumbuhan terbaik. Perlakuan tersebut meningkatkan biomassa sebesar 40,10%; laju pertumbuhan harian 21,25%; retensi protein 71,35%; retensi lemak 52,10%; meningkatkan kadar glikogen otot 129,0 %; dan efisiensi pakan sebesar 28,57% dibandingkan dengan kontrol (P<0,05). Perlakuan rElGH melalui perendaman dan oral juga meningkatkan ekspresi gen terkait pertumbuhan (SIBD dan CHH), dan gen terkait imunitas (lektin dan proPO).
Selanjutnya dilakukan uji respons imun udang vaname terhadap infeksi
infectious myonecrosis virus (IMNV). Inokulum IMNV berdasarkan OIE (2009). Pada hari ke-8, udang perlakuan perendaman dan dilanjutkan secara oral 50 mg kg-1 pakan menunjukkan kelangsungan hidup 37,5% lebih tinggi dibandingkan perlakuan kontrol yang diinfeksi. Peningkatan kelangsungan hidup didukung oleh tingkat ekspresi gen lektin, gen proPO dan nilai THC. Sebagai kesimpulan bahwa perlakuan rElGH meningkatkan respons imun udang vaname terhadap infeksi IMNV.
Berdasarkan uraian diatas, secara umum dapat disimpulkan bahwa pemberian rElGH yang efektif meningkatkan pertumbuhan udang vaname adalah pada fase pembenihan digunakan metode perendaman dengan dosis 15 mg L-1 dan dilanjutkan melalui oral pada fase pembesaran dengan dosis 0,5 mg kg-1 pakan. Metode pemberian rElGH ini berpotensi tinggi meningkatkan produktivitas budidaya.
SITI SUBAIDAH. Growth Response and Immune of White Shrimp Litopenaeus vannamei on Administration of Recombinant Giant Grouper Growth Hormone. Under direction of ODANG CARMAN, KOMAR SUMANTADINATA, ALIMUDDIN and SUKENDA
White shrimp (Litopenaeus vannamei) is one of the major commodities in aquaculture industrialization program in 2009-2014. White shrimp production projected to increase by 16% per year with a target production of 500,000 tons in 2014. Increased production can be reached in various ways, one effective is the application of biotechnology. This study aimed to examine the bioactivity of recombinant giant grouper growth hormone (rElGH) at white shrimp in promoting growth and immunity, particularly in the examine for rElGH administration method.
The first research was aimed to examine the growth response of white shrimp after immersed by different dosage of rElGH. The five different dosage of rElGH, namely 150; 15; 1.5; 0.15; 0.015; 0.0 mgL-1 by 1 hour immersion time were reared up to PL14. The results showed that the dosage of rElGH 15 mgL-1 allowed highest increment in body weight, body length and survival by 37.77%; 12.75%; and 9.45% compared to control (P<0.05), respectively. Furthermore, administration of rElGH at dosage 15 mgL-1 was developed by 3 hours immersion time and could increased body weight of 109.9%; body length of 26.0%; and biomass of 66.0% higher compared to the control. Expression level of single insulin binding domain (SIBD) that analyzed by quantitative real-time PCR in rElGH treated was about 3.3-fold higher than the control, and this suggested that SIBD plays important role in growth induction. Expression level of molt inhibiting hormone (MIH) increased about 1.3-fold, and about 5.5-fold of crustacean hyperglycemia hormone (CHH), while expression of cyclopilin A (CypA) in rElGH treated was similar with of control.
Growth-related genes of white shrimp including SIBD, CHH, MIH, CypA, whereas the immunity-related genes such as lectin and proPo. The research aimed to identify of these genes and analyzed their expression in shrimp post-larvae (PL). Gene expression levels were analyzed using real-time PCR and normalized by β-actin gene expression. Subsequently PCR products were electrophoresed to identify the presence of genes, followed by purification and sequencing. The sequence similarity was analyzed by BLAST-N and aligned with sequences available in GenBank using the GENETYX-7 program. Identification results showed that all genes detected in the samples. Genes expressed at all sample with defference levels. The similarity for the sequences of each gene in GenBank of mRNA SIBD, CHH, MIH, CypA, lectins, proPO, β-actin, were 91%, 89%, 99%, 100%, 99%, 99%, and 84% respectively.
control. While the body length and survival were not significantly different (P> 0.05). mRNA expression of SIBD in P3 increased 2.1-fold of control related with the increase in growth. Expression level of CypA and MIH were small and decreased. Based on the result of growth increasing with support of gene expression i.e. SIBD, CypA, and MIH was conclused that administration rElGH at larvae stage more effective by immersion.
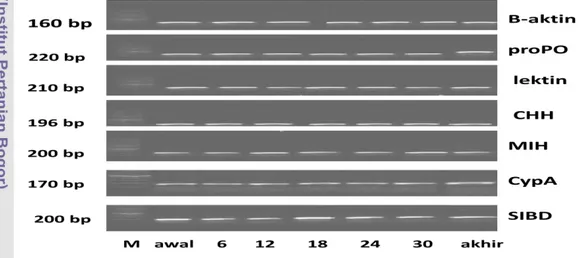
Once known effective method of nursery stage, then in the fourth study evaluated growth response to white shrimp after administration of rElGH by immersion one time in PL2 and the PL14 applied with the artificial feed containing rElGH, and determine the optimal dose rElGH in feed. Feed-rElGH applied once a day, 2 times a week for 4 weeks. The results showed that the rElGH immersion treatment for PL2 and followed by oral administration at a dosage of 0.5 mg kg-1feed allowed the best growth responses. The treatment increased biomass, daily growth rate, protein retention, fat retention, muscle glycogen levels, feed efisiency by 40.1%; 21.25%; 71.35%; 52.10%; 129.0%; 28.57% respectively compared with controls (P<0.05). rElGH treatment with immersion and oral also increased the expression of growth-related genes (SIBD and CHH), and immune-related genes (lectin and proPO).
The research was examined shrimp immune response for IMNV (infectious myonecrosis virus) infections. IMNV inoculum by OIE (2009). On 8th day, shrimp of immersion treatment and continued orally at a dosage of 50 mg kg-1 of feed allowed survival enhance at 37.5% compared to the control with infection. The increasing of survival was supported by gene expression levels of lectin, proPO and the highest THC values. As the conclusion that the rElGH treatment increased white shrimp immune response for IMNV infection.
Based on the description above, in general it can be concluded that the effective of rElGH administration for growth increasing of Litopenaeus vannamei
is the immersion method at nursery stage with a dosage of 15 mg L-1 and continued at grow out stage with orally in dosage of 0.5 mg kg-1 feed. This method is high potential to increase the productivity of aquaculture.
© Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
HORMON PERTUMBUHAN REKOMBINAN IKAN KERAPU
KERTANG
SITI SUBAIDAH
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Penguji pada Ujian Tertutup : 1. Prof. (Ris) Dr. Ir. Ketut Sugama, MS Peneliti pada Pusat Penelitian dan Pengembangan Perikanan Budidaya, Kementerian Kelautan dan Perikanan 2. Prof. Dr. Ir. Muhammad Zairin Junior, M.Sc Staf Pengajar pada Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB
Penguji pada Ujian Terbuka: 1. Dr. Ir. Slamet Soebjakto, M.Si
Direktur Jenderal Perikanan Budidaya, Kementerian Kelautan dan Perikanan 2. Dr. Ir. Dedi Jusadi, M.Sc
Judul Disertasi : Respons Pertumbuhan dan Imunitas Udang Vaname
Litopenaeus vannamei Terhadap Pemberian Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang Nama : Siti Subaidah
NIM : C161090071
Disetujui oleh
Komisi Pembimbing
Dr.Ir. Odang Carman, M.Sc Ketua
PProf.Dr.Ir. Komar Sumantadinata, M.Sc Anggota
Dr. Alimuddin, S.Pi, M.Sc Dr. Ir. Sukenda, M.Sc
Anggota Anggota
Diketahui oleh
Ketua Departemen Budidaya Perairan
Dr.Ir.Sukenda, M.Sc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulisan disertasi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2012 – Januari 2013 ini adalah “Respons Pertumbuhan dan Imunitas Udang Vaname Litopenaeus vannamei Terhadap Pemberian Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang”.Disertasi ini disusun sebagai salah satu syarat untuk memperoleh gelar Doktor di Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penulis sangat menyadari bahwa proses penyelesaian penelitian dan penulisan disertasi ini tidak akan dapat berjalan lancar tanpa dukungan banyak pihak, sehingga pada kesempatan ini penulis mengucapkan terimakasih kepada Dr.Ir.Odang Carman, M.Sc; Prof.Dr. Ir. Komar Sumantadinata, M.Sc; Dr. Alimuddin, S.Pi, M.Sc; Dr.Ir.Sukenda, M.Sc; selaku komisi pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan disertasi. Penulis juga mengucapkan terima kasih kepada Prof.(Ris) Dr.Ir.Ketut Sugama, MS dan Prof. Dr. Ir. Muhammad Zairin Junior, M.Sc selaku penguji luar komisi pada ujian tertutup serta kepada Dr. Ir. Slamet Soebjakto, M.Si dan Dr. Ir. Dedi Jusadi, M.Sc selaku penguji luar komisi pada ujian terbuka atas saran yang diberikan.
Terima kasih penulis ucapkan kepada Kementerian Kelautan dan Perikanan yang telah memberikan beasiswa periode Agustus 2009 – Juli 2012. Selanjutnya, penghargaan penulis sampaikan kepada Ir. Dwi Suharmanto MM selaku Kepala Balai Budidaya Air Payau (BBAP) Situbondo yang telah memberikan izin kepada saya untuk menempuh pendidikan S3 di Institut Pertanian Bogor, dan memberikan fasilitas penelitian. Ucapan terima kasih juga saya sampaikan kepada Kepala Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi, yang juga telah memberikan fasilitas penelitian.
Terima kasih dan penghargaan yang tinggi penulis sampaikan kepada suami dan anak-anak tercinta, Bambang Hadidoso Mardi, Aditya Utama, Rian Carmana, dan Hesti Irissanti; serta seluruh keluarga atas doa dan perhatiannya. Karya ilmiah ini juga saya persembahkan buat ayahanda Roekoen Santosomihardjo (alm) dan ibunda Soemardijah (alm).
M.Si; semoga kerjasama kita tetap terjalin. Terima kasih secara khusus saya sampaikan kepada Dr.Ir.Andi Parenrengi, M.Si yang telah banyak membantu dalam penelitian dan penyusunan disertasi. Ungkapan terima kasih juga saya sampaikan kepada Dudi Lesmana, S.Pi, M.Si yang telah banyak membantu, dan kepada semua pihak yang telah membantu dan tidak mungkin saya sebutkan satu persatu, semoga Allah SWT akan memberikan balasan dengan kebaikan yang berlimpah, amin.
Akhir kata, semoga hasil penelitian ini dapat dimanfaatkan oleh pembudidaya udang vaname sehingga produksi dapat meningkat dan target produksi pada program industrialisasi perikanan budidaya dapat tercapai.
Bogor, Agustus 2013
DAFTAR ISI
Halaman
DAFTAR TABEL ……… xvii
DAFTAR GAMBAR ……… xviii
DAFTAR LAMPIRAN ……… xxvi
1 PENDAHULUAN Latar Belakang……… 1
Tujuan Penelitian……… 4
Manfaat Penelitian……….. 4
Ruang Lingkup Penelitian………. 5
Hipotesis Penelitian………... 5
Tingkat Kebaruan (Novelty)……….. 5
2 RESPONS PERTUMBUHANUDANGVANAME TERHADAP PEMBERIAN HORMON PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG MELALUI PERENDAMAN Pendahuluan……….. 8
Bahan dan Metode ………. 9
Hasil……….. 13
Pembahasan……….. 17
Kesimpulan……… 20
3 ANALISIS SEKUEN GEN TERKAIT PERTUMBUHAN DAN IMUNITAS PADA UDANG VANAME Pendahuluan……….. 23
Bahan dan Metode ……….. 24
Hasil……… 27
Pembahasan………. 38
Kesimpulan………. 42
4 RESPONS PERTUMBUHAN UDANG VANAME TERHADAP PEMBERIAN HORMON PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG MELALUI ORAL Pendahuluan……… 45
Bahan dan Metode……….. 46
Hasil……… 48
Pembahasan……….... 51
5 RESPONS PERTUMBUHAN UDANG VANAMETERHADAP PEMBERIAN HORMON PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG MELALUI PERENDAMAN DAN ORAL
Pendahuluan………... 55
Bahan dan Metode……… 56
Hasil……….. 59
Pembahasan………... 66
Kesimpulan……… 69
6 RESPONS IMUN UDANG VANAME TERHADAP PEMBERIAN HORMON PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG Pendahuluan……….. 72
Bahan dan Metode……… 73
Hasil………. 78
Pembahasan……….. 81
Kesimpulan……… 82
7 PEMBAHASAN UMUM ……….. 83
8 KESIMPULAN DAN SARAN……… 90
DAFTAR PUSTAKA ……… 91
LAMPIRAN ………. 99
DAFTAR TABEL
Halaman
1 Primer spesifik yang dirancang dan sekuen nukleotidanya ………. 13
2 Bobot tubuh, panjang tubuh, kelangsungan hidup, biomasa, dan laju pertumbuhan spesifik (SGR) udang vaname yang direndam dengan
rElGH. ……….. 14 3 Bobot tubuh, panjang tubuh, kelangsungan hidup, dan biomasa udang
vaname yang direndam dengan rElGH 15 mgL-1dengan lama waktu
perendaman 1 jam, 2 jam, dan 3 jam……….. 15
4 Similaritas sekuen mRNA yang diisolasi dari udang vaname dengan
mRNA yang terdapat pada BankGen……….. 30
5 Bobot tubuh, panjang tubuh, kelangsungan hidup, biomasa, dan laju pertumbuhan spesifik (SGR) udang vaname yang diberi rElGH secara
oral ……….. 49
6 Rancangan perlakuan pemberian rElGH dengan metode perendaman
dan oral pada udang vaname……… 57
7 Bobot tubuh, panjang total, laju pertumbuhan harian (ADG), biomassa,dan tingkat konversi pakan (FCR) udang vaname yang diberi hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH)
melalui perendaman dan oral ……… 60
8 Retensi protein dan retensi lemak udang vaname yang diberi rElGH melalui perendaman pada pasca larva dan melalui oral pada fase
pembesaran……….. 61
9 Kadar glukosa darah dan glikogen otot udang vaname yang diberikan rElGH secara perendaman dan oral……….. 61 10 Nilai THC pada awal sebelum uji tantang dan akhir sesudah uji tantang
DAFTAR GAMBAR
Halaman
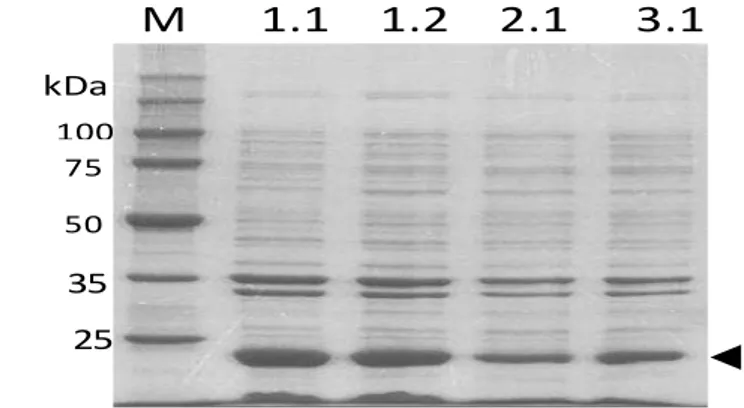
1 Hasil analisis badan inklusi Escherichia coli yang mengandung rElGH menggunakan SDS-PAGE (ditunjukkan dengan tanda kepala panah). M=marker protein prestained protein marker (Promega). Kolom 1.1; 1.2; dan 2.1 masing-masing diproduksi dengan sonikasi 12 siklus, sonikasi 6 siklus, dan lisozim, kemudian disimpan dalam lemari pendingin -80oC. Kolom 3.1 diproduksi dengan sonikasi 6 siklus, kemudian disimpan dalam lemari pendingin -20oC selama 1
bulan……….. 14
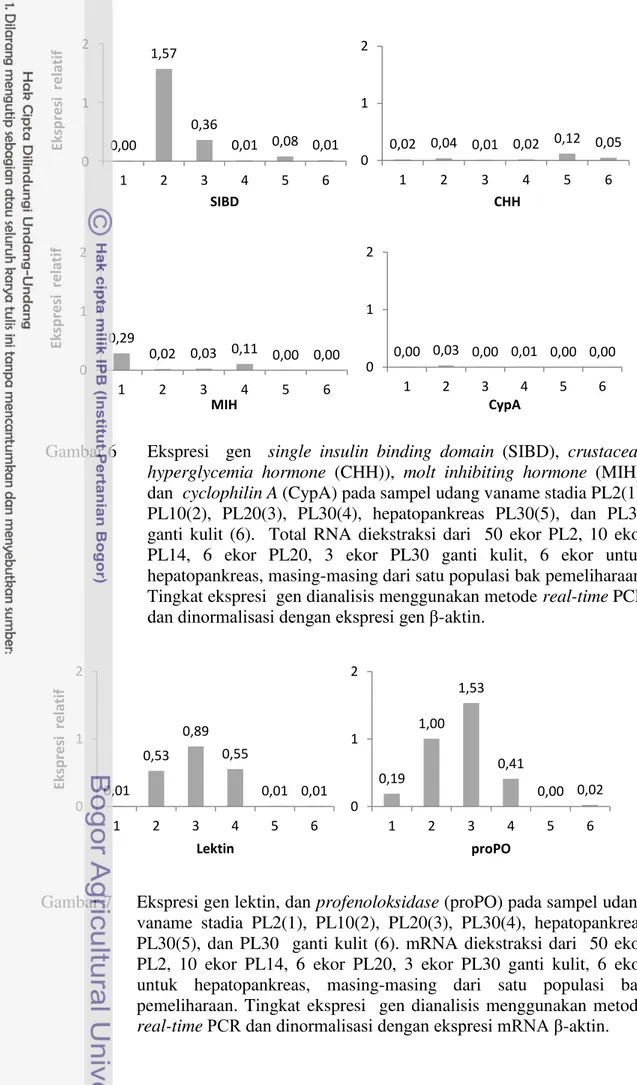
2 Tingkat ekspresi gen single insulin binding domain (SIBD),
cyclophilin A (CypA), molt inhibiting hormone (MIH) dan crustacean hyperglycemia hormone (CHH) dari jam ke-0 sampai ke-30 setelah perlakuan perendaman rElGH 15 mg L-1.Tingkat ekspresi gen dianalisis menggunakan metode real-time PCR dan dinormalisasi dengan ekspresi gen β-aktin ………. 16
3 Tingkat ekspresi gensingle insulin binding domain(SIBD), moult inhibiting hormone (MIH), cyclophilin A (CypA)dan crustacean hyperglycemia hormone (CHH) pada awal : sebelum perendaman dan akhir : 12 hari setelah perendaman hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dosis 15 mg L-1 media dan tanpa perendaman (kontrol). RNA total diekstraksi dari 50 ekor PL2 (awal) dan 9 ekor PL14 (akhir) dari populasi 3 ulangan. Tingkat ekspresi gen dianalisis menggunakan metode real-time PCR dan dinormalisasi dengan ekspresi gen β-aktin……….. 16
4 Tingkat ekspresi gen lektin danprofenoloksidase (proPO) perlakuan perendaman rElGH 15 mg L-1 dan kontrol pada hari ke-12. Tingkat ekspresi gen dianalisis menggunakan metode real-time PCR dan dinormalisasi dengan ekspresi gen β-aktin……… 17
6 Ekspresi gensingle insulin binding domain (SIBD), crustacean hyperglycemia hormone (CHH)), molt inhibiting hormone (MIH), dan cyclophilin A (CypA) pada sampel udang vaname stadia PL2(1), PL10(2), PL20(3), PL30(4), hepatopankreas PL30(5), dan PL30 ganti kulit (6). Total RNA diekstraksi dari 50 ekor PL2, 10 ekor PL14, 6 ekor PL20, 3 ekor PL30 ganti kulit, 6 ekor untuk hepatopankreas, masing-masing dari satu populasi bak pemeliharaan. Tingkat ekspresi gen dianalisis menggunakan metode real-time PCR dan dinormalisasi dengan ekspresi gen β-aktin……….. 28
7 Ekspresi gen lektin, dan profenoloksidase (proPO) pada sampel udang vaname stadia PL2(1), PL10(2), PL20(3), PL30(4), hepatopankreas PL30(5), dan PL30 ganti kulit (6). mRNA diekstraksi dari 50 ekor PL2, 10 ekor PL14, 6 ekor PL20, 3 ekor PL30 ganti kulit, 6 ekor untuk hepatopankreas, masing-masing dari satu populasi bak pemeliharaan. Tingkat ekspresi gen dianalisis menggunakan metode real-time PCR dan dinormalisasi dengan ekspresi mRNA β-aktin………. 28
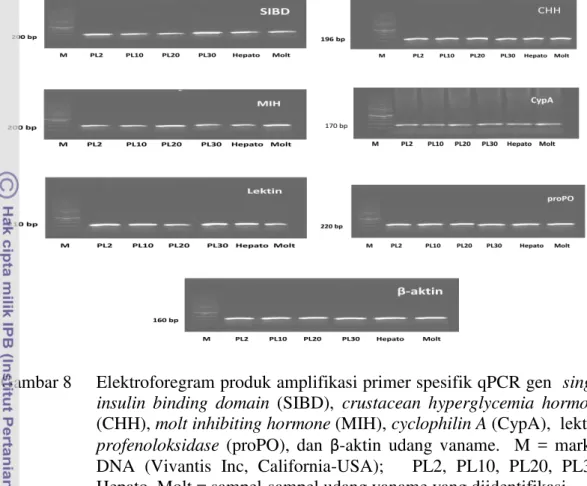
8 Elektroforegram produk amplifikasi primer spesifik qPCR gen single insulin binding domain (SIBD), crustacean hyperglycemia hormone
(CHH), molt inhibiting hormone (MIH), cyclophilin A (CypA), lektin, profenoloksidase (proPO), dan β-aktin udang vaname. M = marker DNA (Vivantis Inc, California-USA); PL2, PL10, PL20, PL30, Hepato, Molt = sampel-sampel udang vaname yang
diidentifikasi………. 29
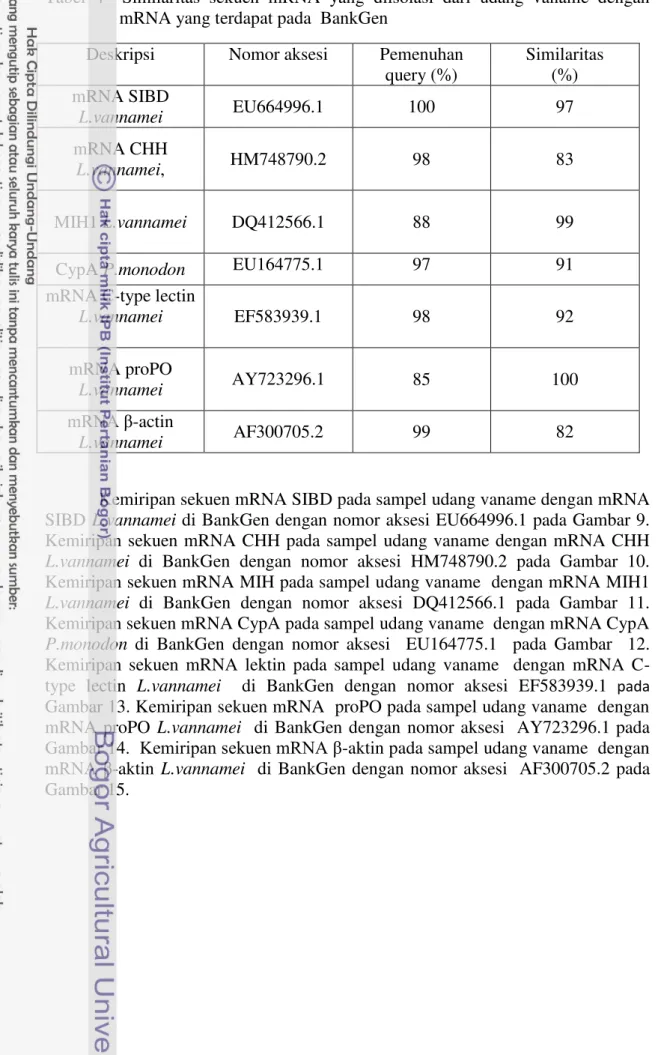
9 Penyejajaran sekuen nukleotida mRNA single insulin binding domain
(SIBD) yang diisolasi dari udang vaname dengan sekuen SIBD (kode aksesi EU664996.1). Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida. A=adenin, C=sitosin, T=timin, G=guanin. Kotak penuh = primer forward; kotak putus-putus =
primer reverse……… 31
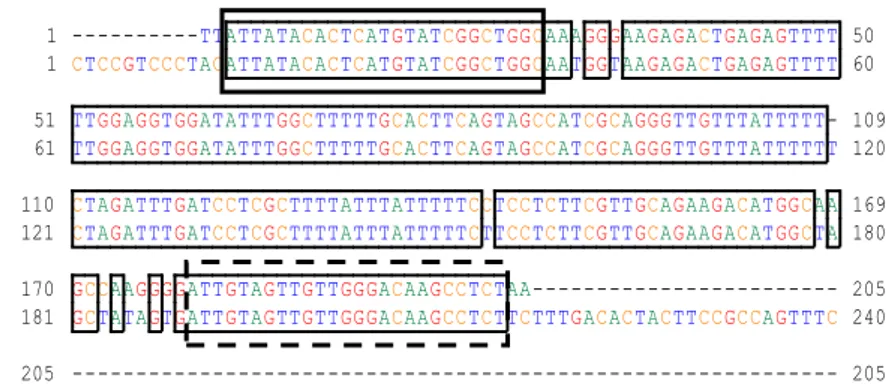
10 Penyejajaran sekuen nukleotida mRNA crustacean hyperglycemiahormone (CHH) yang diisolasi dari udang vaname dengan sekuen CHH referensi dari Bank Gen (kode aksesi HM748790.2).Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida. A=adenin, C=sitosin, T=timin, G=guanin. Kotak penuh = primer forward; kotak putus-putus = primer reverse ……… 31
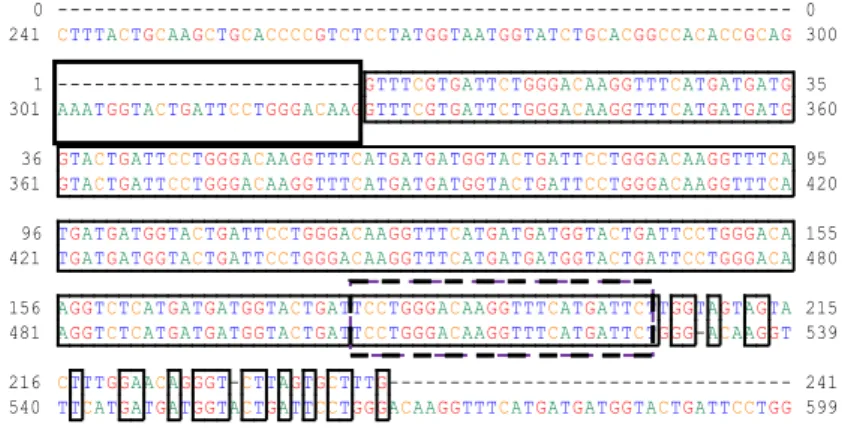
11 Penyejajaran sekuen nukleotida mRNA molt inhibiting hormone
12 Penyejajaran sekuen nukleotida mRNA cyclophilin A (CypA) yang diisolasi dari udang vaname dengan sekuen CypA referensi dari Bank Gen (kode aksesi EU164775.1). Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida. A=adenin, C=sitosin, T=timin, G=guanin. Kotak penuh = primer forward; kotak
putus-putus = primer reverse ………. 32
13 Penyejajaran sekuen nukleotida mRNA lektin yang diisolasi dari udang vaname dengan sekuen lektin referensi dari Bank Gen (kode aksesi EF583939.1).Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida. A=adenin, C=sitosin, T=timin, G=guanin. Kotak penuh = primer forward; kotak putus-putus =
primer reverse ……… 33
14 Penyejajaran sekuen nukleotida mRNA profenoloksidase (proPO) yang diisolasi dari udang vaname dengan sekuen proPO referensi dari Bank Gen (kode aksesi AY723296.1). Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida. A=adenin, C=sitosin, T=timin, G=guanin. Kotak penuh = primer forward; kotak
putus-putus = primer reverse ………. 33
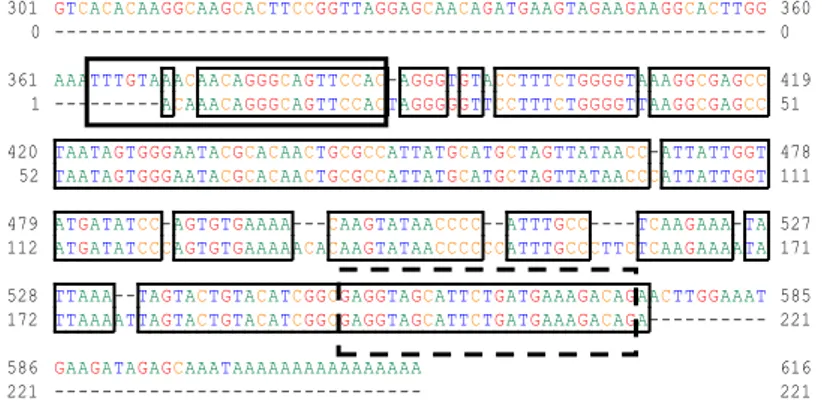
15 Penyejajaran sekuen nukleotida mRNA β-aktin yang diisolasi dari udang vaname dengan sekuen β-aktin referensi dari Bank Gen (kode aksesi AF300705.2). Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida. A=adenin, C=sitosin, T=timin, G=guanin. Kotak penuh = primer forward; kotak putus-putus =
primer reverse ………. 34
16 Filogenetik mRNA single insulin binding domain(SIBD) yang diisolasi dari udang vaname L.vannamei disejajarkan dengan
L.vannamei SIBD (kode aksesi EU664996.1), dengan Cupiennius salei SIBD-2 / IGFBP (kode aksesi HE580154.1), dan dengan
Eriocheir sinensis SIBD / IGFBPs (kode aksesi FJ607954.1) ………. 34 17 Filogenetik mRNA crustacean hyperglycemiahormone (CHH) yang
diisolasi dari udang vaname L.vannamei disejajarkan dengan
L.vannamei CHH partial (kode aksesi FJ598023.1), P.vannamei CHH (kode aksesi X99731.1), L.vannamei CHH A gen partial (kode aksesi AY434016.1), L.vannamei CHH complete (kode aksesi HM748790.2), dan P.monodon CHH homolog PmSGP (kode aksesi
AF104386.1) ………. 35
18 Filogenetik mRNA molt inhibiting hormone (MIH) yang diisolasi dari udang vaname L.vannamei disejajarkan dengan P.semisulcatus
MIH (kode aksesi AB810255.1), P.monodon MIH (kode aksesi AY496454.1), L.vannamei MIH1 (kode aksesi DQ412566.1), dan
19 Filogenetik mRNA cyclophilin A (CypA) yang diisolasi dari udang vaname L.vannamei disejajarkan dengan L.vannamei CypA (kode aksesi JN546074.1), P.monodon CypA (kode aksesi EU164775.1), dan Danio rerio CypA (kode aksesi AY391451.1). ……… 36 20 Filogenetik mRNA lektin yang diisolasi dari udang vaname
L.vannamei disejajarkan dengan L.vannamei C-type lectin clone c002 (kode aksesi DQ858900.1), L.vannamei C-type lectin (kode aksesi EF583939.1), Fenneropenaeus chinensis C-type lectin (kode aksesi DQ167572.1), dan P.monodon C-type lectin (kode aksesi
AB197373.1)………. 36
21 Filogenetik mRNA profenoloksidase (proPO) yang diisolasi dari udang vaname L.vannamei disejajarkan dengan Fenneropenaeus chinensis proPO (kode aksesi AB374531.1), P.semisulcatus proPO (kode aksesi AF521949.1), M.rosenbergii proPO (kode aksesi AY947401.1), P.monodon proPO (kode aksesi AF099741.1),
L.vannamei microsatellite proPO (kode aksesi EF115296.1),
L.vannamei proPO (kode aksesi AY723296.1), dan L.vannamei
proPO1 (kode aksesi EU284136.1)……… 37
22 Filogenetik mRNA β-aktin yang diisolasi dari udang vaname
L.vannamei disejajarkan dengan Fenneropenaeus chinensis
β-actin (kode aksesi DQ205426.1), P.monodon β-actin (kode aksesi JN808449.1), dan L.vannamei β-actin (kode aksesi AF300705.2) ….. 38 23 Tingkat ekspresi gen single insulin binding domain (SIBD),
cyclophilin A (CypA), dan molt inhibiting hormone (MIH) udang vaname pada pengamatan jam ke-0 sampai ke-30 setelah pemberian rElGH secara oral dengan dosis 0,5 mg kg-1pakan. Tingkat ekspresi gen dianalisis menggunakan metode real-time PCR dan dinormalisasi dengan ekspresi gen β-aktin……….. 49
24 Tingkat ekspresi gen single insulin binding domain (SIBD),
25 Elektroforegram produk amplifikasi primer spesifik qPCR gen single insulin binding domain (SIBD), cyclophilin A(CypA),molt inhibiting hormone (MIH),dan β-aktin udang vaname. M :marker DNA (Vivantis Inc, California-USA). Awal, 6, 12, 18, 24, 30, akhir : cDNA pasca larva udang vaname dari pengamatan awal penelitian, jam ke-6, 12, 18, 24, 30, dan akhir penelitian ……….. 50
26 Deteksi infectious hypodermal and haematopoetic necrosis virus
(IHHNV) menggunakan PCR pada pasca larva 2 (PL2), M: marker DNA (Vivantis Inc. - California USA), (-): produk PCR tanpa cetakan DNA sebagai kontrol negatif, (+): produk PCR menggunakan cetakan DNA positif IHHNV sebagai kontrol positif, PL2: sampel PL2 yang dianalisis ( masing-masing 50 ekor PL2 dipool). Tanda kepala panah menunjukkan fragmen DNA IHHNV pada posisi
sekitar 81 bp ………. 58
27 Tingkat ekspresi gen single insulin binding domain (SIBD) pada PL2 (sebelum perlakuan), PL14 (akhir fase pembenihan, awal fase pembesaran), dan udang umur 60 hari (akhir penelitian). P3: (perlakuan perendaman rElGH 15mgL-1 + oral 0,5 mg kg-1 pakan); P4: (perlakuan perendaman rElGH 15 mgL-1); P7: (perlakuan rElGH melalui oral dengan dosis 0,5 mg kg-1 pakan); K: (kontrol tanpa perendaman dan tanpa pemberian rElGH secara oral). Total RNA diekstraksi dari 50 ekor PL2, 9 ekor PL14 dan 3 ekor udang umur 60 hari, masing-masing dari populasi 3 ulangan (pooled sample). Tingkat ekspresi mRNA dianalisis menggunakan metode real-time
PCR dan dinormalisasi dengan ekspresi mRNA β-aktin……….. 62
28 Tingkat ekspresi gen crustacean hyperglycemic hormone (CHH) pada PL2 (sebelum perlakuan), PL14 (akhir fase pembenihan, awal fase pembesaran), dan udang umur 60 hari (akhir penelitian). P3: (perlakuan perendaman rElGH 15mgL-1 + oral 0,5 mg kg-1 pakan); P4: (perlakuan perendaman rElGH 15 mgL-1); P7: (perlakuan rElGH melalui oral dengan dosis 0,5 mg kg-1 pakan); K: (kontrol tanpa perendaman dan tanpa pemberian rElGH secara oral). Total RNA diekstraksi dari 50 ekor PL2, 9 ekor PL14 dan 3 ekor udang umur 60 hari, masing-masing dari populasi 3 ulangan (pooled sample). Tingkat ekspresi gen dianalisis menggunakan metode qPCR dan dinormalisasi dengan ekspresi gen β-aktin……… 63
29 Elektroforegram produk amplifikasi primer spesifik qPCR gen single insulin binding domain (SIBD), crustacean hyperglycemia hormone
30 Kelangsungan hidup (%) udang vaname pada stadia PL14 dan umur 60 hari. P3: (perlakuan perendaman rElGH 15mgL-1 + oral 0,5mg kg-1 pakan); P4: (perlakuan perendaman rElGH 15 mgL-1); P7: (perlakuan rElGH melalui oral dengan dosis 0,5 mg kg-1 pakan); K: (kontrol tanpa perendaman dan tanpa pemberian rElGH secara oral). Huruf berbeda di atas bar pada udang umur sama menunjukkan berbeda nyata secara statistik (P< 0,05)……… 64
31 Level ekspresi gen lektin pada PL2 (sebelum perlakuan), PL14 (akhir fase pembenihan, awal fase pembesaran), dan udang umur 60 hari (akhir pembesaran). P3: (perlakuan perendaman rElGH 15mgL-1 + oral 0,5mg kg-1pakan); P4: (perlakuan perendaman rElGH 15 mgL-1); P7: (perlakuan rElGH melalui oral dengan dosis 0,5 mg kg-1 pakan); K: (kontrol tanpa perendaman dan tanpa pemberian rElGH secara oral). Total RNA diekstraksi dari 50 ekor PL2; 9 ekor PL14 dan 3 ekor udang umur 60 hari; masing-masing dari populasi 3 ulangan (pooled sample). Tingkat ekspresi mRNA dianalisis dengan metode qPCR dan dinormalisasi dengan ekspresi mRNA
β-aktin……… 65
32 Level ekspresi genprofenoloksidase (proPO) pada PL2 (sebelum perlakuan), PL14 (akhir fase pembenihan, awal fase pembesaran), dan udang umur 60 hari (akhir pembesaran). P3: (perlakuan perendaman rElGH 15mgL-1 + oral 0,5 mg kg-1 pakan); P4: (perlakuan perendaman rElGH 15 mgL-1); P7: (perlakuan rElGH melalui oral dengan dosis 0,5 mg kg-1 pakan); K: (kontrol tanpa perendaman dan tanpa pemberian rElGH secara oral). Total RNA diekstraksi dari 50 ekor PL2; 9 ekor PL14 dan 3 ekor udang umur 60 hari; masing-masing dari populasi 3 ulangan (pooled sample). Tingkat ekspresi mRNA dianalisis menggunakan metode qPCR dan dinormalisasi dengan ekspresi mRNA β-aktin……….. 65
33 Elektroforegram produk amplifikasi primer spesifik qPCR gen lektin,
profenoloksidase (proPO) dan β-aktin udang vaname. M : marker DNA (Vivantis Inc, California-USA). P3 : cDNA (perlakuan perendaman rElGH 15mgL-1 + oral 0,5 mg kg-1 pakan); P4: cDNA (perlakuan perendaman rElGH 15 mgL-1); P7: cDNA (perlakuan rElGH melalui oral dengan dosis 0,5 mg kg-1 pakan); K: cDNA (kontrol tanpa perendaman dan tanpa pemberian rElGH secara oral). 66
34 Perkembangan gejala klinis udang vaname pada hari 1 sampai ke-6 setelah infeksi infectious myonecrosis virus (IMNV). Tanda panah dan lingkaran adalah tanda-tanda klinis. Gambar 34.1 dan 34.2 belum
35 Hasil analisis PCR terhadap udang yang mati. Infectious myonecrosis virus (IMNV) terdeteksi pada 139 bp (tanda panah). M : marker DNA (Vivantis, inc – California USA); (-) tanpa cDNA; (+) cDNA positif IMNV; P1: perlakuan (perendaman rElGH 15mgL-1 + oral 50 mg kg-1pakan) + infeksi IMNV; P3: perlakuan (perendaman rElGH 15mgL-1 +oral 0,5 mgkg-1pakan)+infeksi IMNV; P4: perlakuan (perendaman rElGH 15 mgL-1)+infeksi IMNV; P7: perlakuan (rElGH melalui oral dengan dosis 0,5 mgkg-1pakan) + infeksi IMNV; K(+): kontrol (tanpa perendaman dan tanpa oral)+infeksi IMNV; K(-) : kontrol (tanpa perendaman dan tanpa
oral)+tanpa infeksi IMNV. ……….. 77
36 Kelangsungan hidup udang pada hari ke-1 sampai ke-8 setelah diuji tantang dengan infectious myonecrosis virus (IMNV). P1: perlakuan (perendaman rElGH 15mgL-1 +oral 50 mg kg-1pakan)+infeksi IMNV; P3: perlakuan (perendaman rElGH 15mgL-1 + oral 0,5 mg kg-1 pakan)+infeksi IMNV; P4: perlakuan (perendaman rElGH 15 mg L-1)+infeksi IMNV; P7: perlakuan (rElGH melalui oral dengan dosis 0,5 mg kg-1 pakan)+infeksi IMNV; K(+): kontrol (tanpa perendaman dan tanpa oral)+infeksi IMNV; K(-) : kontrol (tanpa perendaman dan tanpa oral)+tanpa infeksi IMNV. ……… 78
37 Kelangsungan hidup udang pada hari ke-8 setelah diuji tantang dengan IMNV. P1: perlakuan (perendaman rElGH 15mgL-1 +oral 50 mg kg-1pakan)+infeksi IMNV; P3: perlakuan (perendaman rElGH 15mgL-1 + oral 0,5 mg kg-1pakan)+infeksi IMNV; P4: perlakuan (perendaman rElGH 15 mgL-1)+infeksi IMNV; P7: perlakuan (rElGH melalui oral dengan dosis 0,5 mg kg-1pakan) +infeksi IMNV; K(+): kontrol (tanpa perendaman dan tanpa oral) +infeksi IMNV; K(-) : kontrol (tanpa perendaman dan tanpa oral)+tanpa infeksi IMNV. Huruf berbeda diatas balok menunjukkan berbeda nyata secara statistik (P<0,05)……… 78
39 Elektroforegram produk amplifikasi primer spesifik qPCR gen lektin,
profenoloksidase (proPO) dan β-aktin udang vaname. M : marker DNA (Vivantis Inc, California-USA). P1: cDNA udang perlakuan (perendaman rElGH 15mgL-1 +oral 50 mgkg-1pakan)+infeksi IMNV; P3: cDNA udang perlakuan (perendaman rElGH 15mgL-1 +oral 0,5 mg kg-1 pakan)+infeksi IMNV; P4: cDNA udang perlakuan (perendaman rElGH 15 mg L-1)+infeksi IMNV; P7: cDNA udang perlakuan (rElGH melalui oral dengan dosis 0,5 mg kg1 pakan) +infeksi IMNV; K(+):cDNA udang kontrol+infeksi IMNV; K(-): cDNA udang kontrol tanpa infeksi IMNV……….. 80
DAFTAR LAMPIRAN
Halaman
1 ANOVA dan Uji Duncan untuk Boobt, Panjang, SGR, SR, dan Biomasa pada perlakuan perendaman (Bab II)…..………. 100
2 ANOVA dan Uji Duncan untuk Bobot, Panjang, SGR, SR, dan Biomasa pada perlakuan oral(Bab IV)…..……… 102
3 ANOVA dan Uji Duncan untuk Panjang, Bobot, ADG, SR, FCR dan Biomassa pada perlakuan perendaman dan oral (Bab V).………….. 104
4 ANOVA dan Uji Duncan untuk perlakuan uji tantang IMNV (Bab VI) ……… 109
5 Perhitungan tingkat konversi pakan (FCR) pada perlakuan fase pembesaran (Bab V) ………... 111
6 Profil HP55 ……….. 112
7 a. Sekuen nukleotida parsial yang mengkode gen single insulin
binding domain (SIBD) udang vaname……….. 113 b. Sekuen nukleotida parsial yang mengkode gen crustacean
hyperglycemia hormone (CHH) udang vaname……….. 113 c. Sekuen nukleotida parsial yang mengkode gen molt inhibiting
hormone(MIH) udang vaname ……… 113 d. Sekuen nukleotida parsial yang mengkode gen cyclophilin A
(CypA) udang vaname……….. 113
e. Sekuen nukleotida parsial yang mengkode gen lektin udang
vaname………. 114
f. Sekuen nukleotida parsial yang mengkode gen profenoloksidase
(proPO) udang vaname………. 114
g. Sekuen nukleotida parsial yang mengkode gen β-aktin udang
PENDAHULUAN
Latar Belakang
Udang vaname (Litopenaeus vannamei) adalah salah satu komoditas utama dalam program industrialisasi perikanan budidaya tahun 2009-2014. Produksi udang vaname diproyeksikan meningkat sebesar 16% setiap tahun dengan target produksi 500 ribu ton pada tahun 2014. Seperti diketahui bersama bahwa salah satu faktor penting yang mendukung peningkatan produksi budidaya udang adalah penyediaan induk unggul dan benih bermutu, terutama benih tumbuh cepat dan tahan terhadap infeksi penyakit.
Peningkatan produksi dapat ditempuh dengan berbagai cara, salah satu cara yang efektif adalah dengan aplikasi bioteknologi. Teknologi DNA (deoxyribonucleic acid) rekombinan muncul sebagai bioteknologi yang berpotensi tinggi untuk diaplikasikan dalam budidaya, yang dimulai pada tahun 1980an. Akhirnya ditemukan konstruksi gen hasil DNA rekombinan dari sumber berbeda seperti mamalia, burung, insekta, bakteria dan virus yang ditransfer ke embrio ikan menggunakan metode mikroinjeksi. Pada awal tahun 1990, beberapa gen dari banyak spesies ikan dapat diisolasi. Gen tersebut dapat diaplikasikan untuk meningkatkan kinerja pertumbuhan, reproduksi, resistensi terhadap penyakit, produksi karkas, toleransi terhadap suhu dingin dan aplikasi lainnya (Dunham 2004).
Namun demikian, teknologi transfer gen masih menjadi perdebatan karena dianggap sebagai genetically modified organism (GMO) yang dari sisi keamanan pangan belum mudah diterima oleh sebagian konsumen. Oleh karena itu untuk lebih menjamin keamanan produk bagi konsumen, kini telah dikembangkan pendekatan baru yang dikenal dengan teknologi protein rekombinan. Teknologi ini merupakan salah satu tindak lanjut penerapan teknologi DNA rekombinan dengan mentransformasi dan memperbanyak DNA rekombinan yang sudah didesain menggunakan bakteri Escherichia coli sebagai bioreaktor untuk memproduksi protein target secara massal. Perbedaan mendasar antara protein rekombinan dengan DNA rekombinan ditinjau dari sisi keamanan pangan adalah bahwa organisme yang diberi protein rekombinan tidak termasuk kategori GMO, dan diharapkan akan lebih mudah diterima oleh konsumen.
Pertumbuhan krustase khususnya udang tidak kontinyu karena kulit luar yang keras, sehingga ganti kulit secara periodik dan penggantinya berhubungan dengan pertumbuhan (Keller 1992). Ganti kulit sangat dipengaruhi oleh kondisi lingkungan, pakan, dan dipicu oleh hormon ecdysteroid dan dihambat oleh hormon penghambat yaitu molt inhibiting hormone (MIH). Namun demikian, hingga saat ini keberadaan dan mekanisme hormon pertumbuhan pada udang belum jelas.
terbatas, khususnya udang vaname. Penelitian yang dilakukan oleh Santiesteban et al. (2010) menyebutkan bahwa pemberian rGH ikan nila (rtiGH) pada pasca larva 2 (PL2) udang vaname dengan dosis 100 µgL-1 media imersi, dapat meningkatkan pertumbuhan sebesar 42,4%. Sementara Sonnenschein (2001) dengan menggunakan rGH sapi (bST) dengan dosis 300 mgL-1 selama 1 jam dapat meningkatkan pertumbuhan bobot sebesar 38% dibandingkan dengan kontrol.
Peran growth hormone (GH) dalam tubuh adalah meningkatkan sintesis protein, meningkatkan asam lemak bebas, meningkatkan glukoneogenesis, dan meningkatkan keseimbangan positif Ca, Mg, dan P. Pada ikan, peran GH berlangsung hampir di semua proses fisiologis dalam tubuh termasuk regulasi ion, keseimbangan osmosis, metabolisme lemak-protein-karbohidrat, pertumbuhan tulang keras dan tulang rawan, reproduksi dan fungsi imun (Reinecke et al. 2005). Oleh sebab itu untuk meningkatkan produksi udang vaname secara teoritis dapat dilakukan dengan aplikasi rGH. Dengan pemberian rGH ikan diharapkan dapat meningkatkan pertumbuhan dan imunitas udang vaname, sehingga produksi udang vaname meningkat.
Mekanisme kerja GH dalam menstimulasi pertumbuhan khususnya pada vertebrata sudah banyak diteliti (Sakai et al. 1997; Moriyama & Kawauchi 2001; Reinecke et al. 2005; Wong et al. 2006; Liu et al. 2007; Debnanth 2010).
Mekanisme kerja GH secara langsung memacu pertumbuhan tubuh khususnya merangsang pelepasan somatomedin, dan mempengaruhi metabolisme protein, karbohidrat, dan lemak (Moriyama dan Kawauchi 2001), sementara mekanisme kerja tidak langsung adalah menstimulasi pertumbuhan linier skeleton yang diperantarai oleh insulin growth factor-1 (IGF-1). Sintesis dan pelepasan IGF-1 diawali dengan masuknya rangsangan eksternal yang diintegrasikan oleh otak menjadi suatu perintah ke kelenjar pituitari untuk mensintesis dan mensekresikan GH. GH masuk ke dalam jaringan pembuluh darah, selanjutnya berikatan dengan reseptor spesifik yaitu growth hormone receptor (GHR) di beberapa organ target terutama hati untuk menstimulasi sintesis dan pelepasan IGF-1 (Bolander 2004).
IGF-1 mengatur pertumbuhan sel, metabolisme, dan fungsi jaringan spesifik. Kehadiran IGF-1 telah dibuktikan dalam berbagai invertebrata, dan fungsinya sebagai stimulator pertumbuhan. Pada krustase, peptida insulin (IGF-like) telah diteliti dan dikaitkan dengan kontrol metabolisme. Penelitian yang dilakukan oleh Gutie´rrez et al. (2007) menunjukkan bahwa penyuntikan insulin rekombinan manusia (rhIGF-1) pada Penaeus vannamei meningkatkan kadar glukosa dalam hemolim pada 1 jam setelah injeksi, dan menurun pada 5 jam pasca injeksi. Hal ini menunjukkan adanya insulin endogenus pada udang, sama seperti vertebrata lainnya, yang mungkin terlibat dalam pengaturan metabolisme karbohidrat pada krustase. Pada vertebrata, insulin dan IGF-I memegang peran penting dalam regulasi proses anabolik dalam metabolisme. Namun demikian, fungsi peptida mirip insulin ini dalam krustase belum jelas, meskipun dalam studi ini menunjukkan insulin in vivo.
Penelitian lain menunjukkan adanya protein single insulin binding domain
superfamili IGFBP yang mempunyai hubungan antara endokrin dan sistem imun serta dibentuk oleh 240-300 asam amino dengan berat molekul 22-32 kDa.
Hasil identifikasi GH pada krustase belum jelas, namun demikian beberapa penelitian menunjukkan bahwa pemberian rGH dapat meningkatkan pertumbuhan pada udang (Toullec et al. 1991; Sonnenschein 2001; Santiesteban et al. 2010). Pertumbuhan krustase khususnya udang tergantung dari frekuensi ganti kulit dan penambahan bobot antar ganti kulit, sementara frekuensi ganti kulit dipengaruhi oleh kondisi lingkungan dan nutrisi. Ganti kulit dikontrol oleh hormon ecdysteroid dari Y-organ dalam cephalotorac dan dihambat oleh molt inhibiting hormone (MIH) dari kelenjar X-organ (Baldaia et al. 1984; Cariolou dan Flytzanis 1994; Hatt et al. 2001). Keberadaan dan mekanisme kerja GH pada udang belum jelas, tetapi beberapa peneliti telah mencoba mengungkap dengan mengkarakterisasi kandidat GH (Gutie´rrez et al. 2007; Castellanos et al. 2008; Tangprasittipap et al. 2010) dan keberadaan reseptornya (Santiesteban et al. 2010). Kandungan GH dalam tubuh ikan berkisar antara 0,2-111,2 ng/ml plasma darah (Björnsson et al. 2000; Einarsdottir et al. 2002; Arnesen et al. 2003; Drennon et al. 2003; Nordgarden et al. 2005).
Metabolisme krustase juga dipengaruhi oleh crustacean hyperglycemia hormone (CHH). CHH merupakan hormon neuropeptida yang paling banyak ditemukan dan diproduksi oleh neuron peptida pada medulla terminalis organ-X pada kelompok krustase. Fungsi utama CHH adalah untuk meregulasi level glukosa pada hemolym krustase (Nagai et al. 2011). Selain itu, Padhi et al. (2007) menyatakan bahwa CHH memegang peranan penting dalam regulasi metabolisme karbohidrat dan proses fisiologis lainnya misalnya osmoregulasi, metabolisme lemak dan molting. CHH merupakan hormon peptida, yang umumnya termasuk ke dalam kelompok CHH adalah MIH, gonad-inhibiting hormone (GIH) dan
mandibular organ-inhibiting hormone (MOIH).
GH juga dapat meningkatkan sistem imun (Reinecke et al. 2005). Menurut Braak (2002), patogen (bakteri, virus, fungi) yang tergabung dalam PAMP (pathogen-associated molecules pattern), akan dikenali dengan cara diubah menjadi binding protein oleh lektin dan disebut dengan pattern recognition proteins (PRPs), dan diterima oleh pattern recognition receptor (PRR). Sebagai imuno reaktor, lektin akan mengaglutinasi agar dapat dimusnahkan oleh haemosit. Selanjutnya akan terjadi 4 aktivitas, yaitu: (a) degranulasi, (b) clotting protein
menjadi clot oleh enzim transglutaminase, (c) profenoloksidase (proPO) menjadi
fenoloksidase (PO) oleh enzim ppA yang kemudian PO menginisiasi fenol menjadi
quinones dan menjadi melanin, (d) peroxinectin. Keempat aktivitas tersebut berperan dalam pertahanan diri jika ada serangan patogen. Pada udang yang resisten, jika terjadi serangan patogen, keempat aktivitas tersebut meningkat, sehingga patogen dapat ditolak atau dihancurkan (Sritunyalucksana 2001). Lektin, proPO, dan haemosit adalah parameter imun yang sangat penting dalam pertahanan udang.
ikan mas Cyprinus carpio (rCcGH) dan rGH ikan gurame Osphronemus goramy
(rOgGH). Dengan menggunakan protein total, dosis rElGH untuk menghasilkan peningkatan pertumbuhan yang sama pada ikan gurame juga lebih rendah daripada rCcGH (Irmawati et al. 2012), sehingga penggunaan rElGH lebih efisien daripada rCcGH. Penelitian yang dilakukan Lesmana (2010), yaitu aplikasi rElGH melalui penyuntikan dengan dosis 1 µg g-1 bobot ikan nila menunjukkan respons peningkatan bobot sebesar 20,94%, sedangkan pada perendaman glass eel ikan sidat dalam larutan rElGH dosis 12 mgL-1 meningkatkan bobot tubuh sebesar 37,4% dibandingkan dengan kontrol (Handoyo 2012). Oleh karena itu, pada penelitian ini digunakan rElGH. Penelitian terdiri atas 5 tahap, yaitu: (1) Pemberian rElGH melalui perendaman pada tahap pembenihan; (2) Analisis sekuen gen terkait pertumbuhan dan imunitas (3) Pemberian rElGH secara oral melalui pakan buatan pada tahap pembenihan; (4) Pemberian rElGH pada tahap pembenihan dilanjutkan dengan oral pada tahap pembesaran (5) Uji resistensi dengan infectious myonecrosis virus (IMNV) setelah udang diberi rElGH.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji bioaktivitas rElGH pada udang vaname dalam meningkatkan pertumbuhan dan imunitas. Secara khusus penelitian ini bertujuan untuk:
1. Mencari metode aplikatif pemberian rElGH untuk meningkatkan pertumbuhan udang vaname,
2. Mengkaji daya tahan udang vaname terhadap infeksi IMNV setelah pemberian rElGH,
3. Mengkaji mekanisme kerja rElGH secara tidak langsung dalam menstimulasi pertumbuhan udang vaname,
4. Mengkaji mekanisme kerja rElGH dalam meningkatkan metabolisme udang vaname,
5. Mengkaji mekanisme kerja rElGH dalam meningkatkan daya tahan tubuh udang vaname terhadap infeksi IMNV.
Manfaat Penelitian
1. Metode aplikatif pemberian rElGH dapat digunakan oleh pembudidaya dalam meningkatkan produksi udang, sehingga produktivitas udang secara nasional bisa meningkat,
3. Metode aplikatif pemberian rElGH dapat digunakan untuk mencegah kematian massal akibat serangan penyakit, sehingga produksi tidak mengalami penurunan.
Ruang Lingkup Penelitian
Secara umum ruang lingkup disertasi ini adalah sebagai berikut :
1. Menentukan dosis dan lama perendaman rElGH optimum yang mampu meningkatkan pertumbuhan pada pasca larva udang vaname,
2. Menentukan dosis pemberian rElGH secara oral melalui pakan yang mampu meningkatkan pertumbuhan pada pasca larva udang vaname.
3. Menentukan metode pemberian rElGH yang tepat pada fase pembenihan dan fase pembesaran yang mampu meningkatkan pertumbuhan udang vaname, 4. Menguji respons imun udang vaname setelah diberi rElGH,
5. Mempelajari mekanisme kerja rGH secara molekuler, 6. Menganalisis efek rGH terhadap metabolisme udang,
7. Analisis sekuen gen SIBD, CHH, MIH, CypA, lektin, proPO, β-aktin.
Hipotesis Penelitian
1. Hormon pertumbuhan rekombinan ikan kerapu kertang mampu memacu pertumbuhan udang secara tidak langsung melalui stimulasi gen SIBD, dan peningkatan metabolisme.
2. Hormon pertumbuhan rekombinan ikan kerapu kertang mampu meningkatkan respons imun udang melalui peningkatan ekspresi gen lektin dan proPO.
Tingkat Kebaruan (Novelty)
Kebaruan (novelty) dalam penelitian ini adalah :
1. Metode aplikatif pemberian rElGH pada udang vaname untuk meningkatkan pertumbuhan dan imunitas.
2. Usulan mekanisme endokrin pengontrol pertumbuhan pada udang vaname dengan pemberian rElGH yang dibuat berdasarkan data penelitian dan mengacu pada mekanisme endokrin pengontrol pertumbuhan pada ikan.
RESPONS PERTUMBUHAN UDANG VANAME TERHADAP
PEMBERIAN HORMON PERTUMBUHAN REKOMBINAN
IKAN KERAPU KERTANG MELALUI PERENDAMAN
ABSTRAK
Pertumbuhan ikan dapat ditingkatkan menggunakan hormon pertumbuhan rekombinan. Penelitian ini bertujuan mengkaji respons pertumbuhan dan ekspresi gen udang vaname, Litopenaeus vannamei setelah direndam dengan hormon pertumbuhan rekombinan ikan kerapu kertang, Epinephelus lanceolatus (rElGH). Pada percobaan pertama, pasca larva stadia 2 (PL2) sebanyak 1500 ekor direndam selama 1 jam dalam 1 liter air laut yang mengandung rElGH lima dosis berbeda, yaitu 150; 15; 1,5; 0,15; 0,015; 0,0 mgL-1 serta bovine serum albumin 0,01%. Setiap perlakuan diulang 3 kali. Perendaman dilakukan dalam kantong plastik ditambah oksigen (volume air : oksigen 1:5). Udang dipelihara dalam akuarium volume 60 liter dengan kepadatan 25 ekor per liter sampai PL14. Hasil penelitian menunjukkan bahwa dosis 15 mgL-1 memberikan peningkatan bobot tubuh, panjang tubuh dan kelangsungan hidup tertinggi (P<0,05) masing-masing sebesar 37,77% ; 12,75%; dan 9,45% dibandingkan dengan kontrol. Pada percobaan kedua, perendaman PL2 dalam larutan rElGH dosis 15 mgL-1 dengan lama waktu 3 jam meningkatkan bobot tubuh sebesar 109,9%; panjang tubuh 26,0%; dan biomassa 66,0% lebih tinggi daripada kontrol. Ekspresi mRNA single insulin binding domain (SIBD) pada PL14 yang dianalisis dengan real-time PCR menunjukkan kenaikan sebesar 3,3 kali pada udang yang direndam rElGH dibandingkan dengan kontrol, dan dapat dinyatakan bahwa SIBD berperan penting dalam induksi pertumbuhan. Tingkat ekspresi moult inhibiting hormone meningkat sekitar 1,3 kali, crustacean hyperglycemia hormone (CHH) meningkat sekitar 5,5 kali, sementara ekspresi cyclopilin A pada udang yang direndam rElGH sama dengan kontrol. Dengan demikian, perendaman udang dalam larutan rElGH dapat meningkatkan pertumbuhan dan ekspresi gen SIBD, dan metode ini dapat berguna dalam peningkatan produksi budidaya.
GROWTH RESPONSE OF WHITE SHRIMP BY IMMERSION
WITH RECOMBINANT GIANT GROUPER
GROWTH HORMONE
ABSTRACT
Fish growth can be improved by using recombinant growth hormone. This research was aimed to examine the growth response and genes expression of white shrimp, Litopenaeusvannamei after immersed by different dosages of recombinant giant grouper, Epinephelus lanceolatus growth hormone (rElGH). At the first experiment, a total of 1500 pasca larvae at stadia 2 (PL2) was immersed for one hour in 1 L sea water containing five different dosages of rElGH, namely 150; 15; 1.5; 0.15; 0.015; 0.0 mg L-1, and 0.01% bovine serum albumin. Each treatment was triplicates. Immersion was performed in a plastic bags supplied by oxygen (water volume:oxygen 1:5). Shrimp was then reared up to PL14 stage in 60-L aquaria at density of 25 shrimp per liter. The results showed that the dosage of rElGH 15 mg L-1 allowed highest increment in body weight, body length and survival by 37.77%; 12.75%; and 9.45% compared to the control (P<0.05), respectively. At the second experiment, immersion of PL2 in 15 mgL-1 rElGH solution for 3 hours increased body weight of 109.9%; body length of 26.0%; and biomass of 66.0% higher compared to the control. Expression level of single insulin binding domain (SIBD) mRNA analyzed by quantitative real-time PCR in rElGH-immersed was about 3.3-fold higher than the control, and this suggested that SIBD plays important role in growth induction. Expression level of molt inhibiting hormone (MIH) increased about 1.3-fold, and about 5.5-fold of crustacean hyperglycemia hormone (CHH), while expression of cyclopilin A (CypA) in rElGH treated was similar to that of control. Thus, immersion of shrimp in rElGH solution could increased of growth and SIBD gene expression, and this technique can be used to increase aquaculture production.
PENDAHULUAN
rGH merupakan protein yang diproduksi oleh bioreaktor seperti bakteri
Escherichia coli yang membawa vektor ekspresi gen hormon pertumbuhan. Produksi rGH menggunakan bioreaktor dilakukan setelah diketahui bahwa pemberian hormon pertumbuhan alami dapat memacu pertumbuhan, dan gen penyandinya berhasil diisolasi. Berbagai rGH ikan telah berhasil diproduksi seperti rGH ikan salmon (Sekine et al. 1985), rGH ikan flounder (Jeh et al. 1998), rGH
orange-spotted grouper (Li et al. 2003); rGH ikan patin siam (Poen 2009), rGH ikan mas “rCcGH”, rGH ikan gurame “rOgGH” dan rGH ikan kerapu kertang “rElGH” (Alimuddin et al. 2010).
Penelitian aplikasi rGH untuk meningkatkan pertumbuhan umumnya dilakukan pada ikan, di antaranya pada ikan black seabream (Spondyliosoma cantharus) (Tsai et al. 1997), ikan nila (Oreochromis niloticus) (Li et al. 2003; Acosta et al. 2007; Alimuddin et al. 2010; Hardiantho et al. 2012), ikan giant catfish (Pangasianodon gigas) (Promdonkoy et al. 2004), ikan beronang (Siganus guttatus) (Funkenstein et al. 2005), ikan mas (Cyprinus carpio) (Utomo 2010), ikan gurame (Osphronemus goramy) (Irmawati et al. 2012; Syazili 2012) dan ikan sidat (Alimuddin et al. 2012). Aplikasi rGH pada udang, khususnya udang vaname masih sangat terbatas. Selain itu, “hormon pertumbuhan” udang belum diketahui dan tentu rekombinannya juga belum ada. Dari referensi yang dapat diakses, dua kelompok peneliti telah melakukan riset penggunaan rGH pada udang dengan metode perendaman. Sonnenschein (2001) melakukan perendaman juvenil udang penaeid (bobot tubuh awal 90 mg) dengan bST dosis 300 mgL-1 selama 1 jam. Perendaman dilakukan satu kali, kemudian udang dipelihara sampai 2 bulan, dan terbukti dapat meningkatkan bobot tubuh sebesar 38% dan panjang tubuh sebesar 11% dibandingkan dengan kontrol. Selanjutnya, Santiesteban et al. (2010) merendam pasca larva 2 (PL2) udang vaname dengan rtiGH dosis 100 µgL-1 dengan frekuensi 7 kali, dan hasilnya pertumbuhan udang meningkat sekitar 42,4% dibandingkan dengan kontrol.
Pada vertebrata, insulin dan IGF-I memegang peranan penting dalam regulasi proses anabolisme. Pada krustase fungsi peptida mirip insulin ini belum jelas, tetapi dalam penelitian Gutie´rrez et al. (2007) menunjukkan adanya insulin
in vivo, sedangkan Castellanos et al. (2008) menunjukkan adanya protein SIBD dari L. vannamei yang mempunyai similaritas tinggi dengan IGF binding protein
ditemukan pada hemosit. Selain SIBD pertumbuhan juga berkaitan erat dengan CHH, karena CHH mempunyai peranan penting dalam regulasi metabolisme karbohidrat dan proses fisiologis lainnya misalnya osmoregulasi, metabolisme lemak dan ganti kulit (Padhi et al. 2007). Selanjutnya CHH juga berperan dalam metabolisme glikogen pada hepatopankreas (Nagai et al. 2011). Pada penelitian ini ekspresi gen SIBD dan CHH dianalisis untuk mengevaluasi keterkaitan perubahan laju pertumbuhan udang vaname akibat perlakuan rElGH.
Pertumbuhan krustase berhubungan dengan ganti kulit (Keller 1992). Ganti kulit dikontrol oleh hormon ecdysteroid dari Y-organ dalam cepalotorak dan dihambat oleh hormon penghambat MIH dari kelenjar X-organ (Baldaia et al.
1984; Tangprasittipap et al. 2010). Selanjutnya Tangprasittipap et al. (2010) menemukan lima kandidat yang menyerupai gen pertumbuhan yaitu cyclophilin, cyclophili A (CypA), fibrillarin, SPARC dan PC2. CypA mempunyai korelasi yang tinggi dengan bobot tubuh udang windu Penaeus monodon. Oleh karena itu, pada penelitian ini juga dilakukan analisis ekspresi gen CypA dan MIH untuk mengevaluasi keterkaitan perubahan laju pertumbuhan udang vaname akibat perlakuan rElGH.
Selanjutnya analisis lektin dan proPO juga dilakukan sebagai representasi gen terkait dengan sistem imun pada udang (Braak 2002). Dengan demikian penelitian ini bertujuan untuk mengkaji respons pertumbuhan dan ekspresi gen terkait pertumbuhan dan kelangsungan hidup, setelah pemberian rElGH melalui perendaman sehingga dapat diproduksi benih udang vaname cepat tumbuh.
BAHAN DAN METODE
Waktu dan Tempat
Produksi rElGH
Sel bakteri Escherichia coli BL21 (DE3) yang mengandung vektor ekspresi protein pCold/rElGH (Alimuddin et al. 2010) diambil dari stok gliserol, kemudian digoreskan ke media padat 2xYT yang telah diberi ampisilin. Bakteri kemudian diinkubasi pada suhu 37oC selama 24 jam. Koloni tunggal yang tumbuh diambil menggunakan tusuk gigi steril, kemudian ujung yang mengandung sel bakteri dicelupkan ke media kultur cair 5 mL 2xYT mengandung ampisilin, dan selanjutnya diinkubasi menggunakan shaker pada suhu 37oC selama 18 jam. Selanjutnya dilakukan subkultur dengan cara mengambil 1% dari kultur awal tersebut dan dimasukkan ke dalam 60 mL media 2xYT cair yang baru, dan diinkubasi pada suhu 37oC selama 2 jam. Induksi produksi rElGH dilakukan menggunakan kejutan suhu 15oC selama 30 menit dan ditambahkan IPTG sebanyak 750 μL, kemudian diinkubasi menggunakan shaker pada suhu 15oC selama 24 jam. Pemanenan sel bakteri dilakukan menggunakan sentifugasi pada kecepatan 12000 rpm selama 2 menit.
Pelet bakteri E. coli diresuspensi menggunakan phosphate buffer saline (PBS) yang mengandung 0,1% (w/v) Triton X-100, kemudian dilakukan sonikasi (1 menit hidup dan 1 menit mati) sebanyak 6 siklus dengan amplitudo 14%. Suspensi yang terbentuk kemudian disentrifugasi, dan supernatan dibuang. Pelet dibilas sebanyak 2 kali dengan 1 M NaCl yang mengandung 1% (w/v) Triton X-100, dan terakhir dibilas dengan PBS. Sonikasi berfungsi melisis sel-sel dinding bakteri, oleh sebab itu untuk mendapatkan rElGH yang lebih bersih diuji dengan 12 siklus sonikasi. Pada penelitian ini juga dilakukan pembandingan metode sonikasi dan lysozim, untuk kemudian bioaktivitas protein dianalisis. Lisis dinding sel bakteri dengan lysozim dilakukan dengan cara mencuci pelet bakteri hasil sentrifugasi menggunakan 1 mL bufer 1xTE, dan diinkubasi pada suhu 37oC selama 20 menit. Selanjutnya disentrifugasi pada kecepatan 12000 rpm selama 15 menit, dan kemudian supernatan dibuang. Pelet bakteri dalam tube ditambahkan 500 μL larutan lisozim (10 mg dalam 1 mL buffer1xTE), kemudian diinkubasi pada suhu 37oC selama 20 menit, lalu disentrifugasi pada kecepatan 12000 rpm selama 15 menit. Supernatan dibuang dan pelet yang terbentuk merupakan protein rGH dalam bentuk badan inklusi. Pelet rGH dicuci dengan PBS sebanyak 2 kali dan disimpan pada suhu -80oC.
Badan inklusi (protein total) yang mengandung rElGH dianalisis menggunakan metode sodium dodecyl sulfate-polyacrylamide gel electrophoresis
(SDS-PAGE) untuk verifikasi keberadaan dan konsistensi produksi rElGH. Prosedur pengerjaan SDS-PAGE dilakukan berdasarkan metode Walker et al.
Penentuan Dosis Perendaman
Penentuan dosis rElGH berdasarkan hasil penelitian Handoyo (2012) yakni pemberian rElGH pada glass eel ikan sidat secara imersi dan diperoleh dosis terbaik 12 mgL-1 dengan sekali perendaman. Dengan asumsi udang membutuhkan dosis yang lebih tinggi karena udang memiliki kulit luar yang keras, maka dosis tertinggi dibuat menjadi 150 mg L-1 (P1) dan dilakukan penurunan dosis menjadi 15 (P2); 1,5 (P3); 0,15 (P4); dan 0,015 mg L-1 (P5). Sebagai kontrol adalah perendaman 15 mg L-1 badan inklusi pCold tanpa sisipan GH (K+); dan tanpa perendaman (K). Masing-masing perlakuan dilakukan ulangan 3 kali dengan desain rancangan acak lengkap.
Prosedur Penelitian
Perlakuan secara perendaman didesain dengan rancangan acak lengkap. Semua perlakuan menggunakan akuarium berukuran 45x45x45 cm dengan volume air 60 liter dan kepadatan awal 25 ekor per liter. Hewan uji adalah pasca larva udang vaname stadia dua (PL2) bebas virus IHHNV (infectious hypodermal and haematopoetic necrosis virus) yang diperoleh dari pembenihan udang di Situbondo. Pakan yang diberikan adalah pakan buatan bentuk flake (serpihan) dengan kadar protein 48%, dan naupli Artemia. Jumlah pakan buatan untuk PL2 - PL14 adalah 2-4 ppm per aplikasi yang diberikan 5 kali sehari, sedangkan naupli Artemia
sebanyak 10-20 naupli per ekor pasca larva udang dan diberikan 2 kali sehari. Parameter kualitas air dikontrol agar media selalu dalam kondisi layak. Pemeliharaan untuk semua perlakuan dihentikan pada PL14.
Udang vaname PL2 sebanyak 1500 ekor direndam selama 60 menit dengan air laut 1 liter yang mengandung larutan rElGH sesuai dosis masing-masing perlakuan ditambah bovine serum albumin (BSA) 0,01%. Perendaman dilakukan dengan cara memasukkan PL2 tersebut ke dalam plastik kemas volume 6 liter dan diberi oksigen dengan perbandingan volume air : oksigen adalah 1:5.
Untuk menentukan dosis perendaman rElGH terbaik, dilakukan pengamatan pertumbuhan bobot dan panjang tubuh. Pengukuran bobot dan panjang dilakukan 6 hari sekali. Bobot diukur dengan mengambil 40 ekor pasca larva udang secara acak dari setiap akuarium, kemudian ditimbang secara total dengan timbangan analitik dengan ketelitian 0,01 mg . Pengukuran panjang total dilakukan terhadap 10 ekor udang dengan menggunakan mistar dengan ketelitian 0,1 cm.
Jumlah udang yang hidup pada akhir penelitian dihitung untuk setiap akuarium, kemudian dibandingkan dengan penebaran awal, dikalikan 100% untuk menentukan kelangsungan hidup. Selanjutnya pada akhir penelitian dilakukan penimbangan udang secara total untuk setiap akuarium untuk mendapatkan biomassa.
Penentuan Lama Waktu Perendaman
terbaik. Lama waktu perendaman yang diuji adalah 1, 2, dan 3 jam, dengan lama waktu pengamatan 18 hari. Metode perendaman dan pemeliharaan udang dilakukan seperti dijelaskan sebelumnya. Parameter yang diukur adalah pertumbuhan bobot dan panjang, kelangsungan hidup, serta biomassa.
Analisis Ekspresi Gen
Ekspresi gen SIBD, MIH, CypA, dan CHH dianalisis pada jam ke-0, 6, 12, 18, 24, 30 setelah perlakuan, dan akhir penelitian. Ekspresi gen lektin dan proPO diukur pada awal dan akhir penelitian. Sampel awal adalah PL2 sebelum dilakukan perendaman rElGH sebanyak 50 ekor, dan sampel akhir adalah PL14 dengan dosis perendaman terbaik sebanyak 9 ekor dari 3 ulangan yang diambil secara acak kemudian dijadikan satu sampel (pooled sample), dalam kondisi segar dilakukan ekstraksi RNA. RNA total diekstraksi dari sampel sekitar 10-25 mg menggunakan bahan isogen (Nippon gen, Japan) dengan metode sesuai prosedur dalam manual. RNA total dilarutkan dengan air mengandung 0,05% DEPC sebanyak 50 µL.
Sintesis DNA komplementer (cDNA) dilakukan menggunakan kit Ready-To-Go You-Prime First Strand Beads (GE Healthcare, USA) dengan prosedur sesuai manual. Primer yang digunakan adalah oligo(dT3) (5‟-gtaatacgaataa ctatagggcacgcgtggtcgacggcccgggctgg-ttttttttttttttttt-„3) konsentrasi 1 µg/3 µL sebanyak 3 µL per sampel. Hasil sintesis diencerkan dengan menambahkan air steril sebanyak 50 µL.
Tingkat ekspresi setiap gen dari masing-masing sampel dianalisis secara kuantitatif menggunakan real-time PCR (qPCR) dengan mesin Rotor Gene (Corbett research), menggunakan primer spesifik (Tabel 1). Primer didesain berdasarkan sekuen yang ada pada BankGen. Data amplifikasi yang terekam diolah dengan metode Livak & Schmittgen (2011) untuk menghitung tingkat ekspresi gen, yang dinormalisasi menggunakan β-aktin (primer Lvbac-F dan Lvbac-R) sebagai kontrol internal loading RNA dalam sintesis cDNA.
Analisis data
Tabel 1 Primer spesifik yang dirancang dan sekuen nukleotidanya.
No. Primer Sekuen (urutan 5'-3') No aksesi Referensi 1 SIBD-F AAATGGTACTGATTCCTGGGACAAG EU664996.1 Castellanos
SIBD-R AGAATCATGAAACCTTGTCCCAGGA et al.2008 2 MIH-F ATTATACACTCATGTATCGGCTGGC DQ412566.1 Chen et al.
MIH-R AGAGGCTTGTCCCAACAACTACAAT 2007
3 CypA-F CTGTAAAGTTTCAGAACATTCCCCC EU164775.1 Qiu et al.
CypA-R GAACACCTATCTTGTTTCACCACCT 2009
4 CHH –R CHH - F
CCAACGTATCTACTGAATGCAGAAG AGGGTGCCTTTTACTATCATCGGAT
HM748790.2 Liu et al. 2012 5 lektinV-F TTTGTAAACAACAGGGCAGTTCCAC EF583939.1 Zhang et
lektinV-R CTGTCTTTCATCAGAATGCTACCTC et al. 2009 6 proPO-F TTCAACGGTAGACCCGTGATTCTTC AY723296.1 Wang et al.
proPO-R TCTTGCCGGGTTTAAGGTGAACAGT 2007
7 Lvbac-F CCTCCACCATGAAGATCAAGATCAT AF300705.2 Sun et al.
Lvbac-R CACTTCCTGTGAACAATTGATGGTC 2007
HASIL
Produksi Protein rGH
Analisis SDS-PAGE menunjukkan bahwa rElGH diekspresikan dengan ukuran prediksi sekitar 23,02 kDa (Irmawati 2013). Pengujian 12 siklus sonikasi, 6 siklus sonikasi, lisis dengan lisozim, dan penyimpanan pada suhu –20oC selama 1 bulan, hasilnya seperti ditunjukkan pada Gambar 1 berturut-turut pada kolom 1.1; kolom 1.2; kolom 2.1; dan kolom 3.1. Secara kuantitatif jumlah pelet bakteri yang dihasilkan dari 1600 mL media kultur adalah sebanyak 9,3 gram yang merupakan rata-rata dari tiga ulangan, dan setara dengan 4850 mg bobot protein badan inklusi
Pertumbuhan dan Kelangsungan Hidup
rElGH dengan dosis lebih tinggi yaitu 150 mgL-1 dan dosis lebih rendah yaitu 1,5 mgL-1; 0,15 mgL-1 dan 0,015 mgL-1 mengindikasikan pertumbuhan yang lambat (Tabel 2).
Gambar 1 Hasil analisis badan inklusi Escherichia coli yang mengandung rElGH m