SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
YANG DIBERI HORMON PERTUMBUHAN REKOMBINAN
IKAN KERAPU KERTANG
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul “Respons Pertumbuhan dan Reproduksi Ikan Nila yang Diberi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Muhammad
RINGKASAN
MUHAMMAD. Respons Pertumbuhan dan Reproduksi Ikan Nila yang Diberi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang. Dibimbing oleh M. ZAIRIN JUNIOR, ALIMUDDIN, dan ODANG CARMAN.
Hormon pertumbuhan (growth hormone/GH) berperan penting dalam pertumbuhan organisme vertebrata. Level GH alami relatif rendah dan metode isolasinya relatif rumit sehingga tidak ekonomis dan tidak praktis, maka digunakan teknologi DNA rekombinan untuk memproduksi GH rekombinan (rGH). rGH ikan dari berbagai spesies telah dapat diproduksi dalam jumlah banyak menggunakan bioreaktor berupa bakteri Escherichia coli. Saat ini penggunaan GH untuk meningkatkan pertumbuhan ikan budidaya mendapat perhatian yang cukup besar. Peningkatan pertumbuhan ikan memberi manfaat yang besar untuk memperpendek waktu produksi, meningkatkan efisiensi pakan, meningkatkan produksi, dan mengontrol ketersediaan produk. Penelitian ini bertujuan untuk mengkaji respons pertumbuhan dan reproduksi ikan nila yang diberi hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH).
Penelitian terdiri atas empat tahap. Penelitian pertama bertujuanmengevaluasi respons petumbuhan ikan nila merah (Oreochromis niloticus) yang diberi pakan mengandung rElGH pada dosis berbeda. Benih dengan bobot rata-rata 3.5 g dipelihara dalam akuarium berukuran 1.0x0.5x0.5 m3, kedalaman air 40 cm (200 L) dengan kepadatan 25 ekor. Pakan mengandung rElGH dengan dosis 0.03, 0.30, dan 3.00 mg/kg pakan, serta kontrol (tanpa rElGH) diberikan tiga hari sekali selama empat minggu pemberian. Hasil penelitian menunjukkan bahwa pertambahan biomassa (B), pertumbuhan harian (LPH), dan konversi pakan (KP) berbeda nyata (p<0.05) antara perlakuan dibandingkan dengan kontrol, tetapi antara perlakuan tidak berbeda nyata (p>0.05).B, LPH, dan KP perlakuan pemberian rElGH masing-masing berkisar 564.17-589.74 g, 3.35-3.46%, dan 1.07-1.14 lebih tinggi daripada kontrol yang berkisar 454.70-457.16 g, 3.02-3.03%, dan 1.36-1.38. Pemberian dosis rElGH antara 0.03-3.00 mg/kg pakan efektif dalam meningkatkan pertumbuhan ikan nila merah dengan pertambahan bobot 24.07-31.68% dan dosis efisien adalah 3.00 mg/kg pakan.
rElGH secara oral.
Penelitian ketiga bertujuan untuk menguji respons pertumbuhan dan pemanfaatan pakan pada ikan nila strain SULTANA ukuran berbeda yang diberi pakan mengandung rElGH. Ikan dengan ukuran bobot badan 3.5±0.25 g (perlakuan A), 12.5±0.40 g (perlakuan B), dan 40.0±2.50 g (perlakuan C) dipelihara dalam hapa ukuran 2x1x1 m3, kedalaman air 0.75 m dengan padat tebar 50 ekor. Ikan dipelihara selama delapan minggu. Pakan mengandung rElGH diberikan tiga hari sekali dengan dosis 3 mg/kg pakan, selama empat minggu pemberian, dan selanjutnya ikan diberi pakan yang tidak diperkaya rElGH. Hasil penelitian menunjukkan bahwa rata-rata B ikan yang diberi rElGH adalah lebih tinggi (p<0.05) dibandingkan dengan kontrol yang tidak diberi rElGH, sedangkan perlakuan ukuran ikan tidak berpengaruh nyata (p>0.05). LPH ikan yang diberi rElGH lebih tinggi (p<0.05) dibandingkan dengan kontrol. TKH ikan perlakuan dan kontrol adalah sama (p>0.05), berkisar 90.67-96.67%. KP pada ikan yang diberi rElGH lebih baik (p<0.05) dibandingkan dengan tanpa rElGH, kecuali ikan ukuran 40 g. Kadar glikogen hati dan otot, retensi protein dan lemak, indeks hepatosomatik, dan rasio RNA:DNA ikan yang diberi rElGH lebih tinggi dibandingkan kontrol. Pemberian rElGH meningkatkan pertumbuhan dan pemanfaatan pakan untuk pertumbuhan ikan nila pada ukuran awal 12.5 g.
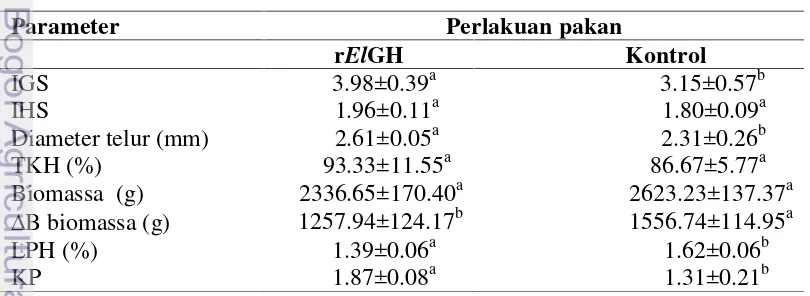
Penelitian terakhir bertujuan untuk menguji respons reproduksi ikan nila strain SULTANA. Ikan betina dengan bobot rata-rata 100 g dipelihara dalam hapa ukuran 2x1x1 m3 kedalaman air 0.75 m dengan padat tebar 10 ekor. Pakan yang diperkaya rElGH dengan dosis 3.00 mg/kg pakan diberikan tiga hari sekali dengan frekuensi tiga kali sehari (pagi, siang, dan sore) secara at satiation. Hasil penelitian menunjukkan bahwa konsentrasi protein darah ikan yang diberi rElGH tidak memperlihatkan perbedaan yang nyata (p>0.05) dibandingkan kontrol, berkisar 3.12–4.20 mg/dL. Konsentrasi hormon estradiol-17β ikan yang diberi rElGH berkisar dari 0.36 – 2.08 ng/mL lebih tinggi (p<0.05) dibandingkan ikan kontrol yang berkisar 0.46–0.53 ng/mL. Konsentrasi glukosa plasma lebih tinggi (p<0.05) pada ikan yang diberi rElGH dibandingkan kontrol. Nilai indeks gonadosomatik (IGS) ikan yang diberi rElGH (3.98) dan diameter telur (2.61 mm) lebih tinggi (p<0.05) dibandingkan kontrol (IGS:3.15, diameter telur: 2.31 mm ). Sementara itu, indek hepatosomatik ikan yang diberi rElGH tidak berbeda nyata (p>0.05) dibandingkan dengan kontrol. Pemberian rElGH pada ikan nila strain SULTANA memberikan pengaruh yang nyata lebih rendah (p<0.05) terhadap B, dan LPH masing-masing 1257.94 g, 1.39%, dibandingkan ikan kontrol yang masing-masing adalah 1556.74 g, 1.62%,, sementara KP ikan yang diberi rElGH 1.87 lebih tinggi dibandingkan kontrol 1.31. Dengan demikian, pakan yang mengandung rElGH yang diberikan pada calon induk ikan nila strain SULTANA lebih banyak digunakan untuk perkembangan gonad.
Sebagai kesimpulan, rElGH efisien untuk meningkatkan pertumbuhan ikan nila pada dosis 3.00 mg/kg pakan. Strain ikan nila SULTANA memiliki respons pertumbuhan tertinggi pada penebaran awal ukuran 12.5 g, dan pemberian rElGH pada calon induk mempercepat perkembangan gonad.
SUMMARY
MUHAMMAD. Growth and Reproduction Responses of Nile Tilapia fed on Diet Containing Recombinant Giant Grouper Growth Hormone. Supervised by M. ZAIRIN JUNIOR, ALIMUDDIN and ODANG CARMAN.
Growth hormone (GH) plays an important role in the growth of vertebrate organisms. Natural GH level is relatively low and isolation method is complicated making its application uneconomical and impractical. Therefore, the recombinant DNA technology has been applied to produce recombinant growth hormone (rGH). Fish rGH from a variety of species has been produced in large quantity using a bioreactor such as bacteriumEscherichia coli. The current use of GH for promoting growth of fish culture gets considerable attention. Increased growth of fish provides great benefits to shorten production time, improve feed efficiency, and increase production, as well as to control the availability of the product. These studies aimed to examine the growth and reproduction responses of Nile tilapia fed on diet containing recombinant giant grouper (Epinephelus lanceolatus) growth hormone (rElGH).
The research was divided into four steps. The first study was conducted to examine the growth response of red tilapia (Oreochromis niloticus) fed on diet containing rElGH at different dosages. Four level of rElGH doses were tested, namely 0 (control diet; CD), 0.03 (test diet 1; TD1), 0.3 (TD2) and 3.0 mg/kg diet (TD3). Red tilapia juvenile (average body weight: 3.5±0.5 g) were obtained from Experimental Station of Aquaculture Department, IPB. Fish (n= 25) were reared in the 200 L glass aquaria for eight weeks. Fish were fed with TD at interval of two days three times daily at satiation for one month. The results showed that weight gain (W), specific growth rate (SGR), and feed conversion ratio (FCR) were significantly different among treatments compared to the control (p<0.05), but were not significantly different among treatments (p>0.05). W (ranged from 564.17 to 589.74 g), SGR (3.35 to 3.46%), and FCR (1.07 to 1.14) of rElGH treatments were higher than that of control (W: 454.70-457.16 g, SGR: 3.02-3.03 %, FCR: 1.36-1.38). Feeding with diet containing rElGH 0.03-3 mg/kg increased growth of red tilapia with weight gain of 24.07 to 31.68% higher than control, and the efficient dose was 3 mg/kg diet.
growth response on rElGH oral administration.
The third study was conducted to examine the growth response and feed utilization at different size of SULTANA tilapia strain on feeding rElGH supplemented diet. The fish avarage body weight 3.5±0.25 g (treatment A), 12.5±0.40 g (treatment B), 40.0±2.50 g (treatment C)were reared in the hapa (2x1x1 m3) settled in a concrete pond (20x10x1.5 m3) at density of 50 fish/hapa for eight weeks. Each treatment was fed 3 mg/kg rElGH-enriched diet, and without rElGH supplementation as control at interval two days, three time daily for one month, than commercial diet was given at the rest days.. The results showed that weight gain of rElGH-treated fish were significantly higher p<0.05) compared with control, whereas effect of different fish size was similar (p>0.05). SGR of rElGH-treated fish were higher than without rElGH. Survival of fish was similar (p>0.05), ranged at 90.7 to 96.7%. FCR of rElGH-treated fish were higher than control, except for fish 40 g. Liver and muscle glycogen content, protein and lipid retention, hepatosomatic indexs and RNA:DNA ratio in rElGH-treated fish were higher than without rElGH treatment. Feeding with diet containing rElGH increased growth and feed utilization of Nile tilapia at initial body weight 12.5 g.
The last study was conducted to examine the reproduction response of Nile tilapia SULTANA strain on feeding rElGH supplemented diet at a dose of 3 mg/kg. The fish (avarage body weight 100 g) were reared in the hapa (2x1x1 m3) settled in a concrete pond (20x10x1.5 m3) at density of 10 fish/hapa for eight weeks. The result of the study was not significanly different (p>0.05) to protein plasm (3.12 to 4.20 mg/dL). Estradiol-17β of rElGH-treated fish (0.36 to 2.08 ng/mL) was higher than (p<0.05) control (0.46 to 0.53 ng/mL). Glucose of rElGH-treated fish was also higher than control (p<0.05). Gonadosomatic index (GSI) of rElGH-treated fish (3.98) and egg diameter (2,61mm) were significantly higher (p<0.05) compared control (GSI: 3.15 and egg diameter: 2.31). HSI was not significanly different (p>0.05). Weight gain and SGR in rElGH-treated fish (1257.94 g, 1.39 %, respectively) were lower than (p<0.05) control (1556.74 g and 1.62 %, respectively). While FCR in rElGH-treated fish (1.87) higher than contro (1.31). Thus feeding Nile tilapia broodstock on diet containing rElGH is most likely spent more energy for gonad development rather than somatic growth.
As conclusion, oral administration of recombinant giant grouper growth hormone at 3.00 mg/kg of feed was efficient dose in improving the growth of Nile tilapia. The rElGH administration to SULTANA tilapia strain at initial body weight of 12.5 g had the best growth response, and administration of rElGH at dose of 3 mg/kg diet stimulated gonad development of broodstock.
Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Akuakultur
RESPONS PERTUMBUHAN DAN REPRODUKSI IKAN NILA
YANG DIBERI HORMON PERTUMBUHAN REKOMBINAN
IKAN KERAPU KERTANG
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
ii
Penguji pada Ujian Tertutup: 1. Dr Ir Etty Riani, MS
Staf Pengajar Departemen Manajemen Sumberdaya Perairan, FPIK IPB
2. Dr Ir Mia Setiawati, MSi.
Staf Pengajar Departemen Budidaya Perairan, FPIK IPB
Penguji pada Ujian Terbuka: 1. Dr Ir Wartono Hadie, MS.
Peneliti Utama Pusat Penelitian dan Pengembangan Perikanan Budidaya
` 2. Dr Ir Muhammad Agus Suprayudi, MSi.
Judul Disertasi : Respons Pertumbuhan dan Reproduksi Ikan Nila yang Diberi Pakan Mengandung Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang.
Nama : Muhammad
NIM : C161090051
Disetujui, Komisi Pembimbing
Prof Dr M. Zairin Junior, MSc. Ketua
Dr Alimuddin, MSc. Dr Odang Carman, M.Sc.
Anggota Anggota
Mengetahui,
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Akuakultur
Dr Ir Widanarni, MSi. Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Alhamdulillah, segala pujian hanya milik Allahsubhanahu wa ta’ala, yang
maha memberi petunjuk melimpahkan hidayah-Nya kepada penulis sehingga disertasi ini berhasil diselesaikan. Shalawat dan salam semoga selalu terlimpah kepada Rasulullah SAW. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2013 – Desember 2014 ini adalah “Respons Pertumbuhan dan Reproduksi Ikan Nila yang Diberi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang”. Disertasi ini disusun sebagai salah satu syarat untuk memperoleh gelar Doktor di Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penulis sangat menyadari bahwa proses penyelesaian penelitian dan penulisan disertasi ini tidak akan dapat berjalan lancar tanpa dukungan banyak pihak, sehingga pada kesempatan ini penulis mengucapkan terima kasih kepada Prof Dr Ir Muhammad Zairin Junior, MSc., Dr Alimuddin, SPi, MSc., dan Dr Ir Odang Carman, MSc. selaku komisi pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan disertasi.
Penulis juga sampaikan terimakasih kepada penguji luar komisi pada prilium lisan Dr Dedi Jusadi, MSc. dan Dr Sri Nuryati MSi, ujian tertutup Dr Mia Setiawati, MSi. dan Dr Etty Riani, MS, Ujian terbuka Dr Agus Suprayudi, MSi. dan Dr Wartono Hadie, MS. Atas saran dan masukan untuk perbaikan disertasi ini.
Terima kasih penulis ucapkan kepada Direktorat Jenderal Pendidikan Tinggi Kementrian Pendidikan Nasional yang telah memberikan beasiswa BPPS periode Agustus 2009 – Juli 2012, Rektor Universitas Lambung Mangkurat (UNLAM) Banjarmasin, Dekan Fakultas Perikanan dan Kelautan UNLAM Banjarbaru, serta Ketua jurusan dan Ketua program studi Budidaya Perairan UNLAM Banjarbaru yang telah memberikan izin kepada saya untuk menempuh pendidikan S3 di Institut Pertanian Bogor.
Terima kasih dan penghargaan yang tinggi penulis haturkan kepada orangtua tercinta ayahnda H. Asmuni (Alm) dan ibunda Hj. Zubaidah atas dukungan, bantuan, pengorbanan, kasih sayang, dan do’a yang selalu dipanjatkan untuk keberhasilan dan kebahagiaan penulis. Terimakasih kepada istri tercinta Rini Marlida, dan anak-anakku tersayang Rafiqa Humaira, Annisa Amalia, Ahmad Shidqi Fadhilla, dan Ahmad Fadhil Azhim atas kesetiaan, kesabaran, pengorbanan, dan doa yang diberikan. Kepada saudara-saudaraku: H. Aziannoor dan keluarga, H. Azanuddin dan keluarga, Hj. Azinarrahmah dan keluarga, H. Azinal Mukhlis dan keluarga, Hj. Azmi Rahmiati dan keluarga, Hj. Azmiati dan keluarga, H. Aziani Yahya dan keluarga, dan Hj. Azrinayati dan keluarga, serta mertua ayahanda H. Badaruddin dan ibunda Hj. Marbani, adik-adik H. Fachri Ubadiyah SE MP dan isteri, Hj. Narima Zuraida SP, Ihklas Surianoor SHut dan isteri, serta seluruh keluarga atas dukungan, perhatian, menjaga anak-anak dan do’a nya.
vi
Edi (FKH), kepada rekan-rekan mahasiswa Kalimantan Selatan Taufik Hidayat, Untung Bijaksana, Indira Fitriliyani, Fatmawati, Agussyarif Hanafi, Aidi Noor, Fachrul Razi, Kissinger, Indya, Lusita Wardani, Syahdan, M. Yusuf, Surya Noor, Hadi Hermansyah, Tintin Rostini, Hamdani, dan Jumena atas doa, dukungan dan kerjasama selama ini, serta keluarga Drs. Sunyoto dan keluarga Werry Desra atas perhatian dan bantuan selama tinggal di Bogor.
Terima kasih kepada, Anna Octavera, Fajar Maulana, Darmawan, Jasmadi, Rangga, Epro Barades, Dedi Supriadi, Bapak Ranta, Wasjan, dan Retno M. atas segala bantuan yang telah diberikan selama penelitian. Terimakasih saya sampaikan kepada Ir H Sarifin, MS, dan Dian Hardiantho, SPi, MSi, Arief Eko Prasetyo SPi, Dwi Hany Yanti SPi, dan Nurlatifa Khairun Nisa, SPi. selaku kepala dan Staf Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi yang telah membantu dan memberikan ikan SULTANA. Balai Pengembagan Benih Ikan Air Tawar (BPBIAT) Wanayasa Purwakarta, Balai Penelitian Pemuliaan Ikan (BPPI) Sukamandi Subang yang memberikan ikan nila masing-masing strain NIRWANA dan SRIKANDI. Terima kasih kepada seluruh sivitas akademika Fakultas Perikanan dan Kelautan UNLAM atas semua dukungan dan do’anya.
Ungkapan terima kasih juga saya sampaikan kepada semua pihak yang telah membantu dan tidak mungkin saya sebutkan satu per satu, semoga Allah SWT memberikan balasan dengan kebaikan yang berlimpah.
Akhir kata, semoga karya ilmiah ini bermanfaat dan berkontribusi terhadap pengembangan budidaya ikan nila di masa depan.
Bogor, Agustus 2014
DAFTAR ISI
Halaman
DAFTAR TABEL ... Ix
DAFAR GAMBAR ... X
DAFTAR LAMPIRAN ... Xi
PENDAHULUAN
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
Kebaharuan (Novelty) ... 4
Ruang Lingkup Penelitian ... 4
RESPONS PERTUMBUHAN IKAN NILA MERAH YANG DIBERI PAKAN MENGANDUNG HORMON PERTUMBUHAN REKOMBINAN PADA DOSIS BERBEDA Abstrak ... 6
Pendahuluan ... 8
Metode Penelitian ... 8
Hasil dan Pembahasan ... 10
Kesimpulan ... 12
RESPONS PERTUMBUHAN EMPAT STRAIN IKAN NILA YANG DIBERI PAKAN MENGANDUNG HORMON PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG Abstrak ... 13
Pendahuluan ... 15
Metode Penelitian ... 16
Hasil dan Pembahasan ... 18
Kesimpulan ... 20
RESPONS PERTUMBUHAN DAN PEMANFAATAN PAKAN PADA IKAN NILA UKURAN BERDEDA YANG DIBERI PAKAN MENGANDUNG HORMON PERTUMBUHAN REKOMBINAN Abstrak ... 21
Pendahuluan ... 23
Metode Penelitian ... 23
Hasil dan Pembahasan ... 25
viii
RESPONS REPRODUKSI IKAN NILA YANG DIBERI PAKAN MENGANDUNG HORMON PERTUMBUHAN
Abstrak ... 30
Pendahuluan ... 32
Metode Penelitian ... 33
Hasil dan Pembahasan ... 35
Kesimpulan ... 38
PEMBAHASAN UMUM ... 39
KESIMPULAN DAN SARAN ... 41
DAFTAR PUSTAKA ... 43
LAMPIRAN ... 49
DAFTAR TABEL
1 Proksimat pakan uji yang mengandung hormon pertumbuhan rekombinan ikan kerapu kertangEpinephelus lanceolatus(rElGH)
dan kontrol ... 9
2 Biomassa, pertambahan bobot akhir (B), laju pertumbuhan harian (LPH), konversi pakan (KP), dan tingkat kelangsungan hidup (TKH) strain ikan nila merah yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu
kertang (rElGH) ... 11
3 Proksimat pakan yang mengandung hormon pertumbuhan ikan
kerapu kertang (rElGH) dan pakan harian ... 16
4 Biomassa, pertambahan bobot (B), laju pertumbuhan harian (LPH), dan tingkat kelangsungan hidup (TKH) empat strain ikan nila yang diberi pakan mengandung hormon pertumbuhan
rekombinan ikan kerapu kertang (rElGH) ... 18
5 Konversi pakan, glikogen hati, glikogen otot, retensi protein, retensi lemak, dan rasio RNA:DNA empat strain ikan nila yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan
kerapu kertang (rElGH) ... 19
6 Tingkat kelangsungan hidup (TKH), pertambahan bobot akhir (B), laju pertumbuhan harian (LPH), dan konversi pakan (KP) ikan nila strain SULTANA yang dipelihara selama delapan
minggu ... 26
7 Kadar glikogen hati dan glikogen otot (mg/g), retensi protein dan retensi lemak (%), indek hapatosomatik (IHS), dan rasio RNA:DNA ikan nila strain SULTANA yang dipelihara selama
delapan minggu ... 28
8 Indeks gonadosomatik (IGS), indeks hepatosomatik (IHS), diameter telur, tingkat kelangsungan hidup (TKH), pertambahan biomassa (B), laju pertumbuhan harian (LPH), dan konversi pakan (KP) ikan nila strain SULTANA yang dipelihara selama
x
DAFTAR GAMBAR
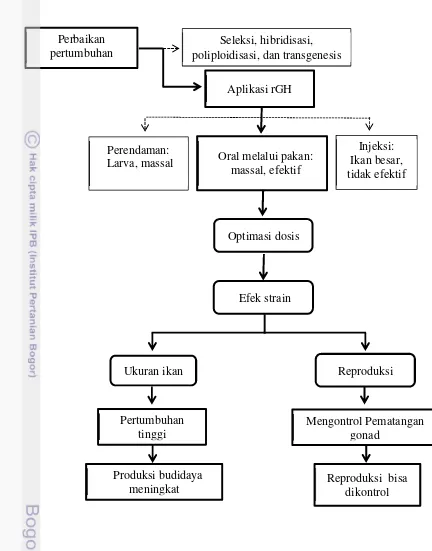
1 Ruang lingkup dan alur penelitian ... 5
2 Biomassa ikan nila merah (Oreochromis niloticus) yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan
kerapu kertang (rElGH) dan kontrol ... 11
3 Biomassa empat strain ikan nila yang diberi pakan mengandung
hormon pertumbuhan rekombinan ikan kerapu kertang ... 20
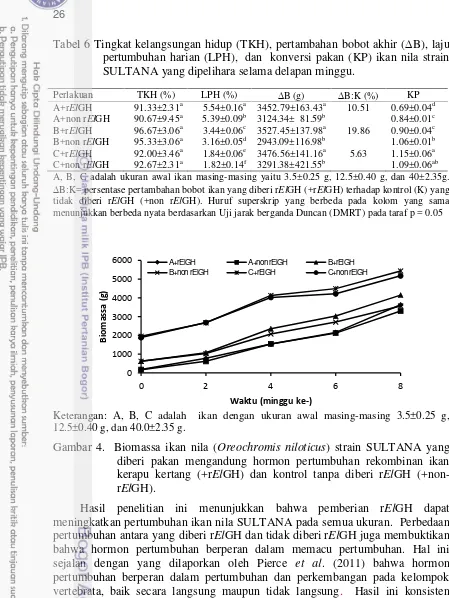
4 Biomassa ikan nila (Oreochromis niloticus) strain SULTANA yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (+rElGH) dan kontrol tanpa
diberi rElGH (+non-rElGH) ... ... 26
5 Konsentrasi protein darah ikan nila diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang () dan
kontrol ()selama delapan minggu pemeliharaan... 35
6 Kadar hormon estradiol-17β ikan nila diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang () dan
kontrol ()selama delapan minggu pemeliharaan... 36
7 Konsentrasi glukosa darah ikan nila diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang () dan
DAFTAR LAMPIRAN
1 Prosedur kerja produksi dan ekstraksi rGH ... 49
2 Prosedur kerja analisis proksimat... 50
3 Prosedur kerja pengukuran glikogen hati dan otot ... 52
4 Prosedur kerja Analisis RNA dan DNA ... 53
PENDAHULUAN
Latar Belakang
Pengembangan dan penerapan teknologi untuk meningkatkan efisiensi produksi ikan nila berkaitan dengan upaya peningkatan pertumbuhan telah banyak dilakukan. Berbagai penelitian yang telah dilakukan terkait rekayasa genetika seperti seleksi, hibridisasi, triploidisasi, dan transgenesis. Aplikasi metode seleksi membutuhkan waktu yang relatif lama untuk mencapai hasil yang signifikan karena peningkatan kecepatan tumbuh yang dihasilkan per generasi relatif rendah, seperti yang dilaporkan oleh Bolivar et al. (2002) bahwa membutuhkan waktu selama 10 tahun untuk menghasilkan 12 generasi dengan kecepatan tumbuh 12.4% per generasi pada ikan nila. Penerapan teknologi hibridisasi dan triploidisasi terbatas pada ikan-ikan budidaya yang sudah diketahui teknik pemijahan buatannya secara baik. Begitu pula dengan metode transgenesis masih menimbulkan kontroversi dan kekhawatiran akan keamanan (foodsafety) dalam mengkonsumsi organisme transgenik tersebut, meskipun laju pertumbuhan 30 kali lebih cepat (Nam et al. 2001). Oleh karena itu diperlukan cara lain untuk mengatasi masalah tersebut. Salah satu alternatif yang bisa dilakukan adalah penggunaan protein hormon pertumbuhan rekombinan (rGH) ikan. Acosta et al. (2007) menjelaskan bahwa penggunaan rGH ikan dalam meningkatkan pertumbuhan ikan budidaya dilakukan dengan prosedur yang aman, bukan merupakan genetically modified organism (GMO) karena yang dimodifikasi adalah bakteri yang memproduksi rGH saja dan rGH tidak ditransmisikan ke keturunannya.
ikan nila yangdiberikan melalui teknik injeksi. Selanjutnya, pemberian rGH pada benih ikan nila dengan dosis 30 mg/kg pakan (dosis basah) dengan frekuensi pemberian dua kali seminggu selama tiga minggu meningkatkan bobot tubuh sebesar 35% daripada kontrol (Hardianthoet al. 2012).
Pemberian rGH melalui pakan merupakan metode yang praktis dan lebih efektif, tetapi perlu disalut (coating) untuk menghindari degradasi akibat enzim pencernaan dan pH rendah di lambung. Hasil penelitian Latar (2013) bahwa penggunaan penyalut HP55, PMC, dan kuning telur tidak berbeda terhadap pertumbuhan ikan nila.
Efek rGH terhadap pertumbuhan, selain ditentukan oleh jenis rGH, juga ditentukan oleh dosis, dan umur ikan (Hertz et al. 1991). Kajian tentang dosis rGH dan umur (ukuran) ikan penting untuk dilakukan untuk meningkatkan pertumbuhan pada ikan nila yang merupakan salah satu jenis ikan penting dalam produksi akuakultur.
Pemberian rGH dapat dilakukan dengan cara injeksi, perendaman, dan oral melalui pakan. Pemberian rGH melalui injeksi kurang aplikatif digunakan karena memerlukan waktu yang relatif lama, tenaga yang banyak, serta dibatasi oleh ukuran ikan. Metode perendaman hanya efektif dilakukan pada fase larva/benih ikan, sehingga pada penelitian ini pemberian rGH dilakukan secara oral melalui pakan. Beberapa rGH ikan seperti rGH ikan mas (Cyprinus carpio)(rCcGH), ikan gurami (Osphronemus goramy) (rOgGH), dan ikan kerapu kertang (Epinephelus lanceolatus) (rElGH) telah diproduksi, dan diuji bioaktivitasnya dalam memacu laju pertumbuhan ikan (Alimuddinet al. 2010). Berdasarkan analisis SDS-PAGE, rElGH terekspresi pada level lebih tinggi dibandingkan rGH ikan mas dan rGH ikan gurami (Irmawati 2013).
Ikan nila unggul yang ada di Indonesia yang telah dirilis dan beredar di masyarakat antara lain: nila merah Bangkok, nila NIRWANA (nila ras Wanayasa), nila SRIKANDI (salinity resistant fromSukamandi), nila SULTANA (seleksi unggul Selabintana), nila GIFT (genetic improvement of farmed tilapias), nila GESIT (genetically supermale Indonesian tilapia), nila JICA (Japan international cooperation agency), nila GET (genetically enhanced tilapias), nila BEST (Bogor enhanced strain tilapia), nila Jatimbulan (nila Jawa Timur Umbulan), dan nila Larasati (nila merah strain Janti). Untuk menguji apakah ada perbedaan respons pertumbuhan ikan nila yang telah dirilis dalam pemanfaatan rGH, dilakukan penelitian terhadap beberapa strain ikan nila.
3
cairan darah untuk pengisian oosit. Konsentrasi estradiol-17β di dalam plasma yang meningkat selama periode perkembangan oosit dapat digunakan sebagai indikator vitelogenesis (Fostieret al.1978).
Singh et al. (1988) melaporkan bahwa perlakuan dengan rGH ikan salmon mampu menunjang perkembangan gonad dan menstimulasi produksi testosteron dan estradiol-17β pada ikanFundulus heteroclitus. Selanjutnya Van Der Kraak & Wade (1994) menambahkan bahwa GH juga memberikan potensi pada GTH II menstimulasi produksi estradiol pada ovari ikan koki (Carassius auratus). Weber
et al. (2007) menemukan bahwa IGF-1 pada ikan white perch (Morone americana)meningkatkan produksi testosteron dan estradiol-17βmelalui fragmen ovari.
Kajimura et al.(2004) melaporkan bahwa terdapat sejumlah besar reseptor GH pada oosit yang belum matang (immature) sebagaimana terdapat pada granulosa dan sel-sel teka yang mengelilingi oosit vitelogenik pada ikan mujair. GH alami memiliki kontribusi dalam proses pematangan gonad, sehingga penggunaan rGH melalui pakan diharapkan dapat meningkatkan produksi estradiol-17β dan mampu menstimulasi sintesis vitelogenin dalam proses rematurasi ikan nila. Namun demikian mengingat ikan nila yang mudah dan cepat memijah, pemberian rGH pada ukuran calon induk diharapkan dapat menghambat perkembangan gonad agar reproduksinya dapat dikontrol. Oleh karena itu diperlukan penelitian yang berkaitan dengan pemberian rElGH sehingga bisa terlihat peran GH dalam mengontrol reproduksi, dan mengevaluasi apakah pemberian rElGH dapat meningkatkan pertumbuhan dan menghambat proses pematangan gonad atau sebaliknya dapat mempercepat pematangan gonad.
Tujuan Penelitian
Penelitian ini secara umum bertujuan untuk mengevaluasi respons pertumbuhan dan reproduksi ikan nila yang diberi pakan mengandung hormon pertumbuhan rekombinan. Secara khusus penelitian ini bertujuan untuk:
1. Menentukan dosis optimum rElGH dalam pakan untuk pertumbuhan
2. Mengkaji respons pertumbuhan pada empat strain ikan nila yang diberi rElGH
3. Mengkaji respons pertumbuhan ikan nila pada ukuran yang berbeda setelah pemberian rElGH
4. Mengkaji peran rElGH dalam proses perkembangan gonad ikan nila
Manfaat Penelitian
Kebaharuan (Novelty)
Pertama kalinya dilakukan penelitian aplikasi pemberian hormon pertumbuhan rekombinan ikan kerapu kertang untuk membandingkan respons pertumbuhan antara varietas ikan nila yang ada di Indonesia dan terhadap respons reproduksi ikan nila.
Ruang Lingkup Penelitian
Secara umum ruang lingkup dan tahapan pelaksanaan penelitian adalah sebagai berikut :
1. Persiapan penelitian meliputi produksi dan penyiapan rElGH, serta penyiapan ikan uji.
2. Penelitian penentuan dosis optimum aplikasi rElGH secara oral pada ikan nila merah. Pada penelitian ini diukur parameter-parameter pertumbuhan yaitu bobot ikan, pertambahan bobot tumbuh (B), laju pertumbuhan harian (LPH), kelangsungan hidup (TKH) dan konversi pakan (KP).
3. Mengkaji efek pemberian rElGH terhadap pertumbuhan empat strain ikan nila yaitu SULTANA, NIRWANA, SRIKANDI, dan nila merah. Pada penelitian ini diukur parameter-parameter pertumbuhan, komposi proksimat, glikogen hati, glikogen otot, dan rasio RNA:DNA.
4. Mengkaji efek pemberian rElGH terhadap pertumbuhan ikan nila SULTANA pada ukuran yang berbeda. Pada penelitian ini diukur parameter-parameter pertumbuhan, komposi proksimat, glikogen hati, glikogen otot, indeks hepatosomatik (IHS), dan rasio RNA:DNA.
5. Mengkaji efek pemberian rElGH terhadap reproduksi ikan nila SULTANA. Pada penelitian ini diukur parameter-parameter reproduksi dan pertumbuhan yaitu protein darah, glukosa darah, kandungan estradiol, indeks gonadosomatik (IGS), indeks hepatosomatik (IHS), ukuran oosit, bobot ikan,B, LPH, TKH, dan konversi pakan (KP)
5
Gambar 1 Ruang lingkup dan alur penelitian. Perbaikan
pertumbuhan
Seleksi, hibridisasi, poliploidisasi, dan transgenesis
Aplikasi rGH
Oral melalui pakan: massal, efektif Perendaman:
Larva, massal
Injeksi: Ikan besar, tidak efektif
Optimasi dosis
Efek strain
Ukuran ikan Reproduksi
Mengontrol Pematangan gonad
Pertumbuhan tinggi
Produksi budidaya meningkat
RESPONS PERTUMBUHAN IKAN NILA MERAH YANG
DIBERI PAKAN MENGANDUNG HORMON PERTUMBUHAN
REKOMBINAN PADA DOSIS BERBEDA
ABSTRAK
Penelitian ini bertujuan untuk mengevaluasi respons petumbuhan ikan nila merah (Oreochromis niloticus) yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (Epinephelus lanceolatus) (rElGH) pada dosis berbeda. Ikan nila merah dengan bobot rata-rata 3.5 g dipelihara dalam akuarium berukuran 1.0x0.5x0.5 m3 (volume air 200 L) dan diberi pakan buatan dengan dosis rElGH 3.00 mg/kg pakan (perlakuan A), 0.30 mg/kg pakan (perlakuan B), 0.03 mg/kg pakan (perlakuan C), dan 0 (kontrol). Hasil penelitian menunjukkan bahwa pertambahan biomassa (B), pertumbuhan harian (LPH), dan konversi pakan (KP) tidak berbeda nyata (p>0.05) antara perlakuan, tetapi berbeda nyata jika dibandingkan dengan kontrol (p<0.05). B, LPH, dan KP perlakuan pemberian rElGH masing-masing berkisar 564.17-589.74 g, 3.35-3.46 %, 1.07-1.14, lebih tinggi daripada kontrol yang masing-masing berkisar 454.70-457.16 g, 3.02-3.03 %, dan 1.38-1.40. Sebagai kesimpulan pemberian dosis rElGH antara 0.03-3.00 mg/kg pakan efektif dalam meningkatkan pertumbuhan ikan nila merah dengan pertambahan bobot 24.07-31.68% dan dosis yang efisien adalah 3 mg/kg pakan.
Kata kunci: dosis berbeda, hormon pertumbuhan rekombinan, nila merah,
7
GROWTH RESPONSE OF RED NILE TILAPIA FED ON
DIFFERENT DOSES OF RECOMBINANT GROWTH
HORMONE SUPPLEMENTED DIET
ABSTRACT
This study was conducted to examine the growth response of red tilapia (Oreochromis niloticus) fed on diet containing recombinant Epinephelus lanceolatusgrowth hormone (rElGH). Red tilapia with initial body weight of 3.5 g were reared in 200-L glass aquaria and fed on artificial diet with different doses of crude rElGH protein, namely 3.00 mg/kg diet (treatment A), 0.30 mg/kg diet (treatment B), 0.03 mg/kg (treatment C), 0 (control). The results showed that weight gain (W), specific growth rate (SGR), and feed conversion ratio (FCR) were not significantly different among treatments (p>0.05), but significantly different compared to the control (p<0.05). W, SGR, and FCR of rEl GH-treated fish were ranged 564.17 to 589.74 g, 3.35 to 3.46 % and 1.07 to1.14, and higher than that of control (W: 454.70-457.16 g, SGR: 3.02-3.03 %, FCR: 1.38-1.40. As conclusion, feeding with diet containing rElGH 0.03-3.00 mg/kg increased growth of red tilapia with weight gain of 24.07-31.68% and the efficient rElGH dose was 3.00 mg/kg diet.
PENDAHULUAN
Hormon pertumbuhan (growth hormone/GH) berperan penting dalam pertumbuhan organisme vertebrata. Level GH alami relatif rendah dan metode isolasinya relatif rumit sehingga tidak ekonomis dan tidak praktis, maka digunakan teknologi DNA rekombinan untuk memproduksi GH rekombinan (Sekine et al. 1985). Hormon pertumbuhan rekombinan (rGH) dari berbagai spesies vertebrata, termasuk ikan telah dapat diproduksi dalam jumlah banyak menggunakan bioreaktor berupa bakteri Escherichia coli (Promdonkoy et al.
2004, Sørensen & Kim 2005, Alimuddin et al. 2010), dan ragi Pichia pastoris
(Acosta et al. 2007, Weidner et al. 2010). Bioaktivitas rGH dalam memacu pertumbuhan telah diuji pada ikan, udang dan kekerangan (Moriyama & Kawauchi 2001, Acosta et al. 2007, Alimuddin et al. 2010, Santiesteban et al. 2010). Namun demikian efek rGH terhadap pertumbuhan selain ditentukan oleh jenis rGH yang diberikan, juga ditentukan oleh dosis dan ukuran ikan uji (Hertzet al. 1991).
Dosis yang digunakan dalam pemberian rGH berbeda terhadap setiap spesies ikan seperti yang dilaporkan Liet al. (2003) bahwa pemberian rGH ikan mas 0.1 μ g/g bobot tubuh pada benih ikan nila dapat meningkatkan bobot tubuh sebesar 53.1% dibandingkan dengan kontrol. Acosta et al. (2007), menyatakan bahwa rGH ikan nila yang diberikan pada benih ikan nila umur lima hari setelah menetas dengan cara perendaman selama 90 menit, dilakukan tiga kali/minggu selama enam minggu dengan dosis 0.1 mg/L air, mampu meningkatkan pertumbuhan 171% dibandingkan dengan kontrol setelah enam minggu. Selain itu, pemberian rGH ikan mas melalui pakan dengan dosis 30 mg/kg pakan dengan frekwensi pemberian dua kali seminggu selama tiga minggu pada benih ikan nila ukuran panjang tubuh sekitar 2 cm (bobot tubuh sekitar 0.7 g), diperoleh peningkatan pertumbuhan sekitar 35% dibandingkan dengan kontrol tanpa diberi rGH (Hardianthoet al.2012). Dosis pemberian rGH harus tepat, karena jika tidak tepat maka terjadi umpan balik negatif pada kelenjar untuk tidak menyekresikan GH (Moriyama & Kawauchi 2001) sehingga kajian tentang dosis untuk meningkatkan pertumbuhan ikan perlu dilakukan.
METODE PENELITIAN
Waktu dan Tempat
Pemeliharaan dilaksanakan pada bulan November 2012 sampai dengan Januari 2013 di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Fakultas Perikanan dan Ilmu kelautan IPB (FPIK IPB), Bogor. Pembuatan pakan mengandung rElGH dilakukan di Laboratorium Reproduksi & Genetika Organisme Akuatik FPIK IPB. Analisis proksimat pakan dan ikan dilakukan di Laboratorium Nutrisi FPIK IPB.
Produksi rElGH
9
E.coli yang mengandung rGH tersebut diperoleh dari Laboratorium Reproduksi dan Genetika Organisme Akuatik, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor (FPIK IPB). Klon bakteri E. coli dikultur awal dalam 4 mL media 2xYT cair yang mengandung ampisilin, dan diinkubasi menggunakan
shakerpada suhu 37˚C selama 16-18 jam. Kemudian dilakukan subkultur dengan mengambil sebanyak 1 mL dari kultur awal, dimasukkan ke dalam 100 mL media 2xYT cair baru, dan diinkubasi pada suhu 37˚C selama 2 jam. Kemudian kultur diberi kejutan suhu 15˚C selama 30 menit, ditambahkan IPTG 1 mM sebanyak 1 mL, dan diinkubasi menggunakan shakerpada suhu 15˚C selama 24 jam. Bakteri hasil kultur dikumpulkan dengan sentrifugasi pada 12 000 rpm selama 2-10 menit. Lisis dinding sel bakteri dilakukan secara kimiawi menggunakan lisozim. Pelet bakteri hasil sentrifugasi dicuci menggunakan 1 mL bufer tris-EDTA (TE) per 200 mg bakteri, diinkubasi pada suhu 37˚C selama 20 menit, dan selanjutnya disentrifugasi pada 12.000 rpm selama 1 menit. Supernatan dalam tabung mikro dibuang, diganti dengan larutan lisozim (10 mg dalam 1 mL bufer TE) sebanyak 500 µL, diinkubasi pada suhu 37 °C selama 20 menit, lalu disentrifugasi pada 12 000 rpm selama 1 menit. Supernatan dibuang, dan pelet yang terbentuk merupakan protein rGH dalam bentuk badan inklusi (inclusion body). Pelet rGH dicuci dengan bufer fosfat salin (PBS) sebanyak 1 kali. dan rGH siap digunakan atau disimpan pada suhu -80˚C. Verifikasi protein berdasarkan berat molekul dilakukan melalui elektroforesis badan inklusi menggunakan teknik SDS-PAGE menggunakan coomasie brilliant blue sebagai pewarna (CBB staining) berdasarkan Walker (2002).
Pembuatan pakan mengandung rElGH
[image:30.595.111.518.580.716.2]Pembuatan pakan mengandung rELGH dilakukan dengan cara mencampurkan rElGH ke dalam pakan komersial dengan dosis 0.03, 0.3, dan 3.00 mg/kg pakan dengan komposisi proksimat (isoenergi dan rasio C/P sama) seperti disajikan pada Tabel 1. Pencampuran pakan dilakukan berdasarkan metode Hardiantho et al. (2012) yaitu rELGH dilarutkan dalam 15 mL PBS dicampur dengan 2 mg kuning telur lalu dihomogenkan dengan menggunakan vorteks. Campuran tersebut disemprotkan secara merata pada 100 g pakan buatan. Selanjutnya pakan dikering-udarakan sebelum diberikan ke ikan.
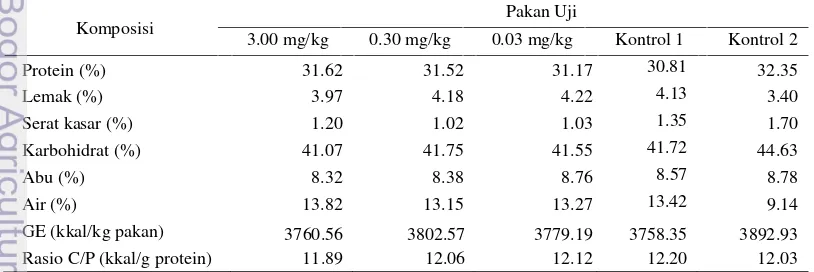
Tabel 1 Proksimat pakan uji yang mengandung hormon pertumbuhan rekombinan ikan kerapu kertang Epinephelus lanceolatus(rElGH) dan kontrol.
Komposisi
Pakan Uji
3.00 mg/kg 0.30 mg/kg 0.03 mg/kg Kontrol 1 Kontrol 2 Protein (%) 31.62 31.52 31.17 30.81 32.35
Lemak (%) 3.97 4.18 4.22 4.13 3.40
Serat kasar (%) 1.20 1.02 1.03 1.35 1.70 Karbohidrat (%) 41.07 41.75 41.55 41.72 44.63
Abu (%) 8.32 8.38 8.76 8.57 8.78
Hewan Uji
Hewan uji yang digunakan pada percobaan ini adalah ikan merah (Oreochromis niloticus) yang diperoleh dari pembenihan ikan di kolam Percobaan FPIK IPB Bogor. Sebelum digunakan, terlebih dahulu ikan uji diadaptasikan dengan kondisi pemeliharaan, kemudian diseleksi untuk mendapatkan ukuran yang seragam. Benih dengan bobot rata-rata 3.5 g dipelihara dalam akuarium berukuran 1.0x0.5x0.5 m3, kedalaman air 40 cm dengan kepadatan 25 ekor. Adaptasi terhadap pakan buatan dilakukan selama satu minggu sebelum pemberian pakan mengandung rElGH. Penelitian dilaksanakan selama delapan minggu. Pakan diberikan dengan frekuensi tiga kali sehari (07.30-08.30, 12.00-13.00, dan 16.30-17.30 WIB) secara at satiation (sampai kenyang). Pakan mengandung rElGH diberikan tiga hari sekali selama empat minggu pemberian, dengan dosis sesuai perlakuan. Aerasi diberikan pada setiap akuarium untuk menjaga suplai oksigen tetap terjamin dan sesuai kebutuhan ikan. Untuk menjaga kelayakan media budidaya, dilakukan penyifonan wadah setiap hari dan dua hari sekali air diganti 100 %.
Rancangan Percobaan
Desain percobaan yang digunakan adalah rancangan acak lengkap dengan mengaplikasikan tiga perlakuan dan dua kontol, setiap perlakuan diulang tiga kali.
Perlakuan yang diterapkan adalah:
A = Pemberian pakan mengandung rElGH 3 mg/kg pakan B = Pemberian pakan mengandung rElGH 0.3 mg/kg pakan C = Pemberian pakan mengandung rElGH 0.03 mg/kg pakan K1 = Pemberian pakan tanpa mengandung rElGH + kuning telur K2 = Pemberian pakan tanpa mengandung rElGH
Efektivitas pemberian dosis rElGH ditentukan berdasarkan pertambahan bobot rata-rata (B), laju pertumbuhan harian (LPH), kelangsungan hidup (TKH) dan konversi pakan (KP). Bobot dan panjang tubuh semua ikan diukur setiap dua minggu. TKH dihitung pada akhir pemeliharaan.
Perhitungan dan analisis data
LPH dan KP dihitung mengikuti formula NRC (1977). LPH = (ln Wt - ln Wo) /t x 100 %. B= Wt-Wo. KP = F/(Wt+D)-Wo. Wt, Wo, F, D, dan t, masing masing adalah bobot akhir (g), Bobot awal (g), jumlah konsumsi pakan, bobot ikan mati (g), dan t waktu (hari). Semua data disajikan berdasarkan rata-rata±standar deviasi (SD) dan dianalisis menggunakan one-way ANOVA, diikuti dengan uji Fisher menggunakan Minitab 16. Perbedaan dianggap nyata bila p<0.05.
HASIL DAN PEMBAHASAN
11
pertumbuhan sebesar 24.07–31.68 % dibanding kontrol (tanpa pemberian rElGH dan tanpa kuning telur).
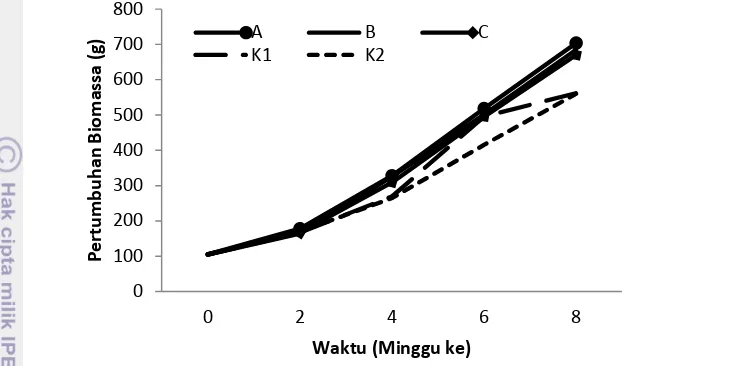
[image:32.595.113.490.133.316.2]Keterangan : A, B, C adalah perlakuan pemberian rElGH masing-masing 3.00 mg/kg, 0.30 mg/kg, dan 0.03 mg/kg pakan. K1: pakan komersial ditambah dengan kuning telur. K2: pakan komersial tidak ditambah dengan kuning telur.
Gambar 2 Biomassa ikan nila merah (Oreochromis niloticus) yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dan kontrol (tanpa diberi rElGH).
Hasil percobaan menunjukkan bahwa biomassa akhir, LPH, dan KP semua perlakuan pemberian rElGH lebih tinggi (p<0.05) dibandingkan kontrol 1 dan 2, sedangkan TKH tidak berbeda nyata (p>0.05) (Tabel 2). Selanjutnya, biomassa, LPH, dan KP antar perlakuan rElGH tidak berbeda (p>0.05).
Tabel 2 Biomassa, Pertambahan bobot (B) laju pertumbuhan harian (LPH), konversi pakan (KP), dan tingkat kelangsungan hidup (TKH) strain ikan nila merah yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH)
Parameter Perlakuan Kontrol
3.00 mg/kg 0.30 mg/kg 0.03 mg/kg K1 K 2 Biomassa awal (g) 104.85±1.34a 104.72±0.99a 105.72±1.01a 105.08±1.54a 105.15±0.92a Biomassa akhir(g) 703.60±21.80a 685.20±41.35a 669.91±19.15a 562.24±60.67b 559.89±60.56b B(g) 598.75±21.69a 580.48±42.01a 564.17±18.12a 457.16±60.67b 454.70±60.25b LPH (%) 3.46±0.06a 3.41±0.13a 3.35±0.04a 3.03±0.21b 3.02±0.20b
KP 1.07±0.04a 1.14±0.06a 1.14±0.03a 1.36±0.17b 1.38±0.19b TKH (%) 93.33±2.31a 93.33±2.31a 90.67±2.31a 93.33±2.31a 93.33±2.31a B : K1 (%) 30.97 26.97 23.40 0 -0.53
B : K2 (%) 31.68 27.66 24.07 0.54 0
Ikan dipelihara dalam 200 L akuarium selama delapan minggu. Kontrol 1: pakan komersial ditambah dengan kuning telur. Kontrol 2: pakan komersial tidak ditambah dengan kuning telur. ∆B = pertambahan bobot biomassa, ∆B:K (%) = persentase pertambahan bobot relatif terhadap kontrol. Huruf superskrip berbeda pada baris yang sama menunjukkan berbeda nyata (p<0.05)
GH berperan dalam meregulasi pertumbuhan baik secara langsung maupun tidak langsung. Mekanisme secara langsung adalah GH akan langsung mempengaruhi pertumbuhan organ tanpa perantara insulin growth factor-1
(IGF-0 100 200 300 400 500 600 700 800
0 2 4 6 8
P e rt u m b u h a n B io m a ss a ( g )
Waktu (Minggu ke)
A B C
1) di dalam hati. Mekanisme tidak langsung adalah mekanisme GH dalam mempengaruhi pertumbuhan yang dimediasi oleh IGF-1 dalam hati ikan. Ada beberapa faktor lain yang berperan dalam mekanisme ini, yaitu: reseptor GH (GHr), GH binding proteins (GHBPs), IGF binding proteins (IGFBPs), dan
reseptorIGF. GHr berfungsi dalam menangkap sinyal GH yang disekresikan oleh pituitari, GHBPs berfungsi dalam melindungi dan pengangkutan GH dari pituitari di dalam darah. IGFBPs berfungsi dalam melindungi dan mengangkut IGF-1 di dalam darah menuju ke organ target. Reseptor IGF-1 berfungsi untuk menangkap sinyal IGF-1 dalam organ-organ yang menjadi target (Wonget al. 2006; Debnanth 2010). Perbedaan respons pertumbuhan antara ikan yang diberi rElGH dengan kontol terlihat mulai minggu kedua hingga minggu kedelapan pemeliharaan. Pada dosis 0.03, 0.30, dan 3.00 mg/kg pakan dapat meningkatkan pertumbuhan masing-masing sebesar 24.07 %, 27.66%, dan 31.67 % dibanding dengan ikan kontrol (tanpa ditambah kuning telur). Peningkatan pertumbuhan juga diikuti oleh peningkatan nilai konversi pakan ikan dengan peningkatan masing-masing 21.05 %, 21.05 %, dan 28.97 %.
Hasil percobaan ini mengindikasikan bahwa pemberian rElGH secara oral pada dosis 0.03 sampai 3.00 mg/kg pakan memberikan respons pertumbuhan yang sama (p>0.05) dan dapat meningkatkan pertumbuhan sebesar 24.07 sampai 31.68 %. Berdasarkan nilai konversi pakan, pemberian rElGH 3.00 mg/kg pakan dapat menghemat jumlah pakan sebanyak 28.97 %, sementara dosis 0.03 dan 0.3 mg/kg hanya menghemat 21.05%. Berdasarkan analisis ekonomi (Lampiran 5) diketahui bahwa rElGH pada dosis 3.00 mg/kg pakan merupakan dosis yang efisien. Biaya untuk pakan dapat mencapai lebih dari 50% biaya produksi perikanan budidaya. Dengan demikian, perbaikan KP tersebut sangat berpotensi menurunkan biaya produksi. Selanjutnya, peningkatan pertumbuhan akan mempercepat pencapaian ukuran panen, sehingga jumlah siklus produksi per satuan waktu menjadi meningkat. Oleh karena itu, peningkatan pertumbuhan dan perbaikan KP secara bersama-sama dapat meningkatkan pendapatan pembudidaya.
Bila mengacu pada Hardiantho et al. (2012) yang melaporkan pemberian rGH ikan mas pada ikan nila maka percobaan ini menunjukkan bahwa pemberian rGH ikan kerapu kertang lebih efektif dan efisien dapat diturunkan 10 dan 100 kali lebih rendah dibanding dengan rGH ikan mas. Hal ini sejalan dengan penelitian yang dilaporkan Alimuddinet al. (2010) yang menyatakan bahwa rGH yang berasal dari ikan kerapu kertang lebih baik dibandingkan dengan rGH ikan gurami dan ikan mas.
Ketiga level dosis rElGH yaitu 0.03, 0.30, dan 3.00 mg/kg pakan dapat digunakan untuk meningkatkan pertumbuhan ikan nila. Dari tiga level dosis rElGH tersebut dapat dikemukakan bahwa pemberian rElGH untuk memacu pertumbuhan ikan nila pada dosis 3.00 mg/kg pakan menunjukkan efisiensi yang terbaik.
KESIMPULAN
13
RESPONS PERTUMBUHAN EMPAT STRAIN IKAN NILA
YANG DIBERI PAKAN MENGANDUNG HORMON
PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG
ABSTRAK
Penelitian ini bertujuan untuk menguji respons pertumbuhan empat strain ikan nila (Oreochromis niloticus) yang dibudidayakan di Indonesia yaitu SULTANA (seleksi unggul Selabintana), NIRWANA (nila ras Wanayasa), SRIKANDI (salinity resistant improvement from Sukamandi), dan ikan nila merah yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (Epinephelus lanceolatus) (rElGH). Ikan dipelihara dalam hapa (2x1x1m3) yang dipasang pada kolam beton (20x10x1.5 m3). Dengan menggunakan 3 mg rElGH/kg pakan, hasil penelitian menunjukkan bahwa pertambahan bobot (B) ikan nila SULTANA tertinggi (p<0.05) dibanding ikan strain lainnya. Laju pertumbuhan harian tertinggi (p<0.05) diperoleh pada ikan nila strain SULTANA, diikuti NIRWANA (3.41%). SRIKANDI (3.36 %), dan nila merah (3.14%). Konversi pakan terbaik (p<0.05) diperoleh pada ikan nila strain SULTANA (0.84), diikuti NIRWANA (0.99), SRIKANDI (1.02), and nila merah (1.22). Tingkat kelangsungan hidup keempat strain ikan nila adalah sama berkisar dari 84.67 hingga 90.00 % (p>0.05). Glikogen hati dan otot, retensi protein dan lemak, dan rasio RNA:DNA tertinggi (p<0.05) pada ikan nila strain SULTANA, diikuti NIRWANA, SRIKANDI, dan nila merah. Sebagai kesimpulan, ikan nila strain SULTANA menunjukkan respons pertumbuhan yang tertinggi terhadap pemberian rElGH secara oral, dan budidaya dengan strain ini dapat membantu meningkatkan produksi akuakultur.
Growth Response of Four Nile Tilapia Strains Fed on Diet
Containing a Recombinant Teleostean Growth Hormone
ABSTRACT
Various Nile tilapia strains are cultured in Indonesia. This study was conducted to examine the growth response of four Nile tilapia (Oreochromis niloticus) strains, namely SULTANA (superior selected tilapia strain from Selabintana), NIRWANA (tilapia strain from Wanayasa), SRIKANDI (salinity resistant improvement from Sukamandi), and red tilapia fed on diet containing recombinant Epinephelus lanceolatus growth hormone (rElGH). The study was performed in the hapa (2x1x1m3) settled in a concrete pond (20x10x1.5 m3). By using 3 mg rElGH/kg diet, the results of the study showed that SULTANA strain weight gain (W) was the highest (p<0.05) compared with the other strains. The highest (p<0.05) spesific growth rate (SGR) was obtained in SULTANA (3.73%), followed by NIRWANA (3.41%). SRIKANDI (3.36 %), and red tilapia (3.14%) strain. Lowest feed conversion ratio (FCR) (p<0.05) was found in SULTANA (0.84), followed by NIRWANA (0.99), SRIKANDI (1.02), and red tilapia (1.22) strains. Survival of the four strains were similar, ranging from 84.67 to 90.00 % (p>0.05). The highest (p<0.05) liver and muscle glycogen, protein and fat retention, and RNA/DNA ratio were found in SULTANA, followed by NIRWANA, SRIKANDI, and red tilapia. As conclusion, SULTANA Nile tilapia strain showed high growth response on rElGH oral administration, and farming of this strain can be helpful to increase aquaculture production level.
15
PENDAHULUAN
Level GH alami relatif rendah dan metode isolasinya relatif rumit sehingga tidak ekonomis dan tidak praktis, maka digunakan teknologi DNA rekombinan untuk memproduksi GH rekombinan (Sekine et al. 1985). Hormon pertumbuhan rekombinan (rGH) dari berbagai spesies vertebrata, termasuk ikan telah dapat diproduksi dalam jumlah banyak menggunakan bioreaktor berupa bakteri
Escherichia coli (Promdonkoy et al. 2004, Sørensen & Kim 2005, Alimuddinet al. 2010), dan ragi Pichia pastoris (Acosta et al. 2007, Weidner et al. 2010). Bioaktivitas rGH dalam memacu pertumbuhan telah diuji pada ikan, udang dan kekerangan (Moriyama & Kawauchi 2001, Acosta et al. 2007, Alimuddin et al. 2010, Santiesteban et al. 2010). Selanjutnya, metode pemberian rGH juga telah dikembangkan pada ikan nila (Liet al. 2003; Acostaet al. 2007; Alimuddinet al. 2010; Hardiantho et al. 2012; Latar 2013), salmonids (Sekine et al. 1985),
rainbow trout (Moriyama et al. 1993), black seabream (Tsai et al. 1997), ikan koki (Promdonkoy et al. 2004), ikan baronang (Funkenstein et al. 2005), ikan
flounder Jepang (Liu et al. 2008), ikan sidat (Handoyo 2012), ikan gurami (Irmawati et al. 2012; Safir 2012), dan udang putih Litopenaeus vannamei
(Subaidahet al.2012).
Tingkat perbaikan pertumbuhan akibat pemberian rGH dapat dipengaruhi oleh jenis rGH (Alimuddin et al. 2010; Irmawati 2013), jenis dan umur ikan target (species-specific dan age dependent) (Hertzet al. 1991), dosis (Hardiantho
et al. 2012: Irmawati et al. 2012; Safir 2012), dan metode pemberian melalui injeksi, imersi, oral, atau kombinasi imersi dan oral (Handoyo 2012). Tiga jenis rGH telah dibuat di Indonesia, yakni rGH ikan mas (rCcGH), ikan gurami (rOgGH) dan ikan kerapu kertang (rElGH) (Alimuddin et al. 2010). Selain itu, pemberian rGH tersebut dalam bentuk protein total menunjukkan bahwa peningkatan bobot ikan nila yang dinjeksi dengan rElGH (20,94%) lebih tinggi daripada yang diinjeksi dengan rCcGH (18.09%), dan rOgGH (16.99%) (Alimuddin et al. 2010). Selanjutnya, pemberian rCcGH pada benih ikan nila dengan dosis 30 mg/kg pakan dengan frekuensi pemberian dua kali seminggu selama tiga minggu meningkatkan bobot tubuh sebesar 35% dari kontrol (Hardianthoet al. 2012).
Respons pertumbuhan ikan nila berbeda strain terhadap pemberian rGH belum diketahui. Tujuan penelitian ini adalah mengevaluasi respons pertumbuhan empat strain ikan nila (SULTANA, NIRWANA, SRIKANDI, dan Merah) pada pemberian rElGH secara oral.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2013 hingga April 2013. Penyiapan dan pembuatan pakan mengandung rElGH dilakukan di Laboratrium Reproduksi & Genetika Organisme Akuatik Departemen Budidaya perairan, dan pemeliharaan ikan dilakukan di Kolam Percobaan FPIK IPB. Analisis proksimat pakan dan ikan, glikogen hati dan otot dilakukan di Laboratrium Nutrisi Ikan Departemen Budidaya perairan FPIK IPB.
Produksi rElGH dan Penyiapan Pakan
Bakteri Escherichia coli strain BL21 yang mengandung vektor ekspresi protein pCold-ElGH digunakan sebagai bioreaktor untuk memproduksi rElGH. Kultur bakteri, ekstraksi dan verifikasi protein rElGH mengikuti prosedur yang digunakan oleh Alimuddin et al. (2010). Pembuatan pakan mengandung rElGH dilakukan dengan cara mencampurkan rElGH ke dalam pakan komersial (kadar protein 32%) dengan dosis 3 mg/kg pakan (Tabel 3). Pencampuran pakan dilakukan berdasarkan metode Hardiantho et al. (2012), yaitu rElGH dilarutkan dalam 15 mLphosphate buffer saline(PBS) dicampur dengan 2 mg kuning telur, lalu dihomogenkan dengan menggunakan vorteks. Campuran tersebut disemprotkan secara merata pada 100 g pakan buatan. Selanjutnya pakan dikering-udarakan sebelum diberikan ke ikan.
Tabel 3 Proksimat pakan yang mengandung hormon pertumbuhan ikan kerapu kertang (rElGH) dan pakan harian
Komposisi Nutrisi Pakan diperkaya rElGH (3mg/kg)*
Pakan Harian
Protein (%) 31.62 32.35
Lemak (%) 3.97 3.40
Serat Kasar (%) 1.2 1.70
Karbohidrat (%) 41.07 44.63
Kadar Abu (%) 8.32 8.78
Kadar Air (%) 13.82 9.14
GE (kkal/kg pakan)** 3760.58 3892.93
Rasio C/P (kkal/g protein) 11.89 12.00
17
Pemeliharaan ikan
Pada percobaan ini rancangan yang digunakan RAL dengan empat perlakuan berupa ikan nila berbeda strain, yaitu (A) SULTANA, (B) NIRWANA (C) SRIKANDI, dan (D) nila Merah. Strain SULTANA berasal dari Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi, strain NIRWANA diperoleh dari Balai Pengembangan Benih Ikan Air Tawar (BPBIAT) Wanayasa Purwakarta, strain SRIKANDI dari Balai Penelitian Pemuliaan Ikan (BPPI) Sukamandi Subang. Setiap perlakuan diulang tiga kali. Dosis rElGH yang digunakan adalah 3 mg/kg pakan.
Benih ikan dengan bobot 5,80±0,19 g dipelihara dalam hapa (2x1x1m3) dengan kedalaman air 0,75 cm, dipasang dalam kolam beton (20x10x1,5 m3) dengan kepadatan 50 ekor/hapa. Suhu air selama penelitian berkisar 24 - 31 ˚C, pH 6.0 - 6.5, oksigen terlarut (DO) 6-7 mg/L. Adaptasi terhadap pakan buatan dilakukan selama satu minggu sebelum pemberian pakan mengandung rElGH. Pakan diberikan dengan frekuensi tiga kali sehari (07.30-08.30, 12.00-13.00, dan 16.30-17.30 WIB) secara at satiation (sampai kenyang). Pakan mengandung rElGH diberikan tiga hari sekali selama empat minggu pemberian, dengan dosis sesuai perlakuan. Ikan dipelihara selama sepuluh minggu.
Parameter uji
Efektivitas pemberian rElGH ditentukan berdasarkan rata-rata pertambahan bobot (B), laju pertumbuhan harian (LPH), konversi pakan (KP), dan tingkat kelangsungan hidup (TKH). Bobot tubuh semua ikan diukur setiap dua minggu. Analisis TKH, retensi protein, retensi lemak, glikogen hati, glikogen otot, dan rasio RNA:DNA dilakukan pada akhir percobaan.
Pada akhir percobaan, sebanyak tiga ekor ikan diambil secara acak dari setiap perlakuan pada setiap ulangan untuk dianalisis proksimat menggunakan prosedur AOAC (2000), kadar glikogen hati dan otot mengacu pada metode Wedemeyer & Yasutake (1977). Konsentrasi RNA dan DNA diukur menggunakan gene quant calculator. RNA total dan DNA diekstraksi dari organ hati dari tiga ekor ikan diambil secara acak dari tiap perlakuan. RNA total dan DNA masing-masing diekstraksi menggunakan isogen (Nippon Gene, Tokyo, Japan) dan kit Puregene®Core Kit A (QIAGEN Science Marylan USA) sesuai prosedur dalam manual.
Perhitungan dan analisis data
dengan uji Fisher menggunakan Minitab 16. Perbedaan dianggap nyata bila p<0,05.
HASIL DAN PEMBAHASAN
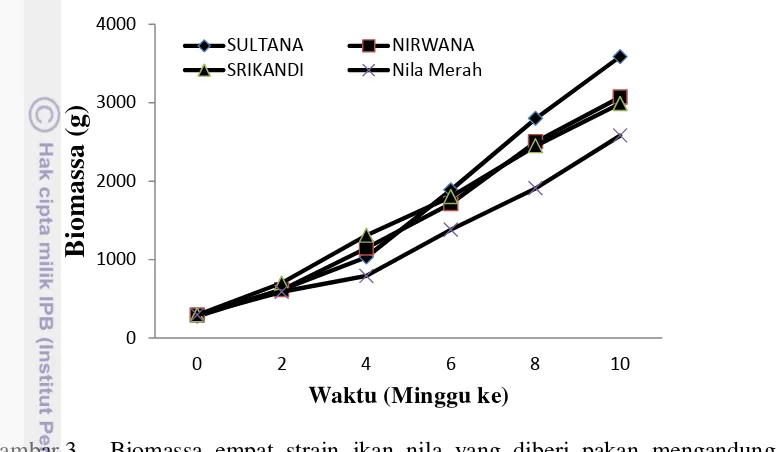
Respons pertumbuhan ikan nila berbeda strain terhadap pemberian rElGH disajikan pada Tabel 4. Pertumbuhan (B dan LPH) strain SULTANA paling tinggi (p<0.05) dibandingkan strain lainnya, peningkatan pertumbuhan ikan nila strain SULTANA 44.84% dibandingkan dengan ikan nila merah (Tabel 4). Sementara itu, kelangsungan hidup semua strain ikan nila tidak berbeda nyata (p>0.05), berkisar 88.67- 91.33%, sehingga perbedaan pertumbuhan antar strain bukan disebabkan oleh perbedaan kepadatan pemeliharaan.
Ikan dipelihara pada kolam yang sama dan penempatannya dalam hapa dilakukan secara acak. Dengan demikian, perbedaan respons pertumbuhan antar strain ikan nila terhadap pemberian rElGH diduga terkait dengan perbedaan histori, dan metode pemuliaan yang digunakan. Ikan nila strain SULTANA merupakan generasi kelima, dan NIRWANA adalah generasi keempat waktu dirilis. Kedua strain tersebut dihasilkan menggunakan seleksi family. Sementara itu, ikan nila strain SRIKANDI merupakan hasil hibrida antara ikan nila NIRWANA dan ikan nila biru, sedangkan ikan nila merah sudah relatif lama tidak dilakukan perbaikan kualitas genetik. Perbedaan respons pertumbuhan antar strain terhadap pemberian rGH juga telah dilaporkan oleh Silversteinet al. (2000) pada
catfish berbeda strain (strain Norris dan USDA-103) yang diberi hormon pertumbuhan rekombinan sapi (rbGH).
Tabel 4 Biomassa, pertambahan bobot (B), laju pertumbuhan harian (LPH), dan tingkat kelangsungan hidup (TKH) empat strain ikan nila yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH).
Parameter Strain ikan nila
SULTANA NIRWANA SRIKANDI Nila Merah
Biomassa awal (g) 276.04±5.84a 93.25±5.88a 294.29±2.21a 296.74±3.68a Biomassa akhir (g) 3584.69±32.53a 3069.86±172.50b 2987.13±180.87b 2581.06±105.48c B (g) 3308.65±32.17a 2776.61±177.57b 2692.84±182.33b 2284.32±108.10c
LPH (%) 3.73±0.03a 3.41±0.11b 3.36±0.10b 3.14±0.08c
TKH (%) 91.33±2.31a 89.33±1.16a 88.67±1.16a 88.67±2.31a
B : nila merah (%) 44.84 21.55 17.88
-Ikan dipelihara dalam hapa (2x1x1 m3) yang dipasang di kolam beton selama 10 minggu dengan kepadatan 50 ekor/hapa.B= Biomasa akhir - biomasa awal. Huruf superskrip berbeda pada baris yang sama menunjukkan berbeda nyata (p<0.05).
19
NIRWANA dan SRIKANDI adalah sama, tetapi lebih tinggi daripada ikan nila merah (Tabel 5).
Nilai retensi protein dan lemak tinggi mencerminkan bahwa protein dan lemak tidak banyak dirombak untuk menghasilkan energi, dan biokonversi karbohidrat terjadi. Walsh (2003) melaporkan bahwa efek biologi utama yang dimediasi GH adalah pertumbuhan, terutama pertumbuhan tubuh dan tulang, menstimulasi sintesis protein di beberapa jaringan, memobilisasi lipid dari jaringan adipose melalui glikogenesis, dan meningkatkan deposit glikogen di hati. Selain itu, Rasmussenet al. (2001) dan Vijayakumar et al. (2010) menambahkan bahwa salah satu efek biologi GH adalah mengurangi kebutuhan asam amino dengan menekan proses proteolisis.
Laju pertumbuhan dapat diprediksi dari nilai rasio RNA:DNA (Glémet & Rodriguez 2007). Pada percobaan ini ikan nila strain SULTANA memiliki pertumbuhan dan nilai rasio RNA:DNA lebih tinggi daripada ketiga strain lainnya. Namun demikian, RNA total tidak menunjukkan secara spesifik gen yang diinduksi oleh pemberian rGH dan kaitannya dengan strain. Dengan menggunakan metode semi-kuantitatif, ekspresi gen insulin-like growth factor-1 (IGF-1) meningkat dengan adanya pemberian rGH pada benih ikan nila (Hardiantho et al. 2012). Dengan fakta tersebut diduga bahwa ikan nila strain SULTANA memiliki ekspresi IGF-1 lebih tinggi daripada strain lainya. Penelitian lebih lanjut diperlukan untuk mendapatkan informasi lebih jelas faktor endogen yang membedakan respons antar strain ikan nila terhadap pemberian rElGH.
Tabel 5 Konversi pakan, glikogen hati, glikogen otot, retensi protein, retensi lemak, dan rasio RNA:DNA empat strain ikan nila yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH).
Parameter Strain ikan nila
SULTANA NIRWANA SRIKANDI Nila Merah
Konversi pakan 0.84±0.02c 0.99±0.07c 1.02±0.07b 1.22±0.06a
Glikogen hati (mg/g) 4.90±0.02a 3.40±0.01b 2.60±0.06bc 1.70±0.03c Glikogen otot (mg/g) 41.00±0.70a 36.50±1.40b 25.10±6.50bc 23.50±5.00c Retensi protein (%) 59.56±1.35a 53.72±0.51b 49.78±0.86b 43.94±3.02c Retensi lemak (%) 206.52±14.48a 157.63±6.77bc 168.11±0.87b 138.33±8.86c
Rasio RNA:DNA 0.57±0.01a 0.47±0.01b 0.47±0.00b 0.24±0.00c
Ikan dipelihara dalam hapa (2x1x1 m3) yang dipasang di kolam beton selama 10 minggu dengan kepadatan 50 ekor/hapa. Analisis dilakukan pada akhir percobaan. Huruf superskrip berbeda pada baris yang sama menunjukkan berbeda nyata (p<0.05).
baik daripada pemberian satu kali (perendaman atau oral saja). Oleh karena itu, pemberian rElGH yang kedua pada stain ikan nila diduga dapat lebih memacu pertumbuhan dan produksi menjadi lebih tinggi.
Gambar 3 Biomassa empat strain ikan nila yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang
KESIMPULAN
Ikan nila strain SULTANA, NIRWANA, SRIKANDI, dan nila Merah memberikan respons pertumbuhan berbeda terhadap pemberian hormon pertumbuhan rekombinan ikan kerapu kertang yang diaplikasikan secara oral, dan strain SULTANA memberikan respons pertumbuhan terbaik dengan selisih pertambahan bobot 44.84% dibandingkan dengan ikan nila merah.
0 1000 2000 3000 4000
0 2 4 6 8 10
Bi
o
m
a
ss
a
(g
)
Waktu (Minggu ke)
SULTANA NIRWANA
21
RESPONS PERTUMBUHAN DAN PEMANFAATAN PAKAN PADA IKAN NILA UKURAN BERBEDA YANG DIBERI PAKAN MENGANDUNG
HORMON PERTUMBUHAN REKOMBINAN
ABSTRAK
Penelitian ini bertujuan untuk menguji respons pertumbuhan dan pemanfaatan pakan pada ikan nila (Oreochromis niloticus) strain SULTANA ukuran berbeda yang diberi pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (Epinephelus lanceolatus) (rElGH). Ukuran awal ikan yang digunakan adalah 3.5±0.25 g (perlakuan A); 12.5±0.4 g (perlakuan B) dan 40.0±2.35 g (perlakuan C). Setiap perlakuan diberi pakan mengandung 3 mg rElGH /kg dan tidak diberi rElGH (kontrol), masing-masing perlakuan diulang 3 kali. Penelitian ini dilakukan dengan menggunakan hapa 2x1x1 m3yang dipasang di kolam beton (20x10x1.5 m3), dengan padat tebar 50 ekor/hapa, selama delapan minggu pemeliharaan. Hasil penelitian menunjukkan bahwa rata-rata pertambahan biomassa ikan yang diberi rElGH adalah lebih tinggi (p<0.05) dibandingkan dengan yang tidak diberi rElGH, sedangkan perlakuan ukuran ikan tidak berpengaruh nyata (p>0.05). Laju pertumbuhan harian (LPH) ikan yang diberi rElGH lebih tinggi (p<0.05) dibandingkan dengan tanpa pemberian rElGH, dan LPH ikan perlakuan A lebih tinggi dibandingkan dengan perlakuan B dan C. Kelangsungan hidup ikan perlakuan dan kontrol adalah sama (p>0.05), berkisar 90.67-96.67%. Konversi pakan pada ikan yang diberi rElGH lebih rendah (p<0.05) dibandingkan dengan tanpa rElGH, kecuali perlakuan C. Kadar glikogen hati dan otot, retensi protein dan lemak, indeks hepatosomatik, dan rasio RNA:DNA ikan yang diberi rElGH lebih tinggi daripada tanpa pemberian rElGH. Dengan demikian, pemberian rElGH meningkatkan pertumbuhan dan pemanfaatan pakan untuk pertumbuhan ikan nila, dan hal ini berpotensi tinggi diterapkan untuk meningkatkan produksi dan efisiensi budidaya ikan nila.
GROWTH RESPONSE AND FEED UTILIZATION AT DIFFERENT SIZE OF NILE TILAPIA ON FEEDING RECOMBINANT GROWTH
HORMONE-SUPPLEMENTED DIET
ABSTRACT
This study was conducted to examine the growth response and feed utilization at different size of Nile tilapia (Oreochromis niloticus) SULTANA strain on feeding recombinant Epinephelus lanceolatusgrowth hormone (rElGH) supplemented diet. Tilapia SULTANA strain with initial body weight of 3.5±0.25 g (treatment A), 12.5±0.4 g (treatment B) and 40.0±2.35 g (treatment C) were reared in the happa (2x1x1m3) settled in a concrete pond (20x10x1.5 m3) at density of 50 fish, for eight weeks. Each treatment was fed 3 mg/kg rEl GH-enriched diet, and without rElGH supplementation as control, with 3 replications. The results showed that weight gain of rElGH-treated fish were significantly higher p<0.05) compared with control, whereas effect of different fish size was similar (p>0.05). Specific growth rate (SGR) of rElGH-treated fish was higher than control, and SGR of treatment A was higher than treatments B and C. Survival of fish was similar (p>0.05), ranged at 90.7-96.7%. FCR of rEl GH-treated fish were lower than control, except for treatment C. Liver and muscle glycogen content, protein and lipid retention, hepatosomatic index and RNA:DNA ratio in rElGH-treated fish were higher than control. As conclusion, feeding with diet containing rElGH increased growth and feed utilization of Nile tilapia, and this has high potential to be applied to improve production and farming efficiency.
23
PENDAHULUAN
Produksi hormon pertumbuhan rekombinan (rGH) ikan telah dapat dilakukan dalam jumlah banyak menggunakan fermentor, seperti bakteri
Escherichia coli (Promdonkoy et al. 2004; Sørensen & Kim 2005; Demain & Vaishnap 2009; Alimuddin et al. 2010) dan ragi Pichia pastoris (Acosta et al. 2007; Weidner et al. 2010). Selanjutnya, metode pemberian rGH juga telah dikembangkan, dan telah terbukti dapat meningkatkan pertumbuhan berbagai spesies ikan, di antaranya ikan nila (Li et al. 2003; Acostaet al. 2007; Alimuddin
et al. 2010; Hardianthoet al. 2012; Latar 2013), ikan salmon (Sekineet al. 1985), ikan rainbow trout (Moriyama et al. 1993), ikan black seabream (Tsai et al.
1997), ikan koki (Promdonkoy et al. 2004), ikan baronang (Funkenstein et al. 2005), ikan flounder(Liuet al. 2008), ikan sidat (Handoyoet al. 2012), dan ikan gurami (Irmawatiet al. 2012).
Produksi benih ikan nila di Indonesia umumnya dilakukan melalui pemijahan massal di kolam. Benih yang sudah lepas dari mulut induknya (umur 4-5 hari) dipanen setiap hari, dan kemudian didederkan di kolam yang telah ditumbuhkan pakan alami. Benih ikan nila yang sudah dilepas dari mulut induknya bisa diberikan rGH melalui metode perendaman. Seperti yang dilakukan Acostaet al.(2007), rGH ikan nila diberikan pada benih ikan nila umur lima hari setelah menetas dengan cara perendaman selama 90 menit, dilakukan tiga kali/minggu selama enam minggu dengan dosis 0.1 mg/L air, mampu meningkatkan pertumbuhan 171% dibandingkan dengan kontrol tanpa rGH setelah enam minggu. Selain itu, pengujian pemberian rGH ikan mas melalui pakan pada benih ikan nila SULTANA ukuran panjang tubuh sekitar 2 cm (bobot tubuh sekitar 0.7 g), dan diperoleh peningkatan pertumbuhan sekitar 35% dibandingkan dengan kontrol tanpa diberi rGH. Pada minggu ketiga pemeliharaan bobot benih mencapai sekitar 2.23 g, tetapi pertumbuhannya terlihat mulai melambat (Hardiantho et al. 2012). Pemberian rGH berulang diduga dapat memacu pertumbuhannya kembali. Selain itu, respons pertumbuhan ikan nila SULTANA, NIRWANA, SRIKANDI, dan ikan nila merah terhadap pemberian rGH ikan kerapu kertang (rElGH) telah diuji, dan diketahui bahwa peningkatan pertumbuhan ikan nila SULTANA lebih tinggi daripada ketiga varietas lainnya (Muhammad et al. 2013). Penelitian ini bertujuan untuk mengevaluasi respons pertumbuhan dan pemanfaatan pakan pada ikan nila strain SULTANA ukuran berbeda yang diberi pakan mengandung rElGH.
METODE PENELITIAN
Produksi rElGH dan penyiapan pakan
dalam 15 mLphosphate buffer saline(PBS) dicampur dengan 2 mg kuning telur, lalu dihomogenkan dengan menggunakan vortek