EFIKASI VAKSINASI INDUK DAN BENIH IKAN NILA
DENGAN METODE INFILTRASI HIPEROSMOTIK UNTUK
MENCEGAH INFEKSI
Streptococcus agalactiae
AMALIA PUTRI FIRDAUSI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Efikasi Vaksinasi Induk dan Benih Ikan Nila dengan Metode Infiltrasi Hiperosmotik untuk Mencegah Infeksi Streptococcus agalactiae adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
AMALIA PUTRI FIRDAUSI. Efikasi Vaksinasi Induk dan Benih Ikan Nila dengan Metode Infiltrasi Hiperosmotik untuk Mencegah Infeksi Streptococcus agalactiae. Dibimbing oleh SUKENDA dan SRI NURYATI.
Streptococcosis merupakan salah satu penyakit bakterial yang menyerang berbagai strain ikan nila, penyakit ini seringkali disebabkan oleh bakteri Streptococcus agalactiae dan Streptococcus iniae. Akhir-akhir ini S. agalactiae lebih sering ditemukan dengan virulensi lebih tinggi dibandingkan S. iniae. Pengendalian penyakit streptococcosis sampai saat ini masih terus diupayakan. Salah satu upaya yang efektif untuk pencegahan penyakit tersebut adalah dengan vaksinasi induk yang dapat menyebabkan adanya transfer imunitas maternal. Transfer imunitas maternal merupakan upaya vaksinasi yang lebih menguntungkan karena dapat melindungi induk sekaligus benih yang dihasilkan terhadap agen patogen.
Kekebalan induk yang diturunkan kepada anaknya akan meluruh dengan cepat seiring dengan pertambahan umur larva ikan dan perkembangan sistem imun. Vaksinasi benih setelah antibodinya menurun dengan metode dan waktu yang tepat diperlukan untuk meningkatkan ketahanan benih ikan terhadap serangan S. agalactiae. Suatu penelitian peningkatan efikasi vaksinasi pada benih dari induk yang divaksin dengan metode perendaman pada salinitas yang berbeda akan memberikan metode vaksinasi dan konsentrasi garam yang diberikan sebelum vaksinasi secara tepat. Oleh karena itu, penelitian ini bertujuan untuk mendapatkan perlakuan perendaman salinitas terbaik tehadap vaksinasi untuk mencegah infeksi bakteri S. agalactiae pada benih ikan nila Oreochromis niloticus terhadap kinerja sistem imun.
Penelitian dibagi menjadi dua tahapan. Tahap pertama dilakukan pengujian efikasi vaksinasi pada induk yang menyebabkan transfer antibodi ke anaknya. Induk yang digunakan memiliki berat rata-rata 250±0.03 g dipelihara di bak beton berukuran 3x2x0.6 m. Penelitian ini menggunakan rancangan acak lengkap yang terdiri dari dua perlakuan dan tiga ulangan. Sebanyak tiga induk nila betina divaksinasi dengan cara penyuntikan secara intraperitoneal dengan dosis 0.4 mL/kg ikan dan kontrolnya disuntik dengan phospate buffer saline (PBS). Pemeliharaan induk pascavaksinasi dilakukan selama empat minggu, kemudian dilakukan pemijahan. Kinerja sistem imun yang diamati meliputi relative percent survival (RPS), level antibodi spesifik, dan lisozim. Hasil penelitian menunjukkan bahwa vaksinasi induk dapat memberikan level antibodi, aktivitas lisozim yang signifikan (P<0.05) pada benih dibandingkan dengan perlakuan kontrol dengan rataan RPS berturut-turut mencapai 83.20% dan 65.80% pada hari ke-10 dan 20 pascamenetas.
tawar pada hari ke-10, 20, dan 30 pascavaksinasi kinerja sistem imun yang diamati meliputi relative percent survival (RPS), level antibodi spesifik, dan lisozim. Penelitian dilakukan menggunakan rancangan acak lengkap (RAL) dan tiga ulangan. Hasil penelitian menunjukkan bahwa perlakuan salinitas 10 ppt memberikan hasil terbaik dengan nilai RPS akhir, level antibodi spesifik, dan lisozim secara berturut-turut yaitu 84.72%; 66.49%; dan 47.06% pada hari ke-10, 20, dan 30 pascavaksinasi; 0.077; dan 0.0317. Level antibodi spesifik dan nilai RPS berbeda nyata (P<0.05) dibandingkan perlakuan yang lain, sedangkan aktivitas lisozim perlakuan 10 ppt tidak berbeda nyata terhadap perlakuan 20 ppt (P>0.05).
Kesimpulan dari penelitian ini yaitu, pemberian vaksin pada induk ikan nila dapat menyebabkan transfer kekebalan maternal ke benih. Vaksinasi yang diberikan memberikan tingkat proteksi yang tinggi dengan nilai tingkat kelangsungan hidup relatif rataan mencapai 83.20% dan 65.80% pada hari ke-10 dan 20 pascamenetas. Vaksinasi pada benih dari induk yang divaksin secara infiltrasi hiperosmotik salinitas 10 ppt dapat memperbaiki kinerja sistem imun benih dengan memperbaiki proteksi imunitas maternal melawan infeksi S. agalactiae.
SUMMARY
AMALIA PUTRI FIRDAUSI. Efficacy of Hyperosmotic Vaccination on Tilapia Broodstock and Offspring Against Streptococcus agalactiae Infection. Supervised by SUKENDA and SRI NURYATI.
Streptococcosis is a bacterial disease that attacks the various strains of tilapia, the disease is often caused by Streptococcus agalactiae and Streptococcus iniae. But lately S. agalactiae is more prevalent with higher virulence than S. iniae. Streptococcosis control is still continued effort. One of the effective measures for prevention of the disease is by vaccination broodstock that cause maternal immunity transfer. The transfer of maternal immunity is more profitable because it can protect the broodstock and offspring at the same time against the pathogenic agents.
Broodstock derived immunity to the offspring that will decay rapidly with increasing age of fish larvae and the development of the immune system. Offspring immune reinforcement by vaccination at the right method and timing needed to increase the resilience of offspring against S. agalactiae. A study to increase the efficacy of vaccination on the offspring from broodstock vaccinated by immersion method at different salinity will provide a method of vaccination and the concentration of salt that given before vaccination appropriately. Therefore, this study aimed to get the best salinity treatments in hyperosmotic vaccination method against S. agalactiae infection in tilapia..
Briefly, the research was divided into two steps. First step was to evaluating the efficacy of vaccination in the parental antibody which led to immunity transfer. Broodstocks with average body weight of 250±0.03 g reared in 3x2x0.6 m concrete tank and performed in complete randomized design which consist two treatments and three replications. A total of three female broodstock vaccinated by means of intraperitoneal injection at a dose of 0.4 mL/kg fish and controls injected with phosphate buffer saline (PBS). Rearing of the parent carried out for four weeks post-vaccination, and then spawning done. The performance of the immune response were observed, such as final relative percent survival (RPS), the level of specific antibodies, and lysozyme activity. The results showed that there were significancy in level of parental antibodies, and also offspring lysozyme activity (P<0.05) compared to control treatment where the average RPS reached 83.20% and 65.80% at 10 and 20 day post hatching.
have significant difference (P<0.05) compared others treatment while lisozyme activity have no significant difference against 20 ppt treatment.
Overall, broodstock vaccination provides a high level of protection, with RPS value of fry reached 83.20% and 65.80% at day 10 and 20 post hatching. The highest antibody titers pointed at the age of 10 days and then slowly decreased with age seed increased. Then, it was concluded that vaccination on tilapia broodstocks lead maternal immunity transfer into the offspring and combination with subsequent hyperosmotic vaccination at salinity 10 ppt improves immune response of fries by strengthen maternal immunity protection against streptococcosis.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akualkultur
EFIKASI VAKSINASI INDUK DAN BENIH IKAN NILA
DENGAN METODE INFILTRASI HIPEROSMOTIK UNTUK
MENCEGAH INFEKSI
Streptococcus agalactiae
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2015 ini ialah vaksinasi, dengan judul Efikasi Vaksinasi Induk dan Benih Ikan Nila dengan Metode Infiltrasi Hiperosmotik untuk Mencegah Infeksi Streptococcus agalactiae. Terima kasih penulis ucapkan kepada Bapak Dr Sukenda dan Ibu Dr Sri Nuryati selaku pembimbing, Ibu Dr Widanarni dan Ibu Dr Mia Setiawati selaku dosen penguji tamu, serta Bapak Rahman, MSi selaku suami tercinta yang telah banyak membantu dan memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Ranta, laboran Laboratorium Kesehatan Organisme Akuatik yang telah membantu selama proses penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN 1
Latar Belakang 2
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 METODE 3
Waktu dan Tempat Penelitian 3
Rancangan Percobaan 3
Prosedur Penelitian 5
Parameter Penelitian 7
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Tingkat Kematian dan Relative Percent Survival (RPS) Benih
Pascamenetas 9
Titer Antibodi Induk, Telur, dan Benih Pascamenetas 9 Aktivitas Lisozim Induk, Telur, dan Benih Pascamenetas 10
Tingkat Kematian dan Relative Percent Survival (RPS) Benih
Pascavaksinasi 10
Titer Antibodi Benih Pasca Vaksinasi 11
Aktivitas lisozim Benih Pasca Vaksinasi 12
Pembahasan 12
4 KESIMPULAN DAN SARAN 16
Kesimpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 20
DAFTAR TABEL
1 Perlakuan pengujian efikasi vaksinasi pada induk ikan nila 3 2 Perlakuan pengujian efikasi vaksinasi pada benih ikan nila hasil dari
induk yang divaksin 4
3 Kisaran kualitas air optimum pemeliharaan ikan nila 7 4 Tingkat kematian dan relative percent survival (RPS) pada benih ikan
nila pada hari ke-10 dan 20 pasca menetas 9
5 Titer antibodi pada induk, telur, serta benih umur 10 dan 20 hari pasca
menetas 9
6 Aktivitas lisozim pada induk, telur, serta benih umur 10 dan 20 hari
pasca menetas 10
7 Tingkat kematian dan relative percent survival (RPS) pada benih ikan nila pada hari ke-10, 20, dan 30 pasca vaksinasi 10
DAFTAR GAMBAR
1 Diagram alir penelitian 4
2 Titer antibodi benih ikan nila pada hari ke-10, 20, dan 30 pasca vaksinasi dengan metode infiltrasi hiperosmotik pada salinitas berbeda. 11 3 Aktivitas lisozim benih ikan nila pada hari ke-10, 20, dan 30 pasca
vaksinasi dengan metode infiltrasi hiperosmotik pada salinitas berbeda 12
DAFTAR LAMPIRAN
1 Hasil validasi Streptococcus agalactiae menggunakan KIT Api 20
Strep 20
1 PENDAHULUAN
Latar Belakang
Streptococcosis merupakan salah satu penyakit bakterial yang menyerang berbagai strain ikan nila. Penyakit ini seringkali disebabkan oleh bakteri Streptococcus agalactiae dan Streptococcus iniae. Akhir-akhir ini S. agalactiae lebih sering ditemukan dengan virulensi lebih tinggi dibandingkan S. iniae. Sheehan et al. (2009) membedakan S. agalactiae menjadi 2 tipe bakteri yaitu bakteri tipe 1 (β-hemolitik) dan bakteri tipe 2 (non-hemolitik). S. agalactiae tipe 1 hanya ditemukan di Thailand, Malaysia, dan Singapura. S. agalactiae tipe 2 memiliki wilayah penyebaran lebih luas daripada bakteri tipe satu dan hanya ditemukan di China, Ekuador, Honduras, Indonesia, Filipina, dan Thailand. Hanya di Filipina dan Vietnam sajalah dapat ditemukan S. agalactiae tipe 1, S. agalactiae tipe 2, dan S. iniae dalam satu negara.
Pengendalian streptococcosis pada produksi budidaya nila selama ini dilakukan dengan pemberian antibiotik yang dicampur dengan pakan. Akan tetapi, antibiotik sudah dilarang penggunaannya karena antibiotik bersifat bioakumulatif dan dapat menyebabkan resistensi bakteri terhadap antibiotik (Pridgeon et al. 2011). Vaksinasi merupakan salah satu alternatif metode pencegahan penyakit streptococcosis yang sangat menjanjikan. Salah satu upaya vaksinasi yang efektif untuk pencegahan penyakit tersebut adalah dengan vaksinasi induk yang dapat menyebabkan adanya transfer imunitas maternal. Transfer imunitas maternal merupakan upaya vaksinasi yang lebih menguntungkan karena dapat melindungi induk sekaligus benih yang dihasilkan terhadap agen patogen (Nur 2004).
Vaksinasi Aeromonas hydrophilla pada induk ikan patin dengan dosis 0.4 mg/kg BB pada TKG II memberikan imun turunan bawaan pada larva hingga
Beberapa penelitian sudah membuktikan adanya transfer antibodi dari induk ke benih melalui telur pada beberapa ikan air tawar jenis lele (Hanson & Ainsworth 1999), ikan mas (Swain et al. 2006), dan ikan air laut seperti zebrafish (Wang et al. 2008). Kekebalan induk yang diturunkan kepada anaknya akan meluruh dengan cepat seiring dengan pertambahan umur larva ikan dan perkembangan sistem imun. Penelitian sebelumnya, pemberian vaksin pada induk ikan Sparus aurata dapat memberikan ketahanan pada benih hasil induk yang divaksin dan mulai menurun pada hari ke-30 setelah menetas (Hanif et al. 2004) dan pada ikan nila. Oleh karena itu, diperlukan vaksinasi ulang dengan tujuan untuk meningkatkan kembali kinerja sistem imun benih dengan memperbaiki proteksi imunitas maternal.
2
sistem imun spesifiknya. Berdasarkan hasil penelitian Doggett & Harris (1987), organ ginjal pada ikan mujair Oreochromis mossambicus baru dapat berfungsi 100% pada benih umur 14 hari setelah menetas. Organ ginjal yang sudah berfungsi 100% ini menyebabkan sistem imun spesifik pada benih sudah dapat bekerja secara aktif dan sudah dapat diberikan vaksin.
Menurut Ellis (1988), vaksin sel utuh adalah vaksin yang berasal dari sel utuh bakteri yang antigenik ketika masih hidup dan imunogenik ketika dimatikan. Akan tetapi, vaksinasi benih dengan menggunakan sel utuh yang diinaktivasi dengan formalin menunjukkan hasil tingkat kelangsungan hidup yang belum optimal (Lusiastuti et al. 2010). Jenis vaksin yang digunakan pada penelitian ini adalah vaksin gabungan yang sebelumnya sudah dikaji oleh Hardi et al. (2013) dan dapat memberikan efikasi terbaik dibandingkan vaksin sel utuh atau produk ekstraseluler saja.
Menurut Evensen (2009), cara vaksinasi pada benih paling tepat dengan perendaman. Akan tetapi, metode perendaman memiliki kelemahan yaitu penyerapan vaksin yang tidak maksimal, sehingga dibutuhkan metode perendaman lain untuk memaksimalkan penyerapan vaksin. Metode lain yang dapat dilakukan yaitu dengan cara infiltrasi hiperosmotik. Metode infiltrasi hiperosmotik ini menggunakan media perlakuan yang didesain hipertonik yaitu konsentrasi cairan lingkungan lebih tinggi dibandingkan konsentrasi cairan tubuh ikan dengan memberikan kejutan salinitas. Akibatnya, membran-membran di permukaan tubuh terbuka dan cairan tubuh keluar kemudian digantikan dengan cairan yang mengandung vaksin.
Ellis (1988) mengemukakan bahwa, vaksinasi dengan metode infiltrasi hiperosmotik dapat meningkatkan jumlah vaksin yang diserap. Jumlah salinitas yang diberikan juga mempengaruhi efikasi vaksin yang diserap. Sehubungan dengan hal tersebut, maka perlu dikaji efikasi pemberian vaksin gabungan sel utuh dan produk ekstraseluler S. agalactiae pada benih ikan nila umur 20 hari pascamenetas dengan metode infiltrasi hiperosmotik pada salinitas yang berbeda.
Perumusan Masalah
3
Tujuan Penelitian
Tujuan penelitian ini adalah:
1. Mengevaluasi efektifitas vaksinasi pada induk betina ikan nila yang dapat menyebabkan transfer kekebalan ke anaknya.
2. Mengevaluasi perlakuan perendaman salinitas terbaik tehadap vaksinasi untuk mencegah infeksi bakteri S. agalactiae pada benih ikan nila Oreochromis niloticus terhadap parameter relative percent survival, tingkat kematian, titer antibodi, dan lisozim.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi mengenai metode vaksinasi benih dari induk yang divaksin secara infiltrasi hiperosmotik dengan perendaman konsentrasi garam yang tepat dan lama proteksi yang diberikan terhadap benih ikan nila dari induk yang divaksin.
2 METODE PENELITIAN.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2014 sampai April 2015 bertempat di Laboratorium Kesehatan Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rancangan Percobaan
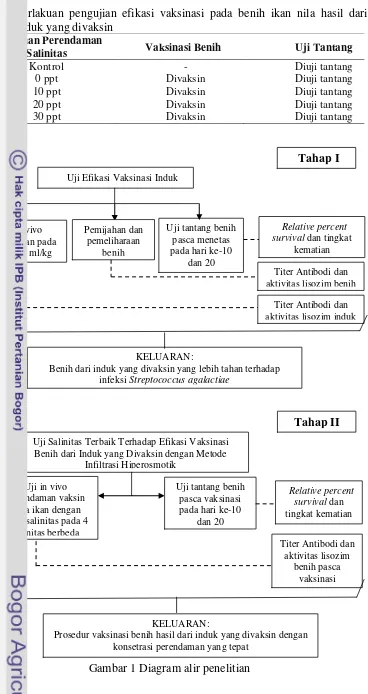
Penelitian ini dilakukan dengan metode eksperimen rancangan acak lengkap. Penelitian ini dilaksanakan melalui dua tahapan, yaitu tahap pertama pengujian efikasi vaksinasi pada induk yang menyebabkan transfer antibodi ke anaknya. Tahap kedua pengujian efikasi vaksinasi pada benih ikan nila hasil dari induk yang divaksin dengan metode infiltrasi hiperosmotik. Pelaksanaan penelitian secara skematis disajikan pada Gambar 1. Tahap pertama terdiri dari dua perlakuan dan tiga ulangan. Rancangan penelitian tahap pertama disajikan pada Tabel 1.
Tabel 1 Perlakuan pengujian efikasi vaksinasi pada induk ikan nila
Perlakuan Vaksinasi Uji Tantang
Induk kontrol - -
Induk perlakuan Divaksin -
Benih kontrol - Diuji tantang
Benih perlakuan - Diuji tantang
4
Tabel 2 Perlakuan pengujian efikasi vaksinasi pada benih ikan nila hasil dari induk yang divaksin
Perlakuan Perendaman
Salinitas Vaksinasi Benih Uji Tantang
Kontrol - Diuji tantang
0 ppt Divaksin Diuji tantang
10 ppt Divaksin Diuji tantang
20 ppt Divaksin Diuji tantang
30 ppt Divaksin Diuji tantang
Gambar 1 Diagram alir penelitian
Benih dari induk yang divaksin yang lebih tahan terhadap infeksi Streptococcus agalactiae
Uji Salinitas Terbaik Terhadap Efikasi Vaksinasi Benih dari Induk yang Divaksin dengan Metode
Infiltrasi Hiperosmotik
Prosedur vaksinasi benih hasil dari induk yang divaksin dengan konsetrasi perendaman yang tepat
5
Prosedur Penelitian
Peningkatan Virulensi dan Karakterisasi Bakteri
Bakteri uji yang digunakan adalah S. agalactiae koleksi dari Laboratorium Kesehatan Organisme Akuatik, Departemen Budidaya Perairan, Institut Pertanian Bogor. Peningkatan virulensi dapat dilakukan dengan cara menyuntikan 0,1 mL biakan cair bakteri S. agalactiae dengan dosis 107 CFU/mL secara intraperitoneal ke masing-masing induk ikan nila yang sehat. Ikan yang diinfeksi S. agalactiae diamati gejala klinisnya yang menandakan ikan uji sudah sakit. Setelah itu, bakteri diisolasi di media agar BHI dari cairan organ ginjal, mata, dan otak kemudian diinkubasi di inkubator suhu 29-30 ºC selama 24 jam. Setelah 24 jam, bakteri yang tumbuh dimurnikan dan dikarakterisasi ulang. Karakterisasi bakteri dilakukan dengan menggunakan Kit API 20 Strep (Biomereux).
Pemeliharaan Induk
Induk ikan nila yang digunakan adalah induk strain Nirwana yang diperoleh dari Balai Pengembangan Benih Ikan Air Tawar, Wanayasa, Jawa Barat. Calon induk yang digunakan setiap perlakuan sejumlah satu ekor jantan dan tiga ekor betina sebagai ulangan individu dengan berat rata 250±30 g dan panjang rata-rata 22.97±0.86 cm. Induk yang digunakan berasal dari pemijahan induk yang sama. Induk yang diberikan vaksin adalah induk yang belum pernah memijah pada TKG II. Induk diadaptasikan terhadap kondisi pemeliharaan sampai mencapai TKG II. Pemeliharaan dilakukan dalam bak beton berukuran 3x2x0,6 m yang terpisah antara jantan dan betina. Selama pemeliharaan, calon induk diberi pakan komersial dengan kadar protein 33% sebanyak 2% dari bobot ikan perhari.
Penetasan Telur dan Pemeliharaan Benih
6
kecepatan 140 rpm selama 72 jam. Setelah 72 jam, kepadatan bakteri mencapai 3.54x1011 CFU/mL. Biakan bakteri selanjutnya diinaktivasi menggunakan neutral buffer formalin sebanyak 3% dari volume biakan dan diinkubasi selama 24 jam. Bakteri kemudian dipanen dengan cara disentrifugasi dengan kecepatan 10.000 rpm pada suhu 4 °C selama 30 menit. Vaksin sel utuh diperoleh dengan mengambil endapan pellet bakteri, kemudian dicuci menggunakan 500 mL PBS sebanyak dua kali. Vaksin yang telah jadi diuji viabilitasnya, jika bakteri tidak tumbuh dalam waktu 48 jam maka vaksin aman untuk digunakan.
Pembuatan vaksin produk ekstraseluler yaitu isolat bakteri S. agalactiae pada media agar miring diambil sebanyak satu ose dan dikultur dalam media BHIB sebanyak 25 mL secara aseptik, kemudian diinkubasi pada water bath shaker suhu 29-30 °C kecepatan 140 rpm selama 24 jam. Biakan bakteri sebanyak 50 mL dimasukkan ke dalam 450 mL BHIB dan diinkubasi dalam water bath shaker suhu 29-30 °C kecepatan 140 rpm selama 72 jam. Biakan bakteri selanjutnya diinaktivasi menggunakan neutral buffer formalin sebanyak 3% dari volume biakan dan diinkubasi selama 24 jam. Bakteri kemudian dipanen dengan cara disentrifugasi dengan kecepatan 10 000 rpm pada suhu 4 °C selama 30 menit. Vaksin produk ekstraseluler diperoleh dengan menyaring supernatant dengan filter saring 0.22 µm. Vaksin produk ekstraseluler diuji keamanannya dengan cara disuntikkan pada lima ekor ikan nila dan dilihat perkembangannya selama 72 jam. Apabila hingga jam ke-72 tidak muncul kematian dan gejala streptococcosis, maka vaksin produk ekstraseluler aman untuk digunakan. Vaksin sel utuh dan produk ekstraseluler disimpan dalam suhu 4 °C sampai akan digunakan.
Vaksinasi Induk dan Benih
Vaksinasi induk pra salin dilakukan dengan cara sebanyak tiga induk betina pada TKG II divaksinasi dengan dosis 0,4 mL/kg yang diberikan dengan cara disuntikkan secara intraperitoneal (IP). Sebelum divaksinasi, induk dibius untuk mengurangi terjadinya stres dengan cara direndam di dalam larutan stabilizer (Ocean free) dengan konsentrasi 1 mL/3 L air. Induk betina diberi tanda untuk membedakan antar perlakuan. Induk jantan dan betina disatukan setelah diberikan vaksin, kemudian dipelihara hingga memijah. Pemijahan dilakukan empat minggu pascavaksinasi dengan ratio jantan : betina yaitu 1:3.
Vaksinasi benih dari induk yang divaksin dilakukan dengan cara sebelum vaksinasi disiapkan terlebih dahulu media bersalinitas. Media bersalinitas dibuat dengan cara melarutkan garam krosok ke dalam air tawar sesuai takaran. Sebanyak 100 ekor ikan nila berumur 20 hari dengan ukuran 0.16±0,021 gram direndam dalam media bersalinitas 0, 10, 20, dan 30 ppt selama lima menit dengan padat tebar 100 ekor/L. Selanjutnya ikan dipindahkan dalam larutan vaksin berdosis 109 CFU/mL selama 30 menit dengan padat tebar 100 ekor/L. Setelah 30 menit, benih dikembalikan ke media air pemeliharaan.
Uji Tantang
7 107 CFU/mL. Ikan direndam dalam media dengan larutan bakteri patogen S. agalctiae selama 30 menit, selanjutnya dipindahkan kembali ke media pemeliharaan. Tingkat kematian diamati selama 14 hari. Jumlah benih yang diuji tantang sebanyak 20 ekor pada setiap wadah.
Pengukuran Kualitas Air
Kualitas air dijaga pada keadaan optimal untuk pemeliharaan ikan nila. Pengukuran kualitas air meliputi suhu, pH, DO, TAN, dan NH3. Pengukuran suhu
dilakukan setiap hari pada pukul 07.00 WIB dan 17.00 WIB.Pengukuran pH, DO, TAN, dan NH3 dilakukan pada awal dan akhir pemeliharaan. Kualitas air optimum
untuk pemeliharaan ikan nila disajikan pada Tabel 3.
Tabel 3 Kisaran kualitas air optimum pemeliharaan ikan nila
Parameter Kualitas Air Satuan Nilai Terukur Nilai Ambang Batas
Suhu ºC 26-32 25-32 (SNI 7550:2009)
DO Ppm 5.1-6.0 ≥ 3 (SNI 7550:2009)
Ph - 7.59-79 6,5-8,5 (SNI 7550:2009)
TAN Ppm 0.07-0.14 < 1 (Boyd 1982) Amoniak Ppm 0.02-0.03 0-0,03 (Yuniar 2009)
Parameter Penelitian
Tingkat Kelangsungan Hidup Relatif atau Relative Percent Survival (RPS)
Tingkat kelangsungan hidup relatif atau relative percent survival (RPS) dihitung untuk mengetahui efektivitas vaksin yang diberikan pasca uji tantang. Tingkat kelangsungan hidup relatif (Relative Percent Survival) dapat dihitung menggunakan rumus Ellis (1988) seperti berikut:
RPS =
( 1-
)
x 100Keterangan:
RPS = Tingkat kelangsungan hidup relatif (%)
Mv = Mortalitas benih hasil induk yang divaksinasi (%) Mc = Mortalitas benih hasil induk kontrol (%)
Tingkat Kematian atau Mortality Rate (MR)
Tingkat kematian adalah persentase perbandingan jumlah ikan yang mati pasca uji tantang dengan ikan awal. Tingkat mortalitas dapat dihitung menggunakan rumus seperti berikut:
MR = x 100
Keterangan:
MR = Tingkat kematian (%)
8
Level Antibodi
Level antibodi diukur dengan cara antigen sebanyak 100 μL dimasukkan pada microtiter plate, ditambahkan 100 μL carbonate-bicarbonate buffer (pH 9,6) pada setiap sumur dari delapan sumur microtiter plate, kemudian diinkubasi pada suhu 4 oC selama 24 jam (over night). Microtiter plate dicuci dengan menggunakan PBS-T (PBS pH 7,4 + 0,05% Tween-20). Sebanyak 100 μL Bovine Serum Albumin (BSA, Sigma) 3% ditambahkan dalam H2O w/v, lalu disimpan
pada suhu 25oC selama 1 jam dan microtiter plate dicuci dengan PBS-T. Sampel serum yang sudah dipreparasi (Lampiran 3) diencerkan 1:100 pada PBS-T dan ditambahkan kedalam microtiter plate 100 μL dengan tiga kali ulangan. Microtiter plate diinkubasi pada 25 oC selama satu jam kemudian dicuci dengan PBS-T. Ig Anti-nila rantai panjang untuk antibodi monoklonal spesifik diencerkan 1:200 pada PBS-T dan 100 μL ditambahkan ke setiap sumur microtiter plate. Microtiter plate diinkubasi pada suhu 25 oC selama satu jam, kemudian dicuci menggunakan PBS-T. Peroxidase-conjugated rabbit anti rabbit (Sigma) yang diencerkan menjadi 1:5000 ditambahkan pada PBS-T dan 100 μL ditambahkan pada setiap sumur microtiter plate. Microtiter plate diinkubasi pada suhu 25 oC selama satu jam, kemudian dicuci. Sebanyak 100 μL One-Step Ultra TMB-ELISA (Sigma) (TMB 5 mg + 10 µL H2O2 38% dalam 5 mL asetat buffer pH 5)
ditambahkan pada setiap sumur microtiter plate. Setelah 20 menit, reaksi ELISA
dihentikan dengan menambahkan 50 μL 3 M H2SO4 dengan optical density (OD)
pada absorbance 405 nm (Shelby et al. 2002 ) dengan ELISA strip reader (EL 301). Sebanyak 100 μL H2SO4 ditambahkan pada blanko kedalam sumur pertama
dari microtiter plate didiamkan selama 20 menit, kemudian tambahkan 100 μL substrat TBM-ELISA.
Aktivitas Lisosim
Pengujian lisozim menggunakan metode Ellis (1990). Pengujian ini dilakukan dengan cara sampel serum sebanyak 100 µl ditambah larutan Micrococcus lysodeikticus 100 µl (0,2 mg/mL dalam 0,05 M NaH2PO4 pada suhu
25 °C). Pembacaan dilakukan dengan menggunakan ELISA reader dengan panjang gelombang 450 nm setelah 30 detik dari larutan dan 45 menit dari larutan.
Analisis Data
9
3 HASIL DAN PEMBAHASAN
Hasil
Tingkat Kematian dan Relative Percent Survival (RPS) Benih Pascamenetas
Tingkat kematian dan relative percent survival benih pascauji tantang umur 10 dan 20 hari pasca menetas disajikan pada Tabel 4. Hasil pengamatan tingkat kematian benih umur 10 hari pasca menetas didapatkan perlakuan kontrol dan vaksin masing-masing sebesar 50.00% dan 8.33% menunjukkan hasil yang berbeda nyata (P<0.05) dengan nilai RPS sebesar 83.20%. Pada hari ke-20 tingkat mortalitas perlakuan kontrol dan vaksin masing-masing sebesar 63.33% dan 21.67% menunjukkan hasil yang berbeda nyata (P<0.05) dengan nilai RPS sebesar 65.80%.
Tabel 4 Tingkat kematian dan relative percent survival (RPS) pada benih ikan nila pada hari ke-10 dan 20 pascamenetas
Uji Tantang Keterangan: Huruf superscript yang berbeda di belakang nilai standar deviasi pada hari
pengamatan yang sama menunjukkan adanya perbedaan antar perlakuan (P<0.05).
Titer Antibodi Induk, Telur, dan Benih Pascamenetas
Rataan titer antibodi pada induk sebelum dan sesudah vaksinasi, telur, serta benih umur 10 dan 20 hari pascamenetas disajikan pada Tabel 5. Data titer antibodi pada induk meningkat sesudah diberikan vaksin sebesar 0.09 menunjukkan hasil yang berbeda nyata (P<0.05) dibandingkan perlakuan kontrol sebesar 0.04. Nilai titer antibodi pada telur perlakuan kontrol dan vaksin masing-masing senilai 0.04 dan 0.07 yang menunjukkan hasil berbeda nyata (P<0.05). Kemudian, nilai titer antibodi pada benih mengalami penurunan seiring bertambahnya umur dengan nilai terendah yaitu pada perlakuan kontrol dan vaksin benih umur 20 hari masing-masing sebesar 0.03 dan 0.06 yang Keterangan: Huruf superscript yang berbeda di belakang nilai standar deviasi pada hari
10
Aktivitas Lisozim Induk, Telur, dan Benih Pascamenetas
Rataan aktivitas lisozim pada induk sebelum dan sesudah vaksinasi, telur, serta benih umur 10 dan 20 hari pascamenetas disajikan pada Tabel 6. Data aktivitas lisozim pada induk meningkat sesudah diberikan vaksin sebesar 0.217 menunjukkan hasil yang berbeda nyata (P<0.05) dibandingkan perlakuan kontrol sebesar 0.044. Nilai aktivitas lisozim pada telur perlakuan kontrol dan vaksin masing-masing senilai 0.075 dan 0.099 yang menunjukkan hasil berbeda nyata (P<0.05). Nilai aktivitas lisozim pada benih mengalami penurunan seiring bertambahnya umur dengan nilai terendah yaitu pada perlakuan kontrol dan vaksin benih umur 20 hari masing-masing sebesar 0.037 dan 0.086 yang Keterangan: Huruf superscript yang berbeda di belakang nilai standar deviasi pada kolom yang
sama menunjukkan adanya perbedaan antar perlakuan (P<0.05).
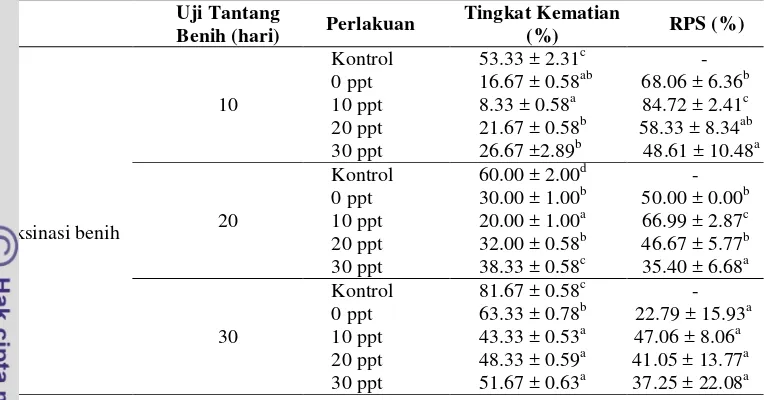
Tingkat Kematian dan Relative Percent Survival (RPS) Benih Pascavaksinasi
11 Tabel 7 Tingkat kematian dan relative percent survival (RPS) pada benih ikan nila
pada hari ke-10, 20, dan 30 pascavaksinasi Uji Tantang Keterangan: Huruf superscript yang berbeda di belakang nilai standar deviasi pada hari
pengamatan yang sama menunjukkan adanya perbedaan antar perlakuan (P<0.05).
Titer Antibodi Benih Pascavaksinasi
Nilai rataan titer antibodi pada hari ke-10, 20, dan 30 pascauji tantang benih hasil dari induk yang divaksin disajikan pada Gambar 2. Nilai titer antibodi benih mulai meningkat pada hari ke-10 pasca vaksinasi dan menurun secara perlahan pada hari ke-20 dan 30 pasca vaksinasi. Data titer antibodi akhir tertinggi terdapat pada perlakuan salinitas 10 ppt yaitu sebesar 0.077 yang berbeda nyata (P<0.05) terhadap perlakuan kontrol yaitu sebesar 0.048.
12
Aktivitas Lisozim Benih Pascavaksinasi
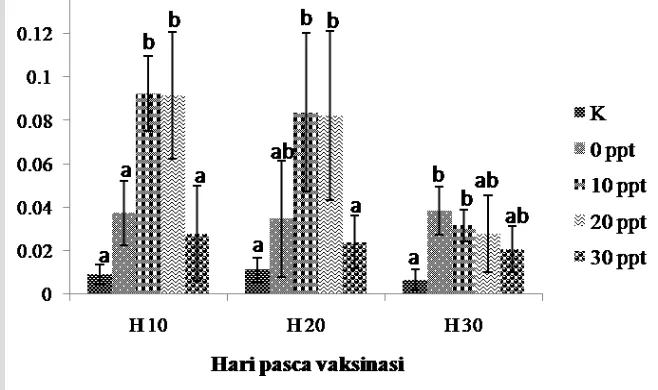
Nilai rataan aktivitas lisozim pada hari ke-10, 20, dan 30 pasca uji tantang benih hasil dari induk yang divaksin disajikan pada Gambar 3. Nilai aktivitas lisozim mulai meningkat pada hari ke-10 pascavaksinasi dan menurun secara perlahan pada hari ke-20 pasca vaksinasi. Pada hari ke-30 pasca vaksinasi nilai aktivitas lisozim perlakuan salinitas 10, 20, dan 30 ppt menurun tajam, akan tetapi pada perlakuan salinitas 0 ppt meningkat perlahan. Data aktivitas lisozim tertinggi terdapat pada perlakuan salinitas 10 ppt pada hari ke-10 pasca vaksinasi yaitu sebesar 0.092 yang berbeda nyata (P<0.05) terhadap perlakuan kontrol yaitu sebesar 0.009.
Gambar 3 Aktivitas lisozim benih ikan nila pada hari ke-10, 20, dan 30 pascavaksinasi dengan metode infiltrasi hiperosmotik pada salinitas berbeda. Keterangan: huruf superscript yang berbeda pada hari pengamatan yang sama menunjukkan nilai yang beda nyata antar perlakuan (P<0.05).
Pembahasan
13 kemampuan bakteri yang tidak dapat menghidrolisis gula-gula jenis laktosa, trehalosa, sorbitol, arabinosa, dan starch. Hasil ini sesuai dengan penelitian Hardi (2013) yang menyatakan bahwa, bakteri S. agalactiae tipe non hemolitik mempunyai kemampuan menghidrolisis gula-gula yang terbatas. Gula yang dapat dihidrolisis berupa hipurik dan arginin dan gula yang tidak dapat dihidrolisis berupa laktosa, trehalosa, sorbitol, arabinosa, dan starch.
Susunan vaksin yang terdiri dari sel utuh dan produk ekstraseluler merangsang terbentuknya antibodi. Dinding sel bakteri S. agalactiae tersusun dari peptidoglikan yang merupakan struktur kompleks yang terdiri dari gula dan asam amino. Sel utuh bekerja secara ekstraseluler. Produk ekstraseluler bakteri S. agalactiae merupakan zat antigenik yang kuat, sehingga dapat bersifat imunogenik dan dapat merangsang pertahanan tubuh ikan ketika dilakukan uji tantang terhadap bakteri yang sama (Woolf 2000). Eksotoksin biasanya disekresikan oleh bakteri hidup selama fase pertumbuhan eksponensial. Umumnya, strain bakteri yang patogen menghasilkan toksin yang virulen. Peptidoglikan dan produk ekstraseluler ini memainkan peran penting dalam menginduksi aktivasi sel-sel makrofag yang berfungsi sebagai sel pembentuk antibodi (respons imun spesifik) dan sel fagositik (respons imun non spesifik) (Pasnik 2005).
Benih dari induk yang tidak divaksin dan yang divaksin diuji tantang dengan bakteri patogen S. agalactiae saat benih berumur 10 dan 20 hari pascamenetas. Hasilnya, benih dari induk yang divaksin mempunyai tingkat kematian lebih rendah (P<0.05) dibandingkan benih yang berasal dari induk yang tidak divaksin. Hasil ini didukung oleh penelitian lain tentang transfer imunitas induk pada beberapa spesies ikan. Nilai tingkat kematian benih sangat mempengaruhi nilai parameter RPS. RPS merupakan parameter utama yang dapat digunakan untuk mengukur efikasi vaksin. Hasil penelitian menunjukkan bahwa nilai RPS benih pada hari ke-10 dan 20 pascamenetas berturut-turut sebesar 83.20% dan 65.80%. Nilai pada pengamatan hari ke-20 cukup efektif untuk memberikan proteksi terhadap benih, tetapi sudah mendekati nilai minimum. Menurut Amend (1981), vaksin dikatakan efektif apabila dapat menimbulkan proteksi terhadap ikan uji yang ditandai dengan nilai RPS > 60% saat dilakukan uji tantang. RPS yang tinggi ini berbanding lurus dengan parameter pendukung titer antibodi dan aktivitas lisozim
Transfer imunitas maternal pada ikan seringkali didasarkan pada perpindahan Ig dari induk ke benih. Imunitas maternal melindungi organisme muda pada masa awal kehidupannya, di mana induk betina menyalurkannya melalui kuning telur. Kedua jenis imunitas alami dan adaptif dapat disalurkan melalui induk betina ke anaknya. Faktor tersebut mencakup imunoglobulin (Ig)/antibodi, faktor komplemen, lisozim, protease inhibitor menyerupai makroglobulin, jenis berbeda dari lektin, dan serin protease seperti molekul. Bukti adanya transfer antibodi ke benih melalui telur mirip seperti hormon yang dapat masuk ke benih melalui telur. Antibodi yang terbentuk dan dilepaskan, dapat ditemukan pada serum induk kemudian ikut dalam aliran darah. Proses vitelogenesis yang terjadi di hati kemudian membawa bakal kuning telur menuju ke dalam oosit melalui aliran darah. Akumulasi antara antibodi dan bakal kuning telur terjadi di dalam darah (Swain & Nayak 2009).
14
diduga karena ikan uji berasal dari kolam terbuka yang memungkinkan terjadinya kontak dengan agen patogen yang ada di dalam lingkungan kolam, sehingga memungkinkan terjadinya imunisasi alamiah. Selain itu, hal ini juga dapat disebabkan karena adanya antibodi alamiah. Seperti yang dikemukakan Ellis (1988) faktor yang mempengaruhi mekanisme imun adalah genetik (gen induk timus), metabolik (hormon), lingkungan, gizi, anatomi, fisiologi, umur ikan, dan mikroba.
Data titer antibodi pada induk setelah vaksinasi memiliki nilai optical density lebih tinggi (P<0.05) dibandingkan dengan kontrol (Tabel 5). Tingginya nilai titer antibodi pada telur hasil induk yang divaksin ini diduga adanya transfer antibodi dari induk ke telur. Hal ini memperkuat beberapa penelitian sebelumnya yang membuktikan adanya transfer antibodi dari induk ke benih melalui telur pada beberapa ikan air tawar jenis ikan lele (Hanson & Ainsworth 1999), ikan mas (Swain et al. 2006), dan ikan air laut seperti zebrafish (Wang et al. 2008). Nilai rataan titer antibodi pada benih hasil induk yang divaksin sudah dapat terlihat pada sampling hari ke-10 dan semakin menurun sampai hari ke-20 pascamenetas dan memiliki nilai lebih tinggi (P<0.05) dibandingkan kontrol. Nilai antibodi yang semakin menurun ini disebabkan karena nilai antibodi spesifik yang terdapat pada cairan tubuh benih dari induk yang divaksin mengalami penurunan pada fase pasca-benih dimana kuning telur sudah terserap seluruhnya (Swain & Nayak 2009).
Lisozim adalah salah satu enzim bakterisidal penting dari sistem imun alami sebagai respons imun non spesifik selama infeksi seperti kondisi stres dan bertindak sebagai protein fase akut yang berperan dalam pertahanan melawan infeksi penyakit dari ikan (Swain & Nayak 2009). Hasil penelitian aktivitas lisozim menunjukkan bahwa aktivitas lisozim pada induk setelah vaksinasi, telur dan benih dari induk yang divaksin pascamenetas memiliki nilai lebih tinggi (P<0.05) dibandingkan dengan konrol (Tabel 6). Tingginya nilai aktivitas lisozim yang terdeteksi di telur ini diduga karena adanya transfer kekebalan dari induk yang divaksin ke telur karena didukung oleh adanya aktivitas lisozim yang lebih tinggi berasal dari induk yang divaksin dan aktivitasnya menurun pasca hari ke-10 sampai ke-20 pengamatan. Menurunnya aktivitas lisozim ini disebabkan karena adanya penyerapan kuning telur dan katabolisme protein alami selama periode ini. Hal ini mendukung penelitian dari Hanif et al. (2004) yang membuktikan adanya transfer lisozim maternal pada benih ikan Sparus aurata. Hasil lisozim kelompok ekstrak telur dan benih dari induk yang diberi vaksin secara signifikan (P<0.05) lebih tinggi dibandingkan dengan kelompok yang tidak diberi vaksin.
Mekanisme sistem imun non spesifik dapat diaktifkan selama terjadi infeksi oleh bakteri patogen (Wang et al. 2010). Tanggapan ini dimediasi oleh makrofag melalui produksi berbagai mediator seperti nitrat oksida, reactive oxygen species (ROS), dan pro inflammatory cytokines. Vaksinasi benih dari induk yang divaksin gabungan sel utuh dan produk ekstraseluler ini yang dipercaya mampu menginduksi aktivasi makrofag. Hal ini mendukung penelitian Hanif et al. (2005) yang membuktikan bahwa aktivitas lisozim pascavaksinasi benih dari induk yang divaksin mempunyai nilai lebih tinggi dibandingkan perlakuan kontrol (P<0.05).
15 dengan cara larva divaksinasi dengan sel utuh dan produk ekstraseluler pada umur 20 hari pasca menetas dengan metode hiperosmotik. Uji tantang dilakukan pada hari ke-10, 20, dan 30 pascavaksinasi. Secara keseluruhan, nilai rataan tingkat kematian perlakuan vaksin lebih rendah (P<0.05) dibandingkan perlakuan kontrol. Hal ini menunjukkan bahwa vaksinasi yang diberikan dapat menurunkan angka kematian benih setelah diuji tantang dibandingkan dengan kontrol. Rendahnya tingkat kematian ini disebabkan vaksinasi dapat menginduksi antibodi (respons imun spesifik) dan lisozim (respons imun non spesifik).
Hasil penelitian menunjukkan bahwa nilai produk ekstraseluler pada perlakuan 10 ppt memberikan hasil terbaik (P<0.05) dibandingkan perlakuan salinitas 0 ppt, 20 ppt, dan 30 ppt hingga akhir pengamatan. Nilai RPS benih perlakuan salinitas 10 ppt pada hari 10, 20, dan 30 pascavaksinasi berturut-turut senilai 84.72%; 66.99%; dan 47.06%. Nilai RPS sudah sangat turun dipengamatan akhir senilai 47.06% yang didukung dengan penurunan titer antibodi dan aktivitas lisozim. Nilai tersebut kurang efektif untuk memberikan proteksi terhadap benih dan diperlukan vaksinasi ulang untuk meningkatkan tingkat proteksinya kembali. Menurut Amend (1981), vaksin dikatakan efektif apabila dapat menimbulkan proteksi terhadap ikan uji yang ditandai dengan nilai RPS > 60% saat dilakukan uji tantang. Sedangkan nilai RPS terendah terdapat pada perlakuan salinitas tertinggi (30 ppt), hal ini diduga benih kurang bisa beradaptasi dengan salinitas tinggi sehingga vaksin yang terserap kurang dan tingkat proteksi yang ditimbulkan rendah.
Hasil pengukuran titer antibodi pada benih pasca vaksinasi menunjukkan bahwa secara keseluruhan antibodi benih ikan nila antar perlakuan mengalami peningkatan dibandingkan kontrol (P<0.05). Hal ini diduga vaksinasi pada perendaman salinitas 10, 20, dan 30 ppt mampu menginduksi terbentuknya antibodi sudah dapat terlihat pada hari ke-10 pasca vaksinasi dalam tubuh ikan dibandingkan dengan kontrol (Gambar 2). Kemampuan ikan menginduksi antibodi ini menunjukkan bahwa ginjal sudah berfungsi sempurna. Berdasarkan hasil penelitian Doggett & Harris (1987), organ ginjal pada ikan mujair Oreochromis mossambicus sudah berdiferensiasi dan berfungsi 100% pada benih umur 14 hari setelah menetas. Ginjal sudah mulai terbentuk jaringan hematopoietik. Jaringan hematopoetik merupakan jaringan yang mengandung sel-sel bulat poligonal dan memiliki inti hiperkromatik (Iqbal et al. 2004). Di dalam jaringan hematopoetik terdapat banyak sel limfosit dan sel antibodi, selain itu berfungsi juga sebagai tempat filtrasi makrofag yang memfagosit antigen (Ellis 1988).
Nilai titer antibodi benih ikan nila yang direndam pada salinitas 10 ppt lebih tinggi dibandingkan perlakuan kontrol, 0, 20, dan 30 ppt (P<0.05). Vaksinasi dengan metode infiltrasi hiperosmotik akan menambah jumlah vaksin yang diserap ke dalam tubuh ikan, sehingga menyebabkan antibodi yang lebih tinggi (Ellis 1988). Salinitas 10 ppt memberikan hasil paling optimum terhadap kinerja sistem imun pada benih. Hanif (2005) menjelaskan bahwa antibodi benih yang dihasilkan sangat bervariasi dan tergantung pada suhu air, ukuran ikan, antigen yang digunakan, dosis vaksin, dan rute pemberian.
16
salinitas yang diberikan, maka semakin berat kinerja organ dalam menjaga keseimbangan osmoregulasi. Kenaikan salinitas pada benih menyebabkan lebih banyak kerusakan pada jaringan penghasil antibodi, sehingga menyebabkan antibodi yang dihasilkan menjadi rendah. Pernyataan ini didukung dengan penelitian Nugon (2003) bahwa kerusakan jaringan paling sedikit pada benih terdapat pada salinitas paling kecil (10 ppt). Kerusakan jaringan dapat berupa lubang pada epitel kulit karena hilangnya jaringan dan pembengkakan pada epitel insang (Fridman 2011).
Seperti pada respons imun spesifik, perlakuan perendaman vaksinasi pada salinitas 10 ppt juga memberikan hasil terbaik terhadap respons imun non spesifik berupa lisozim (P<0.05) dibandingkan dengan perlakuan 0 ppt, 20 ppt, dan 30 ppt (Gambar 3). Peningkatan aktivitas lisozim tertinggi terdapat pada perlakuan salinitas 10 ppt dibandingkan perlakuan lainnya (P<0.05) pada hari ke-10 kemudian menurun sampai hari ke-30. Tingginya nilai aktivitas lisozim ini diduga perlakuan 10 ppt tidak menimbulkan banyak kerusakan jaringan yang banyak mengandung sel-sel leukosit sebagai sumber lisozim, sehingga dapat menyerap volume vaksin yang paling banyak. Pada ikan teleostei, aktivitas lisozim telah terdeteksi di serum, lendir, kulit, epitel, limpa, ginjal, sel-sel seperti makrofag, dan neutrofil darah (Magnadottir et al. 2005; Fletcher et al. 2010).
4 KESIMPULAN
Kesimpulan
1. Pemberian vaksin pada induk ikan nila dapat menyebabkan transfer kekebalan maternal ke benih dengan nilai relative percent survival mencapai 83.20% dan 65.80% pada hari ke-10 dan 20 pascamenetas.
2. Vaksinasi secara infiltrasi hiperosmotik perlakuan salinitas 10 ppt dapat memperbaiki kinerja sistem imun benih dengan nilai relative percent survival yaitu 84.72%; 66.49%; dan 47.06% pada hari ke-10, 20, dan 30 pascavaksinasi.
Saran
Perlu dilakukan penelitian lebih lanjut terkait tingkat stres benih yang divaksinasi dengan kejut salinitas 10 ppt.
DAFTAR PUSTAKA
Amend DF. 1981. Potency testing of fish vaccine. Dev. Biol. Stand. 49:447-454. Doggett TA, Harris JE. 1987. The ontogeny of gut-associated lymphoid tissue in
17 Ellis AE. 1990. Lysozyme Assays. In Stolen JS, Fletcher TC, Anderson DP, Roberson BS, van Muiswinkel WB. (Ed) Textbook of techniques in fish immunology. NJ: SOS Publication. Page 101-103.
Evans JJ, Klesius PH, Shoemaker CA, Fitzpatrick BT. 2005. Streptococcus agalactiae vaccination and infection stress in Nile t ilapia Oreochromis niloticus. Journal of Applied Aquaculture. 16(3):105-115.
Evensen O. 2009. Development in fish vaccinology with focus on delivery methodologies, adjuvants and formulations. The Use of Veterinary Drugs and Vaccines in Mediterranean. Aquaculture. 86:177-186.
Fletcher GL, Hobbs R, Evans R, Shears MA, Hahn A, Hew C. 2010. Lysozyme transgenic Atlantic salmon (Salmo salar L.). Aquaculture Research. 42:427–440.
Firdausi AP. 2014. Vaksinasi induk ikan nila Oreochromis niloticus dengan sel utuh dan ketahanan benih yang dihasilkannya terhadap infeksi Streptococcus agalactiae. [Skripsi]. Indonesia (ID): Institut Pertanian Bogor.
Fridman S. 2011. The ontogeny of osmoregulation in the Nile Tilapia (Oreochromis niloticus L.). [Thesis]. Inggris (ID): University of Stirling. Hadie W, Lusiastuti AM, Sularto, Tahapari E. 2010. Imunitas maternal terhadap
Aeromonas hydrophila: pengaruhnya terhadap fekunditas dan daya tetas ikan patin siam (Panqasionodon hypophthalmus). Jurnal Akuakultur Indonesia. 5(2): 229-235
Hanif A, Bakopoulos V, Dimitriadis GJ. 2004. Maternal transfer of humoral specific and non-specific immune parameters to sea bream (Sparus aurata) larvae. Fish and Shellfish Immunology. 17:411-435.
Hanif A, Bakopoulus V, Leonardos I, Dimitriadis GJ. 2005. The effect of sea bream (Sparusaurata) broodstock and larval vaccination on the susceptibility by Photobacterium damsel subsp. piscicida and on the humoral immune parameters. Fish and Shelfish Immunology. 19:345-361. Hanson LP dan Ainsworth AJ. 1999. Humoral immune responses of channel
catfish (Ictalurus punctatus) fry and fingerlings exposed to Edwardsiella ictaluri. Fish & shellfish immunology. 9:579-589.
Hardi EH, Sukenda, Harris E, Lusiastuti AM. 2013. Kandidat vaksin potensial Streptococcus agalactiae untuk pencegahan penyakit streptococcosis pada ikan Nila (Oreochromis niloticus). Jurnal Veteriner. 14:408-416.
Hidayatullah D. 2013. Efikasi vaksin dengan metode infiltrasi hiperosmotik untuk mencegah infeksi bakteri Streptococcus agalactiae pada ikan nila. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Iqbal F, Qureshi IZ, Ali M. 2004. Histopathological changes in the kidney of common carp, Cyprinus carpio, following nitrate exposure. Journal of Research. 15(4):411-418.
Kamiso HN. 2001. Imunologi dan vaksinasi pada ikan. Pekanbaru (ID): Universitas Riau.
18
nila Oreochromis niloticus. Prosiding Simposium Nasional Bioteknologi Akuakultur III.hal.48-55.
Magnadottir B, Lange S, Gudmundsdottir S, Bøgwald J, Dalmo RA. 2005. Ontogeny of humoral immune parameters in fish. Fish and Shellfish Immunology. 19:429–439.
Mulero I, Ayala AG, Meseguer J, Mulero V. 2007. Maternal transfer of immunity and ontogeny of autologous immunocompetence of fish: A minireview. Aquaculture. 268:244-250.
Nugon RW. 2003. Salinity Tolerance Of Juveniles Of Four Varieties Of Tilapia. x. [Thesis]. Millsaps College.
Nur I, Sukenda, Dana D. 2004. Ketahanan benih ikan nila gift (Oreochromis niloticus Linne) dari hasil induk yang diberi vaksin terhadap infeksi buatan Streptococcus iniae. Jurnal Akuakultur Indonesia. 3(1):37-43.
Nybakken JW. 1988. Biologi laut suatu pendekatan ekologis. Eidman HM, Koesoebiono DG, Bengen M, Hutomodan S, Sukardjo, penerjemah. Jakarta (ID): Gramedia.
Pasnik DJ, Evans JJ, Panangala VS, Klesius PH, Shelby RA, Shoemaker CA. 2005. Antigenicity of Streptococcus agalactiae extracellular products and vaccine efficacy. J Fish Dis. 28:205–212.
Pasnik DJ, Evans JJ, Klesius PH. 2006. Passive immunization of Nile tilapia (Oreochromis niloticus) provides significant protection against Streptococcus agalactiae. Fish Shellfish Immunol. 21:365-371.
Pridgeon JW, Klesius PH, Mu X, Song L. 2011. An in vitro screening method to evaluate chemicals as potential chemotherapeutants to control Aeromonas hydrophila infection in channel catfish.J ApplMicrobiol. 111:114–24.
Sheehan B, Labrie L, Lee Y, Lim W, Wong F, Chan J. 2009. Streptococcal diseases in farmed tilapia. Aquaculture Asia Pacific. 5(6):26–9.
Shelby RA, Shoemaker CA, Klesius PH, 2002. Detection of humoral response to Streptococcus iniae infection of Nile tilapia, Oreochromis niloticus, by a monoclonal antibody based ELISA. J. Appl. Aquac. 12:23–31.
[SNI] Standar Nasional Indonesia. 2009. Produksi ikan nila hitam (Oreochromis niloticus Bleeker) kelas induk pokok. Badan Standardisasi Nasional/BSN, SNI 6139:2009.
Swain P, Dash S, Bal J, Routray P, Sahoo PK, Sahoo SK, Saurabh S, Gupta SD, Meher PK. 2006. Passive transfer of maternal antibodies and their existence in eggs, benihe, and fry of Indian major carp, Laboe rohita (Ham.). Fish & shellfish immunology. 20:519-527.
Swain P, Nayak NK. 2009. Role of maternally derived immunity in fish. Journal Fish & Shellfish Immunology. 27:89-99.
Tizard I, 1982. Pengantar Imunologi Veteriner. Surabaya (ID): Universitas Airlangga.
Wang Z, Zhang S, Wang G, An Y. 2008. Complement activity in the egg cytosol of Zebrafish Danio rerio: evidence for the defense role of maternal complement components.Plos one. 3(1):463.
19 (NO) and tumor necrosis factor (TNF)-α. Fish Shellfish Immunol. 29:778-785.
20
Lampiran 1 Hasil validasi Streptococcus agalactiae menggunakan KIT Api 20 Strep
Pengujian Hasil Uji
Produksi acetoin (VP) +
Hidrolisis HIPpuric Acid +
ESCulin -
PYRrolidonyl Arylamidase -
α-Galactosidase -
β-Glucuronidase -
β-Galactosidase -
Alkaline Phosphatase +
Leucine aminopeptidase +
Arginine Dihidrolase +
Ribose +
Arabinose -
Mannitol -
Sorbitol -
Lactose -
Trehalose -
Inulin -
Raffinose -
Amidon/starch -
21 Lampiran 2 Komposisi media yang digunakan untuk pembuatan vaksin
A. Brain Heart Infusion Broth = 37 g/liter ≈ 3.7 g/100 ml Aquadest 1. Calf Brains, Infusion
2. Beef Hearts, Infusion 3. Proteose Pepton, Difco 4. Sodium Chloride 5. Disodium Phosphate 6. Bacto-Dextrose 7. Ph
200 g 250 g 10 g
5 g 2.5 g
2 g 7.4 B. Phosphate Buffer Saline (PBS) = g/liter
1. NaCl 2. KH2PO4 3. Na2HPO4 4. KCl 5. Aquadest 6. pH
8 g 0.2 g 1.5 g 0.2 g 1000 ml 7.0 – 7.4 C. Larutan Neutral Buffer Formalin 3%
1. Na2HPO4 2. NaH2PO 4. H20
3. Formaldehyde Solution min. 37%
0,195 g 0,12 g
22
Lampiran 3 Prosedur preparasi serum induk, cairan tubuh telur dan benih Preparasi serum induk (Harlow & Lane 1988)
a) Darah dikumpulkan dari masing-masing perlakuan melalu pembuluh vena ekor ikan
b) Darah dibiarkan beku pada suhu ruangan selama 30 – 60 menit pada suhu 30°C
c) Cairan bening yang terbentuk dipisahkan dari endapannya dan disimpan pada suhu 4° C overnight.
d) Serum dikumpulkan setelah sentrifugasi pada 10,000 g selama 10 menit pada suhu 4° C dan disimpan pada suhu -20° C
Preparasi cairan tubuh telur dan benih (Sakai 1981)
a) Telur sebanyak 30 butir dan benih ikan masing-masing lima ekor dicuci dengan akuades dan dikeringkan dengan kertas saring.
b) Telur dan benih ikan yang sudah kering dihomogenkan dengan PBS-tween (0,13 ml tween dalam 500 ml PBS) dengan ratio 1 : 4 v/v
c) Disentrifugase 3.000 rpm selama 10 menit.
d) Hasil ekstraksi terdiri atas tiga lapisan, lapisan atas adalah lemak, lapisan kedua berupa serum darah dan cairan tubuh bercampur PBS, dan lapisan ketiga adalah endapan cangkang telur dan jaringan ikan. Lapisan kedua yang diasumsikan sebagai campuran antara serum darah dan cairan tubuh.
23