ISOLASI Bacillus sp. PENGHASIL BAKTERIOSIN DAN PENINGKATAN AKTIVITASNYA SEBAGAI PENGHAMBAT
Vibrio harveyi
ASAHEDI UMORO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Isolasi Bacillus sp. Penghasil Bakteriosin dan Peningkatan Aktivitasnya sebagai Penghambat Vibrio harveyi” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir ditesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Asahedi Umoro
RINGKASAN
ASAHEDI UMORO. Isolasi Bacillus sp. Penghasil Bakteriosin dan Peningkatan Aktivitasnya sebagai Penghambat Vibrio harveyi. Dibimbing oleh NISA RACHMANIA MUBARIK dan WIDANARNI.
Udang merupakan salah satu komoditas unggulan perikanan budidaya, dengan permintaan dunia yang terus mengalami peningkatan. Tantangan terbesar bagi pembudidaya udang saat ini ialah serangan penyakit. Salah satu penyakit penyebab kegagalan panen dalam budidaya udang ialah serangan vibriosis yang disebabkan oleh bakteri Vibrio harveyi. Serangan bakteri patogen Vibrio harveyi ini dapat berakibat terhadap penurunan produksi udang dan kerugian ekonomi bagi pembudidaya udang. Aplikasi Bacillus sp. dapat digunakan sebagai alternatif solusi untuk mengontrol pertumbuhan bakteri patogen pada budidaya udang, karena bakteri Bacillus sp. dapat diaplikasikan sebagai probiotik dan biokotrol yang menghasilkan senyawa antimikrob polipeptida seperti bakteriosin yang dapat menghambat pertumbuhan bakteri patogen.
Bakteriosin merupakan senyawa antimikrob polipeptida yang disintesis di ribosom. Proses sintesis bakteriosin berlangsung selama masa pertumbuhan sel dan mengikuti pola sintesis protein. Umumnya bakteriosin hanya menghambat galur-galur yang berkerabatan dekat dengan bakteri penghasil bakteriosin. Hampir seluruh patogen yang ada dibudidaya perikanan merupakan bakteri gram negatif sehingga galur Bacillus sp. penghasil bakteriosin terpilih harus mampu menghasilkan bakteriosin dengan kemampuan spektrum penghambatannya yang luas sehingga mampu menghambat bakteri Vibrio harveyi yang termasuk patogen Gram negatif.
Tujuan dari penelitian ini ialah mengisolasi Bacillus sp. penghasil bakteriosin asal tambak udang, Pangandaran, Jawa Barat dan melakukan peningkatan aktivitas penghambatannya terhadap Vibrio harveyi. Metode penelitian yang dilakukan antara lain: 1) isolasi Bacillus sp. dilakukan dengan pemanasan pada suhu ± 800 C selama 15 menit untuk memberi peluang tertapisnya Bacillus sp.; 2) seleksi isolat Bacillus sp. yang mempunyai kemampuan antimikrob dilakukan dengan menggunakan metode doube layer dan uji aktivitas penghambat bakteriosin dilakukan dengan menggunakan kertas cakram pada media SWC (Sea Water Complete) padat yang berisi bakteri uji
Vibrio harveyi; 3) isolat Bacillus sp. terpilih dilakukan identifikasi 16S rRNA,
karakteristik morfologi sel, pewarnaan Gram dan endospora; 4) pengendapan protein dilakukan dengan menggunakan amonium sulfat bertingkat 30-80%; 5) perhitungan kadar protein dilakukan dengan menggunakan metode Bradford dan perhitungan bobot molekul dengan metode SDS PAGE; dan 6) dilakukan penguji aktivitas penghambatan bakteriosin dan uji kompetisi Bacillus sp. terhadap Vibrio harveyi pada media tumbuh SWC cair.
isolat tersebut kemudian diuji aktivitas penghambatan bakteriosinnya. Isolat LTP 1 merupakan isolat dengan aktivitas antimikrob terbesar dan dipilih untuk analisis 16S rRNA, produksi bakteriosin pada media pertumbuhan, dan uji antagonis penghambatan terhadap Vibrio harveyi.
Isolat Bacillus LTP 1 telah diidentifikasi sebagai Bacillus subtillis dengan tingkat kesamaaan 96%. Produksi antimikrob bakteriosin isolat LTP 1 terjadi selama fase pertumbuhan dengan aktivitas maksimal antimikrob bakteriosin terjadi pada fase stasioner dengan besar zona hambat 16 mm. Penurunan aktivitas antimikrob bakteriosin terjadi setelah dilakukan perlakuan dengan enzim proteinase K. Pengendapan bakteriosin dengan amonium sulfat 70% memiliki aktivitas penghambatan terbesar dengan indeks penghambatan 2,7 dengan aktivitas unit penghambatan 2490 mm2/ml. Isolat LTP 1 dapat digunakan sebagai penghasil bakteriosin yang potensial dan menghambat Vibrio harveyi.
SUMMARY
ASAHEDI UMORO. Isolation of Bacillus sp. Producing Bacteriocin and Enhancement The Inhibitors Activity toward Vibrio harveyi. Supervised by NISA RACHMANIA MUBARIK dan WIDANARNI.
Shrimp is one of the leading commodity aquaculture with increases in global demand. Shirmp disease is the biggest challenges for shrimp farmers. One of the bacterial disease pathogens cause failures culture in shrimp farming is vibriosis which caused by the Vibrio harveyi. The presence of pathogenic bacteria
Vibrio harveyi in shirmp culture cause a decreasing in shrimp production. Applications Bacillus sp. can be used as an alternative solution to control the growth of pathogenic bacteria in shrimp farming. Bacillus sp. can be applied as probiotic and biocontrol that produce antimicrobial compounds such as bacteriocins that can inhibit the growth of pathogenic bacteria.
Bacteriocin is a polypeptide antimicrobial compounds produced in ribosomes. Process of bacteriocins synthesis during the period growth of bacteria follows the pattern of protein synthesis. Generally bacteriocin only inhibit closely related strains with bacterial producing bacteriocin. While almost all pathogens in the aquaculture is a Gram-negative bacteria so that strains of Bacillus sp. selected should be able to produce bacteriocins with a broad inhibitory spectrum capabilities to inhibit Vibrio harveyi including Gram-negative bacteria.
The aim of study was to isolate bacteriocin producing Bacillus sp. from shrimp farms, Pangandaran, West Java and examined its inhibitory activity toward
Vibrio harveyi. The methods used in this research were: 1) isolation of Bacillus
sp. which performed by heating at 800 C for 15 minutes to give the opportunity selected Bacillus sp.; 2) antimicrobial activity of selected Bacillus sp. was determined using double layer method and test the inhibitory activity of bacteriocins by using paper disc at SWC (Sea Water Complete) solid media containing test bacteria Vibrio harveyi; 3) identification of selected Bacillus sp. by 16S rRNA, cell morphology characterized based on Gram staining and endospore staining; 4) protein precipitation by using ammonium sulfate 30-80%; 5) measurement of the protein content by using Bradford method and calculation molecular weight using SDS PAGE; 6) testing inhibitory activity of bacteriocins and competition test Bacillus sp. against Vibrio harveyi at SWC liquid medium.
From sediment and water from shrimp farms were obtained 22 isolates of
activity with index inhibitory 2,7 and inhibition activity 2490 mm2/ml. The LTP 1 isolate could be used as bacteriocin producer and also could inhibit growth of
Vibrio harveyi.
.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ISOLASI
Bacillus
sp. PENGHASIL BAKTERIOSIN
DAN PENINGKATAN AKTIVITASNYA SEBAGAI
PENGHAMBAT
Vibrio harveyi
ASAHEDI UMORO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penelitian ini berhasil diselesaikan. Penelitian yang berjudul “Isolasi Bacillus sp. Penghasil Bakteriosin dan Peningkatan Aktivitasnya sebagai Penghambat Vibrio harveyi”, ini ditujukkan sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Bioteknologi Sekolah Pascasarjana IPB.
Terima kasih penulis ucapkan kepada semua pihak yang telah membantu dalam penelitian ini baik secara langsung maupun tidak langsung. Ungkapan terima kasih juga disampaikan kepada Dr Nisa Rachmania Mubarik, MSi sebagai ketua komisi pembimbing dan Dr Widanarni, MSi sebagai anggota komisi pembimbing atas bimbingan dan motivasi yang diberikan kepada penulis. Kepada DIKTI atas Beasiswa Unggulan Dalam Negeri selama menempuh pendidikan pascasarjanan di IPB.
Ucapan terima kasih juga disampaikan kepada Ibu tercinta dan Istri tersayang Fadlilah Purna Agustin atas doa dan kasih sayangnya, tim Biotek Hadi Susilo, Rike Tri Kumala Dewi dan Nutika Kurniati, staf Laboratorium Mikrobiologi IPB Ibu Heni dan Bapak Jaka, serta teman-teman di Laboratorium Mikrobiologi IPB dan teman-teman di Sekolah Pacasarjana Biotek angkatan 2012. Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
Biosintesis Bakteriosin ... 5
Mekanisme Kerja Antibakteri Bakteriosin ... 6
Vibrio harveyi ... 6
Sistem Pertahanan Imun Udang 7
METODE ... 9
Kerangka Penelitian ... 9
Waktu dan Tempat ... 9
Bahan Penelitian ... 10
Pengambilan Sampel ... 10
Seleksi Isolat Bacillus sp. ... 10
Uji Aktivitas Penghambatan Antimikrob ... 10
Uji Aktivitas Penghambatan Bakteriosin ... 10
Kurva Tumbuh dan Penentuan Sintesis Bakteriosin ... 11
Pengendapan Amonium Sulfat, Penghitungan Kadar Protein, dan Penentuan Bobot Molekul Protein ... 1122111 Karakterisasi Isolat Bakteri ... 12
Identifikasi Bakteri Terpilih ... 12
Uji Penghambatan Bakteriosin dan Kompetisi Bacillus sp. terhadap Vibrio harveyi secara in vitro ... 12
HASIL DAN PEMBAHASAN ... 13
Isolasi dan Identifikasi Bacillus sp. Penghasil Bakteriosin ... 13
Aktivitas Penghambatan Bacillus sp. ... 13
Kurva Tumbuh dan Sintesis Bakteriosin ... 14
Pengendapan Amonium Sulfat dan Pengitungan Bobot Molekul Bakteriosin ... 15
Identifikasi Molekuler ... 16
Uji Penghambatan Bakteriosin dan Kompetisi Bacillus sp. terhadap Vibrio harveyi secara in vitro ... 17
SIMPULAN DAN SARAN... 11121 Simpulan ... 1721
Saran 22
DAFTAR PUSTAKA ... 22
LAMPIRAN ... 29
RIWAYAT HIDUP ... 35
DAFTAR TABEL 1 Jenis bakteriosin dari genus Bacillus sp. ... 4
2 Kategori kelas senyawa bakteriosin ... 45 3 Karakteristik morfologi koloni dan sel isolat Bacillus sp. terpilih ... 13
4 Aktivitas penghambatan isolat Bacillus sp. terpilih ... 14
5 Perbandingan aktivitas penghambatan sebelum dan sesudah pengendapan ... 15
DAFTAR GAMBAR 1 Kerangka penelitian isolasi Bacillus sp. penghasil bakteriosin dan peningkatan aktivitasnya sebagai penghambat Vibrio harveyi ... 9
2 Kurva pertumbuhan isolat LTP 1 media pertumbuhan SWC cair selama 24 jam pada suhu ± 280 C ... 14
3 Hasil pengendapan amonium sulfat ... 15
4 Penentuan bobot molekul bakteriosin isolat LTP1 dengan SDS PAGE ... 16
5 Identifikasi molekuler gen 16S rRNA ... 16
6 Uji kompetisi penghambatan Vibrio harveyi pada media SWC cair ... 17
7 Turbiditas pertumbuhan Vibrio harveyi pada perlakuan penambahan bakteriosin hasil pengendapan amonium sulfat selama 12 jam inkubasi ... 17
DAFTAR LAMPIRAN 1 Komposisi bahan yang digunakan ... 29
2 Data indeks penghambatan isolat Bacillus sp... 30
3 Pengujian antimikrob Bacillus sp. ... 31
4 Pengujian bakteriosin. ... 32
1
PENDAHULUAN
Latar Belakang
Udang merupakan salah satu komoditas unggulan perikanan budidaya, dengan permintaan dunia yang terus mengalami peningkatan. Indonesia termasuk negara terbesar pengekspor udang vaname (Litopenaeus vannamei) di dunia selain beberapa negara seperti Ekuador, Thailand, Vietnam, China, India, dan Malaysia (FAO 2015). Sebagai salah satu negara pengekspor udang terbesar di dunia, produksi udang dilakukan dengan sistem budidaya intensif dengan padat tebar dan pemberian pakan yang tinggi. Pakan yang diberikan pada saat budidaya udang tidak semua dimanfaatkan oleh udang, akan tetapi sebagian akan terbuang ke perairan sebagai limbah yang berpotensi menurunkan kualitas lingkungan dan meningkatkan serangan penyakit. Salah satu penyakit bakteri yang paling serius dan menyebabkan kematian masal pada udang adalah vibriosis yang disebabkan oleh bakteri patogen Vibrio harveyi (Zokaeifar et al. 2013). Bakteri ini merupakan salah satu penyebab kegagalan dalam budidaya udang akibat adanya kematian masal pada semua stadia udang mulai stadia nauplius, zoea, mysis, dan postlarva sampai udang dewasa di tambak pembesaran (Saulnier et al. 2000), serta berdampak pada penurunan jumlah produksi dan menimbulkan kerugian ekonomi (Muliani et al. 2003; Nasi et al. 2007).
Berbagai upaya pengendalian penyakit vibriosis telah dilakukan salah satunya dengan penggunan antibiotik. Penggunaan antibiotik dalam pengendalian penyakit telah dilarang, karena dapat menyebabkan resistensi patogen terhadap antibiotik dan adanya akumulasi residu antibiotik pada udang sebagai bahan pangan. Alternatif pengendalian penyakit udang yang disebabkan Vibrio harveyi secara biologi di tambak udang ialah dengan memanfaatkan Bacillus sp. Bakteri ini diketahui sebagai bakteri probiotik yang dapat memberikan pengaruh menguntungkan pada inang dengan meningkatkan penyerapan nilai nutrisi sehingga meningkatkan pertumbuhan dan kelangsungan hidup udang, memperbaiki kualitas lingkungan, memperbaiki respon inang terhadap penyakit dan mempunyai kemampuan untuk menghasilkan senyawa antimikrob peptida yang mampu untuk menghambat pertumbuhan bakteri patogen (Irina et al. 2001; Nimrat et al. 2012; Widanarni et al. 2015).
Senyawa antimikrob peptida berupa bakteriosin dan BLIS (Bacteriocin
like inhibitory substance) yang dihasilkan oleh Bacillus sp. memiliki efek
bakteri Gram negatif, mampu hidup pada kondisi pH rendah, dan tidak sensitif terhadap zat antibiotik (Ahern et al. 2013).
Kemampuan bakteri Bacillus sp. untuk memproduksi senyawa bakteriosin dengan spektrum penghambatan yang lebih luas diharapkan dapat menekan Vibrio harveyi. Penggunaan bakteriosin sebagai pengganti antibiotik memiliki keunggulan yaitu tidak meninggalkan residu pada udang dan dapat terdegradasi oleh enzim protease karena merupakan senyawa peptida, sehingga aman digunakan dibandingkan dengan antibiotik. Mekanisme kerja penghambatan bakteriosin yaitu diawali dengan bakteriosin berinteraksi dengan struktur permukaan sel, seperti membran dan atau molekul reseptor kemudian bakteriosin membuat membran menjadi permeabel melalui pembentukan lubang sehingga mampu membunuh target bakteri patogen (Nes et al. 2007).
Isolasi dan seleksi bakteri Bacillus sp. dari lingkungan perairan budidaya udang yang berpotensi menghasilkan senyawa antimikrob bakteriosin dilakukan dalam penelitian ini. Bakteriosin yang dihasilkan diharapkan dapat menekan dan mengendalikan bakteri patogen Vibrio harveyi yang menyerang udang dan penyebab kegagalan panen.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolat Bacillus sp. penghasil bakteriosin dari lingkungan tambak udang, Pangandaran, Jawa Barat dan melakukan peningkatan aktivitas penghambatannya terhadap Vibrio harveyi.
Manfaat Penelitian
Dari hasil penelitian ini diharapkan diperoleh isolat Bacillus sp. sebagai penghasil senyawa antibakteri bakteriosin yang potensial yang dapat menghambat pertumbuhan Vibrio harveyi penyebab kegagalan panen pada budidaya udang vaname.
Hipotesis
3
TINJAUAN PUSTAKA
Bacillus sp. dalam Akuakultur
Spesies Bacillus adalah bakteri berbentuk batang, aerob atau fakultatif anaerob, dan dapat membentuk endospora. Banyaknya spesies pada genus ini menunjukkan luasnya kemampuan fisiologi yang memungkinkan bakteri ini dapat hidup pada setiap lingkungan alam. Bacillus sp. yang digunakan sebagai probiotik pada budidaya udang dapat ditemukan pada sedimen dan saluran pencernaan udang (Moriarty 1999). Penggunaan Bacillus sp. sebagai probiotik di tambak udang dapat menghambat bakteri patogen udang karena Bacillus sp. dapat menghasilkan zat antimikrob polipeptida yang disebut bakteriosin (Lisboa et al. 2006). Perkembangan penelitian mikrob yang menguntungkan bagi akuakultur mulai dicoba diisolasi dari banyak bahan mikrob air laut, sedimen ataupun organ hewan yang mampu menghasilkan senyawa antimikrob yang dapat menghambat pertumbuhan bakteri patogen secara in vitro (Rengpipat et al.1998). Bacillus sp. dapat berperan sebagai probiotik atau biokontrol yang dapat menekan pertumbuhan bakteri patogen melalui berbagai mekanisme, misalnya memproduksi senyawa penghambat (Nimrat et al. 2012).
Probiotik ialah mikrob hidup yang memberikan pengaruh menguntungkan pada inang dengan memodifikasi komunitas mikrob, memperbaiki nilai nutrisi, memperbaiki respon inang terhadap penyakit, dan memperbaiki kualitas lingkungan. Secara umum probiotik untuk budidaya perairan diseleksi berdasarkan kemampuannya dalam memproduksi senyawa antibakteri. Mekanisme kerja bakteri probiotik dapat dibagi menjadi beberapa cara yaitu: (1) produksi senyawa inhibitor; (2) kompetisi terhadap senyawa kimia atau sumber energi; (3) kompetisi terhadap tempat pelekatan; (4) peningkatan respon imun, (5) perbaikan kualitas air; dan (6) interaksi dengan fitoplankton (Verschuere et al. 2000). Penggunaan probiotik pada pemeliharaan udang yang terinfeksi oleh
Vibrio harveyi mampu meningkatkan sintasan udang vaname hingga 79.17%
(Widanarni et al. 2014).
Beberapa probiotik Bacillus sp. yang telah digunakan dalam bidang akuakultur diantaranya B. subtilis, B. megaterium, B. polymyxa, B. licheniformis,
dan B. pumilus yang diketahui berperan dalam pertumbuhan, merangsang sistem
imun, meningkatkan kelulushidupan, serta menghambat bakteri patogen seperti
Vibrio harveyi (Newaj-Fyzul et al. 2014). Probiotik Bacillus sp. merupakan
probiotik umum yang diaplikasikan dan selalu ada pada beberapa produk komersial dibidang akuakultur karena Bacillus sp. memiliki kemampuan yang efektif untuk daya pelekatan (adhesion) pada saluran cerna, menyediakan sistem imunostimulan pada udang, kemampuannya yang dapat membentuk endospora untuk penyimpanan, serta mampu menghasilkan antimikrob peptida berupa bakteriosin (Irina et al. 2001; Watson et al. 2008).
Bakteriosin
berlangsung selama masa pertumbuhannya dan umumnya hanya menghambat galur-galur yang berkerabatan dekat dengan bakteri penghasil bakteriosin (Kone dan Fung 1992; Jack et al.1995; Drider et al. 2006). Senyawa antimikrob polipeptida tersebut merupakan senyawa antagonis heterogenus yang menunjukkan beragam bobot molekul, sifat biokimia, spektrum penghambatan dan mekanisme kerjanya, serta tersusun dari 20 sampai 60 asam amino (Nes dan Holo. 2000; Prasad et al. 2005; Lisboa et al. 2006). Bakteriosin pada bakteri Gram positif umumnya berukuran kecil, stabil terhadap panas dan aktivitas antimikrobnya memiliki spektrum yang lebih luas dari pada bakteriosin dari bakteri Gram negatif (Jack et al. 1995), (Tabel 1).
Tabel 1 Jenis bakteriosin dari genus Bacillus sp.
No Organisme
3 B. licheniformis Bacillocin 490
Peptide A12C 7 B. polyfermenticus Polyfermenticin
SCD
14,3
Lee et al. (2001)
8 B. thuringiensis Thuricin 439
Thuricin 17
2,9 3,2
Ahern et al. (2003) Gray et al. (2006)
5
stabil panas, mengandung peptida dengan BM < 10 kDa; dan kelas 3 bakteriosin dengan BM > 30 kDa, sensitif panas (Tabel 2).
Tabel 2 Katagori kelas senyawa bakteriosin
Katagori
Subkatagori Contoh Sumber
Kelas I
Mersacidin (Bacillus sp. Galur HIL Y-85,54728)
Biosintesis bakteriosin dengan bobot molekul rendah yang dihasilkan oleh bakteri Gram positif diawali dengan pembentukan prapeptida yaitu bakteriosin yang belum aktif, dengan ujung N penuntun (N-terminal leader sequence) yang pendek. Ujung ini terpisah pada saat pematangan dengan bantuan endopeptidase (de Vost et al. 1991). Contoh pada lantibiotik pemisahan terjadi pada asam amino prolin, sedangkan pada non lantibiotik terjadi pada asam amino glisin. Pemisahan ini untuk mempermudah prapetida bergandengan dengan peptida lain yang tepat. Ujung penuntun N ini berperan penting untuk mengarahkan proses pematangan berupa penggandengan prapetida dengan peptida lain untuk membentuk bakteriosin aktif, pelepasan bakteriosin aktif ke ekstraseluler dari model hipotesis biosintesis pediocin AcH yang berbentuk bebas atau terikat pada dinding sel (Jack et al.1995).
Mekanisme Kerja Antibakteri Bakteriosin
Mekanisme kerja bakteriosin diketahui bergantung pada konsentrasi bakteriosin, kemampuan ionisasi, suhu, pH dan fase pertumbuhan sel target. Spektrum antimikrob didefinisikan sebagai satuan galur yang sensitif terhadap bakteriosin yang diberikan. Sensitivitas ini tergantung dua tahap pada model in vivo. Tahap pertama, bakteriosin berinteraksi dengan struktur permukaan sel, seperti membran dan atau molekul reseptor. Tahap kedua, bakteriosin membuat permeabilisasi membran melalui pembentukan lubang. Pengikatan awal dipengaruhi oleh komposisi membran, muatan membran, dan adanya struktur molekul target (reseptor). Tahap kedua dipengaruhi oleh komposisi membran, struktur C terminal pada bagian membran yang permeabilisasi dan adanya protein imunitas dari bakteri penghasil (Drider et al. 2006).
Umumnya kebanyakan bakteriosin aktif di membran yang menyebabkan permeabillisasi dan kadang membunuh bakteri target. Beberapa bakteriosin jenis lantibiotik jenis A dan B mampu membunuh sel target bakteri dengan menghentikan sintesis dinding sel melalui ikatan dengan afinitas besar pada molekul lipid II, suatu molekul yang memainkan peran esensial pada sintesis lapisan peptidoglikan. Bakteriosin lantibiotik jenis A juga dapat membunuh bakteri dengan mekanisme tambahan, yaitu terikat pada molekul lipid dan kemudian, membuat lubang di membran sitoplasma target. Mekanisme pembentukan lubang oleh lantibiotik jenis A ialah mekanisme pembunuhan yang paling penting. Mekanisme pembentukan lubang yang mirip juga ditunjukkan oleh lantibiotik dua peptida lacticin 3147 (Nes et al. 2007).
Vibrio harveyi
7
energi. Bakteri ini selain ditemukan di perairan air laut, air tawar dan juga dapat ditemukan pada perairan air payau (Logan 1994).
Vibrio harveyi merupakan salah satu agen penyakit vibriosis yang banyak menyerang udang vaname, yang menyebabkan penyakit udang berpendar serta merupakan patogen oportunistik yang umum dijumpai di lingkungan pemeliharaan udang atau ikan laut. Jika kondisi kesehatan udang menurun maka bakteri ini akan bersifat patogen (Lavilla-Pitogo et al. 1990). Berdasarkan hasil penelitian Widanarni et al. (2012) tingkat kematian udang vaname yang diinfeksi
V. harveyi dengan dosis 106 cfu/ml mencapai 31,67%. Vibrio dapat berperan
sebagai patogen primer ataupun patogen sekunder, sebagai patogen primer Vibrio masuk melalui kontak langsung dengan organisme, sedangkan sebagai patogen sekunder, Vibrio menginfeksi organisme yang telah terlebih dahulu terinfeksi penyakit lain.
Lima jenis penyakit yang disebabkan oleh bakteri Vibrio dan dapat menyebabkan kematian pada udang antara lain: tail necrosis, shell disease, red disease, loose shell syndrome (LSS) dan white gut disease (WGD). Infeksi Vibrio terjadi melalui infeksi lewat pakan, insang, dan hepatopankreas. Vibrio akan berkoloni pada jaringan utama udang setelah Vibrio melewati jaringan epitel (Lightner 1993; Jayasree et al. 2006). Penyakit vibriosis disebabkan oleh Vibrio terjadi ketika udang mengalami stres karena beberapa faktor seperti kualitas air yang jelek, kepadatan yang tinggi, suhu air yang tinggi, rendahnya oksigen, dan rendahnya pergantian air yang dilakukan selama budidaya (Brock and Lightner 1990).
Sistem Pertahanan Imun Udang
Sistem imun pada hewan merupakan upaya proteksi terhadap infeksi maupun melindungi fisiologik homeostasi udang. Respon imunitas hewan akuatik terdiri atas respon nonspesifik dan spesifik, mekanisme pertahanan udang bersifat nonspesifik atau kurang mengembangkan sistem kekebalan spesifik dengan memori yang sangat lemah (tidak memiliki sel memori), dibandingkan vertebrata tingkat tinggi lainnya yang mempunyai antibodi spesifik atau komplemen (Itami et al. 1994). Mekanisme pertahanan pada krustasea sebagian besar bergantung pada sel-sel darah dan proses hemolim. Darah udang tidak mengandung haemoglobin, sehingga darahnya tidak berwarna merah. Peran haemoglobin digantikan oleh haemosianin, yaitu suatu protein mengandung Cu yang berfungsi untuk transpor oksigen dan sebagai bufer dalam darah krustasea. Hemosit memainkan peranan penting pada pertahanan tubuh krustasea, yaitu dapat menghilangkan partikel asing yang masuk ke tubuh udang, meliputi tahap-tahap pengenalan, fagositosis, melanisasi, sitotoksis, dan komunikasi sel (Johansson et al. 2000).
Cerenius 1992). Sistem pertahanan selular meliputi fagosit sel-sel hemosit, nodulasi dan enkapsulasi. Sistem pertahanan humoral mencakup phenoloksidase (PO), prophenoloksidase (proPO), letin, dan aglutinin. Kedua sistem ini bekerja sama memberikan perlindungan tubuh terhadap infeksi organisme patogen dari lingkungan (Itami et al. 1994).
Pencegahan penyakit merupakan upaya alternatif untuk menanggulangi penyebaran penyakit. Salah satu alternatif yang dapat digunakan yaitu dengan menggunakan imunostimulan untuk meningkatkan kekebalan tubuh udang. Salah satu mekanisme peningkatan sistem imunitas udang ialah dengan menggunakan bakteri probiotik yang dapat menstimulasi sistem imun dari udang dengan menekan mekanisme competitive ecxlucion dengan menekan pertumbuhan bakteri patogen (senyawa antimikrob, bakteriosin) pada lingkungan hidup udang serta menghasilkan senyawa-senyawa biologi (glukan, peptidoglikan, dan lipopolisakarida) yang dapat meningkatkan aktivitas imun (fagositosis dan aktivitas proPO) pada udang (Johansson et al. 2000).
9
METODE
Kerangka Penelitian
Kerangka penelitian meliputi: isolasi Bacillus sp. dari air dan sedimen lumpur tambak udang daerah Pangandaran – Jawa Barat, seleksi isolat penghasil antimikrob, uji aktivitas bakteriosin, identifikasi isolat terpilih, pengendapan bakteriosin dengan ammonium sulfat, uji kandungan protein dan perhitungan bobot molekul protein (Gambar 1).
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Maret 2014 sampai Maret 2015. Penelitian dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
Gambar 1 Kerangka penelitian isolasi Bacillus sp. penghasil bakteriosin dan peningkatan aktivitasnya sebagai penghambat Vibrio harveyi
Isolasi dan seleksi isolat Bacillus sp.
Uji kompetisi bakteriosin dan Bacillus sp. terhadap V. harveyi pada media
SWC cair secara in vitro
Air dan sedimen dari tambak udang daerah Pangandaran; identifikasi morfologi, pewarnaan gram dan endospora; uji patogen agar-agar darah
Indeks penghambatan sel
a) Uji indeks penghambatan supernatan bebas sel (pH 7) b) Uji sensitivitas proteolitik
(proteinase K)
c) Aktivitas penghambatan (mm2/ml) a) Penentuan kurva tumbuh dan
sintesis bakteriosin
b) Identifikasi molekuler 16S rRNA
a) Uji aktivitas penghambatan Vibrio harveyi
b) Perhitungan kadar protein dan bobot molekul protein
Bahan Penelitian
Bahan yang digunakan pada penelitian ini adalah sampel air dan sedimen lumpur yang diambil dari tambak udang daerah Pangandaran – Jawa Barat dengan koordinat 7°41'- 7°45"LS dan 108°30- 108°35'BT.
Pengambilan Sampel
Sampel air tambak diambil sebanyak 100 ml sedangkan sedimen lumpur tambak diambil kira-kira 100 g kemudian dimasukkan ke dalam botol sampel. Semua sampel disimpan di dalam kondisi dingin hingga sampai di laboratorium (Jamilah et al. 2011).
Seleksi Isolat Bacillus sp.
Sampel diencerkan dengan garam fisiologis hingga pengenceran 10-4- 10-6 kemudian dipanaskan di dalam penangas air pada suhu 80 0C selama 15 menit. Sebanyak 0.1 mL sampel kemudian disebar pada media agar-agar SWC (seawater complete) (Lampiran 1), kemudian diinkubasi pada suhu ruang. Metode ini memberi peluang bagi tertapisnya Bacillus sp. (Jamilah et al. 2011).
Uji Aktivitas Penghambatan Antimikrob
Isolat bakteri Bacillus sp. dan bakteri V. harveyi diremajakan pada media SWC, kemudian diinkubasi selama ± dua hari. Untuk mengetahui kemampuan isolat bakteri Bacillus sp. yang menghasilkan zat antimikrob dalam menghambat
V. harveyi maka sebanyak 50 µl biakan bakteri V. harveyi dengan kepadatan sel
106 CFU/ml disuspensikan dalam 50 ml SWC semipadat, kemudian dituang sekitar ± 10 ml pada permukaan SWC padat dan didiamkan beberapa saat hingga beku. Selanjutnya isolat bakteri Bacillus sp. yang berumur dua hari digores atau ditotolkan pada agar-agar SWC yang sudah berisikan bakteri V. harveyi dengan menggunakan jarum ose dan diinkubasi pada suhu ± 280 C selama 24 jam. Bakteri yang memiliki kemampuan dalam menghasilkan senyawa antimikrob menunjukkan adanya zona bening (zona penghambatan) di sekitar koloni dan dihitung indeks penghambatannya dengan menggunakan persamaan (Isramilda 2007).
11
kecepatan 10.000 rpm (Sentrifuge Hermle dengan rotor 220.97) selama lima menit. Supernatan dilakukan penetralan pada pH 7 dengan penambahan 0,1 M NaOH. Sebanyak 100 µl biakan bakteri V. harveyi dengan kepadatan sel 106 CFU/ml dituang pada media agar-agar SWC dan dilakukan penggoresan dengan menggunakan cotton bud steril untuk meratakan. Sebanyak 10-20 µl supernatan diteteskan ke kertas cakram berukuran 5 mm dengan ketebalan 2 mm. Kemudian diinkubasi selama 24 jam pada suhu ± 280 C dan zona bening (zona penghambatan) yang terbentuk dihitung (Sharma et al. 2011) dan Aktivitas penghambatan (mm2/ml) bakteriosin dihitung dengan persamaan (Usmiati dan Marwati 2007).
Akitivitas hambat (mm2/ml) =
(ml)
Pengujian kepekaan supernatan bebas sel (bakteriosin) terhadap enzim proteolitik dilakukan untuk memastikan aktivitas penghambatan bakteriosin terhadap V. harveyi disebabkan oleh senyawa protein bakteriosin bukan oleh senyawa lainya. Pengujian kepekaan enzim proteolitik dilakukan dengan menambahkan enzim proteinase K (1 mg/ml) sebanyak 10 µl pada supernatan bebas sel 100 µl dan diinkubasi selama 2 jam pada suhu ± 280 C kemudian diuji aktivitas penghambatan terhadap V. harveyi (Nguyen et al. 2014).
Kurva Tumbuh dan Penentuan Sintesis Bakteriosin
Satu lup isolat Bacillus sp. terpilih berumur 24 jam dan memiliki aktivitas penghambatan terbesar ditumbuhkan pada 10 ml media SWC cair kemudian ditumbuhkan selama 12 jam. Kemudian kultur dipindahkan sebanyak 1,5 ml ke dalam media cair 150 ml dan diinkubasi selama 24 jam untuk diamati pertumbuhan sel dengan mengukur absorbansinya pada panjang gelombang 600 nm setiap 3 jam. Penentuan sintesis bakteriosin dilakukan setiap 3 jam selama 24 jam dengan mengambil sebanyak 3 ml kultur ke dalam tabung mikro dan dilakukan sentrifuse pada kecepatan 10.000 rpm (Centrifuge Hermle dengan rotor 220,97) selama 5 menit kemudian supernatan bebas sel diuji aktivitas antimikrobnya terhadap V. harveyi (Lisboa et al. 2006) dan dihitung kadar proteinnya.
Pengendapan Amonium Sulfat, Penghitungan Kadar Protein, dan Penentuan Bobot Molekul Protein
bobot molekul ditentukan dengan menggunakan 12% gel pemisah dan 4% gel penumpuk. Kondisi elektroforesis ialah 50 mA, 100 volt selama 30 menit. Hasil elektroforesis diwarnai oleh Coomasie Brilliant Blue G-250 (CBB G-250). Bobot molekul sampel dihitung dengan menggunakan kurva standar bobot molekul protein (Oscariz et al. 1999).
Karakterisasi Isolat Bakteri
Isolat Bacillus sp. dikarakterisasi berdasarkan ciri-ciri morfologi dan fisiologi berdasarkan: pewarnaan Gram, dan spora mengikuti Bergey’s Manual of Determintive Bacteriology.
Identifikasi Bakteri Terpilih
Isolasi DNA genom dilakukan menggunakan Geneid Presto Mini gDNA Bacteria Kit. Primer yang digunakan ialah primer spesifik untuk prokariot, 63f
(5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan 1387r (5’-GGG CGG WGT GTA CAA GGC-3’) (Marchesi et al.1998). Komposisi reaksi PCR dengan volume reaksi 50 µl yang mengandung 25 µl mix PCR, 0.8 µl DNA template, 0.5 µl primer forward (10 pmol), 0.5 µl primer reverse (10 pmol) dan 23.2 µl ddH2O steril. Kondisi PCR yaitu pradenaturasi (94 0C, 5 menit), denaturasi (94 0C, 1 menit), annealing (55 0C, 1 menit), elongation (72 0C, 1 menit), dan post
elongation (720C, 7 menit) sebanyak 27 siklus. Elektroforesis dengan
menggunakan agarosa 1% pada tegangan listrik 80 Volt selama 45 menit. Visualisasi DNA dilakukan di atas UV transiluminator menggunakan pewarna Etidium Bromida (EtBr). DNA hasil amplifikasi disekuen untuk mengetahui urutan basa nukleotidanya. Urutan basa nukleotida hasil sekuen kemudian disejajarkan dengan data GeneBank menggunakan program BLASTN (Basic Local Alignment Search Tool-Nucleotida) dari situs NCBI (National Center for Biotechnology Information). Analisis filogenetik dilakukan menggunakan program MEGA 5 dengan metode Neighbour Joining (NJ) dengan bootstrap 1000x(Tamura 2007).
Uji Penghambatan Bakteriosin dan Kompetisi Bacillus sp. terhadap Vibrio harveyi secara in vitro
13
50 µl) dan 1:2 (100 µl : 50 µl) diinkubasi selama 24 jam. Jumlah sel V. harveyi yang tumbuh dihitung dengan metode cawan sebar pada media TCBS padat.
Kemampuan kompetisi ditentukan dengan menghitung jumlah Vibrio harveyi dengan metode cawan sebar. Penentuan persentase penghambatan dihitung dengan persamaan.
Persen Penghambatan = x100%
Kontrol Perlakuan
-Kontrol
HASIL DAN PEMBAHASAN
Isolasi dan Identifikasi Bacillus sp. Penghasil Bakteriosin
Sebanyak 22 isolat Bacillus sp. diperoleh dari sampel sedimen lumpur dan air tambak udang Pangandaran, Jawa Barat. Dari 22 isolat yang didapat dilakukan seleksi penghambatan terhadap bakteri Vibrio harveyi dan diperoleh 12 isolat yang mempunyai aktivitas antimikrob (Lampiran 2). Hasil seleksi dari 12 isolat tersebut dipilih lima isolat terbaik, yaitu: LTP 1, LTP 4, LTP 6, LTP 14, dan ATP 2, yang memiliki indeks penghambatan terbesar untuk diamati karakteristik morfologi isolat dan diuji lanjut aktivitas antimikrob bakteriosin (Tabel 3).
Tabel 3 Karakteristik morfologi koloni dan sel isolat Bacillus sp. terpilih
No Morfologi Isolat Bacillus sp. Terpilih
LTP 1 LTP 4 LTP 6 LTP 14 ATP 2
Koloni
1 Tepi Utuh Berombak Berombak Berombak Utuh
2 Elevasi Timbul Rata Melengkung Melengkung Timbul
3 Warna Putih
Aktivitas Penghambatan Bacillus sp.
Hasil uji aktivitas penghambatan kelima isolat Bacillus sp. terhadap V.
harveyi (sel 106 cfu/ml) menunjukkan bahwa indeks penghambatan yang didapat
penghambatan terhadap V. harveyi jika dibandingkan dengan tanpa penambahan enzim proteinase K (Tabel 4).
Tabel 4 Aktivitas penghambatan isolat Bacillus sp. terpilih terhadap V. harveyi
No Asal
Isolat Isolat
Indeks Penghambatan Aktivitas hambat mm2/ml
Protein mg/ml
Kepekaan enzim proteolitik Sel Supernata
n
1 Sedimen LTP 1 1,77±0,93 1,93±0,12 1492 0,0834 + 2 Sedimen LTP 4 1,26±0,16 1,67±0,31 1199 0,0697 + 3 Sedimen LTP 6 1,22±0,38 1,53±0,31 1063 0,0661 + 4 Sedimen LTP 14 1,07±0,81 1,8±0,20 1342 0,0796 + 5 Air ATP 2 1,53±0,35 1,73±0,31 1270 0,0763 +
Kurva Tumbuh dan Sintesis Bakteriosin
Isolat LTP 1 yang merupakan isolat dengan kemampuan penghambatan terbaik dipilih untuk dilakukan pengamatan terhadap laju fase pertumbuhan, waktu sintesis bakteriosin, dan pengukuran kadar proteinnya. Sintesis bakteriosin sudah mulai terjadi pada fase logaritmik, aktivitas penghambatan supernatan (bakteriosin) mulai terjadi pada waktu pengamatan jam ke-9 dengan zona hambat yang terjadi 8 mm sedangkan penghambatan sel bakteri Bacillus sp. terjadi pada jam ke-3 dengan zona hambat 7,3 dan nilai kadar protein selama fase pertumbuhan berkisar antara 16,7 x 10-2 mg/ml sampai 69,4 x 10-2 mg/ml (Gambar 2).
Gambar 2 Kurva pertumbuhan isolat LTP 1 pada media pertumbuhan SWC cair selama 24 jam pada suhu ± 280 C. a) aktivitas penghambatan ( logsel, zona hambat sel, zona hambat supernatan/crude bakteriosin); b) kadar protein ( kadar protein supernatan, logsel)
15
Pengendapan Amonium Sulfat dan Perhitungan Bobot Molekul Bakteriosin
Pengendapan dengan menggunakan amonium sulfat dilakukan secara bertingkat dengan penambahan amonium sulfat 10% mulai pengendapan 30%-80%. Hasil pengendapan 60-70% dan 70-80% menunjukkan aktivitas penghambatan tertinggi dengan nilai penghambatan sebesar 18,5 mm dan 16,5 mm (Gambar 3). Peningkatan zona hambat sebesar 142% terjadi pada pengendapan 60-70% dengan nilai aktivitas hambat sebesar 2490 mm2/ml dan peningkatan zona hambat sebesar 126 % untuk pengendapan 70-80% dengan nilai aktivitas hambat 1941 mm2/ml jika dibandingkan dengan ekstrak kasar supernatan sebelum pengendapan (Tabel 3).
s
Gambar 3 Hasil pengendapan amonium sulfat ( supernatan, hasil pengendapan bakteriosin). a) nilai kadar protein hasil pengendapan dan; b) penghambatan terhadap Vibrio harveyi
Tabel 5 Perbandingan aktivitas penghambatan sebelum dan sesudah pengendapan
No Perbandingan
Hasil perhitungan bobot molekul protein hasil pengendapan bakteriosin dengan SDS PAGE menunjukkan bahwa bobot molekul dari bakteriosin ekstrak kasar dan bakteriosin hasil pengendapan bervariasi antara 10,03 kDa hingga sekitar 22,46 kDa (Gambar 4).
a
b
a b
Gambar 4 Penentuan bobot molekul bakteriosin isolat LTP 1 dengan SDS PAGE. Keterangan: 1) ekstrak kasar; 2) pengendapan 70% bakteriosin; 3) pengendapan 80% bakteriosin
Identifikasi Molekuler
Daerah gen 16S rRNA merupakan daerah yang konservatif pada makhluk hidup dan menunjukkan ciri spesifik pada setiap spesies. Hasil visualisasi amplifikasi gen 16S rRNA pada gel agarosa 1 % dihasilkan produk pita DNA dengan ukuran ± 1300 pasang basa (Gambar 5a). Analisis sekuen gen 16S rRNA dengan data pada Genbank pada program BLAST-N menunjukkan bahwa isolat
Bacillus LTP1 termasuk dalam Bacillus subtilis dengan nilai kesamaan 96%.
Sedangkan berdasarkan kontruksi pohon filogenetik untuk mengetahui kekerabatan isolat LTP 1 dengan data pada GenBank menujukan isolat LTP 1 berada dalam satu klad atau group dengan Bacillus subtilus galur DSM 10 (Gambar 5b).
Gambar 5 Identifikasi molekuler gen 16S rRNA a) hasil amplifkasi gen 16S rRNA dan; b) kontruksi filogenetik isolat LTP 1
0.02 96
85 78
10 kDa
1 2 3
15 kDa
20 kDa 25 kDa 200 kDa
17
Uji Penghambatan Bakteriosin dan Kompetisi Bacillus sp. terhadap Vibrio harveyi secara in vitro
Hasil uji kompetisi penghambatan bakteriosin dan Bacillus LTP 1 terhadap
V. harveyi pada kultur cair selama 24 jam inkubasi menunjukkan adanya
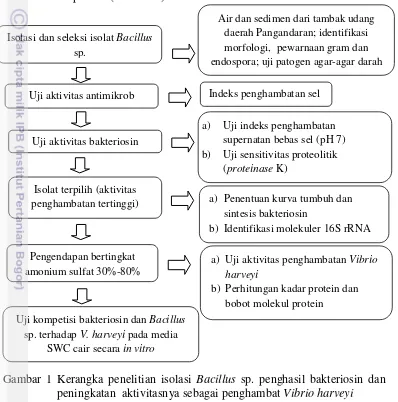
kemampuan penghambatan terhadap pertumbuhan V. harveyi. Persentase penghambatan bakteriosin tertinggi terjadi pada bakteriosin hasil pengendapan 70 % dengan perbandingan 2:1 yaitu sebesar 59,36 % sedangkan penghambatan untuk isolat Bacillus LTP 1 terhadap pertumbuhan V. harveyi terbesar terjadi pada perlakuan konsentrasi 2:1 dengan penghambatan 43,07 % (Gambar 6).
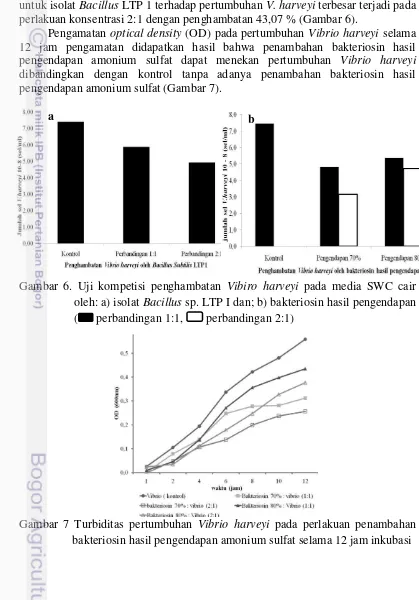
Pengamatan optical density (OD) pada pertumbuhan Vibrio harveyi selama 12 jam pengamatan didapatkan hasil bahwa penambahan bakteriosin hasil pengendapan amonium sulfat dapat menekan pertumbuhan Vibrio harveyi dibandingkan dengan kontrol tanpa adanya penambahan bakteriosin hasil pengendapan amonium sulfat (Gambar 7).
Gambar 6. Uji kompetisi penghambatan Vibiro harveyi pada media SWC cair oleh: a) isolat Bacillus sp. LTP I dan; b) bakteriosin hasil pengendapan ( perbandingan 1:1, perbandingan 2:1)
Gambar 7 Turbiditas pertumbuhan Vibrio harveyi pada perlakuan penambahan bakteriosin hasil pengendapan amonium sulfat selama 12 jam inkubasi
PEMBAHASAN
Penapisan Bacillus sp. dari sedimen lumpur dan air tambak udang Pangandaran di Jawa Barat dilakukan dengan cara memanaskan sampel dalam larutan garam fisiologis pada suhu 800 C selama 15 menit. Metode ini sudah menjadi cara yang umum dilakukan untuk menyeleksi Bacillus dari sampel alam, karena bakteri ini merupakan bakteri penghasil endospora. Endospora akan tahan terhadap suhu pemanasan dan bakteri yang tertapis ialah kelompok Bacillus. Bakteri ini memiliki ciri-ciri koloni yang spesifik seperti permukaan yang berpati, umumnya berwarna krem keputihan atau kekuningan jika ditumbuhkan pada media padat. Bacillus sp. dari tambak udang diperkirakan termasuk kepada kelompok bakteri mesofilik. Suhu perairan tambak udang berkisar antara 26-320 C (Jamilah et al. 2011). Pada penelitian ini, sedimen lumpur merupakan sumber
Bacillus yang paling dominan dibandingkan dengan sampel air. Hal ini diduga
karena banyaknya nutrisi dari sisa pakan yang ikut terakumulasi pada sedimen sebagai sumber nutrisi bagi kelangsungan hidup Bacillus.
Lima isolat terpilih merupakan isolat yang memiliki aktivitas penghambatan terbesar yang ditandai dengan terbentuknya zona bening di sekitar koloni pada media SWC padat yang mengandung bakteri uji Vibrio harveyi. Zona bening mengindikasikan isolat memiliki kemampuan menghasilkan senyawa antimikrob yang dapat menghambat pertumbuhan Vibrio harveyi (Lampiran 3). Faktor yang dapat mempengaruhi besar kecilnya aktivitas penghambatan zat antimikrob antara lain:1) jenis, umur dari bakteri penghasil bakteriosin dan bakteri uji; 2) konsentrasi zat antimikrob bakteriosin dan jumlah inokulum atau kepadatan bakteri uji; 3) resistensi dari bakteri terhadap substansi zat antimikrob terkait dengan perbedaan dinding sel dari bakteri uji; 4) kadar substansi aktif atau gugus fungsi dari substansi senyawa antimikrob (Frazier dan Westhoff 1981; Usmiati et al. 2009; Noaman et al. 2014).
Bakteriosin merupakan senyawa aktif antimikrob yang bersifat ekstraseluler yang disintesis keluar sel. Senyawa antimikrob selain terdapat di dalam sel, juga merupakan komponen permukaan sel yang dihasilkan pada kondisi tertentu dan dilepas dari sel ke dalam lingkungan sekitarnya. Oleh karena itu sel bakteri yang telah ditumbuhkan di dalam media cair akan melepaskan zat antimikrobnya ke dalam media. Fase cair yang diperoleh setelah dipisahkan dari sel merupakan antimikrob ekstraseluler sehingga pengujian supernatan bebas sel yang mengandung senyawa antimikrob bakteriosin dilakukan terhadap bakteri uji
Vibrio harveyi. Kemampuan bakteriosin untuk menghambat bakteri Vibrio
19
Pengujian sensitivitas terhadap supernatan bebas sel yang mengandung bakteriosin dari kelima isolat dengan menggunakan enzim proteinase K menunjukkan tidak adanya aktivitas penghambatan terhadap bakteri uji Vibrio
harveyi ketika diuji pada media SWC padat (Tabel 4 dan Lampiran 4). Tidak
adanya aktivitas penghambatan supernatan bebas sel yang terjadi akibat perlakuan enzim proteinase K menunjukkan komponen utama senyawa antimikrob merupakan protein alami atau polipeptida, sehingga enzim proteinase K mampu mendegradasi senyawa protein polipeptida (He et al. 2006). Senyawa bakteriosin merupakan antimikrob polipeptida yang tersusun dari 20 sampai 60 asam amino (Nes dan Holo 2000).
Isolat LTP 1 merupakan isolat dengan kemampuan penghambatan tertinggi yang memiliki nilai indeks penghambatan sel dan supernatan bebas sel sebesar 1,77 ± 0,93 dan 1,93 ± 0,12 dan dipilih untuk pengujian lanjut. Hasil identifikasi molekuler dengan menggunakan analisis molekuler 16S rRNA menunjukkan isolat LTP 1 memiliki kesamaan 96% dengan galur Bacillus
subtilis. Galur Bacillus subtilis merupakan bakteri yang diketahui dapat
menghasilkan bakteriosin jenis subtilosin Aericin, sublacin 168, dan menghasilkan BLIS jenis betacin (Abriouel et al. 2011; Sharma et al. 2011).
Pengamatan kurva tumbuh isolat terpilih Bacillus LTP1 (Gambar 2a) menunjukkan fase logaritmik terjadi pada pengamatan jam ke-3 dan fase stasioner terjadi pada jam ke-15. Sedangkan uji penghambatan Vibrio harveyi oleh sel
Bacillus sp. mulai terjadi pada jam ke-3 dan penghambatan supernatan bebas sel
(bakteriosin) terhadap Vibrio harveyi mulai terjadi pada waktu pengamatan jam ke- 9. Hal ini menunjukkan bakteriosin sudah mulai disintesis oleh Bacillus LTP 1 pada jam ke-3 dan mulai disekresikan keluar sel Bacillus sp. pada jam ke-9. Hal ini dapat dilihat dengan adanya aktivitas penghambatan pada Vibrio harveyi pada supernatan bebas sel pada jam ke-9. Pada kurva sintensis bakteriosin isolat
Bacillus LTP1 mulai terjadi pada fase logaritmik dan aktivitas penghambatannya
terus meningkat hingga memasuki fase stasioner hingga jam ke-24 pengamatan. Pada penelitian yang dilakukan oleh Khochamit et al. (2014) sintesis bakteriosin Bacillus subtilis KKU213 selama pengamatan 48 jam, diketahui bahwa aktivitas penghambatan bakteriosin mulai terjadi pada pengamatan jam ke-6 dan terus meningkat hingga pengamatan jam ke-24, sehingga bakteriosin dari Bacillus subtilis mempunyai kecenderungan untuk diproduksi maksimal pada fase stasioner (memasuki pengamatan jam ke-24).
Pola sintesis bakteriosin ini mirip dengan pola pertumbuhan bakteri dan pola sintesis protein, seperti beberapa hasil penelitian yang telah dilakukan oleh Alam et al. (2011) dan Xie et al. (2009) bahwa produksi bakteriosin Bacillus subtilis terjadi pada fase eksponensial pertumbuhan bakteri. Bakteriosin disintesis di ribosom dengan menghasilkan senyawa metabolit berupa protein atau polipeptida yang umumnya disintesis selama fase pertumbuhan. Bakteriosin mulai disintesis pada pertengahan fase ekponensial, hingga puncak maksimum terjadi pada awal fase stasioner dan menurun pada akhir stasioner, penurunan terjadi karena adanya enzim proteolitik yang dilepas keluar sel oleh bakteri (Ray dan Daeschel 1992; Drider et al. 2006).
antimikrob bakteriosin yang lebih tinggi. Bakteriosin hasil pengendapan amonium sulfat 30% hingga 80% menunjukkan adanya peningkatan aktivitas penghambatan terhadap Vibrio harveyi, dengan nilai aktivitas penghambatan tertinggi pada pengendapan amonium sulfat 70% dan 80%. Pengendapan amonium sulfat 70% dapat meningkatkan zona hambat hingga 1,42 kali dan pengendapan amonium sulfat 80% dapat meningkatkan zona hambat sebesar 1,26 kali, jika dibandingkan dengan ektrak kasar bakteriosin sebelum dilakukan pengendapan (Tabel 3). Penelitan yang dilakukan oleh Alam et al. (2011) menunjukkan bahwa pengendapan amonium sulfat dari BLIS dari Bacillus subtilus BS15 telah berhasil meningkatkan total protein dan aktivitas penghambatan bakteriosin setelah dilakukan pengendapan dengan menggunakan amonium sulfat 80%. Pengendapan bakteriosin dengan menggunakan amonium sulfat hingga 80% telah banyak dilakukan dan berhasil untuk meningkatkan perolehan protein, dan aktivitas penghambatan bakteriosin dari B. thuringensis, B. cereus dan B. subtilis (Risoen et al. 2004; Cherif et al. 2008; Xie et al. 2009; Sharma et al. 2012).
Hasil perhitungan bobot molekul bakteriosin hasil pengendapan dengan menggunakan SDS PAGE, didapatkan bobot molekul protein bervariasi antara 10,03 kDa hingga sekitar 22,46 kDa (Gambar 4). Bakteriosin yang dihasilkan oleh Bacillus subtilis umumnya subtilin yang memiliki bobot molekul rendah berkisar 3-14 kDa seperti subtilosin A, subtilin, dan Ericin (Sharma et al. 2011) dan yang berjenis molekul besar seperti BILS dari Bacillus subtilis 14B yang berat molekulnya hingga 21 kDa (Hammami et al. 2009).
Dari uji penghambatan bakteriosin dan kompetisi Bacillus LTP 1 terhadap Vibrio harveyi pada media SWC cair, persentase penghambatan dengan perbandingan rasio bakteriosin (1:1) dan rasio inokulum Bacillus LTP 1 (1:1) sudah cukup untuk menghambat pertumbuhan Vibrio harveyi. Sedangkan dengan perbandingan rasio 2:1 bakteriosin pengendapan 70% memiliki aktivitas penghambatan terhadap Vibrio harveyi tebesar dengan persen penghambatan 59,36 % sedangkan penghambatan oleh isolat Bacillus LTP1 sebesar 43,07 %. Mekanisme utama penghambatan oleh bakteriosin bervariasi, yaitu pembentukan pori dalam membran sitoplasma atau penghambatan biosintesis dinding sel dan aktivitas enzim (RNase atau DNAse) dalam sel target. Umumnya, target dari aksi antimikrob bakteriosin ialah membran sel (Faheem et al. 2007; Chotiah 2013). Contoh subtilosin A yang dihasilkan oleh Bacillus subtilis mampu berinteraksi dengan membran sel bakteri target.Tiga mekanisme antimikroba yang mungkin terjadi antara lain: 1) interaksi antara subtilosin A dengan membran yang berfungsi sebagai reseptor sehingga menyebabkan kematian sel; 2) ikatan dengan membran luar sel target sehingga meningkatkan permeabilitas membran sel target; 3) ion yang memediasi translokasi subtilosin A masuk ke dalam membran sel target kemungkinan dapat mengganggu proses kehidupan sel (Shelburne et al. 2007).
21
berpengaruh negatif jangka panjang terhadap manusia dan kesehatan hewan akuatik. Selain itu galur Bacillus sp. penghasil bakteriosin mempunyai potensi sebagai probiotik karena kemampuan untuk memberikan keuntungan kesehatan bagi organisme sekitarnya (Gillor et al. 2008; Nguyen et al. 2014).
Penggunaan bakteriosin untuk mengatasi bakteri patogen dalam budidaya udang dapat dilakukan dengan pemberian isolat Bacillus LTP 1 sebagai bakteri probiotik yang langsung diaplikasikan pada perairan tempat hidup udang atau dengan mencampurkan bakteriosin pada pakan udang, sehingga pakan yang dihasilkan memiliki kemampuan antimikrob untuk mengatasi serangan bakteri patogen Vibrio harveyi. Tantangan pengaplikasian bakteriosin jika diaplikasikan pada pakan ialah kebutuhan akan bakteriosin yang besar dan kemampuan bakteriosin untuk tahan panas selama ditambahkan pada proses pembuatan (pelleting) pakan.
Pendekatan secara bioteknologi dapat dilakukan guna meningkatkan produksi bakteriosin dan memodifikasi bakteriosin yang dihasilkan oleh Bacillus subtilis LTP1 sehingga lebih tahan terhadap panas. Pendekatan secara bioteknologi di antaranya dengan bioproses melalui rekayasa lingkungan dan sumber nutrisi bagi pertumbuhan Bacillus subtilis LTP1 dan juga melalui rekayasa genetik diantaranya rekayasa jalur metabolisme produksi bakteriosin, atau dengan mengintroduksikan gen penyandi bakteriosin ke dalam inang E.coli untuk diproduksi. Menurut Pag dan Sahl (2002) saat ini pengembangan pengetahuan mengenai organisasi penyusun genetik dan jalur biosintesis bakteri telah banyak membantu untuk memfasilitasi dan menganalisis di dalam peningkatan produksi bakteriosin serta memodifikasi bakteriosin sehingga dapat meningkatkan potensi bakteriosin sebagai antimikrob.
Kesuksesan produksi bakteriosin melalui proses rekayasa tergantung pada banyak faktor, antara lain: pertumbuhan sel, tingkatan ekspresi, lokasi akhir dari produk rekombinan, modifikasi pasca traslasi, dan regulasi. Selain itu bakteriosin harus memenuhi persyaratan khusus sebagai antimikrob yang efektif dan aman serta harus aktif terhadap target patogen yang dituju dan stabil dalam lingkungan saat penggunaan. Pemilihan sel inang dan unsur-unsur genetik (host-encoded) menjadi titik krusial terpenting di dalam kesuksesan ekspresi dari gen yang diinginkan karena sistem ekspresi adalah kombinasi dari kedua komponen tersebut (Makrides et al. 1996; Rodriguez et al. 2003; Gillor et al. 2005).
Bakteriosin dari Bacillus subtilis LTP1 berpotensi untuk mengatasi serangan vibrosis pada budidaya udang, dan diharapkan dapat ditingkatkan kemampuan antimikrobnya melalui pendekatan bioteknologi baik secara bioproses maupun secara rekayasa molekuler sehingga aplikasinya sebagai antimikrob yang ramah lingkungan dapat diterapkan dalam budidaya udang.
SIMPULAN DAN SARAN
Simpulan
logaritmik dengan indeks penghambatan bakteriosin setelah diendapkan dengan ammonium sulfat 70 % yaitu 2,7 dan aktivitas penghambatan 2490 mm2/ml. Berdasarkan hasil identifikasi molekuler isolat LTP 1 memiliki kemiripan 96% dengan Bacillus subtilis galur DSM 10.
Saran
Perlu dilakukan pengujian minimum inhibitory concetration (MIC) untuk mengetahui konsentrasi minimum penghambatan dari bakteriosin dan aplikasi secara in vivo pengujian bakteriosin dan isolat Bacillus subtilis LTP1 terhadap bakteri patogen Vibrio harveyi.
DAFTAR PUSTAKA
Abriouel H, Franz CMAP, Omar NB, Galvez A. 2011. Diversity and application of Bacillus bacteriocin. J FEMS Microbiol Lett. 35: 201-232.
Ahern M, Verschueren S, Van sinderen D. 2013. Isolation and characterisation of a novel bacteriocin produced by Bacillus thuringiensis strain B439. J FEMS Microbiol Lett. 220 (8):127-131.
Alam SI, Kamran M, Sohalim M, Ahmad A, Khan SA. 2011. Partial chracterization of bacteriocin like inhibitory substance from Bacillus Subtilis BS15, a local soil isolate. Pak J Bot. 43(4):2195-2199.
Altena K,Guder A, Cramer C, Bierbaum G. 2000. Biosynthesis of the lantibiotic mersacidin: organization of a type B lantibiotic gene cluster. J Appl Environ
Microbiol. 66(6):2565–2571.
Banerjee S, Hansen JN. 1988. Structure and expression of a gene encoding the precursor of subtilin, a small protein antibiotic. J Biol Chem. 263: 9508– 9514.
Bierbaum G, Brotz H, Koller KP, Sahl HG. 1995. Cloning, sequencing and production of the lantibiotic mersacidin. J FEMS Microbiol Lett. 127:121– 126.
Bollag DM, Edelstein SJ. 1991. Protein Method. New York (US): A John Wiley dan Sons.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing principels of protein-dye binding. Anal Biochem. 72 (2):248-254.
Brock JA, Lightner DV. 1990. Diseases of crustacea. Di dalam: Kinne O editor. Diseases of Marine Animals.Volume 3. Hamburg (DE): Biologische Anstalt Helgoland. hlm:245-424.
23
Cherif A, Rezgui W, Raddadi N, Daffonchio D, Boudabous A. 2008. Characterization and partial purification of entomocin 110, a newly identified bacteriocin from Bacillus thuringiensis subsp. entomocidus HD110. Microbiol Res.163:684–692.
Chotiah S. 2013. Potensi Bakteriosin untuk kesehatan hewan dan keamanan bahan pangan. Wartazoa Bul Ilmu Peter Kes Hewan Indones. 23(2):94-101. Cuesta MCM, Kok J, Herranz E, Pelaez C, Requena T, Buist G. 2000. Requirement of autolytic activity for bacteriocin-induced lysis. Appl
Environ Microbiol. 66(8):3174–3179.
De Vost WM, Jung G, Sahl HG. 1991. Appendix definition and nomenclature of lantibiotics. Di dalam: Jung G, Sahl HG, editor. Nisin and Novel Lantibiotics. Leiden (NL): Escom Publisher. hlm:145-156.
Drider D, Fimland G, Hechard Y, McMullen M, Prevost H. 2006. The continuing story of class IIa bacteriocins. Microbiol Mol Biol Rev. 70(2):564-582. Faheem F, Saeed S, Rasool SA. 2007. Study on brevecin AF01: a bacteriocin
like inhibitory substance active against methicilin resistant Staphylococcus aureus. J Bontani. 39(4):1293-1302.
[FAO] Food and Agriculture Organization. 2015. Market reports: shrimp-maret 2015. Globefish [Internet]. [diunduh 2015 Mar 21] tersedia pada; http:// www.fao.org/in-action/globefish/market-reports/resource-detail/en/c/33802 Frazier WC, Wasthoff DC. 1981. Food Microbiology. New Delhi (IN): Tata Mc
Graw-Hill.
Galvez A, Valdivia E, Gonzalez-Segura A, Lebbadi M, Martinez-Bueno M, Maqueda M. 1993. Purification, characterization and lytic activity against Naegleria fowleri of two amoebicins produced by Bacillus licheniformis A12. J Appl Environt Microbiol. 59:1480–1486.
Gillor O, Nigro LM, Riley MA. 2005. Genetically engineered bacteriocins and their potential as the next generation of antimicrobials. J Curr Pharm Design. 11(8):1067-1075.
Gillor O, Etzion A, Riley MA. 2008. The dial role of bacteriocin as anti and probiotic. App Microbiol Biotechnol. 81:591-606.
Gray EJ, Di Falco M, Souleimanov A, Smith DL. 2006a. Proteomic analysis of the bacteriocin thuricin 17 produced by Bacillus thuringiensis NEB17.
J FEMS Microbiol Lett. 255:27–32.
Gullian M, Thompson F, Rodríguez J. 2004. Selection of probiotic bacteria and study of their immunostimulatory effect in Penaeus vannamei. J Aquacult. 233:1–14.
Hammami I, Rhouma A, Jaouadi B, Rebai A, Nesme X. 2009. Optimization and biochemical characterization of a bacteriocin from a newly isolated
Bacillus subtilis strain 14B for biocontrol of Agrobacterium spp.
strains. Lett Appl Microbiol. 48:253–26.
He L, Chen W, Liu Y. 2006. Production and partial characterization of bacteriocin like peptide by Bacillus licheniformis ZJU12. Microbiol Reserch. 161:321-326.
Irina VP, Philippe B, Bernard V, Bernard F. 2001. In vitro anti Helicobacter pylori activity of the probiotic strain Bacillus subtilis 3 is due to secretion of antibiotic. J Antimicrob Agent Chemother. (45):3156-3161.
Itami T, Asano M, Tokushige K, Kubono K, Nakagawa A, Takeno N, Nishimura H, Maeda M, Kondo M, Takahashi Y. 1994. Enhancement of disease resistance of kuruma shrimp, Penaeus japonicus after oral administration of peptidoglycan derived from Bifidobacterium thermophilum. J Aquacult. 164:277-288.
Isramilda. 2007. Karakterisasi zat antimikrob penghambat pertumbuhan Vibrio
harveyi dan Escherichia coli dari Bacillus sp. asal tambak udang.[tesis].
Bogor (ID): Institut Pertanian Bogor.
Jamilah I, Meryandini A, Rusmana I, Suwanto A, Mubarik NR. 2009. Activity of proteolytic and amylolytic enzymes from Bacillus sp. isolated from shrimp ponds. Microbiol Indones. 3(2):67-71.
Jack RW,Tagg JR, Ray B. 1995. Bacteriocin of gram positive bacteria. Microbiol Rev. (59):171-200.
Johansson MW, Soderhall K. 1992. Celluler defense and cell adhesion in crustacean. J Anim Biol. 1:97-107.
Johansson MW, Keyser P, Sritunyalucksana K, Soderhall K. 2000. Crustacean haemosytes and haematopoiesis. J Aquacult. 191:45-92
Jayasree L, Janakiram P, Madhavi R. 2006. Characterization of Vibrio spp. associated with diseased shrimp from culture ponds of andhra pradesh (India). J World Aquacult Soc. 37:523-530.
Khalil R, Djadouni F, Elbahloul Y, Omar S. 2009a. The influence of cultural and physical conditions on the antimicrobial activity of bacteriocin produced by a newly isolated Bacillus megaterium 22 strain. Afr J Food Sci. 3:11–22. Khalil R, Elbahloul Y, Djadouni F, Omar S. 2009b. Isolation and partial characterization of a bacteriocin produced by a newly isolated Bacillus
megaterium 19 strain. Pakist J Nutr. 8:242–250.
Khochamit N, Siripornadulsil S, Sukon P, Siripornadulsil W. 2004. Antibacterial activity and genotypic–phenotypic characteristics of bacteriocin-producing Bacillus subtilis KKU213: potential as probiotic strain. J Microbiol Res. 8(12):1-15.
Kone K, Fung YC. 1992. Understanding bacteriocins and their use in food. J Food Environ. 12:282-285.
Lavilla-Pitogo CR, Baticados MCL, Cruz-Lacuerda ER, Dela-Pena LD. 1990. Occurrence of luminous bacteria diseases of Penaeus monodon larvae in Philiphines. J Aquacult. 9:11-13.
Lee KH, Jun KD, Kim WS, Paik HD. 2001. Partial characterization of polyfermenticin SCD, a newly identified bacteriocin of Bacillus
polyfermenticus. Lett Appl Microbiol. 32:146–151.
Lightner DV.1993. Diseases of cultured penaeid shrimp. Di dalam: Mc Vey JP, editor. CRC Handbook of Mariculture. Edisi ke-2. Boca Raton (US): CRC Press. hlm:393-486.
25
Liu CH, Yeh ST, Chen JC, Jiann CC. 2004. The immune response of white shrimp Litopenaeus vanamei and its susceptibility to vibrio infection ini relation with the moult cycle. J Fish Shell Immunol. 16:151-161.
Logan NA. 1994. Bacterial Systematic. London (GB): Blackwell Scientific Publication.
Makrides SC. 1996. Strategies for achieving high-level expression of genes in Escherichia coli. Microbiol Rev. 60:512-38.
Marchesi JR, Sato T, Andrew JW, Tracey AM, Fry JC, Sarah JH, Wade WG. 1998. Design and evaluation of useful bacterium specific PCR primer that amplify genes coding for bacterial 16S rRNA. Appl Environ Microbiol. 64 (2):795-799.
Martirani L, Varcamonti M, Naclerio G, De Felice M. 2002. Purification and partial characterization of bacillocin 490, a novel bacteriocin produced by a thermophilic strain of Bacillus licheniformis. Microb Cell Fact. 1:1-5. Mathot AG, Beliard E, Thuault D. 2003. Streptococcus thermophilus 580
produces a bacteriocin potentially suitable for inhibition of Clostridium tyrobutyricumin hard cheese. J Dairy Sci. 86:3068-3074.
Muliani, Nurbaya, Tompo A, Atmomarsono M. 2004. Eksplorasi bakteri filosfer dari tanaman mangrove sebagai bakteri probiotik pada budidaya udang windu, Penaeus monodon. J Penel Perikan Indones.10:47-56.
Mori K. 1990. The present state of immunological research in marine aquaculture. Di dalam T C. Cheng editor. Proceeding The Third International Colloqium on Pathology in Marine Aquaculture, 2-6 October 1988: California (US): Academic Inc. hlm: 457.
Moriarty DJW. 1999. Disease control in shrimp aquaculture with probiotic bacteria. Di dalam: Bell CR, Brylinsky M, Johnson-Green P, editor. Proceedings of the 9th International Symposium on Microbial Ecology [Internet]. [Halifaz July 1999]. Halifax (CA): Microbil Biosystem. [diunduh 2014 Mar 2014].Tersedia pada: http://ag.arizonal/edu/azaaqua/tilapia/ tilapia_shrimp/moriarty.pdf.
Mota-Meira M, Morency H, Lavoie MC. 2005. In vivo activity of mutacin B-Ny266. J Antimic Chemo. 56:869–871.
Naclerio G, Ricca E, Sacco M, Felice MD. 1993. Antimicrobial activity of a newly identified bacteriocin of Bacillus cereus. Appl Environ Microbiol. 59:4313-4316.
Nasi L, Prayitno SB, Sarjito. 2007. Kajian bakteri penyebab Vibriosis pada udang secara biomolekuler. J Coast Res Manag. 3(1):123-128.
Nes IF, Holo H. 2000. Class II antimicrobial peptides from lactic acid bacteria.
Biopolymer. (55):50–61.
Newaj-fyzul A, Al-harbi AH, Austin B. 2014. Review: developments in the use of probiotics for disease control in aquaculture. J Aquacult. 431:1-11.
Nimrat S, Suksawat S, Boonthai T, Vuthiphandchai V. 2012. Potential Bacillus probiotics enhance bacterial numbers, water quality and growth during early development of white shrimp (Litopenaeus vannamei). J Vet Microbiol. 159:443-450.
Noaman NH, Fattah A, Khaleata M, Zaky SH. 2004. Factor affecting antimicrob activity of Synechococus leopoliensis. Microbiol Res.159(4):395-402. Oscariz. JC, Lasa I, Pisabarro AG. 1999. Detection and characterization of cerein
7, a new bacteriocin produced by Bacillus cereus with a board spectrum of activity. FEMS Microbiol Lett. 178:337-341.
Oscariz JC, Cintas L, Holo H, Lasa I, Nes IF, Pisabarro AG. 2006. Purification and sequencing of cerein 7B, a novel bacteriocin produced by Bacillus
cereus Bc7. J FEMS Microbiol Lett. 254:108–115.
Pag U, Sahl HG. 2002. Multiple activities in lantibiotics-models for the design of novel antibiotics?. J Curr Pharm. 8:815-33.
Pattnaik P, Kaushik JK, Grover S, Batish VK .2001. Purification and characterization of a bacteriocin-like compound (lichenin) produced anaerobically by Bacillus licheniformis isolated from water buffalo. J
Appl Microbiol. 91:636–645.
Parada JL, Caron CR, Medeiros ABP, Soccol CR. 2007. Bacteriocin from lactic acid bacteria: purification, properties dan use as biopreservative. Braz Arch Biol Technol. 50:521-542.
Prasad S, Morris PC, Hansen R, Meaden PG, Austin B. 2005. A novel bacteriocin-like substance (BLIS) from a pathogenic strain of Vibrio harveyi. Microbiology. 151:3051-3058.
Ramachandran R, Chalasani AG, Lal R, Roy U. 2014. A broad-spectrum antimicrobial activity of Bacillus subtilis RLID 12.1. J Sci Word. 20(14): 10-18. DOI 10.1155/2014/968 487.
Ray B, Daeschel M. 1992. Food Biopreservative of Microbiol Origin. London (GB): CRC Press.
Rengpipat S, Rucpratanporn S, Piyatiratitivorakul S, Menasveta P. 1998. Probiotic in aquaculture: a case study of probiotic for larvae of the black tiger shrimp
Penaeus monodon. Didalam Fegel, TW, editor. Advances in Shrimp
Biotechnology. National Center for Genetic Engineering and
Biotechnology. 1998 Nov 11-14; Bangkok, Thailand. Bangkok (TH): Biotec. hlm:177-181.
Rengpipat S, Rukpratanporn S, Piyatiratitivorakul S, Menasaveta P. 2000. Immunity enhancement in black tiger shrimp Penaeus monodon by a probiont bacterium (Bacillus S11). J Aquacult.191:271–288.
Risoen PA, Ronning P, Hegna IK, Kolsto AB. 2004. Characterization of a broad range antimicrobial substance from Bacillus cereus. J Appl Microbiol. 96:648-655.
Rizvi RZ, Wahab A, Pirzada ZA. 2014. Screening and identification of aquatic bakteriocinogenic Bacillus strains inhibiting clinical merhicillin resistant
Staphylococcus aureus and vancomycin resistan Enterococcus from
Pakistan. Asian J Pharma Clin Res. 7(5):654-659.