ABSTRACT
RIRI NOVITA SUNARTI. Specificity and effectiveness of Salmonella sp. lytic phage. Under supervision of SRI BUDIARTI and IMAN RUSMANA
Salmonellosis is caused by Salmonella sp. The presence of Salmonella sp. which resistant to antibiotics make it more difficult to control salmonellosis. Therefore it should be considered an alternative way to control the disease. One of the alternative application is using bacteriophage which is a natural pathogen of the bacteria. The use of lytic phage as natural and non toxic agent to reduce and control the human pathogenic bacteria has a great potential application, because phages are part of the gastrointestinal and environmental ecosystem. The purpose of this study was to characterize and test the effectiveness of the lytic fage to lyse Salmonella sp. The results of study obtained four isolates of phages, named phage FR15, FR19, FR38, and FR84. Each phage is specific to its host. Based on the determination of plaque diameter, phage FR38 and FR84 were 2 mm in diameter, while phage FR15 dan FR19 were 1 mm. Phage titer of FR19 was 33600 PFU mL-1, phage FR15 was 25700 PFU mL-1, phage FR38 was 11440 PFU mL-1,and phage FR84 was 10720 PFU mL-1. Effectiveness of phage infection to Salmonella sp. determined by addition of phage 104 PFUmL-1 indicated that phage FR38 had the highest lytic activity. It was able to reduce optical dencity of Salmonella p38 cells after 5 hours inoculation of the phage. However, addition 3x104 PFU mL-1 of phage indicated that phage FR84 had the highest lytic activity. It was able to reduce significally of optical dencity Salmonella p84 cells within 1 hour. The results of this study is expected to be applied as a biocontrol of Salmonella sp. in water and food in order to reduce salmonellosis.
PENDAHULUAN
Latar Belakang
Bakteri Salmonella merupakan anggota famili Enterobacteriaceae, gram negatif, anaerob fakultatif, tidak berspora dan berbentuk batang. Lebih dari 2000 serotip Salmonella adalah patogen (Madigan et al. 2009). Penyakit akibat infeksi Salmonella disebut salmonellosis (Marriot 1999). Salmonellosis merupakan salah satu penyakit yang ditularkan melalui makanan dan air. Gejala salmonellosis pada manusia dapat berupa sindrom gastroenteritis (Cox 2000; Chung et al. 2003).
Kasus salmonellosis telah banyak dilaporkan di negara maju maupun di negara berkembang. Kasus salmonellosis di Amerika Serikat diderita oleh 1,4 juta orang setiap tahunnya, dan 95% kasusnya adalah ditularkan melalui makanan (Mrema et al. 2006). Di Indonesia salmonellosis-tifoid diperkirakan terjadi sebanyak 60.000 hingga 1.300.000 kasus dengan sedikitnya terjadi 20.000 kematian pertahun (Suwandono et al. 2005).
Penggunaan antibiotik yang berlebihan pada kasus salmonellosis di samping menimbulkan efek samping yang berbahaya, juga dapat beresiko timbulnya resistensi bakteri terhadap antibiotik. Tjaniadi et al. (2003) menyatakan Salmonella yang diisolasi dari penderita diare di Indonesia menunjukkan resistensi terhadap antibiotik: ampisilin, trimethoprin, sulfamethoxazole, chloramphenicol, tetracycline, cephalothin, ceftriazone, norfloxacin dan ciprofloxacin. Hasil penelitian Kusumaningrum et al. (2012) menunjukkan beberapa isolat Sallmonella yang diisolasi dari produk segar berupa ayam potong, daging sapi, daging giling, ikan dan sayuran yang berasal dari pasar tradisional dan supermarket di Bogor menunjukkan resistensi terhadap antibiotik chloramphenicol, erythromycin, tetracyclin, sulfamethoxazole dan streptomycin. Adanya bakteri Salmonella yang resisten terhadap antibiotik akan menyulitkan pengobatan salmonellosis sehingga perlu dicari cara selain pemberian antibiotik untuk menanggulangi masalah penyakit salmonellosis.
pada kasus infeksi bakteri yang hampir tidak dapat disembuhkan dengan kemoterapi konvensional (Alisky et al. 1998; Ho 2001; Sulakvelidze et al. 2001). Terapi fage adalah metode memanfaatkan fage sebagai bioagen untuk pengobatan penyakit infeksi bakteri. Terapi fage awalnya diperkenalkan 80 tahun yang lalu oleh Felix d'Herelle, seorang penemu fage (Ho 2001). Fage dalam beberapa tahun terakhir telah digunakan sebagai pengganti antibiotik untuk penyembuhan infeksi bakteri (Cann 1993).
Fage adalah virus yang menginfeksi bakteri, virus ini bereplikasi dalam sel bakteri dan melisiskan sel bakteri (Cann 1993). Fage adalah bagian dari flora normal saluran pencernaan dan ekosistem lingkungan, sehingga fage litik dapat digunakan sebagai metode alami dan non toksik untuk mereduksi dan mengontrol pertumbuhan bakteri patogen pada manusia (Ackerman & Dubow 1987). Fage dapat diisolasi dari air, limbah, dan tanah. Terapi fage telah terbukti secara medis lebih unggul dari terapi antibiotik (Barrow & Soothill 1997; Lederberg 1996; Pirisi 2000; Smith et al. 1987).
Aplikasi fage sebagai biokontrol pencemaran makanan diantaranya fage spesifik Campylobacter jejuni pada daging ayam (White et al. 1997), fage spesifik E. coli O157 pada daging sapi (Abuladze et al. 2008), fage spesifik Listeria monocytogenes pada makanan yang berasal dari laut (Guenther et al. 2009), fage spesifik Enterobacter sakazaki pada susu formula bayi (Kim 2007). Aplikasi fage spesifik E. coli patogen sebagai sanitasi air (Ochman & Selender 1984). Penelitian aplikasi fage pada Salmonella sebagai biokontrol pencemaran makanan pernah dilakukan pada sosis ayam yaitu fage spesifik Salmonella Typhimurium DT104 (Whichard et al. 2003).
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengkarakterisasi dan menguji efektivitas fage litik dalam melisis galur Salmonella p15, p19, p38, dan p84. Manfaat Penelitian
TINJAUAN PUSTAKA
Karakteristik Salmonella
Salmonella (Enterobacteriaceae) merupakan bakteri gram negatif berbentuk batang langsing (0.7- 1.5 x 2-5 µm), fakultatif anaerobik, uji oksidase negatif, dan uji katalase positif. Sebagian besar strain Salmonella bersifat motil dan memfermentasi glukosa dengan membentuk gas dan asam (Cox 2000). Salmonella umumnya memfermentasi dulsitol, tetapi tidak memfermentasi laktosa, menggunakan sitrat sebagai sumber karbon, menghasilkan hidrogen sulfida, dekarboksilat lisin dan ornitin, tidak menghasilkan indol, dan negatif untuk uji urease. Salmonella merupakan bakteri mesofilik, dengan suhu pertumbuhan optimum antara 35 - 37°C, tetap dapat tumbuh pada range 5 - 46°C, Salmonella sensitif pada pH rendah (lebih kecil atau sama dengan 4,5) dan tidak berbiak pada Aw0,94 khususnya jika dikombinasikan dengan pH 5,5 atau kurang. Salmonella
dapat bertahan pada pembekuan dan bentuk kering dalam waktu yang lama. Salmonella mampu berbiak pada berbagai makanan tanpa mempengaruhi tampilan kualitasnya (Ray 2001).
Salmonella secara alami hidup di saluran gastrointestinal hewan baik yang terdomestikasi maupun liar. Salmonella pada hewan dapat menyebabkan salmonellosis, pada kasus hewan bertindak sebagai pembawa penyakit. Manusia dapat bertindak sebagai pembawa penyakit setelah terinfeksi dan menyebarkannya melalui feces untuk waktu yang cukup lama. Selain itu Salmonella dapat juga diisolasi dari tanah, air, dan sampah yang terkontaminasi feces (Ray 2001).
memiliki gen yang mengkode lebih dari 12 tipe pili (fimbriae) yang berbeda, termasuk SEF 14, 17, 18 dan 21, long polar fimbriae (lpf) dan plasmid-encoded fimbriae (pef) (Edwards et al. 2002; Townsend et al. 2001).
Salmonella di dalam tubuh inang akan menginvasi mukosa usus halus, berbiak di sel epitel, dan menghasilkan toksin yang akan menyebabkan reaksi radang dan akumulasi cairan di dalam usus. Salmonella yang ada di dalam sel epitel akan memperbanyak diri dan menghasilkan termolabil enterotoksin yang secara langsung mempengaruhi sekresi air dan elektrolit sehingga menyebabkan diare (Ray 2001).
Menurut Jay (2000) Salmonella secara epidemiologis, dikelompokkan menjadi tiga grup yaitu: (1) Salmonella yang menginfeksi hanya manusia; (2) (pada domba) dan S.choleraesuis (pada babi). Grup ke 3 sangat patogen untuk manusia dan hewan yang menyebabkan salmonellosis. Contohnya: S. enteritidis, S. typhimurium.
Salmonella dikelompokkan berdasarkan antigen somatik (O), flagela (H), dan kapsular (Vi) (Bhunia 2008; Molbak et al. 2006). Saat ini terdapat 2463 modern informasi mengenai subspesies diabaikan, isolat dengan nama S. enterica
subspesies I serovar Enteritidis pada kalimat ditulis sebagai S. enteritidis (Bhunia
Salmonellosis
Salmonellosis disebabkan oleh infeksi bakteri Salmonella yang menyerang saluran gastrointestinal yang mencakup usus halus, dan usus besar atau kolon. Serangan gastroenteritis terjadi 8-72 jam setelah mengkonsumsi makanan yang tercemar Salmonella, dengan gejala sakit perut mendadak dengan diare encer atau berair, kadang-kadang dengan lendir atau darah. Penderita gastroenteritis seringkali merasa mual dan muntah, demam dengan suhu 38-39oC (Chung et al. 2003; Cox 2000). Ray (2001) menjelaskan bahwa secara umum gejala penyakit salmonellosis berlangsung 2 - 3 hari, dengan angka mortalitas rata-rata 4,1 %, dengan variasi 5,8 % pada penderita berumur di bawah 1 tahun, 2 % sampai umur 50 tahun dan 15 % pada umur di atas 50 tahun. Perbedaan tingkat mortalitas juga terjadi pada berbagai spesies Salmonella, angka mortalitas tertinggi dicapai S. cholerasuis yaitu 21 %.
Salmonelosis pada manusia umumnya dikategorikan penyakit yang disebabkan oleh mengkonsumsi makanan asal hewan yang tercemar Salmonella (daging, susu, unggas, telur). Produk susu, termasuk keju dan es krim, juga pernah dilaporkan terkait kasus salmonelosis (Bhunia 2008; Hugas et al. 2009).
Penularan salmonellosis dapat terjadi dari hewan ke manusia melalui pangan asal hewan yang terkontaminasi Salmonella. Berbagai jenis Salmonella yang dapat menular dari hewan ke manusia tersebut adalah: S. enteritidis, S.
typhimurium. Serovar-serovar pada kelompok ini umumnya menyebabkan
gastroenteritis, dengan infeksi terbatas pada saluran pencernaan, biasanya tidak berada dalam sirkulasi darah dan masa inkubasi yang pendek. Infeksi Salmonella ini diketahui sebagai Salmonellosis-non tifoid (Cary et al. 2000; Cooper 1994).
Pada periode 1999-2003 sebanyak 59 isolat Salmonella spp. dari manusia telah berhasil diisolasi oleh Balai Penelitian Veteriner (Balitvet). Isolat-isolat tersebut adalah: S.typhimurium, S. enteritidis, S. worthington, S. lexington, S. agona, S. weltervreden, S. bovismorbificans, S. dublin, S. newport, S11. (stellenbosch), S. virchow dan S. virginia (Poernomo 2004). Sudarmono et al. (2001) melaporkan bahwa selama bulan April 1998 sampai dengan bulan Maret 1999, salmonellosis-non tifoid pada manusia yang paling umum terjadi disebabkan oleh S. aequaticus, S. derby, S. enteritidis, S. javana, S. lexington, dan S. vircow.
Salmonellosis sebagai penyakit yang ditularkan melalui makanan terdokumentasi untuk pertama kali pada akhir tahun 1800an (Cox 2000), dan sejak itu serangan Salmonella terus terjadi dan meningkat. Kasusnya menyebar secara cepat karena Salmonella mampu membentuk klon-klon baru pada hewan ternak yang berbeda (Wagener et al. 2003) dan resisten terhadap berbagai antibiotik (Chung et al. 2003).
Bakteri dapat bersifat resisten terhadap antibiotik karena adanya mutasi kromosom ataupun karena pertukaran material genetik melalui transformasi, transduksi dan konjugasi melalui plasmid. Peningkatan atau kesalahan penggunaan antibiotik dalam bidang klinik, penggunaan antibiotik dalam bidang molekular, dan penambahan antibiotik pada pakan ternak juga dapat menyebabkan bakteri bersifat resisten terhadap antibiotik (Desselberger 1998; Neu 1992).
chloramphenicol, erythromycin, tetracyclin, sulfamethoxazole dan streptomycin. Penelitian Tjaniadi et al. (2003), menyatakan Salmonella yang diisolasi dari penderita diare di Indonesia resisten terhadap antibiotik. S. enteritidis resisten terhadap ciprofloxacin dan norfloxacin. S. typhi resisten terhadap trimetroprim-sulfamethoxazole, chloramphenicol, streptomycin dan tetracycline.
Karakteristik Fage
Fage ditemukan oleh Frederick W. Twort di Inggris pada tahun 1915 dan Felix d’Herelle dari Pasteur Institute pada tahun 1917. Twort mengamati adanya koloni bakteri yang lisis, sifat lisis dapat ditularkan dari satu koloni ke koloni lainnya. D’Herelle menemukan hal yang sama pada tahun 1917, sehingga diberi nama fenomena Twort-d’Herelle (Pelczar & Chan 2007).
Fage telah digunakan sebagai metode pengendalian biologis untuk berbagai aplikasi. Fage adalah virus yang menggunakan bakteri sebagai inangnya untuk bisa bereplikasi. Fage tidak dapat bereproduksi (replikasi) di luar sel karena tidak memiliki enzim untuk melakukan metabolisme (Doyle 2007).
Fage terdiri dari protein kapsid yang mengandung asam inti. Asam inti dapat berupa ss-RNA, ds-RNA, ss-DNA atau ds-DNA. Asam inti ds-DNA fage dapat mengkode 50-200 protein, ss-DNA dan ss-RNA fage dapat mengkode 3-5 protein, ds-RNA fage dapat mengkode 20 macam protein. Ukuran fage jauh lebih kecil daripada bakteri, biasanya antara 20 dan 200 nm (Mc Grath & Van Sinderen 2007).
Fage diperkirakan paling banyak terdapat di biosfer. Fage berada di mana-mana dan dapat ditemukan di semua tempat yang dihuni oleh bakteri, seperti tanah atau usus binatang. Salah satu sumber fage adalah air laut, 9 × 108 fage per mililiter telah ditemukan pada permukaan air laut (Wommack & Colwell 2000) 70% dari bakteri laut dapat terinfeksi oleh fage (Prescott 1993).
Podoviridae (ekor pendek, non-kontraktil) (Ackermann 2001). Fage polyhedral memiliki kepala simetri ikosahedral dan kubik (Ackermann 1999). Fage polyhedral meliputi famili: Microviridae, Corticoviridae, Tectiviridae, Leviviridae, dan Cystoviridae. Fage berserabut meliputi famili: Inoviridae, Lipothrixviridae, dan Rudiviridae. Fage pleomorfik meliputi famili: Plasmoviridae dan Fuselloviridae (Ackermann 2005).
Infeksi fage dimulai dengan tahap adsorpsi yaitu serat ekor fage mengenali dan mengikat reseptor permukaan spesifik sel bakteri. Pada bakteri gram negatif komponen yang dapat berfungsi sebagai reseptor permukaan dapat berupa: protein membran luar, lipopolisakarida, dan oligosakarida. Selanjutnya ekor fage menghasilkan ezim lisozim yang merusak struktur permukaan sel bakteri sehingga ekor fage dapat menembus permukaan sel bakteri dan menyuntikkan materi genetiknya ke dalam sel bakteri. Didalam sel bakteri, genom fage melakukan transkripsi. Transkripsi terjadi dalam beberapa tahap melalui gen fage yang disebut sebagai: gen awal (early genes), gen tengah (middle genes), dan gen akhir (late genes). Produk gen awal bertanggung jawab untuk memblokir protease dan pembatasan enzim sel inang, menghentikan metabolism sel inang, dan mendenaturasi protein sel inang. Gen tengah ditranskripsikan dan diterjemahkan untuk menghasilkan produk yang dibutuhkan untuk replikasi genom fage. Gen akhir ditranskripsi dan diterjemahkan untuk menghasilkan komponen protein partikel fage seperti ekor, kepala dan serabut. Gen akhir juga menyandikan pembentukan lisozim yang melisiskan sel bakteri sehingga fage baru dapat dilepaskan dari sel inang (Guttman et al. 2005).
Penelitian dan Aplikasi Fage
untuk mengobati disentri, namun munculnya antibiotik pada tahun 1940-an menyebabkan penurunan penggunaan fage terapi dan penelitian tentang fage terapi. Pada saat ini dengan adanya peningkatan jumlah bakteri yang resisten antibiotik, penelitian tentang fage kembali meningkat terutama sebagai pengawet produk makanan (Doyle 2007).
Fage litik memiliki aktivitas antibakteri yang luar biasa. Fage dilaporkan lebih efektif daripada antibiotik untuk mengobati infeksi bakteri tertentu pada manusia (Sakandelidze 1991). Studi oleh Meladze et al. (1982) menggunakan fage untuk mengobati pasien penderita penyakit paru-paru dan pleura bernanah yang disebabkan oleh Staphylococcus aureus. Menunjukkan bahwa pasien yang diobati dengan fage membaik sebanyak 82%, sedangkan yang diobati dengan antibiotik hanya 64%. Pemulihan kesehatan kelompok pasien yang menerima fage secara intravena bahkan lebih tinggi yaitu 95%.
Fage dapat ditemukan pada bahan makanan. Hal ini memungkinkan fage dapat digunakan untuk mengurangi atau menghilangkan kontaminasi patogen Salmonella dari makanan (Doyle 2007). Penelitian penggunaan fage spesifik E. coli secara oral aman dilakukan pada manusia telah dilaporkan oleh Bruttin dan Brussow (2005).
Dalam hal pengendalian Salmonella, spesifisitas inang adalah sebuah rintangan untuk dapat mengurangi tingkat pencemaran. Fage tunggal tidak mampu melisiskan semua serovarian Salmonella, maka penggunaan gabungan beberapa fage (koktail fage) harus dirancang agar mampu melisiskan semua strain Salmonella (Joerger 2003). Produksi koktail fage yang efektif untuk Salmonella telah dilaporkan sebelumnya oleh Chighladze et al. (2001), yaitu mengembangkan koktail fage yang mampu melisiskan 232 dari 245 isolat Salmonella terdiri dari 21 serovarian dengan 78 pola jenis Pulsed-Field Gel Electrophoresis (PFGE).
METODE
Alur Penelitian
Alur penelitian dan metode yang digunakan dalam penelitian ini terdiri dari 6 tahapan, yaitu: peremajaan bakteri Salmonella sp., verifikasi bakteri Salmonella sp., isolasi fage, penentuan kisaran inang, efektivitas lisis sel Salmonella sp. oleh fage, dan pengamatan morfologi lisis sel Salmonella sp. oleh fage dengan Scanning Electron Microscope (SEM) (Gambar 1).
a). Pengambilan sampel b). Filtrasi Sampel c). Pencawanan d). Pemurnian Fage
e). Kuantifikasi Fage (PFU/mL)
Gambar 1 Diagram alir tahapan metode penelitian. C. Isolasi Fage
D. Penentuan Kisaran Inang
E. Efektivitas Lisis Sel Salmonella sp. oleh Fage
F. Pengamatan Morfologi Lisis sel Salmonella sp. oleh Fage dengan SEM
A. Peremajaan Salmonella sp.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan September 2010 sampai dengan Agustus 2011, bertempat di Laboratorium Bioteknologi Hewan, IPB Darmaga; dan Laboratorium SEM LIPI Cibinong.
Bahan
Bakteri yang digunakan pada penelitian ini: bakteri Salmonella p15, p19, p38, dan p84 dan E. coli non patogen merupakan koleksi Dr. dr. Sri Budiarti.
Media yang dipergunakan pada penelitian ini: Nutrien Broth (NB); molten top agar (1% bakto tripton, 0,8% NaCl, 0,7% agar); Nutrien agar (NA); soft agar (NB mengandung 0,7% agar); media kaldu Lauria Bertani (LB) (1% Bakto tripton, 0,5% Bakto yeast ekstrak, 1% NaCl); Media agar LB (1% Bakto tripton, 0,5% Bakto yeast ekstrak, 1% NaCl, 2,5% agar); Salmonella shigella (SS) agar; MRVP; Urea; TSIA; KCN; Simmons Sitrat; Tripton; media gula-gula: Glukosa, Laktosa, dan Sukrosa.
Peremajaan Salmonella sp.
Sebanyak satu lup bakteri Salmonella p15, p19, p38, dan p84 digoreskan pada media agar miring SS secara aseptik, kemudian diinkubasi pada suhu 37 ºC selama 24 jam.
Verifikasi Salmonella sp.
Dilakukan pewarnaan gram dan uji fisiologis berupa: MR, VP, urea, KCN, indol, sitrat, H2S, dan uji fermentasi gula-gula: glukosa, laktosa, sukrosa pada
isolat Salmonella p15, p19, p38, dan p84.
Isolasi Fage
Filtrasi sampel. Filtrasi sampel dilakukan berdasarkan metode Pitt & Gaston (1995) yang dimodifikasi pada kecepatan sentrifugasi yang dipergunakan yaitu 2800 x g . Sebanyak 4.5 mL sampel LCRT dicampurkan dengan 0.5 mL kultur Salmonella OD600nm=1 dengan jumlah bakteri Salmonella sebanyak 108
CFU/ mL dan ditambahkan 0,5 mL dari 10x NB. Campuran diinkubasi di dalam Waterbath shaker (Certomat WR) selama 24-48 jam pada suhu 37 ºC. Kultur tersebut kemudian disentrifugasi dengan sentrifus Beckman pada kecepatan 2800 x g suhu 40 C selama 20 menit. Sebanyak 3 mL supernatan diambil dengan 5 mL syringe dan difiltrasi dengan membran filter milipore 0.22 µm. Supernatan yang telah difiltrasi dimasukkan ke dalam tabung steril.
Pencawanan. Koloni tunggal isolat Salmonella p15, p19, p38, dan p84 diinokulasikan ke dalam media NB lalu diinkubasi di dalam Waterbath shaker (Certomat WR) dengan kecepatan 150-200 x g pada suhu 370 C selama 24 jam sampai OD600nm=1. Sebanyak 100 µL masing-masing kultur Salmonella p15,
p19, p38, dan p84 dicampurkan dengan 100 µL supernatan yang telah difiltrasi ke dalam tabung steril dan diinkubasi pada suhu 370 C selama 30 menit. Campuran ditambahkan 5 mL soft agar yang bersuhu 470 C, dituang pada media NA. Inkubasi dilakukan pada suhu 370 C selama 24 jam (Atterbury et al. 2007).
Pemurnian fage. Pemurnian fage dilakukan berdasarkan metode Goodridge et al. (2001) yang dimodifikasi pada kecepatan sentrifusgasi 2800 x g. Plak dipindahkan dengan menggunakan pipet Pasteur kemudian plak tersebut dicampurkan dengan 2-3 mL 25% pelarut Ringers. Suspensi fage divortex dan dibiarkan selama 5-10 menit pada suhu ruang. Suspensi tersebut kemudian di sentrifugasi pada kecepatan 2800 x g, suhu 4 ºC, selama 20 menit sebanyak 2 kali ulangan. Supernatan difiltrasi menggunakan membran filter milipore 0.22 µm, kemudian supernatan disimpan untuk stok atau bahan produksi.
p15, p19, p38, dan p84 yang telah diinkubasi selama 3-4 jam pada media NB. Suspensi diinkubasi selama 15 menit pada suhu 37 ºC. Sebanyak 5 mL soft agar yang masih bersuhu 42 ºC dicampurkan, selanjutnya dituang ke media NA, kemudian diinkubasi pada 37 ºC selama 24 jam. Zona bening (plak) yang terbentuk dihitung setelah diinkubasi selama 24 jam.
Penentuan Kisaran Inang Fage
Sebanyak 100 µL kultur bakteri Salmonella nomer 15, 19, 38, dan 84 yang telah ditumbuhkan di media NB selama 3-4 jam dan E. coli non patogen yang telah ditumbuhkan pada media kaldu LB selama 3-4 jam masing-masing dicampurkan dengan stok fage dengan konsentrasi 100 µL, lalu diinkubasi pada suhu 37 ºC selama 15-30 menit. Uji pada E. coli non patogen, sebanyak 5 mL molten top agar yang masih bersuhu 42 ºC dicampurkan, selanjutnya dituang ke media agar cawan LB. Diinkubasi pada suhu 37 ºC selama 24 jam. Uji pada Salmonella, sebanyak 5 mL soft agar yang masih bersuhu 42 ºC dicampurkan, selanjutnya dituang ke media NA. Diinkubasi pada 37 ºC selama 24 jam (Carey-Smith et al. 2006).
Efektivitas Lisis Sel Salmonella oleh Fage
Efektivitas lisis sel Salmonella oleh fage dilakukan berdasarkan metode Atterbury et al. (2007) yang dimodifikasi pada kecepatan sentrifugasi 2800 x g. Sebanyak 100 mL kultur bakteri Salmonella p15, p19, p38, dan p84 yang telah ditumbuhkan di media NB sampai OD600nm=1 dengan jumlah bakteri Salmonella
Pengamatan Morfologi Lisis Sel Salmonella sp. oleh Fage dengan Scanning Electron Microscope (SEM)
Sebanyak 5 mL kultur Salmonella sp. yang telah ditumbuhkan di media NB sampai OD600nm=1 ditambah 100 L stok fage diinkubasi selama 2 jam.
HASIL DAN PEMBAHASAN
Verifikasi Salmonella sp.
Hasil uji Fisiologis menunjukkan isolat p15, p19, p38, dan p84 adalah Salmonella sp. (Tabel 1). Salmonella merupakan bakteri gram negatif berbentuk batang, sebagian besar strain Salmonella memfermentasi glukosa dengan membentuk gas dan asam (Cox 2000). Salmonella tidak memfermentasi laktosa dan sukrosa, menggunakan sitrat sebagai sumber karbon, menghasilkan hidrogen sulfida pada media TSIA, tidak menghasilkan indol, dan negatif untuk uji urease (Garrity et al. 2007; Ray 2001). Salmonella menunjukkan hasil negatif untuk uji VP, KCN, dan positif untuk uji MR (Madigan et al. 2009).
Tabel 1 Hasil uji Fisiologis isolat-isolat Salmonella sp.
Isolat UJI FISIOLOGIS
Salmonella Gram MR VP Urea KCN Indol Sitrat H2S Glu Lak Suk
p15 -* + - - - - + + + - - p19 -* + - - - - + + + - - p38 -* + - - - - + + + - - p84 -* + - - - - + + + - -
Keterangan: -* : gram negatif berbentuk batang, - : reaksi negatif, + : reaksi positif, MR : Metil Red, VP : Voges Proskauer, Glu: Glukosa, Lak: Laktosa, Suk: sukrosa
Isolasi Fage
p19, p38, dan p84 sehingga fage tidak dapat diisolasi dari LCRT di lokasi pengambilan sampel tersebut.
Tabel 2 Tempat pengambilan sampel limbah cair rumah tangga
Asal Jumlah Fage hasil isolasi menggunakan inang Salmonella
Sampel Sampel Isolat p15 Isolat p19 Isolat p38 Isolat p84 untuk mengisolasi fage perlu ditambahkan bakteri sebagai inangnya. Persyaratan utama bagi isolasi dan kultivasi fage ialah adanya kondisi yang optimum untuk pertumbuhan organisme inangnya (Pelczar & Chan 2007). Metode isolasi fage yang dilakukan pada penelitian ini menggunakan penambahan media NB yang merupakan nutrisi untuk meningkatkan pertumbuhan Salmonella sp., agar fage dapat bereplikasi di dalam sel Salmonella sp. dan dapat diperoleh fage dalam jumlah yang banyak. Salmonella sp. ditumbuhkan pada suhu 370 C yang merupakan suhu optimum untuk pertumbuhannya.
Isolasi fage yang berasal dari LCRT di daerah Babakan Raya, Darmaga Bogor diperoleh empat isolat fage yaitu FR15, FR19, FR38, dan FR84 untuk isolat Salmonella p15, p19, p38, dan p84 (Gambar 2). Plak yang terbentuk dari suatu kultur bakteri yang ditumbuhkan di cawan petri merupakan parameter penting dari adanya fage litik. Plak merupakan zona bening yang menandakan adanya lisis sel bakteri inang oleh fage.
laten dan ukuran ledakan fage (banyaknya progeni yang dilepaskan saat sel inang lisis) (Abedon et al. 2001). Periode laten adalah waktu yang dibutuhkan fage untuk melisiskan sel inang (Abedon et al. 2001; Young et al. 2000). Ukuran pembentukan plak fage dari akibat infeksi sel inang berkaitan dengan kemampuan fage bereplikasi dalam sel inang (Pelczar & Chan 2007). Kepekaan galur bakteri terhadap fage yang menyerangnya berbeda-beda akibat adanya variasi molekul reseptor (Flynn et al. 2004).
Pada proses isolasi fage dilakukan tahap pemurnian. Hal ini dilakukan untuk mendapatkan populasi fage yang murni tanpa adanya beberapa bakteri termasuk bakteri inang yang tahan fage. Goodridge et al. (2003) menyatakan masing-masing fage menginfeksi pada sel inang tertentu sehingga sangat diperlukan tahapan untuk memperoleh strain fage yang murni.
Titer merupakan ukuran jumlah virus yaitu jumlah unit infektif per volume cairan. Fage dapat menginfeksi sel inang pada permukaan media dengan memperlihatkan zona lisis. Zona lisis dinamakan plak dan tiap plak berasal dari replikasi satu fage. Jumlah fage sesuai jumlah plak dengan satuan yang disebut Plague forming units (PFU) (Hogg 2005; Tortora et al. 2006).
(A) (B)
(C) (D)
Gambar 2 Pola keragaman plak fage. Fage FR15 (A); fage FR19 (B); fage FR38 (C); fage FR84 (D).
5 mm 5 mm
Tabel 3 Hasilkarakterisasi isolat fage
Isolat Fage Konsentrasi Fage (PFU/mL) Diameter Plak (mm)
FR15 25700 1
FR19 33600 1
FR38 11440 2
FR84 10720 2
Penentuan Kisaran Inang Fage
Penentuan kisaran inang fage dilakukan untuk melihat spesifisitas inang dari fage yang diperoleh. Pada penentuan kisaran inang fage dilakukan uji silang fage FR15, FR19, FR38, dan FR84 dengan Salmonella p15, p19, p38, dan p84 dan E. coli non patogen. Penggunaan E. coli non patogen pada penentuan kisaran inang fage ini bertujuan untuk melihat apakah fage yang berhasil diisolasi dari LCRT di daerah Babakan Raya, Darmaga Bogor ini bisa digunakan sebagai biokontrol pencemaran air dan makanan yang tidak membahayakan kesehatan manusia. E. coli non patogen merupakan flora normal dalam sistem pencernaan manusia. Sehingga pada pengujian penentuan kisaran inang ini diharapkan fage tidak melisis E. coli non patogen. Madigan et al. (2009) menyatakan genus Escherichia banyak terdapat pada sistem pencernaan manusia, Escherichia berperan dalam sintesis vitamin terutama vitamin K dan berperan dalam sistem pencernaan manusia.
Hasil uji kisaran inang menunjukkan bahwa fage FR15, FR19, FR38, dan FR84 semuanya bersifat spesifik inang. Hal ini tampak ketika fage FR15, FR19, FR38, dan FR84 diuji dengan masing-masing inangnya ataupun uji silang dengan isolat Salmonella lainnya dan E. coli non patogen, ternyata kisaran inangnya hanya pada isolat inangnya saja (Tabel 4). Kespesifikan isolat fage yang diperoleh terhadap masing-masing inang menunjukkan bahwa di permukaan sel pada masing-masing inang memiliki reseptor yang spesifik terhadap fage yang tidak dimiliki oleh E. coli non patogen maupun isolat Salmonella lainnya.
alami reseptor-reseptor ini berbeda-beda tergantung dari fagenya. Reseptor bervariasi untuk setiap fage, lipopolisakarida dan protein yang ada pada dinding sel bakteri, asam teikoat, flagella dan pili juga bisa berfungsi sebagai reseptor. Variasi dari reseptor-reseptor ini yang berperan besar terhadap fage spesifik inang (Prescott et al. 2002). Adsorpsi partikel-partikel fage terhadap sel-sel bakteri pada tahap awal infeksi fage bergantung pada reseptor-reseptor spesifik di dinding sel bakteri (Topley & Wilson 1990). Fage sangat spesifik inang, hanya menginfeksi satu serotipe dalam satu spesies bakteri (McLaughlin et al. 2006). Tidak semua fage bersifat spesifik inang, seperti sudah dilaporkan sebelumnya oleh Bielke et al. (2007), yang menyatakan bahwa satu jenis fage hasil penemuannya mampu menginfeksi enam serovar Salmonella berbeda.
Tabel 4 Hasil uji kisaran inang fage
Keterangan: + = mampu melisiskan sel bakteri (terbentuk plak)
- = tidak mampu melisiskan sel bakteri (tidak terbentuk plak)
Efektivitas Lisis Sel Salmonella sp. oleh Fage
Pada pengujian efektivitas lisis sel Salmonella sp. oleh fage, dilakukan dengan mengukur nilai OD (Optical Density) pada panjang gelombang 600 nm. Menghitung jumlah sel tak langsung dapat dilakukan melalui penetapan kekeruhan atau turbiditas. Turbiditas dapat diukur dengan spektrofotometer, untuk organisme uniselular nilai OD sebanding dengan jumlah sel. Data turbiditas dapat dipakai sebagai substitusi penetapan jumlah sel dengan hitungan langsung (Hogg 2005).
terlihat adanya penurunan nilai OD yang lebih cepat dibandingkan dengan perlakuan kontrol (tanpa penambahan fage).
Salmonella spp. pada suhu 370 C bermultiplikasi setiap 25-26 menit (Adams & Moss 1995). Salmonella pada suhu 400 C bermultiplikasi setiap 25 menit (Pearson & Dutson 1995). Fage mampu melisiskan sel bakteri setelah 22 menit dan menghasilkan 200 progeni (Hogg 2005). Pada suhu 35 0C fage memiliki periode laten 15-20 menit dan menghasilkan 100-230 progeni (McLaughlin & King 2008). Penurunan nilai OD yang mengindikasikan adanya penurunan jumlah sel Salmonella sp. dikarenakan laju pertumbuhan fage lebih cepat dibandingkan dengan laju pertumbuhan Salmonella sp., sehingga fage mampu mengurangi pertumbuhan Salmonella sp. dengan cara melisiskan sel Salmonella sp.
Efektivitas fage dalam melisis sel Salmonella sp. untuk semua isolat fage berbeda-beda, hal ini dikarenakan galur Salmonella yang diinfeksinya juga berbeda. Ini dibuktikan dengan hasil uji kisaran inang, yang menyatakan satu galur fage hanya mampu menginfeksi satu isolat Salmonella.
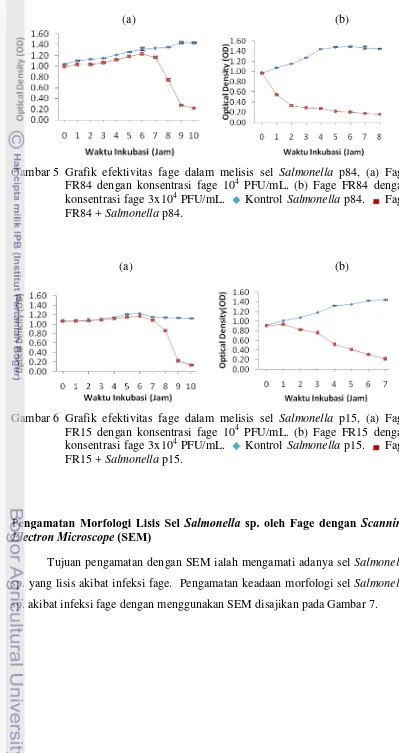
Pengaruh penambahan fage dengan konsentrasi 104 PFU/mL dan 3x104 PFU/mL terhadap penurunan nilai OD untuk masing-masing isolat Salmonella berbeda-beda. Pada konsentrasi fage sebesar 104 PFU/mL, fage FR38 memiliki aktivitas yang tertinggi yaitu mampu menurunkan nilai OD suspensi bakteri p38 setelah 5 jam, dan pada konsentrasi fage sebesar 3x104 PFU/mL fage FR38 mampu menurunkan nilai OD suspensi bakteri p38 setelah 3 jam (Gambar 3).
Pada penambahan konsentrasi fage sebanyak 3x104 PFU/mL ternyata fage FR84 mampu menurunkan nilai OD suspensi bakteri p84 dalam waktu 1 jam, sedangkan pada konsentrasi fage FR84 sebesar 104 PFU/mL mampu menurunkan nilai OD suspensi bakteri p84 setelah 7 jam inkubasi (Gambar 5). Hal ini diduga karena penambahan konsentrasi fage FR84 sebesar 104 PFU/mL jumlahnya masih kurang banyak sehingga membutuhkan waktu yang lama untuk menurunkan nilai OD suspensi bakteri p84. Penyebab lainnya dapat juga disebabkan oleh lamanya masa periode laten dari fage FR84 sehingga laju pertumbuhan Salmonella p84 lebih cepat dibandingkan kemampuan lisis fage FR84. Penyebab lain lamanya penurunana nilai OD suspensi bakteri p84 diduga karena adanya perlawanan dari sel inang yang menghambat replikasi fage dengan menggunakan enzim endonuklease restriksi yang merusak DNA fage setelah injeksi. Young et al. (2000) menyatakan periode laten dikontrol oleh kompleks protein fage yaitu holin. Holin menahan aktivitas endolisin mencerna dinding sel, adanya mutasi pada gen holin secara signifikan dapat memodifikasi waktu lisis sel inang. Hogg (2005) menyatakan bahwa meskipun sistem restriksi dapat memberi perlindungan terhadap sel bakteri, beberapa virus DNA dapat mengatasi mekanisme tersebut dengan memodifikasi asam nukleatnya sendiri sehingga tidak dapat dipengaruhi enzim restriksi. dibandingkan fage pada penelitian Filho et al. (2007).
lisozim. Enzim ini mendegradasi polimer lipopolisakarida sel bakteri Salmonella sp. dalam proses infeksi yang selanjutnya melisiskan sel tersebut.
(a) (b)
Gambar 3 Grafik efektivitas fage dalam melisis sel Salmonella p38, (a) Fage
FR38 dengan konsentrasi fage 104 PFU/mL. (b) Fage FR38 dengan konsentrasi fage 3x104 PFU/mL. Kontrol Salmonella p38. Fage FR38 + Salmonella p38.
(a) (b)
(a) (b)
Gambar 5 Grafik efektivitas fage dalam melisis sel Salmonella p84, (a) Fage FR84 dengan konsentrasi fage 104 PFU/mL. (b) Fage FR84 dengan konsentrasi fage 3x104 PFU/mL. Kontrol Salmonella p84. Fage FR84 + Salmonella p84.
(a) (b)
Gambar 6 Grafik efektivitas fage dalam melisis sel Salmonella p15, (a) Fage FR15 dengan konsentrasi fage 104 PFU/mL. (b) Fage FR15 dengan konsentrasi fage 3x104 PFU/mL. Kontrol Salmonella p15. Fage FR15 + Salmonella p15.
Pengamatan Morfologi Lisis Sel Salmonella sp. oleh Fage dengan Scanning Electron Microscope (SEM)
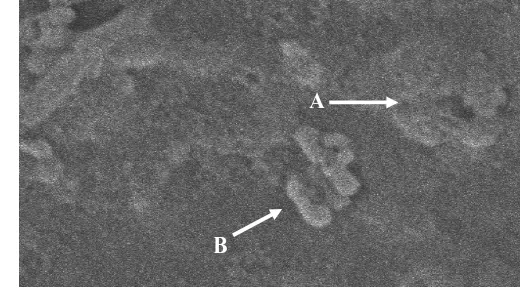
Gambar 7 Morfologi kerusakan sel Salmonella sp. oleh infeksi fage, perbesaran 10.000 x. Tanda panah (A) sel Salmonella sp. yang sudah lisis; (B) sel Salmonella sp. yang baru mengalami kerusakan.
Hasil pengamatan sel bakteri Salmonella sp. dengan menggunakan SEM memperlihatkan adanya pengaruh dari infeksi fage dengan adanya sel-sel Salmonella sp. yang mengalami kerusakan dan lisis. Hal ini menunjukkan bahwa fage yang diisolasi dari limbah cair rumah tangga di daerah Babakan Raya, Dermaga Bogor secara pasti dapat melisiskan bakteri Salmonella sp.
Cara reproduksi fage litik terdiri atas lima tahap, yaitu: adsorpsi, penetrasi, sintesis, perakitan, dan lisis sel. Fage litik saat menginfeksi sel bakteri akan bereplikasi di dalam sel inang membentuk sejumlah fage baru kemudian akan melisiskan sel inang dan menginfeksisel inang lainnya (Toro et al. 2005; Tortora et al. 2006; Cowan & Talaro 2009). Fage dapat melisiskan sel inangnya karena memiliki enzim lisozim. Enzim lisozim yang dihasilkan oleh gen fage disintesiskan di dalam sel bakteri yang menjadi inangnya. Enzim ini yang menyebabkan pecahnya dinding sel bakteri (lisis) dan fage yang baru terbentuk dilepaskan dari sel inang (Tortota et al. 2006). Lisozim adalah enzim yang memutuskan ikatan β-1,4-glikosida antara asam-N-asetil glukosamin dengan asam-N-asetil muramat pada peptidoglikan sehingga dapat merusak dinding sel bakteri (lisis) (Madigan et al. 2009).
A
KESIMPULAN DAN SARAN
Kesimpulan
Empat isolat fage, yaitu fage FR15, FR19, FR38 dan FR84 bersifat spesifik inang. Berdasarkan karakterisasi diameter plak yang dimilikinya fage FR38 dan FR84 memiliki diameter plak 2 mm, sedangkan fage FR15 dan FR19 memiliki diameter plak 1 mm. Pada efektivitas lisis sel Salmonella sp. oleh fage, penambahan fage sebesar 104 PFU/mL fage FR38 memiliki aktivitas yang tertinggi yaitu mampu menurunkan nilai OD suspensi Salmonella p38 setelah 5 jam. Pada penambahan fage sebanyak 3x104 PFU/mL fage FR84 memiliki aktivitas yang tertinggi yaitu mampu menurunkan nilai OD suspensi Salmonella p84 dalam waktu 1 jam.
Saran
DAFTAR PUSTAKA
Abedon ST, Herschler TD, Stopar D. 2001. Bacteriophage latent-period evaluation as a response to resource availability. Appl Environ Microbiol 67: 4233-4241.
Abuladze T, Li M, Menetrez MY, Dean T, Senecal A, Sulakvelidze A. 2008. Bacteriophages reduce experimental contamination of hard surfaces, tomato, spinach, broccoli, and ground beef by Escherichia coli O157:H7. Appl Environ Microbiol 74: 6230-6238.
Ackermann HW, Dubow MS. 1987. Viruses of Prokaryotes. Volume ke-2, Natural groups of bacteriophages. Boca Raton: CRC Pr.
Ackermann HW. 1999. Tailed bacteriophages. The order Caudovirales. Adv
Adams MR, Moss MO. 1995. Food Microbiology. Cambridge: The royal Society of Chemistry.
Alisky J, Iczkowski K, Rapoport A, Troitsky N. 1998. Bacteriophage show promise as antimicrobial agents. J Infect 36: 5-15.
Atterbury RJ, Van Bergen MAP, Ortiz F, Lovell MA, Harris JA, De Boer A, Wagenaar JA, Allen VM, Barrow PA. 2007. Bacteriophage therapy to reduce Salmonella colonization of broiler chickens. Appl Environ Microbiol 73:4543-4549.
Barrow PA, Soothill JM. 1997. Bacteriophage therapy and prophylaxis: rediscover and renewed assessment of potential. Trends Microbiol 5: 268-271.
Bielke L, Higgins S, Donoghue D, Hargis BM. 2007. Salmonella host range of bacteriophages that infect multiple genera. Poultry Science 86: 2536-2540.
Bhunia AK. 2008. Foodborne Microbial Pathogens: Mechanisms and Pathogenesis. New York: Springer.
Bruttin A, Brussow H. 2005. Human volunteers receiving Escherichia coli phage T4 orally: a safety test of phage therapy. Antimicrob Agents Chemother
49:2874-2878
Cann AJ. 1993. Principles of Molecular Virology. New York: Harcourt Brace and Co.
Carey-Smith GV, Billington C, Cornelius AJ, Hudson JA, Heinemann JA. 2006. Isolation and characterization of bacteriophages infecting Salmonella spp. FEMS Microbiol Lett 258: 182-186.
Cary JW, Linz JE, Bhatnagar D , editor. 2000. Molecular and cellular biology of Salmonella pathogenesis in microbial foodborne disease: Mechanisms of pathogenesis and toxin synthetis. Ed ke-1. Pennsylvania: Technomic. Chighladze E, Alavidze Z, Brown T, Pasternack G, Morris JG, Sulakvelidze A.
2001. Application of lytic phages for reducing contamination of poultry with selected Salmonella serotypes. Abstract 2001 Annual Meeting, American Society for Microbiology.
Chung YH, Kim SY, Chang YH. 2003. Prevalence and antibiotic suspectibility of Salmonella isolated from foods in Korea from 1993 to 2001. J Food Prot 66: 1154-1157.
Cogan TA, Humphrey TJ. 2003. The rise and fall of SalmonellaEnteritidis in the UK. J Appl Microbiol 94: 114-119.
Cooper GL. 1994. Salmonellosis: infections in man and the chicken: pathogenesis and development of live vaccines – a review. Vet Bull 64:123-143.
Cowan MK, Talaro KP, editor. 2009. Microbiology a Systems Approach. Ed ke-2. New York: McGraw-Hill.
Cox J. 2000. Salmonella (Introduction). Di dalam: Robinson RK, Batt CA, Patel PD, editor. Ensyclopedia of Food Microbiology, Ed ke-3. San Diego: Academic Pr.
Desselberger U. 1998. Resistance to antibiotics and other antimicrobial agents. Soc Gen Microbiol Q 25:94-95.
Doyle MP, Beuchat LR, Montville TJ, editor. 2007. Food Microbiology: fundamentals and frontiers, Ed ke-3. Washington DC: ASM Pr.
Filho ARL, Higgins JP, Higgins SE, Gaona G, Wolfenden AD, Tellez G, Hargis BM. 2007. Ability of bacteriophages isolated from different sources to reduce Salmonella enterica serovar Enteritidis in vitro and in vivo. Poultry Science 86: 1904-1909.
Fiorentin L, Vieira ND, Barioni W Jr. (2005) Oral treatment with bacteriophages reduces the concentration of Salmonella enteritidis PT4 in caecal contents of broilers. Avian Pathol 34:258-263
Flynn GO, Ross RP, Fitzgerald GF, Coffey A. 2004. Evaluation of a cocktail of three bacteriophages for biocontrol of Escherichia coli O157: H7. Appl Environ Microbiol 70: 3417-3242.
Foschino R, Perrone F, Galli A. 1995. Characterization of two virulent Lactobacillus fermentum bacteriophages isolated from sour dough. J Appl Bacteriol 79: 677-683.
Garrity GM, Brenner DJ, Krieg NR, Staley JR, editor. 2007. Bergey's Manual of Systematic Bacteriology: The Proteobacteria. Volume ke-2. USA: Springer.
Goodridge L, Gallaccio A, Griffiths WM. 2001. Morphological, host range, and genetic characterization of two colifages. Appl Environ Microbiol 69: 5364-5371.
Guenther S, Huwyler D, Richard S, Loessner MJ. 2009. Virulent bacteriophage for efficient biocontrol of Listeria monocytogenes in ready-to-eat foods. Appl Environ Microbiol 75: 93-100.
Guttman B, Raya R, Kutter E. 2005. Basic phage biology. Di dalam: Kutter E, Sulakvelidze A, editor. Bacteriophages Biology and Application. Boca Raton: CRC Pr.
Hogg S. 2005. Essential Microbiology. England: Jhon Wiley & Sons.
Ho K. 2001. Bacteriophage therapy for bacterial infections. Perspect Biol Med 44:1-16.
Hugas M, Tsigarida E, Robinson T, Colistri P. 2009. The EFSA Scientific Panel on Biological Hazard first mandate: May 2003 - May 2006. Insight into foodborne zoonosis. Trends Food Sci Technol 20: 188-193.
Inglis TJJ. 2007. Microbiology and Infection: A Clinical Core Text for Integrated Curricula with Self-Assessment. Ed ke-2. Philadelphia: Elsevier Health Sciences.
Jay JM. 2000. Modern Food Microbiology. Ed ke-6. Maryland: Aspen Inc. Joerger RD. 2003. Alternatives to antibiotics: bacteriocins, antimicrobial peptides,
and bacteriophages. Poult Sci 82: 640-647.
Kim KP. 2007. The effect of environmental factors on phage stability and infectivity on their host bacteria: a case study for an Escherichia coli phage (T7), a Listeria phage (A511), and a Salmonella phage (Felix O1). Food Sci Biotechnol 16: 398-403.
Kusumaningrum HD, Suliantari, Dewanti HR. 2012. Multidrug resistance among different serotypes of Salmonella isolates from fresh products in Indonesia. IFRJ 19: 57-63.
Kutter E, Sulakvelidze A. 2005. Introduction. Di dalam Kutter E, Sulakvelidze A, editor. Bacteriophages Biology and Application. Boca Raton: CRC Pr. Hlm 1-4.
Madigan MT, Martinko JM, Brock TD. 2009. Brock Biology of Microorganism. New Jersey: Pearson Prentice Hall.
Marriot NG. 1999. Principle of Food Sanitation. Gaithersburg, Maryland: Aspen Inc.
Meladze GD, Mebuke MG, Chkhetiia NS, Kiknadze NI, Koguashvili GG. 1982. Efficacy of staphylococcal bacteriophage in the treatment of purulent lung and pleural diseases. Grudn Khir 1: 53-56.
McLaughlin MR, Balaa MF, Sims J, King R. 2006. Isolation of Salmonella bacteriophages from swine effluent lagoons. J Environ Qual 35:522-528. McLaughlin MR, King RA. 2008. Characterization of Salmonella bacteriophages
isolated from swine lagoon effluent. Curr Microbiol 56: 208-213.
Modi R, Hirvi Y, Hill A, Griffiths MW. 2001. Effect of phage on survival of Salmonella enteritidis during manufacture and storage of chedder cheese made from was and pasteurized milk. J Food Protect 64: 927-933.
Molbak K, Olsen JE, Wegener HC. 2006. Salmonella Infection. Di dalam: Riemann HP, Cliver DO, editor. Foodborne Infections and Intoxications. California: Elsevier.
Mrema N, Mpuchane S, Gashe BA. 2006. Prevalence of Salmonella in raw minced meat, raw fresh sausages and raw burger patties from retail outlets in Gaborone, Botswana. Food Control 17: 207-212.
Neu CH. 1992. The crisis in antibiotic resistance. Science 257:1064-1073.
Nogrady N, Kardos G, Bistyak A, Turcsanyi I, Meszaros J, Galantai Z, Juhasz A, Samu P, Kaszanyitzky JE, Paszti J, Kiss I. 2008. Prevalence and characterization of Salmonella infantis isolates originating from different points of the broiler chicken-human food chain in Hungary. J Food Microbiol 127:162-167.
Ochman H, Selander RK. 1984. Standard reference strains of Escherichia coli from natural populations. J Bacteriol 157:690-693.
Pao S, Randolph SP, Westbrook EW, Shen H. 2004. Use of bacteriophage to control Salmonella in experimentally contaminated sprout seeds. J Food Sci 69: 127-130.
Pitt TL, Gaston MA. 1995. Bacteriophage Typing. Methods Mol Biol 46:15-26. Poernomo S. 2004. Variasi Tipe Antigen Salmonella pullorum yang ditemukan
di Indonesia dan penyebaran serotipe Salmonella pada ternak (PO). Wartazoa 14:143-159.
Prescott LM, Harley JP, Klein DA. 2002. Microbiology. Ed ke-5. New York: McGraw-Hill.
Prescott LL. 1993. Microbiology. Elgin: William C Brown Pub.
Skandelidze VM. 1991. The combined use the specific phages and antibiotics in different infectious allergoses. Vrach Delo 3:60-63.
Sklar IB, Joerger RD. 2001. Attempts to utilize bacteriophage to combat Salmonella enterica serovar Enteritidis infection on chickens. J Food Safety 21: 15-30
Slopek S, Durlakowa I, Weber-Dabrowska B, Kucharewicz-Krukowska A, Dabrowski M, Bisikiewicz R. 1983. Results of bacteriophage treatment of suppurative bacterial infections. Arch Immunol Ther Exp 3: 267 - 29.
Smith HW, Huggins MB, Shaw KM. 1987. The control of experimental Escherichia coli diarrhea in claves by mean of bacteriophage. J Gen Microbiol 133:1111-1126.
Sudarmono P, poernomo S dan suhadi I. 2001. The current management of Salmonella typhi and Salmonella in Indonesia. In Typhoid fever and other Salmonellosis. Ed ke-1. The Fourth International Symposium on thypoid fever and other Salmonellosis. Taipei, Taiwan.
Sulakvelidze A, Alavidze Z, Morris JG Jr. 2001. Bacteriophage therapy. Antimicrob Agents Chemother 45: 649-59.
Suwandono, Destri AM, Simanjuntak C. 2005. Salmonellosis dan surveillans demam tifoid yang disebabkan Salmonella di Jakarta Utara. Disampaikan dalam Lokakarya Jejaring Intelijen Pangan – BPOM RI, Jakarta.
Tjaniadi P, Lesmana M, Subekti D, Machpud N, Komalarini S, Santoso W, Simanjuntak CH, Punjabi N, Campbell JR, Alexander WK, Beecham III HJ, Corwin AL, Oyofo BA. 2003. Antimicrobial resistance of bacterial pathogens associated with diarrheal patients in Indonesia. Am J Trop Med Hyg 68: 666-670.
Topley WWC, Wilson GS. 1990. Principles of Bacteriology, Virology and Immunity. London: B.C. Decker.
Toro H, Price SB, McKee S, Hoerr FJ, Krehling J, Perdue M, Bauermeister L. 2005. Use of bacteriophages in combination with competitive exclusion to reduce Salmonella from infected chickens. Avian Dis 49:118-124.
Tortora GJ, Funke BR, Case CL. 2006. Microbiology: an Introduction. Ed ke-9. New York: Benjamin Cummings.
Vought KJ, Tatini SR. 1998. Salmonella enteritidis contamination of ice cream associated with a 1994 multistate outbreak. J Food Protect 61: 5-10.
Wagener HC, Hald T, Wong DLF, Madsen M, Korsgaard H, Bager F, Gerner-Smidt P, Molbak K. 2003. Salmonella Control Programs in Denmark. EID 9: 774-780.
Wendelschafer-Crabb G, Erlandsen SL, Walker DH Jr. 1975. Conditions critical for optimal visualization of bacteriophage adsorbed to bacterial surfaces by scanning electron microscopy. J Virol 15: 1498-1503.
Whichard JM, Sriranganathan N, Pierson FW. 2003, Suppresion of Salmonella growth by wild-type and large-plaque variants of bacteriophage Felix 01 in liquid culture and on chicken frankfurters. J Food Protect 66: 220-225. White PL, Baker AR, James WO. 1997. Strategies to control Salmonella and
Campylobacter in raw poultry products. Rev Sci Tech 16: 525-541.
Wommack KE, Colwell RR. 2000. Virioplankton: viruses in aquatic ecosystems. Microbiol Mol Biol Rev 64: 69-114.
RINGKASAN
RIRI NOVITA SUNARTI. Spesifisitas dan Efektivitas Fage Litik Salmonella sp. Di bimbing oleh SRI BUDIARTI dan IMAN RUSMANA.
Salmonellosis merupakan salah satu penyakit yang ditularkan melalui makanan dan air. Salmonellosis disebabkan oleh bakteri Salmonella sp. Gejala salmonellosis pada manusia dapat berupa sindrom gastroenteritis salah satunya adalah diare. Bakteri Salmonella sp. yang digunakan pada penelitian ini ialah isolat Salmonella p15, p19, p38, dan p84 yang merupakan koleksi Dr. dr. Sri Budiarti. Beberapa studi melaporkan bahwa galur S. enteritidis dan S. typhi yang diisolasi dari penderita diare di Indonesia resisten terhadap antibiotik. S. enteritidis resisten terhadap ciprofloxacin dan norfloxacin. S. typhi resisten terhadap trimetroprim-sulfamethoxazole, chloramphenicol, streptomycin dan tetracycline. Galur S. Weltevreden, S. Kenthucky, S. Typhimurium dan S. Paratyphy C yang diisolasi dari produk segar di Indonesia resisten terhadap antibiotik chloramphenicol, erythromycin, tetracyclin, sulfamethoxazole dan streptomycin. Adanya bakteri Salmonella sp. yang resisten antibiotik ini menyulitkan pengobatan salmonellosis, untuk itu perlu dicari cara pengganti antibiotik untuk menanggulangi masalah penyakit salmonellosis. Salah satunya dengan menggunakan bakteriofage (fage) yang dapat melisiskan sel bakteri. Penelitian ini bertujuan untuk mengkarakterisasi dan menguji efektivitas fage litik dalam melisis Salmonella sp. Hasil penelitian ini diharapkan dapat diaplikasikan sebagai biokontrol pencemaran air dan makanan sehingga dapat mencegah penyakit salmonellosis.
Fage diisolasi dari limbah cair rumah tangga di daerah Babakan Raya, Darmaga Bogor. Isolat fage yang diperoleh dimurnikan dan dibiakkan, selanjutnya dilakukan kuantifikasi fage, ditentukan kisaran inangnya, dilakukan uji efektivitasnya dalam melisiskan sel Salmonella sp., dan diamati morfologi lisis sel Salmonella sp. oleh fage dengan SEM.
Pada penelitian ini diperoleh empat isolat fage yaitu fage FR15, FR19, FR38, dan FR84. Keempat isolat fage tersebut bersifat spesifik inang. Berdasarkan karakterisasinya, diameter plak (zona bening) fage FR38 dan FR84 sebesar 2 mm, sedangkan fage FR15 dan FR19 sebesar 1 mm. Ukuran plak sebanding dengan efisiensi adsorpsi, panjang periode laten, dan banyaknya progeni yang dilepaskan pada saat sel lisis. Titer fage diukur dengan cara menghitung jumlah plak yang terbentuk (Plague forming units (PFU)), fage FR15 bertiter 25700 PFU/mL, fage FR19 bertiter 33600 PFU/mL, fage FR38 bertiter 11440 PFU/mL, dan fage FR84 bertiter 10720 PFU/mL.
tertinggi yang mampu menurunkan nilai OD suspensi bakteri Salmonella p38 setelah 5 jam. Pada penambahan konsentrasi fage sebanyak 3x104 PFU/mL fage FR84 mampu menurunkan nilai OD suspensi bakteri Salmonella p84 dalam waktu 1 jam. Penurunan nilai OD yang mengindikasikan adanya penurunan jumlah sel Salmonella sp. dikarenakan laju pertumbuhan fage lebih cepat dibandingkan dengan laju pertumbuhan Salmonella sp., sehingga fage mampu mengurangi pertumbuhan Salmonella sp. dengan cara melisiskan sel Salmonella sp. Fage mampu melisiskan sel Salmonella sp. karena fage memiliki enzim polisakarida depolimerase dan lisozim. Enzim ini mendegradasi polimer lipopolisakarida sel bakteri Salmonella sp. dalam proses infeksi selanjutnya melisiskan sel tersebut. Hasil ini dilakukan pengamatan dengan menggunakan SEM, dari pengamatan menunjukkan adanya sel Salmonella sp. yang lisis. Hal ini menunjukkan bahwa fage secara pasti dapat melisiskan bakteri Salmonella sp.
Kata kunci: Salmonella sp., fage litik,salmonellosis.
SPESIFISITAS DAN EFEKTIVITAS
FAGE LITIK Salmonella sp.
RIRI NOVITA SUNARTI
SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Spesifisitas dan Efektivitas Fage Litik Salmonella Sp. adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2012
ABSTRACT
RIRI NOVITA SUNARTI. Specificity and effectiveness of Salmonella sp. lytic phage. Under supervision of SRI BUDIARTI and IMAN RUSMANA
Salmonellosis is caused by Salmonella sp. The presence of Salmonella sp. which resistant to antibiotics make it more difficult to control salmonellosis. Therefore it should be considered an alternative way to control the disease. One of the alternative application is using bacteriophage which is a natural pathogen of the bacteria. The use of lytic phage as natural and non toxic agent to reduce and control the human pathogenic bacteria has a great potential application, because phages are part of the gastrointestinal and environmental ecosystem. The purpose of this study was to characterize and test the effectiveness of the lytic fage to lyse Salmonella sp. The results of study obtained four isolates of phages, named phage FR15, FR19, FR38, and FR84. Each phage is specific to its host. Based on the determination of plaque diameter, phage FR38 and FR84 were 2 mm in diameter, while phage FR15 dan FR19 were 1 mm. Phage titer of FR19 was 33600 PFU mL-1, phage FR15 was 25700 PFU mL-1, phage FR38 was 11440 PFU mL-1,and phage FR84 was 10720 PFU mL-1. Effectiveness of phage infection to Salmonella sp. determined by addition of phage 104 PFUmL-1 indicated that phage FR38 had the highest lytic activity. It was able to reduce optical dencity of Salmonella p38 cells after 5 hours inoculation of the phage. However, addition 3x104 PFU mL-1 of phage indicated that phage FR84 had the highest lytic activity. It was able to reduce significally of optical dencity Salmonella p84 cells within 1 hour. The results of this study is expected to be applied as a biocontrol of Salmonella sp. in water and food in order to reduce salmonellosis.
RINGKASAN
RIRI NOVITA SUNARTI. Spesifisitas dan Efektivitas Fage Litik Salmonella sp. Di bimbing oleh SRI BUDIARTI dan IMAN RUSMANA.
Salmonellosis merupakan salah satu penyakit yang ditularkan melalui makanan dan air. Salmonellosis disebabkan oleh bakteri Salmonella sp. Gejala salmonellosis pada manusia dapat berupa sindrom gastroenteritis salah satunya adalah diare. Bakteri Salmonella sp. yang digunakan pada penelitian ini ialah isolat Salmonella p15, p19, p38, dan p84 yang merupakan koleksi Dr. dr. Sri Budiarti. Beberapa studi melaporkan bahwa galur S. enteritidis dan S. typhi yang diisolasi dari penderita diare di Indonesia resisten terhadap antibiotik. S. enteritidis resisten terhadap ciprofloxacin dan norfloxacin. S. typhi resisten terhadap trimetroprim-sulfamethoxazole, chloramphenicol, streptomycin dan tetracycline. Galur S. Weltevreden, S. Kenthucky, S. Typhimurium dan S. Paratyphy C yang diisolasi dari produk segar di Indonesia resisten terhadap antibiotik chloramphenicol, erythromycin, tetracyclin, sulfamethoxazole dan streptomycin. Adanya bakteri Salmonella sp. yang resisten antibiotik ini menyulitkan pengobatan salmonellosis, untuk itu perlu dicari cara pengganti antibiotik untuk menanggulangi masalah penyakit salmonellosis. Salah satunya dengan menggunakan bakteriofage (fage) yang dapat melisiskan sel bakteri. Penelitian ini bertujuan untuk mengkarakterisasi dan menguji efektivitas fage litik dalam melisis Salmonella sp. Hasil penelitian ini diharapkan dapat diaplikasikan sebagai biokontrol pencemaran air dan makanan sehingga dapat mencegah penyakit salmonellosis.
Fage diisolasi dari limbah cair rumah tangga di daerah Babakan Raya, Darmaga Bogor. Isolat fage yang diperoleh dimurnikan dan dibiakkan, selanjutnya dilakukan kuantifikasi fage, ditentukan kisaran inangnya, dilakukan uji efektivitasnya dalam melisiskan sel Salmonella sp., dan diamati morfologi lisis sel Salmonella sp. oleh fage dengan SEM.
Pada penelitian ini diperoleh empat isolat fage yaitu fage FR15, FR19, FR38, dan FR84. Keempat isolat fage tersebut bersifat spesifik inang. Berdasarkan karakterisasinya, diameter plak (zona bening) fage FR38 dan FR84 sebesar 2 mm, sedangkan fage FR15 dan FR19 sebesar 1 mm. Ukuran plak sebanding dengan efisiensi adsorpsi, panjang periode laten, dan banyaknya progeni yang dilepaskan pada saat sel lisis. Titer fage diukur dengan cara menghitung jumlah plak yang terbentuk (Plague forming units (PFU)), fage FR15 bertiter 25700 PFU/mL, fage FR19 bertiter 33600 PFU/mL, fage FR38 bertiter 11440 PFU/mL, dan fage FR84 bertiter 10720 PFU/mL.
tertinggi yang mampu menurunkan nilai OD suspensi bakteri Salmonella p38 setelah 5 jam. Pada penambahan konsentrasi fage sebanyak 3x104 PFU/mL fage FR84 mampu menurunkan nilai OD suspensi bakteri Salmonella p84 dalam waktu 1 jam. Penurunan nilai OD yang mengindikasikan adanya penurunan jumlah sel Salmonella sp. dikarenakan laju pertumbuhan fage lebih cepat dibandingkan dengan laju pertumbuhan Salmonella sp., sehingga fage mampu mengurangi pertumbuhan Salmonella sp. dengan cara melisiskan sel Salmonella sp. Fage mampu melisiskan sel Salmonella sp. karena fage memiliki enzim polisakarida depolimerase dan lisozim. Enzim ini mendegradasi polimer lipopolisakarida sel bakteri Salmonella sp. dalam proses infeksi selanjutnya melisiskan sel tersebut. Hasil ini dilakukan pengamatan dengan menggunakan SEM, dari pengamatan menunjukkan adanya sel Salmonella sp. yang lisis. Hal ini menunjukkan bahwa fage secara pasti dapat melisiskan bakteri Salmonella sp.
Kata kunci: Salmonella sp., fage litik,salmonellosis.
© Hak cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SPESIFISITAS DAN EFEKTIVITAS
FAGE LITIK Salmonella sp.
RIRI NOVITA SUNARTI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Spesifisitas dan Efektivitas Fage Litik Salmonella sp. Nama : Riri Novita Sunarti
NIM : G351090121
Disetujui Komisi Pembimbing
Dr. dr. Sri Budiarti Dr. Ir. Iman Rusmana, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Mikrobiologi
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kapada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2010 hingga Agustus 2011 ini ialah Spesifisitas dan Efektivitas Fage Litik Salmonella sp. Judul ini dipilih karena Salmonella sp. adalah bakteri penyebab salmonellosis, salmonellosis ditularkan melalui air dan makanan. Bakteri Salmonella sp. banyak yang resisten terhadap antibiotik, sehingga diperlukan alternatif selain antibiotik untuk menanggulangi masalah penyakit salmonellosis, yaitu dengan menggunakan fage litik yang spesifik dan efektif untuk digunakan sebagai biokontrol pencemaran air dan makanan.
Terimakasih penulis ucapkan kepada Hibah Penelitian TIM Pascasarjana (HPTP) 2010 yang membiayai penelitian ini melalui Dr. dr. Sri Budiarti sebagai ketua TIM Peneliti. Terima kasih penulis ucapkan kepada Ibu Dr. dr. Sri Budiarti selaku ketua komisi pembimbing, yang telah banyak memberikan bimbingan, saran, nasihat, masukan, dan arahan. Bapak Dr. Ir. Iman Rusmana selaku anggota komisi pembimbing, yang telah memberikan bimbingan, arahan, dan masukan. Ibu Dr. Drh. Sri Murtini, M.Si. selaku penguji di luar komisi pembimbing, yang telah memberikan masukan dan penyempatan waktunya. Ibu Dr. Ir. Gayuh Rahayu selaku ketua program studi atas diizinkannya penelitian di Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB, IPB, Darmaga. DIKTI melalui kopertis wilayah II yang telah memberikan beasiswa kepada penulis selama menempuh pendidikan di Sekolah Pascasarjana IPB. Ibu Dewi selaku teknisi di Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB, IPB, Darmaga. Ibu Dr. Endang selaku peneliti di Laboratorium SEM, LIPI Cibinong. Ucapan terima kasih juga disampaikan kepada suamiku Erfandy Suryawan, mami, papi, putraku Ahmad Idris Rifandy, serta seluruh keluarga, atas segala doa, perhatian, dukungan, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2012