Lampiran 2. Gambar simplisia kulit bawang merah
Sebelum dikeringkan
Lampiran 4. Bagan alur penelitian
• Hasil skrining fitokimia simplisia
• Penetapan kadar air simplisia
• Penetapan kadar sari larut dalam air simplisia
• Penetapan kadar sari larut dalam etanol simplisia
• Penetapan kadar abu total simplisia
• Penetapan kadar abu tidak larut asam simplisia
• Hasil skrining fitokimia ekstrak • Penetapan kadar air ekstrak • Penetapan kadar abu total
ekstrak
• Penetapan kadar abu tidak larut asam esktrak
dilakukan uji aktivititas hepatoprotektor
(lihat di halaman selanjutnya)
Lampiran 4 (lanjutan). Bagan alur penelitian
24 ekor mencit jantan
Normal :
diberikan perlakuan selama 14 hari secara per oral
diberikan parasetamol 1 g/kg bb secara per oral 6 jam setelah pemberian perlakuan terakhir
didislokasi di leher pada hari ke 15
Lampiran 5. Gambar mikroskopik serbuk simplisia kulit bawang merah pada
perbesaran 10 x 40
Mikroskopik serbuk simplisia kulit bawang merah pada perbesaran 10 x 40
Keterangan : 1 = serabut sklerenkim
2 = parenkim berisi tetesan minyak 3 = kristal kalsium oksalat bentuk prisma 4 = trakea dengan penebalan bentuk tangga
1
2
3
Lampiran 6. Perhitungan karakterisasi simplisia kulit bawang merah dan
EEKBM
Perhitungan Penetapan Kadar Air dari Simplisia Kulit Bawang Merah dan EEKBM
No Simplisia Ekstrak
Berat (g) Kadar Air (mL) Berat (g) Kadar Air (mL)
1 5,003 0,05 5,007 0,05
2 5,008 0,5 5,018 0,10
3 5,010 0,05 5,012 0,10
Simplisia
1. % Kadar Air I = 0,05
5,003x100% = 1,00%
2. % Kadar Air II = 0,5
5,008x100% = 9,98%
3. % Kadar Air III = 0,05
5,010x100% = 1,00%
% Kadar Air Rata-Rata = 0,99+ 9,98+ 0,99
3 = 4,00%
Ekstrak
1. % Kadar Air I = 0,05
5,007x100% = 1,00%
2. % Kadar Air II = 0,10
5,018x100% = 2,00%
3. % Kadar Air III = 0,10
5,012x100% = 2,00%
4. % Kadar Air Rata-Rata = 3,94+ 3,99 + 3,99
3 = 1,67%
% Kadar air= volume air (mL)
Lampiran 6.(lanjutan)
Perhitungan penetapan kadar sari larut air dari simplisia kulit bawang merah
Lampiran 6.(lanjutan)
Perhitungan penetapan kadar sari larut etanol dari simplisia kulit bawang merah
No Berat Sampel (g) Berat Sari (g)
% Kadar Sari Larut Etanol Rata-Rata = 12,60%+ 12,70% + 13,09% 3
Lampiran 6. (lanjutan)
Perhitungan penetapan kadar abu total dari serbuk simplisia kulit bawang merah dan EEKBM
No Simplisia Ekstrak
Berat (g) Kadar Abu (g) Berat (g) Kadar Abu (g)
1 2,041 0,228 2,022 0,080
2 2,030 0,300 2,035 0,081
3 2,015 0,255 2,038 0,065
Simplisia
1. % Kadar Abu Total I = 0,028
2,041 x100% = 4,75%
2. % Kadar Abu Total II = 0,300
2,030 x100% = 14,78%
3. % Kadar Abu Total I = 0,255
2,015x100% = 12.65%
% Kadar Abu Total Rata-Rata = 4,75%+ 3,46% +4,12%
3 = 12,66%
Ekstrak
1. % Kadar Abu Total I = 0,080
2,022 x100% = 3,40%
2. % Kadar Abu Total II = 0,081
2,035 x100% = 3,80%
3. % Kadar Abu Total I = 0,065
2,038x100% = 3,19%
% Kadar Abu Total Rata-Rata = 3,40%+3,80% +3,19%
3 = 3,47%
% kadar abu total = berat abu (g)
% Kadar abu tidak larut asam = berat abu tidak larut asam
berat sampel x 100 %
Lampiran 6. (lanjutan)
Perhitungan penetapan kadar abu tidak larut asam dari serbuk simplisia kulit bawang merah dan EEKBM
No Simplisia Ekstrak
Berat (g) Kadar Abu (g) Berat (g) Kadar Abu (g)
1 2,041 0,071 2,022 0,002
2 2,030 0,070 2,035 0,008
3 2,015 0,057 2,038 0,005
Simplisia
1. % Kadar Abu Total I = 0,071
2,041 x100% = 3,47%
2. % Kadar Abu Total II = 0,070
2,030x100% = 3,45%
3. % Kadar Abu Total I = 0,057
2,015 x100% = 2,83%
% Kadar Abu tidak Larut Asam Rata-Rata = 3,47%+3,45% + 2,83%
3 = 3,25%
Ekstrak
1. % Kadar Abu Total I = 0,002
2,022 x100% = 0,10%
2. % Kadar Abu Total II = 0,008
2,035 x100% = 0,39%
3. % Kadar Abu Total I = 0,005
2,038 x100% = 0,24%
% Kadar Abu tidak Larut Asam Rata-Rata = 0,10%+0,39% + 0,24%
Lampiran 8. Gambar mencit jantan dan proses pengambilan darah dari jantung
dan organ hati mencit jantan
kiri: organ hati yang normal, kanan: organ hati yang mengalami nekrosis akibat induksi parasetamol
Lampiran 9. Volume maksimum sesuai jalur pemberian dan konversi dosis.
1. Tabel volume maksimum larutan sediaan uji yang dapat diberikan pada hewan uji (Harmita dan Radji, 2008)
Jenishewanuji Volume maksimal (ml) sesuai jalurpemberian
iv. im. ip. sc. po.
Lampiran 10. Perhitungan Dosis
1. EEKBM 300 mg/kg bb
Berat badan mencit = 20 g
Dosis pemberian = 20 g � 300 mg
1000 = 6 mg
Dosis EEKBM 300 mg/kg bb adalah dosis yang terkandung dalam 1 kg berat badan sebanyak 300 mg. Volume dosis maksimum untuk mencit adalah 10 mL/kg (Laboratory Animal Resources Center of Oregon State University, 2011)
atau 1 mL/100 g (BPOM., RI., 2014), maka 300 �� 10 mL
=
30 ��
1 mL
,
sehingga volumeyang diberikan secara per oral : 6 ��
30 mgx 1 mL
=
0,2 mL.2. EEKBM 450 mg/kg bb
Dosis pemberian = 20 g � 450 mg
1000 = 9 mg
450 �� 10 mL
=
45 ��
1 mL
,
makavolume yang diberikan secara per oral :9 ��
45 mgx 1 mL
=
0,2 mL.3. EEKBM 600 mg/kg bb
Dosis pemberian = 20 g � 600 mg
1000 = 12 mg
12 ��
60 mgx 1 mL
=
0,2 mL.4. Rutin 20 mg/kg bb
Dosis pemberian = 20 g � 20 mg
1000 = 0,4 mg
20 �� 10 mL
=
2 ��
1 mL
,
maka volume yang diberikan secara per oral :0,4 ��
2 mg x 1 mL
=
0,2 mL.5. Parasetamol 1000 mg/kg bb
Dosis pemberian = 20 g � 1000 mg
1000 = 20 mg
1000 �� 10 mL
=
100 ��
1 mL
,
makavolume yang diberikan secara per oral :20 ��
100 mgx 1 mL
=
0,2 mL.6. Volume pemberian suspensi Na CMC 0,5%
Lampiran 12. Data analisis ALT secara statistik SPSS One WayANOVA
ANOVA
Nilai ALT
Sum of Squares df Mean Square F Sig.
Between Groups 4202870.423 5 840574.085 114.926 .000
Within Groups 131652.770 18 7314.043
Total 4334523.193 23
1369.875 202.4000 101.2000 1047.812 1691.938 1201.6 1664.2
Post Hoc Test tanpa perlakuan kontrol
negatif (Na CMC 0,5%)
-1230.1000* 60.4733 .000 -1422.286 -1037.914
(kontrol
1176.1000* 60.4733 .000 983.914 1368.286
EEKBM 300
perlakuan 54.0000 60.4733 .943 -138.186 246.186 kontrol
negatif (Na CMC 0,5%)
-1176.1000* 60.4733 .000 -1368.286 -983.914
EEKBM 300
Multiple Comparisons
perlakuan 173.9250 60.4733 .090 -18.261 366.111 kontrol
negatif (Na CMC 0,5%)
-1056.1750* 60.4733 .000 -1248.361 -863.989
(kontrol
Homogeneous Subsets
Nilai ALT
Tukey HSDa
Kelompok Perlakuan N
Subset for alpha = 0.05
1 2 3
tanpa perlakuan 4 139.775
(kontrol positif) rutin 20 mg/kg BB 4 193.775
EEKBM 600 mg kg BB 4 313.700
EEKBM 450 mg/kg BB 4 528.000
EEKBM 300 mg/kg BB 4 715.175
kontrol negatif (Na CMC 0,5%) 4 1369.875
Sig. .090 .059 1.000
Means for groups in homogeneous subsets are displayed.
Lampiran 13. Data analisis AST secara statistik SPSS One WayANOVA
Descriptives
Nilai AST
N Mean
Std.
Deviation Std. Error
95% Confidence
Between Groups 9460627.632 5 1892125.526 85.926 .000
Within Groups 396369.277 18 22020.515
Post Hoc Tests Tanpa perlakuan Kontrol negatif
(Na CMC 0,5%)
-1875.5000 104.9298 .000 -2208.970 -1542.030
kontrol positif
Multiple Comparisons
Homogeneous Subsets
Nilai AST
Tukey HSDa
Kelompok Perlakuan N
Subset for alpha = 0.05
1 2 3 4
Tanpa perlakuan 4 210.850
kontrol positif (rutin 20 mg/kg
bb)
4 354.225
EEKBM 600 mg/kg bb 4 472.950 472.950
EEKBM 450 mg/kg bb 4 803.400 803.400
EEKBM 300 mg/kg bb 4 1051.000
Kontrol negatif (Na CMC 0,5%) 4 2086.350
Sig. .176 .053 .222 1.000
Means for groups in homogeneous subsets are displayed.
DAFTAR PUSTAKA
Adlia, F. (2014). Uji Aktivitas Hepatoprotektor Ekstrak Etanol Rimpang Temu Giring (Curcuma heyneana Val) terhadap Tikus Putih Jantan yang Diinduksi Parasetamol. Skripsi. Medan: Program Ekstensi Sarjana Farmasi Fakultas Farmasi Universitas Sumatera Utara. Hal. 2.
Induced Hepatotoxicity in Mice Occurs with Inhibition of Activity and Nitration of Mitochondrial Manganese Superoxide Dismutase. Journal of
Pharmacology and Experimental Therapeutic. 337 (1): 110-118.
Barret, K., Brooks, H., Boitano, S., dan Barman, S. (2010). Ganong’s Review of
Medical Physiology. 23rd Edition. New York: McGraw Hill Companies, Inc. Hal. 479, 481-482.
Brunetti, C., Ferdinando, M.D., Fini, A. Pollastri, S., dan Tattini, M. (2013). Flavonoid as Antioxidants and Developmental Regulators: Relative
Significance in Plants and Humans. International Journal of Molecular Sciences. 14: 3540-3555.
Bunchorntavakul, C., dan Reddy, K.R. (2013). Acetaminophen-related Hepatotoxicity. Clinical Liver Disease. 17(13): 590.
Christ, B., dan Brückner, S. (2012). Rodent Animal Models for Surrogate Analysis of Cell Therapy in Acute Liver Failure. Frontiers in Physiology. 3(78): 1.
Depkes RI. (1989). Materia Medika Indonesia. Jilid V. Jakarta: Direktorat Jenderal Pengawas Obat dan Makanan. Hal. 302-306, 321-325, 336.
Depkes RI. (1995). Materia Medika Indonesia. Edisi VI. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 323-325.
Depkes RI. (2014). Farmakope Indonesia. Edisi V. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 984-985.
Domitrović, R., Jakovac, H., Marchesi, V.V., Vladimir-Knežević,S., Cvijanović, O., Tadić, Z., Romić, Z., dan Rahelić, D. (2012). Differential Hepatoprotective Mechanisms of Rutin and Quercetin in CCl4-Intoxicated
BALB/Cn Mice. Acta Pharmacologica Sinica. 33: 1260–1270.
Durgo, K., Vukovic, L., Rusak, G., Osmak, M., dan Colic, J.K. (2007) . Effect of Flavonoids on Glutathione Level, Lipid Peroxidation and Cytochrome P450 CYP1A1 Expressionin Human Laryngeal Carcinoma Cell Lines.
Featherstone, B. (2008).Causes of Liver Disease and Dysfunction. Dalam: Drugs and the Liver. Illinois: Pharmaceutical Press. Hal. 5-15.
Filho, M. (2006). Bioactive Phytocompunds: New Approaches in the
Phytosciences. Dalam: Modern Phytomedicine. Editor: Iqbal Ahmad,
Farrukh Aqil and Mohammad Owais. Wilheim: Wiley-VCH. Hal. 9-10. Furst, D.E., Ulrich, R.W., dan Prakash, S. (2012). Nonsteroidal Anti-Inflammatory
Drugs,Disease-Modifying, Antirheumatic Drugs, Nonopioid Analgesics, & Drugs Used in Gout. Dalam: Katzung’s Basic Clinical Pharmacology..
New York : Mc Graw Hill Companies Inc. Hal. 650.
Graefe, E.U., Wittig, J., Silke Mueller, S., Riethling, A.K., Uehleke, B., Drewelow, B., Pforte, H., Jacobasch, Derendorf, H., dan Veit, M. (2001). Pharmacokinetics and Bioavailability of Quercetin Glycosides in Humans.
Journal of Clinical Pharmacology. 41(5): 492-499.
Gregorio, R.M., Falcòn M.S.G., Gándara , J.S., Rodrigues, A.S., Almeida, D.P.F. (2010). Identification and Quantification of Flavonoids in Traditional Cultivars of Red and White Onions at Harvest. Journal of Food
Composition and Analysis. 23: 592-598.
Hall, R. (2007). Clinical Pathology of Laboratory Animals. Dalam: Animal Models of Toxicology. Edisi II. Florida: CRC Press. Hal. 815.
Harborne, J.B. (1987). Metode Fitokimia. Bandung : Penerbit ITB. Hal. 151.
Hinson, J.A., Roberts, D.W., dan James, L.P. (2010). Mechanisms of Acetaminophen-Induced Liver Necrosis. Handbook of Experimental
Pharmacology. 196(12): 373-374.
Hodgson, E., dan Levi, P. E. (2000). A Textbook of Modern Toxicology. Edisi II. Boston: Mc Graw Hill Co. Hal: 203-204.
Holt, A. dan Smith, A. (2008). An Introduction to The Anatomy of The Liver. In: Drugs and the Liver. Illinois: Pharmaceutical Press. Hal. 5-15.
Iyanda, A.A., dan Adeniyi, F.A.A. (2011). Biochemical and Histologic Presentations of Female Wistar Rats Administered with Different Doses of Paracetamol/Methionine. Nigeria Journal of Physiology and Science. 26: 155-156.
Jaeschke, H., Williams, C.D., McGill, MR., Xie, Y., dan Ramchandran, A. (2013). Models of Drug-induced Liver Injury for Evaluation of Phytotherapeutics and Other Natural Products. Food Chemistry
James, L.P, Mayeux, P.R., dan Hinson, J.A. (2003). Acetaminophen-Induced Hepatotoxicity. Drug Metabolism and Disposition. 23(13): 1490-1506. Lewis, P. N. (2008). Drugs and The Liver. London: Pharmaceutical Press.
Hal.59-60.
Kenward, R., dan Tan, C.K. Penggunaan Obat pada Gangguan Hati. Dalam: Farmasi Klinis. Jakarta : Gramedia Elex Computindo. Hal. 160-161.
Klaasen, Curtis, D., Watkins, John, B. (2003). Casarett dan Doull’s Essentials Of
Toxicology. USA: Mc Graw Hill Co. Hal: 199 – 366.
Kumar, V., Abbas, A.K., dan Aster, J.C. (2013). Robbin’s Basic Pathology. Philadelphia: Elsevier. Hal. 6-9.
Kumar, V., Abbas, A.K., Fausto, N. (2005). Pathologic Basis Of Disease. Edisi VII. Philadelphia: Elsevier Saunders. Hal. 12 – 16.
Materska, M. (2008). Quercetin And Its Derivatives: Chemical Structure And Bioactivity – A Review. Polish Journal Of Food And Nutrition Sciences. 58 (4): 407-413.
Murli, K. (2013). Microscopic Anatomy of the Liver. Clinical Liver Disease. 2 (1): 4-6.
Murray, R.K. (2000). Harper Ilustrated Biochemistry. Edisi XX. Boston: Mc Graw Hill Co. Hal. 416
Nirmala, M., Girija, K., Lakshman, K., dan Divya, T. (2012). Hepatoprotective Activity of Musa Paradisiaca on Experimental Animal Models. Asian
Pasific Journal of Tropical Biomedicine; 2(1): 11.
Ozougwu, J.C., dan Eyo, J.E. (2014). Hepatoprotective Effects of Allium cepa (Onion) Extracts Against Paracetamol-Induced Liver Damage in Rats.
African Journal of Biotechnology. 13(26): 2679-2688.
Rahayu, E., dan Berlian, N. (1999). Bawang Merah. Jakarta: Penebar Swadaya Hal. 4-8; 8-13.
Robbins, S.L. dan Kumar, V. (1995). Buku Ajar Patologi. Edisi IV. Jakarta: EGC. Hal. 9 – 14.
Rukmana, R. (1994). Bawang Merah: Budidaya & Pengolahan Pascapanen. Yogyakarta: Penerbit Kanisius. Hal. 11-13; 15-20; 29-31.
Sahid, M., dan Subhan, F. (2014). Comparative Histopathology of
Skerget, M., Majheniè, L., Bezjak, M., dan Knez, Z. (2009). Antioxidant, Radical Scavenging and Antimicrobial Activities of Red Onion (Allium cepa L.) Skin and Edible Part Extracts. Chemical and Biochemical Engineering
Quarterly. 23(4): 435–444.
Thapa, B.R., dan Walia, A. (2007). Liver Function Tests and Their Interpretation.
Indian Journal of Pediatrics.74(7): 665-667.
Venkatesh P., Dinakar A., dan Senthilkumar, N. (2011). Hepatoprotective Activity of An Ethanolic Extract of Stems of Anisochilus Carnosus Against Carbon Tetrachloride Induced Hepatotoxicity in Rats.
International Journal of Pharmacy and Pharmaceutical Sciences. 3(1):
243-245.
Wibowo, S. (2008). Budidaya Bawang. Jakarta : Penebar Swadaya. Hal. 88-95. Wiczkowski, W., Nèmeth, N., Buciñski, A., dan Piskula, M.K. (2003).
Bioavailability of Quercetin from Flesh Scales and Dry Skin of Onion in Rats. Polish Journal of Food and Nutrition Sciences. 12(53): 95-99.
Wilbraham, A.C., dan Matta, M.S. (1992). Pengantar Kimia Organik. Penerjemah Suminar Achmadi. Penyunting Sofia dan Nik Solihin. Bandung: ITB. Hal. 100-105.
Wilmana, P., dan Gan, S. (2013), Analgesik-Antipiretik, Analgesik Antiinflamasi
Nonsteroid dan Obat Gangguan Sendi Lainnya. Dalam: Farmakologi dan
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental yaitu untuk mengetahui pengaruh hubungan antara variabel bebas dan variabel terikat (aktivitas hepatoprotektor) dengan tahapan penyiapan sampel, identifikasi sampel, karakterisasi serbuk simplisia, skrining fitokimia serbuk simplisia, pembuatan ekstrak, karakterisasi ekstrak, skrining fitokimia ekstrak, penyiapan hewan uji, pengujian aktivitas hepatoprotektor pada mencit jantan yang meliputi pemeriksaan aktivitas alanin transferase (ALT), aspartat transferase (AST) dan histopatologi hati dan pengolahan data. Na CMC 0,5% diberikan sebagai kontrol pelarut di kelompok kontrol negatif dan kelompok kontrol positif diberikan rutin dosis 20 mg/kg bb sebagai perbandingan efek hepatopotektor kelompok ekstrak Data hasil penelitian dianalisis dengan program SPSS 22.0 menggunakan uji ANOVA.
3.1 Alat-alat
3.2 Bahan
Akuades, α-naftol, asam nitrat pekat, asam asetat anhidrida, asam sulfat pekat, Etanol (destilasi), merkuri (II) klorida, kalium iodida, iodium, bismut (III) nitrat, asam klorida pekat, timbal (II) asetat, besi (III) klorida , buffer formalin 10%, isopropanol, kloroform, metanol, n-heksana, parasetamol, Na CMC 0,5%, reagen kit ALT Dialab®, reagen kit AST Dialab®, rutin (Sigma Aldrich), serbuk seng, toluen, zat warna (hematoksilin dan eosin).Sampel yang digunakan dalam penelitian ini adalah simplisia kulit bawang merah (Allium cepa L.).
3.3 Hewan Percobaan
Hewan percobaan yang digunakan dalam penelitian ini adalah mencit (Mus
musculus) jantan dengan berat badan 20-30 gram sebanyak 24 ekor dengan
kondisi sehat. Hewan diaklimatisasi selama 2 minggu dengan tujuan untuk menyeragamkan makanan dan hidupnya dengan kondisi yang serba sama sehingga dianggap memenuhi syarat penelitian.
3.4 Pengumpulan dan Pembuatan Simplisia Kulit Bawang Merah
3.4.1 Pengumpulan kulit bawang merah
3.4.2 Identifikasi bawang merah
Identifikasi bawang merah dilakukan di Herbarium Medanense (MEDA) Universitas Sumatera Utara.
3.4.3 Pembuatan simplisia
Sampel kulit bawang merah yang digunakan dikumpulkan beberapa jam setelah dikupas dari umbinya. Kulit dipisahkan dari pengotor lain lalu dicuci hingga bersih kemudian ditiriskan dan ditimbang (diperoleh berat basah sebesar 894,2 g). Selanjutnya, sampel dikeringkan selama 7 hari dalam lemari pengering dengan temperatur 40oC sampai daun kering (ditandai bila diremas rapuh). Simplisia yang telah kering diblender menjadi serbuk kasar lalu dimasukkan ke dalam wadah plastik bertutup dan disimpan pada suhu kamar. Kemudian serbuk ditimbang (diperoleh berat kering sebesar 534,8 g).
3.5 Pembuatan Pereaksi
3.5.1 Pereaksi Mayer
Sebanyak 5 g kalium iodida dalam 10 mL air suling kemudian ditambahkan larutan 1,358 g merkuri (II) klorida dalam 60 mL air suling. Larutan dikocok dan ditambahkan air suling hingga 100 ml (Depkes, RI., 1995).
3.5.2 Larutan pereaksi Dragendorff
3.5.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 mL air suling kemudian ditambah 2 g iodium sambil diaduk sampai larut, lalu ditambah air suling hingga 100 mL (Depkes, RI., 1995).
3.5.4 Pereaksi asam klorida 2 N
Sebanyak 17 mL larutan asam klorida pekat ditambahkan air suling hingga 100 mL (Depkes, RI., 1978).
3.5.5 Pereaksi Liebermann-Burchard
Sebanyak 20 bagian asam asetat anhidrat dicampurkan dengan 1 bagian asam sulfat pekat. Larutan penyemprotnya dibuat dengan 20 bagian asam asetat anhidrida dengan 1 bagian asam sulfat pekat dan 50 bagian kloroform. Larutan penyemprot ini harus dibuat baru (Harborne, 1987).
3.5.6 Pereaksi Molish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga diperoleh volume 100 mL (Depkes, RI., 1989).
3.5.7 Larutan air kloroform
Sebanyak 2,5 mL kloroform dikocok dengan 900 mL air suling, encerkan dengan air suling hingga 1000 mL (Depkes, RI., 1989).
3.5.8 Larutan kloralhidrat
Sebanyak 50 g kloralhidrat ditimbang dan dilarutkan dalam mL ml air suling (Depkes RI, 1989).
3.5.9 Pereaksi timbal (II) asetat 0,4 N
3.6 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam.
3.6.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap kulit bawang merah dengan cara mengamati bentuk, ketebalan, diameter, permukaan simplisia. Pemeriksaan organoleptis meliputi warna, bau dan rasa dari kulit bawang merah.
3.6.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia tumbuhan dengan cara menaburkan serbuk simplisia di atas kaca objek yang telah ditetesi dengan kloralhidrat dan ditutupi dengan kaca penutup kemudian dilihat dibawah mikroskop.
3.6.3 Penetapan kadar air
toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan dingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (WHO, 1998).
3.6.4Penetapan kadar sari larut air
Sebanyak 5 g serbuk yang telah dikeringkan diudara dimaserasi selama 24 jam dengan 100 mL air-kloroform dalam labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam lalu disaring. Sejumlah 20 mL filtrat diuapkan hingga kering dalam cawan penguap berdasar rata yang telah ditara. Residu dipanaskan pada suhu 105o C sampai bobot tetap. Kadar sari larut dalam air dihitung dengan persen terhadap bahan yang telah kering (Depkes, RI., 1995).
3.6.5 Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 mL etanol 95% dalam labu bersumbat sambil dikocok selama 18 jam, disaring cepat untuk menghindari penguapan etanol 96 %, sejumlah 20 mL filtrat diuapkan sampai kering dalam cawan penguap berdasar rata yang telah ditara dan sisanya dipanaskan pada suhu 105o C sampai bobot tetap. Kadar sari larut dalam etanol dihitung dalam persen terhadap bahan yang telah kering (Depkes, RI., 1995).
3.6.5 Penetapan kadar abu total
dilakukan pada suhu 500-600o C selama 3 jam kemudian didinginkan di desikatordan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah kering (WHO, 1998).
3.6.6 Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dalam penetapan kadar abu dididihkan dalam 25 mL asam klorida encer selama 5 menit, Bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, dan cuci dengar air pans sampai filtrat berwarna netral. Keringkan di hot plate lalu dipija sampai bobot tetap, kemudian didinginkan di desikator selama 30 menit dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang kering (WHO, 1998).
3.7 Skrining Fitokimia
3.7.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambah 1 mL asam klorida 2 N dan 9 mL air suling, dipanaskan di atas penangas air selama 2 menit. Ditunggu dingin dan disaring. Filtrat digunakan untuk percobaan berikut:
a. filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer, akan terbentuk endapan menggumpal berwarna putih atau kuning
b. filtrat sebanyak 3 tetes ditambah pereaksi Bouchardat, akan terbentuk endapan berwarna cokelat sampai hitam
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari ketiga percobaan di atas (Depkes, RI., 1989).
3.7.2 Pemeriksaan flavonoida
Sebanyak 0,5 g simplisia disari dengan 10 mL metanol, lalu direfluks selama 10 menit. Kemudian disaring panas-panas melalui kertas saring kecil berlipat. Filtrat diencerkan dengan 10 mL air. Setelah dingin ditambahkan 5 mL eter, dikocok hati-hati dan didiamkan. Lapisan metanol diambil, lalu diuapkan pada suhu 40oC, sisanya dilarutkan dalam 5 mL etil asetat, disaring. Filtrat digunakan untuk uji flavonoida dengan cara sebagai berikut :
a. sebanyak 1 mL larutan percobaan diuapkan hingga kering, sisa dilarutkan dalam 1 sampai 2 ml etanol 96%, lalu ditambahkan 0,5 g serbuk seng dan 2 mL asam klorida 2 N, didiamkan selama 1 menit. Ditambahkan 10 mL asam klorida pekat, dalam waktu 2 sampai 5 menit terjadi warna merah intensif menunjukkan adanya flavonoida.
b. sebanyak 1 mL larutan percobaan diuapkan hingga kering, sisa dilarutkan dalam 1 mL etanol 96%, lalu ditambahkan 0,1 g serbuk magnesium dan 10 mL asam klorida pekat, terjadi warna merah jingga, menunjukkan adanya flavonoida, (Depkes RI, 1989).
3.7.3 Pemeriksaan saponin
3.7.4 Pemeriksaan glikosida
Disari 3 g serbuk simplisia dengan 30 mL campuran etanol 95% dengan air (7:3) dan 10 mL asam sulfat 2 N. Direfluks selama 1 jam, didinginkan dan disaring. Pada 20 ml filtrat ditambahkan 25 mL timbal (II) asetat 0,4 M, dikocok dan didiamkan selama 5 menit, disaring. Disaring filtrat 3 kali, tiap kali dengan 20 mL campuran kloroform-isopropanol (3:2). Sari air digunakan untuk percobaaan berikutnyaa yaitu 0,1 mL larutan percobaan dimasukkan ke dalam tabung reaksi, diuapkan di atas penangas air, sisa ditambahkan 2 mL air dan 5 tetes pereaksi Molish. Tambahkan 2 mL dengan hati-hati asam sulfat pekat melalui dinding tabung, terbentuknya cincin ungu pada kedua batas cairan menunjukkan adanya glikosida (Depkes, RI., 1995).
3.7.5 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia, disari dengan 10 mL air suling lalu dipanaskan, lalu disaring. Filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 mL dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1 %. Jika terjadi warna biru atau hijau kehitaman, menunjukkan adanya tanin (Depkes, RI., 1989).
3.7.6 Pemeriksaan steroida dan triterpenoida
3.8 Pembuatan Ekstrak Etanol Kulit Bawang Merah
Pembuatan ekstrak etanol kulit bawang merah dilakukan secara maserasi dengan pelarut etanol 96%. Sebanyak 500 g serbuk simplisia kulit bawang merah dimasukkan ke dalam wadah kaca, ditambahkan etanol 96% sebanyak 3,75 L, tutup, biarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, serkai, peras, cuci ampas dengan cairan penyari secukupnya hingga diperoleh 4 L. Pindahkan ke dalam bejana tertutup, biarkan di tempat sejuk, terlindung dari cahaya selama 2 hari. Dienaptuangkan atau disaring. Hasil yang diperoleh dipekatkan dengan rotary evaporator sampai sebagian besar pelarutnya menguap dan dilanjutkan proses penguapan di atas penangas air sampai diperoleh ekstrak kental (Depkes, RI., 1979).
3.9 Pemeriksaaan Karakterisasi Ekstrak
Pemeriksaan karakteristik EEKBM meliputi penetapan kadar air, penetapan kadar abu total, dan penetapan kadar abu tidak larut dalam asam. Prosedur pemeriksaan ekstrak sama seperti prosedur karakterisasi simplisia.
3.10 Skrining Fitokimia Ekstrak
3.11 Uji Aktivitas Hepatoprotektor
3.11.1 Pembuatan suspensi Na CMC 0,5%
Pembuatan suspensi Na CMC 0,5% dilakukan dengan cara sebagai berikut: sebanyak 0,5 gram Na CMC ditaburkan kedalam lumpang yang berisi air suling panas sebanyak 10 mL. Didiamkan selama 15 menit hingga diperoleh masa yang transparan, digerus hingga terbentuk gel dan diencerkan dengan sedikit air suling, kemudian dituang ke dalam labu tentukur 100 mL, ditambah air suling sampai batas tanda. Suspensi ini digunakan sebagai pembawa EEKBM, parasetamol dan rutin.
3.11.2 Pembuatan suspensi EEKBM
Sebanyak 300 mg EEKBM dimasukkan ke dalam lumpang dan ditambahkan suspensi Na CMC 0,5% sedikit demi sedikit sambil digerus sampai homogen lalu dimasukkan ke labu tentukur 10 mL. Volume dicukupkan dengan suspensi Na CMC 0,5% sampai garis tanda. Prosedur yang sama dilakukan untuk pembuatan suspensi EEKBM 450 dan 600 mg/kg bb.
3.11.3 Pembuatan suspensi parasetamol
Suspensi parasetamol dalam suspensi Na CMC 0,5% dibuat dengan cara melarutkan 1 gram serbuk parasetamol yang telah ditimbang ke dalam suspensi Na CMC 0,5% di dalam lumpang, digerus hingga homogen lalu dimasukkan ke dalam labu tentukur 10 mL. Volume dicukupkan dengan suspensi Na CMC 0,5% sampai garis tanda.
3.11.4 Pembuatan suspensi rutin
tetes sambil digerus hingga homogen, ditambahkan suspensi Na CMC 0,5% lalu dimasukkan ke dalam labu tentukur 10 mL. Volume dicukupkan dengan suspensi Na CMC 0,5% sampai garis tanda.
3.11.5 Pembuatan larutan buffer formalin 10%
Larutan buffer formalin 10 % dibuat dengan penambahan 4 g NaH2PO4 dn
6,5 g Na2HPO4 ke dalam formalin 10 % (100 mL larutan formaldehid 40%
ditambah akuades 900 mL) kemudian dicukupkan dengan akuades sampai 1000 mL.
3.11.6 Pengujian hewan uji
Hewan uji dibagi atas 6 kelompok dan masing-masing terdiri dari 4 hewan percobaan. Pengujian aktivitas hepatoprotektor dijelaskan sebagai berikut:
a. kelompok I: normal, hewan uji tidak diberi perlakuan apapun. Makanan dan minuman diberikan secara ad libitum.
b. kelompok II: kontrol negatif, hewan uji diberikan suspensi Na CMC 0,5% sekali sehari selama 14 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1 g/kg bb 6 jam setelah pemberian suspensi Na CMC 0,5% pada hari ke-14. Makanan dan minuman diberikan secara ad libitum.
c. kelompok III: kontrol positif, hewan uji diberikan suspensi rutin dosis 20 mg/kg bb sekali sehari selama 14 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1 g/kg bb 6 jam setelah pemberian ekstrak pada hari ke-14. . Makanan dan minuman diberikan secara ad libitum.
g/kg bb 6 jam setelah pemberian ekstrak pada hari ke-14. . Makanan dan minuman diberikan secara ad libitum.
e. kelompok V : hewan uji diberikan EEKBM dosis 450 mg/kg bb sekali sehari selama 14 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1 g/kg bb 6 jam setelah pemberian ekstrak pada hari ke-14. . Makanan dan minuman diberikan secara ad libitum.
f. kelompok VI: hewan uji diberikan EEKBM dosis 600 mg/kg bb sekali sehari selama 14 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1 g/kg bb 6 jam setelah pemberian ekstrak pada hari ke-14. . Makanan dan minuman diberikan secara ad libitum.
3.11.7 Pengukuran ALT dan AST
Dikatakan adanya aktivitas hepatoprotektor apabila ALT dan AST dari EEKBM lebih rendah dibandingkan kelompok kontrol negatif (Na CMC 0,5% + parasetamol). Pemeriksaan ALT dan AST dilakukan di Laboratorium Kesehatan Dinas Kesehatan Provinsi Sumatera Utara.
3.11.8 Pemeriksaan kerusakan organ hati mencit
3.11.8.1 Pemeriksaan makroskopik
Mencit dibedah kemudian diambil organ hati dan dicuci dengan larutan NaCl 0,9% untuk membersihkan sisa darah yang menempel. Pengamatan dilakukan dengan mengamati warna dan tekstur permukaan hepar mencit.
3.11.8.2 Pembuatan preparat histologi (tissue processing) dan pemeriksaan mikroskopik
Jaringan yang akan dibuat preparat histologi difiksasi dalam larutan buffer formalin 10% minimal 4 jam hingga mengeras (matang). Sampel organ yang terfiksasi dengan sempurna ditrimming setebal ± 0,5 cm. Potongan kemudian dimasukkan dalam tissue cassette untuk dimasukkan dalam automatic tissue
processor. Di dalam tissue processor jaringan melalui beberapa tahap pemrosesan
preparat. Jaringan yang dipilih akan direndam secara berurutan ke dalam 12 tabung berisi berbagai reagen sebagai berikut:
a. tabung I dan II berisi formalin 10 % masing-masing selama 2 jam. Proses ini dinamakan fiksasi (fixation), tujuannya untuk mengurangi efek penyusutan sel selama proses dehidrasi.
c. tabung VIII, IX dan X berisi xylene, masing –masing selama 1,5 jam. Proses ini disebut pembeningan (clearing), bertujuan mengeluarkan alkohol sehingga parafin bisa masuk ke dalam jaringan.
d. tabung XI dan XII berisi paraffin masing-masing selama 2 jam. Proses pengisian paraffin ke dalam pori-pori jaringan ini dinamakan infiltrasi, bertujuan mengeraskan jaringan agar mudah dipotong dengan microtome.
Tissue cassette berisi jaringan dikeluarkan dan dilakukan proses embedding,
yaitu jaringan diletakkan di mould dan ditambahkan paraffin bersuhu 56oC dan dibiarkan membeku di cold area dari embedding centre. Penyayatan jaringan (sectioning) dilakukan setelah sebelumnya dibentuk (trimming) menggunakan
microtome dengan ketebalan 3-4 μm, hasil sayatan dipindahkan ke kaca objek dan dipindahkan ke penangas air agar ukuran sayatan mendekati ukuran sebenarnya dengan bantuan air hangat. Jaringan diwarnai dengan metode Hematoxylin-Eosin sebagai berikut :
a. xylol I selama 5 menit b. xylol II selama 5 menit c. etanol I selama 5 menit d. etanol II selama 5 menit e. alkohol 96% selama 5 menit f. alkohol 80% selama 5 menit g. alkohol 70% selama 5 menit h. air mengalir selama 5 menit i. hematoxylin 5 menit
k. HCl 0,1% selama 2 menit l. eosin selama 5 menit
m. air mengalir selama 5 menit
Jaringan yang sudah diwarnai ditutup dengan kaca penutup dengan penambahan Entellan sebagai perekat. Pembuatan preparat histologi dilakukan di laboratorium patologi anatomi RS Murni Teguh Medan. Hasil kemudian diamati di bawah mikroskop.
3.11.9 Analisis data
BAB IV
HASIL DAN PEMBAHASAN
4.1 Karakterisasi Simplisia dan Ekstrak Kulit Bawang Merah
4.1.1 Pemeriksaan makroskopik dan karakterisasi simplisia dan ekstrak
Hasil identifikasi yang dilakukan oleh Herbarium Medanense Universitas Sumatera Utara terhadap sampel yang diteliti adalah tumbuhan bawang merah (Allium cepa L.) suku Liliaceae (Lampiran 1).
Hasil pemeriksaan secara makroskopik yang dilakukan terhadap kulit tumbuhan bawang merah (Allium cepa L.) yaitu berwarna merah, berbentuk tidak beraturan dan lembaran tipis, panjang ± 6 cm dan lebar ± 5 cm, mempunyai bau dan rasa yang lebih lemah dari umbi bawang merah (Lampiran 2).
Hasil pemeriksaan secara mikroskopik yang dilakukan terhadap serbuk simplisia kulit bawang merah yaitu terlihat serabut skelerenkim, parenkim dengan sel berisi tetesan minyak, kristal kalsium oksalat bentuk prisma dan trakea dengan penebalan tangga (Lampiran 5). Hasil karakterisasi serbuk simplisia kulit bawang merah dapat dilihat pada Tabel 4.1.dan Lampiran 6.
Tabel 4.1 Hasil karakterisasi serbuk simplisia dan EEKBM
No Karakteristik serbuk simplisia Kadar (%)
Simplisia Ekstrak
1 Kadar air 4,00 1,67
2 Kadar sari larut dalam air 6,63 - 3 Kadar sari larut dalam etanol 12,80 -
4 Kadar abu total 12,66 3,47
Hasil karakterisasi serbuk simplisia memenuhi syarat berdasarkan persyaratan pada Materia Medika Indonesia (MMI) edisi VI yang menyantumkan kadar air tidak lebih dari 10%, sedangkan kadar air simplisia yang diperoleh adalah 4,00% dan kadar air ekstrak 1,67%. Pemeriksaan kadar air penting untuk mengetahui kandungan air dalam simplisia, khususnya yang mudah mengabsopsi air dan membusuk akibat kadar air yang tinggi. Kadar air yang tinggi akan meningkatkan pertumbuhan bakteri, dan jamur (WHO, 1992).
Penetapan kadar sari larut air dan kadar sari larut etanol untuk mengetahui banyaknya sari larut dalam pelarut air dan etanol. Senyawa yang dapat larut dalam air adalah glikosida, gula, gom, protein, enzim, zat warna, dan asam organik. Kadar sari larut air simplisia diperoleh 6,63%. Kadar sari larut etanol simplisia yang diperoleh 12,80%. Penetapan kadar sari dilakukan untuk mengetahui kandungan senyawa kimia yang larut dalam air maupun dalam etanol. Senyawa yang dapat larut dalam etanol adalah glikosida, antrakinon, steroida, flavonoida, klorofil, dan dalam jumlah sedikit yaitu lemak dan saponin (Depkes, RI.,1979).
4.1.2 Skrining fitokimia serbuk simplisia dan ekstrak
Penentuan golongan senyawa kimia simplisia dan EEKBM dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat di dalamnya. Adapun pemeriksaan yang dilakukan terhadap simplisia dan ekstrak adalah pemeriksaan golongan senyawa alkaloid, flavonoid, tanin, saponin, glikosida dan steroid/triterpenoid. Hasil skrining fitokimia serbuk simplisia dan EEKBM dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia dan EEKBM
Tabel tersebut menunjukkan bahwa simplisia dan EEKBM memiliki kandungan senyawa kimia yang sama yaitu flavonoid, tanin, saponin dan steroid/triterpenoid. Ini disebabkan oleh sifat etanol yang memiliki gugus hidroksil polar dan gugus alkil yang bersifat nonpolar (Wilbraham dan Matta,1992). Selain itu, pelarut etanol sangat efektif untuk mengikat senyawa-senyawaseperti fixed oils, lemak, lilin, alkaloid, flavon, polifenol, tanin, saponin, aglikon dan glikosida (Filho, 2006).
No Pemeriksaan Serbuk simplisia Ekstrak
1 Alkaloida - -
2 Flavonoida + +
3 Saponin + +
4 Tanin + +
5 Glikosida + +
4.2 Hasil uji aktivitas hepatoproktektor
4.2.1 Hasil pengukuran ALT dan AST
Pengukuran ALT dan AST dilakukan pada hari ke-15, 24 jam setelah pemberian parasetamol. Hasil pengukuran dapat dilihat secara rinci pada Tabel 4.3.
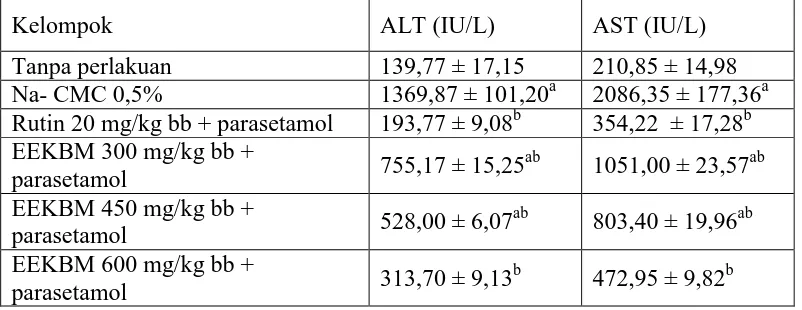
Tabel 4.3 ALT dan AST mencit dengan perbedaan perlakuan di setiap kelompok
(Mean ± SE) hasil analisis secara statistik SPSS metode One Way
ANOVA
Ket : a data berbeda signifikan (p < 0,05) terhadap kelompok tanpa perlakuan.
b
data berbeda signifikan (p < 0,05) terhadap kelompok kontrol negatif (Na CMC 0,5%)
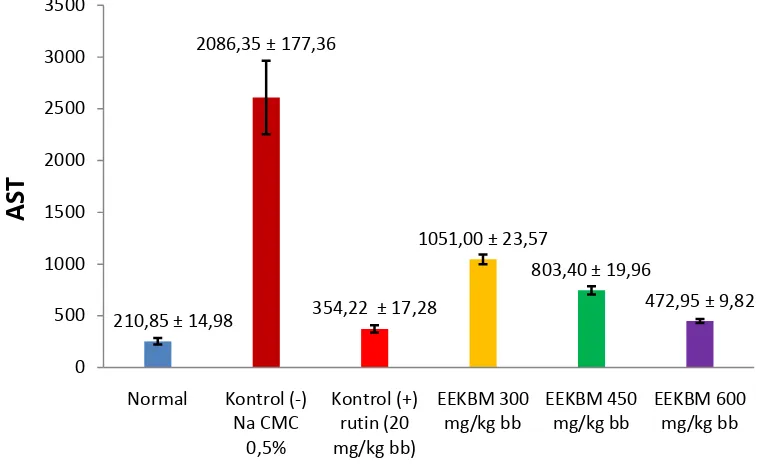
Tabel menunjukkan kelompok kontrol negatif dengan ALT 1369,87 IU/L dan AST 2086,35 IU/L. berbeda signifikan dengan kelompok tanpa perlakuan (p < 0,05) dengan ALT 139,77 IU/L dan AST 210,85 IU/L. Kelompok kontrol positif dengan ALT 193,77 IU/L dan AST 354,22 IU/L tidak berbeda signifikan (p > 0,05) dengan kelompok taanpa perlakuan. Kelompok EEKBM 300 mg/kg bb dengan nilai ALT 755,17 IU/L dan nilai AST 1051,00 IU dan kelompok EKKBM 450 mg/kg bb dengan ALT 528,00 IU/L dan AST 803,40 IU/L berbeda signifikan dengan kelompok tanpa perlakuan dan kontrol negatif. Kelompok EEKBM 600 mg/kg bb dengan nilai ALT 313,70 IU/L dan AST 472,95 IU/L
Kelompok ALT (IU/L) AST (IU/L)
Tanpa perlakuan 139,77 ± 17,15 210,85 ± 14,98 Na- CMC 0,5% 1369,87 ± 101,20a 2086,35 ± 177,36a Rutin 20 mg/kg bb + parasetamol 193,77 ± 9,08b 354,22 ± 17,28b EEKBM 300 mg/kg bb +
parasetamol 755,17 ± 15,25
ab
1051,00 ± 23,57ab EEKBM 450 mg/kg bb +
parasetamol 528,00 ± 6,07
ab
803,40 ± 19,96ab EEKBM 600 mg/kg bb +
parasetamol 313,70 ± 9,13
b
tidak berbeda signifikan dengan kelompok tanpa perlakuan. Grafik hasil pengukuran ALT dan AST dapat dilihat di Gambar 4.1 dan Gambar 4.2.
Gambar 4.1 Grafik ALT mencit jantan yang diukur setelah pemberian
parasetamol 1g/kg bb pada hari ke-14. Data berupa mean ± SE (n=4). Kelompok normal tidak diberi perlakuan.
Gambar 4.2 Grafik ALT AST mencit jantan yang diukur setelah pemberian
Meskipun nilai ALT dan AST EEKBM 300 mg/kg bb dan EEKBM 450 mg/kg bb berbeda signifikan terhadap kontrol negatif, keduanya juga berbeda secara signifikan terhadap kontrol positif (rutin), sehingga dapat disimpulkan bahwa EEKBM 300 mg/kg bb dan EEKBM 450 mg/kg bb mampu menghambat kenaikan nilai ALT dan AST akibat induksi parasetamol, namun efeknya belum sebanding dengan kelompok kontrol positif (rutin 20 mg/kg bb). Hal ini mungkin dipengaruhi perbedaan komposisi kuersetin, flavonoid yang diyakini memiliki aktivitas hepatoprotektif, tergantung pada bagian dari bawang merah. Kuersetin berada dalam bentuk glukosida (kuesetin 3,4-glukosida, kuersetin-4’-glukosida dan kuersetin-3’-glukosida) dengan total 53,5% di lapisan umbi, sedangkan di kulit terluar kuersetin dalam bentuk aglikon sebanyak 53,2% (Wiczkowski, et al., 2003). Meskipun aglikon kuersetin yang mempunyai efek antioksidan namun lebih sulit diserap karena sifatnya yang lebih lipofilik sehingga sulit mencapai lapisan dinding usus halus, selain juga karena aglikon tidak stabil pada pH dan temperatur usus halus. Ikatan gula dengan aglikon membantu meningkatkan absorpsi di usus halus, karena gula yang terikat secara aktif dihidrolisis oleh β–
glukosidase di brush border usus halus yang mempunyai afinitas yang tinggi terhadap glukosida (Graefe, et al., 2001).
peningkatan dosis EEKBM, sehingga menjadi petunjuk adanya hubungan peningkatan dosis dengan kemampuan penghambatan.
Nilai AST dan ALT merupakan biomarker yang sangat sensitif sehingga bisa digunakan dalam penilaian hati atau liver test (LT). Apabila membran plasma hepatosit rusak, enzim yang normalnya berada di sitosol keluar menuju aliran darah. Nilai AST yang lebih tinggi dibandingkan ALT mengindikasikan bahwa kerusakan sudah mencapai mitokondria karena AST berada di sitoplasma dan juga mitokondria. Pemeriksaan AST dan ALT biasanya dilakukan untuk menilai tipe dan luas kerusakan sel. Peningkatan yang tinggi (>20 kali lipat hingga mencapai >1000 IU/L) menandakan hepatitis virus berat, nekrosis yang diinduksi obat dan toksin lain serta syok sirkular (Iyanda and Adeniyi, 2011; Thapa and Walia, 2007).
4.2.2 Gambaran Kerusakan Organ Hepar
4.2.2.1 Gambaran makroskopik organ hati
Pengamatan makroskopik organ hati dilakukan dilakukan pada hari ke-15, 24 jam setelah pemberian parasetamol. Mencit yang masih hidup dikorbankan dengan cara dislokasi leher kemudian dibedah untuk diambil hatinya. Hasil pengamatan mikroskopik dapat dilihat di Gambar 3.3
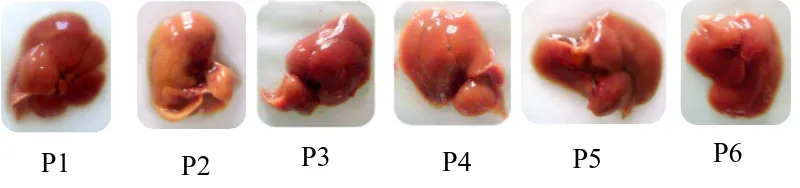
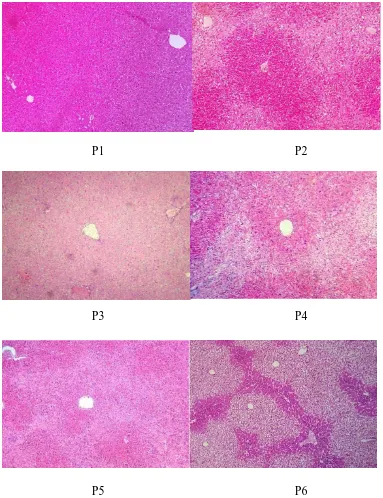
Gambar 4.3 Pemeriksaan makroskopik organ hati mencit jantan yang diambil
dari mencit setelah didislokasi pada hari ke-15. Keterangan: P1 = tanpa perlakuan; P2 = kontrol negatif (Na CMC 0,5%); P3 = kontrol positif (rutin 20 mg/kg bb); P4,P5,P6 = EEKBM dosis 300, 450, dan 600 mg/kg bb.
Hasil menunjukkan adanya perbedaan warna yang cukup jelas pada kontrol negatif yaitu organ berwarna coklat muda atau cenderung kuning pucat jika dibandingkan dengan kelompok lainnya, namun tekstur organ dari setiap kelompok perlakuan semuanya tidak terdapat perbedaan yakni memiliki tekstur yang licin.
4.2.2.2 Gambaran mikroskopik organ hati
Gambar 4.4Histopatologi jaringan hati mencit perbesaran 10 x 10. Keterangan:
P1 = tanpa perlakuan; P2 = kontrol negatif (Na CMC 0,5%); P3 = kontrol positif (rutin 20 mg/kg bb); P4,P5,P6 = EEKBM dosis 300, 450, dan 600 mg/kg bb. Tampak perdarahan yang meluas pada kelompok kontrol negatif, kemudian berkurang pada kelompok EEKBM 300 mg/kg bb dan 450 mg/kg bb dan akhirnya tidak tampak sama sekali pada kelompok EEKBM 600 mg/kg bb.
P1 P2
P3 P4
VS
P1 P2
P3 P4
P5 P6
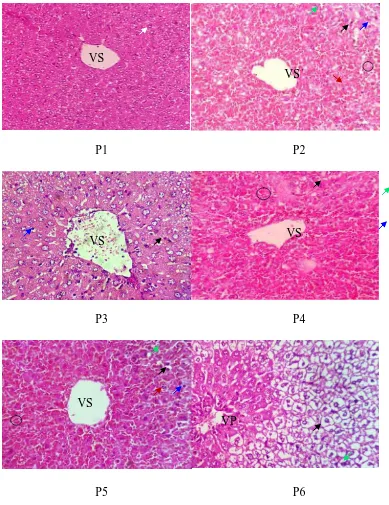
Gambar 4.5Histopatologi jaringan hati mencit jantan perbesaran 10 x 40. Cedera
hati akibat induksi parasetamol ditandai dengan pendarahan (lingkaran), degenerasi hidropik (panah hitam) yang bersifat reversibel dan nekrosis yang bersifat ireversibel dengan ciri inti mengalami piknosis (panah biru), karyolisis (panah hijau) dan karyoreksis (panah merah).Keterangan: P1 = tanpa perlakuan; P2 = kontrol negatif (Na CMC 0,5%); P3 = kontrol positif (rutin 20 mg/kg bb); P4,P5,P6 = EEKBM dosis 300, 450, dan 600 mg/kg bb; VS = vena sentral; VP = vena porta.
VS VS
VS
VS
Nekrosis adalah tipe kematian sel yang berkaitan dengan hilangnya integritas membran dan bocornya komponen sel yang berujung pada disolusi sel, menghasilkan proses degradasi sel yang mati oleh enzim. Komponen sel yang bocor akan memicu reaksi lokal yaitu inflamasi yang berusaha mengeliminasi sel yang mati dan memulai program regenerasi sel. Nekrosis adalah tipe cedera yang bersifat ireversibel, ditandai dengan vakuolasi, pembengkakan sel, degradasi inti dan pelepasan secara masif isi dari sel yang berada dalam area toksisitas yang luas (Jaeschke, 2013).
Secara histopatologi, cedera hati akibat paparan parasetamol dosis toksik dapat ditandai dengan pendarahan yang luas, kongesti vena sentral yang disertai dengan rusaknya endothelium, degenerasi hidropik, nekrosis perivenular, steatosis mikrovesikular dan perubahan inti (Shahid dan Subhan, 2014). Kongesti pada jaringan parenkim hati mencit bisa terjadi sebelum atau sesudah nekrosis. Studi morfologi oleh Walker, dkk. menunjukkan kongesti berasal dari akumulasi sel darah merah ke dalam vakuola endositik dan rongga Disse karena sel endotel sinusoid membengkak dan perfusinya menurun (Hinson, et al., 2010). Degenerasi hidropik atau swelling merupakan tahap awal terjadinya nekrosis yang ditandai dengan hepatosit yang membengkak, di mana terdapat vakuola berbentuk bundar dan berwarna pucat yang disebabkan lumpuhnya aktivitas pompa ion di plasma membran sehingga tidak mempu mempertahankan keseimbangan ion dan cairan (Kumar, et al., 2013). Dilatasi RE merupakan konsekuensi dari meningkatnya aktivitas CYP P450 yang juga menghasilkan spesies oksigen reaktif (ROS) yang nantinya mempengaruhi permeabilitas membran plasma dan menyebabkan
metabolisme lemak akibat hepatosit yang rusak, dengan ciri pernumpukan lemak dengan ukuran yang kecil, bulat, dan jernih di sitoplasma (Featherstone, 2008). Baik degenerasi hidropik maupun steatosis merupakan perubahan morfologi yang bersifat nonletal dan reversibel, namun dapat berubah menjadi ireversibel apabila disfungsi mitokondria tidak dapat dikoreksi dan gangguan fungsi membran terjadi. Nekrosis perivenular adalah bentuk kematian sel yang terjadi di sekeliling vena, baik vena sentral maupun vena porta. Hal ini dapat terjadi jika dosis obat yang menginduksi nekrosis cukup tinggi, seperti pada penelitian ini di mana dosis parasetamol yang diberikan sebesar 1 g/kg bb. Pemilihan dosis pemberian parasetamol 1 g/kg bb untuk mencit didasarkan pada penelitian oleh Jaeschke, et al., yang menyimpulkan dosis ≥ 200 mg untuk mencit yang dipuasakan dan ≥ 400 mg untuk mencit yang tidak dipuasakan mampu menginduksi toksisitas hati yang signifikan. Konversi dosis menunjukkan dosis 1 g/kg bb untuk mencit dengan bb 20 g setara dengan 7,758 g untuk manusia dengan berat 70 kg. Hal ini sesuai dengan data klinis di Amerika Serikat di mana dosis tunggal ≥ 7,5 -10 g untuk orang dewasa menyebabkan hepatotoksitas dan harus segera dievaluasi dan diberikan intervensi medis (Bunchorntavakul and Reddy, 2013). Perubahan inti merupakan hasil akhir dari kerusakan sel, yaitu pemecahan DNA dan kromatin yang ditandai inti sel menjadi samar (karyolisis), mengecil dan berwarna kehitaman (piknotik), kemudian pecah (karyoreksis) (Kumar, et al., 2013).
bb menunjukkan pendarahan yang cukup luas yang berawal dari vena sentral kemudian melebar secara radial. Perbesaran 40 x 10 memperlihatkan ekstravasasi eritrosit di sepanjang sinusoid. Steatosis (fatty change) dan degenerasi hidropik juga tersebar di jaringan parenkim hati. Pada gambaran histopatologi EEKBM 450 mg/kg bb area sentrilobular dan periportal menunjukkan penurunan luas pendarahan dan degenerasi hidropik. Gambaran histopatologi EEKBM 600 mg/kg bb menunjukkan perbaikan yang signifikan, ditandai dengan degenerasi hidropik yang cukup luas dan vena sentral yang normal dan tidak dijumpai pendarahan.. Gambaran yang bersifat reversibel ini menunjukkan bahwa EEKBM 600 mg/kg bb mampu menurunkan stres oksidatif sehingga tidak sampai menimbulkan nekrosis perivenular seperti pada kontrol negatif. Evaluasi kerusakan jaringan hati dari setiap kelompok perlakuan dirangkum dalam Tabel 4.4.
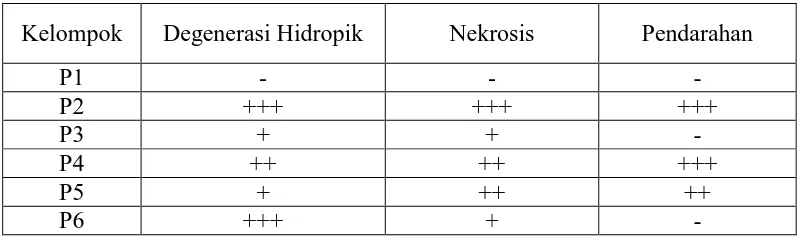
Tabel 4.4 Evaluasi histopatologi hati mencit akibat induksi parasetamol pada
tiap kelompok perlakuan
Kelompok Degenerasi Hidropik Nekrosis Pendarahan
P1 - - -
P2 +++ +++ +++
P3 + + -
P4 ++ ++ +++
P5 + ++ ++
P6 +++ + -
Tingkat keparahan kerusakan hati dievaluasi berdasarkan skor berikut: (-) = normal; (+) = ringan; (++) = sedang; (+++) = berat. Keterangan: P1 = tanpa perlakuan; P2 = kontrol negatif (Na CMC 0,5%); P3 = kontrol positif (rutin 20 mg/kg bb); P4,5,6 = EEKBM dosis 300, 450, dan 600 mg/kg bb.
setelah deplesi glutation (GSH) dan menjadi titik awal proses kematian sel dalam beberapa jam (Jaeschke and Bajt, 2005). Terlebih lagi, toksisitas berkembang hanya setelah onset stres oksidatif tercapai dan mitokondria mengalami disfungsi, sehingga dengan mencegah fenomena ini akan melindungi sel dari kematian karena induksi parasetamol. Pengikatan NAPQI-protein di mitokondria sel dianggap sebagai pemicu meningkatnya stres oksidatif. Umumnya ROS yang dihasilkan dalam mekanisme toksisitas ini adalah superoksida (O2−), yang berdismutasi dengan katalisator superoxide dismutase (SOD) menjadi hidrogen peroksida (H2O2) yang berubah menjadi HO- melalui reaksi Fenton. Superoksida
juga bereaksi dengan nitrit oksida (NO-) membentuk peroksinitrit yang selanjutnya menitrasi protein menjadi nitrotirosin dan melangsungkan rangkaian tahap kematian sel (Jaeschke et al., 2012). Selain hepatosit, sel non-parenkim seperti sel Kupffer dan sel endotel sinusoid juga terlibat dalam produksi ROS dan RNS (Christ dan Bruckne, 2012).
Studi oleh Wiczkowski, et al., menunjukkan bahwa kandungan kuersetin dalam kulit bawang merah berkisar antara 25-35 mg/g, sedangkan dalam lapisan umbinya 4-7 mg/g. Melimpahnya bentuk aglikon di kulit bawang merah berhubungan dengan fungsinya sebagai proteksi terhadap sinar UV B matahari (Wiczkowski et al, 2003). Durgo, et al., dalam penelitiannya menunjukkan kemampuan utama kuersetin sebagai antioksidan melalui pengikatan radikal bebas O2- dan H2O2 yang ditandai penurunan kadar malondialdehid (MDA) dalam darah
dan urin. Kadar MDA adalah hasil dari peroksidasi lipid yang diperantarai O2- dan H2O2. Selain itu kuersetin dapat meningkatkan kadar GSH dalam sel CK2 dan sel
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang dilakukan dapat disimpulkan bahwa: a. EEKBM menunjukkan aktivitas sebagai hepatoprotektor.
b. EEKBM dosis 300, 450 dan 600 mg/kg bb dapat menghambat peningkatan aktivitas ALT dan AST. EEKBM dosis 300 mg/kg bb dengan ALT 755,17 IU/L dan AST 1051,00 IU/L, EEKBM dosis 450 mg/kg bb bb dengan ALT 528,00 IU/L dan AST 803,00 IU/L, dan EEKBM dosis 600 mg/kg bb dengan ALT 313,70 IU/L dan AST 472,95 IU/L menunjukkan perbedaan signifikan (p < 0,05) terhadap kelompok kontrol negatif dengan ALT 1369,87 IU/L dan AST 2086,35 IU/L .
c. pemberian EKKBM dosis 300, 450 dan 600 mg/kg bb menunjukkan adanya penurunan kerusakan jaringan hati pada pemeriksaan histopatologi.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Sistematika tumbuhan
Di dalam dunia tumbuhan, tanaman bawang merah diklasifikasikan sebagai berikut :
Kerajaan : Plantae
Divisi : Spermatophyta Kelas : Monocotyledoneae Bangsa : Liliales
Suku : Liliaceae Marga : Allium
Jenis : Allium cepa L. (Rahayu dan Berlian,1999).
2.1.2 Nama daerah
Nama daerah dari tumbuhan bawang merah : Bawang merah (Aceh dan
Palembang); pia (Batak); bawang sirah atau dasun merah (Minangkabau), barambang
sirah atau dasun merah (Minangkabau); bawang suluh (Lampung); bawang beureum
(Sunda); brambang atau brambang abang (Jawa Tengah dan Jawa Timur); bhabang
mera (Madura); jasum bang atau jasum merah (BaIi); bawangi (gorontalo); lasuna eja
(Makassar), lasuna cela (Bugis); laisuna mpilas (Roti); kalpeo miha (Timor); bawa
(Halmahera); bawa rohika (Ternate); bawa kahori (Tidore) (Rukmana, 1994).
2.1.3 Sejarah, habitat dan penyebaran
Tanaman bawang merah diduga berasal dari Asia. Sebagian literatur
menyebutkan bahwa tanaman ini dari Asia tengah (Palestina dan India), sebagian juga
menyebutkan bawang merah berasal dari Asia Barat yang berkembang ke Mesir dan
Turki. Bangsa Mesir mengenal bawang merah sejak 3200-3700 SM. Di Yunani dan
Israel, bawang merah dibudidayakan sejak 1500 SM. Eropa Barat, Timur dan Spanyol
mengenal bawang merah sejak abad kedelapan, lalu menyebar ke Amerika.
Penyebaran bawang merah telah meluas hampir ke setiap negara. Eropa Barat, Eropa
Timur, Spanyol, Amerika Serikat, Mesir dan Turki merupakan negara penghasil
bawang mereah terpenting di dunia. Di Indonesia, sentra budidaya bawang merah
diusahakan di hampir seluruh provinsi di Indonesia kecuali Riau, DKI Jakarta,
Kalimntan Barat dan Kalimantan Tengah (Rukmana, 1994). Daerah Samosir menjadi
sentra budidaya bawang merah di Sumatera Utara, (Rahayu dan Berlian,1999).
.Bawang merah termasuk tumbuhan semusim yang tumbuh dengan baik di
daerah beriklim kering yang cerah dengan udara panas, namun harus disertai
pengairan yang baik dengan ketinggian tanah 0-800 m di atas permukaan laut dan
suhu antara 25-32 0C. Tanah yang gembur dan subur serta banyak mengandung
humus sangat baik dengan pH antara 6,0-6,8 (sedikit agak asam-normal) cocok untuk
pertumbuhan bawang merah, sedangkan di tanah yang becek menyebabkan
pertumbuhan bawang merah menjadi kerdil dan umbinya mudah busuk. Pada pH
kurang dari 5,5 tanaman akan keracunan alumunium sehingga tanaman menjadi
kerdil, sebaliknya pada pH di atas 6,5 Mangan tidak dapat diserap akibatnya umbinya
menjadi kecil-kecil (Rukmana, 1994; Wibowo, 2008).
2.1.4 Morfologi tumbuhan
Bawang merah (Allium cepa L.) merupakan terna (tanaman yang berbatang
lunak karena tidak membentuk kayu) rendah yang tumbuh tegak dengan tinggi
mencapai 15-50 cm, berakar serabut dengan sistem perakaran dangkal dan tidak
Di bagian atas discus terbentuk batang semu yang tersusun dari pelepah-pelepah
daun. Batang semu yang berada dalam tanah akan berubah bentuk dan fungsinya
menjadi umbi lapis (bulbus). Beberapa helai kelopak daun terluar (2-3 helai) tipis dan
mengering tetapi cukup liat, membungkus lapisan-lapisan kelopak daun di dalamnya
sehingga membentuk umbi yang kemudian berisi cadangan makanan bagi tunas yang
akan menjdi tanaman baru. Pada pangkal umbi tumbuh akar-akar serabut. Di bagian
atas umbi terdapat mata tunas yang disebut tunas lateral dan dapat tumbuh menjadi
tanaman baru. Daun berbentuk pipa, yakni bulat kecil memanjang antara 50-70 cm,
berlubang, bagian ujungnya meruncing, berwarna hijau muda sampai hijau tua dan
letak daun melekat pada tangkai yang ukurannya relatif pendek. Bunga akan muncul
dari tunas utama (tunas apikal) di bagian tengah umbi, dengan panjang 30-90 cm dan
terdapat 50-200 kuntum yang tersusun melingkar seperti payung. Biji mempunyai
bentuk agak pipih,sewaktu masih muda berwarna bening atau putih, tetapi setelah tua
menjadi hitam. Umbi lapis bawang merah sangat bervariasi, bentuknya ada yang
bulat, bundar sampai pipi, sedangkan ukuran umbi meliputi besar, sedang, dan kecil.
Warna kulit umbi merah muda sampai merah tua (Rukmana, 1994; Rahayu dan
Berlian,1999; Wibowo, 2008).
2.1.5 Khasiat
Secara tradisional bawang merah dapat bermanfaat untuk pengobatan beberapa
penyakit, seperti disentri, jantung koroner, influenza, tekanan darah tinggi, sembelit,
luka, bisul pada kulit, jamur pada vagina (trichomoniasis), demam, masuk angin,
impotensi dan cacar air. Selain itu bawang merah dapat berkhasiat menurunkan lemak
darah, tekanan darah, mencegah pembekuan darah, menyembuhkan asma, melawan
2.2 Parasetamol
2.2.1 Uraian Kimia
Parasetamol mempunyai nama IUPAC 4’-hidroksiasetanilida dengan rumus struktur C8H9NO2. Pemeriannya berupa serbuk hablur, putih tidak berbau, dan
memiliki rasa sedikit pahit, larut dalam air mendidih dan dalam natrium hidroksida 1N, serta mudah larut dalam etanol (Depkes, RI., 2014). Parasetamol merupakan metabolit aktif fenasetin yang memiliki efek antipiretik yang ditemukan di Jerman dan telah lama digunakan sejak tahun 1893 (Wilmana, 2013; Katzung, 2012). Efek antipiretik ditimbulkan oleh gugus aminobenzen Obat ini merupakan inhibitor COX-1 dan COX-2 di jaringan perifer dengan efek antiinflamasi yang tidak signifikan. Nyeri akut dan demam efektif terobati dengan dosis 325-500 mg empat kali sehari (Wilmana, 2013).
2.2.2 Farmakokinetik
2.2.3 Farmakodinamik
Efek analgesik parasetamol yaitu menghilangkan atau mengurangi nyeri ringan sampai sedang seperti sakit kepala, myalgia, nyeri setelah melahirkan di mana pemberian aspirin tidak ditoleransi pasien dengan riwayat alergi, tukak lambung, hemophilia dan bronkospasma dan juga diberikan kepada pasien (Wilmana dan Gan, 2013; Furst, et al., 2012). Di Indonesia, penggunaan parasetamol sebagai analgesik dan antipiretik berkembang luas. Nyeri akut dan demam dapt diobati dengan dosis pemberian 325-500 mg empat kali sehari (direkomendasikan tidak melebihi 4 g) atau dosisnya diturunkan jika pemberian untuk anak-anak (Furst, et al., 2012). Jika dosis terapi tidak memberi manfaat, biasanya dosis lebih besar tidak menolong. Penggunaannya sebagai antiinflamasi, misalnya untuk mengobati arthritis rheumatoid bersifat inadekuat karena merupakan penghambat biosisntesis prostaglandin yang lemah. Karena hampir tidak mengiritasi lambung, parasetamol sering dikombinasi dengan AINS untuk efek analgesik (Wilmana dan Gan, 2013).
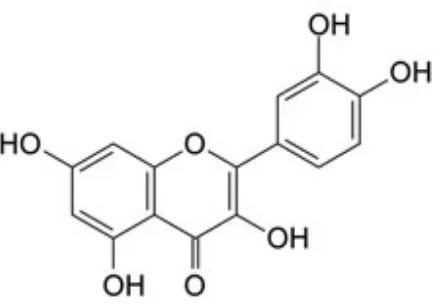
2.3 Kuersetin
untuk selanjutnya diabsorbsi dan dimetabolisme sebagai aglikon (Materska, 2008).
Gambar 2.1 Struktur Kuersetin (Domitrović, et al., 2012)
Kuersetin aglikon memiliki struktur lipofilik, namun demikian turunan kuersetin dapat bersifat lipofilik maupun hidrofilik tergantung pada subtituen yang terikat. Pada umumnya, turunan flavonoid dengan O-metil, C-metil dan turunan prenil bersifat lipofilik. Glikosilasi paling tidak di satu gugus hidroksil akan meningkatkan sifat hidrofiliknya (Materska, 2008).
3-OH dan 5-OH di cincin A meningkatkan potensi antiksidan. Turunan kuersetin memberikan efek farmakologi yang lebih rendah dibandingkan dengan bentuk aglikonnya. Beberapa turunan kuersetin yang mengalami glikosilasi di C4’-OH dapat menurunkan kemampuan mendonorkan H+ sehingga sifat antioksidannya berkurang. Uji aktivitas antoksidan aglikon flavonoid, termasuk fisetin, kaempferol, morin, mirisetin dan kuersetin menyimpulkan kemampuan potensi penurunan radikal bebas ditunjukkan oleh gugus 4’-OH di cincin B (Brunetti, et al., 2013).
Kuersetin dan turunannya secara umum mengalami konversi metabolik dan berada dalam jaringan tubuh dengan mengalami glukuronasi, sulfasi dan metilasi. Mekanisme pertama, ketiganya merupakan substrat potensial untuk enzim laktose
phlorizin hydrolaze (LPH) di brush border membran usus halus. Mekanisme
kedua memampukan absorpsi glikosida kuersetin melalui interaksi dengan
sodium-dependent glucose transporter 1 (SGLT1). Setelah diabsorpsi, glikosida
kemudian dihidrolisis oleh β-glikosidase di sitosol sebagian kecil sel mukosa
usus halus (Materska, 2008).
umbinya dalam bentuk kuersetin-4'-glukosida, kuersetin-3-glukosida, dan kuersetin-3,4'-glukosida (Wiczwoski, et al., 2003).
Studi oleh Po’voa et al menyimpulkan bahwa kandungan flavonol terutama kuersetin menurun dari lapisan terluar sampai ke dalam dan dari ujung atas sampai pangkal bawah. Meningkatnya kusersetin seiring dangan bertambahnya usia sel-sel yang menyusun lapisan umbinya, sehingga sel-sel di lapisan luar tentu umurnya lebih tua dibandingkan di lapisan yang lebih dalam. Lapisan luar dan bagian atas umbi paling banyak mengandung kuersetin, berkaitan dengan fungsinya sebagai proteksi terhadap paparan sinar UV B (Gregorio et al., 2010).
2.4 Rutin
Rutin (kuersetin 3-O-rutinosida) merupakan flavonol yang terdiri dari kuersetin aglikon dan rutinosida di atom C nomor 3 di cincin C. Rutin umumnya terkandung di berbagai macam makanan, dan menunjukkan sejumlah aktivitas biokimia dan farmakologi, seperti antioksidan, antiinflamasi dan antitumor. Uji aktivitas heptoprotektor secara preventif oleh Domtrovic, dkk., menunjukkan
pemberian rutin dosis 50 dan 150 mg/kg secara peritoneal dapat menurunkan peningkatan NO yang diinduksi CCl4. Peningkatan NO akan
2.5 Hati
2.5.1 Anatomi hati
Hati merupakan organ padat terbesar dalam tubuh manusia dengan massa mencapai 1,6 kg pada pria dan 1,4 kg pada wanita, dan menyumbang 2% massa tubuh orang dewasa. Secara anatomi hati terletak di bawah diafragma, di kuadran atas kanan abdomen, dengan posisi anterior dan posteriornya terlindungi oleh tulang rusuk. Hati memiliki dua lobus dan lobus kanan enam kali lebih besar dari lobus kiri. Hati menerima kurang lebih 1,3 liter darah per menit: 75 % berasal dari vena (vena porta) dan sisanya dari arteri hepatik (Holt, 2008). Vena porta membawa darah dari usus dan limpa, dan arteri membawa darah yang berasal dari aorta, darah dari kedua pembuluh tersebut akhirnya bercampur di sinusoid sebelum meninggalkan hati dalam vena hepatik (Murli, 2013).
stelat (sel Ito) yang perannya penting terhadap aliran darah sinusoid, fibrogenesis dan penyimpanan vitamin A. Sel Kupffer bentuknya tidak teratur, cenderung gepeng dan merupakan makrofag yang berperan dalam fagositosis. Terdapat juga sel pit (sel limfosit hati) di sinusoid dan rongga Disse, sel ini mempunyai limfosit T atau fenotip sel NK (natural killer) (Murli, 2013).
Secara mikroskopik, stuktur jaringan dijelaskan dengan konsep acinus (modern) dan lobul (konvensional). Hepatosit dalam acinus dapat dibagi menjadi tiga zona berdasarkan jarak sel dari traktus porta. Traktus porta terdiri atas duktus biliaris, arteri hepatik, vena porta, pembuluh limfatik, saraf dan sel-sel inflamasi. Mulai dari traktus porta, darah dari arteri dan vena mengalir melalui sinusoid hingga mencapai vena sentral (Murli, 2013). Hepatosit yang berada dekat traktus porta lebih dulu menerima nutrisi dan oksigen dari darah karenanya paling resisten terhadap gangguan iskemik, daerah ini dinamakan zona 1 (periportal). Hepatosit yang berada lebih jauh dari traktus porta akan menerima darah dengan konsentrasi nutrisinya yang lebih rendah, dinamakan zona 3 (perisentral/sentrilobular), mengelilingi vena sentral dan beresiko besar mengalami cedera hipoksia. Zona 2 (midzonal) berada di antara zona 1 dan zona 3. Pembagian fungsi metabolik berdasarkan letak zonanya dalam acinus. Zona 1 utamanya bertanggung jawab terhadap perubahan dalam darah porta, seperti kadar glukosa dan insulin sehingga berperan dalam glikolisis dan glukoneogenesis. Sintesis protein, β-oksidasi asam lemak, sintesis kolesterol dan sekeresi asam
NADPH dan NADH reduktase, sehingga lebih beresiko mengalami kerusakan yang diinduksi obat (Holt dan Smith, 2008).
biotransformasi obat dan steroid endogen lewat sistem mono-oksigenase mikrosom. Badan Golgi terlibat dalam sekresi empedu, pembentukan glikoprotein dan lipoprotein serta distribusinya ke komponen intraselular, juga sintesis dan perbaikan membran sel. Lisosom bertugas mendegradasi berbagai substrat. Peroksisom berperan dalam oksidasi dan peroksidasi melalui pembentukan hidrogen peroksida, juga degradasi asam lemak rantai panjang (Holt, 2008).
2.5.2 Fungsi hati
Hati mempunyai fungsi yang cukup banyak berkaitan dengan perannya sebagai kelenjar eksokrin dan endokrin. Hati mensekresi asam empedu yang berperan dalam emulsifikasi lemak di usus halus. Protein yang disintesis di hati berfungsi sebagai enzim, hormon maupun protein plasma. Beberapa enzim yang disintesis di hati juga berguna dalam proses detoksifikasi zat-zat berbahaya. Hati ikut menjaga keseimbangan kadar glukosa dalam darah lewat proses glikogenolisis dan glukoneogenesis. Hati melangsungkan metabolisme lemak menjadi asam lemak, kolesterol dan lipoprotein. Hati merupakan tempat penyimpanan vitamin terutama yang larut dalam lemak. Hati juga berperan besar dalam detoksifikasi racun dan obat, serta memiliki sistem pertahanan tubuh melalui sel Kupffer (Barret, et al., 2010; McKuskey, 2012).
2.5.3 Hepatotoksisitas
termasuk obat-obatan juga merupakan hepatotoksin. Obat yang merusak hati akan berdampak pada kadar enzim hati yang abnormal. Cedera hati akibat obat-obatan atau Drug Induced Liver Injury (DILI) bertanggung jawab terhadap 5 % pengobatan di rumah sakit dan 50% gangguan hati akut (Kumar, et al., 2014).
Banyak obat yang dapat menyebabkan toksisitas dengan gambaran biokimia, klinis, histologi dan kronologi atau kombinasi semuanya yang khas. Beberapa pola hepatotoksitas diketahui berdasarkan mekanisme cedera yang berbeda-beda. Cedera hepatoseluler atau sitolitik melibatkan peningkatan kadar serum transaminase, biasanya didahului diawali peningkatan total bilirubin dan sedikit peningkatan ALP, contohnya isoniazid dan troglitazone. Cedera kolestatik ditandai dengan peningkatan ALP yang cenderung lebih menonjol dibandingkan ALT atau AST, contohnya asam klavulanat atau klorpromazin. Reaksi imun atau hipersentivitas sering tertunda atau terjadi setelah paparan yang berulang, ditandai demam, ruam dan eosinofilia. Fenitoin, nitrofurantoin atau halotan dapat meningkatkan onset reaksi dan keparahan setelah pemberian berulang dalam interval tertentu. Cedera mitokondria melibatkan steatosis mikrovesikular, asidosis laktat dan peningkatan ringan serum aminotranferase, contohnya asam valproat dan tetrasiklin parenteral dosis tinggi (Navarro dan Senior, 2006).
2.5.4 Mekanisme hepatotoksisitas yang diinduksi parasetamol
Hepatotoksisitas oleh parasetamol bukan sekedar kerusakan yang bersifat tunggal namun merupakan hasil kontribusi dan integrasi berbagi mekanisme.NAPQI terbentuk dari oksidasi langsung 2 elektron oleh sitokrom P450 (James, et al., 2003). Ketika pemberian parasetamol mencapai dosis toksik, jalur
glukoronidasi dan sulfasi mejadi jenuh. Metabolisme parasetamol dengan dosis toksik
menurunkan kadar GSH dalam hati hingga lebih dari 90%. Keadaan ini memicu
NAPQI berikatan
Gambar 2.2 Skema jalur metabolisme parasetamol (James, et al., 2003)
secara kovalen dengan gugus sulfhidril di protein sistein hepatosit membentuk