KAJIAN
MORFOLOGIS DAN FUNGSl
BlOLOGIS
OOSlT DOMBA SETELAH KRlOPRESERVASl
DENGAN METODE VlTRlFlKASl
O l e h
I T A DJUWITA
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
KAJIAN MORFOLOGIS DAN FUNGSI BIOWGIS OOSIT DOMBA SETELAH KRIOPRESERVASI DENGAN METODE VITRIFIKASI
ITA DSCTWlTA PEMBIMBING
YUHARA SUKRA, MOZES. R TOELIHERE,
IMAN SUPRIATNA, SRIEADI AGUNGPFUYONO, ARIEF BOEDIONO
ABSTRACT
THE STUDY OF MORPHOLOGY AND BIOLOGICAL FUNCTION
OF CRYOPRESERVED OVElYE OOCYTES
USING VITRIFICATION METHOD
ITA D.JUWITA ADVISORY CO-E
WHARA SUKRA, MOZES.
R
TOELIBERE,lMAN SUPRIATNA, SRIEADI AGUNGPRIYONO, ARIEF BOEDIONO
M A N
BIOLOGIS DAN MORFOLOGIS
OOSIT DOMBA SETELAH KRIOPRESERVASI
DENGAN METODE VITRIFIKASI
Oleh
ITA DJUWITA NRP. 9650781gIO
Disertasi sebagai salah satu syarat
untuk memperoleh gelar Dolctor
pada
Program Studi Biologi
Program Pascasarjana, Institut Pertanian Bogor
PROGRAM PASCASARJ AN A INSTITUT PERTANIAN BOGOR
Judul Disertasi : KAJIAN BIOLOGIS DAN MORFOLOGIS OOSIT DOh4BA SETELAH KRIOPRESERVASI DENGAN METODE VITRIFIKAS I
Nama Mahasiswa : ITA DJUWITA
Nomor Pokok : 965078/BIO
Menyetujui:
~ s i Pembimbing
'k
(Prof. Dr. drh Yuhara Sukra, MSc.) Ketua
(Prof. Dr. drh. Mozes R. Toelihere, MSc.) Anggota
(Dr. drh. Srihadi Agungpriyono) Anggota
2. Ketua Program Studi Biologi
(Dr. Ir. Dede ~ e t i a d i )
\ /
(I%. drh. Iman Supriatna) Anggota
(rk.
drh. Arief Boediono) Anggotaascasarjana IPB
RIWAYAT HIDUP
Penulis adalah putri dari Ayahanda Endorn Nataatrnadja dan Ibunda Rt.
Sukeni. Dilahirkan tanggal 3 April 1959 di Kodya Bogor, Jawa Barat, kernudian
menikah dengan Wiryadi Afandi, pada tahun 1995.
Penulis rnengikuti pendidikan sekolah dasar (SD) sampai menengah atas
(SMA) dari tahun 1966 sarnpai tahun 1979 di Kodya Bogor, Jawa Barat. Pada tahun
1979/1980 melanjutkan pendidikan ke Institut Pertanian Bogor melalui Proyek
Perintis 11.
Pada tahun 1983, penulis lulus sebagai sarjana kedokteran hewan dari Institut
Pertanian Bogor, dan pada tahun berikutnya, 1984, lulus sebagai dokter hewan dari
tempat yang sarna. Sejak tahun 1981 rnenjadi asisten luar biasa untuk mata ajaran
Ernbriologi di Fakultas Kedokteran Hewan, Institut Pertanian Bogor, dan sejak tahun
1986, diangkat rnenjadi pegawai negeri sebagai staf pengajar di Laboratonurn
Ernbriologi, Jurusan Anatorni, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Pada tahun 1987 penulis memperoleh beasiswa dari Pemerintah Indonesia
melalui Proyek Bank Dunia, Departemen Pendidikan dan Kebudayaan untuk
rnengikuti program pendidikan Master ( S 2 ) di bidang bioiogi molekuler pada
Newcastle upon Tyne University, Newcastle upon Tyne, England dan memperoleh
gelar Master of Phylosophy (MPhil) pada tahun 1990. Pada tahun 1990-1995,
penulis sempat beberapa kali mempelajari metodologi dalam bidang bioteknologi
reproduksi di beberapa universitas di Jepang melalui Program JSPS. Pada tahu 1996
penulis mernperoleh beasiswa dari Pemerintah Indonesia melalui Bantuan Program
Past-ana, Departemen Pendidikan Nasional, untuk mengikuti pendidikan
Program S3 dalam bidang studi Biologi, Progam Pascasarjana, Institut Pertanian
KATA PENGANTAR
Dengan memanjatkan puji syukur atas anugerah dan ridho Allah
Subhaanahu Wata'aala, penelitian terhadap 'Kajian Morfologis dan Fungsi
Biologis Oosit Domba setelah Kriopreservasi dengan Metode Vitrifikasi' dapat
penulis selesaikan dan tuangkan dalam bentuk Disertasi sebagai pertanggung-
jawaban penulis selama mengikuti pendidikan Program Doktor di Program
Pascasarjana, Institut Pertanian Bogor.
Kriopreservasi dan produksi embrio in vitro merupakan bidang ilmu yang
sangat menarik dan berharga dalarn kaitannya dengan penerapan teknik transfer
embrio dalam upaya pengembangan peternakan masa depan. Metode
kriopreservasi yang efektif akan mendukung penyediaan oosit yang diperoleh
dengan biaya yang relatif murah seperti rumah pemotongan hewan ataupun hewan
yang merniliki nilai genetik tinggi, tanpa batas waktu. Untuk meningkatkan
keberhasilan metode kriopreservasi, dukungan penelitian serta informasi
mengenai khususnya keadaan morfologi, baik dalam skala makro, mikro maupun
ultra-mikro, serta fungsi biologis oosit setelah kriopreservasi sangat diperlukan.
Penelitian terhadap 'Kajian Morfologis dan Fungsi Biologis Oosit Domba
setelah Kriopreservasi dengan Metode Vitrifikasi' telah dilakukan dalam upaya
memproduksi oosit belcu serta produksi embrio in vitro. Metode kriopreservasi
yang dipergunakan adalah metode vitrifikasi dengan penekanan pada penggunaan
larutan sukrosa bertingkat (0,25M, 0,50M dan 1,OOM) serta penambahan sukrosa
ke dalam larutan vitrifikasi untuk memfasilitasi proses dehidrasi dan pengeluaran
krioprotektan setelah vitrifikasi dan warming. Dengan demikian, pengaruh
toksisitas krioprotektan maupun tekanan osmotik dari Larutan vitrifikasi dapat
diminimumkan. Pengarnatan terhadap keadaan morfologi dan ultra-struktur serta
h n g s i biologis oosit yakni tingkat pematangan, fertilisasi dan perkembangan
embrio in vitro menunjukkan bahwa penambahan sukrosa dengan konsentrasi
0,50M-1.00M memberikan pengaruh yang menguntungkan dan dapat
mempertahankan integrasi membran plasma maupun struktur oosit. Diharapkan
implementasi kegiatan bioteknologi reproduksi baik yang berhubungan dengan
pengembangan peternakan maupun pelestarian plasma nutfah.
Pada kesempatan ini, penulis mengucapkan terima kasih yang sebesar-
besamya dan penghargaan yang setinggi-tingginya kepada Bapak Prof. Dr. drh. H.
Yuhara Sukra, MSG. selaku Ketua Komisi Pembimbing dan 'Bapak kami', atas
ketulusan, pethatian, bimbingan serta bantuannya baik moril maupun materiil
selama penulis mengikuti pendidikan maupun selama menjadi staf pengajar di
Fakultas Kedokteran Hewan, Instirut Pertanian Bogor. Rasa terima kasih yang
sebesar-besarnya dan penghargaan yang setingi-tingginya penulis sampaikan pula
kepada Bapalr Prof. Dr. drh. Mozes R. Toelihere dan Bapak Dr. drh. Iman
Supriatna, selaku Anggota Komisi Pembimbing, atas perhatian serta bimbingannya Kepada Bapak Dr. drh. Arief Boediono dan Bapak Dr. drh.
Srihadi Agungpriyono, selaku Anggota Komisi Pembimbing yang tiada lelah
mencurahkan waktu dan memberikan arahan serta dorongan semangat yang tiada hentinya, penulis ucapkan terima kasih yang sebesar-besarnya.
Secara khusus rasa terima kasih yang sebesar-besamya penulis sampaikan
kepada Prof Dr. Poul Hyttel, Department of Anatomy and Physiology, The Royal
Veterinary and Agricultural University, Copenhagen, Denmark, yang telah
rnemberikan kesempatan, fasilitas, arahan serta dorongan rnoril kepada penulis
untuk mernpelajari dan mengerjakan teknik imunositokimia serta penggunaan slat
mikroskop elektron transmisi untuk pengamatan ultra-struktur oosit domba.
Kepada Dr.
Y.
Yamarnoto, Gifh University, Japan, penulis mengucapkan terima kasih atas ban- bahan penelitian untuk pengamatan secara imunositokimia.S-a h s u s pula, rasa terima kasih yang sebesar-besarnya penulis
sampaikan kepada Pemerintah Indonesia melalui Bantuan Pendidikan Pasca
Sarjana (BPPS) dan Proyek Hibah Tim Periode Tahun 1999-2001 yang telah
memberikan kepercayaan dan beasiswa serta bantuan biaya penelitian sehingga
penulis dapat menyelesaikan pendidikan Doktor
di
Program Pascasarjana IPB.Tanpa mengurangi rasa hormat, tak lupa penulis sampaikan rasa terima
kasih yang sebesar-besamya kepada Bapak Rektor lnstitut Pertanian Bogor, serta
yang telah diberikan kepada penulis; kepada Bapak dan Ibu, seluruh staf pengajar
beserta karyawan di Jumsan Anatomi, FKH IPB, atas dorongan sernangatnya,
serta rekan-rekan mahasiswa dan peneliti di Laboratorium Embriologi, Jurusan
Anatomi, FKH IPB, atas diskusinya serta pengertian dan dorongan semangatnya. Akhirulkdam, dengan rasa cinta dan hormat, penulis mengucapkan terima
kasih kepada ayahanda dan ibunda yang senantiasa mendoakan dan memberikan
dorongan semangat, suarni tercinta atas kesabaran, pengertian, serta doa dan dorongan semangatnya dan seluruh keluarga atas doa dan pengertian yang telah
diberikan kepada penulis.
Penulis berdoa ke hadhirat Ilahi, semoga segala amal perbuatan semua
pihak yang telah diberikan kepada penulis mendapat balasan yang diridhoi dari
Allah Subhaanahu Wata'aala. Amin ya rabbal'aalamin.
Bogor, Mei 2001,
DAFTAR ISI Halaman ... DAFTAR IS1 ... DAFTAR TABEL ... DAFTAR GAMBAR ... DAFTAR LAMPIEUN ... PENDAHULUAN
1 . Latar Belakang ...
2 . Tujuan dan Manfaat Penelitian ...
...
TINJAUAN PUSTAKA
1 . Perkembangan Peternakan Domba d m Bioteknologi Petemakan di Indonesia ...
1 . 1 . Keadaan dan Potensi Pengembangan Peternakan Domba di Indonesia ... 1.2. Perkembangan Bioteknologi Peternakan ...
.
...2 Pertumbuhan dan Perkembangan Folikel
3
.
Keadaan Morfologi dan Fungsi Biologis Oosit ...4 . Potensi Koleksi Oosit dan Produksi Embrio secara In Virro
...
4.1- Maturasi In Vzfro
...
4.2. Fertilisasi If2 Vitro
4.3. Perkembangan Ernbrio In Vifro ...
...
5.1. Metode Pembekuan
... 5.2. Metode Vitrifikasi
5.3. Faktor-Faktor yang Berperanan didalam Proses
...
Vitrifikasi
MATERI DAN h4ETODE PENELITIAN . . .
. ...
1 Mhteri dan Metode yang Dipergunakan
1.1. Koleksi Ovarium dan Oosit
...
1.2. Pernatangan In Viiro ... 1.3. Metode vitrifikasi ...Halaman
...
1.4. Pengamatan Mikroskopis dan Ultra-Struktur
...
1.5. Pengamatan Fungsi Biologis Oosit
2.1. Keadaan Umum Ovarium Domba ...
2.2. Keadaan Morfologi dan Struktur Oosit setelah
...
V~trifikasi
2.3. Keadaan Fungsi Biologis Oosit setelah Pemaparan dan Vitrifikasi ...
3 . Pengumpulan Data dan ~ n a l i s i s Statistik ...
HASIL DAN PEMBAHASAN ...
1 . Keadaan Umum Ovarium serta Perkembangan Oosit selama 24 Jam Inkubasi In M t r o
1.1. Keadaan Berat, Jurnlah Folikel dan Oosit pada Ovarium Domba ...
1.2. Perubahan Status Meiotik Inti Oosit seIama 24 Jam
...
Inkubasi In Vitro
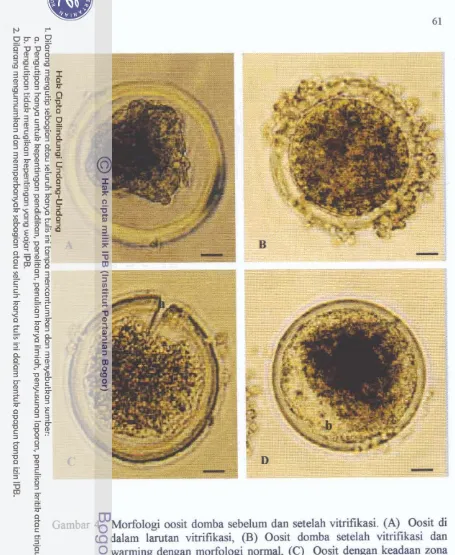
2 . Keadaan Morfologi dan Ultra Struktur Oosit Mt-I1 setelah Vitrifikasi ...
2.1. Keadaan Morfologi Oosit Mt-I1 setelah Vitrifikasi ...
2.2. Keadaan Ultra-Struktur Mt-I1 setelah Vitrifikasi
...
3 . Keadaan Fungs Biologis Oosit setelah Pemaparan dan
Vitrifikasi ...
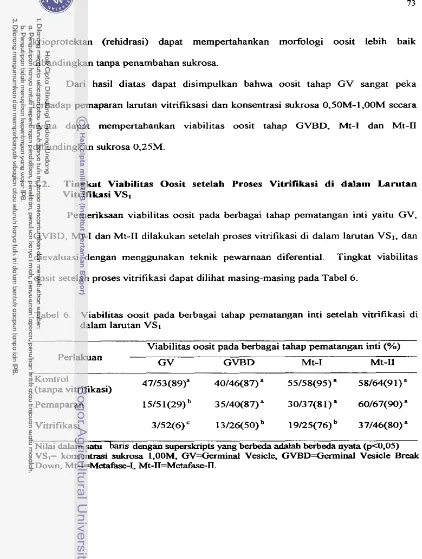
3.1. Tingkat Viabilitas Oosit setelah Pemaparan
...
3.2. Tmgkat =abilitas Oosit setelah Vitrifiksi ...3.3. Tmgkat Pematangan In Vifro Oosit setelah Permparan dan Vitrifikasi ...
3.4. Tingkat Fertilisasi dan Perkernbangan Embrio In Vitro setelah Vitrifikasi ...
KESIMPULAN DAN
SARAN
1
.
Kesirnpulan ...2 . Saran ...
DAFTAR PUSTAKA ...
DAFTAR TABEL
Nomor
Teks
1 . Berat ovarium dan jurnlah folikel per ovarium pada masing- masing ovarium kanan dan kiri ...
2. Berat ovarium, jumlah folikel dan oosit per pasang ovarium pada masing-masing ovariurn fase luteal dan folikuler ...
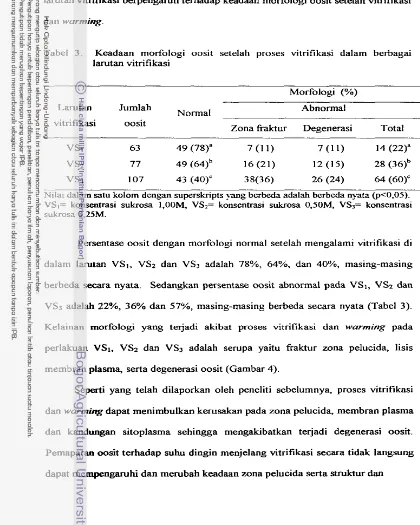
3 . Morfologi oosit setelah proses vitrifikasi di dalam berbagai
. .
larutan vltnfikasi ...4. V~abilitas oosit pada berbagai tahap pematangan inti setelah
...
pemaparan di dalam berbagai larutan vitrifikasi
5. Pengamh dehidrasi di dalam larutan sukrosa bertingkat terhadap viabilitas oosit Mt-I1 ...
6. Viabilitas oosit pada berbagai tahap pematangan setelah vitrifikasi di dalam iarutan VSI ...
7. Tingkat pematangan oosit secara in vifro setelah pemaparan di datam larutan VS ...
8 Tingkat pematangan oosit secara in vitro setelah vitrifikasi di dalam lamtan
VS,
...9. Wabilitas dan tingkat fertilisasi in vifro dari oosit setelah ... vihifikasi di dalam larutan VSI, VSZ dan VSs
DAFTAR GAMBAR
Nomor
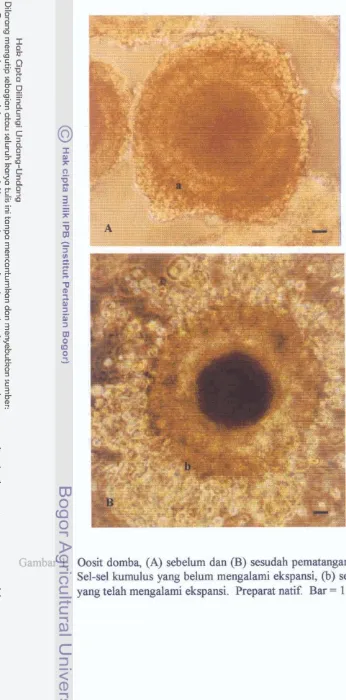
Oosit domba sebelum dan setelah pematangan in viiro
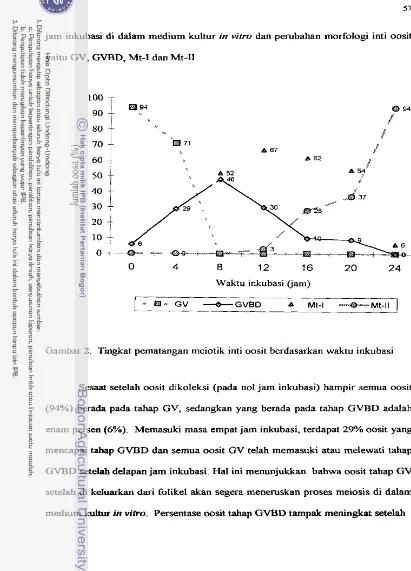
Tingkat pematangan oosit secara it1 vifro berdasarkan waktu inkubasi . . .
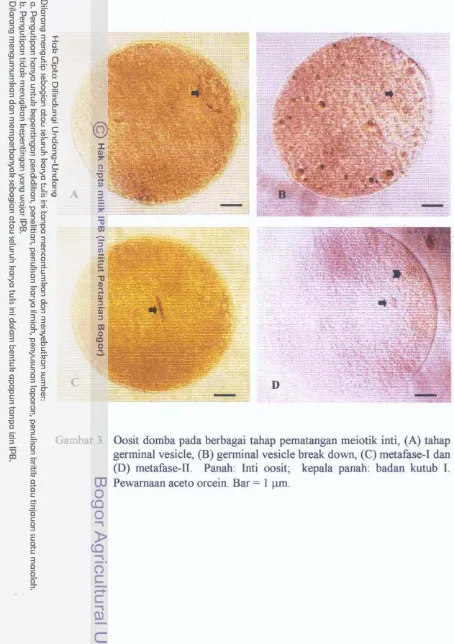
Oosit pada berbagai tahap pematangan meiotik inti . . . ..
Morfhlogi oosit tahap metafase-I1 setelah vitrifikasi .. . .
Ultra-struktur oosit metafase-I1 setelah vitrifikasi di dalam larutan VSz . . .
.
. . . .. . .Morfologi sitoskeleton tubulin oosit metafase-I1 setelah vitrifikasi di dalarn larutan VS2 . . .
UItrastruktur oosit metafase--11 setelah vitrifikasi di dalam larutan VS3 ... . . .. . . .. .
.
. .. . .. . . .. . .Kelainan lempeng metafase pada oosit setelah vitrifikasi
Oosit setelah vitrifikasi dan 16 jam setelah fertilisasi . . .
Preparat natif embrio tahap 4 sel sampai-morula yang
DAFTAR LAMPIRAN
Nomor
Te ks
1 Komposisi Dulbecco 's Phosphate-Buffered Saline (Gibco
BRL) .
.
. . .. . .
. . .
. . .2 Komposisi medium CRlaa (Rosenkrans dan First) . . . ..
1. L a t a r Belakang
Pada rnasa kini, salah satu upaya yang dapat dilakukan untuk
mempercepat peningkatan populasi, produksi dan mutu ternak adalah dengan
penyediaan bibit berkuaIitas tinggi meialui penerapan dan pengembangan
bioteknologi reproduksi, antara lain teknologi Lnseminasi Buatan (IB) dan
Transfer Embrio (TE). Hal ini terbukti dari telah didirikannya Balai Inseminasi
Buatan di Lembang dan Singosari, yang diikuti dengan didirikannya Balai Ernbrio
Ternak di Cipelang, Bogor pada tahun 1992. Inseminasi Buatan dilakukan
sebagai upaya untuk meningkatkan nilai tambah sel garnet jantan (spermatozoa)
dari seekor pejantan unggul sehingga jumlah betina yang dapat dibuahi dapat
ditingkatkan dan keturunan yang diperoleh akan mendapatkan peningkatan mutu
genetik. Sedangkan TE ditujukan untuk meningkatkan nilai tambah dari sel
gamet baik dari induk jantan maupun induk betina terhadap proses produksi
ternak, sehingga keturunan yang diperoleh akan rnendapatkan peningkatan mutu
genetik dari kedua tetuanya. Didalam penerapan TE, embrio yang akan ditransfer
dapat dihasilkan baik secara in vivo maupun in vitro, sehingga tersedianya garnet,
terutama sel tetur (oosit) secara kesinambungan merupakan faktor utama yang
hams terus diupayakan.
Kriopresewasi oosit merupakan salah satu cara untuk rneningkatkan nilai
tambah oosit sehingga dapat dipergunakan tanpa dibatasi oleh kendala waktu dan
jar&. Teknik kriopreservasi oosit merupakan suatu cara untuk menyimpan sampel
dan mempertahankan kelangsungan hidup sel. Dengan teknik kriopreservasi daya tahan hidup (viabilitas) oosit dapat dipertahankan dengan cara mereduksi fungsi-
fungsi dan aktivitas metabolik tanpa terjadinya kerusakan membran maupun
organel sel sehingga fbngsi biologis, fisiologis dan imunologis tetap ada.
Kemampuan untuk melakukan kriopreservasi oosit marnalia akan mernperpanjang
daya tahan oosit dan secara efektif akan meningkatkan penerapan dan peranan TE
serta kemampuan daya guna teknologi biologi reproduksi secara luas, antara lain
kloning dan rekayasa embrio.
Melalui teknik kriopreservasi, oosit dari hewan temak, hewan
laboratoriurn maupun hewan liar dapat disimpan dalam keadaan beku tanpa batas
waktu untuk aplikasi komersial ataupun keperluan penelitian di kemudian hari.
Oosit dari betina yang bermutu genetik tinggi, termasuk species-species yang
hampir punah dapat tetap terpelihara walaupun betina teIah kehilangan fungsi
fertilisasi secara normal atau bahkan telah mati; karenanya penyediaan oosit yang
diperoleh dari hewan bermutu genetik tinggi atau memiliki nilai ekonomi dapat
ditingkatkan dan dilakukan setiap saat setelah hewan dipotong atau mati
mendadak.
Keberhasilan kriopreservasi akan memungkinkan tersedianya oosit beku
sehingga (a) dapat mempermudahkan pengaturan waktu didalam program
produksi embrio in vifro berikut transfer embrio (atau program bayi tabung pada
manusia) serta teknik konsepsi terkait lainnya (Rall, 1992), dan (b) secara umum
merupakan upaya penyimpanan dan pemeliharaan pjasma nutfah (Wildt, 1989).
Pada manusia, kriopreservasi oosit selain akan mempermudah melakukan
pada wanita yang kehilangan k n g s i gonadal akibat proses bedah atau kemo-terapi sehingga potensi reproduksi masih dapat dipertahankan serta mengantisipasi
pertanyaan masalah etika dan legalitas sekitar penyimpanan embrio beku pada
manusia. Sedangkan plasma nutfah dari betina yang berniIai mutu genetik atau
ekonomi tinggi, serta species-species langka yang dilindungi (endangered
species) dapat diselamatkan setelah hewan betina dipotong atau bahkan mati.
Ditinjau dari fenomena fisik, ada dua metode kriopreservasi oosit, yaitu
metode pembekuan w e e z i n g ) , termasuk kedalamnya adalah pembekuan lambat
dan cepat (slow and rapid/ultra rapidfreezing) dan metode vitrifikasi. Perbedaan
yang menyolok diantara kedua metode tersebut adalah pada metode pembekuan
te ja d i pemadatan cairan tetjadi melalui pembentukan kristal es, sedangkan pada
vitrifikasi pemadatan cairan t e jadi tanpa melalui pembentukan kristai es (Rall dan
Fahy, 1985). Adapun kerusakan fisik yang dapat ditimbulkan oleh kedua metode
tersebut di atas adalah hampir sama.
Saat ini metode vitrifikasi telah dipakai sebagai metode alternatif
kriopreservasi embrio maupun oosit (Rall dan Fahy, 1985; Nakagata, 1989; Arav
e f al., 1990). Pada proses vitrifikasi, pemadatan cairan terjadi melalui peningkatan
viskositas yang ekstrim pada masa pendinginan cepat (Fahy, el at., 1984). Bagian
padat ini menyerupai kaca sehingga disebut vitreus, serta memiliki distribusi
molekuler dan ionik dalam keadaan cair. Dengan demikian, efek yang merusak
dari kristal es ekstra dan intraseluler dapat menghidari atau diminimumkan -11
dan Fahy, 1985). Kelebihan lain dari metode vitrifikasi adalah sederhana, murah,
diterapkan di tempat-tempat seperti rumah sakit, laboratorium atau balai-balai
ternak yang memiliki fasilitas kontainer nitrogen cair.
Adapun kelemahan pada rnetode vitrifikasi adalah untuk meniadakan atau
meminimunkan terbentuknya krista1 es dibutuhkan krioprotektan dengan
konsentrasi tinggi. Hal ini dapat mengakibatkan tingginya tekanan osmotik serta
toksisitas krioprotektan terhadap oosit (Arav, et al., 1993). Salah satu upaya untuk menimimunkan pengaruh tekanan osmotik, dapat dilakukan dengan
menambahkan krioprotektan ekstra seluler seperti sukrosa dengan konsentrasi
bertingkat (Takahashi dan Kanagawa, 1990; Tada et al., 1994) Sedangkan pengaruh toksisitas dapat dirninimumkan dengan menggunakan krioprotektan
dengan toksisitas rendah seperti etilen glikol. Penambahan sukrosa ke dalarn
larutan ekuilibrasi embrio sebelum dan sesudah kriopreservasi telah dilaporkan
dapat meningkatkan daya tahan hidup ernbrio maupun oosit setelah penghangatan
kembali (warming) (Szell dan Shelton, 1986; Takahashi dan Kanagawa, 1990). Tada et al. (1994) mempergunakan larutan sukrosa untuk proses dehidrasi oosit mencit pada proses vitrifikasi untuk menghindari penggunaan krioprotektan intra-
seluler yang bersifat toksik bagi oosit dan memfasilitasi pengeluaran krioprotektan intra-seluler pada masa pasca-penghangatan.
Mengacu pada keberhasilan metode vitrifikasi embrio, vitrifikasi oosit
telah dilaporkan pada mencit (Nakagata et d., 1989; Shaw et al., 1991; Shaw e f
al., 1992; O'Neil, et al., 1998; Bautista, et al., 1998) dan beberapa hewan hewan
demikian, sejauh ini keberhasilan yang telah dilaporkan masih sangat terbatas dan
variatif.
Dari berbagai kajian tentang kriopreservasi oosit, kajian terhadap
morfologi dan fingsi biologis oosit setelah vitrifikasi masih sangat terbatas
(Niemann, 1991; Richardson dan Park, 1992; Aman dan Park, 1994; Lim et al.,
1992; Otoi el al., 1992; Rayos, et aL, 1994). Oosit beku akan memiliki nilai
tambah jika setelah kriopreservasi masih menunjukkan keadaan morfologi
maupun struktur organel yang normal. Keadaan ini sangat berkait erat dengan
perananannya didalarn menunjang dan menjalankan aktivitas hngsi biologis
oosit, yaitu sebagai salah satu unsur utama pembentuk sigot pada proses fertilisasi
disamping sebagai sarana atau tempat berlangsungnya proses fertilisasi dan
perkembangan embrio (Hyttel et al., 1997). Dengan demikian, kuantitas serta
kualitas dari organel ataupun bahan-bahan lain yang terkandung di dalam
sitoplasma oosit akan sangat menentukan keberhasilan proses fertilisasi dan
perkembangan embrio selanjutnya (Hyttel et al., 1997).
Dibandingkan dengan sel tubuh lainnya, oosit mamalia memiliki ukuran
yang relatif besar dengan diameter 120 pm, dan memiliki karakteristik morfologik
serta fbngsional yang unik. Keadaan susunan morfologi berturut-huut dari Iuar
adalah zona pelucida, membnrn plasma (oolemma) dan sitoplasma (ooplasma).
Di bagian luar, zona pelucida dikelilingi oleh sel-sel granulosa yang berhubungan
dengan membran plasma melalui g q junction. Sitoplasma oosit mengandung
organel-organel seperti mitokondria, retikulum endopiasmik, butir-butir korteks
pematangan ataupun species telah dilaparkan pula menunjukkan keadaan
perbedaan karakteristik rnembran maupun organel (Agca el al., 1997; Hyttel et
al., 1997). Dengan demikian, sampai saat ini, kriopreservasi oosit masih menjadi
tantangan terbesar bagi kriobiologis yang beke rja di bidang reproduksi. Kerusakan
yang te rjadi pada oosit yang mengalami kriopreservasi sangat variatif tergantung
pada dua faktor utama yaitu karakteristik oosit dan metode yang dipergunakan
sehingga penentuan metode yang akan dipergunakan serta kesesuaiannya dengan
karakteristik sel &an sangat menentukan keberhasilan kriopreservasi. Karenanya
setelah proses vitrifikasi, pemeriksaan morfologi serta keadaan struktur oosit
secara mikroskopis dan imunositokimia adalah penting sekali. Dan keadaan ini
perlu dibuktikan lebih lanjut dengan pengujian aktivitas fungsi biologis oosit
melalui proses pematangan dan fertilisasi in vitro serta perkembangan embrio in
vifro selanjutnya.
2. Tujuan dm Manfaat Penelitian
2. 1. Tujuan Penelitian
Penelitian ini dilakukan untuk rneningkatkan nilai tambah w s i t melalui
proses kriopreservasi dalam rangka memproduksi oosit beku dan embrio secara in
vitro. Sedangkan secara khusus, penelitian ini ditujukan untuk mengkaji keadaan
morfologi dan h g s i biologis oosit domba setelah kriopreservasi dengan metode
2.2. Manfmt Penelitian
Adapun manfaat yang diperoleh dengan dihasilkannya oosit beku melalui
penelitian ini adalah:
(1) Memberikan informasi dasar mengenai vitrifikasi oosit yang dapat diterapkan
pada hewan ternak lainnya ataupun hewan mamalia lainnya.
(2) Memudahkan transportasi oosit.
(3) Mendukung dan mernudahkan implernentasi kegiatan proses produksi embrio
in vitro serta teknik terkait lainnya.
(4) Mendukung upaya pelestarian plasma nutfah melalui pembentukan bank
gamet.
(5) Memperluas khasanah pengetahuan dasar mengenai kriopreservasi melalui
TINJAUAN PUSTAKA
1. Perkembangan Peternakan Domba dam Bioteknologi Peternakan d i
Indonesia
1.1. Keadaan d a n Potensi Pengembangan Peternakan Domba d i Indonesia
Di Indonesia, khususnya Jawa Barat ternak domba dikenal sebagai salah
satu ternak penghasil daging, disamping penghasil bahan baku industri kulit Jan
serat (wool). Populasi domba pada tahun 1999 adalah sebanyak 7 502 437 ekor
dan sebagian besar tersebar di Jawa Barat (3 464 710 ekor), Jawa Tengah (1 838
214 ekor) dan Jawa Timur (1 355 518 ekor). Kontribusi daging domba terhadap
kebutuhan konsurnsi daging national yaitu 1 334 200 ton, hanya sekitar 2,76%
(Anonimouq 1999). Dibandingkan dengan produksi daging unggas serta kerbau
dan sapi, produksi dan kontribusi daging domba terhadap kebutuhan nasional
masih sangat rendah. Hal ini menunjukkan bahwa peluang untuk meningkatan
populasi ternak domba berikut kontribusi daging domba untuk memenuhi
kebutuhan konsumsi daging nasional masih sangat besar. Beberapa keuntungan
dari ternak domba dibandingkan sapi dan kerbau adalah mudah beradaptasi, cepat
berkembang biak, mudah dipasarkan dan tidak memerlukan modal yang terlalu
besar. Di samping itu, berbeda dengan domba dari daerah sub-tropis, domba lokal
Indonesia (tennasuk domba ekor gemuk) tidak memiliki aktivitas reproduksi
musiman dan pada ternak domba ekor gemuk adalah sifatnya sebagai ternak
prolifik (Sutama, 1992).
Namun demikian, kendala yang dihadapi dalam upaya meningkatkan
berpola tradional dan harnpir 97% dipelihara di pedesaan dalam skala kecil secara
sarnbilan. Untuk rneningkatkan kontribusi daging domba dalam memenuhi
kebutuhan konsumsi daging nasional perlu diupayakan pengembangan peternakan
domba dari pola tradional menjadi suatu pola usaha komersiaI. Dan salah satu
cara yang dapat dilakukan untuk meningkatkan produktivitasnya adalah rnelalui
penerapan bioteknologi reproduksi.
1.2. Perkembangan Bioteknologi Peternakan
Bioteknologi Peternakan dapat diartikan sebagai produk biologis atau
proses biologis untuk menghasilkan suatu produk petemakan dalam skala besar
dan berwrak industri yang antara lain rneliputi pemanfaatan proses rekayasa
embrio dan garnet serta rekayasa genetika dalam upaya meningkatkan mutu dan
jumlah produksi. Dalam ha1 produksi ternak, penarapan teknologi tepat guna di
bidang reproduksi telah dilaksanakan sejak 35-40 tahun yang lalu dimulai dengan
Inseminasi Buatan (IB). Dengan menggunakan teknik IB seekor pejantan unggul
dapat rnengawini Iebih dari tiga ribu betina setiap tahunnya, sedangkan dengan
perkawinan alamiah seekor pejantan hanya mampu mengawini sekitar tujuh puluh
sapi betina per tahun. Narnun demikian teknik IB hanya mendayagunakan secara
optimal sifat-sifat genetik dari seekor pejantan unggul. Sekitar 20-25 tahun yang
lalu telah diernbangkan teknologi tepat guna untuk mendayagunakan sifat-sifat
genetik tidak saja dari pejantan unggul tetapi juga induk yang unggul. Dengan
teknologi transfer embrio (TE) seekor betina unggul dapat menghasilkan lebih
teknik IB -pun perkawinan alamiah seekor betina unggul hanya menghasilkan
seekor keturunan per tahun.
Sejalan dengan perkembangan teknologi TE, berkembang pula teknologi
yang melibatkan perekayasaan proses biologis. Perkembangan teknik-teknik
lainnya yang terkait dengan TE antara lain adalah produksi embrio in vitro,
kloning dan kriopreservasi. Karena embrio merupakan salah satu tahap
perkembangan yang banyak dipakai didalam penelitian maupun penerapan teknik
transfer embrio serta teknik terkait lainnya, penelitian yang berkait erat dengan
proses perkembangan embrio berikut faktor-faktor pembentuknya, yaitu oosit dan
sperrna menjadi sangat penting.
2. Pertumbuhan d a n Perkembangan Folikel
Domba memiliki siklus estrus sekitar 14-17 hari, dengan lamanya estrus
sekitar dua sampai tiga hari. Pada hari pertama betina menunjukkan gejala berahi
merupakan hari ke-0 (HO) dari siklus berahi, sehingga dari satu gejala estrus ke
gejala estrus berikutnya dikatakan sebagai satu periode siklus estrus.
Proses pertumbuhan dan perkembangan oosit t e j a d i bersamaan dengan
sel-sel gramlosa yang mengelilinginya di dalam suatu folikel, sehingga dikenal
dengan proses perkembangan folikel atau folikulogenesis. Serdasarkan keadaan
stmktur dan morfologinya, perkembangan folikel dapat dibedakan atas folikel pre-
antral dan folikel antral. Folikel pre-antral merupakan folikel sebelum
terbentuknya rongga, sedangkan folikel antral merupakan folikel yang telah
memiliki rongga. Folikel pre-antral berasal dari folikel primordial, yaitu foliiel
pipih (sebagai prelcursor dari sel-sel lcumulus atau sel-sel granulosa). Folikel
primordial akan mengalami pertumbuhan dan pematangan menjadi folikel
preantral (folikel primer dan sekunder), antral, dan ovulatori atau mengalami
atretik (Findlay et al., 1996). Pada folikel primer dan sekunder, sel-sel pipih telah
merubah menjadi sel-sel yang berbentuk kuboid masing-masing terdiri dari satu
dan lebih dari dua lapis sel. Pada folikel tertier mulai tarnpak adanya pertumbuhan
intrum (rongga) dan mencapai diameter dua milimeter pada saat mencapai folikel
antral. Pada tahap ini pertumbuhan folikel berjalan sangat lambat dan sangat
berkait erat dengan proliferasi dari sel-sel granulosa. Pertumbuhan folikel antral
selanjutnya adalah ditandai dengan terjadinya pembesaran antrum, dan pada tahap
ini pertumbuhan sangat tergantung kepada suplai gonadotropin (Momiaux ef al.,
1996).
Pertumbuhan dan perkembangan folikel ovulatori terdiri dari atas beberapa
tahap yaitu rekruitmen, seleksi dan ovulasi. Tahap rekruitmen terjadi pada saat
corpus luteurn (CL) mengalami regresi dan pertumbuhan folikel telah menjadi
sangat tergantung pada gonadotropin. Pada masa tersebut dua sampai lima folikel
berdiameter lebih dari dua milimeter akan direkruit, namun memasuki tahap
seleksi hanya satu atau lebih folikel (yaitu folikel yang berdiameter di atas empat
milimeter) yang &an tetap tumbuh (tergantung species) menjadi folikel dominan
(yang berdiameter enam sampai delapan milimeter), sedangkan folikel lainnya
yang berdiameter kurang dari empat milimeter akan mengalami atresia atau
regresi.
Kriteria untuk menentukan folikel ovulatori adalah (a) ukuran folikel, (b)
reseptor
LH)
serta jumlah estradiol yang dihasilkan dan ( c ) perubahan yangberhubungan dengan populasi folikel kecil subordinat (Driancourt, 199 1).
Pada domba dalam satu periode siklus estrus terdapat sekitar dua sampai
tiga gelombang pertumbuhan folikel. Dengan demikian, proses rekruitmen dan
seleksi folikel dorninan tidak terbatas hanya pa& awal masa fase folikuler, namun
juga pada fase luteal. Gelombang pertama terjadi pada fase folikuler, dari hari ke-
12 sampai hari ke-0, biasanya &an merekruit dua folikel besar yang akan tumbuh
secara cepat sampai hari ke 15, setelah terjadi luteolisis pada hari ke-14. Folikel yang berdiameter besar atau folikel pre-ovulatori (berdiameter enam sampai
delapan rnilimeter dengan jumlah sel granutosa sekitar 3 x lo6), terlihat pada awal
estrus, dan diikuti dengan atresia dari folikel yang berdiameter medium yaitu dua
sampai empat milimeter.
Gelombang kedua terjadi pada fase luteal, dari hari pertama sampai hari
ke-12, puncaknya pada folikel tertier yaitu pada hari ke-tujuh dan rnenjadi atretik
pada hari ke-sembilan. Pada fase f o l i i l e r kehadiran folikel yang berdiameter
besar akan diakhiri dengan proses ovulasi, sedangkan pada fase luteal kehadiuan
folikel berdiameter besar akan bertahan sampai mendekati fase folikuler,
kemudian mengalami atresia. Namun demikian, kehadiran dari folikel
berdiameter kurang dari dua milimeter terjadi secara konstan sepanjang siklus
estrus. Pada dornba semua folikel sehat yang berdiameter kurang dari dua
milimeter rnemiliki kesempatan untuk owlasi pada saat CL mengalami regresi
(Driancourt, 1991).
Pada sapi tejadinya gelombang pestumbuhan folikuler diawali dengan
dengan disekresikannya inhibin dan estradiol oleh folikel dominan yang
berhubungan dengan regresi cepat dari folikel-folikel non dominan (Kaneko el al.,
1996). Pada fhse folikuler, terjadi pengeluaran LH yang tajam yang berhubungan
dengan peningkatan yang tajam dari reseptor LH pada sel-sel granulosa dari
folikel dominan, dan merangsang perkembangan akhir mencapai tahap pre-
ovulatori.
Sebaliknya, pada fase luteal, fiekuensi pulsa LH yang rendah tidak dapat
memelihara pematangan akhir dari folikel dominan, yang kemudian regresi dan
sekresi estradiol serta inhibin menurun, sehingga memungkinkan terjadinya
peningkatan konsentrasi FSH dan dimuiainya gelombang folikular baru (Taya et
al., 1996). Corpus luteum memberikan pengaruh lokal terhadap perkembangan
folikel, yaitu pada fase luteal terdapat lebih banyak folikel yang berdiameter lebih
dari empat rnilimeter pada ovarium yang mengadung CL dibanding ovarium
pasangannya.
Pada domba semua folikel berdiameter lebih dari dua rnilimeter (foiikel
sehat) memiliki kesempatan untuk ovulasi pada saat CL mengalami regresi.
Persentase folikel yang sensitif terhadap LH sangat tinggi (di atas 80%) pada
ovarium tanpa melihat fisiologis ovarium, yang menunjukkan bahwa gelombang
pertumbuhan folikel pada domba berlangsung secara kontinyu. Hasil penelitian
menunjukkan bahwa sensitivitas terhadap LH dari folikel luteal tidak
menunjukkan perbedaan dengan pada folikel ovulatori, kecuali terhadap
konsentrasi estradiol yang dihasilkan. Konsentrasi estradiol pada folikel fase
luted sangat tertekan. Setelah terjadi pelepasan FSH (pada HO) akan diikuti
baik pada fase folikuler maupun fase luteal setiap dua jam walaupun tanpa ritmik
yang tetap. Sebaliknya peningkatan LH terjadi setiap dua setengah jam pada fase
luteat, dan terus meningkat setiap satu jam pada h e folikuler. Puncak pelepasan
estradiol tejadi pada saat level LH dan FSH tinggi.
3. Keadaan Morfologi dan Fungsi Biologis Oosit
Oosit mamalia merupakan sel tunggal dan dibandingkan dengan sel tubuh
lainnya, &ran oosit relatif sangat besar (120 pm) serta memiliki karakteristik
morfologik dan fingsional yang unik. Keadaan ukuran, serta struktur dan
morfologi sangat berkait erat dengan fungsi biologis oosit, sehingga tidak dapat
dipisahkan satu sama lainnya.
Oosit memiliki fingsi biologis utama yaitu (1) sebagai pembawa unsur genetis dari maternal melalui proses penggabungan dua unsur genetis yang berasal
dari paternal dan maternal, yang dikenal dengan proses fertilisasi; serta (2)
sebagai tempat atau media yang memungkinkan sigot yang dihasilkan melalui
proses fertilisasi untuk menjalani proses perkembangan embrio.
U& itu oosit hams merniliki kapasitas untuk mendukung proses
fertilisasi dam perkembangan embrio (Bevers et al., 1997). Oosit akan memiliki kapasitas tersebut setelah menjalani proses pertumbuhan serta pematangan baik
inti maupun sitoplasma sehingga oosit tersebut memiliki keadaan inti yang
haploid serta kandungan sitoplasma yang siap mendukung proses fertilisasi dan
perkembangan embrio. Selarna menjalani proses pertumbuhan keadaan morfologi
diameter, aktivitas transkripsi dan kandungan sitoplasma, serta perpindahan inti dari pusat ke tepi.
Pada folikel primordial dan primer, komunikasi antara oosit dengan sel-sel
granulosa diperantarai melalui jalur endositotik yang ditandai dengan banyaknya
vesikel serta celah-celah pada oosit. Dan setelah pertumbuhan memasuki folikel
sekunder jalur komunikasi mengalami perubahan yaitu berlangsung melalui gap
junction (hubungan berupa celah) yang terbentuk diantara oosit dan sel-sel
granulosa (Hyttel ef ai., 1997).
Berdasarkan tahap perkembangannya, inti oosit dapat dibedakan atas tahap
Germinal Vesicle (GV), Germinal Vesicle Break Down (GVBD), Metafase-I (Mt-
I) dan Metake-I1 (Mt-11). Oosit pada folikel primordial dan primer berukuran
sekitar 30-50 prn dengan inti berada pada tahap germinal vesicle. Dengan
berlangsungnya proses perkembangan oosit, inti yang semula berada pada tahap
GV dan kromosom dalam keadaan istirahat (tahap profase dari pembelahan
meiosis I), berturut-turut akan mengalami perubahan dimulai dengan pecahnya
membran inti atau germinal vesicle break down, kemudian mencapai Mt-I dan
dilanjutkan ke Mt-I1 yang siap untuk difertilisasi oleh sperma. Pada saat tersebut
ukuran oosit telah mencapai 120 pm.
Pada pematangan sitoplasma te qadi perubahan molekuler dan struktural
yaitu tejadinya peningkatan yang pesat terhadap jumlah maupun ukuran organel
seperti ribosom, butir-butir lernak, badan golgi dan mitokondria serta butir-butir
korteks, sehingga oosit memiliki kapasitas untuk mendukung fertilisasi dan
yang semula berada di bagian dalam ooplasrna kemudian menyusun diri di bagian
perifer di bawah membran plasma. Pembahan kandungan sitoplasma mulai
tampak pada folikel sekunder dan meningkat pada folikel tertier.
Pada s a p i ukuran serta keadaan struktur dan morfologi dari oosit matang
(Mt-II) adalab diameter zona pelucida sekitar 110-120 ~ u n , granulasi ooplasma
homogen clan diielilingi oleh sel-sel kumulus yang fonggar. Dengan mikroskop
cahaya fase kontras dapat dilihat bahwa inti yang berada pada metafase-I1
mengandung aparatus kumparan anastral di perifer, dengan mikrotubulin yang
memanjang dari masing-masing kutub ke kinetokhors kromosom bivalen.
Sedangkan dengan mikroskop elektron transmisi tampak bahwa butir-butir
korteks berada tepat di bawah membran plasma dimana mereka akan dipacu untuk
menjalani eksositosis pada waktu proses fertilisasi. Keluarnya kandungan butir-
butir korteks mengakibatkan perubahan pada zona pelucida (reaksi butit-butir
korteks), rnenciptakan hambatan terhadap polisperma. Membran plasma oosit
mamalia ditutupi oleh sejumlah mikrovili yang mengandung filament aktin inti
(core). Komposisi biokimia dari membran lapis ganda (bilayer) pada oosit
mamalia belum banyak diketahui, namun amat mudah mengalami destabilisasi.
Susunan dari mikrofilamen yang mengandung aktim ditemukan di dalam
perinuklear dan korteks sitoplasma yang terlibat didalam distribusi organel pada
masa pematangan oosit, deformasi pemukaan yang berhubungan dengan
pengelurnan badan kutub (polm boby) (Hyttel et al., 1997).
Baik mikrotubulin maupun mikrofilamen merupakan bagian dari skeleton
meiosis, fertilisasi, serta kompaksi (compaction) dan kavitasi embrio pada proses
pembentukan biastosis (Kim ei al., 1993). Skeleton sel bersifat dinamis dan
mengalami perubahan susunan pada masa pembelahan sel. Pada masa pertumbuhan dan pembelahan sel, mikrotubulus akan mengalami perubahan dan
pada saat metafase mikrotubulin tampak sebagai kumparan meiotik yang
memegang kromosom di ekuator.
4. Potensi Koleksi Oosit d a n Produksi Embrio Secara In M t r o
Penggunaan teknik in vitro sudah menjadi suatu prosedur yang rutin di
banyak laboratorium baik untuk tujuan penelitian maupun untuk memproduksi
embrio skala besar yang berkaitan dengan peningkatan kuantitas dan kualitas
ternak (Gordon dan Lu, 1990). Koleksi oosit maupun produksi embrio secara in
vitro erat kaitan dengan teknologi transfer embrio. Keuntungan lain dari sistern in
vitro, adalah untuk mempelajari perkembangan embrio, mengetahui penyebab
kematian embrio, sintesa protein pada perkembangan transisi antara maternal-
embrionik, transfer inti dan produksi hewan transgenik (Wilmut et al., 2000).
Telcnologi produksi embrio secara in vitro (in vitro produced; IVP)
merupakan serangkaian sistem kultur in vitro yang meliputi maturasi in vitro (in
vifro maturation; IVM), fertilisasi in vitro (in vitro fertilization; IVF) dan kultur
embrio in vitro sampai tahap morula atau blastosis (in vitro culture; IVC). Sarnpai
saat ini metode-metode tersebut telah dipergunakan secara ekstensif pada
beberapa hewan ternak antara lain sapi (Schellander et al., 1990; Utsumi et al..
1991; Bavister et al., 1992; Lonergan et al., 1992; Boediono et al., 1995; Djuwita
Czlonkowska ef al., 1999; Wani ef al., 1999; Rusyiyantono et al., 2000) dan
kambing Q3oediono et al., 2000).
4.1. Maturasi In Viiro (IVM)
Maturasi (pematangan) oosit yang meliputi pematangan inti dan
sitoplasma merupakan suatu tahapan yang sangat penting didalam mendukung
keberhasilan Fertilisasi serta perkembangan embrio selanjutnya (Bevers et af.,
1997; Hyttel, et al., 1997). Perubahan yang berhubungan dengan proses
pematangan akhir in vivo dapat ditiru secara in vifro di dalam medium kultur. Hal
ini telah dibuktikan melalui beberapa penelitian yang menunjukkan bahwa oosit
mamalia setelah dilepaskan dari folikel ovari dapat melanjutkan proses
pematangan inti secara spontan di dalam medium kultur in vifro (Edwards, 1 9 6 5 )
dan fertilisasi in vifro (Iritani dan Niwa, 1977). Namun demikian perkembangan
embrio hasil pematangan dan fertilisasi in vifro menunjukkan tingkat yang lebih
rendah dibandingan hasiI pematangan in vivo (Leibfried-Rutledge et at., 1987).
Salah satu penyebab kegagalan fertilisasi adalah oosit yang diperoleh berasal dari
populasi folikel yang kondisinya heterogen, disamping pematangan sitoplasma
yang tidak sempurna atau oosit telah mengalami aging (penuaan) (Pevlok et al.,
1988, Hyttel et al., 1997).
Pemataugan oosit in viiro dimaksudkan agar oosit primer dapat
berkembang menjadi oosit sekunder yang a k a melakukan proses pembelahan
meiosis dengan normal dan sempurna sehingga dihasilkan oosit yang siap dibuahi
oleh spermatozoa dan akhimya mampu berkembang menjadi embrio yang
Oosit dapat diperoleh dari hewan hidup ataupun ovaria dari rumah potong
hewan. Oosit yang dipergunakan diperoleh dari ovaria hewan betina tanpa
memperhatikan fase siMus berahinya (Djuwita et a / . , 1995; Wani et ai., 1999).
Oosit diambil langsung dari foiikel yang berukuran dua sarnpai fima milimeter
dan disimpan di dalam medium yang s e d untuk kemudian dirangsang proses
pematangannya.
Di luar tubuh, proses pematangan dapat dilakukan di dalam medium
kultur antara lain Tissue Culture Medium (TCM) 199 (Moor dan Trounson,
1977). Untuk membantu proses pematangan, umumnya medium diberi tambahan
protein seperti fetal calf serum (FCS), newborn calf serum (NCS), bovine
serum albumine (SSA) ataupun serum induk (Schellander et al., 1990). serta
foIIicIe stirnuloring hormone ( F S H ) , luteinizing hormone ( L H ) dan estradiol- 17-
B (Schellander et al., 1989). Namun peranan hormon seperti LH dan hormon
steroid diketahui masih bersifat kontroversial (Fukui dan Ono, 1989, Zuelke dan
Brackett, 1990; Keefer et al., 1991). Beberapa fakior pertumbuhan lainnya seperti
Epidermal Growth Factor (EGF), Transfrming Growth Factor (TGF)-a, TGF-p
dan Insulin Growth Factor (1GF)-I diketahui dapat mempengaruhi tingkat
pematangan in vitro (Bevers et al., 1997). Epidemal growth factor diketahui
memiliki pengaruh mitotik terhadap sel-sel granulosa serta memberikan kontribusi
pula terhadap tetjadinya germinal vesicle break down dan pembentukan badan
kutub @as el d . 1991).
Hasil penelitian Critser et al., (1986) menunjukkan bahwa interaksi antara
vifro sangat berpengaruh terhadap kompentensi perkembangan dan pematangan oosit. Interaksi ini sangat diperiukan untuk membantu komunikasi dan
metabolisme oosit dengan lingkungannya melalui gap junction (Staigmiller dan
Moor, 1984; Larsen et al., 1987; Goto et a/., 1988).
4.2. Fertilisasi In Etro (IVF)
Fertilisasi atau fertilisasi merupakan rangkaian proses kompleks yang
dimulai dengan (1) terjadinya kontak antara garnet jantan (spermatozoa) dengan
gamet betina (oosit), (2) penetrasi sperma ke dalam zona pelucida, (3) hsi antara
membran sperma dan membran msit, dan diakhiri dengan (4) synkaryosis, yaitu
bersatunya kedua pro-inti (pro-nukleus) sperma dan oosit. Sarat mutlak bagi
sperma untuk mampu melakukan penetrasi ke dalam oosit adalah terlebih dahulu
mengalami kapasitasi (capacifation), yaitu suatu perubahan fisiologik dan
biokimia . Perubahan ini terjadi akibat adanya ion-ion kalsium bebas sehingga
te qadi perubahan pada membran plasma sperma serta reaksi akrosom. Pada saat
terjadi reaksi akrosom terjadi pelepasan suatu~~~komponen dari permukaan
akrosom sehingga sperma yang juga dibantu dengan pergerakan ekornya mampu
menembus barier oosit yang berupa sel-sel kumulus, zona pelucida serta membran
vitelin @landau, 1980).
Secara in vitro, proses kapasitasi dapat dilakukan dalam medium BO
(Bracken dan Oliphant, 1975) atau CRlaa (Rorenkrans dan First, 1994) yang
telah diberi tambahan kafein (5,0mM), heparin (10,O ug/ml) dan B S A (1,0%)
(Niwa dan Ohgoda, 1988). Dari hasil penelitian Niwa et al. (1992) pada sapi
meningkatkan motilitas sperma sehingga merangsang penetrasi sperma terhadap
w s i t .
4.3. Perkembangan Embrio In Yilro (IVCJ
Sigot yang dihasilkan melalui proses pematangan dan fertiiisasi in vitro
telah berhasil dikembangkan secara in vitro di dalam medium kultur seperti TCM
199, C r l a a (Rosenkrans dan First, 1994), Sjmthetic oviductfCuid (SOF) (Tervit et
al., 1974; Walker et al., 1989), ataupun medium dengan komposisi bahan kimia
tertentu (chemically defined medium) (Gardner et al., 1994). Namun demikian,
w s i t yang telah mengalami pematangan di dalam media kultur, setelah dibuahi
dan ditransfer ke resipien mempunyai kemampuan berkembang yang sangat
rendah (Trounson el al., 1977). Hal ini menunjukkan masih belum
memadainya kondisi in vifro bagi sistem perkembangan embrio selanjutnya.
Hambatan yang paling besar adalah terjadinya fenomena cell-block pada
pertumbuhan embrio rnamalia secara in viwo (Barbehenn et al.
m:
Thompson,2000). Pada kambing dan domba, embrio umumnya mengalami hambatan
pertumbuhan pada tingkat 4-8 sel. Diduga ada faktor-faktor pertumbuhan yang
dapat dihasilkan oleh sel-sel somatis alat reproduksi betina yang sangat penting
untuk perkembangan dan pertumbuhan embrio.
Usaha-usaha yang telah dilakukan untuk mengatasi hambatan
perkembangan embrio antara lain adalah ( I ) penggunaan ko-kultur sel-sel somatis
seperti mo~mlayer sel granulosa (Jiang er al.. 1991; Waiker et al., 1992), sel-sei
kumulus (Kajihara et al., 1987; Fukui ef al., 1988, 1989, Goto, et al., 1988), sel-
1991; Watson et al., 1994) atau sel-sel uterin, penggunaan chemically defined
medium (Gardner et al., 1994) atau penambahan bahan-bahan growth factor (Fry
et al., 1992).
5. Kriopreservasi
Secara umum teknik kriopreservasi rnerupakan suatu cara untuk
menyimpan sarnpel populasi hewan, tanaman atau sumber genetik lainnya dalam
bentuk beku. Tujuan kriopreservasi adalah untuk penyimpanan, pemeliharaan,
menjamin dan mempertahankan kelangsungan hidup sel, serta memperbaiki
lingkungan alamiah. Dengan teknik kriopreservasi yang efektif, viabilitas sel
dapat dipertahankan dengan cara mereduksi fingsi-fungsi dan aktivitas metabolik
sel tanpa terjadinya kerusakan membran maupun organel sel sehingga fungsi
imunologis, biologis dan fisiologis sel tetap ada.
Didalam bidang reproduksi penerapan teknik kriopreservasi embrio maupun
oosit dipakai sebagai alat untuk melakukan intervensi dan pengaturan terhadap
siklus reproduksi (Rall, 1992). Kini teknik kriopreservasi telah menjadi bagian
dalarn (1) industri transfer embrio yang dapat mengatasi kendala waktu maupun
ternpat; karena embrio beku (terutama ras yang mempunyai genetik superior)
lebih mudah diperdagangkan dalam skala national maupun international serta
dapat ditransfer setiap waktu disesuaikan dengan keadaan siklus reproduksi
hewan resipien. (2) penanggulangan infertilitas, d i i a n a perlakuan kriopreservasi
dipakai sebagai usaha untuk dapat menyesuaikan terhadap waktu pelaksanaan
fertilisasi in vilro serta teknik konsepsi yang terkait lainnya, dan (3) menunjang
Berdasmkan fenornena fisik ada dua metode kriopreservasi yakni rnetode
pembekuan (freezing) yang disertai dengan pernbentukan kristal e s dan metode
tanpa pembentukan kristal e s yang dikenal dengan istilah vitrzfikasi (Rall dan
Fahy, 1985; Nakagata, 1989; Arav et a/., 1993). Namun demikian, prinsip dasar
kerja dari kedua metode tersebut di atas adalah serupa yakni pengaturan yang seksama terhadap volume osmotik sel pada masing-masing tahapan proses
pembekuan (Rall, 1992).
Demikian pula dengan faktor-faktor yang berperanan didalam
keberhasilan kriopreservasi pada kedua metode tersebut di atas adalah serupa
yakni: (1) jenis dan konsentrasi krioprotektan yang dipergunakan (Fahy, 1986;
Fahy et a/., 1990); (2) proses pendinginan dan pernbekuan (Farrant dan Moms,
1973; McGrath dan Walterson, 1985); (3) proses rehidrasi dan perubahan osrnotik
(Meryman, 1985), serta (4) karakteristik sel (oosit atau embrio) seperti morfologi
(bentuk dan ukuran) dan tahap pernatangan atau perkembangan, serta kuditas dan
sumber garnet (in vivo atau in vitro) (Rall, 1992; Han e t a/., 1994; Takagi et a/.,
1994, Saha cf a/., 1996b).
5.1. Metodc Pembekuan dengan Pembentukan Kristal Es
Kedalam katagori ini termasuk metode pembekuan konventional atau
lambat (slow peezing) serta pembekuan cepat maupun sangat cepat (rapid a n d
ultra rapid freezing). Dari fenomena fisik, rnetode ini merupakan proses
pernbekuan air melalui pembentukan kristal e s jika didinginkan di bawah 0°C.
Pembentulcan kristal es senantiasa diawali dlbagian cairan ekstraseluler sampai
tekanan o s ~ m t i k dari cairan ekstraseluler yang tersisa. Konsekuensinya teijadi
ekstraksi air dari dalam sel (intraseluler) secara berlebihan dapat rnengakibatkan kekeringan sel (dehidrasi) yang sangat berat serta distorsi organel-organel
intraseluler (Rail, 1992).
Dengan demikian, pembekuan lambat merupakan suatu usaha untuk
mempertahankan keseimbangan diantara berbagai sumber kerusakan fisik (injury)
dengan konsentrasi krioprotektan yang relatif rendah (akan meminimumkan
kerusakan akibat osmotik serta toksisitas) dan mengatur pembentukan kristal es,
yang mengakibatkan larutan kriopreservasi yang terkonsentrasi masuk ke dalam
sel.
Metode pernbekuan oosit telah dilaporkan pada mencit (Van der Elst ef al..
1993; Rayos et al., 1994), sapi (Niemann, 1991; Parks dan Ruffing, 1992) dan
kambing (Le Gal, 1996) umumnya rnengacu pada metode pernbekuan yang telah
diterapkan pada embrio. Sejauh ini telah dilaporkan bahwa proses pembekuan
oosit dapat mengakibatkan kerusakan morfologi dan struktur serta menurunkan
bahkan menghilangkan fingsi biologis oosit, yaitu menurunnya tingkat fertilisasi
dan perkembangan embrio mencit (Van der Elst ei al.. 1993; Rayos et al., 1994)
dan sapi (Otoi et al., 1992; Lim ef al, 1992; Schmidt et al., 1993; Martino et al.,
1996: Kubota et al., 1998). Kerusakan morfologi yang te jadi addah pecahnya
w n a pelucida, dis-integrasi membran plasma, kerusakan bahan serta organel
sitoplasma sepmti skeleton sel dan kromosom, butir-butir korteks dan butir-butir
lemak (Didion et al., 1990, Richardson dan Parks, 1992; Schmidt et al., 1993;
Van der Elst, et al.. 1993; Aman dan Park, 1994; Fulcui ef al., 1995; Zhu et al.,
Beberapa -or yang diduga dapat mengakibatkan perubahan morfologi dan fingsi biologis oosit adalah pemaparan terhadap krioprotektan (Taha d m
Schellander, 1992), proses pendinginan (Pickering dan Johnson, 1987; Richardson dan Parks, 1992; Stoffregen, et a/, 1992; Arnan dan Park, 1994; Wu et
at.,
1999) serta kristal es yang terbentuk (Aman d m Parks, 1994; Fukui etat.,
1995; Vajta etal., 1997).
5.2. Metode Vitifikasi
Alternatif lain untuk metode kriopreservasi adalah vitrifikasi (Rall dan
Fahy, 1985; Nakagata, 1989). Pada proses vitrifikasi, pernadatan cairan terjadi melalui peningkatan viskositas yang ekstrim pada masa pendinginan cepat tanpa
disertai pembentukan kristal-kristal es (Rall, 1987). Bagian padat ini tampak bening sehingga disebut vitreus yang berarti kaca, serta merniliki distribusi
molekuler clan ionik dalam keadaan cair, d m dengan demikian dapat menghidari
efek yang merusak dari kristal es ekstra dan intraseluler.
Metode vitrifikasi bersifat radikal karena pada dasarnya adalah
menghindari terbentuknya kristal es secara total. Hal ini dapat dilakukan dengan
cara peningkatan viskositas larutan serta melalui