82
Lampiran 1
83
Lampiran 2
Hasil Uji Analisis Data Statistik
Tests of Normality
Perlakuan
Kolmogorov-Smirnova Shapiro-Wilk
Statistic Df Sig. Statistic df Sig.
Candida albicans
Perendaman Vinegar Apel 5%
.277 6 .168 .773 6 .033
Perendaman Vinegar Apel 6,23%
.302 6 .094 .775 6 .035
Perendaman Sodium Hipoklorit 1%
.392 6 .004 .701 6 .006
Perendaman NaCl 0,9% .166 6 .200* .969 6 .886
a. Lilliefors Significance Correction
*. This is a lower bound of the true significance.
Distribusi data tidak normal dan nilai data varian tidak sama.
NPar Tests
Descriptive Statistics
N Mean Std. Deviation Minimum Maximum
Candida albicans
24 23091.67 40840.101 0 102100
84
Kruskal-Wallis Test : untuk mengetahui pengaruh perendaman basis gigi tiruan
RAPP pada kelompok yang direndam dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% selama 8 jam terhadap jumlah Candida
albicans
85
Mann-Whitney U Test: untuk mengetahui perbedaan pengaruh antara perendaman
basis gigi tiruan RAPP pada kelompok yang direndam dalam vinegar apel 5%, vinegar apel 6,23%, dan sodium hipoklorit 1% selama 8 jam terhadap jumlah
Candida albicans.
Mann-Whitney U 9.500
Wilcoxon W 30.500
Z -1.422
Asymp. Sig. (2-tailed) .155
Exact Sig. [2*(1-tailed Sig.)] .180a
a. Not corrected for ties.
b. Grouping Variable: Perlakuan
86
Test Statisticsb
Candida albicans
Mann-Whitney U 5.500
Wilcoxon W 26.500
Z -2.091
Asymp. Sig. (2-tailed) .037
Exact Sig. [2*(1-tailed Sig.)]
.041a
a. Not corrected for ties.
b. Grouping Variable: Perlakuan
• PADA KELOMPOK A DAN D
Mann-Whitney U .000
87
Mann-Whitney U 14.500
Wilcoxon W 35.500
Z -.632
Asymp. Sig. (2-tailed) .527
Exact Sig. [2*(1-tailed Sig.)] .589a
a. Not corrected for ties.
b. Grouping Variable: Perlakuan
88
Test Statisticsb
Candida albicans
Mann-Whitney U .000
Wilcoxon W 21.000
Z -2.908
Asymp. Sig. (2-tailed) .004
Exact Sig. [2*(1-tailed Sig.)]
.002a
a. Not corrected for ties.
b. Grouping Variable: Perlakuan
• PADA KELOMPOK C DAN D
Mann-Whitney U .000
Wilcoxon W 21.000
Z -2.934
Asymp. Sig. (2-tailed) .003
Exact Sig. [2*(1-tailed Sig.)]
89
Lampiran 4
76
DAFTAR PUSTAKA
1. McCabe JF, Walls AWG. Applied dental materials. 9th ed., London: Blackwell, 2008: 110-23.
2. The Academy of Prosthodontics. The glossary of prosthodontic terms. The J Prosthetic Dent 2005; 94(1): 30-1.
3. Carr AB, et al. McCracken’s removable partial prothodontics. 11th ed., Saint Louis: Elsevier Mosby, 2005: 8-9.
4. Rueggeberg FA. Dental materials for complete dentures. In: Rahn AO, et al. eds. Textbook of complete denture, 6th ed., USA: People’s Medical Publishing House, 2006: 8-10.
5. Tandon R, Gupta S, Agarwal SK. Denture base materials: Form past to future. IJDS 2010; 2(2): 33-5.
6. Groover MP. Fundamentals of modern manufacturing: Materials, processes,
and systems. 3rd ed., USA: John Wiley & Sons Inc., 2007: 145-66.
7. O’brien WJ. Dental materials and their selection. 3rd ed., USA: Quintessence Publishing Co., 2002: 141-53.
8. Diwan RR. Materials prescribed in the management of edentulous patients. In: Zarb, et al. eds. Prosthodontic treatment for edentulous patients: Complete
dentures and implant-supported prostheses, 12th ed., Saint Louis: Elsevier Mosby, 2003: 190-6.
9. Anusavice KJ. Phillips’ science of dental materials. 11th ed., Saint Louis: Saunders Elsevier, 2003: 75-101, 88-92, 143-6.
10. Van Noort R. Introduction to dental materials. 2nd ed., London: Elsevier, 2002: 211-7.
11. Craig RG, et al. Dental materials properties and manipulation. 7th ed., Saint Louis, Missouri: Mosby, 2002: 258-65.
77
13. Dwiatmoko S, Kristiana D. Pengaruh komuniksi kesehatan secara lisan dan
tulisan terhadap pengetahuan, sikap dan kebersihan gigi tiruan para pemakai gigi tiruan lepasan. Dentika Dent J 2011; 16(1): 14-7.
14. Arici N, Ural C. The effects of a denture cleanser on the surface roughness of
heat-cured and cold-cured acrylic resins. Turkish J Orthod 2013; 26(2): 92-7.
15. Mota ACLG, Castro RD, Oliveira JA, Lima EO. Antifungal activity of apple
cider vinegar on Candida species involved in denture stomatitis. Journal of
Prosthodontics 2015; 4(2): 296-302.
16. de Castro RD, Mota ACLG, Lima EO, Batista AUD, Oliveira JA, Cavalcanti AL. Use of alkohol vinegar in the inhibition of Candida spp. and its effect on
the physical properties of acrylic resins. BMC Oral Health 2015; 15(52): 1-7.
17. PintoTMS, Neves ACC, Leao MVP, Jorge AOC. Vinegar as an antimicrobial
agent for control of Candida spp. in complete denture wearers. J Appl Oral Sci
2008; 16(6): 385-90.
18. Sousa FACG, Paradella TC, Koga-Ito CY, Jorge AOC. Effect of sodium
bicarbonate on Candida albicans adherence to thermally activated acrylic resin. Braz Oral Res 2009; 23(4): 381-5.
19. Faot F, et al. Efficacy of citric acid denture cleanser on the Candida albicans
biofilm formed on poly(methyl methacrylate): effects on residul biofilm and recolonization process. BMC Oral Health 2014; 14: 77.
20. Jafari AA, Falah-Tafti A, Lotfi-Kamran MH, Zahraeii A, Kazemi A. Vinegar as
a removing agent of Candida albicans from acrylic resin plates. Jundishapur J
Microbiol 2012; 5(2): 388-92.
21. Anibal P.C., Sardi JCO, Peixoto ITA, Moraes JJC, Hofling JF. Conventional
and alternative antifungal therapies to oral candidiasis. Brazilian Journal of
Microbiology 2010; 41: 824-31.
22. Komiyama EY, Back-Brito GN, Balducci I, Koga-Ito CY. Evaluation of
alternative methods for the disinfection of toothbrushes. Braz Oral Res 2010;
78
23. Pisani MX, Silva CHL, Paranhos HFO, Souza RF, Macedo AP. The effect of
experimental denture cleanser solution Ricinus communis on acrylic resin properties. Materials Research 2010; 13(3): 369-73.
24. Kumar MN, Thippeswamy HM, Raghavendra Awamy KN, Gujjari AK.
Efficacy of commercial and household denture cleansers against Candida albicans adherent to acrylic denture base resin: an in vitro study. Indian J Dent
Res 2012; 23: 39-42.
25. Yadav R, Yadav VS, Garg S, Mittal S, Garg R. Effectiveness of different
denture cleansing methods on removal of biofilms formed in vivo. J Cranio Max
Dis 2013; 2(1): 22-7.
26. Naeem A, Amrit R, Sumit M, Nisha S, Pankaj K, Taseer B. Denture hygiene: A
short note on denture cleansers. Journal of Science 2015; 5(3): 131-3.
27. David, Munadziroh E. Perubahan warna lempeng resin akrilik yang direndam
dalam larutan desinfektan sodium hipoklorit dan klorhexidin. Maj Ked Gigi
(Dent J) 2005; 38(1): 36-40.
28. Joseph RM. Comparison of efficacy of sodium hypochlorite with sodium
perborate in the removal of stains from heat cured clear acrylic resin. The
Journal of Indian Prosthodontic Society 2009; 9(1): 6-11.
29. Uludamar A, Özkan YK, Kadir T, Ceyhan I. In vivo efficacy of alkaline
peroxide tablets and mouthwashes on Candida albicans in patients with denture stomatitis. J Appl Oral Sci 2010; 18(3): 291-6.
30. Zarb, et al. Prosthodontic treatment for edentulous patients: Complete dentures
and implant supported prosthesis. 13th ed., Elsevier Mosby, 2013: 133-9,152-5. 31. Fukuzaki S, Urano H, Yamada S. Effect of pH on the efficacy of sodium
hypochlorite solution as cleaning and bactericidal agents. Research Papers
2007; 58(8): 465-9.
32. da Silva PMB, et al. Effectiveness of six different disinfectants on removing five
microbial species and effects on the topographic characteristics of acrylic resin.
79
33. Mey Bengkulen. Dunia biosains
34. Kwartiningsih E, Mulyati NS. Fermentasi sari buah nanas menjadi vinegar. Jurusan Teknik Kimia Fakultas Teknik UNS 2005; 4(1): 8-12.
35. International Symposium. Book of abstracts: Vinegars and acetic acid bacteria. Reggio Emilia Italy 2005: 84.
36. Anonymous. Produk fermentasi buah anggur, cider, dan vinegar. http://tekpan. unimus.ac.id/wp-content/uploads/2013/07/PRODUK-FERMENTASI-BUAH-ANGGUR-CIDER-DAN-VINEGAR.pdf
37. Karim NM. Perbandingan efektivitas cuka apel dan dietilpropion terhadap
penurunan berat badan tikus (Rattus novergicus). Skripsi. Jakarta: Fakultas
Kedokteran Gigi Universitas Indonesia, 2011: 4-9.
(20 September 2015).
38. Ostrosky EA, Mizumoto MK, Lima M.E.L., Kaneko TM., Nishikawa SO., Freitas BR. Métodos para avaliação da atividade antimicrobiana e
determinação da Concentração Mínima Inibitória (CMI) de plantas medicinais.
Braz J Pharmacogn 2008; 18(2): 301-7.
39. Zubaidah E, Rosdiana I. Efektivitas cuka salak dan cuka apel terhadap kadar
glukosa darah dan histopatologi pankreas tikus diabetes. Jurnal Pangan dan
Agroindustri 2016; 4(1): 170-9.
40. Ratnasari A, Wahjuni W, Hendrijantini N. Efek seduhan bunga rosella dalam
menghambat pertumbuhan Candida albicans pada resin akrilik. Journal of
Prosthodontics 2013; 4(1): 22-6.
41. Moersidi SNM. Daya hambat minimal ekstrak kulit apel manalagi terhadap
pertumbuhan Candida albicans. Skripsi. Surabaya: Universitas Hasanuddin,
2015: 1-3, 9-12.
42. Khindria S.K., Mittal S, Sukhija U. Evolution of denture base materials. J Indian Prosthodont Soc 2009; 9(2): 64-9.
43. Park HW, Kim CW, Kim YS. A comparative study on the accuracies of resin
denture bases and metal denture bases. J Korean Acad Prosthodont 2001;
80
44. Gurbuz O, Unalan F, Dikbas I. Comparison of the tranverse strength of six
acrylic denture resins. OHDMBSC 2010; 9(1): 21-4.
45. Rashid AA. Evaluation of the hardness of cold cured acrylic resin material by
processing at different temperature. Iraqi National J of Nursing Specialities
2011; 24(2): 44-51.
46. Ferracane JL. Materials in dentistry. 2nd ed. Philadelphia: Lippincott Williams & Wilkins, 2001: 262-73.
47. Naveen BH, Patil SB., Kumaraswamy K. A study on transverse strength of
different denture base resind repaired by various materials an methods: An in vitro study. J Dent Sci 2010; 1(1): 66-73.
48. Kostoulas I, Kavoura VT, Frangou MJ, Polyzois GL. Fracture force, deflection
and toughness of acrylic denture repairs involving glass fiber reinforcement.
Journal of Prosthodontics 2008; 17: 257-61.
49. Hilgenberg SP, Oreliana-Jimenez EE, Sepulveda-Navarro WF, et al. Evaluation
of surface physical properties of acrylic resins for provisional prosthesis. Mat
Res 2008; 11(3): 257-60.
50. Sugianitri N K. Ekstrak biji buah pinang (Areca Catechu L.) dapat menghambat
pertumbuhan koloni Candida albicans secara in vitro pada resin akrilik heat cured. Tesis. Denpasar: Fakultas Kedokteran Gigi Universitas Udayana, 2011.
51. Pereira-Cenci T, Del Bel Cury AA, Crielaard W, Ten Cate JM. Development of
Candida-associated denture stomatitis: New insights. J Appl Oral Sci 2008;
16(2): 86-94.
52. Jubhari EH, Putri NDU. Tingkat pemahaman terhadap instruksi cara
pembersihan gigi tiruan lepasan pada pasien Fakultas Kedokteran Gigi Universitas Hasanuddin. Jurnal PDGI 2014; 63(2): 54-7.
53. Anonymous. Aneka vinegar si anggur asam
54. Jhonston CS, Gaas CA. Vinegar: Medical uses and antiglycemic effect.
81
55. Animated-Teeth.com. Homemade denture cleansers. http://www.animated teeth.com/false-teeth.com/a-homemade-denture-cleanser.htm. 2015
56. Supranto, J. 2001. Teknik Sampling untuk Survei dan Eksperimen. Jakarta: PT Rineka Cipta, 2001.
39
BAB 3
METODE PENELITIAN
3.1 Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental laboratoris dengan menggunakan desain post test only control group.
3.2 Sampel dan Besar Sampel Penelitian
3.2.1 Sampel Penelitian
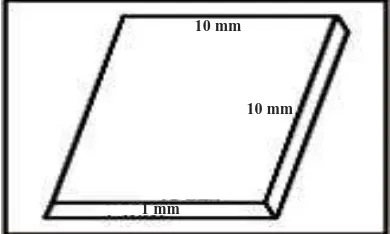
Sampel pada penelitian ini menggunakan RAPP dengan bentuk lempeng uji berukuran 10 mm x 10 mm x 1 mm sesuai dengan ANSI/ADA Standard No.12 tahun 2002 (Gambar 5).40
Gambar 5. Bentuk dan ukuran sampel
3.2.2 Besar Sampel Penelitian
Jumlah sampel penelitian ditentukan berdasarkan rumus Federer:56 (t - 1) (r - 1) ≥ 15
Keterangan:
t: jumlah perlakuan r: jumlah ulangan
Penelitian ini terdapat 4 kelompok sampel untuk setiap pengujian, maka t = 4 dan jumlah sampel (r) setiap kelompok dapat ditentukan sebagai berikut:
1 mm 10 mm
40
(4 - 1) (r - 1) ≥ 15 3(r - 1) ≥ 15 3r – 3 ≥ 15 3r ≥ 15 + 3
3r ≥ 18 r ≥ 18/3
r ≥ 6 r = 6
Jumlah sampel untuk masing-masing kelompok adalah 6, maka jumlah keseluruhan sampel sebanyak 24 buah lempeng uji.
3.3 Variabel Penelitian dan Definisi Operasional
3.3.1 Klasifikasi Variabel
3.3.1.1 Variabel Bebas
Resin akrilik polimerisasi panas yang direndam selama 8 jam masing-masing dalam:
- Vinegar apel dengan konsentrasi 5% - Vinegar apel dengan konsentrasi 6,23% - Sodium hipoklorit 1%
- NaCl 0,9%
3.3.1.2 Variabel Terikat
Jumlah Candida albicans
3.3.1.3 Variabel Terkendali
a. Ukuran sampel
41
f. Tekanan pengepresan g. Suhu dan waktu kuring
h. Suhu dan waktu perendaman sampel i. Suhu dan waktu autoklaf
j. Suhu dan waktu inkubator
k. Jumlah vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9%
l. NaCl 0,9% m. Alkohol 70%
n. Media pertumbuhan Candida albicans berupa Sabouraud’s Dextrose Agar (SDA) dan Sabouraud’s Dextrose Broth (SDB)
o. Phosphate Buffer Saline (PBS)
p. Saliva buatan
3.3.2 Definisi Operasional
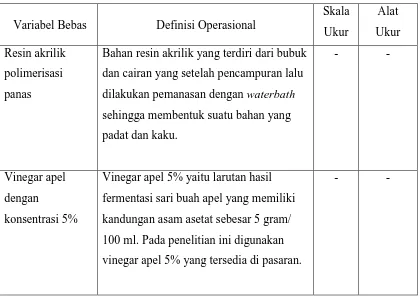
Tabel 2. Definisi Operasional Variabel Bebas
Variabel Bebas Definisi Operasional
Skala
Bahan resin akrilik yang terdiri dari bubuk dan cairan yang setelah pencampuran lalu dilakukan pemanasan dengan waterbath sehingga membentuk suatu bahan yang padat dan kaku.
- -
Vinegar apel dengan
konsentrasi 5%
Vinegar apel 5% yaitu larutan hasil fermentasi sari buah apel yang memiliki kandungan asam asetat sebesar 5 gram/ 100 ml. Pada penelitian ini digunakan vinegar apel 5% yang tersedia di pasaran.
42
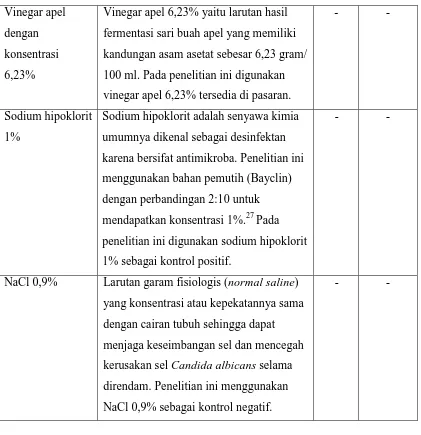
Vinegar apel dengan konsentrasi 6,23%
Vinegar apel 6,23% yaitu larutan hasil fermentasi sari buah apel yang memiliki kandungan asam asetat sebesar 6,23 gram/ 100 ml. Pada penelitian ini digunakan vinegar apel 6,23% tersedia di pasaran.
- -
Sodium hipoklorit 1%
Sodium hipoklorit adalah senyawa kimia umumnya dikenal sebagai desinfektan karena bersifat antimikroba. Penelitian ini menggunakan bahan pemutih (Bayclin) dengan perbandingan 2:10 untuk mendapatkan konsentrasi 1%.27 Pada penelitian ini digunakan sodium hipoklorit 1% sebagai kontrol positif.
- -
NaCl 0,9% Larutan garam fisiologis (normal saline) yang konsentrasi atau kepekatannya sama dengan cairan tubuh sehingga dapat menjaga keseimbangan sel dan mencegah kerusakan sel Candida albicans selama direndam. Penelitian ini menggunakan NaCl 0,9% sebagai kontrol negatif.
- -
Tabel 3. Definisi Operasional Variabel Terikat
Variabel Terikat Definisi Operasional
Skala
43
Tabel 4. Definisi Operasional Variabel Terkendali Variabel
Terkendali Definisi Operasional
Skala Ukur
Alat Ukur Ukuran sampel Ukuran RAPP yang digunakan untuk
penelitian yaitu 10 mm x 10 mm x 1 mm
- Kaliper
Jenis gips yang digunakan
Gips yang digunakan adalah gips tipe III (dental stone).
- -
Perbandingan adonan gips
Perbandingan jumlah gips dan air yang digunakan untuk menanam sampel dalam kuvet, yaitu:
Waktu yang digunakan untuk mengaduk gips dengan spatula plastik selama 15 detik dilanjutkan dengan vacuum mixer 30 detik hingga homogen.
- Stopwatch
Perbandingan adonan RAPP
Perbandingan jumlah polimer :
monomer RAPP yang digunakan pada penelitian ini yaitu 2 : 1.
- -
Tekanan pengepresan
Tekanan yang diperlukan untuk
mengepres kuvet yang telah berisi RAPP yaitu 1000 psi untuk pengepresan
pertama dan 2200 psi untuk pengepresan yang kedua.
- -
Suhu dan waktu kuring
Suhu dan waktu yang diperlukan untuk proses polimerisasi RAPP yaitu tahap pertama pada suhu 700C selama 90
44
menit dan dilanjutkan tahap kedua pada suhu 1000C selama 30 menit dalam
waterbath, lalu kuvet dibiarkan sampai
dingin pada suhu ruangan. Suhu dan waktu
perendaman sampel
Suhu dan waktu yang diperlukan untuk merendam RAPP dalam vinegar apel 5%, 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% yaitu pada suhu ruangan selama 8 jam.
- -
Suhu dan waktu autoklaf
Suhu dan waktu yang digunakan untuk mensterilkan alat yaitu pada suhu 1210C selama 1 jam.
- -
Suhu dan waktu inkubator
Suhu dan waktu yang digunakan untuk mengkultur Candida albicans yaitu 370C selama 24 jam untuk inkubasi awal dan 48 jam untuk inkubasi akhir.
- -
Jumlah vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% adalah jumlah (volume dalam ml) yang digunakan untuk merendam sampel yaitu 2 ml/sampel.
- Gelas ukur
45
Media
Sabouraud’s Dextrose Agar
(SDA)
Media untuk pertumbuhan Candida
albicans dalam bentuk agar, dengan
komposisi 40 gram/L dekstrosa dan 10 gram/L pepton.
Media untuk pertumbuhan Candida
albicans dalam bentuk cair, dengan
komposisi 20 gram/L dekstrosa dan 10 gram/L pepton.
- -
Phosphate Buffer Saline
(PBS)
Larutan isotonis yang terdiri dari NaCl, KCl, KH2PO4, dan Na2HPO4.7H2O serta
mempunyai pH=7,4. PBS digunakan untuk mempertahankan pH.
- -
Saliva buatan Saliva buatan yang diperoleh dengan campuran NaCl, KCN, NaHCO3, KCl,
H2NCONH2, Na2HPO4, dan akuades
serta mempunyai pH=7.
- -
3.4 Tempat dan Waktu Penelitian
3.4.1 Tempat Pembuatan Sampel
a. Unit Uji Laboratorium Dental FKG USU b. Departemen IMTKG FKG USU
3.4.2 Tempat Pengujian Sampel
Laboratorium Penelitian Mikrobiologi FMIPA USU
3.4.3 Waktu Penelitian
46
3.5 Alat dan Bahan Penelitian
3.5.1 Alat Penelitian
3.5.1.1 Alat yang Digunakan untuk Menghasilkan dan Merendam
Sampel
a. Model induk terbuat dari logam ukuran 10 mm x 10 mm x 1 mm b. Kuvet logam (Kanghul, Cina)
c. Mangkuk karet dan spatula (Tahran, Iran) d. Kuas
e. Vacuum mixer
f. Pot porselen (Cobra Dental, Indonesia) g. Spatula semen (Smic, Cina)
h. Lecron mass (Smic, Cina)
i. Pres hidrolik (OL 57 Manfredi, Italia) j. Waterbath model 1H (Filli Manfredi, Italia)
k. Vibrator (Filli Manfredi Pulsar-2, Italia)
l. Mikromotor dan straight handpiece (Strong, Korea) m. Bur fraser
n. Kertas abrasif nomor 500 dan 800 (Toho Sangyo, Jepang) o. Penggaris besi (Kenko, Indonesia)
3.5.1.2 Alat yang Digunakan untuk Menguji Sampel
a. Mikroskop (Olympus, Jepang) b. Gelas beaker 500 ml (Pyrex, Jepang) c. Blue tip mikropipet 1 ml
d. Mikropipet (Accumax Pro, India) e. Spuit 10 ml (Terumo, Filipina)
f. Tabung reaksi (Iwaki Pyrex, Indonesia) g. Rak tabung dan kertas saring
h. Hotplate magnetik stirer (Solid, Inggris)
47
j. Timbangan neraca (Okaus Dial-O-Gram, Cina) k. pH meter (Schott, Jerman)
l. Pinset (Benz, Jerman)
m. Inkubator (Fisher Scientific, Jerman) (Gambar 6)
Gambar 6. Inkubator (Fisher Scientific, Jerman)
n. Autoklaf (Vision Scientific, Korea) (Gambar 7)
Gambar 7. Autoklaf (Vision Scientific, Korea)
o. Vortex (Fisons, Inggris)
p. Colony counter (Stuart Scientific, UK) (Gambar 8)
48
q. Labu erlenmeyer (Iwaki Pyrex, Jepang) r. Cawan petri (Pyrex Cover, USA) s. Pisau cutter (Sailor Man, Indonesia) t. Botol selai kaca
u. Ose 2 buah dan hockey v. Bunsen
3.5.2 Bahan Penelitian
a. Resin akrilik polimerisasi panas (QC-20, Inggris) b. Vinegar apel 5% dan vinegar apel 6,23% (Gambar 9)
Gambar 9. Vinegar apel 5% dan vinegar apel 6,23%
c. Sodium hipoklorit 1% d. NaCl 0,9%
e. Akuades
f. Gips keras (Moldano, Cina) g. Cold mould seal (QC-20, Inggris)
h. Plastik selopan
i. Vaselin untuk bahan separasi j. Air
k. Suspensi Candida albicans
49
m. Sabouraud’s Dextrose Broth (SDB)
n. Phosphate Buffer Saline (PBS)
o. Spiritus p. Alkohol 70% q. Saliva buatan
r. Aluminium foil dan cling wrap (Total, Indonesia) s. Sarung tangan (Everglove, Malaysia)
t. Masker (Sensi Mask, Indonesia) u. Kapas (Bio Panca, Indonesia) v. Serbet
3.6 Cara Kerja
3.6.1 Pembuatan Sampel Penelitian
3.6.1.1 Penanaman Model Induk dalam Kuvet dan Pembuatan Mold
1. Seluruh bagian dalam kuvet bawah diolesi dengan vaselin, kemudian membuat adonan gips dengan perbandingan untuk satu kuvet bawah 250 gram gips : 150 ml air. Adonan diaduk dengan spatula selama 15 detik kemudian dilanjutkan dengan vacum mixer sampai tercampur homogen selama 30 detik dan adonan dimasukkan ke dalam kuvet bawah yang telah diletakkan di atas vibrator.
2. Model induk diolesi dengan vaselin, kemudian dibenamkan pada adonan gips di dalam kuvet bawah sampai permukaan model induk sama rata dengan gips, satu kuvet berisi 8 buah model induk. Setelah adonan gips agak mengeras, rapikan gips yang berlebihan dan diamkan sampai gips mengeras selama 60 menit.
3. Permukaan gips pada kuvet bawah diolesi dengan vaselin dan disatukan dengan kuvet atas lalu diisi adonan gips dengan perbandingan 200 gram gips : 100 ml air dan di atas vibrator. Setelah gips mengeras, kuvet dibuka, model induk diangkat, kemudian mold yang didapat disiram dengan air panas sampai bersih untuk membuang vaselin yang tersisa dan dibiarkan hingga kering.
50
3.6.1.2 Pengisian Resin Akrilik pada Mold
1. Polimer dan monomer dituangkan ke dalam pot porselen dengan perbandingan 2 gram polimer : 1 ml monomer sampai semua monomer terserap oleh polimer (sesuai petunjuk pabrik).
2. Adonan diaduk dengan spatula semen sampai monomer dan polimer tercampur baik dan homogen.
3. Adonan didiamkan kira-kira selama waktu yang dianjurkan pabrik, sampai mencapai tingkat dough stage dan tidak menempel pada dinding pot porselen.
4. Permukaan mold diolesi dengan bahan cold mould seal kemudian diisi dengan adonan resin akrilik.
5. Letakkan plastik selopan diantara kuvet atas dan bawah, lalu ditutup dan dipres dengan tekanan 1000 psi (70 kg/cm2) menggunakan pres hidrolik.
6. Kuvet atas dibuka, plastik selopan dilepas dan akrilik yang berlebihan dipotong menggunakan lecron mass.
7. Kuvet atas ditutup kembali lalu dilakukan pres akhir secara perlahan- lahan sampai tekanan 2200 psi (154 kg/cm2) dan dibiarkan pada suhu ruangan selama 30 menit.
8. Kemudian baut kuvet dipasang untuk mempertahankan kuvet atas dan bawah tetap rapat dan dibiarkan pada selama 15 menit.
3.6.1.3 Proses Kuring
1. Air diisikan ke dalam waterbath yang akan digunakan untuk proses kuring kemudian kuvet dimasukkan ke dalam waterbath.
2. Suhu dan waktu kuring diatur, pada tahap pertama dipertahankan 70oC selama 90 menit. (sesuai Japan industrial Standard)
3. Kemudian pada tahap kedua suhu kuring dinaikan menjadi 1000C dan dipertahankan selama 30 menit. (sesuai Japan industrial Standard)
51
3.6.1.4 Penyelesaian Akhir Sampel
Sampel dikeluarkan dari kuvet, akrilik yang berlebih dibuang dan dirapikan untuk menghilangkan bagian yang tajam dengan menggunakan bur frasser serta dilanjutkan menghaluskan seluruh permukaan sampel RAPP dengan menggunakan kertas abrasif nomor 500 dan 800.
3.6.2 Pembuatan Media Pertumbuhan Candida albicans
3.6.2.1 Pembuatan Sabouraud’s Dextrose Agar (SDA)
1. Bahan pembuatan media SDA yang diperlukan untuk 1 liter air adalah 65 gram, sehingga untuk 460 ml air diperlukan 30 gram bahan media SDA (sesuai kebutuhan) dan ditimbang dengan menggunakan timbangan digital dan analitik.
2. Masukkan bahan media SDA pada labu erlenmeyer, kemudian ditambahkan 500 ml akuades sebagai pelarut dan panaskan bahan di atas hotplate magnetik stirer sehingga semua bahan terlarut sempurna yang ditandai dengan larutan akan mendidih dan terlihat lebih bening kekuningan (Gambar 10).
Gambar 10. Pembuatan SDA
3. Tutup rapat labu erlenmeyer dengan menggunakan kapas, kemudian melapisinya dengan aluminium foil dan cling wrap.
4. Selanjutnya, sterilkan media SDA dengan autoklaf pada tekanan 2 atm hingga mencapai suhu 1210C selama 1 jam.
52
3.6.2.2 Pembuatan Sabouraud’s Dextrose Broth (SDB)
1. Bahan pembuatan media SDB yang diperlukan untuk 1 liter air adalah 20 gram dekstrosa ditambah 10 gram pepton, sehingga untuk 300 ml air diperlukan 3 gram pepton ditambah glukosa 6 gram (sesuai kebutuhan) dan ditimbang dengan menggunakan timbangan digital dan analitik.
2. Masukkan bahan media SDB pada labu erlenmeyer, kemudian larutkan 250 ml akuades tanpa perlu dipanaskan. Aduk dengan spatula sampai semua bahan terlarut sempurna hingga terlihat bening kekuningan.
3. Tutup rapat labu erlenmeyer dengan menggunakan kapas, kemudian melapisinya dengan aluminium foil dan cling wrap. Selanjutnya, sterilkan media dengan autoklaf pada tekanan 2 atm hingga mencapai suhu 1210C selama 1 jam.
4. Memanaskan media kembali, lalu menuangkannya pada tabung reaksi secara aseptik masing-masing 10 ml hingga merata.
3.6.3 Pembuatan Phosphate Buffer Saline (PBS)
1. Phosphate Buffer Saline (PBS) dapat dibuat dari NaCl sebanyak 3,2 gram, KCl sebanyak 0,08 gram, KH2PO4 sebanyak 0,96 gram dan Na2HPO4 sebanyak 1,58
gram yang ditimbang dengan menggunakan timbangan digital dan analitik.
2. Bahan-bahan tersebut dilarutkan dalam 400 ml akuades dan dihomogenkan dengan menggunakan magnetik stirer di dalam labu erlenmeyer. Atur pH larutan menggunakan pH meter dengan menambahkan larutan HCl 1 N hingga mencapai pH 7,4. Kemudian pindahkan larutan Phosphate Buffer Saline (PBS) tersebut ke dalam gelas beaker 500 ml dan tambahkan kembali akuades sampai tanda batas.34
3.6.4 Pembuatan Suspensi Candida albicans
53
3.6.5 Perendaman Sampel
3.6.5.1 Perendaman Sampel dalam Akuades dan Saliva Buatan
Sampel RAPP dicuci dengan air mengalir lalu disimpan di dalam botol selai kaca dan direndam dalam akuades pada suhu 370C selama 48 jam sebelum diberikan perlakuan agar sampel menjadi jenuh.27,28 Kemudian sampel disterilisasi di dalam autoklaf pada suhu 1210C selama 1 jam. Selanjutnya, sampel dimasukkan ke dalam gelas beaker yang berisi saliva buatan dan direndam selama 1 jam, lalu dibilas dengan Phosphate Buffer Saline (PBS) sebanyak dua kali.19,41
3.6.5.2 Perendaman Sampel dalam Suspensi Candida albicans
Sampel RAPP dikontaminasi dengan cara dimasukkan ke dalam labu erlenmeyer yang berisi suspensi Candida albicans, kemudian diinkubasi awal pada
suhu 370C selama 24 jam.
3.6.5.3 Perendaman Sampel dalam Vinegar Apel 5%, Vinegar Apel
6,23%, Sodium Hipoklorit 1%, dan NaCl 0,9%
Setelah 24 jam diinkubasi, selanjutnya tiap satu sampel RAPP dimasukkan dan direndam selama 8 jam di dalam satu tabung reaksi pada masing-masing kelompok sebanyak 2 ml per sampel (Gambar 11).
Pada penelitian ini sampel dibagi menjadi 4 kelompok:
a. Kelompok sampel yang akan direndam dalam vinegar apel konsentrasi 5% selama 8 jam (kelompok A).
b. Kelompok sampel yang akan direndam dalam vinegar apel konsentrasi 6,23% selama 8 jam (kelompok B).
c. Kelompok sampel yang akan direndam dalam sodium hipoklorit 1% selama 8 jam (kelompok C).
54
(A) (B) (C) (D)
Gambar 11. Kelompok sampel (A). Perendaman dalam vinegar apel 5%, (B). Perendaman dalam vinegar apel 6,23%, (C). Perendaman dalam sodium hipoklorit 1%, (D). Perendaman dalam NaCl 0,9%.
Setelah 8 jam perendaman maka sampel RAPP dapat dikeluarkan dari tabung reaksi, dibilas kembali dengan Phosphate Buffer Saline (PBS) sebanyak dua kali, dan dibiarkan sampai kering, lalu dilakukan penentuan jumlah Candida albicans.
3.6.6 Penentuan Jumlah Candida albicans
1. Sterilkan terlebih dahulu meja kerja, tangan peneliti dan udara di daerah sekitar kerja dengan menggunakan alkohol 70% dan sterilkan pinset dengan menggunakan bunsen, lalu diamkan sampai dingin.
2. Sampel RAPP dimasukkan ke dalam tabung reaksi yang berisi 10 ml
Sabouraud’s Dextrose Broth (SDB), kemudian digetarkan dengan alat getar vortex
selama 30 detik untuk melepaskan Candida albicans yang melekat pada lempeng uji (Gambar 12).
Gambar 12. Tabung reaksi SDB digetarkan alat vortex
55
6. Pada saat pembenihan suspensi Candida albicans yaitu ketika membuka tutup tabung reaksi atau cawan petri harus dilakukan dekat dengan bunsen sehingga mencegah mikroorganisme lain yang tidak diperlukan masuk ke dalam cawan petri.
7. Tepi cawan petri dipanaskan dengan gerakan melingkar di atas bunsen. Setelah itu, cawan petri dilapisi dengan cling wrap dan lakukan inkubasi akhir pada suhu 370C selama 48 jam.
56
3.7 Kerangka Operasional Penelitian
Tiap satu sampel RAPP dimasukkan dan direndam selama 8 jam di dalam satu tabung reaksi pada masing-masing kelompok
Sampel Resin Akrilik Polimerisasi Panas (RAPP) sebanyak 24 buah lempeng uji
Sampel RAPP direndam dalam akuades pada suhu 370C selama 48 jam
Sampel RAPP disterilisasi dalam autoklaf Penyelesaian akhir sampel
Sampel RAPP dikontaminasi dengan Candida albicans, kemudian diinkubasi awal pada suhu 370C selama 24 jam
Penanaman model induk dalam kuvet dan pembuatan mold
Pengisian resin akrilik pada mold
Proses kuring
Pembuatan Media Pertumbuhan Candida albicans Sabouraud’s Dextrose Agar (SDA) dan Sabouraud’s Dextrose Broth (SDB)
Pembuatan Phosphate Buffer Saline (PBS)
Pembuatan suspensi Candida albicans
57
Hasil
Sampel RAPP dimasukkan ke dalam tabung reaksi yang berisi 10 ml Sabouraud’s
Dextrose Broth (SDB), kemudian digetarkan dengan vortex
Sabouraud’s Dextrose Broth (SDB) dibenihkan pada Sabouraud’s Dextrose Agar
(SDA), lalu diinkubasi akhir pada suhu 370C selama 48 jam
Sampel RAPP dibilas kembali dengan Phosphate Buffer Saline (PBS) dua kali
Penghitungan jumlah Candida albicans dengan menggunakan colony counter dalam satuan CFU/ml
Analisis data Pengumpulan data Vinegar Apel
5% (n = 6)
Vinegar Apel
6,23% (n = 6)
NaCl 0,9% (n = 6)
Sodium Hipoklorit
58
3.8 Analisis Data
Analisis data yang digunakan pada penelitian ini adalah:
1. Uji Univarian untuk mengetahui nilai rata-rata dan standar deviasi setiap kelompok pada basis gigi tiruan RAPP setelah dilakukan perendaman dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% selama 8 jam.
2. Uji Kruskal-Wallis untuk mengetahui pengaruh perendaman basis gigi tiruan RAPP pada kelompok yang direndam dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% selama 8 jam terhadap jumlah Candida
albicans, karena hasil tes Homogeneity of Variances menunjukkan distribusi data
tidak normal (p<0,05) dan varians data tidak sama.
59
BAB 4
HASIL PENELITIAN
4.1 Jumlah Candida albicans Setelah Dilakukan Perendaman Basis Gigi
Tiruan RAPP dalam Vinegar Apel 5%, Vinegar Apel 6,23%, Sodium Hipoklorit
1%, dan NaCl 0,9% Selama 8 Jam
Penghitungan jumlah Candida albicans dilakukan setelah perendaman basis gigi tiruan RAPP selama 8 jam dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% (sebagai kontrol negatif) yaitu dilakukan dengan cara setiap sampel RAPP dimasukkan ke dalam tabung reaksi yang berisi 10 ml
Sabouraud’s Dextrose Broth (SDB) dan kemudian digetarkan dengan vortex, lalu
diambil 0,1 ml suspensi Candida albicans yang berasal dari sampel RAPP pada
Sabouraud’s Dextrose Broth (SDB) dan dibenihkan pada Sabouraud’s Dextrose Agar
(SDA), selanjutnya diinkubasi akhir pada suhu 370C selama 48 jam. Jumlah Candida
albicans dihitung dengan menggunakan colony counter dalam satuan CFU/ml
(Gambar 13). Data yang diperoleh berupa nilai rerata dan standar deviasi yang dihitung menggunakan uji univarian.
Gambar 13. Koloni Candida albicans dalam Sabouraud’s Dextrose Agar (SDA) pada masing-masing kelompok yaitu vinegar apel 5% (A), vinegar apel 6,23% (B), sodium hipoklorit 1% (C), dan NaCl 0,9% (D)
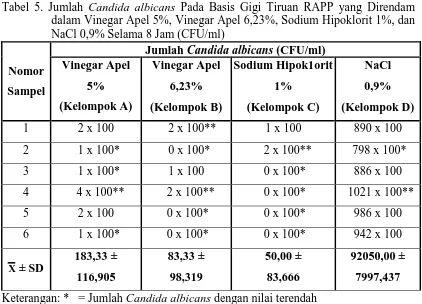
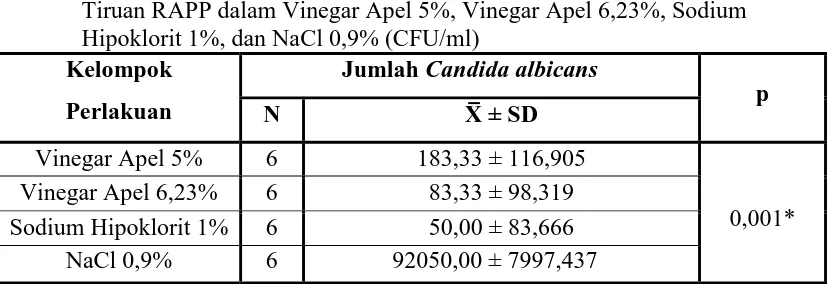
Tabel 5 menunjukkan jumlah Candida albicans pada basis gigi tiruan RAPP yang direndam dalam vinegar apel 5% nilai terendah adalah 1 x 100 CFU/ml dan nilai tertinggi adalah 4 x 100 CFU/ml, serta nilai rerata dan standar deviasi adalah 183,33 ± 116,905. Sedangkan, jumlah Candida albicans pada basis gigi tiruan RAPP
60
yang direndam dalam vinegar apel 6,23% nilai terendah adalah 0 x 100 CFU/ml dan nilai tertinggi adalah 2 x 100 CFU/ml, serta nilai rerata dan standar deviasi adalah 83,33 ± 98,319 (tabel 5).
Pada basis gigi tiruan RAPP yang direndam dalam sodium hipoklorit 1% menunjukkan jumlah Candida albicans dengan nilai yang terendah adalah 0 x 100 CFU/ml dan nilai tertinggi adalah 2 x 100 CFU/ml, serta nilai rerata dan standar deviasi adalah 50,00 ± 83,666. Pada basis gigi tiruan RAPP yang direndam dalam NaCl 0,9% sebagai kelompok kontrol negatif jumlah Candida albicans dengan nilai terendah adalah 798 x 100 CFU/ml dan nilai tertinggi adalah 1021 x 100 CFU/ml, serta nilai rerata dan standar deviasi adalah 92050,00 ± 7997,437 (tabel 5).
Tabel 5. Jumlah Candida albicans Pada Basis Gigi Tiruan RAPP yang Direndam dalam Vinegar Apel 5%, Vinegar Apel 6,23%, Sodium Hipoklorit 1%, dan NaCl 0,9% Selama 8 Jam (CFU/ml)
Nomor
Sampel
Jumlah Candida albicans (CFU/ml) Vinegar Apel
61
4.2 Pengaruh Perendaman Basis Gigi Tiruan RAPP dalam Vinegar Apel
5%, Vinegar Apel 6,23%, Sodium Hipoklorit 1%, dan NaCl 0,9% Selama 8 Jam
terhadap Jumlah Candida albicans
Pengaruh perendaman basis gigi tiruan RAPP dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% selama 8 jam terhadap jumlah
Candida albicans dapat dilihat dari nilai rerata, standar deviasi, dan derajat
kemaknaan jumlah Candida albicans setelah dilakukan perendaman pada seluruh kelompok perlakuan dan kontrol. Tabel 6 menunjukkan nilai rerata dan standar deviasi kelompok A direndam dalam vinegar apel 5% adalah 183,33 ± 116,905 dan kelompok B direndam dalam vinegar apel 6,23% adalah 83,33 ± 98,319. Nilai rerata dan standar deviasi kelompok C direndam dalam sodium hipoklorit 1% adalah 50,00 ± 83,666 dan kelompok direndam D dalam NaCl 0,9% adalah 92050,00 ± 7997,437. Untuk menentukan ada atau tidaknya pengaruh perendaman basis gigi tiruan RAPP dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% selama 8 jam terhadap jumlah Candida albicans, maka dilakukan uji statistik ANOVA satu arah dan hasil tes Homogeneity of Variances menunjukkan distribusi data tidak normal dan nilai data varian tidak sama sehingga untuk memastikan nilai p dilakukan uji Kruskal-Wallis. Hasil uji statistik diperoleh tingkat signifikansi p = 0,001 (p <0,05) menunjukkan bahwa ada pengaruh perendaman basis gigi tiruan RAPP dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% selama 8 jam terhadap jumlah Candida albicans (tabel 6).
62
4.3 Perbedaan Pengaruh Perendaman Basis Gigi Tiruan RAPP dalam
Vinegar Apel 5%, Vinegar Apel 6,23%, dan Sodium Hipoklorit Selama 8 Jam
terhadap Jumlah Candida albicans
Untuk menentukan apakah ada perbedaan pengaruh perendaman basis gigi tiruan RAPP dalam kelompok vinegar apel 5%, vinegar apel 6,23%, dan sodium hipoklorit 1% terhadap jumlah Candida albicans dilakukan uji Mann-Whitney.
Pada tabel 7 menunjukkan bahwa tidak terdapat perbedaan yang signifikan pada jumlah Candida albicans setelah dilakukan perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dibandingkan dengan vinegar apel 6,23% selama 8 jam dengan nilai rata-rata perbedaan sebesar 100,000 dan diperoleh p = 0,155.
Nilai rata-rata perbedaan jumlah Candida albicans setelah dilakukan perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dibandingkan dengan sodium hipoklorit 1% adalah sebesar 133,333 dan diperoleh p = 0,037 yang menunjukkan terdapat perbedaan pengaruh yang signifikan pada jumlah Candida
albicans setelah dilakukan perendaman basis gigi tiruan RAPP dalam vinegar apel
5% dibandingkan dengan sodium hipoklorit 1% selama 8 jam (tabel 7).
Terdapat perbedaan yang signifikan pada jumlah Candida albicans setelah dilakukan perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dibandingkan dengan NaCl 0,9% selama 8 jam dengan nilai rata-rata perbedaan sebesar 91866,667 dan diperoleh p = 0,004 (tabel 7).
Nilai rata-rata perbedaan jumlah Candida albicans setelah dilakukan perendaman basis gigi tiruan RAPP dalam vinegar apel 6,23% dibandingkan dengan sodium hipoklorit 1% adalah sebesar 33,333 dan diperoleh p = 0,527 yang menunjukkan bahwa tidak terdapat perbedaan pengaruh yang signifikan pada jumlah
Candida albicans setelah dilakukan perendaman basis gigi tiruan RAPP dalam
vinegar apel 6,23% dibandingkan dengan sodium hipoklorit 1% selama 8 jam. Menurut uji statistik terdapat perbedaan pengaruh yang signifikan pada jumlah
Candida albicans setelah dilakukan perendaman basis gigi tiruan RAPP selama 8 jam
63
Hal ini berarti menunjukkan bahwa tidak terdapat perbedaan pengaruh yang signifikan setelah dilakukan perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dibandingkan dengan vinegar apel 6,23% selama 8 jam terhadap jumlah Candida
albicans dan terdapat perbedaan yang signifikan antara pengaruh perendaman basis
gigi tiruan RAPP dalam vinegar apel 5% dibandingkan dengan sodium hipoklorit 1% selama 8 jam terhadap jumlah Candida albicans dan terdapat perbedaan pengaruh yang signifikan setelah dilakukan perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dibandingkan dengan NaCl 0,9% selama 8 jam terhadap jumlah Candida
albicans.
64
Tabel 7. Perbedaan Pengaruh Perendaman Basis Gigi Tiruan RAPP dalam Vinegar Apel 5%, Vinegar Apel 6,23%, dan Sodium Hipoklorit 1% Selama 8 Jam terhadap Jumlah Candida albicans
Perlakuan
Rata-Rata
Perbedaan p
Vinegar apel 5% Vinegar apel 6,23%
Sodium Hipoklorit 1%
Vinegar apel 6,23% Vinegar apel 5%
Sodium Hipoklorit 1%
Sodium Hipoklorit 1% Vinegar apel 5%
Vinegar apel 6,23%
65
BAB 5
PEMBAHASAN
Rancangan penelitian yang digunakan pada penelitian ini adalah eksperimental laboratoris dengan menggunakan desain post test only control group. Penelitian eksperimental merupakan penelitian yang digunakan untuk mengungkapkan pengaruh yang timbul sebagai akibat adanya pemberian perlakuan tertentu antara variabel bebas yaitu basis gigi tiruan RAPP yang direndam dalam vinegar apel 5% dan vinegar apel 6,23% kemudian dibandingkan dengan sodium hipoklorit 1% sebagai kontrol positif dan NaCl 0,9% sebagai kontrol negatif dengan variabel terikat yaitu jumlah Candida albicans.
5.1 Jumlah Candida albicans Setelah Dilakukan Perendaman Basis Gigi
Tiruan RAPP dalam Vinegar Apel 5%, Vinegar Apel 6,23%, Sodium Hipoklorit
1%, dan NaCl 0,9% Selama 8 Jam
Jumlah Candida albicans dari kelompok A, kelompok B, kelompok C, dan kelompok D didapatkan dengan cara melakukan penghitungan koloni pada basis gigi tiruan RAPP yang direndam dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% selama 8 jam dengan menggunakan alat colony
counter dalam satuan CFU/ml.
66
albicans yang tersisa pada setiap kelompok disebabkan karena kemampuan yang
berbeda antara vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%, dan NaCl 0,9% terhadap penurunan jumlah Candida albicans, hal ini kemungkinan dapat disebabkan pada saat proses penyelesaian akhir lempeng uji RAPP sebagai sampel yaitu adanya perbedaan kualitas lempeng uji RAPP karena permukaan RAPP yang dihaluskan hanya dengan kertas abrasif secara manual sehingga menyebabkan permukaan sampel RAPP tidak mendapatkan penekanan yang sama rata. Permukaan sampel RAPP yang kasar karena tidak dipoles merupakan tempat retensi bagi
Candida albicans. Perbedaan nilai tersebut kemungkinan juga dapat disebabkan
karena cara menggetarkan tabung reaksi Sabouraud’s Dextrose Broth untuk melepaskan Candida albicans yang melekat pada sampel RAPP dengan alat getar
vortex yang tidak sama untuk setiap sampel sehingga dapat menyebabkan Candida albicans yang terlepas dari sampel juga menjadi tidak sama rata. Perbedaan jumlah Candida albicans pada setiap sampel kemungkinan juga dapat disebabkan pada saat
pembenihan suspensi Candida albicans dari media Sabouraud’s Dextrose Broth ke
Sabouraud’s Dextrose Agar yang cairan tersebut tidak diteteskan semuanya dan
penyebaran suspensi Candida albicans ke seluruh permukaan media tidak sama pada setiap sampel sehingga kemungkinan dapat menyebabkan Candida albicans yang tumbuh pada setiap sampel juga menjadi tidak sama rata.
5.2 Pengaruh Perendaman Basis Gigi Tiruan RAPP dalam Vinegar Apel
5%, Vinegar Apel 6,23%, Sodium Hipoklorit 1%, dan NaCl 0,9% Selama 8 Jam
terhadap Jumlah Candida albicans
Pada tabel 6 menunjukkan nilai rerata dan standar deviasi kelompok yang direndam dalam vinegar apel 5% adalah 183,33 ± 116,905 dan kelompok yang direndam dalam vinegar apel 6,23% adalah 83,33 ± 98,319. Nilai rerata dan standar deviasi kelompok C direndam dalam sodium hipoklorit 1% adalah 50,00 ± 83,666 dan kelompok D direndam dalam NaCl 0,9% adalah 92050,00 ± 7997,437. Jumlah
Candida albicans pada kelompok vinegar apel 5%, vinegar apel 6,23%, sodium
67
terlalu tinggi dan ada data yang terlalu rendah dari rata-rata, dapat dilihat dari hasil tes Homogeneity of Variances, menunjukkan distribusi data tidak normal dan nilai data varian yang tidak sama, sehingga untuk memastikan nilai p dilakukan uji Kruskal-Wallis. Dari hasil analisis Kruskal-Wallis terbukti bahwa jumlah Candida
albicans pada kelompok vinegar apel 5%, vinegar apel 6,23%, sodium hipoklorit 1%,
dan NaCl 0,9% memiliki perbedaan secara signifikan (p < 0,05).
Hasil uji statistik dari penelitian ini menunjukkan bahwa ada pengaruh perendaman basis gigi tiruan RAPP dalam vinegar apel selama 8 jam terhadap jumlah
Candida albicans. Sedangkan pada kelompok kontrol tidak ada pengaruh
perendaman basis gigi tiruan RAPP dalam NaCl 0,9% selama 8 jam terhadap jumlah
Candida albicans. Hal ini disebabkan karena adanya kandungan vinegar apel seperti
asam asetat, asam malat, senyawa polifenol yang berasal dari buah apel yaitu tanin dan flavonoid yang mempunyai efek menekan pertumbuhan jamur dan bakteri sehingga vinegar apel bisa diharapkan sebagai antiseptik di dalam rongga mulut yang dapat menyebabkan penurunan terhadap jumlah Candida albicans pada basis gigi tiruan RAPP. Menurut penelitian Ostrosky EA, dkk. (2008) bahwa kandungan asam asetat dalam vinegar akan menunjukkan mekanisme kerja yang dapat menyebabkan potensi hidrogen menjadi berkurang untuk memfasilitasi terjadinya difusi asam, sehingga asam asetat dapat melintasi membran plasma dari sel jamur dan menyebabkan terjadinya apoptosis sel Candida albicans.16,38 Sementara, menurut Suskovic Hs, dkk. (2010) terjadi pengaruh penghambatan oleh asam asetat terhadap enzim 14α-lanosterol-demethylase yang terlibat dalam pembentukan ergosterol pada Candida albicans yang sangat penting untuk mempertahankan integritas membran
68
tanin dan flavonoid yang besarnya kandungan pada buah apel dipengaruhi oleh beberapa faktor seperti varietas, pemanenan, penyimpanan, dan pengolahan buah apel. Tanin merupakan kumpulan poli hidroksil senyawa polifenol yang bersifat koloid dan merupakan asam lemah. Tanin dapat berperan sebagai bakteriostatik dan fungistatik. Menurut American Dental Association (ADA) 1998 bahwa tanin memiliki kandungan zat yang dapat mencegah kerusakan gigi dan penyakit gingiva yang disebabkan oleh tumpukan plak.33 Sifat antifungi tanin diketahui dari kemampuannya dalam mengganggu struktur membran sel dan menghambat proses reproduksi vegetatif Candida albicans. Menurut Ratnasari A, dkk. (2013) bahwa tanin dapat menghambat biosintesis ergosterol yang merupakan sterol utama dalam membran sel Candida. Sterol ini bertanggung jawab atas fluiditas dan permeabilitas membran, sehingga jika sterol tidak terbentuk maka membran sel Candida akan terganggu fungsinya.40 Flavonoid juga termasuk ke dalam senyawa polifenol. Konsentrasi polifenol berbeda antara kulit dan daging buah apel.33 Pada kulit apel terdapat kandungan flavonoid turunan senyawa polifenol seperti kuersetin,
phloridzin, asam klorogenik dan katekin. Daging buah apel juga mengandung
senyawa-senyawa tersebut, tetapi dalam jumlah yang lebih kecil dibandingkan pada kulit buah apel.Katekin merupakan golongan flavonoid yang memiliki peran sebagai agen antifungi. Studi in vivo dan in vitro menunjukkan bahwa flavonoid memiliki aktivitas antimikroba yaitu dengan mendenaturasi ikatan protein sehingga membran sel Candida albicans menjadi lisis. Akibatnya sel tersebut masuk ke dalam inti sel sehingga jamur tidak berkembang.31,36,40,41
Pada tabel 6 menunjukkan nilai rerata dan dan standar deviasi dari masing-masing kelompok. Terlihat bahwa kelompok sodium hipoklorit 1% memiliki jumlah
Candida albicans yang lebih sedikit daripada kelompok kontrol. Dari hasil analisis
69
senyawa toksik yaitu N-chloro. Larutan ini merupakan desinfektan derajat tingkat tinggi karena sangat aktif pada semua bakteri, virus, jamur, parasit, dan beberapa spora.Saat dilakukan perendaman basis gigi tiruan RAPP dalam sodium hipoklorit 1%, maka larutan tersebut akan membentuk asam hipoklorit yang akan melepaskan klorin. Klorin yang dilepaskan akan menempel pada lipoprotein dinding sel jamur yang terdapat pada permukaan basis gigi tiruan RAPP tersebut dan kemudian akan membentuk senyawa toksik yaitu N-chloro yang dapat menggangu pembelahan sel, menghentikan regenerasi sel dan mengakibatkan terjadinya penurunan jumlah
Candida albicans.27 Hasil penelitian ini sesuai dengan penelitian yang dilakukan oleh Jafari AA, dkk. (2012) yang melaporkan mengenai mekanisme kerja dari sodium hipokorit 1% di dalam sebuah larutan yaitu akan membentuk asam hipoklorit (HOCl) dan oxychloride (OCl) yang akan mengoksidasi kelompok sulfhidril (-SH) dari asam amino dan protein untuk menghasilkan bentuk disulfida (SS) yang efektif menghilangkan 100% Candida albicans pada penelitian ini.20,27
5.3 Perbedaan Pengaruh antara Perendaman Basis Gigi Tiruan RAPP
dalam Vinegar Apel 5%, Vinegar Apel 6,23%, dan Sodium Hipoklorit 1%
Selama 8 Jam terhadap Jumlah Candida albicans
70
yang direndam dalam vinegar apel 6,23% dengan NaCl 0,9% sebesar 91966,667 (p = 0,004). Sedangkan, nilai rata-rata perbedaan jumlah Candida albicans antara kelompok sodium hipoklorit 1% dengan NaCl 0,9% sebesar 92000,000 (p = 0,003).
Dari hasil uji Mann-Whitney, didapatkan bahwa pada tingkat signifikansi 5% rata-rata perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dan vinegar apel 6,23% tidak ada perbedaan secara signifikan (p > 0,05) (tabel 7). Hal ini disebabkan karena adanya kandungan vinegar apel seperti asam asetat, asam malat, senyawa polifenol yang berasal dari buah apel yaitu tanin dan flavonoid yang mempunyai efek menekan pertumbuhan jamur dan bakteri sehingga vinegar apel bisa diharapkan sebagai antiseptik di dalam rongga mulut yang dapat menyebabkan penurunan terhadap jumlah Candida albicans pada basis gigi tiruan RAPP. Penelitian Phillips AJ, dkk. (2006) menunjukkan bahwa vinegar yang memiliki kandungan asam asetat dengan dosis rendah dapat berefek fungisida yaitu menginduksi apoptosis dan menyebabkan kematian sel Candida albicans.17,20 Azuma, dkk. (2006) melakukan analisis terhadap perbedaan konsentrasi pada beberapa jenis vinegar dan diamati bahwa vinegar dengan konsentrasi yang rendah yaitu 3% sampai 6% efektif dalam membunuh Candida albicans.22 Menurut hasil penelitian Kumar MN, dkk. (2012) terdapat perbedaan yang signifikan antara vinegar 4% dan vinegar murni yang dibandingkan dengan kelompok kontrol dalam membunuh Candida albicans dan vinegar 4% lebih efektif daripada vinegar murni. Hasil penelitian Mota ACLG, dkk. (2015) melaporkan bahwa vinegar apel 4% menunjukan efek fungisida terhadap
Candida spp. karena memiliki kandungan asam malat yang bersifat bakterisida dan
fungisida. Penelitian ini membandingkan vinegar apel 4% dengan agen antijamur yaitu nistatin. Oleh karena itu, vinegar apel dapat menjadi pilihan bahan pembersih gigi tiruan sebagai salah satu dari perawatan alternatif pada pasien denture
71
yang bersifat koloid dan merupakan asam lemah. Tanin dapat berperan sebagai bakteriostatik dan fungistatik. Menurut American Dental Association (ADA) 1998 bahwa tanin memiliki kandungan zat yang dapat mencegah kerusakan gigi dan penyakit gingiva yang disebabkan oleh tumpukan plak.33 Sifat antifungi tanin diketahui dari kemampuannya dalam mengganggu struktur membran sel dan menghambat proses reproduksi vegetatif Candida albicans. Menurut Ratnasari A, dkk. (2013) bahwa tanin dapat menghambat biosintesis ergosterol yang merupakan sterol utama dalam membran sel Candida. Sterol ini bertanggung jawab atas fluiditas dan permeabilitas membran, sehingga jika sterol tidak terbentuk maka membran sel
Candida akan terganggu fungsinya.40 Flavonoid juga termasuk ke dalam senyawa polifenol. Konsentrasi polifenol berbeda antara kulit dan daging buah apel.33 Pada kulit apel terdapat kandungan flavonoid turunan senyawa polifenol seperti kuersetin,
phloridzin, asam klorogenik dan katekin. Daging buah apel juga mengandung
senyawa-senyawa tersebut, tetapi dalam jumlah yang lebih kecil dibandingkan pada kulit buah apel.Katekin merupakan golongan flavonoid yang memiliki peran sebagai agen antifungi. Studi in vivo dan in vitro menunjukkan bahwa flavonoid memiliki aktivitas antimikroba yaitu dengan mendenaturasi ikatan protein sehingga membran sel Candida albicans menjadi lisis. Akibatnya sel tersebut masuk ke dalam inti sel sehingga jamur tidak berkembang.31,36,40,41 Hasil ini juga didukung oleh da Silva PMB, dkk. (2010) dalam penelitiannya yang berjudul analisis secara mikroskopis terhadap biofilm Candida albicans pada permukaan resin akrilik polimerisasi panas setelah perendaman dalam klorheksidin glukonat dan sodium hipoklorit. Hasilnya menunjukkan bahwa sodium hipoklorit 1% dan 2% lebih efektif menghilangkan seluruh biofilm Candida albicans pada permukaan RAPP jika dibandingkan dengan klorheksidin glukonat 4%.32
72
dalam vinegar apel 6,23% dan sodium hipoklorit 1% selama 8 jam terhadap jumlah
Candida albicans tidak terdapat perbedaan secara signifikan (p > 0,05) (tabel 7).
Faktor yang mungkin mempengaruhi efektifitas penurunan jumlah Candida
albicans pada perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dengan
vinegar apel 6,23% yang sedikit lebih efektif adalah karena adanya perbedaan tingkat konsentrasi pada kandungan vinegar apel seperti asam asetat, asam malat, dan senyawa polifenol yang berasal dari vinegar apel tersebut sehingga mempengaruhi kemampuan cara kerja dalam membunuh Candida albicans secara keseluruhan.
73
menghasilkan bau dan rasa yang tidak sedap, dapat meninggalkan stain, menyebabkan perubahan warna pada basis gigi tiruan, dan dapat merusak permukaan basis gigi tiruan, sedangkan efek tersebut tidak dijumpai pada penggunaan vinegar apel 6,23% sehingga lebih baik digunakan sebagai bahan pembersih gigitiruan alternatif ditinjau dalam penurunan jumlah Candida albicans pada permukaan basis gigi tiruan RAPP.
Kelemahan dalam penelitian ini adalah pada saat proses pembuatan lempeng uji RAPP sebagai sampel yaitu kemungkinan adanya perbedaan kualitas lempeng uji RAPP karena permukaan RAPP yang tidak dipoles. Permukaan RAPP yang tidak dipoles merupakan tempat retensi bagi Candida albicans. Permukaan RAPP dipoles hanya dengan kertas pasir secara manual sehingga menyebabkan permukaan RAPP tidak mendapatkan penekanan yang sama rata sehingga menjadi faktor penyebab tingkat kehalusan pada seluruh permukaan RAPP tidak sama. Selain itu, dalam penelitian ini jumlah Candida albicans awal yang hanya berpedoman pada jumlah
Candida albicans pada kelompok kontrol, sehingga jumlah Candida albicans awal
pada masing-masing sampel tidak diketahui secara akurat, dan ini merupakan kekurangan dari penelitian dan juga karena adanya kecepatan vortex yang berbeda pada setiap Saboraud’s Dextro Broth menyebabkan kemungkinan Candida albicans yang lengket pada lempeng uji RAPP tidak lepas dengan sempurna sehingga jumlah
Candida albicans pada sampel tersebut akan berkurang. Perbedaan jumlah Candida albicans pada setiap sampel kemungkinan juga dapat disebabkan pada saat
pembenihan suspensi Candida albicans dari media SDB ke SDA yang kemungkinan cairan tersebut tidak diteteskan keseluruhan dan saat penyebaran suspensi Candida
albicans ke seluruh permukaan media tidak sama pada setiap sampel sehingga
kemungkinan dapat menyebabkan Candida albicans yang tumbuh pada setiap sampel RAPP tersebut akan berkurang dan tidak merata serta dapat kesulitan pada saat melakukan penghitungan jumlah koloni Candida albicans dengan menggunakan
74
BAB 6
KESIMPULAN DAN SARAN
6.1 Kesimpulan
Berdasarkan hasil penelitian eksperimental laboratoris yang telah dilakukan dapat disimpulkan sebagai berikut:
1. Terjadi penurunan jumlah Candida albicans pada basis gigi tiruan RAPP setelah direndam dalam vinegar apel 5%, vinegar apel 6,23%, dan sodium hipoklorit 1% selama 8 jam.
2. Ada pengaruh perendaman basis gigi tiruan RAPP dalam vinegar apel 5%, vinegar apel 6,23%, sodium hipokorit 1% selama 8 jam terhadap jumlah Candida
albicans. (p < 0,05).
3. Tidak terdapat perbedaan pengaruh yang signifikan antara perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dibandingkan dengan vinegar apel 6,23% dan terdapat perbedaan pengaruh yang signifikan antara perendaman basis gigi tiruan RAPP dalam vinegar apel 5% dengan sodium hipoklorit 1%. Sedangkan, tidak terdapat perbedaan pengaruh yang signifikan antara perendaman basis gigi tiruan RAPP dalam vinegar apel 6,23% dibandingkan dengan sodium hipoklorit 1% selama 8 jam terhadap jumlah Candida albicans (p > 0,05).
75
lebih lanjut dalam hal pengaruh perendaman basis gigi tiruan RAPP yang direndam dalam vinegar apel terhadap sifat-sifat fisis, kemis, dan mekanis lainnya.
6.2 Saran
1. Perlu dilakukan penelitian yang lebih lanjut mengenai pengaruh perendaman basis gigi tiruan RAPP dalam vinegar apel dengan konsentrasi yang lebih tinggi tehadap penurunan jumlah Candida albicans.
2. Perlu dilakukan penelitian yang lebih lanjut mengenai pengaruh perendaman basis gigi tiruan RAPP dalam vinegar apel dengan variasi waktu yang berbeda tehadap penurunan jumlah Candida albicans.
9
BAB 2
TINJAUAN PUSTAKA
2.1 Basis Gigi Tiruan
2.1.1 Pengertian
Basis gigi tiruan merupakan bagian dari gigi tiruan yang berada di atas linggir sisa yang bersandar pada jaringan lunak rongga mulut, sekaligus berperan sebagai tempat melekatnya anasir gigi tiruan dan sebagai pendukung jaringan lunak di sekitar gigi.1-4 Menurut The Glossary of Prosthodontic Terms-8 tahun 2005, basis gigi tiruan didefinisikan sebagai bagian dari suatu gigi tiruan yang bersandar pada jaringan pendukung dan tempat anasir gigi tiruan melekat.2,42 Daya tahan, penampilan dan sifat-sifat dari suatu basis gigi tiruan sangat dipengaruhi oleh bahan basis tersebut. Berbagai bahan telah digunakan untuk membuat gigi tiruan, namun belum ada bahan yang dapat memenuhi semua persyaratan bahan basis gigi tiruan.2,9
2.1.2 Persyaratan
Persyaratan basis gigi tiruan yang ideal adalah:1,30 a. Biokompatibel: tidak toksis dan tidak mengiritasi b. Karakteristik permukaan: halus, keras dan berkilat c. Warna: translusen dan warna merata
d. Stabilitas warna: baik
e. Bebas dari porositas: tidak boleh menunjukkan rongga kosong f. Kekuatan lentur: tidak kurang dari 60-65 MPa
g. Modulus elastisitas: paling sedikit 2000 MPa untuk polimer yang dipolimerisasi dengan panas dan paling sedikit 1500 MPa untuk polimer swapolimerisasi
h. Proportional limit: tinggi sehingga tidak mudah mengalami perubahan
10
j. Kekuatan impak: tinggi sehingga basis gigi tiruan tidak mudah pecah apabila terjatuh
k. Stabilitas dimensi: stabil dan akurat l. Kekuatan fatique: tinggi
m.Abration resistance dan kekerasan: baik
n. Konduktivitas termal: baik
o. Density rendah: untuk membantu retensi gigi tiruan pada rahang atas
p. Tidak ada monomer sisa, tidak menyerap cairan, dan tidak dapat larut. Syarat tambahan yang dapat dimiliki suatu basis gigi tiruan adalah harga
relatif murah. Sampai saat ini belum ada satu pun basis gigi tiruan yang dapat
memenuhi semua persyaratan di atas.
2.1.3 Klasifikasi
Bahan yang digunakan untuk pembuatan basis gigi tiruan dapat berasal dari bahan logam dan non-logam.3,4,30,42
2.1.3.1 Logam
Bahan logam yang digunakan untuk basis gigi tiruan dimulai pada abad ke-18 yaitu terbuat dari emas (1775), aluminium (1867), stainless steel (1921), kobalt-kromium, nikel kromium (1930), pure titanium (1998), dan lain sebagainya.3,5-7,30,42
Bahan basis gigi tiruan logam memiliki beberapa kelebihan diantaranya:4,30,43 1. Ketepatan dimensi
2. Ketahanan terhadap abrasi
3. Konduktivitas termal lebih baik dibandingkan dengan resin 4. Kekuatan maksimal dengan ketebalan minimal
5. Modulus elastisitas yang tinggi
Adapun beberapa kerugian dari bahan basis gigi tiruan logam antara lain:6,7,30 1. Mudah mengalami korosi
11
4. Tidak dapat dilakukan reline dan rebase
5. Kurang estetis karena warna basis logam tidak harmonis dengan warna jaringan sekitarnya
6. Perluasan basis logam hingga lipatan bukal serta pengembalian kontur pipi dan bibir sulit dilakukan dengan basis logam
2.1.3.2 Non-Logam
Basis gigi tiruan non-logam biasanya dibuat dari bahan resin. Berdasarkan sifat termalnya, bahan ini dapat diklasifikasikan atas dua jenis, yaitu resin termoplastik dan resin termoset.3-5,9,42
2.1.3.2.1 Resin Termoplastik
Resin termoplastik merupakan bahan berbentuk padat pada suhu ruangan yang dapat menjadi lunak kembali ketika dipanaskan pada suhu tertentu secara berulang-ulang. Molekul-molekul pada polimer termoplastik berikatan satu sama lain dengan ikatan fisik yang lemah sehingga ketika terjadi pemanasan ikatan molekul-molekul tersebut akan putus. Ketika suhu turun kembali ikatan antar molekul akan terbentuk dan pengerasan bahan termoplastik terjadi kembali.6,7 Contoh dari bahan termoplastik adalah seluloid (1870), polystyrene (1951), polyvinyl acrylics (1932), nilon termoplastik (1955), dan lain sebagainya.3-5,41 Seluloid merupakan bahan termoplastik pertama yang digunakan sebagai bahan untuk pembuatan basis gigi tiruan oleh John Wesley Hyatt (1868) karena bersifat translusen dan estetis, namun tidak banyak digunakan jangka panjang karena dapat mengalami distorsi dan diskolorisasi.5,42
2.1.3.2.2 Resin Termoset
12
fenol formaldehid (1909), amino resin, epoxy resin (1951), silikon, resin akrilik (1937), dan lain sebagainya.3-7,42
2.2 Resin Akrilik
2.2.1 Pengertian
Bahan yang paling sering digunakan untuk membuat basis gigi tiruan adalah polimetil metakrilat (PMMA) dan biasanya disebut dengan resin akrilik.8,9,30,42 Resin akrilik adalah turunan dari etilen yang mengandung gugus vinil dalam rumus strukturnya dan yang digunakan dalam kedokteran gigi adalah ester dari asam akrilik (CH2=CHCOOH) dan asam metakrilik (CH2=C(CH3)COOH) atau akrilonitril. Resin
akrilik diaktivasi oleh panas yang terdiri dari rantai monomer-monomer metal metakrilat merupakan salah satu yang paling banyak diantara semuanya.9,30 Pada tahun 1937 Dr. Walter Wright (1937) secara klinis mengevaluasi metil metakrilat dan ditemukan bahwa resin akrilik memenuhi hampir semua persyaratan bahan basis gigi tiruan yang ideal. Resin akrilik merupakan bahan basis gigi tiruan non-logam yang paling banyak digunakan saat ini karena memiliki beberapa keuntungan, seperti tidak toksis, mudah dimanipulasi, harga relatif murah, warna stabil, sifat fisis dan mekanis yang cukup baik, dan sifat lainnya yang membuat resin akrilik sebagai bahan yang paling ideal untuk digunakan.9,42
2.2.2 Klasifikasi
Resin akrilik dapat diklasifikasikan berdasarkan proses polimerisasi yaitu:8-10 a. Resin akrilik polimerisasi sinar adalah resin akrilik yang diaktifkan dengan sinar yang dapat dilihat. Resin akrilik polimerisasi sinar terdiri dari matriks uretan dimetilmetakrilat, microfine silica, dan champhorquinone yang berperan sebagai inisiator. Proses polimerisasinya menggunakan sinar tampak sebagai aktivator. Polimerisasi terjadi didalam suatu unit kuring khusus yang menggunakan lampu halogen dengan panjang cahaya 400-500 nm selama kira-kira 10 menit.8-10,30,44
13
kimia berfungsi untuk mengaktifkan benzoil peroksida yang terdapat didalam polimer sehingga dapat terjadi proses polimerisasi. Aktivator kimia yang biasa digunakan adalah amina tersier, contohnya adalah dimetil paratoluidin. Kekuatan resin akrilik swapolimerisasi cukup rendah, stabilitas warna yang kurang baik, dan jumlah monomer sisa yang dihasilkan lebih banyak daripada RAPP.8-10,30,45,46
c. Resin akrilik polimerisasi microwave dapat menghasilkan basis resin akrilik dengan kualitas yang sama dengan RAPP hanya dengan membutuhkan waktu tiga menit saja. Resin akrilik dicampur dalam bubuk yang tepat dan dalam waktu yang sangat singkat sekitar 3 menit dengan energi microwave sebesar 500-600 W. Kontrol yang cermat pada waktu dan jumlah watt dari oven adalah penting untuk menghasilkan resin bebas pori dan memastikan polimerisasi lengkap.30
d. Resin akrilik polimerisasi panas (RAPP) adalah resin yang memerlukan energi panas untuk polimerisasi bahan dengan menggunakan perendaman air di dalam waterbath atau dengan energi microwave.9,10
2.3 Resin Akrilik Polimerisasi Panas
Resin akrilik polimerisasi panas pertama kali diperkenalkan oleh Dr. Walter Wright pada tahun 1937 sebagai bahan basis gigi tiruan dan sejak tahun 1946 banyak dipergunakan oleh praktisi dokter gigi untuk membuat basis gigi tiruan yaitu 98%.8,9,47
2.3.1 Komposisi
Komposisi RAPP terdiri dari:1,8-12,30,46 a. Bubuk (powder)
- Polimer: komponen utama bubuk adalah butiran polimetil metakrilat (PMMA) dengan diameter 100 µm dan massa jenis 1,19 g/cm3.
- Inisiator: benzoil peroksida (0,5%), inisiator memulai proses polimerisasi. - Pigmen/pewarna: merkuri sulfida menghasilkan warna merah, kadmium sulfida menghasilkan warna kuning, ferric oksida (1%) menghasilkan warna coklat.
14
- Opacifier: titanium dioksida atau zink oksida.
b. Cairan (liquid)
- Monomer: komponen utama cairan adalah monomer metal metakrilat (MMA) yang tidak berwarna, tidak kental dengan titik didih 100.30C, dan bau menyengat yang disebabkan tekanan penguapan yang relatif tinggi pada suhu ruangan - Cross-linking agent: etilen glikoldimetakrilat (10%) yang berperan dalam
pembentukan rantai polimer dan mengurangi daya larut dalam pelarut organik.
- Inhibitor: hydroquinone (<1%) yang berfungsi untuk mencegah reaksi
polimerisasi berlangsung lebih cepat atau setting dari cairan selama penyimpanan.
2.3.2 Manipulasi
Resin akrilik polimerisasi panas umumnya diproses dalam sebuah kuvet dengan menggunakan teknik compression-moulding. Proses manipulasi RAPP dengan teknik compression-moulding antara lain:1,8,9,30,47
a. Perbandingan monomer dan polimer
Bubuk dan cairan dicampur dengan perbandingan 3:1 satuan volume atau perbandingan 2:1 satuan berat.8,30
b. Proses pencampuran polimer dan monomer
Bubuk dan cairan dengan rasio yang tepat dicampur di dalam wadah yang bersih, kering dan tertutup lalu dicampurkan hingga homogen. Setelah pencampuran bubuk dan cairan pada RAPP, maka akan melewati lima tahapan yaitu:1,8,9
1. Tahap basah: campuran seperti pasir (wet sand stage). Pada tahap ini secara bertahap polimer bercampur dengan monomer.
2. Tahap lengket: campuran seperti berserat, berbenang (tacky fibrous). Pada tahap ini polimer larut dalam monomer (sticky stage).