HISTOPATOLOGIS LAMBUNG PADA TIKUS GALUR Sprague dawley
Skripsi
Oleh
MUHAMMAD YOGIE FADLI 1118011082
FAKULTAS KEDOKTERAN UNIVERSITAS LAMPUNG
ANALYSIST OF RAT Sprague dawley
By
Muhammad Yogie Fadli
ABSTRACT
Cancer is a disorder characterized by abnormality of cell growth. Some studies said that sambung nyawa leaves (Gynura procumbens) is one of the plant that have the anticarsiogenic effect becomes alternative cancer treatment. Sambung nyawa contains chemical compounds such as flavonoids, sterol, triterpenoid, polifenol, saponin, steroid, chlorogenic acid, caffeic acid, vanilat acid, para coumaric acid, para hydroxybenzoic acid, and atsiri oil which serves to inhibit cancer cell growth. In the implementation of complementary medicine must be proven effectiveness and toxicity.
14 days study of the toxicity of sambung nyawa etanol extract was investigated in a Post Test-only Control Group. Samples using 25 white male rats Sprague dawley strain divided into 5 unpired groups (5 rats each). Positive control group (K1) was given aquadest 1ml. K2, K3, K4, and K5 group was given sambung nyawa extract 500 mg/kgbb, 1000 mg/kgbb, 1500 mg/kgbb and 2000 mg/kgbb. One-way Anova’s test were used with p<0,05
The result of toxicity of sambung nyawa leaves (Gynura procumbens) ethanol extract did not change gatric histopathologic of white male rat Sprague dawley strain One Way Annova’s test showed p>0,05 (p=0,944).
sambung nyawa’s leaf ethanol extract with effective dose and also the increasing dose did not show statistically significant results againts gastric damage
SANWACANA
Puji syukur penulis panjatkan kepada Allah SWT atas segala nikmat, rahmat, dan
karunia yang telah diberikan sehingga skripsi ini dapat diselesaikan. Tak lupa
shalawat teriring salam semoga senantiasa tercurah kepada Rasulullah
Muhammad SAW yang syafaatnya semoga kita dapatkan kelak di Yaumil Akhir.
skripsi dengan judul “UJI TOKSISITAS EKSTRAK ETANOL DAUN
SAMBUNG NYAWA {Gynura procumbens (Lour.) Merr} TERHADAP
GAMBARAN HISTOPATOLOGIS LAMBUNG PADA TIKUS GALUR
Sprague dawley” adalah salah satu syarat untuk memperoleh gelar Sarjana
Kedokteran di Universitas Lampung.
Dalam kesempatan ini penulis ingin mengucapkan terima kasih kepada:
1. Dr. Sutyarso, M.Biomed selaku Dekan Fakultas Kedokteran.
2. dr. Novita Carolia, M. Sc selaku Pembimbing Utama terima kasih atas
segala bimbingan, telah menjadi sosok yang sabar dan selalu memberikan
solusi atas segala permasalahan yang penulis alami saat penelitian
3. dr. Dina Tri Amalia selaku Pembimbing Kedua atas waktu, pikiran, saran,
bimbingan, serta kesabarannya dalam membimbing saya
4. Dr. dr. Asep Sukohar, M. Kes selaku Penguji Utama pada ujian skripsi.
Terima kasih telah menjadi sosok yang saya idolakan. Pemikiran beliau
tentang pengobatan masa depan membuat saya terpacu untuk terus
menimba ilmu. Terimakasih atas segala motivasi, dukungan, saran dan
5. Staf–staf dosen yang telah menjadi guru saya, sangat banyak ilmu yang
telah diberikan, dan hanya Tuhan yang bisa membalas semua hal yang
telah beliau–beliau berikan kepada saya.
6. Seluruh civitas akademi lainnya yang telah memberikan saran dan
kemudahan dalam urusan administrasi sehingga skripsi ini selesai.
7. Prof. Dr. Ir. H. Hasriadi Matakin, M.S dan Urip Mulyati selaku orang
tuaku yang tak pernah lupa mendoakan disetiap shalatmu. Terimakasih
atas segala kasih sayang yang kalian berikan merupakan pembangkit
semangatku untuk terus berusaha agar bisa menjadi anak yang kalian
banggakan.
8. Kakak-kakak tercinta Yulia Rahma Fitriana S.Hut, M.sc dan Chandra
Prasetyo Hadi S.T. Terimakasih kalian sudah menjadi orang yang selalu
menjagaku ketika kecil dan menjadi orang yang selalu ingin aku lampaui
ketika aku sudah besar.
9. Adiku tersayang Hasril Mulya Budiman yang selalu memberikan
dukungan.
10.Teman seperjuangan skripsi Dea Lita Barozha dan Alvionita Nur F kalian
membantu dalam penyelesaian skripsi ini. Semoga perjuangan kita dapat
berguna bagi ilmu pengetahuan dikemudian hari.
11.Asdos Farmakologi FK Unila yang selalu mengisi hari-hari praktikum
farmakologi dengan tulus tanpa pamrih. Rifka Humaida, Nycho, Vivi,
Karimah, Desi, semoga lelah yang kita dapat digantikan dengan prestasi.
12.Sahabatku, teman seperjuanganku Tanty Yosela, Dina Rianti Fitri, Resty
Gita, Tanika, Ririn Rahayu dan Danar Fahmi. Terimakasih atas segala
suka dan duka yang telah kita lewati bersama dan juga segala waktu
bahagia, tenaga tanpa pamrih. Semoga semua angan dan harapan yang kita
inginkan akan tercapai kelak dan persahabatan ini tetap terjaga selamanya.
13.Teman sejawat satu angkatan 2011, terimakasih telah memberikan saya
kesempatan untuk mengenal kalian. Semoga kita dapat membanggakan
almamater tercinta dan menjadi dokter yang berguna untuk nusa dan
bangsa. Semoga cita-cita dan usaha kita meraihnya melangit dengan
pribadi yang tetap solid.
14.Teman-teman Nadia Anissa M, Masruhan, Febri, Fathan, Vivi, Made,
Nastria, Nafillia, Feby, Astari, dan Meylinda yang selalu memberikan
motivasi.
15.Semua yang tidak dapat saya sebutkan satu persatu. Terima kasih telah
membantu dalam kelancaran skripsi ini.
Akhir kata, penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan,
akan tetapi penulis berharap semoga skripsi yang sederhana ini dapat berguna dan
bermanfaat bagi kita semua. Amin.
Bandar Lampung, 23 Januari 2015
Penulis
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN... ... vi
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Rumusan Masalah ... 4
C. Tujuan Penelitian ... 5
D. Manfaat Penelitian ... 5
E. Kerangka Penelitian ... 6
1. Kerangka teori ... 7
2. Kerangka konsep ... 8
F. Hipotesis ... 9
II. TINJAUAN PUSTAKA ... 7
A. Lambung ... 7
1. Anatomi Lambung Manusia ... 7
2. Histologi Lambung Manusia ... 9
3. Fisiologis Lambung Manusia ... 12
B. Sambung Nyawa (Gynura Procumbens) ... 16
1. Klasifikasi ... 16
2. Deskripsi ... 16
3. Kandungan Kimia ... 18
4. Manfaat Daun Sambung Nyawa ... 20
C. Uji Toksisitas ... 22
1 Toksisitas Akut ... 23
2.Toksisitas Subkronis ... 27
III. METODOLOGI PENELITIAN ... 33
A. Rancangan Penelitian ... 33
B. Sumber Data ... 34
1. Besar Sampel ... 34
2. Kriteria Sampel ... 35
C. Identifikasi Variabel ... 35
1. Variabel Bebas ... 35
2. Variabel Tergantung ... 36
3. Variabel Terkendali ... 36
D. Definisi Operasional ... 37
E. Bahan dan Alat Penelitian ... 38
1. Bahan Penelitian ... 38
2. Alat Penelitian ... 38
F. Jalannya Penelitian ... 38
1. Metode Pembuatan Ekstrak Etanol Daun Sambung nyawa ...38
2. Prosedur Pemberian Ekstrak Etanol Daun Sambung...39
3. Pengamatan ... 41
G. Analisis Data ... 42
H. Etika Penelitian...45
IV. HASIL DAN PEMBAHASAN ... 46
A. Hasil Analisis Data ... .46
1. Uji Normalitas ... 46
2. Uji Homogenitas ... 46
3. Uji Efek Perlakuan ... 47
B. Pembahasan ... 49
1. Subjek Penelitian...49
2. Distribusi Hasil dan Hasil Penelitian ... 49
V. SIMPULAN DAN SARAN ... 54
A. Simpulan...54
B. Saran ... 54
DAFTAR PUSTAKA
DAFTAR GAMBAR
Gambar 5 Diagram Kerangka Teori Penelitian...7
Gambar 6 Diagram Kerangka Konsep Penelitian...8
Gambar 1 Anatomi Lambung Manusia...10
Gambar 2 Histologi Lambung Manusia... ...12
Gambar 3A Erosi Mukosa Lambung...13
Gambar 3B Tukak Pada Lambung...13
Gambar 4 Gynura procumbens......17
Gambar 7 Rancangan Penelitian...44
DAFTAR TABEL
Tabel 1 Definisi Operasional...37
Tabel 2 Hasil Uji Normalitas...46
Tabel 3 Hasil Uji Homogenitas...46
DAFTAR LAMPIRAN
Hasil Analisis Data...60
Etika Penelitian...61
Dokumentasi Perlakuan...62
BAB I PENDAHULUAN
A. Latar Belakang
Kanker merupakan salah satu penyebab kematian dengan kontribusi sebesar
13 % kematian dari 22 % kematian akibat penyakit tidak menular utama di
dunia. Insidensi penyakit kanker di dunia telah mencapai 12 juta penduduk
dengan Per Mortality Rate (PMR) 13 %. Di negara-negara maju seperti
Amerika Serikat dan Inggris kematian akibat kanker menduduki peringkat
kedua setelah penyakit kardiovaskuler. Salah satu penyakit kanker yang
menyebabkan kematian tertinggi di dunia adalah kanker paru. Sedangkan di
Indonesia menunjukan angka kematian akibat kanker sebesar 4,3 per 1000
penduduk, menempati peringkat ke tujuh setelah kematian akibat stroke,
tuberkolosis, hipertensi, cidera, dan diabetes melitus (Depkes RI, 2008).
Peningkatan angka kematian akibat kanker disebabkan oleh pola diet dan
gaya hidup yang tidak baik seperti pola konsumsi lemak jenuh dan juga
alkohol akan meningkatkan kejadian penyakit kanker. Faktor lain yang
berpengaruh adalah kesehatan mental. Orang dengan mental disorder
(khususnya yang berkaitan dengan depresi klinis dan bipolar) akan
meningkatkan risiko kejadian kanker pada usia muda (Oemiati et al., 2011)..
sosial ekonomi, dan psikososial yang akan meningkatan morbiditas dan
mortalitas kanker. Insidensi kanker meningkat di negara berkembang dan
lebih meningkat di daerah perkotaan dibandingkan daerah pedesaan (Risser,
1996).
Radikal bebas yang merupakan salah satu penyebab kanker merupakan atom
atau molekul yang tidak stabil dan sangat reaktif karena memiliki elektron
tidak berpasangan pada lapisan (orbital) terluarnya. Untuk mencapai
kestabilan atom atau molekul, radikal bebas akan bereaksi dengan molekul
di sekitarnya untuk memperoleh pasangan elektron. Reaksi ini akan
berlangsung terus-menerus dalam tubuh dan bila tidak dihentikan akan
menimbulkan berbagai penyakit seperti kanker, jantung, katarak, penuaan
dini, serta penyakit degeneratif lainnya (Arivazhagan et al, 2000).
Radikal bebas dapat menginduksi kerusakan DNA yang berakibat timbulnya
penyakit kanker. Sebagai pertahanan terhadap kerusakan akibat radikal
bebas, tubuh telah mempunyai sistem antioksidan sebagai mekanisme
perlindungan terhadap serangan radikal bebas secara alami yang terdiri dari
banyak komponen diantaranya superoksida dismutase (SOD), glutation
perokside (GPx), katalase (CAT), glutation-S-transferase (GST) dan
antioksidan ekstraseluler yang berasal dari makanan seperti α-tokoferol, β
-karoten, vitamin C, ubiquinol dan flavonoid. Jadi antioksidan mampu
menghilangkan, membersihkan, menahan pembentukan ataupun
meniadakan efek radikal bebas. Kekurangan salah satu komponen tersebut
menyeluruh dan berakibat perlindungan tubuh terhadap serangan radikal
bebas melemah yang berarti rentan terhadap berbagai penyakit diantaranya
kanker (Arivazhagan et al, 2000).
Insidensi kanker yang tinggi di Indonesia menyebabkan berkembangnya
pengobatan antikanker baik dengan cara kemoterapi, hormonal, penyinaran
maupun pembedahan, akan tetapi cara tersebut banyak menyebabkan efek
samping yang serius pada penderita. Selain itu, pemerintah juga telah
mengupayakan penyelenggaraan pengobatan komplementer yang bertujuan
mencegah pertumbuhan sel kanker yang telah teruji dan dikaji manfaatnya
(Depkes, 2008).
Sambung nyawa merupakan salah satu tanaman obat yang dapat digunakan
sebagai pengobatan komplementer untuk menghambat pertumbuhan sel
kanker, dikenal sebagai tanaman sambung nyowo atau ngokilo. Sambung
nyawa ini merupakan tanaman merambat yang banyak tumbuh di
pekarangan rumah dan terkadang dipergunakan sebagai pagar tanaman oleh
masyarakat. Memiliki daun tunggal, berbentuk oval, dan memiliki rambut
halus pada permukaan atas bawah daunnya. Batang berbentuk bulat, lunak
dan berwarna hijau tua. Bagian tanaman yang digunakan sebagai obat
adalah daunnya (Yelia, 2003).
Pembuktian secara ilmiah mengenai khasiat tanaman ini melalui penelitian
telah banyak dilakukan antara lain oleh Sugiyanto et al. (1993) yang
melaporkan adanya efek penghambatan karsinogenitas benzo(a)piren (BAP)
penggunaan tradisional sambung nyawa juga didukung oleh isolasi dan
identifikasi beberapa kandungan kimia yang mungkin aktif dari tanaman ini,
seperti flavonoid, saponin, tanin, dan terpenoid, namun masih sedikit
informasi yang didapat akan penggunaan paparan sambung nyawa dalam
jangka waktu yang lama (Rosidah et al., 2009).
Selain penelitian tentang manfaat daun sambung nyawa, dewasa ini mulai
dilakukan penelitian untuk mengamati toksisitas dari ekstrak etanol daun
sambung nyawa salah satunya ialah penelitian yang dilakukan oleh Astri et
al. (2012). Hal tersebut dikarenakan penggunaan ekstrak etanol daun
sambung nyawa yang semakin meluas. Namun, penelitian ini baru terbatas
pada pemeriksaan makroskopik. Penelitian tersebut dilakukan selama 14
hari dengan menggunakan tikus galur Wistar yang berumur 8 minggu.
Setelah dilakukan pembedahan didapatkan adanya ulkus pada lambung dan
rusaknya pembuluh darah (Astri et al., 2012). Karena hal-hal yang
disebutkan diatas maka peneliti tertarik untuk melakukan penelitian tentang
efek toksisitas daun sambung nyawa terhadap gambaran histopatologis
organ lambung.
B. Rumusan Masalah
Berdasarkan deskripsi tersebut, maka dapat dirumuskan masalah penelitian
adalah: Apakah ekstrak etanol daun sambung nyawa dapat menimbulkan
perubahan gambaran histopatologis lambung tikus putih galur Sprague
C. Tujuan Penelitian
Adapun tujuan dari penelitian ini untuk mengetahui pengaruh pemberian
ekstrak etanol daun sambung nyawa terhadap perubahan gambaran
histopatologi lambung tikus putih galur Sprague dawley.
D. Manfaat Penelitian
1. Bagi peneliti, sebagai wujud pengaplikasian disiplin ilmu yang telah
dipelajari sehingga dapat mengembangkan wawasan keilmuan
peneliti.
2. Bagi masyarakat/institusi, dapat memberikan informasi tentang dosis
toksik yang mungkin muncul akibat penggunaan ekstrak daun
sambung nyawa. Penelitian ini juga dapat mendukung upaya
pemeliharaan tanaman sambung nyawa sebagai salah satu tanaman
berkhasiat obat (apotek hidup) yang memiliki zat aktif anti
karsiogenik natural.
3. Bagi Fakultas Kedokteran Universitas Lampung (FK Unila)
meningkatkan iklim penelitian dibidang agromedicine sehingga dapat
menunjang pencapaian visi FK Unila 2025 sebagai sepuluh terbaik
fakultas kedokteran di Indonesia pada tahun 2025 dengan kekhususan
agromedicine
4. Bagi ilmu pengetahuan, dapat membuka penelitian lanjutan untuk
lebih dikenal sebagai tanaman jamu, sehingga daun sambung nyawa
dapat berkembang menjadi fitofarmaka.
D. Kerangka Penelitian
1. Kerangka Teori
Iritasi pada mukosa lambung yang berlangsung lama menyebabkan
kerusakan mukosa yang berulang-ulang sehingga dapat terjadi radang
lambung kronis dan tukak lambung. Hal ini terjadi misalnya ditemukan
pada pecandu alkohol, perokok, pengguna analgetik non steroid jangka
panjang dan refluks empedu. Keadaan serupa terjadi juga pada fungsi
pengosongan lambung yang lambat, sehingga mukosa lambung kontak
lama dengan isi lambung (Sibuea, 2005).
Sambung nyawa merupakan salah satu tanaman obat yang saat ini sangat
populer di masyarakat. Bagian tanaman yang biasa digunakan sebagai
obat adalah daunnya. Daun sambung nyawa dapat menghambat
terbentuknya batu kandung kemih pada tikus dan tidak bersifat toksik
daun sambung nyawa juga memiliki potensi sebagai antikarsinogenik
(Sugiyanto et al., 2003). Khasiat daun sambung nyawa adalah sebagai
obat ginjal, antikanker, dan penurun tekanan darah. Namun, hingga
sekarang belum diketahui lebih lanjut mengenai batas maksimal
Gambar 1. Diagram Kerangka Teori Penelitian Penggunaan ektrak etanol 96% daun
sambung nyawa yang mengandung flavonoid
Minyak astiri
Saponin Tannin Triterpen
steroida
Peningkatan dosis lebih
dari 200mg/kgBB
Kerusakan pada organ dalam tubuh
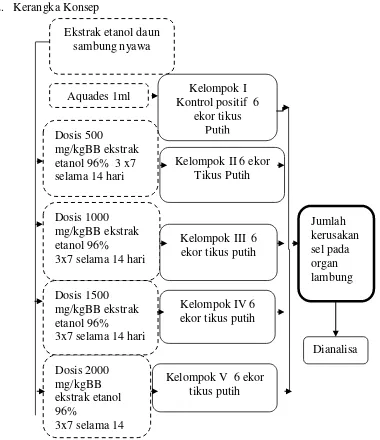
2. Kerangka Konsep
Gambar 2. Diagram Kerangka Konsep Penelitian
Keterangan:
: Variabel independen
: Variabel dependen Ekstrak etanol daun
sambung nyawa
Aquades 1ml Kelompok I
Kontrol positif 6 ekor tikus
Putih Dosis 500
mg/kgBB ekstrak etanol 96% 3 x7 selama 14 hari
Kelompok II 6 ekor Tikus Putih
Dosis 2000 mg/kgBB ekstrak etanol 96%
3x7 selama 14 Dosis 1500 mg/kgBB ekstrak etanol 96% 3x7 selama 14 hari Dosis 1000
mg/kgBB ekstrak etanol 96% 3x7 selama 14 hari
Kelompok III 6 ekor tikus putih
Kelompok IV 6 ekor tikus putih
E. Hipotesis
Berdasarkan rumusan masalah yang telah dipaparkan sebelumnya, hipotesis
dalam penelitian ini adalah ekstrak etanol daun sambung nyawa dapat
menimbulkan kerusakan akibat toksisitas pada gambaran histopatologi
BAB II
TINJAUAN PUSTAKA
A. Lambung
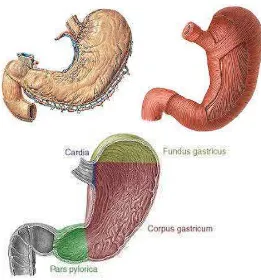
1. Anatomi Lambung Manusia
Lambung adalah perluasan organ berongga besar menyerupai kantung
dalam rongga peritoneum yang terletak diantara esophagus dan usus halus.
Lambung terdiri dari antrum kardia (yang menerima esophagus), fundus
besar seperti kubah, badan utama atau korpus dan pilorus yang menyerupai
corong (Eroschenko, 2010).
Lambung terletak oblik dari kiri ke kanan menyilang di abdomen atas tepat
di daerah epigastrik, di bawah diafragma dan di depan pankreas. Dalam
keadaan kosong, lambung menyerupai tabung bentuk J, dan bila penuh,
berbentuk seperti buah pir raksasa. Kapasitas normal lambung adalah 1
sampai 2 L (Price, 2006). Secara anatomis lambung terdiri atas empat
bagian, yaitu: kardia, fundus, badan atau korpus, dan pilorus. Adapun secara
histologis, lambung terdiri atas beberapa lapisan, yaitu: mukosa,
submukosa, muskularis mukosa, dan serosa. Lambung berhubungan dengan
esofagus melalui orifisium atau kardia dan dengan duodenum melalui
Perdarahan lambung berasal dari arteri gaster sinistra yang berasal dari
truncus coeliacus, a. gastric dekstra yang dilepaskan dari a. hepatica, a.
gastroepiploica cabang dari a. gastricaduodenalis, a. gastro-omentalis yang
berasal dari a. splenica, dan a. gastric breves berasal dari a. splenica
(Moore, 2002).
Gambar 3. Anatomi lambung manusia (Sumber: Sobotta, 2010)
Secara anatomis bagian lambung yang paling sering mengalami gangguan
adalah bagian antrum, ini ditandai dengan peningkatan angka kejadian
gastritis. Dengan data tersebut maka secara histologis lapisan lambung yang
paling sering mengalami kerusakan adalah bagian superfisial atau dapat
menembus lebih dalam ke mukosa lambung yang bisa terjadi diseluruh
permukaan bagian lambung. Beberapa bahan yang dimakan seperti alkohol
tersebut dapat merusak mukosa kelenjar dan sambungan epitel yang rapat
(tight epithelial junctions) diantara sel pelapis lambung hingga sering
menyebabkan gastritis akut atau kronis berat (Guyton, 2008).
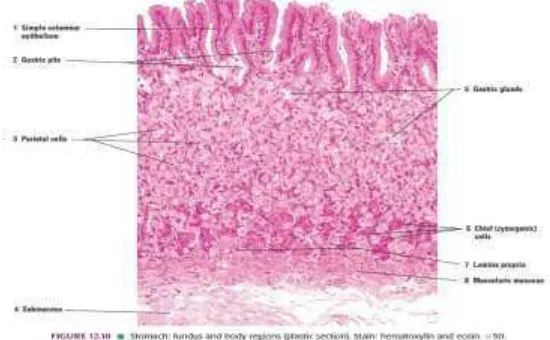
2. Histologis Lambung Manusia
Mukosa lambung mengandung banyak kelenjar. Di daerah pilorus dan
kardia, kelenjar dapat menyekresikan mukus. Di korpus lambung, termasuk
fundus, kelenjar mengandung sel parietal (oksintik), yang menyekresikan
asam hidroklorida dan faktor intrinsik, dan chief cell (sel zimogen, sel
peptik), yang menyekresikan pepsinogen. Sekresi-sekresi ini bercampur
dengan mukus yang disekresikan oleh sel-sel di leher kelenjar. Beberapa
kelenjar bermuara ke ruang bersamaan (gastric pit) yang kemudian terbuka
kepermukaan mukosa. Mukus juga disekresikan bersama HCO3- oleh
sel-sel mukus di permukaan epitel antara kelenjar-kelenjar (Ganong, 2002).
Dinding lambung tersusun dari empat lapisan dasar utama, sama halnya
dengan lapisan saluran cerna secara umum dengan modifikasi tertentu yaitu
lapisan mukosa, submukosa, muskularis eksterna, dan serosa (Schmitz &
Kevin, 2008).
1. Lapisan mukosa terdiri atas epitel permukaan, lamina propia, dan
muskularis mukosa. Epitel permukaan yang berlekuk ke dalam lamina
propia dengan kedalaman yang bervariasi, dan membentuk
sumur-sumur lambung disebut foveola gastrika. Epitel yang menutupi
silindris dan semua selnya menyekresi mukus alkalis. Lamina propia
lambung terdiri atas jaringan ikat longgar yang disusupi sel otot polos
dan sel limfoid. Muskularis mukosa yang memisahkan mukosa dari
submukosa dan mengandung otot polos (Tortora & Derrickson, 2012).
2. Lapisan sub mukosa mengandung jaringan ikat, pembuluh darah, sistem
limfatik, limfosit, dan sel plasma. Sebagai tambahan yaitu terdapat
pleksus submukosa (Schmitz & Kevin, 2008).
3. Lapisan muskularis propia terdiri dari tiga lapisan otot, yaitu inner
oblique, middle circular dan outer longitudinal. Pada muskularis propia
terdapat pleksus myenterik (auerbach) (Schmitz & Martin, 2008).
Lapisan oblik terbatas pada bagian korpus dari lambung (Tortora &
Derrickson, 2012).
4. Lapisan serosa adalah lapisan yang tersusun atas epitel selapis skuamos
(mesotelium) dan jaringan ikat areolar (Tortora & Derrickson, 2009).
Lapisan serosa adalah lapisan paling luar dan merupakan bagian dari
viseral peritoneum (Schmitz & Kevin, 2008).
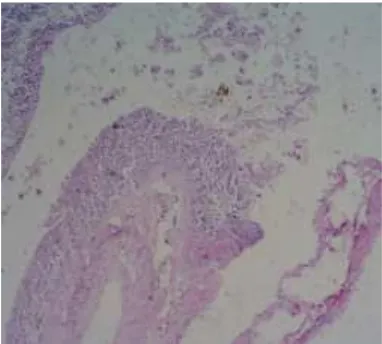
Sedangkan untuk gambaran histopatologis dari lambung (gambar 3) akan
terlihat serbukan sel radang pada bagian mukosa lambung. Peradangan yang
nampak pada pemeriksaan gambaran histopatologis menggambarkan
kerusakan yang terjadi pada daerah mukosa gaster biasa ditandai dengan
erosi disertai bendungan perdarahan seperti yang terlihat pada gambar 3A
ataupun tukak pada gaster yang terlihat pada gambar 3B (Astri et al., 2012)
Gambar 5A. Erosi mukosa disertai bendungan perdarahan (Sumber: Astri et al., 2012).
2. Fisiologis Lambung
Fungsi motorik dari lambung ada tiga: (1) penyimpanan sejumlah besar
makanan sampai makanan dapat diproses di dalam duodenum, (2)
pencampuran makanan ini dengan sekresi dari lambung sampai membentuk
suatu campuran setengah cair yang disebut kimus, dan (3) pengosongan
makanan dengan lambat dari lambung ke dalam usus halus pada kecepatan
yang sesuai untuk pencernaan dan absorpsi yang tepat oleh usus halus
(Guyton, 2008).
Setiap hari lambung mengeluarkan sekitar 2 liter getah lambung. Sel-sel
yang bertanggung jawab untuk fungsi sekresi, terletak di lapisan mukosa
lambung. Secara umum, mukosa lambung dapat dibagi menjadi dua bagian
terpisah: (1) mukosa oksintik yaitu yang melapisi fundus dan badan, (2)
daerah kelenjar pilorik yang melapisi bagian antrum. Sel-sel kelenjar
mukosa terdapat di kantong lambung (gastric pits), yaitu suatu invaginasi
atau kantung pada permukaan luminal lambung. Variasi sel sekretori yang
melapisi invaginasi ini beberapa diantaranya adalah eksokrin, endokrin, dan
parakrin (Sherwood, 2010).
Kapasitas lambung cukup besar, bila kosong volume lumennya hanya 50-75
ml. Namun, 1,2 L dapat masuk sebelum tekanan intralumina mulai naik.
Volume sekret yang dihasilkan seharinya antara 500-1000 ml hanya
beberapa milimeter disekresikan per jam, diantara waktu makan, namun saat
mempertahankan lingkungan intern yang optimal untuk proteolisis oleh
pepsin yang aktif pada pH 2 (Guyton, 2008).
Sekresi asam basal dipengaruhi oleh faktor kolinergik melalui nervus vagus
dan alkohol histaminergik melalui sumber lokal di lambung. Sekresi asam
akibat perangsangan dihasilkan dalam tiga fase yang berbeda tergantung
sumber rangsang. Fase sefalik melalui perangsangan nervus vagus. Fase
gastric terjadi pada saat makanan masuk ke dalam lambung, komponen
sekresi adalah kandungan makanan, yang merangsang sel G untuk
melepaskan gastrin yang selanjutnya mengaktifasi sel parietal. Fase terakhir,
intestinal sekresi asam lambung dimulai pada saat makanan masuk ke dalam
usus dan diperantarai oleh adanya peregangan usus dan pencampuran
kandungan makanan yang ada (Tarigan, 2007).
Ada tiga jenis sel eksokrin yang ditemukan di dinding kantung dan kelenjar
oksintik mukosa lambung, yaitu:
1. Sel mukus yang melapisi kantung lambung, yang menyekresikan mukus
yang encer.
2. Bagian yang paling dalam dilapisi oleh sel utama (chief cell) dan sel
parietal. Sel utama menyekresikan prekursor enzim pepsinogen.
3. Sel parietal (oksintik) mengeluarkan HCl dan faktor intrinsik. Oksintik
artinya tajam, yang mengacu kepada kemampuan sel ini untuk
menghasilkan keadaan yang sangat asam. Semua sekresi eksokrin ini
dikeluarkan ke lumen lambung dan mereka berperan dalam
Sel mukus cepat membelah dan berfungsi sebagai sel induk bagi semua sel
baru di mukosa lambung. Sel-sel anak yang dihasilkan dari pembelahan sel
akan bermigrasi ke luar kantung untuk menjadi sel epitel permukaan atau
berdiferensiasi ke bawah untuk menjadi sel utama atau sel parietal. Melalui
aktivitas ini, seluruh mukosa lambung diganti setiap tiga hari (Sherwood,
2010).
Lambung dapat diserang oleh beberapa faktor endogen dan faktor eksogen
yang berbahaya. Sebagai contoh faktor endogen adalah asam hidroklorida
(HCl), pepsinogen/pepsin, dan garam empedu, sedangkan contoh substansi
eksogen yang dapat menyebabkan kerusakan mukosa lambung adalah
seperti obat, alkohol, dan bakteri. Sistem biologis yang kompleks dibentuk
untuk menyediakan pertahanan dari kerusakan mukosa dan untuk
memperbaiki setiap kerusakan yang dapat terjadi (Kasper et al., 2008).
Sistem pertahanan dapat dibagi menjadi tiga tingkatan sawar yang terdiri
dari preepitel, epitel, dan subepitel. Pertahanan lini pertama adalah lapisan
mukus bikarbonat, yang berperan sebagai sawar psikokemikal terhadap
beberapa molekul termasuk ion hidrogen. Mukus dikeluarkan oleh sel epitel
permukaan lambung. Mukus tersebut terdiri dari air (95%) dan
pencampuran dari lemak dan glikoprotein. Fungsi gel mukus adalah sebagai
lapisan yang tidak dapat dilewati air dan menghalangi difusi ion dan
molekul seperti pepsin. Bikarbonat, dikeluarkan sebagai regulasi di bagian
(pH) yang berkisar dari 1 sampai 2 pada lapisan lumen dan mencapai 6
sampai 7 di sepanjang lapisan epitel sel (Kasper et al., 2008).
Lapisan sel epitel berperan sebagai pertahanan lini selanjutnya melalui
beberapa faktor, termasuk produksi mukus, tranpoter sel epitel ionik yang
mengatur pH intraselular dan produksi bikarbonat dan taut erat intraselular.
Jika sawar preepitel dirusak, sel epitel gaster yang melapisi sisi yang rusak
dapat bermigrasi untuk mengembalikan daerah yang telah dirusak
(restitution). Proses ini terjadi dimana pembelahan sel secara independen
dan membutuhkan aliran darah yang tidak terganggu dan suatu pH alkaline
di lingkungan sekitarnya. Beberapa faktor pertumbuhan (growth factor)
termasuk epidermal growth factor (EGF), transforming growth factor
(TGF)α dan basic fibroblast growth factor (FGF), memodulasi proses
pemulihan. Kerusakan sel yang lebih besar yang tidak secara efektif
diperbaiki oleh proses perbaikan (restitution), tetapi membutuhkan
proliferasi sel. Regenerasi sel epitel diregulasi oleh prostaglandin dan faktor
pertumbuhan (growth factor) seperti EGF dan TGF α. Bersamaan dengan
pembaharuan dari sel epitel, pembentukan pembuluh darah baru
(angiogenesis) juga terjadi pada kerusakan mikrovaskular. Kedua faktor
yaitu FGF dan VEGF penting untuk meregulasi angiogenesis di mukosa
B. Gynura Procumbens
1. Klasifikasi
Klasifikasi tanaman Gynura procumbens (sambung nyawa):
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Asterales
Suku : Compositae
Marga : Gynura
Jenis : Gynura procumbens (Lour) Merr (Winarto et al., 2004).
2. Deskripsi
Sambung nyawa (Gynura procumbens) sebenarnya sudah lama dikenal baik
oleh masyarakat sebagai tanaman obat dan banyak diminati oleh para
pengobat herbal maupun sebagian peminat tanaman obat. Namun, nama
tanaman ini masih rancu karena sering dikelirukan dengan tanaman daun
dewa (Gynura pseudochina DC) yang masih dalam satu famili (Winarto,
2004).
Dalam penamaan Indonesia, sambung nyawa sering disebut daun dewa atau
sebaliknya daun dewa sering disebut daun sambung nyawa. Selain itu, juga
ada yang menyebut sambung nyawa sebagai ngokilo dan daun dewa sebagai
umbi dewa. Namun, adanya kontak antara petani tanaman obat dan para
diterima atau dimengerti bahwa perbedaan yang paling menonjol antara
daun dewa dengan daun sambung nyawa adalah daun sambung nyawa tidak
[image:35.595.201.481.193.361.2]memiliki umbi sedangkan daun dewa memiliki umbi (Winarto, 2004).
Gambar 6. Gynura procumbens (Sumber: Winarto, 2004)
Habitat asli tumbuhan ini berada di hutan, termasuk pada semak belukar.
Walaupun pada dasarnya tanaman ini hidup pada ketinggian 1-1200 meter
diatas permukaan laut. Namun akan tumbuh baik pada ketinggian 300-500
meter di atas permukaan laut, namun dengan naungan khusus tanaman ini
dapat tumbuh baik pada ketinggian 100-300 meter di atas permukaan laut
(Winarto, 2004).
Tumbuhan ini merupakan tumbuhan semak semusim dengan tinggi sekitar
20-60 cm. Berbatang lunak dengan penampang bulat dan berwarna ungu
kehijauan. Berdaun tunggal, berbentuk bulat telur, berwarna hijau, tepi daun
rata atau agak bergelombang, serta panjangnya dapat mencapai 15 cm dan
meruncing, serta pertulangan menyirip. Tumbuhan sambung nyawa berakar
serabut dan tidak berbunga (Suharmiati & Maryani, 2006).
Akan sedikit harum apabila daun tanaman ini dimemerkan. Batangnya lunak
dan cenderung roboh. Pada bagian batang yang menempel ke tanah,
biasanya terbentuk akar. Batangnya bersegi agak lunak dan berair, hanya
sedikit berkayu. Pada bagian ujung tidak berbulu atau berbulu jarang,
bercabang, dan berwarna hijau muda. Panjangnya sampai 3 meter atau lebih
(Winarto, 2004).
3. Kandungan Kimia Sambung nyawa
Tanaman sambung nyawa terbukti mengandung flavonoid, sterol tak jenuh,
triterpenoid, polifenol, saponin, steroid, asam klorogenat, asam kafeat, asam
vanilat, asam para kumarat, asam para hidroksi benzoat, dan minyak atsiri.
Lebih spesifik lagi, dari hasil uji isolasi flavonoid dilaporkan keberadaan 2
macam senyawa flavonoid, yaitu kaemferol (suatu flavonol), flavonol, dan
auron diduga juga keberadaan isoflavon dengan gugus hidroksil pada posisi
6 atau 7, 8 (cincin A) tanpa gugus hidroksil pada cincin B pada kandungan
daun sambung nyawa (Sugiyanto et al., 1993).
Secara in vivo, flavonoid yang terabsorbsi akan aktif menghambat radikal
bebas yang diakibatkan oleh sitotoksisitas oleh peroksidasi. Secara in vitro,
flavonoid menghambat peroksidasi lemak, pada tahap inisiasi berperan
sebagai pengikat anion superoksida dan radikal hidroksil. Reaksi radikal
pada radikal peroksida membentuk radikal flavonoid sekaligus mengakhiri
rantai reaksi. Flavonoid juga dapat menghambat superoksidasi fenton, yaitu
sumber penting radikal O2 aktif. Flavonoid telah dilaporkan dapat
mengkelat ion besi (Fe++) dan membentuk kompleks inert/lambat yang
tidak dapat menginisiasi lipid peroksidasi (Middleton et al., 2000).
Daun mengandung 4 senyawa flavonoid, tanin, saponin, steroid
(triterpenoid). Metabolit yang terdapat dalam ekstrak yang larut dalam
etanol 95% antara lain asam klorogenat, asam kafeat, asam vanilat, asam
kumarat, asam hidroksi benzoat. Hasil analisis kualitatif dengan metode
kromatografi lapisan tipis dapat dideteksi keberadaan sterol, triterpen,
senyawa fenolik (antara lain flavonoid), polifenol, dan minyak atsiri.
Komponen minyak atsiri paling sedikit terdiri dari 6 senyawa monoterpen, 4
senyawa seskuiterpen, 2 macam senyawa dengan ikatan rangkap, 2 senyawa
dengan gugus aldehida dan keton. Hasil penelitian dalam upaya isolasi
flavonoid dilaporkan keberadaan 2 macam senyawa flavonoid yaitu bercak
1 terdiri dari 2 buah senyawa flavonol dan auron; sedangkan pada bercak 11
diduga kaemferol (suatu flavonol). Senyawa yang terkandung dalam etanol
daun antara lain flavonol (3-hidroksi flavon) dengan gugus hidroksil pada
posisi 4,7 dan 6 atau 8 dengan substitusi gugus 5 hidroksi. Bila senyawa
tersebut suatu flavonol, maka gugus hidroksil pada posisi 3 dalam keadaan
tersubstitusi. Di samping itu diduga keberadaan isoflavon dengan gugus
hidroksil pada posisi 6 atau 7,8 (cincin A) tanpa gugus hidroksil pada cincin
Namun, kandungan flavonoid daun sambung nyawa yang diberikan dengan
dosis toksik akan memiliki efek penghambatan terhadap lipoksigenase dan
siklooksigenase. Sebagai salah satu produk dari jalur siklooksigenase,
prostaglandin memiliki efek protektif terhadap lambung. Berkurangnya
prostaglandin akan menyebabkan penurunan produksi mukus, fosfolipid,
sekresi HCO3-, proliferasi sel mukosa, dan aliran mikrovaskular lambung.
Hal ini menyebabkan diskontinuitas di epitel mukosa lambung atau bahkan
lebih dalam, yang dikenal dengan tukak (ulkus) lambung. Mekanisme
tersebut mungkin sebagai penyebab tukak lambung setelah pemberian
ekstrak etanol daun sambung nyawa (Astri et al., 2012).
4. Manfaat Sambung nyawa
Tanaman ini sering digunakan sebagai obat maupun makanan untuk
kesehatan, dapat berupa lalapan maupun berupa kapsul atau teh. Di Jawa
Barat, masyarakat Sunda sering mengkonsumsi sambung nyawa sebagai
lalapan (Suharmiati & Maryani, 2006).
Secara tradisional, sambung nyawa digunakan sebagai obat penyakit ginjal,
infeksi kerongkongan, menghentikan pendarahan, dan penawar racun akibat
gigitan binatang berbisa. Skrining fitokimia daun sambung nyawa diduga
berkhasiat sebagai anti kanker, antara lain kanker kandungan, kanker
payudara, dan kanker darah (Winarto, 2004).
Berdasarkan penelitian-penelitian yang telah dilakukan menunjukkan bahwa
sambung nyawa oleh sebagian masyarakat Indonesia digunakan sebagai
obat kanker rahim, payudara dan kanker darah dengan memakan 3 lembar
daun segar sehari selama 7 hari. Pengobatan tersebut dapat diperpanjang
selam 1-3 bulan tergantung keadaan penyakit (Meiyanto, 1996). Penelitian
Sugiyanto et al., (1993) melaporkan bahwa ekstrak etanolik daun sambung
nyawa menghambat pertumbuhan tumor paru pada mencit yang diinduksi
benzo[a]piren. Selain itu, ekstrak etanolik daun sambung nyawa terbukti
menghambat pertumbuhan sel Myeloma (CCRC, 1998) dan dapat
menghambat pertumbuhan kanker payudara tikus yang diinduksi DMBA
(Meiyanto et al., 2007).
Menurut penelitian Sugiyanto et al. (2003), fraksi etil asetat ekstrak etanolik
sambung nyawa mengandung senyawa flavonoid yang mengarah pada
golongan favon atau flavonol. Senyawa flavonoid yang ditemukan pada
fraksi heksana-etil asetat XIX dan XX ekstrak etanolik daun sambung
nyawa (Meiyanto & Septisetyani, 2005) mempunyai nilai IC50 sebesar 119
μg/ml terhadap sel kanker leher rahim HeLa. Selain itu, senyawa flavonoid
yang ditemukan dalam fraksi heksan-etil asetat XII dan XIII ekstrak etanolik
daun sambung nyawa mampu menghambat sel kanker payudara T47D
dengan IC50 sebesar 80 μg/ml (Winarto, 2004).
Akiyama et al. (2001) menyatakan bahwa senyawa astringen dari tanin yang
terkandung dalam sambung nyawa dapat merangsang pembentukan
kompleks senyawa ikatan tubuh terhadap enzim atau substrat mikroba
lain yang dilakukan oleh Lia Angelin Adriana pada tahun 2006
menunjukkan bahwa ekstrak umbi sambung nyawa dapat meningkatkan
peningkatan sel imunitas tubuh (makrofag) yang terinfeksi oleh Salmonella
typhimurium (Akiyama et al., 2001).
C. Uji Toksisitas
Uji toksisitas adalah suatu pengujian pendahuluan untuk mengamati suatu
aktivitas farmakologi suatu senyawa. Prinsip uji toksisitas merupakan
pengujian terhadap komponen bioaktif selalu bersifat toksik jika diberikan
dengan dosis tinggi dan apabila diberikan dengan dosis rendah maka akan
menjadi obat. Zat atau senyawa asing yang ada di lingkungan dapat terserap
ke dalam tubuh secara difusi dan langsung dan akan memengaruhi
kehidupannya. Uji toksisitas digunakan untuk mengetahui pengaruh racun
yang dihasilkan oleh dosis tunggal dari suatu campuran zat kimia pada
hewan coba sebagai uji pra skrining senyawa bioaktif antikanker
(Hamburger & Hostettmann, 1991).
Menurut bentuknya toksisitas dapat dibagi menjadi 2 bentuk, toksisitas
umum (akut, subakut/subkronis, kronis) dan toksisitas khusus (teratogenik,
mutagenic, dan karsinogenik). Dalam uji toksisitas juga perlu dibedakan
obat tradisional yang dipakai secara singkat dan yang dipakai dalam jangka
Pengujian toksisitas dapat dibagi menjadi tiga kelompok yaitu:
1. Uji toksisitas akut
Pengujian ini dilakukan dengan memberikan zat kimia yang sedang
diuji sebanyak satu kali atau lebih dalam jangka waktu 24 jam.
2. Uji toksisitas jangka pendek (sub kronik)
Pengujian ini dilakukan dengan memberikan zat kimia yang sedang
diuji tersebut berulang – ulang, biasanya setiap hari, atau lima kali
seminggu, dalam jangka waktu sekitar 10% dari masa hidup hewan,
yaitu 3 bulan untuk tikus atau 1 atau 2 tahun untuk anjing.
3. Uji toksisitas jangka panjang (kronik).
Percobaan jenis ini mencakup pemberian zat kimia secara berulang
selama 3-6 bulan atau seumur hewan, misalnya 18 bulan untuk mencit,
24 bulan untuk tikus atau 7-10 tahun untuk anjing dan monyet (Radji,
2008).
1. Uji Toksisitas Akut
Uji toksisitas akut merupakan pengujian untuk menentukan dan mengamati
dosis lethal (LD50), LD50 merupakan dosis tunggal suatu zat yang secara
statistik diharapkan dapat membunuh 50% hewan percobaan. Uji toksisitas
akut ini dilakukan dengan memberikan zat kimia yang sedang diuji
sebanyak satu kali selama masa pengujian dan diamati dalam jangka waktu
minimal 24 jam atau lebih (7-14 hari). Uji toksisitas akut bertujuan untuk
mengamati efek toksik suatu senyawa yang bisa terjadi dalam jangka waktu
empat peringkat dosis yang dianjurkan dalam pengujian toksisitas akut,
dosis tersebut berkisar dari dosis terendah yang tidak atau hampir tidak
mematikan seluruh hewan uji sampai dengan dosis tertinggi yang dapat
mematikan seluruh atau hampir seluruh hewan uji. Biasanya pengamatan
dilakukan selama 24 jam, kecuali pada kasus tertentu selama 7-14 hari.
Yang diamati pada pengujian ini seperti, gejala-gejala klinis, nafsu makan,
bobot badan, keadaan mata dan bulu, tingkah laku, jumlah hewan yang mati,
serta histopatologi organ (Loomis, 1978).
Uji toksisitas akut dapat diperoleh gambaran kerugian yang terjadi akibat
peningkatan dosis tunggal dan bagaimana kematian dapat terjadi. Uji
toksisitas akut dapat memberikan gambaran tentang gejala-gejala ketoksikan
terhadap fungsi penting seperti gerak, tingkah laku, dan pernafasan yang
dapat menyebabkan kematian. LD50 dapat dihubungkan dengan Efektif
Dosis 50 (ED50) yaitu dosis yang secara terapeutik efektif terhadap 50 %
dari sekelompok hewan percobaan. Hubungan tersebut dapat berupa
perbandingan antara LD50 dengan ED50 dan disebut Indeks Terapeutik
(IT), yaitu suatu perbandingan antara dosis obat yang memberikan efek
terapi yang samar dengan dosis obat yang menyebabkan efek toksik yang
nyata. Dengan kata lain, semakin besar indeks terapeutik suatu obat makin
aman obat tersebut (Laurence & Bennet, 1995)
Faktor-faktor yang berpengaruh pada LD50 sangat bervariasi antara jenis
yang satu dengan jenis yang lain dan antara individu satu dengan individu
Spesies, strain dan keragaman individu
Setiap spesies dan strain yang berbeda memiliki sistem metabolism
dan detoksikasi yang berbeda juga. kemampuan bioaktivasi dan
toksikasi suatu zat setiap spesies akan berbeda. Semakin tinggi tingkat
keragaman suatu spesies dapat menyebabkan perbedaan nilai LD50
(Lu, 1995).
Perbedaan jenis kelamin
Perbedaan pada kelenjar endokrin merupakan faktor yang
mempengaruhi nilai LD50 pada uji toksisitas pada hewan uji coba
yang berbeda jenis kelamin. Hewan betina mempunyai sistem
hormonal yang berbeda dengan hewan jantan sehingga menyebabkan
perbedaan kepekaan terhadap suatu toksikan. Walaupun hewan jantan
dan betina yang sama dari strain dan spesies yang sama biasanya
bereaksi terhadap toksikan dengan cara yang sama, tetapi ada
perbedaan secara kuantitatif yang menonjol dalam kerentanan
terutama pada tikus (Lu, 1995).
Umur
Karena enzim untuk biotransformasi masih kurang dan fungsi ginjal
belum sempurna menyebabkam hewan-hewan yang lebih muda
memiliki kepekaan yang lebih tinggi terhadap obat. Sedangkan pada
hewan tua kepekaan individu meningkat karena fungsi
Berat badan
Penentuan dosis dalam pengujian toksisitas akut dapat didasarkan
pada berat badan. Pada spesies yang sama, berat badan yang berbeda
dapat memberikan nilai LD50 yang berbeda pula. Semakin besar berat
badan maka jumlah dosis yang diberikan semakin besar (Mutshler,
1991).
Cara pemberian
Dosis letal dipengaruhi pula oleh cara pemberian pemberian obat
melalui suatu cara yang berbeda pada spesies yang sama akan
memberikan hasil yang berbeda. Menurut Siswandono dan Bambang
pada tahun 1995, pemberian obat peroral tidak langsung
didistribusikan ke seluruh tubuh. Pemberian obat atau toksikan peroral
didistribusikan ke seluruh tubuh setelah terjadi penyerapan di saluran
cerna sehingga mempengaruhi kecepatan metabolisme suatu zat di
dalam tubuh (Mutshler, 1991).
Faktor Lingkungan
Faktor lingkungan yang mempengaruhi toksisitas akut antara lain
temperatur, kelembaban, iklim, perbedaan siang dan malam.
Perbedaan temperatur suatu tempat akan mempengaruhi keadaan
fisiologis suatu hewan (Ganong, 2002).
Kesehatan hewan
Status hewan dapat memberikan respon yang berbeda terhadap suatu
toksik. Kesehatan hewan sangat dipengaruhi oleh kondisi hewan dan
yang berbeda dibandingkan dengan nilai LD50 yang didapatkan dari
hewan sehat (Lu, 1995).
Diet
Komposisi makanan akan mempengaruhi status kesehatan hewan
percobaan. Defisiensi zat makanan tertentu dapat mempengaruhi nilai
LD50. Pemberian makan pada tikus harus mencakupi konsumsi pakan
per hari sebesar 5 gr/100grBB, konsumsi air minum per hari sebsar
8-11 ml/100grBB, dan diet protein sebesar 12% (Ganong, 2002)
Tujuan dilakukannya uji toksisitas akut adalah untuk menentukan potensi
ketoksikan akut dari suatu senyawa dan untuk menentukan gejala yang
timbul pada hewan coba (Loomis TA, 1978).
Untuk uji toksisitas akut obat tradisional perlu dilakukan pada
sekurang-kurangnya satu spesies hewan coba biasanya spesies pengerat yaitu mencit
atau tikus (Lu, 1995). Sampel hewan coba untuk masing-masing kelompok
perlakuan perlu mencukupi jumlahnya untuk memungkinkan estimasi
insiden dan frekuensi efek toksik. Biasanya digunakan 4 – 6 kelompok
hewan coba (Depkes, 2000).
2. Uji toksisitas Sub Kronik
Uji toksisitas subkronis adalah pengujian ketoksisan suatu senyawa pada
suatu hewan coba sekurang-kurangnya tiga bulan pemberian. Uji ini
untuk memperlihatkan apakah spektrum efek toksik itu berkaitan dengan
takaran dosis (Donatus, 2001).
Pengamatan dan pemeriksaan yang dilakukan dari uji ketoksikan subkronis
meliputi:
1. Perubahan berat badan yang diperiksa paling tidak tujuh hari sekali.
2. Masukan makanan untuk masing-masing hewan atau kelompok
hewan yang diukur paling tidak tujuh hari sekali.
3. Gejala kronis umum yang diamati setiap hari.
4. Pemeriksaan hematologi paling tidak diperiksa dua akhir uji coba.
5. Pemeriksaan kimia darah paling tidak dua kali pada awal dan akhir uji
coba.
6. Analisis urin paling tidak sekali.
7. Pemeriksaan histopatologi organ pada akhir uji coba (Loomis, 1978).
Hasil uji ketoksikan subkronis akan memberikan informasi yang bermanfaat
tentang efek utama senyawa uji dan organ sasaran yang dipengaruhinya.
Selain itu juga dapat diperoleh info tentang perkembangan efek toksik yang
lambat berkaitan dengan takaran yang tidak teramati pada uji ketoksikan
akut. Kekerabatan antar kadar senyawa pada darah dan jaringan terhadap
perkembangan luka toksik dan keterbalikan efek toksik. (Donatus, 2001)
Tujuan utama dari uji ini adalah untuk mengungkapkan dosis tertinggi yang
diberikan tanpa memberikan efek merugikan serta untuk mengetahui
pengaruh senyawa kimia terhadap badan dalam pemberian berulang (Eatau
BAB III
METODOLOGI PENELITIAN
A. Rancangan Penelitian
Rancangan penelitian dalam penelitian ini menggunakan rancangan
eksperimental dengan Post Test Only Control Group Design. Desain ini
menggunakan 2 kelompok subyek, kelompok satu diberi perlakuan
eksperimental (kelompok eksperimen) dan yang lain tidak diberi perlakuan
(kelompok kontrol). Dari desain ini efek suatu perlakuan terhadap variabel
dependen akan dilakukan pengujian dengan cara membandingkan keadaan
variabel dependen pada kelompok eksperimen dengan kelompok kontrol.
1. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada Juni–Desember 2014, bertempat di
Laboratorium Kimia Organik Jurusan Kimia Fakultas MIPA Universitas
Padjadjaran dalam proses pembuatan ekstrak. Perawatan dan perlakuan
sampel bertempat di Laboratorium Farmakologi Fakultas Kedokteran
Universitas Lampung. Pemeriksaan histopatologis pada sel epitel
lambung tikus putih jantan galur Sprague dawley dilakukan di Balai
B. Sumber Data
Berdasarkan rancangan penelitian, maka sampel (tikus) dalam penelitian ini
berjumlah 30 ekor dan dibagi dalam lima kelompok yang tidak berpasangan,
yaitu satu kelompok kontrol dan empat kelompok perlakuan. Kelompok
kontrol mendapat pemberian akuades. Kelompok pertama dikenai perlakuan
pemberian ekstrak daun sambung nyawa sebanyak 500 mg/kgBB, kelompok
kedua dikenai perlakuan pemberian ekstrak daun sambung nyawa sebanyak
1000 mg/kgBB, kelompok ke-3 dikenai perlakuan pemberian ekstrak daun
sambung nyawa sebanyak 1500 mg/kgBB dan kelompok ke-4 dikenai
perlakuan pemberian ekstrak daun sambung nyawa sebanyak 2000
mg/kgBB (Gofur et al., 2009).
1. Besar Sampel
Untuk menghitung jumlah sampel yang akan diuji, dapat menggunakan
rumus federer sebagai berikut:
Dari rumus di atas diketahui perhitungan besaran sampel sebagai
berikut: t = 5, maka didapatkan:
(n-1)(t-1) ≥ 15
(n-1)(5-1) ≥ 15
(n-1)4 ≥ 15
(4n-4) ≥ 15
n ≥ 19/4
n ≥ 4.75
n ≥ 5
Dari hasil perhitungan tersebut diketahui bahwa sampel yang digunakan
pada penelitian ini berjumlah 5 ekor per kelompok. Maka jumlah sampel
yang digunakan unutuk percobaan ini adalah sebanyak 25 ekor tikus. Untuk menghindari drop out pada sampel ditambahkan sehingga jumlah
sampel menjadi 6 ekor per kelompok. Jadi jumlah sampel seluruhnya
adalah 30 ekor.
2. Kriteria sampel
Sampel yang digunakan pada penelitian ini adalah tikus putih jantan
(Sprague dawley) yang memenuhi kriteria sebagai berikut:
Kriteria inklusi:
a. Tikus putih jantan dewasa (Sprague dawley)
b. Umur 8 minggu
c. Berat badan tikus 180 – 200 gram
d. Kesehatan umum baik
Kriteria ekslusi: Tikus sakit
Kriteria drop out: Tikus mati saat penelitian
C. Identifikasi Variabel
1. Variabel Bebas: Ekstrak daun sambung nyawa 500 mg/kgBB, 1000
2. Variabel Tergantung: Gambaran histopatologis lambung tikus putih.
3. Variabel terkendali:
a. Galur tikus: Tikus putih (Sprague dawley)
b. Umur tikus: 8 minggu
c. Jenis kelamin tikus: Jantan
d. Berat badan tikus: 180 - 200 gram
D. Definisi Operasional
Tabel 1. Definisi operasional
Variabel Definisi Skala
Dosis ekstrak etanol 96 % daun sambung nyawa
Gambaran histopatologi lambung tikus
Dosis efektif tengah ekstrak etanol daun sambung nyawa adalah 200 mg/KgBB.
Kelompok I (kontrol negatif)=pemberian aquadest
Kelompok II (perlakuan coba)=pemberian ekstrak etanol daun sambung nyawa 500 mg/KgBB
Kelompok III (perlakuan coba)=pemberian ekstrak etanol daun sambung nyawa 1000 mg/KgBB.
Kelompok IV (perlakuan
coba)=pemberian ekstrak etanol daun sambung nyawa 1500 mg/KgBB
Kelompok V (perlakuan coba)=pemberian ekstrak etanol daun sambung nyawa 2000 mg/KgBB.
Gambaran kerusakan lambung tikus dilihat dengan melakukan pengamatan sediaan histopatologi menggunakan mikroskop cahaya dengan perbesaran 40x pada 10 lapang pandang, kerusakan lambung ditandai dengan adanya deskuamasi, erosi epitel mukosa, dan ulserasi epitel lambung. Kerusakan tiap lapangan pandang dinilai berdasarkan skor Barthel Manja
0. Tidak ada perubahan patologis 1. Kongesti pembuluh darah 2. Inflamasi
3. Degenerasi sel epitel (Astri et al., 2012).
Ordinal
E. Bahan dan alat penelitian
1. Bahan – bahan yang diperlukan untuk penelitian ini adalah:
1. Tikus putih jantan galur Sprague dawley
2. Ekstrak daun sambung nyawa (500 mg/kgBB, 1000 mg/kgBB,
1500 mg/kgBB, 2000 mg/kgBB)
3. Pakan standar mencit
4. Aquadest
5. Bahan untuk pembuatan preparat histopatologi
2. Alat – alat yang digunakan pada percobaan ini adalah:
1. Kandang mencit dan perlengkapannya
2. Sonde lambung
3. Seperangkat alat bedah minor untuk pengambilan organ tikus
4. Alat untuk pembuatan preparat histopatologi
5. Mikroskop
F. Jalannya Penelitian
1. Metode Pembuatan Ekstrak Etanol Daun Sambung nyawa
Daun sambung nyawa dibersihkan dengan air mengalir dan setelahnya
ditiriskan. Kemudian dijemur dengan ditutupi kain berwarna gelap
untuk menghindari kontak langsung dengan matahari. Setelah
didapatkan daun yang kering, kemudian daun dibuat serbuk dan diayak
serbuk diekstrak dengan cara maserasi menggunakan pelarut etanol
96% sebanyak 1,5 L. Pengadukan dilakukan sebanyak dua kali yaitu
pada pagi dan sore hari, setelah 3 x 24 jam dilakukan penyaringan.
Ampas proses tersebut kembali dimaserasi dengan pelarut etanol 96%
sebanyak 1,5 L. Proses maserasi dilakukan sebanyak tiga kali. Filtrat
yang diperoleh dikumpulkan kemudian diendapkan, lalu disaring untuk
selanjutnya diuapkan dengan pengurangan tekanan menggunakan
rotary evaporator hingga diperoleh ekstrak kental (Gofur et al., 2009).
2. Prosedur Pemberian Dosis Ekstrak Daun Sambung nyawa.
Penelitian yang telah dilakukan oleh Gofur et al. (2009), yang
menyatakan bahwa dosis 350 dan 700 mg/kgBB telah terbukti efektif
dalam menghambat pertumbuhan sel kanker maka dosis yang akan
digunakan pada penelitian diambil dari pertengahan dosis efektif yaitu
500mg/KgBB. Dosis untuk kelompok perlakuan kedua yang akan
digunakan yaitu 500mg/kgBB kemudian dosis kelompok perlakuan
ketiga hasil pengalian 2x dari dosis kedua, yaitu 1000 mg/kgBB,
sedangkan dosis kelompok perlakuan keempat adalah hasil pengalian
1,5x dari dosis kedua yaitu 1500 mg/kgBB, dan dosis kelompok
perlakuan kelima merupakan hasil pengalian 4x dosis kedua yaitu 2000
mg/kgBB (Gofur et al., 2009).
a. Dosis untuk tiap tikus kelompok II
500 mg/KgBB x 0,2 Kg(berat tikus) = 100 mg
1000 mg/KgBB x 0,2 Kg(berat tikus) = 200 mg
c. Dosis untuk tiap tikus kelompok IV
1500 mg/KgBB x 0,2 Kg(berat tikus) = 300 mg
d. Dosis untuk tiap tikus kelompok V
2000 mg/KgBB x 0,2 Kg(berat tikus) = 400 mg
Volume ekstrak etanol daun sambung nyawa diberikan secara peroral
sebanyak 1 ml yang merupakan volume yang boleh diberikan kepada
tikus mengingat bahwa volume maksimum dari lambung tikus adalah 3
sampai 5 ml. Apabila pemberian ekstrak melebihi volume maksimum
lambung tikus maka akan menyebabkan dilatasi lambung tikus akut
yang kemudian akan menyebabkan robeknya saluran cerna (Ngatidjan,
2006). Ekstrak etanol daum sambung nyawa akan disuspensikan dalam
aquades dengan suspensi agent CMC Na 0,5% kedalam mortir (Gofur
et al., 2009).
Larutan aquades yang perlu ditambahkan adalah sebanyak 200 ml,
maka ekstrak yang perlu ditambahkan adalah sebesar:
a. Untuk dosis 100 mg tiap 1 ml pada kelompok II
=
x = 20.000 mg
x = 20 gr
maka ekstrak yang perlu ditambahkan dalam 200 ml aquades
adalah 20 gr
=
X= 40.000 mg
X = 40 gr
maka ekstrak yang akan ditambahkan dalam 200 ml aquades
adalah sebanyak 40 gr.
c. Untuk dosis 300 mg tiap 1 ml (kelompok IV)
=
X= 60.000 mg
X = 60 gr
maka ekstrak yang akan ditambahkan dalam 200 ml aquades
adalah 60 gr.
d. Untuk dosis 400 mg tiap 1 ml (kelompok V)
=
X= 80.000 mg
X = 80 gr
maka ekstrak yang akan ditambahkan dalam 200 ml aquades
adalah 80 gr.
3. Pengamatan
Tikus dibagi menjadi 5 kelompok yang terdiri dari 6 ekor setiap
kelompoknya. Kelompok perlakuan pertama hanya diberi aquadest.
Kelompok perlakuan kedua dilakukan pemberian ekstrak daun
dilakukan pemberian ekstrak daun sambung nyawa sebanyak 1000
mg/kgBB, kelompok perlakuan keempat dilakukan pemberian ekstrak
daun sambung nyawa sebanyak 1500 mg/kgBB, dan kelompok
perlakuan kelima diberi ekstrak sambung nyawa 2000 mg/kgBB.
Pemberian ekstrak pada kelompok perlakuan satu sampai dengan
empat adalah 3 kali dalam seminggu. Perlakuan tersebut dilakukan
selama 2 minggu. Pada hari keempat belas, semua hewan percobaan
dieliminasi dengan anastesi menggunakan chloroform. Selanjutnya
diproses dengan metode baku histologi, setelah itu dilakukan
pemeriksaan mikroskopis sesudah dilakukan pembuatan preparat
sesuai prosedur. Setiap mencit dibuat preparat lambung dan tiap
preparat dibaca dalam 5 lapangan pandang yaitu keempat sudut dan
bagian tengah preparat dengan perbesaran 100x dan 400x dengan
batasan jumlah sel 20 sel tiap lapang pandang. Sasaran yang dibaca
adalah perubahan struktur histologis mukosa yang mengalami erosi
pada lambung mencit karena sel epitel lambung peka terhadap
keadaan lingkungan pada lumen lambung.
G. Analisis data
Data yang diperoleh akan dianalisis dengan langkah-langkah sebagai berikut
1. Analisis Deskriptif
2. Uji Shapiro-Wilk, uji ini untuk mengetahui apakah data sudah
terdistribusi secara normal atau belum. Uji ini dilakukan apabila jumlah
sampel <50. Apabila data belum terdistribusi secara normal, maka perlu
3. Uji varians dengan Levene’s test. Uji ini bertujuan untuk menguji
apakah dua atau lebih kelompok data mempunyai varian data yang
sama atau tidak.
4. Uji Efek Perlakuan
Apabila data memenuhi syarat (terdistribusi normal dan varian data
sama) maka, digunakan uji statistik parametrik yaitu One Way Anova.
Jika variabel hasil transformasi tidak berdistribusi normal atau varians
tetap tidak sama, maka alternatifnya dipilih uji Kruskal-Wallis.
Jika pada uji One Way Anova menghasilkan nilai p<0,05, maka dilanjutkan
dengan melakukan analisis Least Significant Difference – test (LSD) Post
Hoc Test untuk mengetahui kelompok mana yang berbeda secara
bermakna. Apabila menggunakan uji Kruskal-Wallis dan menghasilkan
nilai p <0,05, maka lanjutkan dengan menggunakan uji Mann-Whitney
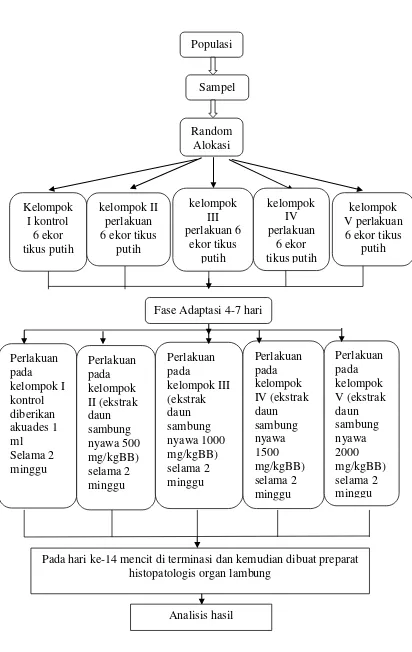
Gambar 7. Rancangan Penelitian. Populasi Sampel Random Alokasi Kelompok I kontrol 6 ekor tikus putih Perlakuan pada kelompok I kontrol diberikan akuades 1 ml Selama 2 minggu kelompok II perlakuan 6 ekor tikus
putih Perlakuan pada kelompok II (ekstrak daun sambung nyawa 500 mg/kgBB) selama 2 minggu kelompok III perlakuan 6 ekor tikus putih Perlakuan pada kelompok III (ekstrak daun sambung nyawa 1000 mg/kgBB) selama 2 minggu kelompok IV perlakuan 6 ekor tikus putih Perlakuan pada kelompok IV (ekstrak daun sambung nyawa 1500 mg/kgBB) selama 2 minggu kelompok V perlakuan
6 ekor tikus putih Perlakuan pada kelompok V (ekstrak daun sambung nyawa 2000 mg/kgBB) selama 2 minggu Fase Adaptasi 4-7 hari
Pada hari ke-14 mencit di terminasi dan kemudian dibuat preparat histopatologis organ lambung
H. Etika Penelitian
Penelitian ini telah diajukan ke Komisi Etik Peneletian Kesehatan Fakultas
Kedokteran Universitas Lampung, dengan menerapkan perinsip 3R dalam
protokol, yaitu:
1. Replacement, adalah keperluan memanfaatkan hewan percobaan
sudah diperhitungkan secara seksama, baik dari pengamatan terdahulu
maupun literatur untuk menjawab pertanyaan penelitian dan tidak
dapat digantikan oleh mahluk hidup lain seperti sel atau biakan
jaringan.
2. Reduction diartikan sebagai pemanfaatan hewan dalam penelitian
sesedikit mungkin, tetapi tetap mendapatkan hasil yang optimal.
3. Refinement adalah memperlakukan hewan percobaan secara
manusiawi memelihara hewan dengan baik, tidak menyakiti hewan,
serta meminimalisasi perlakuan yang menyakitkan sehingga menjamin
BAB V
SIMPULAN dan SARAN
A. Simpulan
Pemberian ekstrak etanol 96% daun sambung nyawa tidak menunjukkan
kerusakan gambaran histopatologis organ lambung pada tikus putih galur
Sprague dawley.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut dengan kontrol yang ketat terhadap
jalannya penelitian.
2. Perlu dilakukan penelitian lebih lanjut mengenai dosis toksisitas sub akut
dan kronis dari ekstrak etanol daun sambung nyawa.
DAFTAR PUSTAKA
Akiyama, HF., Iwatsuki, T. 2001. Antibacterial action of several tennis agains Staphylococcus aureus. J of Antimicrobial Chemo. 48:487-91
Arivazhagan, P., Thilakavathy, T., dan Panneerselvam, P. 2000. Antioxidant lipoate and tissue antioxidants in aged rats. Journal of Nutritional Biochemistry. 11: 122-7.
Astri, Y., Truly, S., Joseph, I., Sigit, Muchtan, S. 2012. Toksisitas akut peroral ekstrak etanol daun dewa (Gynura procumbens (Lour.) Mer) terhadap kondisi lambung tikus jantan dan betina galurwistar. MKB. 44(1):38 - 43
Depkes RI. 1995. Materia Medika Indonesia Jilid VI. Departemen Kesehatan Republik Indonesia. Jakarta.
Depkes RI. 2000. Parameter Standar Umum Ekstrak Tanaman Obat. Departemen Kesehatan Republik Indonesia. Jakarta.
Depkes RI. 2008. Profil Pengendalian Penyakit dan Penyehatan Lingkungan.Departemen Kesehatan Republik Indonesia. Jakarta.
Donatus, I.A. 2001. Toksikologi Dasar. Laboratorium Farmakologi dan Toksikologi. Yogyakarta: Fakultas Farmasi UGM.
Eatau, D.L., Klaassen C.D. 2001. Principle of Toxicology. Casarett and Doull’s Toxicology : The Basic Science of Poison. Ed 6. New Yorks: Mc. Graw Hill.
Eroschenko, V.P. 2010. Atlas Histologi Difiore. ed 11. Jakarta: EGC.
Gofur, A., Iwan, S.H., Edy, M. 2009. Ekspresi CYP1A1 dan GST serta mutasi gen p53 dan H-setelah induksi 7,12-dimethyl benz(a)antrasen (DMBA) dan pemberian antikarsiogenesis Gynura procumbens pada tikus galur Sprague dawley. Seminar Nasional Biologi XX dan Kongres PBI XIV UIN Maliki Malang. hlm.20-5
Guyton, A.C., Hall J.E. 2008. Buku Ajar Fisiologi Kedokteran, ed 6. Jakarta: EGC.
Hamburger, M.K., Hostettmann. 1991. Bioactivity in plants: the link between Phythochemistry and Medicine. Phytochemistry. 30:364-387.
Hollman, P.C. 2004. Absorbtion, bioavability, and metabolism of flavonoid. Pharmaceutical Biology. 42:74–83.
Kartasasmita, R.E., Rina, H., Nuraini, H., Tutus, G. 2009. Docking turunan kuersetin berdasarkan studi interaksi flavonoid terhadap enzim siklooksigenase-2. Indo. J. Chem. 9(2):297-302.
Kasper, D.L., Braunwald, E., Fauci, A.S. 2008. Endocrinology In Harrison’s Principle of Internal Medicine. ed 17. New Yorks: Mc. Graw Hill.
Laurence, D.R., Bennet P.N. 1995. Clinical Pharmacology. ed 7. London: Churchill Livingstone.
Loomis, T.A. 1978. Toksikologi Dasar, (eds) Imono Argo D. ed 3. Semarang: IKIP Semarang Press.
Lu, C.T. 1995. Toksikologi Dasar, Asas, Organ Sasaran, dan Penilaian Resiko. 3th ed. UI Press. Jakarta. 14-20.
Meiyanto, E. 1996, Efek antimutagenik beberapa fraksi ekstrak alkohol daun G. Procumbens (Lour.) Merr. Laporan penelitian. Fakultas Farmasi UGM. Yogyakarta.
Meiyanto, E., Susilowati, S., Tasminatun, S., Murwanti, R., Sugiyanto, 2007, Efek ekstrak etanolik gyynura procumbens (lour.) merr. terhadap Penghambatan pertumbuhan tumor payudara tikus yang diinduksi DMBA, Majalah Farmasi Indonesia. 18(4):169-175.
Meiyanto, E., Sri, T., Sugiyanto, S., Handayani. 2012. Ekstrak etanolik daun Gynura procumbens (Luor) Merr. menghambat proliferasi sel kanker payudara tikus pada karsiogenesis yang diinduksi dengan dimetilbenz(a)antrazena (DMBA). Jurnal Farmasi Indonesia Pharmacon. 1(13):12 – 15.
Middleton, E., Kandaswami, C. 2000. The effect of plant flavonoids on mammalian cells: implications for inflammation, heart disease, and cancer. Am Soc PharmacolExp Ther. 52(4): 673.
Moore, K.L., Anne, M.R. 2012. Anatomi Klinis Dasar. Jakarta: Hipokrates.
Muminarsi. 2012. Ilmu obat dan obat tradisional. Karya Tulis Ilmiah. Sekolah Tinggi Ilmu Kesehatan. Sorong.
Mutshler, E. 1991. Buku Ajar Farmakologi dan Toksikologi. Ed 5. Bandung: Institut Teknologi Bandung Press. hlm.736 - 40.
Ngatidjan. 2006. Metode Laboratorium Dalam Toksikologi. Penerbit Bagian Farmakologi dan Toksikologi Fakultas Kedokteran Universitas Gajah Mada. Yogyakarta.
Oemiati, R., Ekowati, R., Antonius, Y.K. 2011. Pravalensi tumor dan faktor yang mempengaruhinya di indonesia. Badan Penelitian dan Pengembangan Kesehatan.39(1):190-204.
Price, S.A., Lorraine, M. W., 2006. Patofisiologi : Konsep Klinis Proses-Proses Penyakit. Jakarta: EGC.
Radji, M. 2008. Harmita dan M. Radji. 2008. Buku Ajar Analisis Hayati Edisi 3. , Jakarta: EGC.
Ranggiasanka, A. 2010. Waspada Kanker Pada Pria dan Wanita. Yogyakarta: Hanggar Kreator.
Ridwan, E. 2013. Etika Pemanfaatan Hewan Percobaan dalam Penelitian Kesehatan. J Indon Med Assoc. 63(3):112-6.
Risser. 1996. Cancer incidence and mortality in urban vs rural areas of Texas. Texas Medical. 92(1):58-61.
Rosidah, Mun, F., Amirin, A., Gabriel, A., Zaini, A. 2009. Toxicology evaluation of standardized methanol extract of Gynura procumbens. Journal Of Ethnopharmacology. hlm. 244 – 249.
Schmitz, P., Kevin, J. 2008. Internal Medici