BAGI PERTUMBUHAN IKAN GURAME (
Osphronemus
gouramy
Lac.) SEJALAN DENGAN PERUBAHAN ENZIM
PENCERNAAN DAN INSULIN
SRI HANDAYANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BAGI PERTUMBUHAN IKAN GURAME (
Osphronemus
gouramy
Lac.) SEJALAN DENGAN PERUBAHAN ENZIM
PENCERNAAN DAN INSULIN
SRI HANDAYANI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Budidaya Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SRI HANDAYANI. Studi Efisiensi Pemanfaatan Karbohidrat Pakan Bagi Pertumbuhan Ikan Gurame (Osphronemus gouramy Lac.) Sejalan Dengan Perubahan Enzim Pencernaan dan Insulin. Dibimbing oleh MUHAMMAD ZAIRIN Jr., ING MOKOGINTA, MARIA BINTANG, dan AGUS OMAN SUDRAJAT.
Tiga tahap penelitian telah dilakukan untuk menentukan pakan yang sesuai dengan perubahan enzim dalam saluran pencernaan ikan gurame dan konsekuensi perubahan pakan untuk merangsang sekresi insulin untuk meningkatkan pertumbuhan dan efisiensi pemanfaatan karbohidrat pakan pada ikan gurame
Pada penelitian tahap I, ikan gurame diberi pakan dua kali sehari sampai ikan kenyang dengan pakan yang mengandung kadar protein dan karbohidrat yang berbeda . Penelitian ini dilakukan selama 60 hari. Hasil penelitian menunjukkan ikan yang mengkonsumsi pakan berkadar protein 32% menghasilkan aktivitas enzim protease yang lebih tinggi dibandingkan ikan yang mengkonsumsi pakan berkadar protein 28%. Peningkatan kadar karbohidrat pakan dari 20 sampai 50% tidak berpengaruh nyata terhadap aktivitas enzim protease. Pada ikan yang mengkonsumsi pakan berkadar protein 32%, peningkatan kadar karbohidrat pakan menghasilkan peningkatan aktivitas enzim α-amilase. Laju pertumbuhan dan efisiensi pemanfaatan pakan tertinggi juga dihasilkan ikan yang mengkonsumsi pakan berkadar protein 32%.
Penelitian tahap II dilakuan untuk mengetahui kemampuan ikan gurame dalam memanfaatkan karbohidrat. Uji toleransi glukosa dan uji toleransi insulin-glukosa pada ikan gurame yang diberi pakan yang sama sebagaimana penelitian tahap I. Ikan diberi pakan dua kali sehari sampai ikan kenyang selama 30 hari. Hasil penelitian menunjukkan ikan gurame mempunyai kemampuan yang cukup tinggi untuk meregulasi kadar glukosa darah dan mampu memanfaatkan karbohidrat pakan hingga 47 %.
Perlakuan pada penelitian tahap III didasarkan pada hasil penelitian tahap I dan II, dilakukan untuk mengevaluasi efisiensi pemanfaatan karbohidrat pakan bagi pertumbuhan sejalan dengan perubahan enzim pencernaan dan konsekuensi perubahan pakan terhadap sekresi insulin. Ikan diberi pakan dua kali sehari sampai ikan kenyang selama 80 hari. Hasil penelitian menunjukkan pemberian karbohidrat pakan secara bertahap berdasarkan ketersediaan enzim-enzim pencernaan, khususnya
SRI HANDAYANI. Study on The Efficiency of D ietary Carbohydrate Utilization for Growth of Giant Gouramy (Osphronemus gouramy Lac.) in Relation to Changing of Digestive Enzymes and Insulin. Supervised by MUHAMMAD ZAIRIN Jr., ING MOKOGINTA, MARIA BINTANG, and AGUS OMAN SUDRAJAT.
A three-stage experiment was conducted to investigate suitable diet in relation to changing of digestive enzymes and its consequence to stimulate insulin secretion to improve growth and efficiency of carbohydrate utilization of giant gouramy.
In the first stage , fish were fed twice daily to satiation with diets containing different levels of protein and carbohydrate. It was observed for 60 days. Results of the experiment indicated that fish fed diets containing 32% of dietary protein showed higher protease activity compared to those given 28% of dietary protein. Increasing levels of dietary carbohydrate from 20 to 50% , did not affect protease activity. Fish fed 32% of dietary protein, the increasing dietary carbohydrate levels caused increase of amylase activity. The highest growth rate and diet utilization efficiency were also observed in fish fed diets containing 32% of dietary protein.
In the second stage, the ability to utilize carbohydrate was evaluated. Fish were subjected to glucose tolerance and insulin-glucose tolerance tests after feeding trial with diets similar to those performed in stage one. Fish were fed twice daily to satiation for 30 days. Results of the experiment showed that the fish has high ability to regulate blood glucose and capable to utilize up to 47% of dietary carbohydrate.
Dengan ini saya menyatakan bahwa disertasi Studi Efisiensi Pemanfaatan Karbohidrat Pakan bagi Pertumbuhan Ikan Gurame (Osphronemus gouramy Lac.) Sejalan dengan Perubahan Enzim Pencernaan dan Insulin adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juli 2006
dan Insulin Nama : Sri Handayani NIM : C016010021
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Muhammad Zairin Jr., M.Sc. Ketua
Dr. Ir. Ing Mokoginta M.S. Anggota
Prof. Dr. Drh. Maria Bintang, M.S. Anggota
Dr. Ir. Agus Oman Sudrajat, M.Sc. Anggota
Diketahui
Ketua Program Studi Ilmu Perairan Dekan Sekolah Pascasarjana
Dr. Chairul Muluk, M.Sc. Dr. Ir. Khairil Anwar Notodiputro, M.S.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak Agustus 2003 sampai dengan Agustus 2005 ini berjudul Studi Efisiensi Pemanfaatan Karbohidrat Pakan bagi Pertumbuhan Ikan Gurame (Osphronemus gouramy Lac.) Sejalan Dengan Perubahan Enzim Pencernaan dan Insulin .
Selesainya karya ilmiah ini tak lepas dari bantuan dan dorongan dari berbagai pihak. Melalui prakata ini penulis mengucapkan terima kasih kepada : 1. Rektor Universitas Mulawarman dan Dekan Fakultas Perikanan dan Ilmu
Kelautan, Universitas Mulawarman yang telah memberikan kesempatan mengikuti pendidikan Program Doktor pada Sekolah Pascasarjana Institut Perta nian Bogor.
2. Rektor Institut Pertanian Bogor dan Dekan Sekolah Pascasarjana, Institut Pertanian Bogor yang berkenan menerima penulis melanjutkan pendidikan Program Doktor.
3. Departemen Pendidikan Nasional Republik Indonesia dalam hal ini Direktorat Jenderal Pendidikan Tinggi yang telah membiayai penulis selama mengikuti pendidikan melalui BPPS.
4. Pemerintah Propinsi Kalimantan Timur yang telah memberi bantuan biaya pendidikan selama penulis mengikuti pendidikan program Doktor.
5. Yayasan Dana Sejahtera Mandiri (DAMANDIRI) yang telah memberikan bantuan penyusunan disertasi.
6. Prof. Dr. Ir. Muhammad Zairin Jr. , M.Sc., Dr. Ir. Ing Mokoginta, M.S., Prof. Dr. drh. Maria Bintang, M.S., dan Dr. Ir. Agus Oman Sudrajat, M.Sc. , selaku komisi pembimbing atas segala petunjuk, saran, dan bimbingannya.
7. Dr. Chairul Muluk, M.Sc. dan Dr. Ir. Kardiyo Praptokardiyo, M.Sc yang telah banyak memberi saran untuk memperluas wawasan penulis.
9. Kepala dan staf Laboratorium Nutrisi Ikan, Laboratorium Lingkungan Departemen Budidaya Perairan, Laboratorium Limnologi Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Laboratorium Fisiologi dan Farmakologi Departemen Fisiologi dan Farmakologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor, yang telah memberi izin dan fasilitas selama penelitian.
10. Rekan-rekan dari For um Mahasiswa Pascasarjana Ilmu Perairan IPB dan Forum Mahasiswa Pascasarjana IPB asal Kalimantan Timur serta semua pihak atas kerjasamamya selama penulis mengikuti pendidikan di IPB. 11. Khusus kepada kedua orangtua saya H. Hasan Aini (Alm) dan Hj. Asliah
(Alm), mertua saya Supriadi (Alm) dan Indah Suhermi, suami saya Heru Kusdianto, S.Pi, M.Si, putra saya Muhammad Fikri Fa dhlurrahman, serta seluruh keluarga atas segala pengorbanan, dukungan, bantuan, pengertian, doa dan kasih sayangnya selama penulis mengikuti pendidikan di IPB.
Semoga segala bantuan yang diberikan mendapat pahala yang berlipat ganda dari Allah SWT.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2006
Penulis dilahirkan di Samarinda pada tanggal 10 September 1969 sebagai anak kedua dari pasangan H. Hasan Aini (Alm) dan Hj. Asliah (Alm). Pada tahun 1996 penulis menikah dengan Heru Kusdianto, S.Pi., M.Si. dan telah dikaruniai seorang putra bernama Muhammad Fikri Fadhlurrahman.
Pendidikan sarjana ditempuh di Program Studi Budidaya Perairan, Jurusan Perikanan, Fakultas Pertanian, Universitas Mulawarman, lulus pada tahun 1993. Pada tahun 1995, penulis diterima di Program Studi Ilmu Peraira n, Program Pascasarjana Institut Pertanian Bogor dan menamatkannya pada tahun 1997. Kesempatan untuk melanjutkan ke Program Doktor pada Program Studi dan Perguruan Tinggi yang sama diperoleh pada tahun 2001. Beasiswa pendidikan pascasarjana diperoleh da ri Departemen Pendidikan Nasional.
Penulis bekerja sebagai tenaga pengajar pada Fakultas Perikanan dan Ilmu Kelautan Universitas Mulawarman sejak tahun 1994.
Sebuah artikel berjudul : The effect of 3, 5, 3’-triiodotyronine (T3)
hormone on nucleic acid and protein content of the muscle and the growth of
ix Amilase, dan Lipase) pada Ikan Gurame yang Diberi Pakan yang Mengandung Kadar Protein dan Karbohidrat yang Berbeda ... 14
3.1.1 Pakan Uji... 14
3.1.2 Pemeliharaan Ikan... 15
3.1.3 Peubah yang Diamati... 16
3.1.4 Analisis Statistik... 18
3.2 Penelitian tahap II : Uji Toleransi Glukosa dan Uji Toleransi Insulin-Glukosa pada Ikan Gurame yang Diberi Pakan Mengandung Kadar Protein dan Karbohidrat yang Berbeda ... 18
3.2.1 Pakan Uji... 18
3.2.2 Pemeliharaan Ikan... 18
3.2.3 Peubah yang Diamati... 19
3.2.4 Analisis Statistik... 20
3.3 Penelitian tahap III : Efisiensi Pemanfaatan Karbohidrat Pakan bagi Pertumbuhan Ikan Gurame Sejalan dengan Perubahan Enzim Pencernaan Konsekuensi Perubahan Pakan Terhadap Insulin... 20
3.3. 1 Pakan Uji... 20
3.3.2 Pemeliharaan Ikan... 22
3.3.3 Peubah yang Diamati... 22
x
dan Karbohidrat yang Berbeda ... 25
4.1.1 Aktivitas Enzim Protease... 25
4.1.2 A ktivitas E nzim a-amilase... 26
4.1.3 Aktivitas Enzim Lipase... 27
4.1.4 Laju Pertumbuhan Harian dan Efisiensi Pakan... 29
4.1.5 Pembahasan... 30
4.2 Uji Toleransi Glukosa dan Uji Toleransi Insulin Glukosa pada Ikan Gurame yang Diberi Pakan Mengandung Kadar Protein dan Karbohidrat yang Berbeda ... 35
4.2.1 Kadar Glukosa Darah... 35
4.2.2 Kadar Trigliserida Darah... 37
4.2.3 Kadar Glikogen Otot dan Hati... 38
4.2.4 Kadar Insulin Darah... 39
4.2.5 Pembahasan... 40
4.3 Efisiensi Pemanfaatan Karbohidrat Pakan bagi Pertumbuhan Ikan Gurame Sejalan dengan Perubahan Enzim Pencernaan dan Konsekuensi Perubahan Pakan Terhadap Insulin... 47
4.3.1 Koefisien Kecernaan Nutrien Pakan... 47
4.3.2 Kadar Glukosa Darah, Insulin Darah, serta Glikogen Otot dan Hati... 49 4.3.3 Parameter Pemanfaatan Pakan... 51
4.3.4 Pembahasan... 52
V. KESIMPULAN DAN SARAN... 59
5.1 Kesimpulan... 59
5.2 Saran... 60
DAFTAR PUSTAKA... 61
xi Halaman
1. Komposisi pakan uji untuk ikan gurame pada penelitian tahap I... 15
2. Komposisi pakan uji untuk ikan gurame pada penelitian taha p III... 21
3. Laju pertumbuhan harian individu (Lph) dan ef isiensi pa kan pada ikan gurame selama 60 hari penelitian... 29
4. Rata-rata kadar glikogen otot dan hati ikan gurame pada uji toleransi glukosa dan uji toleransi insulin glukosa... 38
5. Kadar insulin darah pada uji toleransi glukosa... 39
6. Koefisien kecernaan nutrien pakan pada ikan gurame yang mengkonsumsi pakan yang mengandung karbohidrat berbeda ... 47
7. Kadar glukosa darah, insulin darah, serta kadar glikogen otot dan hati 49
xii Halaman
1. Aktivitas enzim protease (U/ml enzim) pada ikan gurame yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda ... 25
2. Perubahan relatif aktivitas enzim protease (%) pada ikan gurame yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda ... 26
3. Aktivitas enzim a-amilase (U/ml enzim) pada ikan gurame yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda ... 27
4. Perubahan relatif aktivitas enzim a -amilase (%) pada ikan gurame yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda ... 27
5. Aktivitas enzim lipase (U/ml enzim) pada ikan gurame yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda ... 28
6. Perubahan relatif aktivitas enzim lipase (%) pada ikan gurame yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda ... 29
7. Kadar glukosa darah ikan gurame selama uji toleransi glukosa... 35
8. Kadar glukosa darah ikan gurame selama uji toleransi insulin glukosa.... 36
9. Kadar trigliserida darah ikan gurame setelah injeksi glukosa... 37
xiii Halaman
1. Prosedur pengukuran aktivitas enzim protease... 67
2. Prosedur pengukuran aktivitas enzim α-amilase... 68
3. Prosedur pengukuran aktivitas enzim lipase... 69
4. Prosedur pengukuran glukosa darah... 70
5. Prosedur pengukuran glikogen hati dan otot... 71
6. Prosedur pengukuran trigliserida darah... 72
7. Prosedur pengukuran kadar insulin darah... 73
8. Aktivitas protease pada berbagai waktu pengamatan (U/ml)... 75
9. Aktivitas amilase pada berbagai waktu pengamatan (U/ml)... 76
10. Aktivitas lipase pada berbagai waktu pengamatan (U/ml)... 77
11. Laju pertumbuhan harian (Lph) dan efisiensi pakan ikan gurame yang dipelihara dengan pemberian pakan berbeda... 78
12. Kadar glukosa darah ikan gurame pada uji toleransi glukosa... 79
13. Kadar glukosa darah ikan gurame pada uji toleransi insulin glukosa... 81
14. Kadar trigliserida darah ikan gurame pada uji toleransi glukosa dan uji toleransi insulin glukosa... 83
15. Kadar glikogen hati dan otot ikan gurame pada uji toleransi glukosa... 84 16. Kadar glikogen hati dan otot ikan gurame pada uji toleransi insulin glukosa... 85 17. Kadar insulin darah ikan gurame pada uji toleransi glukosa... 86
xiv 20. Kadar glikogen hati dan otot ikan gurame yang dipelihara dengan
pemberian karbohidrat pakan yang disesuaikan dengan perubahan enzim pencernaan selama 80 hari... 89
21. Retensi protein (%) ikan gurame yang dipelihara dengan pemberian karbohidrat pakan yang disesuaikan dengan perubahan enzim pencernaan selama 80 hari... 90
22. Retensi lemak (%) ikan gurame yang dipelihara dengan pemberian karbohidrat pakan yang disesuaikan dengan perubahan enzim pencernaan selama 80 hari... 91
23. Retensi energi (%) ikan gurame yang dipelihara dengan pemberian karbohidrat pakan yang disesuaikan dengan perubahan enzim pencernaan selama 80 hari... 92
1.1 Latar B elakang
Ikan gurame (Osphronemus gouramy Lac.) merupakan salah satu ikan yang mempunyai nilai ekonomis tinggi. Namun, proses produksi dari hasil budidaya ikan gurame sampai saat ini belum berjalan dengan baik. Hal ini disebabkan pertumbuhan ikan gurame lebih lambat jika dibandingkan dengan jenis ikan air tawar lainnya. Rendahnya laju pertumbuhan ikan gurame dapat disebabkan oleh rendahnya efisiensi pemanfaatan materi dan energi yang terdapat dalam pakan yang diberikan sehingga energi yang tersedia tidak cukup bagi pertumbuhan.
Komponen pakan yang berkontribusi terhadap penyediaan materi dan energi untuk pertumbuhan adalah protein, karbohidrat, dan lemak. Protein merupakan sumber nutrien yang harganya cukup mahal, sehingga pemanfaatan protein untuk pertumbuhan harus efisien. Efisiensi pemanfaatan protein pakan dapat dilakukan dengan penyediaan sumber energi non protein dari karbohidrat dan lemak. Karbohidrat merupakan salah satu sumber energi yang murah, tetapi kemampuan ikan untuk memanfaatkan karbohidrat pakan terbatas.
Ikan gurame dalam tahap perkembangannya mengalami perubahan dari karakter ikan karnivora ke omnivora hingga akhirnya menjadi herbivora. Perubahan karakter ini dikaitkan dengan perubahan ukuran ikan dan komponen nutrien pakan yang dimakan oleh ikan (Affandi 1993). Perubahan nutrien pakan berpengaruh pada aktivitas enzim-enzim pencernaan, yang selanjutnya mempengaruhi efektivitas enzim dalam memanfaatkan pakan yang diberikan (Eusobio dan Coloso 2002; Garcia– Carreno et al. 2003). Perubahan karakter ikan gurame dari karnivora ke omnivora hingga ke herbivora menunjukkan adanya perbedaan kemampuan ikan dalam mencerna karbohidrat pakan pada setiap ukuran ikan.
Pada tingkat metabolik, tingkat pemanfaatan karbohidrat oleh ikan dipengaruhi oleh kemampuan sel dalam memanfaatkan glukosa yang diabsorbsi. Uji toleransi glukosa telah dilakukan pada beberapa spesies ikan untuk mempelajari pemanfaatan glukosa pada tingkat metabolik (Furuichi dan Yone 1981; Marini 1997; Peres et al. 1999; Stone et al. 2003a). Rendahnya toleransi glukosa pada ikan awalnya dianggap berkaitan dengan rendahnya sekresi insulin dan ikan mempunyai potensi untuk menjadi diabetik (Furuichi dan Yone 1981). Akan tetapi, penelitian selanjutnya menunjukkan bahwa ikan sebenarnya tidak diabetik dan kadar insulin darahnya sama seperti yang diamati pada mamalia (Mommsen dan Plisetskaya 1991). Namun demikian respons insulin terhadap suplai glukosa tidak secepat mamalia, sehingga membutuhkan waktu beberapa jam untuk berkembang (Furuichi dan Yone 1981; Peres et al. 1999).
ukuran ikan gurame sejalan dengan perubahan enzim pencernaan dan insulin belum diketahui dengan jelas.
Berdasarkan uraian tersebut diatas, dalam upaya meningkatkan efisiensi pemanfaatan karbohidrat pakan bagi pertumbuhan ikan gurame maka kiranya perlu untuk mengkaji :
1. Perubahan enzim pencernaan yang disebabkan oleh perbedaan pakan yang diberikan sebagai dasar untuk menentukan waktu pergantian kadar karbohidrat pakan yang tepat sesuai dengan ketersediaan enzim pencernaan. 2. Toleransi glukosa dan toleransi insulin glukosa untuk melihat respons
glukosa dan insulin darah terhadap suatu muatan glukosa. Kajian ini dapat dijadikan dasar untuk menentukan kemampuan ikan dalam memanfaatkan karbohidrat (glukosa).
3. Tingkat kebutuhan karbohidrat untuk memenuhi kebutuhan energi dan materi untuk tumbuh sejalan dengan perubahan enzim pencernaan dan insulin.
1 .2 Tujuan dan Manfaat
Penelitian ini bertujuan untuk menentukan pakan yang sesuai dengan perubahan dinamika enzim dalam saluran pencernaan ikan gurame dan konsekuensi perubahan pakan terhadap sekresi insulin bagi peningkatan efisiensi pemanfaatan pakan dan pertumbuhan ikan gurame.
Hasil penelitian ini diharapkan dapat digunakan sebagai dasar manajemen pemberian pakan yaitu komposisi pakan dan waktu pergantian pakan yang tepat sehingga dapat meningkatkan efisiensi pemanfaatan pakan dan pertumbuhan ikan gurame.
1 .3 Hipotesis
2 .1 Pertumbuhan dan Kebutuhan Nutrien Ikan Gurame
Pertumbuhan didefinisikan sebagai perubahan ukuran, dimana variabel yang mengalami perubahan dapat berupa panjang atau dimensi fisik lainnya, termasuk volume, berat atau massa, baik pada keseluruhan tubuh organisme atau pada berbagai jaringan. Perubahan itu juga bias berkaitan dengan kandungan protein, lemak, atau komponen kimia lainnya dari tubuh; perubahan kandungan kalori (energi) dari keseluruhan tubuh atau dari komponen ja ringannya (Weatherley dan Gill 1987).
Ikan membutuhkan materi dan energi untuk pertumbuhan yang diperoleh dari pakan. Komponen pakan yang berkontribusi terhadap penyediaan materi dan energi untuk tumbuh adalah protein, karbohidrat, dan lemak. Protein adalah nutrien yang sangat dibutuhkan untuk perbaikan jaringan tubuh yang rusak, pemeliharaan protein tubuh, penambahan protein tubuh untuk pertumbuhan, dan sebagai sumber energi. Kebutuhan ikan akan protein dipengaruhi oleh berbagai faktor, di antaranya ukuran ikan, temperatur air, kadar pemberian pakan, kandungan energi dalam pakan yang dapat dicerna dan kualitas protein. K ualitas protein bergantung pada kecernaan dan nilai biologis yang dilihat dari jumlah dan kualitas asam-asam aminonya. Fungsi protein sebagai sumber energi dapat digantikan oleh nutrien penghasil energi lain yaitu karbohidrat dan lemak. Peningkatan ketersediaan karbohidrat dan lemak dapat menurunkan oksidasi protein untuk menghasilkan energi sehingga dapat meningkatkan pemanfaatan protein pakan untuk pertumbuhan (Furuichi 1988).
Lemak merupakan sumber energi yang sangat efektif untuk ikan. Lemak juga mempunyai berberapa peran penting lainnya yaitu sebagai media transpor senyawa-senyawa yang larut dalam lemak, sebagai bagian dari struktur membran sel dan sebagai prekursor senyawa-senyawa penting, misalnya hormon dan pigmen (Steffens 1989; Jobling 1994).
metaboliknya, yang bergantung pada kadar dan kompleksitas karbohidrat (Lee dan Lee 2004). Karbohidrat berperan dalam pembentukan rangka karbon asam-asam lemak non esensial dan juga sintesis lemak. Sintesis de novo C 16:0 dan C 18:1 ? 9 asam lemak dimulai dari asetil-koenzim A yang berasal dari katabolik aerobik dekomposisi karbohidrat pakan. Selain itu, karbohidrat juga penting pada pembentukan oksaloasetat dan NADPH2. Fungsi ini hanya dapat digantikan oleh
protein dan tidak dapat digantikan oleh lemak (Steffens 1989).
Efisiensi pemanfaatan pakan untuk pertumbuhan bergantung pada beberapa faktor penting. Komposisi pakan sesuai dengan kebutuhan untuk pertumbuhan merupakan faktor yang paling penting. P akan yang kekurangan nutrien-nutrien esensial untuk tumbuh seperti asam-asam amino esensial, asam lemak, vitamin, dan mineral akan menyebabkan penurunan efisiensi pemanfaatan pakan (Hepher 1990). Oleh karena itu, dalam upaya peningkatan efisiensi pemanfaatan pakan maka dalam penyusunan pakan perlu mempertimbangkan kebutuhan nutrisi dari spesies ikan yang akan dipelihara, di antaranya adalah kebutuhan energi, protein, karbohidrat, lemak, vitamin, dan mineral.
Ikan memenuhi sebagian besar kebutuhan energinya dari protein pakan. Dengan demikian, rasio energi/protein (rasio E/P) sangat berpengaruh pada efisiensi pemanfaatan protein dan energi (Kim dan Kaushik 1994). Rasio energi/protein yang tepat dapat meningkatkan efisiensi pemanfaatan pakan. Pakan yang kandungan energinya kurang akan menyebabkan ikan menggunakan sebagian protein sebagai sumber energi, sehingga bagian protein yang digunakan untuk pertumbuhan menjadi berkurang. Sebaliknya, kandungan energi pakan yang terlalu tinggi akan membatasi konsumsi pakan sehingga akan membatasi jumlah nutrien lain termasuk protein yang dimakan ikan.
kebutuhan karbohidrat pakan pada ikan gurame dengan bobot tubuh berkisar antara 29 dan 32 g adalah 20,8%, sedangkan ikan gurame dengan bobot tubuh berkisar antara 79 dan 80 g dapat menggunakan karbohidrat pakan sampai kadar 47,5% (Mokoginta et al. 2004)
2 .2 Enzim Pencernaan dan Perannya dalam Proses Pencernaan
Pemanfaatan materi dan energi pakan untuk pertumbuhan terlebih dahulu melalui suatu proses pencernaan dan metabolisme. Dalam proses pencernaan, makanan yang tadinya merupakan senyawa kompleks akan dipecah menjadi senyawa yang lebih sederhana sehingga mudah diserap melalui dinding usus dan disebarkan ke seluruh tubuh melalui sistem peredaran darah. Protein dihidrolisis menjadi asam amino bebas dan peptida -peptida pendek, karbohidrat dipecah menjadi gula -gula sederhana dan lemak menjadi asam-asam lemak dan gliserol. Proses-proses di atas dilakukan oleh enzim-enzim pencernaan (Tillman et al. 1991).
Enzim protease menguraikan rantai-rantai peptida dari protein. Bergantung pada letak ikatan peptida pada tengah atau akhir molekul, peptidase diklasifikasikan menjadi endopeptidase dan eksopeptidase. Endopeptidase menghidrolisis protein dan peptida -peptida rantai pa njang menjadi peptida-peptida pendek. Endopeptida-peptidase penting antara lain pepsin yang dihasilkan dari zimogen pepsinogen, tripsin dari tripsinogen, dan kimotripsin dari kimotripsinogen. Eksopeptidase menghidrolisis peptida menjadi asam-asam amino. Karboksipeptidase, aminopeptidase, dan dipeptidase termasuk dalam kelompok eksopeptidase. Alfa-am ilase adalah enzim yang bertanggung jawab menghidrolisis pati menjadi glukosa. Enzim ini memutuskan ikatan 1,4’-a-glukosidik dan mengubah pati menjadi glukosa dan maltosa. Sedangkan lipase adalah enzim penting dalam pencernaan lemak. Lipase memecah lemak menjadi gliserol dan asam lemak (Steffens 1989; Hepher 1990).
kesempurnaannya. Perkembangan struktur alat pencernaan ini diikuti oleh perkembangan enzim pencernaan dan perubahan kebiasaan makan (food habit). Berdasarkan penelitian Affandi (1993) diketahui adanya perubahan pola kebiasaan makan pada ikan gurame yang berukuran kecil dan pada ikan yang berukuran besar, yaitu dari karakter ikan karnivora ke omnivora hingga akhirnya menjadi herbivora. Aktivitas protease umumnya tinggi pada ikan-ikan karnivora dan aktivitas karbohidrase umumnya tinggi pada ikan-ikan herbivora dan omnivora (Ugolev dan Kuz’mina 1994). Hasil penelitian Affandi et al. (1994) menunjukkan bahwa perkembangan alat pencernaan yang sempurna pada ikan gurame dicapai pada ukuran 2,4 cm atau sekitar 40 hari sehingga benih ikan gurame tersebut siap memakan pakan buatan.
Kandungan nutrien pakan nampaknya berpengaruh pada aktivitas enzim pencernaan. Ku’zmina (1996) mengungkapkan bahwa tersedianya substrat merupakan faktor yang nyata dalam pengaturan aktivitas enzim pada ikan dan mamalia. Kandungan protein pakan yang tinggi dikaitkan dengan kandungan selulosa yang rendah umumnya meningkatkan aktivitas protease pada ikan
rainbow trout (Hepher 1990). Peningkatan proporsi pati kentang dalam pakan dari 10 menjadi 90% yang diikuti penurunan proporsi tepung ikan akan meningkatkan aktivitas enzim maltase dan amilase pada ikan mas, dan adaptasi enzim karbohidrase ini terhadap komposisi pakan sudah terlihat kurang dari satu minggu (Kawai dan Ikeda 1972). Peningkatan protein pakan dan penurunan kadar selulose pakan menyebabkan peningkatan aktivitas enzim amilase pada ikan
rainbow trout (Kawai dan Ikeda 1973).
jenis pakan yang dikonsumsi. Selain itu, kecernaan juga dipengaruhi oleh umur ikan. Perbedaan ini disebabkan adanya perbedaan aktivitas enzim pada umur yang berbeda. Komposisi pakan berpengaruh pada kecernaa n. Nutrien dalam bahan pakan yang berbeda akan dicerna dengan tingkat yang berbeda . Hal ini berkaitan dengan sumber dan komposisi bahan tersebut. Bahan pakan yang berasal dari tumbuhan biasanya dicerna lebih lambat dibandingkan bahan pakan yang berasal dari hewan. Kandungan selulosa yang tinggi juga mempengaruhi kecernaan pakan. Kemampuan cerna juga dipengaruhi oleh bentuk pakan dan cara pengolahannya (Hepher 1990).
2 .3 Insulin dan Perannya dalam Metabolisme
Insulin adalah hormon polipeptida yang dihasilkan oleh sel-sel ß pulau-pulau Langerhans dalam pankreas. Peran utama insulin adalah mengatur kadar glukosa darah melalui peningkatan pengambilan glukosa ke jaringan dan penyimpanannya dalam bentuk glikogen dan lemak. Insulin terdiri atas dua polipeptida yaitu rantai A terdiri atas 21 asam amino dan rantai B terdiri atas 30 asam amino, yang dih ubungkan oleh jembatan disulfida. Susunan asam amino insulin hampir sama pada semua vertebrata, dengan demikian insulin yang diisolasi dari satu spesies masih tetap aktif pada spesies lain. Insulin bekerja pada hati untuk meningkatkan pengambilan glukosa dan pembentukan glukosa 6-fosfat serta untuk mengaktifkan enzim glikogen sintetase. Pada jaringan adiposa, glukosa diubah menjadi gliserol dan gliserol ini diesterifikasi dengan asam lemak bebas membentuk trigliserida. Sintesis lemak meningkat melalui peningkatan perangsangan sitrat lipase, asetil-KoA, karboksilase, asam lemak sintase dan gliserol 3-fosfat dehidrogenase. Pada otot , insulin merangsang pengambilan glukosa dan asam amino dan merangsang sintesis glikogen dan protein. Insulin juga mempunyai efek vasodilatori untuk me ningkatkan aliran darah dan suplai nutrien ke otot (Squires 2003).
penggantian jaringan tubuh yang rusak. Arah katabolik diawali dengan deamina si molekul-molekul asam amino yang kemudian digunakan untuk menghasilkan energi atau lipogenesis (Hepher 1990) . Pada ikan, sebagaimana pada mamalia, sintesis protein (khususnya pada otot) dan translokasi asam-asam amino dari hati ke otot dikontrol oleh insulin. Peran insulin pada ikan terutama pada metabolisme protein dan lemak. Keterlibatan insulin dalam homoestasis glukosa mungkin hanya merupakan peran sekunder (Jobling 1994). Peningkatan asam amino dalam plasma setelah pemberian pakan akan merangsang sekresi insulin. Insulin yang disekresikan ini kemudian akan meningkatkan deposisi asam amino dalam sel dan penggabungannya ke dalam protein otot (Cowey dan Walton 1989; Mommsen dan Plisetskaya 1991).
Glukosa hasil pencernaan karbohidrat diserap ke dalam aliran darah, dan selanjutnya akan akan digunakan untuk metabolisme. Metabolisme glukosa sangat dikontrol oleh hormon. Pada hewan-hewan endotermik, homoestasis glukosa darah dikontrol sangat baik. Homoestasis ini terutama dikontrol oleh insulin dan glukagon yang disekresikan oleh pankreas. Hormon-hormon tersebut juga terdapat pada ikan, tetapi homoestasi glukosa darah pada ikan masih belum jelas. Insulin dan somatostatin menye babkan penurunan kadar glukosa darah (hipoglikemia). Glukosa ini akan digunakan secara cepat pada jaringan atau diubah menjadi glikogen yang disimpan di hati. Jika insulin kurang, kadar glukosa darah meningkat (hiperglikemia), dan metabolisme glukosa ter ganggu danmenyebabkan kondisi diabetik. Pada kondisi seperti ini, glikogene sis dan lipogenesis juga akan terhambat. Kebutuhan energi akan disediakan melalui peningkatan glukoneogenesis dari lemak dan protein (Hepher 1990).
puncak glukosa darah yang sama seperti pada ikan mas terjadi 2 jam setelah pemberian glukosa, sedangkan pada ikan yellowtail terjadi 3 jam setelah pemberian glukosa, meningkat dari 120 mg/100 ml menjadi 210 mg/100 ml. Ikan mas membutuhkan waktu kira-kira 5 jam untuk kembali ke kadar glukosa awal (pada saat pemuasaan) dan ikan red seabream belum kembali ke kadar glukosa awal setelah 5 jam. Pada ikan yellowtail. kadar glukosa darah masih sangat tinggi setelah 5 jam.
Peres et al. (1999) juga melakukan uji toleransi glukosa pada ikan gilthead seabream dan European seabass. Sebelumnya , ikan diadaptasikan dengan pakan berkadar protein 50% dan lemak 12% selama 3 minggu. Setelah dipuasakan selama 24 jam, ikan diinjeksi secara intraperitonial denga n 1 g glukosa/kg bobot tubuh. Hasilnya menunjukkan bahwa kadar glukosa darah ikan seabream
mencapai puncak 3 jam setelah injeksi, meningkat dari 67,9 mg/100 ml menjadi 323,3 mg/100 ml, sementara ikan seabass mencapai puncak kadar glukosa darah 6 jam setelah injeksi, meningkat dari 63,9 mg/100 ml menjadi 279,6 mg/100 ml.
berukuran berkisar antara 29 dan 32 g jumlah glukosa yang diabsorbsi tidak diikuti dengan transfer glukosa yang cepat ke sel-sel sehingga kadar glukosa darah mencapai puncak lebih cepat dibandingkan ikan gurame berukuran berkisar antara 79 dan 80 g. Hal ini juga menunjukkan adanya perbedaan kemampuan menggunakan karbohidrat yang diabsorbsi pada kedua ukuran ikan gurame tersebut. Hasil-hasil penelitian ini menunjukkan bahwa toleransi glukosa berbeda antar spesies dan juga antar ukuran ikan. Seba gian besar spesies ikan menunjukkan toleransi glukosa yang rendah, dan ikan-ikan karnivora menunjukkan toleransi glukosa yang paling rendah dibandingkan ikan-ikan omnivora dan herbivora.
Pada mamalia , insulin umumnya dikenal sebagai pemicu enzim-enzim glikolitik hati dan penghambat enzim-enzim glukoneogenik hati. Furuichi dan Yone (1982) mengama ti perubahan enzim-enzim metabolik karbohidrat pada hati yaitu dua enzim glikolitik (heks okinase dan fosfofruktokinase) dan dua enzim glukoneogenik (glukosa 6-fosfatase dan fruktosa 1,6-difosfatase ) pada ikan mas,
red seabream, yellowtail setelah pemberian secara oral glukosa 167 mg/100 g bobot ikan. Aktivitas enzim-enzim glikolitik dan glukoneogenik meningkat mencapai kadar maksimum selama 2 – 3 jam setelah pemberian glukosa, sedikit lebih lambat jika dibandingkan waktu peningkatan kadar insulin darah mencapai maksimum . Aktivitas enzim-enzim glikolitik (heksokinase dan fosfofruktokinase ) dan enzim glukoneogenik (glukosa 6-fosfatase dan fruktosa 1,6-difosfatase) pada semua spesies ikan ini meningkat setelah pemberian glukosa. Aktivitas heksokinase sedikit berbeda antara sebelum dan setelah pemberian glukosa pada semua spesies ikan uji. Aktivitas fosfofrukt okinase sebelum dan sesudah pemberian glukosa paling tinggi ditemukan pada ikan mas, yang diikuti oleh red seabream dan yellowtail. Aktivitas enzim glukosa 6-fosfatase dan fruktosa 1,6-difosfatase paling tinggi ditemukan pada ikan yellowtail dan terendah pada ikan mas. Injeksi insulin menyebabkan peningkatan aktivitas enzim heksokinase dan fosfofruktokinase, sedangkan aktivitas enzim fruktosa 1,6-difosfatase dihambat pada ketiga spesies ikan ini. Injeksi insulin menyebabkan pe ningkatan aktivitas enzim fruktosa 1,6-difosfatase pada ikan yellowtail dan red seabream, sedangkan aktivitas enzim ini pada ikan mas ditekan. Penelitian tersebut menegaskan bahwa sejumlah besar glukosa masuk ke hati dan otot sebelum adanya peningkatan aktivitas enzim-enzim glikolitik dan mungkin dieksresikan tanpa digunakan oleh ikan. Furuichi dan Yone (1982) juga menegaskan bahwa pada ikan mas yang mengkonsumsi pakan yang mengandung glukosa sebagai satu-satunya sumber karbohidrat tumbuh kurang baik jika dibandingkan dengan ikan mas yang mengkonsumsi karbohidrat rantai panjang (maltosa, dekstrin, dan pati). Karbohidrat rantai panjang diabsorbsi (sebagai glukosa) lebih lambat sehingga lebih sinkron dengan sekresi insulin dan aktivits enzim-enzim glikolitik.
Penelitian ini dilakukan di Laboratorium Nutrisi Ikan, Laboratoruim Limnologi, Laboratorium Lingkungan, Fakultas Perikanan dan Ilmu Kela utan, Laboratorium Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor, mulai bulan Agustus 2003 sampai dengan Agustus 2005. Penelitian ini dilakukan dalam tiga tahap. Penelitian tahap I bertujuan mengkaji perubahan enzim pencernaan (protease, a-amilase, dan lipase) pada ikan gurame yang diberi pakan yang mengandung kadar protein dan karbohidrat yang berbeda. Penelitian tahap II bertujuan menguji toleransi glukosa dan uji toleransi insulin-glukosa pada ikan gurame yang diberi pakan yang mengandung kadar protein dan karbohidrat yang berbeda. Penelitian tahap III bertujuan mengkaji efisiensi pemanfaatan karbohidrat pakan bagi pertumbuhan pada ikan gurame sejalan dengan perubahan enzim pencernaan dan konsekuensi perubahan pakan terhadap insulin.
Berdasarkan hasil penelitian tahap I dan II yaitu dengan melihat pola perubahan enzim pada saluran pencernaan ikan gurame, ditentukan pakan yang sesuai dengan ketersediaan enzim pencernaan, dengan prinsip memenuhi kebutuhan energi ikan semaksimal mungkin dari karbohidrat dan meminimalkan pemanfaatan protein untuk energi.
3.1. Penelitian Tahap I : Perubahan Enzim Pencernaan (Protease, α-Amilase, dan Lipase) pada Ikan Gurame yang Diberi Pakan yang Mengandung Kadar Protein dan Karbohidrat yang Berbeda
3.1 .1 Pakan Uji
dapat diturunkan dan digantikan dengan peningkatan kadar karbohidrat pakan sebagai sumber energi. Kadar karbohidrat pakan terdiri atas 3 level yaitu 20, 35, 50%. Dengan demikian terdapat enam macam pakan uji dengan kadar protein dan karbohidrat yang berbeda dengan kandungan energi pakan yang relatif sama. Komposisi bahan dan hasil analisis proksimat pakan antar perlakuan terdapat pada Tabel 1.
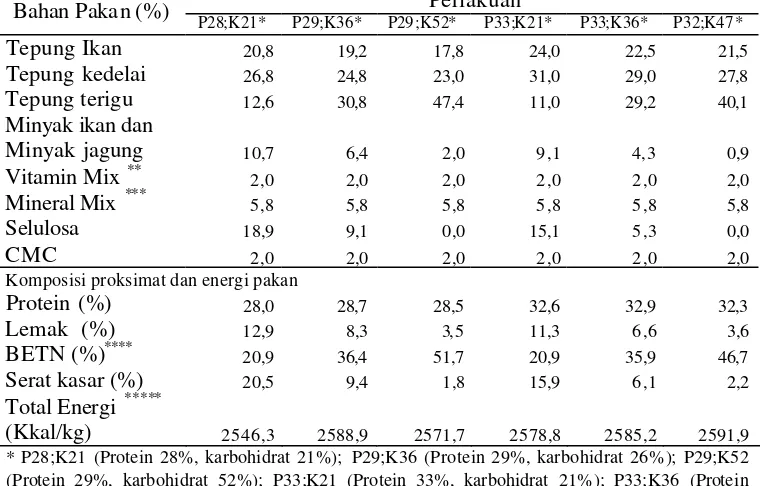
Tabel 1. K omposisi pakan uji untuk ikan gurame pada penelitian tahap I Perlakuan
Bahan Pakan (%)
P28;K21* P29;K36* P29;K52* P33;K21* P33;K36* P32;K47*
Tepung Ikan 20,8 19,2 17,8 24,0 22,5 21,5 Komposisi proksimat dan energi pakan
Protein (%) 28,0 28,7 28,5 32,6 32,9 32,3 * P28;K21 (Protein 28%, karbohidrat 21%); P29;K36 (Protein 29%, karbohidrat 26% ); P29;K52 (Protein 29%, karbohidrat 52%); P33;K21 (Protein 33%, karbohidrat 21%); P33;K36 (Protein 33%, karbohidrat 36%); P32;K47 (Protein 32%, karbohidrat 47%)
**Dalam mg/kg pakan : vit.B1 60; vit. B2 100; vit. B6 40; vit.B12 100; vit C 200; vit K3 50; vit A/D3 400; vit E 200; Ca-pantotenat 100; inositol 2000; biotin 300; as am folat 15; niasin 400; kolin klorida 500.
***Dalam g/kg pakan : MgSO4.7H20 7,5; NaCl 0, 5; NaH2PO4.2H20 12,5; KH2PO4 16,0;
CaHPO4.2H2O 6,53 Fe sitrat 1,25; ZnSO4.7H2O 0,1765; MnSO4.4H20 0, 081; CuSO4.5H2O 0, 0155;
KIO3 0,0015; CoSO4 0,0003
****Bahan ekstrak tanpa nitrogen
*****Total energi tercerna (DE) dihitung berdasarkan : protein = 3, 5 kkal/g; lemak = 8,1 kkal/g; bahan ekstrak tanpa nitrogen = 2, 5 kkal/g (Sumber : NRC, 1977)
3.1.2 Pemeliharan Ikan
dalam wadah penelitian. Penelitian ini dirancang menjadi dua set penelitian yang sama. Satu set penelitian untuk mengkaji perubahan enzim pencernaan sedangkan set penelitian lainnya untuk melihat pertumbuhan dan efisiensi pakan. Setiap perlakuan pakan diulang tiga kali. Dengan demikian dibutuhkan 36 buah akuarium. Setiap akuarium ditebari ikan sebanyak 10 ekor . Sebelum digunakan, ikan gurame diadaptasikan terlebih dahulu terhadap kondisi lingkungan laboratorium dan pakan uji. Masa pemeliharaan dimulai setelah ikan respon terhadap pakan yang diberikan.
Pemeliharaan ikan dilakukan selam 60 hari. Selama masa pemeliharaan, ikan diberi pakan dua kali sehari pada pagi dan sore hari secara at satiation. Pergantian air dilakukan setiap hari untuk meggantikan air yang keluar pada saat penyiponan.
Selama pemeliharaan, suhu air dipertahankan 30 ± 1oC. Kandungan oks igen terlarut berkisar antara 5,20 dan 6,23 ppm, karbondioksida terlarut berkisar antara 4,20 dan 5,00 ppm, pH berkisar antara 6,50 dan 6,95, alkalinitas berkisar antara 19,48 dan 21,98, total ammonia berkisar antara 0,01 dan 0,695 ppm. Kualitas air ini mendukung pertumbuhan ikan.
3.1.3 Peubah yang Diamati
Peubah yang diamati dalam penelitian ini adalah (1) aktivitas enzim (protease, a-amilase, lipase), (2) pertumbuhan, dan (3) efisiensi pakan.
Pengukuran aktivitas enzim pencernaan dilakukan pada awal percobaan yang dilanjutkan setiap 10 hari sekali selama 60 hari penelitian. Pada setiap kali pengukuran aktivitas enzim, 3 ekor sampel ika n diambil secara acak dari setiap perlakuan dan ditimbang bobot tubuhnya .
protease adalah kasein. Tirosin digunakan sebagai standar. Satu unit enzim protease didefinisikan sebagai 1 mg tirosin yang dibebaskan dalam 10 menit pada suhu 37oC. Prosedur pengukuran aktivitas enzim protease disajikan pada Lampiran 1.
Pengukuran aktivitas enzim a -amilase dilakukan dengan menggunakan menggunakan metode Bernfeld (1955). Substrat yang digunakan dalam pengukuran aktivitas a -amilase adalah pati. Maltosa digunakan sebagai standar. Satu unit a -amilase didefinisikan sebagai 1 mg maltosa yang dibebaskan dari pati dalam waktu 3 menit pada suhu 20oC, pH 6,9. Prosedur pengukuran aktivitas enzim a -amilase disajikan pada Lampiran 2. Pengukuran aktivitas lipase dilakukan dengan menggunakan metode Borlongan (1990), Substrat yang digunakan adalah minyak zaitun. Asam lemak yang dihasilkan oleh hidrolisis enzimatik dari trigliserida yang ada dalam emulsi yang stabil dari minyak zaitun dititrasi dengan NaOH. Satu unit aktivitas enzim lipase didefinisikan sebagai volume NAOH 0,05 N yang dibutuhkan untuk menetralisir asam lemak yang dilepaskan selama 6 jam inkubasi dengan substrat dan setelah dikoreksi dengan blanko. Prosedur pengukuran aktivitas enzim lipase disajikan pada Lampiran 3.
Penimbangan bobot tubuh ikan untuk menghitung laju pertumbuhan ikan dilakukan pada set penelitian yang terpisah. Penimbangan bobot tubuh dilakukan pada awal dan akhir penelitian. Sehari sebelum penimbangan, ikan dipuasakan terlebih dahulu. Sebelum penimbangan, ikan dibius dengan menggunakan tricaine methanosulfonate (MS 222) 12,5 ppm.
Laju pertumbuhan harian dihitung menggunakan rumus Huisman (1976) : Wt = Wo (1 + 0,01 a)t
dengan a adalah laju pertumbuhan harian (%),Wt adalah bobot rata-rata ikan pada akhir penelitian (g) , Wo adalah bobot rata -rata ikan pada awal penelitian (g) , dan t adalah lama waktu penelitian.
Penimbangan bobot pakan yang dikonsumsi ikan dilakukan untuk menghitung nilai efisiensi pakan. Nilai efisiensi pakan dihitung dengan menggunakan rumus NRC (1977) :
(Wt + D ) – Wo F
dengan EP adalah efisiensi pakan (%), Wt adalah bobot ikan pada akhir penelitian (g), Wo adalah bobot ikan pada awal penelitian (g) , D adalah bobot ikan yang mati selama penelitian (g), dan F adala h jumlah pakan yang dikonsumsi.
3.1.4 Analisis Statistik
Penelitian ini dirancang dengan rancangan acak lengkap dengan enam perlakuan dan tiga ulangan. Data aktivitas enzim pencernaan (protease, a-amilase, lipase), laju pertumbuhan, dan efisiensi pakan dianalisis menggunakan analisis ragam dan dilanjutkan dengan uji Tukey pada selang kepercayaan 95 % dengan menggunakan program SPSS 11. 5.
3.2 Penelitian Tahap II : Uji Toleransi Glukosa dan Uji Toleransi Insulin-Glukosa pada Ikan Gurame yang Diberi Pakan yang Mengandung Kadar Protein dan Karbohidrat yang Berbeda
3.2.1 Pakan Uji
Pada penelitian ini digunakan pakan uji dengan bahan dan komposisi pakan yang sama seperti pakan uji yang digunakan pada penelitian tahap I.
3.2.2 Pemeliharaan Ikan
Ikan gurame yang digunakan dalam penelitian ini adalah ikan gurame dengan bobot awal berkisar antara 23 dan 25 g/ ekor Sebelum pemeliharaan dimulai, dilakukan berbagai persiapan yang meliputi persiapan wadah, pakan, dan ikan. Penelitian ini dirancang menjadi dua set penelitian yang sama. Satu set penelitian untuk uji toleransi glukosa sedangkan set penelitian lainnya untuk uji toleransi insulin-glukosa. Setiap perlakuan diulang tiga kali. Dengan demikian, dibutuhkan 36 buah akuarium. Setiap akuarium ditebari ikan sebanyak 12 ekor. Sebelum digunakan, ikan gurame diadaptasikan terlebih dahulu terhadap kondisi lingkungan laboratorium dan pakan uji. Masa pemeliharaan dimulai setelah ikan respons terhadap pakan yang diberikan.
Penggantian air dilakukan setiap hari untuk meggantikan air yang keluar pada saat penyiponan.
Selama pemeliharaan, suhu air dipertahankan 30 ± 1oC. Kandungan oks igen terlarut berkisar antara 5,60 dan 6,13 ppm, karbondioksida terlarut berkisar antara 4,18 dan 4,98 ppm, pH berkisar antara 6,50 dan 6,75, alkalinitas berkisar antara 17,48 dan 20,77, total ammonia berkisar antara 0,015 dan 0,796 ppm. Kualitas air ini mendukung pertumbuhan ikan.
3.2.3 Peubah yang Diamati
Peubah yang diamati dalam penelitian tahap II ini adalah (1) kadar glukosa darah, (2) kadar glikogen otot dan hati, (3) kadar trigliserida darah, dan (4) kadar insulin darah.
Setelah 30 hari pemeliharaan dengan pakan uji, dilakukan uji toleransi glukosa dengan cara menginjeksi glukosa secara intraperitonial dengan dosis 1 g D-glukosa per kilogram bobot tubuh ikan. Sebelum uji dilakukan, ikan dari semua ulangan pada perlakuan yang sama dikumpulkan dalam satu wadah dan dibagi secara acak menjadi tujuh kelompok jam pengambilan sampel, dan setiap kelompok ikan dimasukkan ke dalam sebuah akuarium (masing-masing 5 ekor ikan/akuarium). Kemudian ikan dipuasakan selama 48 jam. Sebelum injeksi glukosa, ikan dibius dengan menggunakan tric aine methanosulfonate (MS 222) 12,5 ppm dan ditimbang bobot tubuhnya untuk menentukan jumlah glukosa yang akan diinjeksi pada ikan.
Pada uji toleransi insulin-glukosa, 2 IU insulin (human insulin “Actrapid”) per 100 g bobot tubuh diinjeksi secara intramuskular sebelum pemberian glukosa pada cara dan dosis yang sama sebagaimana uji toleransi glukosa.
glikogennya dilakukan pada jam ke-0 dan ke-3 jam setelah injeksi glukosa dan insulin. Semua sampel (plasma darah, sampel hati, dan otot) disimpan dalam lemari pendingin (suhu -20oC) sampai analisis dilakukan.
Kadar glukosa darah dan kadar glikogen hati dan otot diukur berdasarkan metode Wedemeyer dan Yasutake (1977) . Prosedur pengukuran kadar glukosa darah dan kadar glikogen hati dan otot disajikan pada Lampiran 4 dan 5.
Kadar trigliserida darah diukur pada jam ke -0 dan ke- 2 dan 3 jam setelah injeksi glukosa dan insulin. Kadar trigliserida darah dengan metode enzimatik-kolorimetrik menggunakan kit trigliserida (GPO. Enzimatik, ST. Reagensia ). Prosedur pengukuran kadar trigliserida disajikan pada Lampiran 6.
Kadar insulin darah diukur dengan menggunakan kit insulin (Coat-A-Count Insulin, Diagnostic Product Corporation). Prosedur pengukuran kadar insulin darah disajikan pada Lampiran 7.
3.2.4 Analisis Statistik
Penelitian ini dirancang dengan rancangan acak lengkap dengan enam perlakuan dan tiga ulangan. Data kadar glukosa darah, kadar trigliserida darah, kadar glikogen hati dan otot, kadar insulin darah dianalisis menggunakan analisis ragam dan dilanjutkan dengan uji Tukey pada selang kepercayaan 95 % dengan menggunakan program SPSS 11. 5.
3.3 Penelitian Tahap III : Efisiensi Pemanfaatan Karbohidrat Pakan bagi Pertumbuhan Ikan Gurame Sejalan dengan Perubahan Enzim Pencernaan dan Konsekuensi Perubahan Pakan Terhadap Insulin.
3.3.1 Pakan Uji
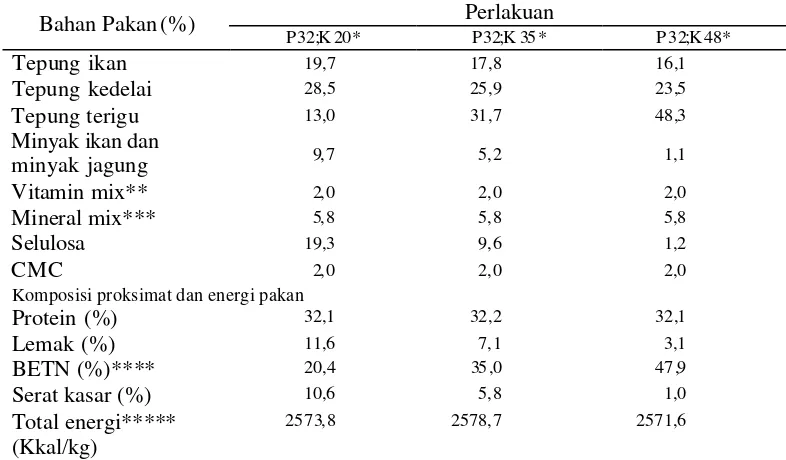
mengandung karbohidrat berbeda (20, 35, dan 48%), dengan kadar protein 32% dan kadar energi yang relatif sama. Komposisi bahan dan hasil analisis proksimat pakan uji disajikan pada Tabel 2. Sedangkan waktu pergantian pakan untuk setiap pakan yang mengandung kadar karbohidrat berbeda adalah sebagai berikut :
Waktu Pergantian Pakan (Hari Ke -) Perlakuan
Tabel 2. Komposisi pakan uji untuk ikan gurame pada penelitian tahap III Perlakuan
Komposisi proksimat dan energi pakan
Protein (%) 32,1 32,2 32,1
* P32;K20 (Protein 32%, karbohidrat 20%); P32;K35 (Protein 32%, karbohidrat 35%); P32;K48 (Protein 32%, karbohidrat 48%)
**Dalam mg/kg pakan : vit.B1 60; vit. B2 100; vit. B6 40; vit.B12 100; vit C 200; vit K3 50; vit A/D3 400; vit E 200; Ca-pantotenat 100; inositol 2000; biotin 300; asam folat 15; niasin 400; kolin klorida 500.
***Dalam g/kg pakan : MgSO4.7H20 7,5; NaCl 0, 5; NaH2PO4.2H20 12,5; KH2PO4 16,0;
CaHPO4.2H2O 6,53 Fe sitrat 1,25; ZnSO4.7H2O 0, 1765; MnSO4.4H20 0, 081; CuSO4.5H2O 0, 0155;
KIO3 0,0015; CoSO4 0,0003
***Bahan ekstrak tanpa nitrogen
3.3.2 Pemeliharaan Ikan
Ikan gurame yang digunakan dalam penelitian ini adalah ikan gurame dengan bobot awal berkisar antara 28 dan 29 g/ekor . Sebelum pemeliharaan dimulai dilakukan berbagai persiapan meliputi persiapan pakan, wadah, dan ikan.
Pemeliharaan ikan dilakukan selama 80 hari. Selama masa pemeliharaan ikan diberi pakan dua kali sehari pada pagi dan sore hari secara at satiation. Pergantian air dilakukan setiap hari untuk meggantikan air yang keluar pada saat penyiponan.
Selama pemeliharaan, suhu air dipertahankan 30 ± 1oC. Kandungan oksigen terlarut berkisar antara 6,02 dan 6,83 ppm, karbondioksida terlarut berkisar antara 4,20 dan 4,65 ppm, pH berkisar antara 6,84 dan 6,95, alkalinitas berkisar antara 17,48 dan 22,54 ppm, total ammonia berkisar antara 0,015 dan 0,587 ppm. Kualitas air ini mendukung pertumbuhan ikan.
3.3.3 Peubah yang Diamati
Peubah yang diamati dalam penelitian tahap III ini adalah (1) laju pertumbuhan (2) efisiensi pakan (3) kecernaan nutrien (protein, BETN dan lemak), (4) retensi protein, lemak dan energi (5) kadar glukosa darah, (6) kadar glikogen otot dan hati, dan (7) kadar insulin darah.
Pengukuran laju pertumbuhan dan efisiensi pakan dilakukan dengan metode dan rumus yang sama seperti pada penelitian tahap I. Analisis proksimat dilakukan pada sampel ikan, pakan, dan feses berdasarkan metode yang digunakan Takeuchi (1988). Analisis proksimat untuk protein dilakukan dengan metode Kjeldahl, lemak menggunakan metode ekstraksi ether dengan menggunakan Soxhlet, abu dengan pemanasan menggunakan tanur pada suhu 600oC, kadar air dengan pemanasan menggunakan oven pada suhu berkisar antara 105 sampai 110oC, serat kasar dengan pelarutan sampel dengan asam dan basa kuat serta pemanasan. Analisis proksimat tubuh ikan dilakukan pada awal dan akhir penelitian.
indikator (Cr2O3) pada pakan dan feses ikan. Pengumpulan feses pada 20 hari
pertama penelitian dilakukan setelah 10 hari ikan mengkonsumsi pakan uji yang mengandung Cr2O3. Pengumpulan feses dilakukan setiap pagi hari setelah
pemberian pakan. Feses dikumpulkan segera setelah ikan mengeluarkan feses untuk menghindari terjadinya pencucian. Feses yang telah terkumpul disentrifugasi dengan kecepatan 3000 rpm selama 10 menit, kemudian disimpan dalam lemari pendingin sampai analisis dilakukan. Penentuan kadar Cr2O3 pakan
dan feses dilakukan berdasarkan metode yang digunakan Takeuchi (1988). Sampel didestruksi dengan 5 ml asam nitrat pekat selama 30 menit hingga vulome menjadi lebih kurang 1 ml, kemudian didinginkan dan ditambah 3 ml asam perklorat (HClO4) pekat. Campuran tersebut dipanaskan hingga larutan berwarna
oranye, didinginkan, diencerkan hingga 100 ml, dan nilainya absorbansinya dibaca dengan spektrofotometer pada panjang gelombang 350 nm.
Koefisien kecernaan nutrien pakan dihitung berdasarkan rumus Takeuchi (1988) : Kecernaan nutrien = 100 – (100 x a’/a x b’/b)
dengan a‘ adalah % indikator dalam pakan, a adalah % indikator dalam feses, b‘ adalah % nutrien dalam feses, dan b adalah % nutrien dalam pakan.
Penentuan kadar glukosa darah, kadar glikogen hati dan otot serta kadar insulin darah dilakukan pada hari ke-20, 50, dan 80 dengan menggunakan metode yang sama seperti pada penelitian tahap II.
Berdasarkan data analisis proksimat pakan dan tubuh, bobot tubuh serta jumlah pakan yang dikonsumsi maka nilai retensi protein, lemak dan energi dapat dihitung. Retensi protein dan lemak dihitung berdasarkan rumus Takeuchi (1988) :
Pertambahan protein tubuh (g) Total protein yang dikonsumsi (g) Pertambahan lemak tubuh (g) Total lemak yang dikonsumsi (g)
3.3.4 Analisis Statistik
4.1 Perubahan Enzim Pencernaan (Protease, α-Amilase, dan Lipase) pada Ikan Gurame yang Diberi Pakan yang Mengandung Kadar Protein dan Karbohidrat yang Berbeda
4.1.1 Aktivitas Enzim Protease
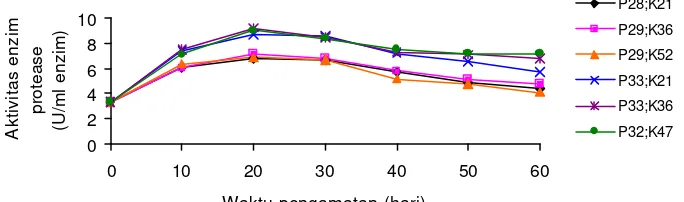
Aktivitas enzim protease pada ikan yang mengkonsumsi pakan yang mengandung protein dan karbohidrat yang berbeda pada pengamatan hari ke -10, 20, 30, 40, 50 dan 60 disajikan pada Gambar 1 dan Lampiran 8.
0
Gambar 1. Aktivitas enzim protease (U/ml enzim) pada ikan gurame yang mengkonsumsi pakan yang mengandung protein dan karbohidrat berbeda
Dari Gambar 1 di atas terlihat bahwa aktivitas enzim protease pada ikan yang mengkonsumsi pakan berkadar protein dan karbohidrat yang berbeda menghasilkan suatu pola perubahan yang hampir sama. Ikan yang mengkonsumsi pakan P33;K21 (pakan dengan protein 33% dan karbohidrat 21%), P33;K36 (pakan dengan protein 33% dan karbohidrat 36%), dan P32;K47 (pakan dengan protein 32% dan karbohidrat 47%) menghasilkan nilai aktivitas enzim protease yang lebih tinggi dibandingkan dengan ikan yang mengkonsumsi pakan P28;K21 (pakan dengan protein 28% dan karbohidrat 21%), P29;K36 (pakan dengan protein 29% dan karbohidrat 36%), dan P29;K52 (pakan dengan protein 29% dan karbohidrat 52%). Pada kadar protein yang sama, peningkatan kadar karbohidrat pakan tidak mempengaruhi aktivitas enzim protease (P>0,05).
yang berbeda. Pada hari ke-20, aktivitas enzim protease masih tinggi tetapi perubahan peningkatan aktivitas enzim ini tidak sebesar perubahan aktivitas enzim pada hari ke -10. Penurunan aktivitas enzim protease mulai terlihat pada hari ke-30 sampai dengan hari ke -60 setelah pembe rian pakan.
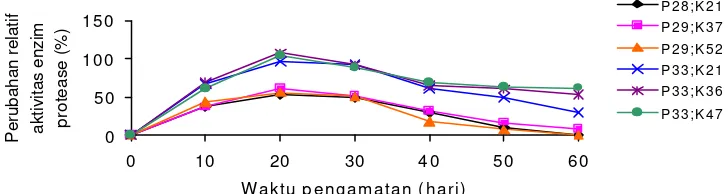
0 Perubahan relatif aktivitas enzim protease (%)
P 2 8 ; K 2 1
Gambar 2. Perubahan relatif aktivitas enzim protease (%) pada ikan gurame yang mengkonsumsi pakan yang mengandung protein dan karbohidrat berbeda
4.1.2 Aktivitas Enzim α-Amilase
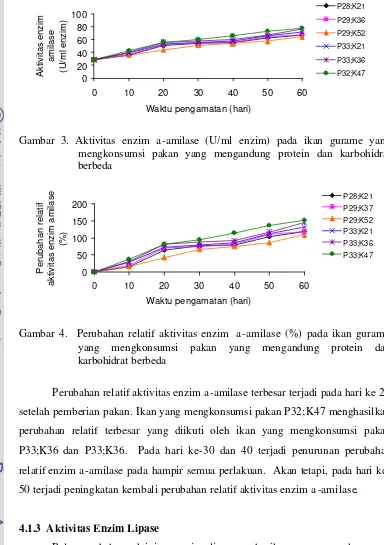
Pola perubahan aktivitas enzim α-amilase pada ikan yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda pada pengamatan hari ke -10, 20, 30, 40, 50 dan 60 disajikan pa da Gambar 3 dan Lampiran 9. Dari Gambar 3 terlihat bahwa pada ikan yang mengkonsumsi pakan yang mengandung protein 28%, adanya peningkatan kadar karbohidrat pakan dari 20.9 menjadi 36.4 dan 51.7% tidak mempengaruhi aktivitas enzim α-amilase (P>0,05). Bahkan, ikan yang mengkonsumsi pakan P29;K52 mempunyai aktivitas amilase yang paling rendah pada setiap pengamatan. Pada ikan yang mengkonsumsi pakan yang mengandung protein 32%, peningkatan kadar karbohidrat pakan dari 21% menjadi 36 dan 47% meningkatkan aktivitas enzim α-amilase. Hal ini menunjukkan ada nya keterkaitan antara kadar protein dan karbohidrat pakan dengan aktivitas enzim α-amilase.
0
Gambar 3. Aktivitas enzim a-amilase (U/ml enzim) pada ikan gurame yang mengkonsumsi pakan yang mengandung protein dan karbohidrat berbeda
Gambar 4. Perubahan relatif aktivitas enzim a-amilase (%) pada ikan gurame yang mengkonsumsi pakan yang mengandung protein dan karbohidrat berbeda
Perubahan relatif aktivitas enzim a-amilase terbesar terjadi pada hari ke 20 setelah pemberian pakan. Ikan yang mengkonsumsi pakan P32;K47 menghasilkan perubahan relatif terbesar yang diikuti oleh ikan yang mengkonsumsi pakan P33;K36 dan P33;K36. Pada hari ke-30 dan 40 terjadi penurunan perubahan relatif enzim a-amilase pada hampir semua perlakuan. Akan tetapi, pada hari ke-50 terjadi peningkatan kembali perubahan relatif aktivitas enzim a -amilase.
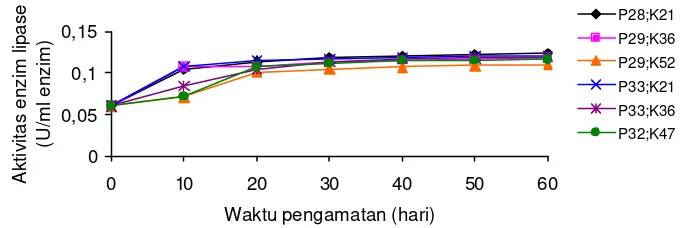
4 .1.3 Aktivitas Enzim Lipase
0 0,05 0,1 0,15
0 10 20 30 40 50 60
Waktu pengamatan (hari)
Aktivitas enzim lipase
(U/ml enzim)
P28;K21 P29;K36 P29;K52 P33;K21 P33;K36 P32;K47
Gambar 5. Perubahan aktivitas enzim lipase (U/ml enzim) pada ikan gurame yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda
Sebagaimana halnya enzim a -amilase, aktivitas enzim lipase meningkat dengan meningkatnya umur/ukuran ikan. Pada penelitian ini, pakan yang diberikan adalah isoenergi, sehingga dengan peningkatan kadar karbohidrat pakan menyebabkan penurunan kadar lemak pakan. Penurunan kadar lemak pakan cenderung menurunkan aktivitas enzim lipase pada ikan gurame.
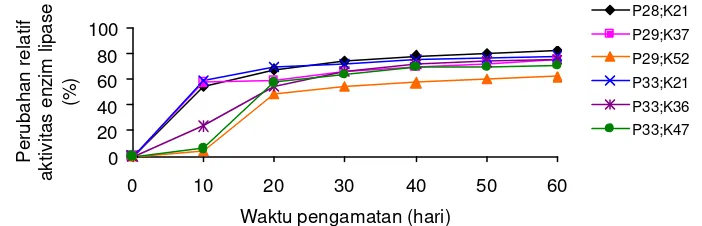
0
Gambar 6. Perubahan relatif aktivitas enzim lipase (%) pada ikan gurame yang mengkonsumsi pakan yang mengandung protein dan karbohidrat berbeda
4. 1.4 Laju Pertumbuhan Harian dan Efisiensi Pakan
Berdasarkan pengukuran terhadap bobot tubuh dan jumlah pakan yang dikonsumsi ikan, perbedaan kadar protein dan karbohidrat pakan mempengaruhi laju pertumbuhan harian dan efisiensi pakan ikan gurame (P<0,05).
Tabel 3. Laju pertumbuhan harian individu (Lph) dan ef isiensi pakan pada ikan gurame selama 60 hari penelitian
Perlakuan Lph (%) Efisiensi pakan(%) P28;K21 2,79 ± 0,04b 70,03 ± 1,80b
Huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada taraf 5%
pertumbuhan dan efisiensi pakan yang lebih rendah dibandingkan ikan yang mengkonsumsi pakan yang mengandung protein 32%. Ikan yang mengkonsumsi pakan P 29;K52 menghasilkan laju pertumbuhan harian dan efisiensi pakan yang paling rendah.
4.1.5 Pembahasan
Berdasarkan perubahan enzim pencernaan (protease, a -amilase, lipase) pada ikan gurame yang mengkonsumsi pakan mengandung protein dan karbohidrat berbeda terlihat adanya pengaruh perbedaan kandungan nutrien pakan (protein, karbohidrat, dan lemak) pada perubahan aktivitas enzim pencernaan.
Aktivitas enzim protease pada ikan yang mengkonsumsi pakan mengandung protein 32 % menghasilkan nilai aktivitas enzim protease yang lebih tinggi dibandingkan ikan yang mengkonsumsi pakan mengandung protein 28%. Hal ini menunjukkan adanya pengaruh kadar protein pakan pada aktivitas enzim protease. Ketersediaan substrat merupakan faktor yang nyata dalam pengaturan aktivitas enzim pada ikan dan mamalia. Peningkatan aktivitas enzim protease ini diduga disebabkan oleh adanya protein dalam usus yang merangsang sekresi enteropeptidase pada mukosa usus. Enteropeptidase ini mengkatalisis konversi tripsinogen menjadi tripsin (Ku’zmina 1996; Stipanuk 2000).
Kandungan protein pakan yang tinggi dikaitkan dengan kandungan selulosa yang rendah umumnya meningkatkan aktivitas protease pada ikan trout pelangi (Hepher 1990). Peningkatan aktivitas enzim protease yang sejalan dengan peningkatan kadar protein pakan ini juga telah dilaporkan Eusebio dan Coloso (2002) yang mengamati perubahan enzim protease pada ikan kakap yang mengkons umsi pakan formulasi dengan kadar protein 49,98% dan pakan ikan rucah dengan kadar protein 22,77%. Hasil penelitian tersebut menunjukkan adanya peningkatan aktivitas enzim protease pada pilorik kaeka dan usus kakap yang mengkonsumsi pakan formulasi.
nutrien dalam lumen usus. Hasil pencernaan sebagian protein dalam lambung, polipeptida dan asam-asam amino, masuk ke dalam lumen usus halus bagian depan (proximal small intestine). Nutrien ini merangsang sel-sel mukosa usus untuk mensekresikan hormon cholecystokinin ke dalam sirkulasi darah. Cholecystokinin selanjutnya menuju pankr eas, berikatan dengan sel-sel asinar dan menstimulasi berbagai prekursor enzim -enzim pencernaan inaktif yang disebut dengan zimogen. Zimogen ini dibawa ke lumen usus halus melalui saluran pankr eatik. Zimogen utama adalah tripsinogen, proelastase, kimotripsinogen, prokarboksipeptidase A, dan prokarboksipeptidase B. Tahap awal dari aktivasi bertingkat (cascade activation) adalah dikata lisis oleh enterokinase (endopeptidase) yang berikatan dengan membran brus border dari sel-sel epitelial mukosa. Enterokinase memecah tripsinogen menjadi tripsin aktif dalam lumen usus. Tripsin kemudian mengaktivasi zimogen-zimogen lainnya. Hasil dari aktivasi bertingkat ini adalah suatu kumpulan protease yang telah aktif di dalam lumen usus (Liddle 1997; Stipanuk 2000).
tidak mengandung pati. Peningkatan aktivitas enzim a -amilase terjadi akibat modulasi substratnya, yaitu pati. Beberapa penelitian juga menegaskan adanya regulasi ekspresi a-amilase pada tingkat transkripsi pada juvenil ikan. Adanya karbohidrat di dalam lumen usus dan aksi langsung hormon CCK pada pankreas eksokrin memperbanyak transkripsi mRNA amilase, menyebabkan peningkatan sintesis amilase (Peres et al. 1998; Stipanuk 2000; Cahu et al. 2004).
Johnson et al. (1970) mengajukan suatu postulat bahwa terdapat keterkaitan antara peningkatan kadar glukosa darah yang diikuti dengan sekresi insulin dan peningkatan sintesis a -amilase. Akan tetapi, kerja insulin tidak secara langsung terlibat dalam mengontrol sintesis amilase karena insulin tidak meningkatkan sekresi amilase jika diinjeksi ke tikus normal. Tikus yang dibuat diabetik dengan cara menginjeksikan alloxan, mengalami peningkatan kadar glukosa darah dan penurunan sintesis amilase, tetapi jika insulin diberikan pada tikus tersebut akan menyebabkan peningkatan sintesis amilase.
Pada penelitian ini, pakan yang diberikan adalah isoenergi sehingga peningkatan kadar karbohidrat pakan menyebabkan penurunan kadar lemak pakan. Penurunan kadar lemak pakan cenderung menyebabkan penurunan aktivitas enzim lipase pada ikan gurame. Hal ini sesuai dengan laporan Zambonino dan Cahu (1999) yang mengamati peruba han aktivitas enzim-enzim lipolitik yaitu lipase dan fosfolipase A2 (PLA2) pada larva sea bass yang diberi
pakan isonitrogen dengan kadar lemak 10, 15, 20, 25, dan 30%. Peningkatan kadar lemak pakan 10 sampai 20% diikuti dengan peningkatan aktivitas enzim lipase dan PLA2, sedangkan ikan yang mengkonsumsi pakan dengan kadar lemak
di atas 20% (25 dan 30%) menghasilkan nilai aktivitas enzim lipase dan PLA2
yang tidak berbeda dari ikan yang mengkonsumsi pakan dengan kadar lemak 20%. Tingginya aktivitas enzim lipase dan PLA2, ini terjadi akibat modulasi
substratnya , yaitu masing-masing trigliserida dan fosfolipid.
optimal untuk pertumbuhan ikan gurame berukuran antara 27 dan 35 g adalah 32,14% dengan rasio energi-protein 8 kkal DE/g pakan. Namun demikian penelitian ini ingin melihat apakah kebutuhan protein ikan gurame dapat diturunkan dengan peningkatan kadar karbohidrat pakan. Ternyata , hasil penelitian ini sejalan dengan penelitian Mokoginta et al. (1994), yaitu ikan yang mengkonsumsi pakan yang mengandung protein 32% menghasilkan laju pertumbuhan dan efisiensi pakan yang lebih tinggi dibandingkan ikan yang mengkonsumsi pakan yang mengandung protein 28%. P ada ikan yang mengkonsumsi pakan berkadar protein 28%, peningkatan kadar karbohidrat pakan dari 21% menjadi 36 dan 52% tidak mampu menghemat pemanfaatan protein karena laju pertumbuhan dan efisiensi pemanfaatan karbohidrat, lebih rendah dibandingkan ikan yang mengkonsumsi pakan yang mengandung protein 32%. Ikan yang mengkonsumsi pakan yang mengandung protein 32%, peningkatan kadar karbohidrat dari 21% menjadi 36 dan 47% diikuti dengan peningkatan laju pertumbuhan dan efisiens i pakan. Hal ini menegaskan bahwa ikan gurame mampu memanfaatkan karbohidrat pakan hingga 47% sehingga dapat menunjang penyediaan energi non-protein guna memperoleh pertumbuhan dan efisiensi pakan yang optimal.
Sehubungan dengan pertumbuhan dan efisiensi pakan tertinggi dihasilkan oleh ikan yang mengkonsumsi pakan P32;K47, pada penelitian penentuan pergantian pakan yang mengandung karbohidrat berbeda (penelitian tahap III) akan menggunakan pakan yang mengandung protein 32%. P erubahan relatif terbesar aktivitas enzim pencernaan (protease, a -amilase dan lipase) dijadikan dasar untuk menentukan waktu pergantian pakan yang mengandung karbohidrat berbeda mulai dapat dilakukan. Pada ikan yang mengkonsumsi pakan yang mengandung protein 32%, khususnya perlakuan P32;K47 tampak perubahan relatif aktivitas enzim protease terbesar terjadi pada hari ke -10 dan 20 setelah pemberian pakan yaitu berturut-turut 60,9 dan 43,4%. Penurunan aktivitas enzim mulai terlihat pada hari ke -30 setelah pemberian pakan. Aktivitas enzim a-amilase tampaknya terus meningkat setiap waktu pengamatan. Perubahan relatif terbesar aktivitas a-amilase selama pengamatan terjadi pada hari ke 20 dan ke 50 setelah pemberian pakan yaitu berturut-turut 44,8 dan 37,4%. Aktivitas enzim lipase tampaknya juga terus meningkat setiap waktu pengamatan. Perubahan relatif terbesar aktivitas terjadi pada hari ke -20 yaitu sebesar 51,5%.
4.2. Uji Toleransi Glukosa dan Uji Toleransi Insulin Glukosa pada Ikan Gurame yang Diberi Pakan Mengandung Kadar Protein dan Karbohidrat yang Berbeda
4.2.1 Kadar Glukosa Darah
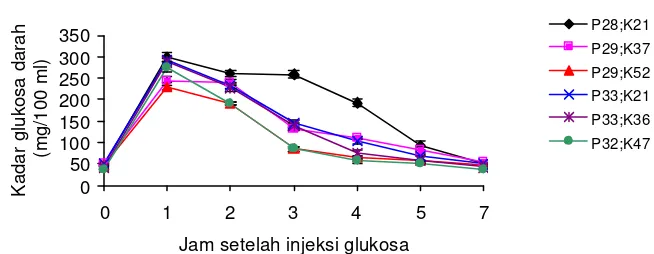
Pola perubahan kadar glukosa darah ikan gurame sesaat sebelum injeksi glukosa (jam ke-0) dan jam ke- 1, 2, 3, 4, 5, dan 7 setelah injeksi glukosa dan setelah injeksi insulin-glukosa disajikan pada Gambar 7 dan 8, Lampiran 12 dan 13.
Gambar 7. Kadar glukosa darah ikan gurame selama uji toleransi glukosa
Dari uji toleransi glukosa dan uji toleransi insulin-glukosa pada ikan gurame yang mengkonsumsi pakan berbeda menghasilkan suatu pola perubahan yang sama, meskipun kadar glukosa pada setiap titik pengamatan berbeda. Pada keadaan puasa (jam ke -0), kadar glukosa darah ikan yang mengkonsumsi pakan P28;K21, P29;K36, P29;K52 masing-masing adalah 49,3, 51,0, 48,3 mg/100ml darah dan tidak berbeda dari kadar glukosa darah ikan yang mengkonsumsi pakan P33;K21 yaitu 50,9 mg/100ml (p>0,05). Ikan yang mengkonsumsi pakan P33;K 36 dan P32;K 47 menghasilkan kadar glukosa darah yang paling rendah dibandingkan perlakuan lainnya, yaitu masing-masing 40,7 dan 38,1 mg/100 ml (p<0,05).
sedangkan ikan yang mengkonsumsi pakan P29;K52 dan P32;K47 menghasilkan kadar glukosa darah yang lebih rendah.
Puncak kadar glukosa pada uji toleransi insulin-glukosa menghasilkan pola yang sama seperti pada uji toleransi glukosa, yaitu ikan yang mengkonsumsi pakan P28;K21 menghasilkan nilai kadar glukosa tertinggi yaitu 266,0 mg/100 ml, sedangkan ikan yang mengkonsumsi pakan P32;K47 menghasilkan kadar glukosa darah yang paling rendah yaitu 133,4 mg/100 ml (p<0,05). Keberadaan insulin mampu menurunkan kadar glukosa yang terlihat dari lebih rendahnya kadar glukosa pada titik pengamatan yang sama.
Laju penurunan kadar glukosa darah ikan yang diinjeksi insulin-glukosa lebih cepat dibandingkan dengan ikan yang hanya diinjeksi glukosa saja. Penurunan kadar glukosa tercepat terjadi pada ikan yang mengkonsumsi pakan P32;K47 baik pada uji toleransi glukosa maupun pada uji toleransi insulin-glukosa. Sedangkan ikan mengkonsumsi pakan P28;K21 menghasilkan laju penurunan yang lebih lambat dibandingkan perlakuan lainnya.
0
Gambar 8 . Kadar glukosa darah ikan gurame selama uji toleransi insulin glukosa
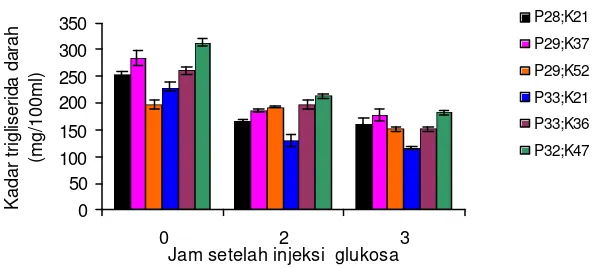
4.2.2 Kadar Trigliserida Darah
Pola perubahan kadar trigliserida darah ikan gurame sesaat sebelum injeksi (jam ke-0) dan jam ke -2 dan 3 setelah injeksi glukosa dan setelah injeksi insulin-glukosa disajikan masing-masing pada Gambar 9 dan 10 dan Lampiran 14.
Gambar 10. Kadar trigliserida darah ikan gurame setelah injeksi insulin glukosa
kadar trigliserida terendah ditemukan pada ikan yang mengkonsumsi pakan P28;K52 yaitu 197,7 mg/100 ml.
Kadar trigliserida darah ikan gurame pada jam ke-2 setelah injeksi pada kedua uji ini menghasilkan pola yang sama, yaitu terjadi penurunan dibandingkan kadar trigliserida awal (jam ke-0). Pada uji toleransi glukosa, kadar trigliserida darah pada jam ke -2 dan ke -3 setelah injeksi glukosa lebih rendah dibandingkan kadar trigliserida awal (setelah pemuasaan 48 jam). Pada uji toleransi insulin glukosa, kadar trigliserida darah pada jam ke -2 setelah injeksi insulin glukosa lebih rendah dibandingkan kadar trigliserida darah awal (setelah pemuasaan 48 jam). Namun, pada jam ke-3, terdapat perbedaan pola perubahan kadar trigliserida darah antar kedua uji, yaitu pada uji toleransi insulin-glukosa terjadi peningkatan kembali kadar trigliserida darah, sementara pada uji toleransi glukosa, kadar trigliserida darah turun terus sampai 3 jam setelh injeksi glukosa.
Pada kadar protein yang sama, peningkatan kadar karbohidrat pakan cenderung meningkatkan kadar trigliserida darah, kecuali pada pada ika n yang mengkonsumsi pakan P29;K52 menghasilkan kadar trigliserida darah yang lebih rendah dibandingkan perlakuan lainnya.
4.2.3 Kadar Glikogen Otot dan Hati
Kadar glikogen otot dan hati ikan yang dipelihara dengan pemberian pakan yang mengandung protein dan karbohidrat berbeda, yang kemudian dilakukan uji toleransi glukosa dan uji toleransi insulin -glukosa disajikan pada Tabel 4, Lampiran 15 dan 16.
Tabel 4. Rata-rata kadar glikogen otot dan hati ikan gurame pada uji toleransi
glukosa dan uji tolerans i insulin glukosa
Sebelum uji Setelah uji (jam ke – 3)
Perlakuan
Jam – 0 Injeksi glukosa Injeksi insulin
P28;K 21 11,63 ± 0,35a 12,31 ± 0,98a 11,86 ± 0,17a
P29;K 36 12,76 ± 0,42a 13,57 ± 0,12b 13,03 ± 0,20a
P29;K 52 14,77 ± 0,88b 14,65 ± 0,40c 15,58 ± 0,57b
P33;K 21 15,82 ± 0,53bc 16,15 ± 0,19d 14,42 ± 0,73b
P33;K 36 17,54 ± 1,15cd 17,68 ± 0,31e 17,17 ± 0,27c
P32;K 47 18,07 ± 0,31d 18,07 ± 0,35e 18,49 ± 0,56d
Huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada taraf 5%
Kadar glikogen otot dan hati ikan gurame sebelum uji (jam ke-0) pada ikan gurame yang mengkonsums i pakan dengan kadar protein 32% menghasilkan kadar glikogen hati dan otot yang cenderung lebih tinggi dibandingkan ikan yang mengkonsumsi pakan dengan kadar protein 28%. P ada kadar protein yang sama, ikan yang mengkonsumsi pakan dengan kadar karbohidrat yang lebih tinggi menunjukan kadar glikogen hati dan otot yang lebih tinggi dibandingkan ikan yang mengkonsumsi karbohidrat rendah. Ikan gurame yang mengkonsums i pakan P32;K 47 menghasilkan kadar glikogen otot dan hati tertinggi, sedangkan kadar glikogen otot dan hati terendah pada ikan yang mengkonsumsi pakan P28;K21 (p<0,05).
Uji toleransi glukosa dan uji toleransi insulin -glukosa menunjukkan kadar glikogen hati dan otot dengan pola yang hampir sama, yaitu terjadi sedikit peningkatan kadar glikogen pada jam k-3 setelah injeksi glukosa dan insulin dibandingkan kadar glikogen awal (jam ke-0)
4.2.4 Kadar Insulin Darah
Data kadar insulin darah pada penelitian ini hanya pada uji toleransi glukosa saja, sedangkan pada uji toleransi insulin glukosa, data kadar insulin darah tidak terdeteksi. Kadar insulin darah pada ikan gurame yang mengkonsumsi pakan P32 ;K47 lebih tinggi dibandingkan perlakuan lainnya. Pada kadar protein yang sama, ikan yang mengkonsumsi pakan dengan kadar karbohidrat yang lebih tinggi menunjukan kadar insulin darah yang cenderung lebih tinggi dibandingkan ikan yang mengkonsumsi karbohidrat rendah (Tabel 5, Lampiran 17)