MODIFIKASI TONGKOL JAGUNG SEBAGAI
ADSORBEN LOGAM BERAT Pb(II)
SARI SULISTYAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SARI SULISTYAWATI. Modifikasi Tongkol Jagung Sebagai Adsorben Logam Berat Pb(II). Dibimbing oleh BETTY MARITA SOEBRATA dan MUCHAMMAD SRI SAENI.
Logam berat yang dihasilkan dari beberapa proses industri banyak menimbulkan masalah lingkungan. Upaya yang dilakukan untuk mengatasi pencemaran logam berat ini di antaranya metode fisikokimia, tetapi metode ini tidak efektif pada konsentrasi logam 1-100 ppm. Beberapa produk samping pertanian berpotensi sebagai adsorben, salah satunya adalah tongkol jagung. Pada penelitian ini, tongkol jagung yang digunakan sebagai adsorben Pb(II) telah dimodifikasi dengan asam nitrat 0.6M dan impregnasi NaOH 0.1N. Parameter yang diujikan adalah waktu kontak, bobot adsorben, konsentrasi awal logam, dan pH. Kondisi optimum yang diperoleh untuk adsorben tanpa modifikasi pada parameter adalah 120 menit, 0.50 g, 15 ppm, dan pH 5.00. Kondisi optimum untuk adsorben modifikasi ialah 120 menit, 0.25 g, 15 ppm, dan pH 5.50. Arang aktif yang digunakan sebagai pembanding kapasitas adsorpsi, memiliki kondisi optimum sebagai berikut 150 menit, 0.25 g, 15 ppm, dan pH 6.00. Pada pengujian larutan tunggal, kapasitas adsorpsi Pb(II) oleh adsorben tanpa modifikasi, dengan modifikasi, dan arang aktif, berturut-turut sebesar 1362.11, 2274.60, dan 2908.07 µg/g adsorben. Kapasitas adsorpsi Pb(II) oleh ketiga jenis adsorben pada limbah industri aki, berturut-turut ialah 21.73, 121.71, dan 485.11 µg/g adsorben. Tipe isoterm yang dianut oleh ketiga jenis adsorben adalah isoterm Langmuir dengan linearitas >90%.
ABSTRACT
SARI SULISTYAWATI. Corncob Modification as Pb(II) Heavy Metal Adsorbent. Supervised by BETTY MARITA SOEBRATA and MUCHAMMAD SRI SAENI.
MODIFIKASI TONGKOL JAGUNG SEBAGAI
ADSORBEN LOGAM BERAT Pb(II)
SARI SULISTYAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Modifikasi Tongkol Jagung Sebagai Adsorben Logam Berat Pb(II) Nama : Sari Sulistyawati
NIM : G44203023
Menyetujui:
Pembimbing I, Pembimbing II,
Betty Marita Soebrata, S.Si, M.Si. Prof. Dr. Ir. MS Saeni, MS NIP 131 694 523 NIP 130 256 339
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. drh. Hasim, DEA NIP 131 578 806
PRAKATA
Bismillahirrahmanirrahim…
Alhamdulillah, segala puji bagi Allah SWT karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini berjudul Modifikasi Tongkol Jagung Sebagai Adsorben Logam Berat Pb(II), yang dilaksanakan pada bulan November 2007 sampai dengan April 2008 bertempat di Laboratorium Kimia Fisik dan Lingkungan, IPB.
Penulis mengucapkan terima kasih kepada Ibu Betty Marita, S.Si, M.Si. dan (alm.) Bapak Prof. Dr. Ir. Muhamad Sri Saeni, MS selaku pembimbing yang telah memberikan masukan dan pengarahan kepada penulis. Ungkapan terima kasih dihaturkan kepada Ayah, Ibu, Dwi, dan Priya atas doa dan dukungannya. Ucapan terima kasih juga disampaikan kepada staf Departemen Kimia IPB, Ibu Ai, Bapak Nano, Bapak Mail, Bapak Eman, Bapak Didi, Bapak Syawal, dan Mas Heri atas bantuannya. Saya haturkan banyak terima kasih kepada Nova, Lia, Dany, Kak Angga, Kak Fahrizal, dan Kak Budi atas kerja samanya dan kebaikannya selama ini. Penulis juga mengucapkan terima kasih kepada Nanda atas kebersamaan dan semangat selama menjalankan penelitian.
Akhir kata, penulis menyampaikan semoga karya ilmiah ini bermanfaat bagi pembaca. Amin.
Bogor, April 2008
Sari Sulistyawati
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 3 Oktober 1985 sebagai anak pertama dari tiga bersaudara, putra dari pasangan Sumarta dan Sugimah.
Tahun 2003 penulis lulus dari SMU Negeri 3 Bogor dan memperoleh kesempatan melanjutkan studi di Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur Undangan Saringan Masuk IPB (USMI).
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Jagung ... 1
Selulosa ... 1
Adsorpsi ... 2
Modifikasi Adsorben ... 2
Isoterm Adsorpsi Freundlich ... 2
Isoterm Adsorpsi Langmuir ... 3
Timbel (Pb) ... 3
Arang Aktif ... ... 3
BAHAN DAN METODE Bahan dan Alat ... 3
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN Preparasi Tongkol Jagung ... 5
Penentuan Kondisi Optimum Adsorpsi ... 5
Kondisi Optimum Adsorben Tanpa Modifikasi ... 6
Kondisi Optimum Adsorben Modifikasi ... 7
Kondisi Optimum Arang Aktif ... 8
Adsorpsi Larutan Tunggal ... 9
Adsorpsi Limbah Industri Aki ... 10
Isoterm Adsorpsi ... 10
SIMPULAN DAN SARAN Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR
TABEL
Halaman
1 Komposisi jagung... 1
2 Kondisi optimum ATM, AM, dan AA... 9
DAFTAR GAMBAR
Halaman 1 Rumus Haworth selulosa ... 22 Adsorben tanpa modifikasi (a), adsorben modifikasi (b), dan arang aktif (c) ... 5
3 Waktu adsorpsi optimum logam Pb(II) oleh adsorben tanpa modifikasi ... 6
4 Pengaruh bobot terhadap kapasitas jerapan Pb(II) oleh adsorben tanpa modifikasi ... 6
5 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas logam Pb(II) oleh adsorben tanpa modifikasi ... 7
6 Pengaruh pH terhadap kapasitas jerapan Pb(II) oleh adsorben tanpa modifikasi . 7
7 Waktu adsorpsi optimum ion Pb(II) oleh adsorben modifikasi ... 7
8 Pengaruh bobot terhadap kapasitas jerapan Pb(II) oleh adsorben modifikasi ... 8
9 Pengaruh pH terhadap kapasitas logam Pb(II) oleh adsorben modifikasi ... 8
10 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas logam Pb(II) oleh adsorben modifikasi ... 8
11 Waktu adsorpsi optimum ion Pb(II) oleh arang aktif... 8
12 Pengaruh bobot terhadap kapasitas jerapan Pb(II) oleh arang aktif ... 9
13 Pengaruh pH terhadap kapasitas logam Pb(II) oleh arang aktif ... 9
14 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas logam Pb(II) oleh arang aktif ... 9
15 Adsorpsi logam Pb(II) pada larutan tunggal oleh adsorben tanpa modifikasi, adsorben modifikasi, dan arang aktif ... 10
16 Adsorpsi logam Pb(II) pada limbah pabrik aki oleh adsorben tanpa modifikasi, adsorben modifikasi, dan arang aktif ... . 10
17 Isoterm Langmuir adsorpsi logam Pb(II) oleh adsorben tanpa modifikasi ... 11
18 Isoterm Freundlich adsorpsi logam Pb(II) oleh adsorben tanpa modifikasi ... 11
19 Isoterm Langmuir adsorpsi logam Pb(II) oleh adsorben modifikasi ... 11
20 Isoterm Freundlich adsorpsi logam Pb(II) oleh adsorben modifikasi ... 11
21 Isoterm Langmuir adsorpsi logam Pb(II) oleh arang aktif ... 11
DAFTAR LAMPIRAN
Halaman 1 Bagan alir penelitian ... 15
2 Kadar air tongkol jagung ... 16
3 Kapasitas adsorpsi adsorben penentuan waktu optimum adsorpsi logam Pb(II) dari 50 mL larutan Pb(II) 15 ppm (adsorben tanpa modifikasi, adsorben modifikasi, dan arang aktif). ... 16
4 Pengaruh bobot adsorben terhadap kapasitas adsorpsi logam Pb(II) dari 50 mL larutan Pb(II) 15 ppm (adsorben tanpa modifikasi, adsorben
modifikasi, dan arang aktif) ... 17
5 Pengaruh pH adsorben terhadap kapasitas adsorpsi logam Pb(II) dari 50 mL larutan Pb(II) 15 ppm (adsorben tanpa modifikasi, adsorben
modifikasi, dan arang aktif) ... 17
6 Pengaruh konsentrasi logam terhadap kapasitas adsorpsi logam Pb(II)
(adsorben tanpa modifikasi, adsorben modifikasi, dan arang aktif) ... 17
7 Pengujian adsorpsi adsorben tanpa modifikasi, adsorben modifikasi, dan
arang aktif terhadap larutan tunggal Pb(II) pada kondisi optimum ... 18
8 Pengujian adsorben (adsorben tanpa modifikasi, adsorben modifikasi, dan
arang aktif) terhadap limbah industri aki pada kondisi optimum... 18
9 Komposisi limbah aki ... 18
10 Reaksi pengolahan aki ... 18
11 Data untuk pembuatan isoterm Langmuir dan Freundlich untuk adsorpsi
logam Pb(II) oleh adsorben tanpa modifikasi ... 19
12 Data untuk pembuatan isoterm Langmuir dan Freundlich untuk adsorpsi
logam Pb(II) oleh adsorben modifikasi ... 19
13 Data untuk pembuatan isoterm Langmuir dan Freundlich untuk adsorpsi
PENDAHULUAN
Latar Belakang
Kontaminasi logam berat di lingkungan merupakan salah satu masalah besar dunia. Peningkatan kadar logam berat menyebabkan keracunan pada tanah, udara, dan air. Proses industri dan urbanisasi memegang peranan penting terhadap kontaminasi tersebut. Berbagai usaha dilakukan untuk mengatasi pencemaran logam berat ini, di antaranya dengan metode fisikokimia seperti presipitasi kimia, osmosis balik, dan pertukaran ion (Suhendrayatna 2001). Akan tetapi metode tersebut memiliki kelemahan, yaitu tidak efektif pada konsentrasi larutan ion logam 1─100 ppm. Metode lain yang dapat
digunakan adalah adsorpsi dengan
menggunakan adsorben, seperti arang aktif dan zeolit. Kumar (2006) menyatakan bahwa beberapa hasil samping pertanian, seperti
gabah padi dan kulit kacang dapat
dimanfaatkan sebagai adsorben Cr(VI)
.
Selain itu Igwe dan Abia (2006) menunjukkan kulit jeruk dan tangkai bunga matahari dapat menjerap logam Cu(II). Untuk itu, diharapkan muncul adsorben alternatif yang mampu bersaing dengan adsorben komersial seperti arang aktif.Jagung merupakan salah satu jenis tanaman pangan biji-bijian. Produksi jagung di Indonesia setiap tahunnya menunjukkan peningkatan. Pada tahun 2004 sebesar 11.22 juta ton, tahun 2005 meningkat menjadi 12.52 juta ton, tahun 2006 mencapai 12.13 juta ton, dan diperkirakan pada tahun 2007 produksi mencapai 14 juta ton (BPS 2007). Tingkat konsumsi jagung pada tahun 2006 sekitar 3.5 juta ton, sedangkan tahun 2007 mencapai 4.1 juta ton.
Penelitian oleh Rajawane (2008)
memperlihatkan bahwa kulit buah kakao yang mengandung pektin dan selulosa berpotensi sebagai adsorben logam Pb(II) dari limbah industri aki dengan kapasitas adsorpsi 724.90 µg/g adsorben. Hal ini diperkuat dengan penelitian Fahrizal (2008) yang menunjukkan bahwa modifikasi selulosa pada tongkol jagung mampu menjerap biru metilena dari limbah tekstil dengan kapasitas adsorpsi 518.07 µg/g adsorben. Pada penelitian tersebut digunakan asam nitrat untuk mengaktivasi selulosa dan natrium hidroksida untuk impregnasi. Hasil-hasil penelitian
tersebut menunjukkan bahwa limbah
pertanian yang mengandung selulosa, seperti tongkol jagung dapat diolah lebih lanjut
sebagai adsorben dan diharapkan mampu meningkatkan nilai tambahnya.
Penelitian ini bertujuan memodifikasi tongkol jagung dengan larutan asam nitrat dan memanfaatkannya sebagai adsorben. Uji kapasitas adsorpsi dari tongkol jagung tersebut dilakukan pada larutan logam tunggal Pb(II) dan limbah industri aki.
TINJAUAN PUSTAKA
Jagung
Jagung merupakan salah satu tanaman pangan dunia yang terpenting, selain gandum dan padi. Selain sebagai sumber karbohidrat, jagung juga digunakan sebagai pakan ternak, diolah menjadi minyak, tepung (dikenal dengan istilah tepung jagung atau maizena), furfural, bioetanol, dan bahan baku industri.
Tongkol jagung kaya akan pentosa yang dipakai sebagai bahan baku pembuatan furfural. Furfural banyak digunakan sebagai pelarut dalam industri pengolahan minyak bumi, pembuatan pelumas, dan pembuatan nilon.
Tongkol jagung sebagian besar tersusun oleh selulosa (41%), hemiselulosa (36%), lignin (6%), dan senyawa lain yang umum terdapat dalam tumbuhan (Tabel 1). Aktivasi terhadap adsorben mengarah pada aktivasi gugus hidroksil pada selulosa, sehingga kemampuannya menjerap zat warna maupun ion logam meningkat (Igwe et al. 2005).
Tabel 1 Komposisi tongkol jagung
Komponen %
Air 9.6
Abu 1.5
Hemiselulosa 36.0
Selulosa 41.0
Lignin 6.0
Pektin 3.0
Pati 0.014
Sumber: Lorenz & Kulp (1991).
Selulosa
Selulosa merupakan karbohidrat utama yang disintesis oleh tanaman dan menempati hampir 60% komponen penyusun struktur tanaman. Selulosa terdiri atas rantai lurus homopolisakarida yang disusun oleh unit-unit D-glukopiranosa melalui ikatan glikosidik β─
MODIFIKASI TONGKOL JAGUNG SEBAGAI
ADSORBEN LOGAM BERAT Pb(II)
SARI SULISTYAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SARI SULISTYAWATI. Modifikasi Tongkol Jagung Sebagai Adsorben Logam Berat Pb(II). Dibimbing oleh BETTY MARITA SOEBRATA dan MUCHAMMAD SRI SAENI.
Logam berat yang dihasilkan dari beberapa proses industri banyak menimbulkan masalah lingkungan. Upaya yang dilakukan untuk mengatasi pencemaran logam berat ini di antaranya metode fisikokimia, tetapi metode ini tidak efektif pada konsentrasi logam 1-100 ppm. Beberapa produk samping pertanian berpotensi sebagai adsorben, salah satunya adalah tongkol jagung. Pada penelitian ini, tongkol jagung yang digunakan sebagai adsorben Pb(II) telah dimodifikasi dengan asam nitrat 0.6M dan impregnasi NaOH 0.1N. Parameter yang diujikan adalah waktu kontak, bobot adsorben, konsentrasi awal logam, dan pH. Kondisi optimum yang diperoleh untuk adsorben tanpa modifikasi pada parameter adalah 120 menit, 0.50 g, 15 ppm, dan pH 5.00. Kondisi optimum untuk adsorben modifikasi ialah 120 menit, 0.25 g, 15 ppm, dan pH 5.50. Arang aktif yang digunakan sebagai pembanding kapasitas adsorpsi, memiliki kondisi optimum sebagai berikut 150 menit, 0.25 g, 15 ppm, dan pH 6.00. Pada pengujian larutan tunggal, kapasitas adsorpsi Pb(II) oleh adsorben tanpa modifikasi, dengan modifikasi, dan arang aktif, berturut-turut sebesar 1362.11, 2274.60, dan 2908.07 µg/g adsorben. Kapasitas adsorpsi Pb(II) oleh ketiga jenis adsorben pada limbah industri aki, berturut-turut ialah 21.73, 121.71, dan 485.11 µg/g adsorben. Tipe isoterm yang dianut oleh ketiga jenis adsorben adalah isoterm Langmuir dengan linearitas >90%.
ABSTRACT
SARI SULISTYAWATI. Corncob Modification as Pb(II) Heavy Metal Adsorbent. Supervised by BETTY MARITA SOEBRATA and MUCHAMMAD SRI SAENI.
MODIFIKASI TONGKOL JAGUNG SEBAGAI
ADSORBEN LOGAM BERAT Pb(II)
SARI SULISTYAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Modifikasi Tongkol Jagung Sebagai Adsorben Logam Berat Pb(II) Nama : Sari Sulistyawati
NIM : G44203023
Menyetujui:
Pembimbing I, Pembimbing II,
Betty Marita Soebrata, S.Si, M.Si. Prof. Dr. Ir. MS Saeni, MS NIP 131 694 523 NIP 130 256 339
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. drh. Hasim, DEA NIP 131 578 806
PRAKATA
Bismillahirrahmanirrahim…
Alhamdulillah, segala puji bagi Allah SWT karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini berjudul Modifikasi Tongkol Jagung Sebagai Adsorben Logam Berat Pb(II), yang dilaksanakan pada bulan November 2007 sampai dengan April 2008 bertempat di Laboratorium Kimia Fisik dan Lingkungan, IPB.
Penulis mengucapkan terima kasih kepada Ibu Betty Marita, S.Si, M.Si. dan (alm.) Bapak Prof. Dr. Ir. Muhamad Sri Saeni, MS selaku pembimbing yang telah memberikan masukan dan pengarahan kepada penulis. Ungkapan terima kasih dihaturkan kepada Ayah, Ibu, Dwi, dan Priya atas doa dan dukungannya. Ucapan terima kasih juga disampaikan kepada staf Departemen Kimia IPB, Ibu Ai, Bapak Nano, Bapak Mail, Bapak Eman, Bapak Didi, Bapak Syawal, dan Mas Heri atas bantuannya. Saya haturkan banyak terima kasih kepada Nova, Lia, Dany, Kak Angga, Kak Fahrizal, dan Kak Budi atas kerja samanya dan kebaikannya selama ini. Penulis juga mengucapkan terima kasih kepada Nanda atas kebersamaan dan semangat selama menjalankan penelitian.
Akhir kata, penulis menyampaikan semoga karya ilmiah ini bermanfaat bagi pembaca. Amin.
Bogor, April 2008
Sari Sulistyawati
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 3 Oktober 1985 sebagai anak pertama dari tiga bersaudara, putra dari pasangan Sumarta dan Sugimah.
Tahun 2003 penulis lulus dari SMU Negeri 3 Bogor dan memperoleh kesempatan melanjutkan studi di Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur Undangan Saringan Masuk IPB (USMI).
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Jagung ... 1
Selulosa ... 1
Adsorpsi ... 2
Modifikasi Adsorben ... 2
Isoterm Adsorpsi Freundlich ... 2
Isoterm Adsorpsi Langmuir ... 3
Timbel (Pb) ... 3
Arang Aktif ... ... 3
BAHAN DAN METODE Bahan dan Alat ... 3
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN Preparasi Tongkol Jagung ... 5
Penentuan Kondisi Optimum Adsorpsi ... 5
Kondisi Optimum Adsorben Tanpa Modifikasi ... 6
Kondisi Optimum Adsorben Modifikasi ... 7
Kondisi Optimum Arang Aktif ... 8
Adsorpsi Larutan Tunggal ... 9
Adsorpsi Limbah Industri Aki ... 10
Isoterm Adsorpsi ... 10
SIMPULAN DAN SARAN Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR
TABEL
Halaman
1 Komposisi jagung... 1
2 Kondisi optimum ATM, AM, dan AA... 9
DAFTAR GAMBAR
Halaman 1 Rumus Haworth selulosa ... 22 Adsorben tanpa modifikasi (a), adsorben modifikasi (b), dan arang aktif (c) ... 5
3 Waktu adsorpsi optimum logam Pb(II) oleh adsorben tanpa modifikasi ... 6
4 Pengaruh bobot terhadap kapasitas jerapan Pb(II) oleh adsorben tanpa modifikasi ... 6
5 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas logam Pb(II) oleh adsorben tanpa modifikasi ... 7
6 Pengaruh pH terhadap kapasitas jerapan Pb(II) oleh adsorben tanpa modifikasi . 7
7 Waktu adsorpsi optimum ion Pb(II) oleh adsorben modifikasi ... 7
8 Pengaruh bobot terhadap kapasitas jerapan Pb(II) oleh adsorben modifikasi ... 8
9 Pengaruh pH terhadap kapasitas logam Pb(II) oleh adsorben modifikasi ... 8
10 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas logam Pb(II) oleh adsorben modifikasi ... 8
11 Waktu adsorpsi optimum ion Pb(II) oleh arang aktif... 8
12 Pengaruh bobot terhadap kapasitas jerapan Pb(II) oleh arang aktif ... 9
13 Pengaruh pH terhadap kapasitas logam Pb(II) oleh arang aktif ... 9
14 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas logam Pb(II) oleh arang aktif ... 9
15 Adsorpsi logam Pb(II) pada larutan tunggal oleh adsorben tanpa modifikasi, adsorben modifikasi, dan arang aktif ... 10
16 Adsorpsi logam Pb(II) pada limbah pabrik aki oleh adsorben tanpa modifikasi, adsorben modifikasi, dan arang aktif ... . 10
17 Isoterm Langmuir adsorpsi logam Pb(II) oleh adsorben tanpa modifikasi ... 11
18 Isoterm Freundlich adsorpsi logam Pb(II) oleh adsorben tanpa modifikasi ... 11
19 Isoterm Langmuir adsorpsi logam Pb(II) oleh adsorben modifikasi ... 11
20 Isoterm Freundlich adsorpsi logam Pb(II) oleh adsorben modifikasi ... 11
21 Isoterm Langmuir adsorpsi logam Pb(II) oleh arang aktif ... 11
DAFTAR LAMPIRAN
Halaman 1 Bagan alir penelitian ... 15
2 Kadar air tongkol jagung ... 16
3 Kapasitas adsorpsi adsorben penentuan waktu optimum adsorpsi logam Pb(II) dari 50 mL larutan Pb(II) 15 ppm (adsorben tanpa modifikasi, adsorben modifikasi, dan arang aktif). ... 16
4 Pengaruh bobot adsorben terhadap kapasitas adsorpsi logam Pb(II) dari 50 mL larutan Pb(II) 15 ppm (adsorben tanpa modifikasi, adsorben
modifikasi, dan arang aktif) ... 17
5 Pengaruh pH adsorben terhadap kapasitas adsorpsi logam Pb(II) dari 50 mL larutan Pb(II) 15 ppm (adsorben tanpa modifikasi, adsorben
modifikasi, dan arang aktif) ... 17
6 Pengaruh konsentrasi logam terhadap kapasitas adsorpsi logam Pb(II)
(adsorben tanpa modifikasi, adsorben modifikasi, dan arang aktif) ... 17
7 Pengujian adsorpsi adsorben tanpa modifikasi, adsorben modifikasi, dan
arang aktif terhadap larutan tunggal Pb(II) pada kondisi optimum ... 18
8 Pengujian adsorben (adsorben tanpa modifikasi, adsorben modifikasi, dan
arang aktif) terhadap limbah industri aki pada kondisi optimum... 18
9 Komposisi limbah aki ... 18
10 Reaksi pengolahan aki ... 18
11 Data untuk pembuatan isoterm Langmuir dan Freundlich untuk adsorpsi
logam Pb(II) oleh adsorben tanpa modifikasi ... 19
12 Data untuk pembuatan isoterm Langmuir dan Freundlich untuk adsorpsi
logam Pb(II) oleh adsorben modifikasi ... 19
13 Data untuk pembuatan isoterm Langmuir dan Freundlich untuk adsorpsi
PENDAHULUAN
Latar Belakang
Kontaminasi logam berat di lingkungan merupakan salah satu masalah besar dunia. Peningkatan kadar logam berat menyebabkan keracunan pada tanah, udara, dan air. Proses industri dan urbanisasi memegang peranan penting terhadap kontaminasi tersebut. Berbagai usaha dilakukan untuk mengatasi pencemaran logam berat ini, di antaranya dengan metode fisikokimia seperti presipitasi kimia, osmosis balik, dan pertukaran ion (Suhendrayatna 2001). Akan tetapi metode tersebut memiliki kelemahan, yaitu tidak efektif pada konsentrasi larutan ion logam 1─100 ppm. Metode lain yang dapat
digunakan adalah adsorpsi dengan
menggunakan adsorben, seperti arang aktif dan zeolit. Kumar (2006) menyatakan bahwa beberapa hasil samping pertanian, seperti
gabah padi dan kulit kacang dapat
dimanfaatkan sebagai adsorben Cr(VI)
.
Selain itu Igwe dan Abia (2006) menunjukkan kulit jeruk dan tangkai bunga matahari dapat menjerap logam Cu(II). Untuk itu, diharapkan muncul adsorben alternatif yang mampu bersaing dengan adsorben komersial seperti arang aktif.Jagung merupakan salah satu jenis tanaman pangan biji-bijian. Produksi jagung di Indonesia setiap tahunnya menunjukkan peningkatan. Pada tahun 2004 sebesar 11.22 juta ton, tahun 2005 meningkat menjadi 12.52 juta ton, tahun 2006 mencapai 12.13 juta ton, dan diperkirakan pada tahun 2007 produksi mencapai 14 juta ton (BPS 2007). Tingkat konsumsi jagung pada tahun 2006 sekitar 3.5 juta ton, sedangkan tahun 2007 mencapai 4.1 juta ton.
Penelitian oleh Rajawane (2008)
memperlihatkan bahwa kulit buah kakao yang mengandung pektin dan selulosa berpotensi sebagai adsorben logam Pb(II) dari limbah industri aki dengan kapasitas adsorpsi 724.90 µg/g adsorben. Hal ini diperkuat dengan penelitian Fahrizal (2008) yang menunjukkan bahwa modifikasi selulosa pada tongkol jagung mampu menjerap biru metilena dari limbah tekstil dengan kapasitas adsorpsi 518.07 µg/g adsorben. Pada penelitian tersebut digunakan asam nitrat untuk mengaktivasi selulosa dan natrium hidroksida untuk impregnasi. Hasil-hasil penelitian
tersebut menunjukkan bahwa limbah
pertanian yang mengandung selulosa, seperti tongkol jagung dapat diolah lebih lanjut
sebagai adsorben dan diharapkan mampu meningkatkan nilai tambahnya.
Penelitian ini bertujuan memodifikasi tongkol jagung dengan larutan asam nitrat dan memanfaatkannya sebagai adsorben. Uji kapasitas adsorpsi dari tongkol jagung tersebut dilakukan pada larutan logam tunggal Pb(II) dan limbah industri aki.
TINJAUAN PUSTAKA
Jagung
Jagung merupakan salah satu tanaman pangan dunia yang terpenting, selain gandum dan padi. Selain sebagai sumber karbohidrat, jagung juga digunakan sebagai pakan ternak, diolah menjadi minyak, tepung (dikenal dengan istilah tepung jagung atau maizena), furfural, bioetanol, dan bahan baku industri.
Tongkol jagung kaya akan pentosa yang dipakai sebagai bahan baku pembuatan furfural. Furfural banyak digunakan sebagai pelarut dalam industri pengolahan minyak bumi, pembuatan pelumas, dan pembuatan nilon.
Tongkol jagung sebagian besar tersusun oleh selulosa (41%), hemiselulosa (36%), lignin (6%), dan senyawa lain yang umum terdapat dalam tumbuhan (Tabel 1). Aktivasi terhadap adsorben mengarah pada aktivasi gugus hidroksil pada selulosa, sehingga kemampuannya menjerap zat warna maupun ion logam meningkat (Igwe et al. 2005).
Tabel 1 Komposisi tongkol jagung
Komponen %
Air 9.6
Abu 1.5
Hemiselulosa 36.0
Selulosa 41.0
Lignin 6.0
Pektin 3.0
Pati 0.014
Sumber: Lorenz & Kulp (1991).
Selulosa
Selulosa merupakan karbohidrat utama yang disintesis oleh tanaman dan menempati hampir 60% komponen penyusun struktur tanaman. Selulosa terdiri atas rantai lurus homopolisakarida yang disusun oleh unit-unit D-glukopiranosa melalui ikatan glikosidik β─
2
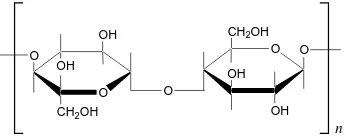
tersebut. Ikatan glikosidik β─(1,4) pada selulosa dapat dihidrolisis oleh asam kuat, menghasilkan glukosa dan selobiosa. Ikatan ini tidak dapat dihidrolisis oleh enzim glikosidase yang terdapat dalam pencernaan manusia. Rumus Haworth selulosa dapat dilihat pada Gambar 2.
O
O CH2OH
OH OH O O O OH OH CH2OH
n
Gambar 1 Rumus Haworth selulosa.
Adsorpsi
Adsorpsi merupakan peristiwa
terakumulasinya partikel pada permukaan. Partikel yang terakumulasi dan dijerap oleh permukaan disebut adsorbat dan material tempat terjadinya adsorpsi disebut adsorben atau substrat (Atkins 1999).
Proses adsorpsi terdiri atas dua jenis, yaitu adsorpsi kimia (kimisorpsi) dan fisika (fisisorpsi). Pada adsorpsi kimia, suatu molekul menempel ke permukaan melalui pembentukan ikatan kimia. Sementara itu dalam adsorpsi fisika, adsorbat menempel
pada permukaan melalui interaksi
antarmolekul yang lemah.
Faktor-faktor yang memengaruhi proses adsorpsi antara lain sifat fisik dan kimia adsorben seperti luas permukaan, ukuran partikel, dan komposisi kimia. Semakin kecil ukuran partikel, maka semakin besar luas permukaan padatan per satuan volume tertentu, sehingga akan semakin banyak zat yang diadsorpsi. Faktor lainnya adalah sifat fisis dan kimia adsorbat, seperti ukuran
molekul dan komposisi kimia, serta
konsentrasi adsorbat dalam fase cairan (Atkins 1999).
Modifikasi Adsorben
Kapasitas adsorpsi adsorben dapat
ditingkatkan dengan modifikasi bahan oleh larutan asam atau basa, atau dapat juga oleh perlakuan fisik seperti pemanasan (Marshall & Mitchell 1996). Modifikasi dengan larutan asam paling umum digunakan dan terbukti
efektif dalam meningkatkan kapasitas
adsorpsi (Gufta 1998). Larutan asam yang sering digunakan antara lain asam nitrat, asam
klorida, dan asam fosfat. Pada penelitian ini digunakan asam nitrat. Hal ini berdasarkan penelitian Dewi (2005) yang menyatakan bahwa modifikasi selulosa pada kulit singkong dengan asam nitrat memberikan
kapasitas adsorpsi yang lebih besar
dibandingkan dengan modifikasi oleh asam fosfat.
Isoterm Adsorpsi
Hubungan kesetimbangan antara potensial kimia adsorbat dalam gas atau cairan dan potensial kimia adsorbat di permukaan adsorben pada suhu tetap dikatakan sebagai isoterm adsorpsi. Kesetimbangan tercapai jika laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya (Koumanova & Antova 2002).
Isoterm adsorpsi yang umum dikenal ada tiga macam, yaitu isoterm Freundlich,
Langmuir, dan Brenauer-Emmet-Teller
(BET). Isoterm Freundlich dan Langmuir digunakan untuk gas atau larutan dengan konsentrasi rendah. Isoterm BET merupakan modifikasi isoterm Langmuir pada tekanan tinggi (Alberty & Silbey 1992).
Isoterm Freundlich
Isoterm Freundlich mengasumsikan suatu permukaan adsorpsi yang heterogen dan
perbedaan energi pada tapak aktif
(Koumanova & Antova 2002). Model isoterm ini menganggap bahwa pada semua tapak aktif permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak mampu memperkirakan adanya tapak-tapak pada
permukaan yang mampu mencegah
tercapainya adsorpsi pada kesetimbangan. Hanya ada beberapa tapak aktif saja yang mampu mengadsorpsi molekul terlarut (Jason 2004).
Persamaan Freundlich dituliskan sebagai berikut:
n
C k m
x = 1/ ... (1)
Persamaan dalam bentuk logaritma:
C n k m x log 1 log
log = + ... (2)
dengan:
m x
= jumlah adsorbat terjerap per satuan
bobot adsorben (µg/g adsorben)
3
adsorbat dalam larutan setelah adsorpsi (ppm)
k, n = konstanta empiris
Isoterm Langmuir
Isoterm Langmuir didasarkan pada asumsi bahwa sejumlah tertentu tapak sentuh adsorben terdapat pada permukaan dan memiliki energi yang sama, serta adsorpsi bersifat dapat balik (Atkins 1999). Menurut Ribeiro et al. (2005), isoterm Langmuir mengasumsikan bahwa setiap tapak adsorpsi adalah ekuivalen dan kemampuan partikel untuk terikat di tapak tersebut tidak bergantung pada ditempati atau tidak ditempatinya tempat yang berdekatan. Dengan kata lain, permukaan adsorpsi digambarkan homogen.
Persamaan Langmuir dituliskan sebagai berikut: C C m x β β α + = 1 ... (3)
Konstanta α, β dapat ditentukan dari kurva hubungan
m x
C
/
terhadap C dengan persamaan:
C m x C α β α 1 1 / = + ... (4) Timbel (Pb)
Timbel atau dikenal sebagai logam Pb dalam susunan unsur berkala merupakan logam berat yang terdapat secara alami di dalam kerak bumi dan tersebar ke alam dalam jumlah kecil melalui proses alami. Unsur Pb dengan nomor atom 82, bobot atom 207.2 g/mol, dan densitas 11.4 g/cm3 merupakan logam yang sangat beracun yang dapat dideteksi hampir pada seluruh benda mati di lingkungan dan seluruh sistem hayati.
Timbel yang terhirup atau tertelan oleh manusia dan masuk ke dalam tubuh, akan beredar mengikuti aliran darah, diserap kembali di dalam ginjal dan otak, dan disimpan di dalam tulang dan gigi. Manusia menyerap timbel melalui udara, debu, air, dan makanan.
Sumber utama timbel berasal dari turunan gugus alkil yang digunakan sebagai bahan aditif bensin. Timbel secara tidak sengaja juga terdapat pada makanan dan minuman. Dalam air minum timbel dapat berasal dari kontaminasi pipa, solder, dan keran air. Komponen ini beracun terhadap seluruh segi
kehidupan. Sifat racunnya dapat merusak sistem saraf, sistem reproduksi, hati, otak, dan memengaruhi kerja ginjal (Saeni 1989). Toleransi konsumsi mingguan unsur ini yang direkomendasikan oleh WHO bagi orang dewasa dan untuk bayi atau anak-anak adalah 50 dan 25 µg/kg bobot badan. Mobilitas timbel di tanah dan tumbuhan cenderung lambat dengan kadar normal pada tumbuhan berkisar 0.5─3 ppm (Suhendrayatna 2001).
Arang Aktif
Arang aktif merupakan karbon dengan struktur amorf atau mikrokristalin yang dengan perlakuan khusus dapat memiliki luas permukaan dalam yang sangat besar. Struktur amorf tersebut terdiri dari pelat-pelat datar, disusun oleh atom-atom karbon yang terikat secara kovalen dalam suatu tapak heksagon (Djatmiko et al. 1985). Pori-pori dalam arang biasanya diisi oleh tar, hidrokarbon, dan zat-zat organik lainnya yang terdiri dari fixed carbon, abu, air, serta senyawaan yang mengandung nitrogen dan sulfur (Ketaren 1986).
Arang aktif dapat dibuat dari bahan yang mengandung karbon. Sumber bahan baku yang dapat digunakan antara lain kayu, ampas tebu, tempurung kelapa, tongkol jagung, tulang, dan batu bara. Suhu aktivasi pada arang berkisar 300─900 °C bergantung pada cara pengaktifannya. Aktivasi arang dapat juga dilakukan pada suhu 1000 °C dengan cara kimiawi. Ukuran pori dari arang aktif dapat digolongkan menjadi tiga macam, yaitu makro, meso, dan mikro. Makropori memiliki ukuran diameter pori sebesar 1000─100 000
Ǻ, mesopori memiliki diameter 100─1000 Ǻ, dan mikropori memiliki diameter kurang dari 100 Ǻ. Luas permukaan arang aktif pada umumnya berkisar dari 850─3000 m2/g (Djatmiko et al. 1985).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah tongkol jagung usia 92 hari yang berasal dari Cisarua, HCl 0.1N, NaOH 0.1N, HNO3 0.6N,
Pb(NO3)2 20 ppm, dan air deionisasi.
Alat-alat yang digunakan adalah
4
Titramax 101, oven, eksikator, hot plate
Nuova Thermolyne, ayakan ukuran 100 mesh, dan peralatan kaca.
Metode
Tongkol jagung setelah melalui tahap preparasi kemudian dimodifikasi dengan menggunakan asam nitrat dan impregnasi
natrium hidroksida. Kondisi optimum
ditentukan sebelum adsorpsi pada larutan tunggal dan limbah industri. Diagram alir penelitian selengkapnya dapat dilihat pada Lampiran 1.
Preparasi Tongkol Jagung
Tongkol jagung dicuci dengan air
mengalir dan air deionisasi sampai bersih, setelah itu dikeringudarakan dalam oven, digiling sampai kira-kira berukuran 100 mesh (Horsfall et al. 2003). Serbuk tongkol jagung ini selanjutnya disebut adsorben tanpa modifikasi.
Penentuan Kadar Air Tongkol Jagung
Tongkol jagung yang telah dicuci, ditimbang sebanyak 1 g. Setelah itu, ditempatkan dalam cawan petri yang telah dikeringkan di dalam oven dan telah diketahui bobot tetapnya. Cawan petri berisi sampel lalu dikeringkan dalam oven pada suhu 105 oC selama 3 jam dan didinginkan. Setelah dingin, disimpan dalam eksikator lalu ditimbang. Pengeringan dilakukan beberapa kali selama
±
30 menit sampai diperoleh bobot tetap. Analisis dilakukan sebanyak tiga ulangan. Kadar air dihitung sebagai berikut:Kadar air = − ×100%
c b a
... (5)
dengan:
a = bobot sampel dan cawan petri sebelum dikeringkan (g)
b = bobot sampel dan cawan petri sesudah dikeringkan (g)
c = bobot sampel sebelum dikeringkan (g)
Pembuatan Larutan Logam
Larutan standar logam Pb2+ 20 ppm dibuat dengan cara melarutkan 31.28 mg Pb(NO3)2
dalam air deionisasi dan diencerkan hingga satu liter.
Modifikasi Asam Nitrat
Sebanyak 100 g adsorben tanpa modifikasi dimasukkan dalam gelas piala 1 L lalu ditambahkan 660 ml asam nitrat 0.6N. Campuran dikocok sambil dipanaskan pada suhu 40 oC selama 3 jam, kemudian disaring. Residu dikeringkan dalam oven pada suhu 50
o
C selama 24 jam, kemudian suhu dinaikkan menjadi 180 oC lalu didinginkan. Setelah itu, direndam dalam air deionisasi panas untuk menghilangkan kelebihan asam dan kembali dikeringkan pada suhu 50 oC selama 24 jam (Marshall et al. 1999). Hasil ini selanjutnya disebut adsorben termodifikasi asam nitrat.
Impregnasi NaOH
Sampel adsorben termodifikasi asam nitrat dimasukkan ke dalam gelas piala 4 L lalu ditambahkan 2 L NaOH 0.1N. Campuran dikocok selama 20 menit sambil dipanaskan pada suhu 80 oC kemudian disaring dan filtratnya dibuang. Setelah itu, residu dicuci dengan menggunakan air deionisasi sebanyak dua kali untuk menghilangkan kelebihan basa, sebelum dikeringkan dalam oven pada suhu 50 oC selama 24 jam (Marshall et al. 1999). Sampel yang dihasilkan selanjutnya disebut adsorben modifikasi.
Penentuan Kondisi Optimum Waktu Adsorpsi
Sebanyak 1 g adsorben dimasukkan ke
dalam 50 ml larutan logam dengan
konsentrasi 15 ppm, kemudian suspensi dikocok dengan shaker. Adsorpsi dilakukan dengan ragam waktu adsorpsi 30, 60, 90, dan 120 menit. Waktu optimum ditentukan dengan menghitung kapasitas adsorpsi maksimum untuk ketiga jenis adsorben, yaitu adsorben tanpa modifikasi, dengan modifikasi, dan arang aktif.
Kapasitas adsorpsi dapat dihitung dengan persamaan:
(
)
m C C VQ= o− a ... (6)
dengan:
Q = kapasitas adsorpsi per bobot
adsorben (µg/g adsorben)
V = volume larutan (ml)
Co = konsentrasi awal larutan (ppm)
Ca = konsentrasi akhir larutan (ppm)
5
Bobot Adsorben
Ragam bobot adsorben yang digunakan adalah 0.25, 0.50, 0.75, dan 1.0 g. Masing-masing dimasukkan ke dalam 50 ml larutan logam 15 ppm kemudian dikocok dengan
shaker. Adsorpsi ini dilakukan pada waktu optimum.
Konsentrasi Awal Logam
Bobot optimum adsorben yang diperoleh dimasukkan ke dalam 50 ml larutan logam. Kemudian larutan dikocok dengan shaker
selama waktu optimum. Ragam konsentrasi logam yang digunakan adalah 5.0, 10.0 dan 15.0 ppm.
pH
Bobot optimum adsorben yang diperoleh ditambahkan ke dalam Erlenmeyer yang berisi 50 ml larutan logam dengan konsentrasi optimum pada pH 5.0, 5.5, 6.0, dan 6.5. Campuran dikocok selama waktu optimum adsorpsi, kemudian disaring dan diukur.
Kemampuan Adsorpsi dari Adsorben Tanpa Modifikasi, Modifikasi, dan Arang Aktif
Adsorben tanpa modifikasi, dengan
modifikasi, dan arang aktif diujikan dalam larutan tunggal Pb(II) dan limbah pabrik aki PT Nitress Tbk pada kondisi optimum setiap adsorben.
Isoterm Adsorpsi
Isoterm adsorpsi untuk Pb(II) ditentukan untuk setiap adsorben pada suhu ruang, waktu optimum, bobot optimum, dan pH optimum. Sebanyak 50 ml larutan tunggal Pb(II) pada beberapa konsentrasi, yaitu 1, 5, 10, 25, 50, dan 100 ppm, dimasukkan ke dalam Erlenmeyer 250 ml. Kemudian ditambahkan adsorben, dan larutan dikocok dengan menggunakan shaker. Larutan disaring dengan menggunakan kertas saring. Filtratnya kemudian dianalisis dengan spektrofotometer serapan atom (SSA). Blangko juga disiapkan dan dianalisis.
HASIL DAN PEMBAHASAN
Preparasi Tongkol Jagung
Limbah tongkol jagung hasil panen, dibersihkan dengan air mengalir dan air deionisasi. Tujuannya ialah untuk mengurangi
kotoran yang melekat dan ion-ion
pengganggu. Adsorben yang dihasilkan dari tongkol jagung dapat dilihat pada Gambar 3a dan 3b. Sebagai pembanding kapasitas adsorpsi (Q) digunakan arang aktif yang telah dikenal sebagai adsorben komersial (Gambar 3c).
(a) (b)
(c)
Gambar 2 Adsorben tanpa modifikasi (a), dengan modifikasi (b), dan arang aktif (c).
Ukuran 100 mesh dipilih berdasarkan hasil
penelitian Sunarya (2005), karena
memberikan kapasitas adsorpsi yang tinggi. Ukuran partikel adsorben adalah salah satu faktor yang memengaruhi adsorpsi. Pada metode tumpak, ukuran butir adsorben yang semakin kecil akan meningkatkan luas permukaan (Demirbas et al. 2004).
Kadar air rerata yang diperoleh adalah 9.71% (Lampiran 2). Menurut Lorenz dan Kulp (1991), tongkol jagung memiliki kadar air sebesar 9.60%. Kandungan air yang terlalu tinggi berpengaruh terhadap penurunan mutu
adsorben tongkol jagung selama
6
Penentuan Kondisi Optimum Adsorpsi
Parameter yang digunakan untuk
menentukan kondisi optimum adalah waktu adsorpsi, bobot adsorben, konsentrasi logam yang dijerap, dan pH adsorbat. Setiap adsorben memiliki karakteristik yang berbeda dalam proses adsorpsi, sehingga kondisi yang dibutuhkan untuk adsorpsi juga berbeda. Kondisi optimum ditentukan berdasarkan kapasitas adsorpsi (Q) tertinggi dari masing-masing parameter. Raghuvanshi et al. (2004)
menyatakan bahwa kapasitas adsorpsi
berbanding lurus dengan waktu sampai pada titik tertentu, kemudian mengalami penurunan setelah melewati titik tersebut. Barros et al.
(2003) menyatakan bahwa peningkatan bobot adsorben akan menyediakan tapak aktif yang
lebih besar, sehingga meningkatkan
persentase penjerapan. Notodarmojo (2004) menyatakan bahwa kondisi pH memengaruhi sifat elektrokimia larutan adsorbat. Untuk adsorpsi kation, umumnya pH tinggi akan meningkatkan daya sorpsi.
Kapasitas adsorpsi juga akan meningkat
seiring dengan konsentrasi adsorbat.
Konsentrasi yang tinggi akan menyebabkan jumlah molekul dalam larutan bertambah, sehingga meningkatkan interaksi molekul adsorbat dengan adsorben. Interaksi yang tinggi akan meningkatkan laju reaksi, sehingga adsorbat yang terjerap semakin besar (Barros et al. 2003).
Kondisi Optimum Adsorben Tanpa Modifikasi
Kapasitas adsorpsi adsorben tanpa
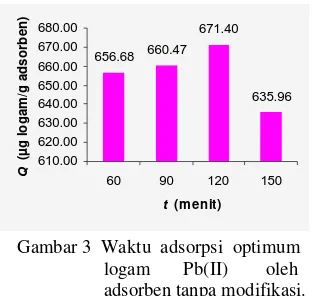
modifikasi mengalami kenaikan sampai
mencapai maksimum pada menit ke-120, yaitu sebesar 671.40 µg/g adsorben (Lampiran 3). Setelah melewati 120 menit, kapasitas adsorpsi menurun. Hal ini dapat dilihat pada Gambar 4. Menurunnya kapasitas adsorpsi
setelah mencapai nilai maksimum
dimungkinkan karena proses desorpsi atau
pelepasan adsorbat kembali selama
pengocokan. Desorpsi terjadi akibat
permukaan adsorben yang telah jenuh. Pada keadaan jenuh, laju adsorpsi menjadi berkurang (Mulyana et al. 2003).
656.68 660.47 671.40 635.96 610.00 620.00 630.00 640.00 650.00 660.00 670.00 680.00
60 90 120 150
t (m enit)
Q ( µ g l o g a m /g a d s o rb e n )
Gambar 3 Waktu adsorpsi optimum logam Pb(II) oleh adsorben tanpa modifikasi.
Pengaruh bobot terhadap kapasitas
adsorpsi dapat dilihat pada Gambar 5. Adsorpsi maksimum terjadi saat bobot adsorben 0.50 gram dengan kapasitas adsorpsi sebesar 1453.69 µg/g adsorben (Lampiran 4). Penurunan kapasitas adsorpsi terjadi setelah titik tersebut. Jika bobot adsorben dinaikkan, sedangkan waktu adsorpsi dan konsentrasi adsorbat tetap, peningkatan jumlah tapak aktif akan meningkatkan penyebaran adsorbat, sehingga waktu yang dibutuhkan untuk mencapai kesetimbangan akan lebih lama. Oleh sebab itu, kapasitas adsorpsi semakin rendah dengan meningkatnya bobot adsorben (Demirbas et al. 2004).
1034.78 1453.69 966.24 694.59 0.00 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00
0.25 0.50 0.76 1.00
bobot (g) Q ( µ g l o g a m /g a d s o rb e n )
Gambar 4 Pengaruh bobot terhadap kapasitas adsorpsi logam Pb(II) oleh adsorben tanpa modifikasi.
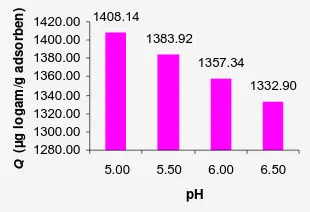
Konsentrasi logam dan pH optimum yang diperoleh adalah 15 ppm dan 5.00. Besarnya kapasitas adsorpsi untuk masing-masing parameter tersebut berturut-turut adalah
1468.88 dan 1408.14 µg/g adsorben
(Lampiran 5 dan 6). Melalui Gambar 6 dapat dilihat bahwa pada selang konsentrasi yang diberikan, kapasitas adsorpsi berbanding lurus dengan konsentrasi awal logam Pb(II).
7 493.07 989.86 1468.88 0.00 500.00 1000.00 1500.00 2000.00
5 10 15
C (ppm )
Q ( µ g l o g a m /g a d s o rb e n )
Gambar 5 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas adsorpsi oleh adsorben tanpa modifikasi.
Kenaikan kapasitas adsorpsi
mengindikasikan jumlah logam Pb(II) yang terjerap pada tapak aktif semakin besar. Konsentrasi yang tinggi akan meningkatkan jumlah Pb(II) dalam larutan, sehingga semakin besar besar kemungkinannya akan terjerap. Pada penelitian ini, konsentrasi 15
ppm belum dapat dikatakan sebagai
konsentrasi optimum, karena kapasitas adsorpsi yang lebih besar masih mungkin diperoleh pada konsentrasi yang lebih tinggi. Hal ini diperkuat dengan hasil penelitian Rajawane (2008) yang menyebutkan bahwa kapasitas adsorpsi Pb(II) oleh kulit buah kakao yang masih terus meningkat seiring dengan bertambahnya konsentrasi logam sampai 35 ppm.
Kondisi pH yang semakin tinggi,
menyebabkan penurunan kapasitas adsorpsi. Hal ini diperlihatkan pada Gambar 7. pH yang tinggi dapat menyebabkan reaksi antara Pb2+ dengan OH─, sehingga membentuk endapan Pb(OH)2. Endapan ini akan menghalangi
proses adsorpsi yang berlangsung. Hasil yang diperoleh menunjukkan bahwa pH optimum dicapai pada 5.00.
1408.14 1383.92 1357.34 1332.90 1280.00 1300.00 1320.00 1340.00 1360.00 1380.00 1400.00 1420.00
5.00 5.50 6.00 6.50
pH Q ( µ g l o g a m /g a d s o rb e n )
Gambar 6 Pengaruh pH terhadap kapasitas adsorpsi logam Pb(II) oleh adsorben tanpa modifikasi.
Kondisi Optimum Adsorben Modifikasi
Modifikasi adsorben dengan menggunakan asam nitrat telah banyak dilakukan (Utomo & Hunter 2006). Hasil penelitian Dewi (2005) menunjukkan bahwa modifikasi selulosa pada kulit singkong oleh asam nitrat memberikan
kapasitas adsorpsi yang lebih besar
dibandingkan dengan menggunakan asam fosfat.
Pengaruh waktu adsorpsi terhadap
kapasitas adsorpsi Pb(II) oleh adsorben modifikasi dapat dilihat pada Gambar 8. Kapasitas adsorpsi terus mengalami kenaikan hingga 713.69 µg/g adsorben pada menit ke-120 (Lampiran 3), kemudian turun pada menit ke-150. Waktu kontak antara adsorbat dan adsorben yang melebihi waktu optimum dapat menyebabkan desorpsi (Notodarmojo 2004). Atkins (1999) mendefinisikan desorpsi sebagai pelepasan adsorbat dari permukaan adsorben. Fenomena ini terjadi akibat jenuhnya permukaan adsorben, sehingga molekul adsorbat yang telah terjerap kembali ke dalam larutan.
703.62 708.58 713.69 680.08 660.00 670.00 680.00 690.00 700.00 710.00 720.00
60 90 120 150
t (m enit)
Q (µ g l o g a m /g a d s o rb e n )
Gambar 7 Waktu adsorpsi optimum logam Pb(II) oleh adsorben modifikasi.
Ketersediaan tapak aktif diperbesar dengan
penambahan bobot adsorben, tetapi
8 2759.55 1377.34 919.20 689.08 0.00 500.00 1000.00 1500.00 2000.00 2500.00 3000.00
0.25 0.50 0.75 1.00
bobot (g) Q ( µ g l o g a m /g a d s o rb e n )
Gambar 8 Pengaruh bobot terhadap kapasitas adsorpsi logam Pb(II) oleh adsorben modifikasi.
Konsentrasi adsorbat memiliki pengaruh yang signifikan terhadap kapasitas adsorpsi, hal ini ditunjukkan pada Gambar 10. Terjadi kenaikan bertahap sampai 2767.51 µg/g adsorben pada konsentrasi 15 ppm (Lampiran 5). Penelitian sebelumnya yang dilakukan oleh Amirullah (2006) dan Rajawane (2008) juga mengalami hal yang serupa. Jika
dibandingkan dengan adsorben tanpa
modifikasi, hasil ini menunjukkan bahwa perlakuan aktivasi pada adsorben modifikasi berhasil yang dibuktikan dengan adanya pergeseran kondisi optimum ke bobot yang lebih rendah dan kenaikan kapasitas adsorpsi pada kondisi tersebut.
939.03 1888.93 2767.51 0.00 500.00 1000.00 1500.00 2000.00 2500.00 3000.00
5 10 15
C (ppm )
Q ( µ g l o g a m /g a d s o rb e n )
Gambar 9 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas
adsorpsi oleh adsorben modifikasi.
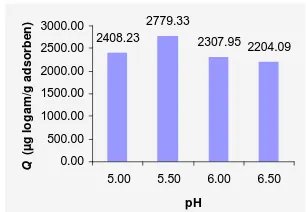
Adsorben dengan modifikasi asam bekerja optimum pada suasana asam. pH optimum diperoleh pada pH 5.50 dengan ragam pH 5.00-6.50. Kapasitas adsorpsi pada kondisi optimum tersebut sebesar 2779.33 µg/g adsorben (Gambar 11).
2408.23 2779.33 2307.95 2204.09 0.00 500.00 1000.00 1500.00 2000.00 2500.00 3000.00
5.00 5.50 6.00 6.50
pH Q ( µ g l o g a m /g a d s o rb e n )
Gambar 10 Pengaruh pH terhadap kapasitas adsorpsi logam Pb(II) oleh adsorben modifikasi.
Kondisi Optimum Arang Aktif
Arang aktif merupakan adsorben
komersial yang memiliki kemampuan
menjerap berbagai jenis senyawa dan zat warna. Proses adsorpsi pada arang aktif dianggap sebagai proses fisikokimia: molekul atau ion-ion adsorbat terikat oleh permukaan partikel yang reaktif. Selain itu, materi ini memiliki pori-pori sehingga molekul adsorbat dapat terperangkap dalam pori tersebut.
Gambar 12 menunjukkan pengaruh waktu adsorpsi terhadap kapasitas adsorpsi oleh arang aktif. Berbeda dengan adsorben tanpa modifikasi dan dengan modifikasi, kapasitas adsorpsi arang aktif terus meningkat sampai menit ke-150, tanpa memperlihatkan gejala desorspsi. Kapasitas adsorpsi pada menit ke-150 diperoleh sebesar 721.18 µg/g adsorben, lebih tinggi daripada kapasitas adsorpsi adsorben tanpa modifikasi (671.40 µg/g adsorben; Gambar 4) dan adsorben modifikasi (713.69 µg/g adsorben; Gambar 8).
708.59 710.34 713.76 721.18 700.00 705.00 710.00 715.00 720.00 725.00
60 90 120 150
t (m enit)
Q (µ g l o g a m /g a d s o rb e n )
Gambar 11 Waktu adsorpsi optimum logam Pb(II)oleh arang aktif.
9
aktif, sehingga waktu yang dibutuhkan untuk mencapai waktu kesetimbangan lebih lama. Hal ini menjadi salah satu faktor yang menyebabkan kapasitas adsorpsi arang aktif terus mengalami peningkatan pada selang waktu yang diberikan.
Seperti halnya adsorben modifikasi, peningkatan bobot arang aktif berbanding terbalik dengan kapasitas adsorpsi (Lampiran 4). Pada Gambar 13 dapat dilihat bahwa kapasitas adsorpsi terbesar ialah 2730.00 µg/g adsorben yang dicapai pada bobot 0.25 g. 2730.00 1385.55 964.29 722.63 0.00 500.00 1000.00 1500.00 2000.00 2500.00 3000.00
0.25 0.50 0.75 1.00
bobot (g) Q ( µ g l o g a m /g a d s o rb e n )
Gambar 12 Pengaruh bobot terhadap kapasitas adsorpsi logam Pb(II) oleh arang aktif.
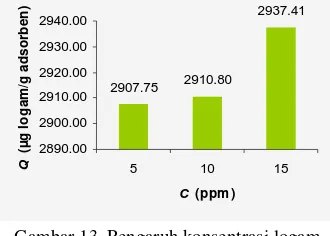
Kondisi yang terjadi pada penentuan bobot optimum serupa dengan penentuan waktu adsorpsi optimum. Pada ragam konsentrasi adsorbat yang diberikan, terus terjadi kenaikan (Lampiran 5). Kapasitas adsorpsi tertinggi, diperoleh sebesar 2937.41 µg/g adsorben, yaitu pada konsentrasi Pb(II) 15 ppm (Gambar14). 2907.75 2910.80 2937.41 2890.00 2900.00 2910.00 2920.00 2930.00 2940.00
5 10 15
C (ppm )
Q ( µ g l o g a m /g a d s o rb e n )
Gambar 13 Pengaruh konsentrasi logam Pb(II) terhadap kapasitas adsorpsi oleh arang aktif.
Adsorpsi kation oleh arang aktif juga dipengaruhi oleh pH (Lampiran 6). Pada Gambar 15 terlihat bahwa kapasitas adsorpsi mengalami kenaikan hingga titik optimum, kemudian menurun setelah melewati titik tersebut. pH optimum didapat pada pH 6.00
dengan kapasitas adsorpsi sebesar 2678.21 µ g/g adsorben. Tabel 2 merangkum kondisi optimum dari masing-masing adsorben.
2607.39 2747.73 2878.21 2857.68 2400.00 2500.00 2600.00 2700.00 2800.00 2900.00
5.00 5.50 6.00 6.50
pH Q ( µ g l o g a m /g a d s o rb e n )
Gambar 14 Pengaruh pH terhadap kapasitas adsorpsi logam Pb(II) oleh arang aktif.
Tabel 2 Kondisi optimum adsorben tanpa modifikasi, dengan modifikasi, dan arang aktif
Parameter T an p a m o d if ik as i M o d if ik as i A ra n g a k ti f
Waktu adsorpsi (menit)
120 120 150
Bobot (g) 0.50 0.25 0.25
Konsentrasi logam (ppm)
15 15 15
pH 5.00 5.50 6.00
Adsorpsi Larutan Tunggal
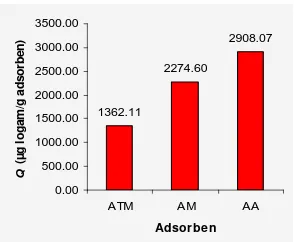
Ketiga jenis adsorben kemudian diujikan pada larutan tunggal Pb(II) dengan kondisi
optimum masing-masing. Gambar 16
menunjukkan hasil yang diperoleh. Kapasitas adsorpsi adsorben modifikasi lebih tinggi
dibanding adsorben tanpa modifikasi,
berturut-turut sebesar 2274.60 dan 1362.11 µ g/g adsorben. Hasil ini membuktikan bahwa
modifikasi asam pada adsorben dapat
meningkatkan kapasitas adsorpsi.
10 1362.11 2274.60 2908.07 0.00 500.00 1000.00 1500.00 2000.00 2500.00 3000.00 3500.00
ATM AM AA
Adsorben Q ( µ g l o g a m /g a d s o rb e n )
Gambar 15 Adsorpsi logam Pb(II) adsorben tanpa modifikasi, modifikasi,
dan arang aktif pada larutan tunggal Pb(II).
Mekanisme adsorpsi yang terjadi pada arang aktif adalah sebagai berikut. Pertama molekul adsorbat berdifusi melalui suatu lapisan batas ke permukaan luar adsorben (difusi eksternal). Sebagian adsorbat ada yang terjerap di permukaan luar, tetapi sebagian besar lainnya terdifusi lanjut ke dalam pori-pori adsorben (difusi internal). Jika permukaan adsorben sudah jenuh atau mendekati jenuh, dapat terjadi dua hal, yaitu terbentuk lapisan adsorbat kedua dan seterusnya di atas adsorbat yang telah terikat di permukaan, gejala ini disebut adsorpsi multilapisan. Sementara jika tidak terbentuk lapisan kedua dan seterusnya, adsorbat yang belum terjerap akan berdifusi keluar pori dan kembali ke arus fluida (Cheremisinoff & Moressi 1978, diacu dalam Rasjidin 2006).
Adsorpsi Limbah Industri Aki
Kemampuan adsorpsi adsorben tanpa modifikasi, modifikasi, dan arang aktif juga diujicobakan pada limbah industri aki (Lampiran 8). Hasil penelitian menunjukkan bahwa konsentrasi Pb(II) yang terdapat pada limbah industri aki adalah 4.0439 ppm (Lampiran 9). Gambar 16 memperlihatkan kenaikan kapasitas adsorpsi dari adsorben tanpa modifikasi, ke adsorben modifikasi, ke arang aktif, yang berturut-turut 21.73; 121.71; dan 485.11 µg/g adsorben.
Komposisi adsorbat ternyata menurunkan adsorpsi zat atau senyawa yang ditinjau, dalam hal ini Pb(II). Hal ini diduga terjadi karena adanya persaingan antara zat yang satu dan lainnya untuk mendapatkan tapak aktif (Notodarmojo 2004). Hasil percobaan juga membuktikan bahwa selain Pb(II), pada
limbah industri aki juga terdapat Cd(II) dan Fe(II), dengan konsentrasi berturut-turut 0.0976 ppm dan 1.9267 ppm (Lampiran 9). Kedua logam inilah yang diperkirakan bersaing dengan timbel untuk mendapatkan tapak aktif adsorben.
Ukuran ion merupakan salah satu faktor yang berpengaruh dalam proses adsorpsi. Jari-jari ion Pb(II), Cd(II) dan Fe(II) berturut-turut adalah 1.21 Å, 0.97 Å dan 0.75 Å. Jika mekanisme fisisorpsi juga berlangsung pada ketiga jenis adsorben, molekul berukuran kecil akan lebih mudah terjerap pada pori-pori adsorben. Jika dilihat dari ukuran ion, maka Fe(II) dan Cd(II) akan lebih mudah terjerap dibandingkan dengan Pb(II).
21.73 121.71 485.11 0.00 100.00 200.00 300.00 400.00 500.00 600.00
ATM AM AA
Adsorben Q ( µ g l o g a m /g a d s o rb e n )
Gambar 16 Adsorpsi logam Pb(II) adsorben tanpa modifikasi, modifikasi, dan arang aktif pada limbah
industri aki.
Isoterm Adsorpsi
Fenomena adsorpsi digambarkan melalui suatu hubungan antara jumlah adsorbat yang terjerap per satuan bobot adsorben dan konsentrasi kesetimbangan. Hubungan ini disebut sebagai isoterm adsorpsi. Telah banyak isoterm adsorpsi yang dikembangkan untuk mendeskripsikan interaksi antara adsorben dan adsorbat. Isoterm Freundlich dan Langmuir pada umumnya dianut oleh adsorpsi padat-cair (Atkins 1999).
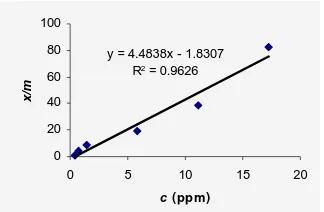
Seperti ditunjukkan pada Gambar 18 dan 19, yang berasal dari pengolahan data pada Lampiran 10, adsorpsi Pb(II) oleh adsorben tanpa modifikasi memberikan linearitas 96.26% untuk isoterm Langmuir dan 91.41% untuk isoterm Freundlich. Berdasarkan hasil tersebut, diduga adsorpsi adsorben tanpa modifikasi mengikuti tipe isoterm Langmuir.
Pendekatan Langmuir mengasumsikan
adsorbat yang teradsorpsi membentuk lapisan tunggal, permukaan adsorbat sama daya
ikatnya, tidak ada antaraksi lateral
11
molekul-molekul tersebut tidak bergerak pada permukaan.
y = 4.4838x - 1.8307 R2 = 0.9626
0 20 40 60 80 100
0 5 10 15 20
c (ppm )
x
[image:30.612.340.493.82.184.2]/m
Gambar 17 Isoterm Langmuir adsorpsi Pb(II) oleh adsorben tanpa modifikasi.
y = 1.1133x + 0.5159 R2 = 0.9141
-0.5 0 0.5 1 1.5 2 2.5
-0.5 0 0.5 1 1.5
log c
lo
g
x
/m
Gambar 18 Isoterm Freundlich adsorpsi Pb(II) oleh adsorben tanpa
modifikasi.
Isoterm adsorpsi Pb(II) oleh adsorben modifikasi yang ditunjukkan oleh Gambar 20 dan 21 juga menunjukkan kecocokan dengan isoterm Langmuir (Lampiran 11) 95.38%, jauh melebihi linearitas isoterm Freundlich. Jadi, molekul Pb(II) juga membentuk lapisan tunggal pada permukaan adsorben modifikasi.
y = 6.9209x + 6.2841
R2 = 0.9538
0 20 40 60 80 100
0 5 10 15
c (ppm )
x
/m
Gambar 19 Isoterm Langmuir adsorpsi Pb(II) oleh adsorben modifikasi.
y = 1.0269x + 0.9871
R2 = 0.8924
-0.5 0 0.5 1 1.5 2 2.5
-1 -0.5 0 0.5 1 1.5
log c
lo
g
x
/m
Gambar 20 Isoterm Freundlich adsorpsi Pb(II) oleh adsorben modifikasi.
Adsorpsi oleh adsorben tanpa modifikasi dan adsorben modifikasi sejenis dengan adsorpsi oleh arang aktif. Gambar 22 dan 23, yang diolah dari data pada Lampiran 12, memperlihatkan bahwa isoterm Langmuir memiliki linearitas 98.71%, sedangkan isoterm Freundlich hanya 94.80%. Ini berarti
adsorben modifikasi berpeluang
menggantikan arang aktif, tetapi perlu dicari metode aktivasi yang lebih baik.
y = 10.612x + 3.745 R2 = 0.9871
0 20 40 60 80 100
0 5 10
c (ppm )
x
[image:30.612.140.302.115.221.2]/m
Gambar 21 Isoterm Langmuir adsorpsi Pb(II) oleh arang aktif.
y = 0.9611x + 1.1398 R2 = 0.948
-0.5 0 0.5 1 1.5 2 2.5
-1.5 -1 -0.5 0 0.5 1 1.5
log c
lo
g
x
[image:30.612.143.296.264.360.2]/m
[image:30.612.141.301.510.621.2]12
SIMPULAN DAN SARAN
Simpulan
Modifikasi asam terhadap tongkol jagung terbukti mampu meningkatkan kapasitas adsorpsi Pb(II). Kapasitas adsorpsi Pb(II) oleh adsorben modifikasi pada larutan tunggal adalah 2274.60 µg/g adsorben, lebih besar dibandingkan adsorben tanpa modifikasi, yaitu 1362.11 µg/g adsorben, sedangkan kapasitas adsorpsi Pb(II) oleh adsorben tanpa dan dengan modifikasi pada limbah industri aki masing-masing sebesar 21.73 dan 121.71 µg/g adsorben. Arang aktif yang digunakan sebagai pembanding memiliki kapasitas adsorpsi Pb(II) sebesar 2908.07 µ g/g adsorben untuk penjerapan larutan tunggal dan 485.11 µg/g adsorben untuk penjerapan limbah industri aki.
Tipe isoterm yang dianut oleh ketiga jenis adsorben adalah isoterm Langmuir. Isoterm ini mengasumsikan molekul adsorbat yang teradsorpsi membentuk lapisan tunggal (monolayer) dan permukaan adsorbat adalah homogen (memiliki energi yang sama).
Saran
Tahapan selanjutnya yang perlu dilakukan adalah pencirian lebih lanjut adsorben modifikasi asam dari tongkol jagung dengan
Scanning electron microscopy (SEM) dan
spektrofotometri infra merah. Serta
menentukan nilai entalpi dan energi aktivasi untuk mengetahui mekanisme adsorpsi yang terjadi.
DAFTAR PUSTAKA
Abia AA, Asuquo ED. 2006. Lead(II) and nickel(II) adsorption kinetics from
aqueous metal solutions using
chemically modified and unmodified agricultural adsorbents. African J Biotechnol 5:1475-1482.
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed. ke-1. New York: J Wiley.
Amirullah. 2006. Biosorpsi biru metilena oleh ganggang cokelat (Sargassum binderi)
[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Atkins PW. 1999. Kimia Fisika jilid II.
Kartohadiprodjo II, penerjemah;
Rohhadyan T, editor. Oxford: Oxford University Press. Terjemahan dari:
Physical Chemistry.
Barros JLM et al. 2003. Biosorption of cadmium using the fungus Aspergillus niger. Braz J Chem Eng 20:1-17.
BPS. 2007. Statistik Pertanian Indonesia. Jakarta: Biro Pusat Statistik.
Demirbas E, Kobya M, Senturk E, Ozkan T. 2004. Adsorption kinetics for the adsorbent of chromium(VI) from aqueous solutions on the activated carbons prepared from agricultural wastes. Water SA 30:533-540
Dewi IR. 2005. Modifikasi asam kulit singkong sebagai bioremoval Pb dan
Cd [skripsi]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Djatmiko B, Ketaren S, Setyahartini S. 1985.
Pengolahan Arang dan Kegunaannya. Bogor: Agro Industri Pr.
Fahrizal. 2008. Pemanfaatan tongkol jagung sebagai biosorben zat warna biru metilena [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Gufta FK. 1998. Utilization of bagasse fly ash generated in the sugar industry for removal and recovery of phenol and p -nitrophenol from wastewater. J Chem Technol Biotechnol 70:180-186.
Horsfall MJ, Abia AA, Spiff Al. 2003. Removal of Cu(II) and Zn(II) ions from
wastewater by cassava (Manihot
esculenta crantz) waste biomass.
African JBiotechnol 2:360-364.
Igwe JC, Abia AA. 2006. A bioseparation process for removing heavy metals from waste water using biosorbents.
African JBiotechnol 5:1167-1179.
13
and husk. African JBiotechnol 4:1113-1116.
Jason PP. 2004. Activated carbon and some application for the remediation of soil
and groundwater pollution.
http://www. cee.vt.edu/program_areas. [8 Jun 2004].
Lorenz KJ, Kulp K. 1991. Handbook of Cereal Science and Technology. New York: Macel Dekker.
Ketaren S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UI Pr.
Koumanova B, Antova PP. 2002. Adsorption
of p-chlorophenol from aqueous
solution on bentonite and perlite. J Hazard Mater 90:229-234.
Kumar U. 2006. Agricultural products and by-products as a low cost adsorbent for heavy metal adsorbent from water and wastewater: A review. African J Biotechnol 1:033-037.
Marshall WE, Mitchell MJ. 1996. Agriculture
by-product as metal adsorbent:
Sorption properties and resistence to mechanical abrasion. J Chem Technol Biotechnol 66:192-198.
Marshall WE, Wartelle LH, Boler DE. 1999. Enhanced metal adsorption by soybean hulls modified with citric acid. Biores Technol 69:263-268
Mulyana L, Pradiko H, Nasution UK. 2003. Pemilihan persamaan adsorpsi isoterm pada penentuan kapasitas adsorpsi kulit kacang tanah terhadap zat warna
remazol golden yellow 6.
www.unpas.ac.id/pmb/home/images/ar ticles/infomatek/jurnal_V_3_3.html [2 Jun 2008]
Notodarmojo S. 2004. Pencemaran Tanah danAir Tanah. Bandung: ITB Pr.
Rajawane A. 2008. Biosorpsi logam berat Pb(II) menggunakan kulit buah kakao [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Raghuvanshi SP, Sing R, Kaushik CP. 2004. Kinetics study of methylene blue dye biadsorption on baggase. App Ecol Env Researches 2:35-43.
Rasjiddin I. 2006. Pembuatan arang aktif dari
tempurung biji jambu mede
(Anacardium cocidentale) sebagai adsorben pada pemurnian minyak goreng bekas [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Ribeiro MHL, Lourenco PAS, Monteiro JP. 2001. Kinetics of selective adsorption of impurities from a crude vegetable oil in hexane to activated earths and
carbons. Eur Food Res Tecnol
213:132-138.
Saeni MS. 1989. Kimia Lingkungan. Bogor: Pusat antar Universitas Ilmu Hayat Institut Pertanian Bogor.
Suhendrayatna. 2001. Adsorben logam berat dengan menggunakan mikroorganisme:
Suatu kajian kepustakaan.
www.shantybio.transdigit.com/?Biolog y_-_Mikrobiologi:Bioremoval_Logam _Berat_Dengan_Menggunakan_Micro organisme%3A_Suatu_kajian_Kepusta kaan.html [22 Mei 2007].
Sunarya AI. 2006. Biosorpsi logam berat Cd(II) dan Pb(II) menggunakan kulit jeruk siam. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
15
Tongkol jagung
*Dicuci dengan air mengalir dan air deionisasi
*Ditumbuk
±
100 MeshPenentuan waktu optimum adsorben
Penentuan bobot optimum adsorben
Penentuan pH optimum adsorben Penentuan konsentrasi optimum adsorben
Penentuan Isoterm Adsorpsi Langmuir dan Freundlich
Uji pada larutan tunggal logam Pb (II) Uji pada limbah industri aki Lampiran 1 Bagan alir penelitian
Penentuan kadar air
+ HNO3 0,6M
+ NaOH 0.1N
Adsorben modifikasi Adsorben tanpa
modifikasi
16
Lampiran 2 Kadar air tongkol jagung
Ulangan a (g) b (g) c (g) Kadar air (%)
1 36.5682 36.4706 1.0024 9.74
2 38.2476 38.1505 1.0026 9.68
3 36.6734 36.5760 1.0027 9.71
Rerata 9.71
Contoh perhitungan: Kadar air (%) =
c b
a− × 100%
= 100%
0024 . 1
4706 . 36 5682 . 36
x −
= 9.74%
Lampiran 3 Kapasitas adsorpsi adsorben tanpa modifikasi, modifikasi, dan arang aktif pada penentuan waktu optimum adsorpsi logam Pb(II) dari 50 mL larutan Pb(II) 15 ppm.
Adsorben Waktu
adsorpsi (menit)
m (g) Co (ppm) Ca (ppm) Q (µg/g)
Tanpa modifikasi 60 1.0110
14.674