SKRIPSI
STABILITAS SEDIAAN BUBUK PEWARNA ALAMI DARI ROSELA (Hibiscus sabdariffa L.) YANG DIPRODUKSI DENGAN METODE SPRAY
DRYING DAN TRAY DRYING
Oleh
SANTY ERNAWATI F24051174
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
STABILITAS SEDIAAN BUBUK PEWARNA ALAMI DARI ROSELA (Hibiscus sabdariffa L.) YANG DIPRODUKSI DENGAN METODE SPRAY
DRYING DAN TRAY DRYING
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
SANTY ERNAWATI F24051174
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
SANTY ERNAWATI. F24051174.Stabilitas Sediaan Bubuk Pewarna Alami dari Rosela (Hibiscus sabdariffa L) yang Diproduksi dengan Metode Spray Drying dan Tray Drying. Di bawah bimbingan: Yadi Haryadi dan Dede R. Adawiyah. 2010.
ABSTRAK
Pewarna makanan merupakan salah satu bahan tambahan pangan yang cukup penting bagi industri pangan karena peranannya untuk memperbaiki penampakan makanan. Penggunaan pewarna sintetis dalam produk pangan sangat berkembang pesat baik di industri besar maupun di industri rumah tangga. Namun, penggunaan pewarna sintetis seringkali menimbulkan masalah kesehatan. Keadaan seperti itu memunculkan berkembangnya penggunaan pigmen alami yang berasal dari bahan alam untuk memperbaiki penampakan dan meningkatkan intensitas warna produk pangan. Contoh tanaman yang dapat dimanfaatkan sebagai pewarna alami adalah rosela (Hibiscus sabdariffa L.). Pigmen alami yang terkandung dalam tanaman rosela mengandung pigmen antosianin yang menimbulkan warna merah pada pH rendah.
Sediaan pewarna makanan banyak tersedia dalam bentuk konsentrat. Namun, sediaan pewarna dalam bentuk konsentrat memiliki stabilitas dan umur simpan yang relatif tidak lama. Oleh karena itu, diperlukan suatu metode untuk membuat sediaan pewarna dalam bentuk yang lebih stabil. Teknik mikroenkapsulasi zat warna diharapkan dapat menghasilkan sediaan pewarna dalam bentuk bubuk dengan kadar air yang rendah. Metode mikroenkapsulasi yang digunakan dalam penelitian ini adalah spray drying dan Tray Drying (TLD).
Penelitian ini bertujuan memperoleh sediaan pewarna bubuk dari rosela, sebagai alternatif pewarna alami yang aman serta mengetahui stabilitas sediaan bubuk pewarna alami selama penyimpanan. Penelitian ini terbagi menjadi beberapa tahap penelitian, yaitu ekstraksi pigmen rosela, pembuatan pewarna bubuk dari ekstrak rosela dengan metode spray drying dan Tray Drying, analisis fisik dan kimia pewarna bubuk, serta uji stabilitas pewarna bubuk.
sebanyak 69.03 %. Sampel dengan maltodekstrin 10 % selanjutnya dipilih untuk diuji stabilitasnya.
Ekstrak rosela dengan total padatan 3 % selanjutnya dipekatkan hingga total padatan 20 % serta dikeringkan dengan Thin Layer Dryer. Sebelumnya ditambahkan maltodekstrin dengan proporsi total padatan terhadap maltodekstrin adalah 3 : 15, 3 : 17.5, dan 3 : 20. Kadar air bubuk pewarna tersebut berturut-turut adalah 10.31 %, 9.81 %, dan 9.12 %, kadar abu berurut-turut adalah 2.34 %, 1.97 %, dan 1.41 %, sedangkan kelarutan berberurut-turut-berurut-turut adalah 99.23 %, 99.20 %, dan 98.26 %. Penurunan jumlah antosianin sebelum dan sesudah proses produksi paling tinggi terdapat pada sampel bubuk pewarna proporsi total padatan terhadap maltodekstrin 3 : 20 yaitu dari 147 mg menjadi 29.51 mg atau turun sebanyak 79.93 %. Penurunan jumlah antosianin sampel bubuk pewarna proporsi total padatan terhadap maltodekstrin 3 : 15 paling rendah yaitu 147 mg menjadi 33.79 mg atau turun sebanyak 76.24 %. Sampel dengan proporsi total padatan terhadap maltodekstrin 3 : 15 selanjutnya dipilih untuk diuji stabilitasnya.
Uji stabilitas dilakukan dengan menyimpan bubuk pewarna pada suhu yang berbeda (35 C, 45 C, dan 50 C) dengan interval waktu yang berbeda. Penurunan nilai a, kenaikan nilai b, dan kenaikan nilai L pada bubuk pewarna (metode spray drying) yang disimpan pada suhu 50 C lebih cepat daripada bubuk pewarna pada suhu lainnya, begitu pula dengan bubuk pewarna rosela yang dibuat dengan metode Tray Drying. Secara umum, intensitas warna (chroma) selama penyimpanan semakin menurun. Semakin tinggi suhu penyimpanan nilai E pun semakin besar. Secara umum nilai E bubuk pewarna rosela (metode Tray Drying) lebih besar daripada bubuk pewarna rosela (metode spray drying) kecuali pada suhu penyimpanan 35 C. Nilai E dapat dipengaruhi oleh jumlah maltodekstrin. Semakin banyak proporsi maltodekstrin maka perubahan warna pun semakin besar. Proporsi maltodekstrin terhadap total padatan ekstrak bubuk pewarna (metode tray drying) lebih besar (15:3) dibandingkan dengan proporsi maltodekstrin terhadap total padatan ekstrak bubuk pewarna (metode spray drying) (10:3).
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
STABILITAS SEDIAAN BUBUK PEWARNA ALAMI DARI ROSELA (Hibiscus sabdariffa L.) YANG DIPRODUKSI DENGAN METODE SPRAY
DRYING DAN TRAY DRYING SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
SANTY ERNAWATI F24051174
Dilahirkan pada tanggal 2 Mei 1986 Di Bogor, Jawa Barat
Tanggal Lulus: 16 Desember 2009
Menyetujui
Bogor, Januari 2010
Pembimbing I, Pembimbing II,
Dr. Ir. Yadi Haryadi, M.Sc. Dr. Ir. Dede R. Adawiyah, M.Si NIP: 19490612. 197603. 1. 003 NIP: 19680505. 199203. 2. 002
Mengetahui,
Ketua Departemen ITP
RIWAHAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 2 Mei
1986. Penulis adalah anak pertama dari dua bersaudara dari
keluarga Bapak Kamisan dan almarhumah Ibu Siti Rohmatin.
Penulis mengawali jenjang pendidikannya di TK Insan Kamil
Bogor pada tahun 1991-1992, SDN Cibalagung V pada tahun
1992-1993, dan SDN Ciomas VI Bogor pada tahun
1993-1998. Kemudian dilanjutkan ke jenjang sekolah lanjutan di SLTP Negeri 7 bogor
pada tahun 1998-2001 serta sekolah Menengah Analis Kimia Bogor (SMAKBo)
pada tahun 2001-2005. Pada tahun 2005, penulis diterima sebagai mahasiswa IPB
melalui jalur Undangan Seleksi masuk IPB (USMI) dan pada tahun berikutnya
terdaftar di departemen Ilmu dan Teknologi Pangan, Fakultas Telnologi Pertanian,
Institut Pertanian Bogor.
Selama menduduki bangku perkuliahan penulis aktif dalam kegiatan
akademik dan non akademik. Dalam kegiatan akademik, penulis pernah menjadi
asisten praktikum Analisis Pangan pada tahun 2009, dan sebagai pengajar Kimia
pada Bimbingan Belajar Mahasiswa MSC Education pada tahun 2008-2009.
Dalam kegiatan non akademik penulis pernah menjadi pengurus Badan Pengawas
HIMITEPA pada tahun 2006-2007 dan pengurus BEM FATETA pada tahun
2007-2008. Penulis juga aktif di beberapa kepanitiaan seperti Sie. HUMAS Art
IPB Day’s tahun 2005, Sie. Konsumsi Wisuda FATETA periode September tahun 2006, Sie. Konsumsi Panitia Wisuda FATETA Periode November tahun 2006,
Sie. Sekretariatan Suksesi HIMITEPA tahun 2007, Sie. Acara Olimpiade
FATETA tahun 2007, Sie. PDD Techno-F FATETA tahun 2007, PAK BAUR
tahun 2007, Skertaris Kartini IPB Day’s (KIDS) tahun 2008, Sie. Konsumsi A Total English in Action (Attention)tahun 2008. Penulis melakukan penelitian
i
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah
melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan
skripsi ini. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar
Sarjana Teknologi pertanian pada Departemen Ilmu dan Teknologi Pangan,
fakultas Teknologi Pertanian, Institut Pertanian Bogor. Penulisan skripsi yang
berjudul “Stabilitas Bubuk Pewarna Rosela (Hibiscus sabdariffa L.) yang Diproduksi dengan Metode Spray Drying dan Metode Tray Drying” ini didasarkan pada penelitian yang telah dilaksanakan sejak Februari sampai Agustus
2009.
Penyusunan skripsi ini tidak terlepas dari dukungan beberapa pihak baik
secara langsung maupun tidak lagsung. Oleh karena itu, penulis menyampaika
penghargaan dan terima kasih kepada:
1. Dr. Ir. Yadi Haryadi, M.Sc. selaku dosem pembimbing akademik atas pengarahan dan masukan serta kesabarannya dalam membimbing penulis.
2. Dr. Ir. Dede R. Adawiyah, M.Si. selaku dosen pembimbing atas segala perhatian dan arahan yang membimbing penulis selama melakukan penelitian dan penyelesaian skripsi ini.
3. Dr. Ir. Sedarnawati Yasni, M.Agr. yang telah bersedia untuk menjadi dosen penguji.
4. Bapak dan Ibu yang sangat kucintai yang senantiasi memberikan kasih sayang, do’a dan dukungan kepada penulis.
5. Adikku Sandy Erwanto yang sangat kusayangi atas segala dukungan dan
do’a.
6. Bibi Sutiyah di Bandung atas segala kasih sayang dan motivasi, serta keluarga besar yang telah memberikan semangat kepada penulis.
7. Galih Eka, Fajar, Reni, dan Khrisia, terima kasih atas persahabatan dan kebersamaan selama ini.
8. Teman seperjuangan, team “Rocang” (Galih eka, Arya, Galih Ika, Ola) atas kerjasama, bantuan dan semangatnya selama penelitian.
9. Rino, teman satu bimbingan, terima kasih atas dukungannya.
ii
11. Teman-teman ITP 42, Tuti, Nina, Tyu, Muji, Nanda, Harist, Adi, Sina, Aji serta teman-teman ITP lainnya yang tidak bisa disebutkan satu persatu. Terima kasih atas kebersamaannya selama di ITP.
12. Pak Wahid, Pak sobirin, Pak Rojak, Pak Yahya, Bu Rubiah, Pak Gatot, Bu Antin dan teknisi lainnya yang selalu memberikan bantuan selama penelitian.
13. Teknisi LJA (Mbak Yane, Mbak Ririn, Siti, dan Mbak Yuli) terimaksih atas bantuannya.
14. Pimpinan, teman-teman staf pengajar dan karyawan MSC Education atas dukungannya.
15. Pihak-pihak lain yang tidak dapat disebutkan satu persatu yang telah membantu penulis dalam penyelesaian skripsi ini.
Penulis berharap semoga skripsi ini dapat berguna dan bermanfaat bagi
semua pihak, khususnya bagi dunia teknologi pangan.
Bogor, Januari 2010
iii
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... viii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
C. MANFAAT ... 2
II. TINJAUAN PUSTAKA ... 3
A. ROSELA ... 3
B. ZAT WARNA ... 5
C. ANTOSIANIN... 6
D. PENGUKURAN WARNA... 10
1. SPEKTROSKOPI ... 10
2. CHROMAMETER ... 10
E. MIKROENKAPSULASI... 11
F. MALTODEKSTRIN ... 12
G. SPRAY DRYING ... 14
H. TRAY DRYING ... 15
III. METODE PENELITIAN... 17
A. BAHAN DAN ALAT ... 17
B. METODE PENELITIAN ... 17
1. EKSTRAKSI PIGMEN DARI ROSELA ... 17
2. PEMBUATAN DAN KARAKTERISASI SEDIAAN BUBUK PEWARNA ROSELA ... 18
3. PENGUJIAN STABILITAS BUBUK PEWARNA ... 19
C. METODE ANALISIS ... 20
D. RANCANGAN PERCOBAAN ... 24
IV. HASIL DAN PEMBAHASAN ... 25
A. EKSTRAKSI PIGMEN ANTOSIANIN DARI ROSELA ... 25
B. KARAKTERISTIK SEDIAAN BUBUK PEWARNA ROSELA METODE SPRAY DRYING... 25
iv
D. STABILITAS ANTOSIANIN ... 35
E. PENGUKURAN WARNA DENGAN CHROMAMETER... 43
V. KESIMPULAN DAN SARAN ... 59
A. KESIMPULAN ... 59
B. SARAN ... 60
DAFTAR PUSTAKA ... 61
v
DAFTAR TABEL
Tabel 1. Kandungan gizi Rosela ... 4
Tabel 2. Gugus pengganti pada struktur kation flavilium pada antosianidin ... 7
Tabel 3. Kadar antosianin dalam bubuk pewarna rosela (metode Spray drying) 29 Tabel 4. Kadar antosianin dalam bubuk pewarna rosela (metode Tray Drying) 34 Tabel 5. Karakteristik Bubuk Pewarna yang terpilih untuk diuji stabilitasnya .. 36
Tabel 6. Nilai waktu paruh bubuk pewarna rosela ... 40
Tabel 7. Energi aktivasi degradasi antosianin pada bubuk pewarna rosela ... 41
Tabel 8. Nilai E Energi aktivasi (Ea) berdasarkan perubahan nilai L,a, dan a/L pada larutan bubuk pewarna rosela ... 56
Tabel 9. Umur simpan pewarna bubuk rosella berdasarkan intensitas warna merah pada suhu penyimpanan 4 C, 15 C, 35 C, 45 C, 50 C, dan suhu ruang... 58
vi
DAFTAR GAMBAR
Gambar 1. Tanaman Rosela ... 3
Gambar 2. Struktur umum antosianidin ... 6
Gambar 3. Struktur antosianin pada berbagai pH ... 8
Gambar 4. Perbedaan tipe mikrokapsul ... 12
Gambar 5. Spray dryer ... 15
Gambar 6. Skema thin layer cabinet dryer ... 16
Gambar 7. Metode ekstraksi pigmen antosianin ... 18
Gambar 8. Ekstrak antosianin ... 25
Gambar 9. Bubuk pewarna rosela yang dibuat dengan metode spray drying (proporsi total padatan terhadap penambahan maltodekstrin A= 3 : 5, B = 3 : 10, C = 3 : 15) ... 26
Gambar 10. Bubuk pewarna rosela yang dibuat dengan metode spray drying setelah dilarutkan dalam air (proporsi total padatan terhadap penambahan maltodekstrin A= 3 : 5, B = 3 : 10, C = 3 : 15) ... 26
Gambar 11. Diagram kadar air bubuk pewarna rosela (metode spray drying) 27 Gambar 12. Diagram kadar abu bubuk pewarna rosela (metode spray drying) 28 Gambar 13. Diagram kelarutan bubuk pewarna rosela (metode spray drying) 29 Gambar 14. Penurunan jumlah antosianin sebelum dan setelah dikeringkan (metode spray drying) ... 30
Gambar 15. Bubuk pewarna rosela yang dibuat dengan metode tray drying (Proporsi total padatan terhadap penambahan maltodekstrin A= 3 : 15, B = 3 : 17.5, C = 3 : 20) ... 31
Gambar 16. Bubuk pewarna rosela yang dibuat dengan metode tray drying setelah dilarutkan dalam air (Proporsi total padatan terhadap penambahan maltodekstrin A= 3 : 15, B = 3 : 17.5, C = 3 : 20) . 31 Gambar 17. Diagram kadar air bubuk pewarna rosela (metode tray drying) .. 32
Gambar 18. Diagram kadar abu bubuk pewarna rosela (metode tray drying) 33 Gambar 19. Diagram kelarutan bubuk pewarna rosela (metode tray drying) . 34 Gambar 20. Penurunan jumlah antosianin sebelum dan setelah proses produksi (metode tray drying) ... 35
Gambar 21. Kurva hubungan total antosianin dengan dengan waktu penyimpanan pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d). ... 37
vii pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d) ... 44
Gambar 27. Kurva hubungan nilai a dengan dengan waktu penyimpanan pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d) ... 45
Gambar 28. Kurva hubungan nilai b dengan dengan waktu penyimpanan pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d) ... 47
Gambar 29. Kurva hubungan nilai C dengan dengan waktu penyimpanan pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d) ... 48
Gambar 30. Kurva hubungan nilai E dengan dengan waktu penyimpanan pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d) ... 50
Gambar 31. Kurva hubungan ln [L] dengan dengan waktu penyimpanan pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d) ... 52
Gambar 32. Kurva hubungan ln k dengan 1/T berdasarkan perubahan nilai L 52
Gambar 33. Kurva hubungan ln [a] dengan dengan waktu penyimpanan pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d) ... 53
Gambar 34. Kurva hubungan ln k dengan 1/T berdasarkan perubahan nilai a 53
Gambar 35. Kurva hubungan ln [a/L] dengan dengan waktu penyimpanan pada bubuk pewarna rosela pada suhu penyimpanan kontrol atau suhu ruang (a), suhu 35 C (b), suhu 45 C (c), dan suhu 50 C (d) ... 54
viii
DAFTAR LAMPIRAN
Lampiran 1. Karakteristik pewarna rosela (metode spray drying) ... 66 Lampiran 2. Karakteristik pewarna rosela (Metode tray drying) ... 68 Lampiran 3. Analis ragam kadar air pewarna bubuk rosela (metode spray
drying) metode Duncan ... 70 Lampiran 4. Analis ragam kadar abu pewarna bubuk rosela (metode spray
drying) metode Duncan ... 71 Lampiran 5. Analis ragam kelarutan pewarna bubuk rosela (metode spray
drying) metode Duncan ... 72 Lampiran 6. Analis ragam kadar air pewarna bubuk rosela (metode tray
drying) metode Duncan ... 73 Lampiran 7. Analis ragam kadar abu pewarna bubuk rosela (metode tray
drying) metode Duncan ... 74 Lampiran 8. Analisis ragam kelarutan pewarna bubuk rosela (metode tray
drying) metode Duncan ... 75 Lampiran 9. Stabilitas antosianin bubuk pewarna rosela (metode spray
drying) pada suhu ruang (kontrol)... 76 Lampiran 10. Stabilitas antosianin bubuk pewarna rosela (metode spray
drying) pada suhu 35 C ... 77 Lampiran 11. Stabilitas antosianin bubuk pewarna rosela (metode spray
drying) pada suhu 45 C ... 78 Lampiran 12. Stabilitas antosianin bubuk pewarna rosela (metode spray
drying) pada suhu 55 C ... 79 Lampiran 13. Stabilitas antosianin bubuk pewarna rosela (metode tray
drying) pada suhu ruang (kontrol)... 80 Lampiran 14. Stabilitas antosianin bubuk pewarna rosela (metode tray
drying) pada suhu 35 C ... 82 Lampiran 15. Stabilitas antosianin bubuk pewarna rosela (metode tray
drying) pada suhu 45 C ... 84 Lampiran 16. Stabilitas antosianin bubuk pewarna rosela (metode tray
drying) pada suhu 50 C ... 86 Lampiran 17. Kinetika degradasi antosianin pada bubuk pewarna rosella
ix
Lampiran 18. Kinetika degradasi antosianin pada bubuk pewarna rosela pada suhu 45 C ... 89
Lampiran 19. Kinetika degradasi antosianin pada bubuk pewarna rosela pada suhu 50 C ... 90
Lampiran 20. Energi aktivasi dan waktu paruh antosianin pada bubuk pewarna rosela ... 91
Lampiran 21. Pengukuran warna larutan bubuk pewarna rosela dengan chromameter ... 92
Lampiran 22. Kinetika degradasi warna berdasarkan perubahan L, a, dan a/L pada suhu ruang ... 94
Lampiran 23. Kinetika degradasi warna berdasarkan perubahan L, a, dan a/L pada 35 C ... 95
Lampiran 24. Kinetika degradasi warna berdasarkan perubahan L, a, dan a/L pada 45 C ... 96
Lampiran 25. Kinetika degradasi warna berdasarkan perubahan L, a, dan a/L pada 50 C ... 97
Lampiran 26. Penentuan energi ektivasi (Ea) berdasarkan perubahan nilai L 98
Lampiran 27. Penentuan energi ektivasi (Ea) berdasarkan perubahan nilai a . 99
Lampiran 28. Penentuan energi ektivasi (Ea) berdasarkan perubahan nilai a/L ... 100
Lampiran 26. Penentuan umur simpan berdasarkan perubahan nlai a/L ... 101
I. PENDAHULUAN
A. LATAR BELAKANG
Pewarna makanan merupakan salah satu bahan tambahan pangan yang
cukup penting bagi industri pangan karena peranannya untuk memperbaiki
penampakan makanan yang memudar akibat pengolahan, memperoleh warna
yang seragam pada komoditi yang warna alamiahnya tidak seragam,
memperoleh warna yang lebih tua dari aslinya, melindungi flavor dan vitamin
yang peka selama penyimpanan, memperoleh penampakan yang menarik dari
bahan aslinya, untuk identitas produk, serta sebagai indikator visual dari
kualitas. Zat warna makanan secara umum dibagi dalam tiga golongan, yaitu
zat warna alami, zat warna identik alami, dan zat warna sintetik (Henry,
1996). Zat warna sintetik umumnya bersifat lebih stabil, lebih cerah, dan lebih
bervariasi. Sebaliknya zat pewarna alami memiliki sifat yang kurang stabil,
kurang cerah, dan kurang bervariasi.
Penggunaan pewarna sintetis dalam produk pangan sangat berkembang
pesat baik di industri besar maupun di industri rumah tangga. Namun,
penggunaan pewarna sintetis seringkali menimbulkan masalah kesehatan.
Keadaan ini menimbulkan keinginan orang-orang untuk menggunakan
pewarna alami yang relatif aman.
Keadaan seperti itu memunculkan berkembangnya penggunaan
pigmen alami yang berasal dari bahan alam sebagai pewarna makanan.
Pigmen alami tersebut banyak ditemukan pada tumbuhan. Bagian tumbuhan
yang biasanya memiliki pigmen yang dapat dimanfaatkan sebagai pewarna
makanan adalah bagian daun, bagian bunga, dan bagian batang. Selain
berfungsi untuk mewarnai produk, pigmen alami ini juga memiliki fungsi
sebagai flavour, antioksidan, antimikroba, dan fungsi lainnya (Winarno, 2002). Contoh tanaman yang dapat dimanfaatkan sebagai pewarna alami
adalah rosela (Hibiscus sabdariffa L.).
Rosela (Hibiscus sabdariffa L.) mengandung pigmen antosianin. Antosianin menimbulkan warna merah pada pH rendah (2-4), sedangkan pada
2 Pada umumnya sediaan pewarna makanan tersedia dalam bentuk
konsentrat. Namun, sediaan pewarna dalam bentuk konsentrat memiliki
stabilitas dan umur simpan yang relatif tidak lama. Oleh karena itu,
diperlukan suatu metode untuk membuat sediaan pewarna dalam bentuk yang
lebih stabil. Teknik mikroenkapsulasi zat warna diharapkan dapat
menghasilkan sediaan pewarna dalam bentuk bubuk. Dengan demikian,
sediaan pewarna bubuk diharapkan memiliki stabilitas dan umur simpan relatif
lebih lama dibandingkan dengan sediaan pewarna dalam bentuk konsentrat.
Selain itu, produk mikroenkapsulasi memiliki keunggulan dalam hal
kemudahan penanganan, transportasi, dan penyimpanan. Mikroenkapsulasi
dapat memberikan perlindungan pada bahan inti dan menjaga pigmen warna
dari faktor-faktor fisik dan kimia.
Metode mikroenkapsulasi yang digunakan dalam penelitian ini adalah
spray drying dan tray drying. Pada metode spray dring, bahan disemprotkan ke dalam suatu media pengering pada suhu tinggi, sehingga bahan menjadi
bubuk, granula, atau produk aglomerat. Dengan metode tray drying, bahan yang dikeringkan dengan menggunakan medium udara panas dibuat dalam
bentuk lapisan tipis sehingga efisiensi pengeringan menjadi semakin
meningkat karena semakin besar luas permukaan. Metode tray drying dilakukan pada suhu yang lebih rendah dari pada metode spray drying yaitu sekitar 50 C sehingga diharapkan dapat mengurangi kerusakan pigmen akibat
suhu pemanasan yang tinggi.
B. TUJUAN
1. Mengetahui pengaruh mikroenkapsulasi ekstrak rosela terhadap stabilitas
warna merah yang dihasilkan selama penyimpanan.
2. Mengetahui metode mikroenkapsulasi yang mampu menurunkan laju degradasi
antosianin dan meningkatnya nilai aktivasi pada bubuk pewarna rosela.
C. MANFAAT
Manfaat dari penelitian ini adalah memberikan alternatif pewarna
makanan yang aman bagi konsumen dan memiliki stabilitas yang baik selama
II. TINJAUAN PUSTAKA A. ROSELA
Rosela adalah tumbuhan yang berasal dari India dan memiliki nama
Latin Hibiscus sabdariffa L. (keluarga Malvaceae). Tumbuhan ini dikenal sebagai penghasil serat bermutu yang dimanfaatkan untuk membuat karung
goni. Rosela merupakan tumbuhan semak yang tingginya mencapai 3 m.
Batangnya bulat, tegak, percabangan simpodial, memiliki kambium, dan
berwarna merah. Daunnya tunggal berbentuk bulat seperti telur. Tipe tulang
daunnya menjari. Ujung daunnya tumpul, dan pangkalnya berlekuk. Panjang
daun rosela sekitar 6-15 cm dan lebarnya 5-8 cm. Panjang tangkai daun 4-7
cm dengan penampang bulat dan berwarna hijau (Maryani dan Kristiana,
2005). Rosela memiliki bunga tunggal yang tumbuh di ketiak daun. Kelopak
bunga berwarna merah, berbulu, terdiri dari delapan sampai sebelas daun
kelopak, dan pangkalnya berlekatan seperti yang dapat dilihat pada Gambar 1.
Mahkota bunganya berwarna kuning berbentuk corong. Setiap bunga terdiri
dari lima daun mahkota yang panjangnya 3-5 cm.
Daerah terbaik untuk menanam rosela adalah tempat tropis atau
subtropis yang hangat dengan ketinggian 0-900 meter di atas permukaan laut.
Pada 4-5 bulan setelah tanam, tanaman ini memerlukan banyak sinar matahari
untuk mencegah munculnya bunga prematur yang dapat menyebabkan
kualitasnya menjadi buruk. Curah hujan yang diperlukan selama pertumbuhan
rosela adalah 182 cm/ tahun. Rosela dapat langsung diolah setelah dipanen
atau dikeringkan agar lebih awet dalam penyimpanannya. Rasio pengeringan
rosela umumnya 10 : 1, artinya dari setiap 10 kg kelopak segar akan
menghasilkan 1 Kg kelopak kering (Maryani dan Kristiana, 2005).
4 Rosela merupakan sumber penting untuk vitamin, mineral, dan
komponen bioaktif seperti asam organik, phytosterol, dan polyphenol.
Beberapa di antaranya memiliki sifat antioksidan. Warna merah pada kelopak
bunga rosela disebabkan oleh pigmen antosianin. Pigmen antosianin yang
terdapat pada kelopak bunga rosela mengandung delphinidin-3-sambubiosida,
cyanidin-3-sambubiosida, dan delphinidin-3-glucose (Fasoyiro et al., 2005). Persentase jenis antosianin dalam rosela yang terdistribusi sebagai
sambubiosida, cyanidin-3-sambubiosida, dan
delphinidin-3-glikosida adalah 71.40 %, 26.60 %, dan 2.00 % (Hong dan Wrolstad (1990)
diacu dalam Wong et. al. (2002)). Kelopak Rosela mengandung vitamin C, vitamin A, dan 18 jenis asam amino. Kandungan asam lemak yang terdapat
pada kelopak rosela diantaranya asam lemak miristat, palmitat, asam amino
stearat, oleat, dan linoleat. (Maryani dan Kristiana, 2005). Rosela yang
dimaksud pada penelitian ini adalah bagian kelopak bunga yang berwarna
merah. Kandungan gizi rosela secara lengkap dapat dilihat pada Tabel 1.
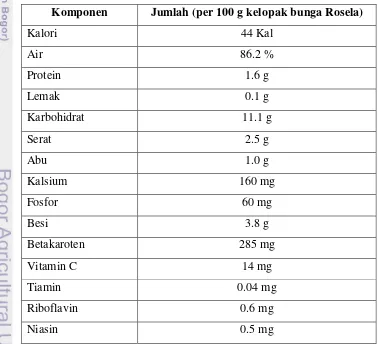
Tabel 1. Kandungan gizi rosela (Maryani dan Kristiana, 2005)
Komponen Jumlah (per 100 g kelopak bunga Rosela)
Kalori 44 Kal
Air 86.2 %
Protein 1.6 g
Lemak 0.1 g
Karbohidrat 11.1 g
Serat 2.5 g
Abu 1.0 g
Kalsium 160 mg
Fosfor 60 mg
Besi 3.8 g
Betakaroten 285 mg
Vitamin C 14 mg
Tiamin 0.04 mg
Riboflavin 0.6 mg
5 Rosela kini mulai dikembangkan petani untuk diambil kelopak bunga
dan bijinya sebagai tanaman herbal dan bahan baku minuman kesehatan.
Kelopak bunga rosela selain mengandung asam malat yang segar, juga
mempunyai warna yang menarik dan dapat diolah menjadi beberapa produk
yang mempunyai nilai ekonomis cukup tinggi, yaitu berupa sirup atau
minuman segar, selai, dan manisan (Ditjenbun, 2008).
B. ZAT WARNA
Warna adalah sifat sensori pertama yang diamati pada saat konsumen
menemui produk pangan. Penentuan mutu bahan makanan pada umumnya
sangat bergantung pada beberapa faktor diantaranya adalah rasa, warna,
tekstur, dan gizinya. Namun, sebelum faktor-faktor lain diperhatikan, secara
visual faktor warna tampil lebih dahulu dan kadang-kadang sangat
menentukan keputusan konsumen. Selain sebagai faktor yang menentukan
mutu, warna juga dapat digunakan sebagai indikator kesegaran atau
kematangan. Baik tidaknya cara pencampuran atau cara pengolahan dapat
ditandai dengan adanya warna yang seragam atau merata (Winarno, 2002).
Pewarna makanan ditambahkan ke dalam makanan untuk beberapa tujuan
yaitu meningkatkan intensitas warna pada makanan yang intensitas warnanya
rendah, untuk menyeragamkan warna dalam makanan, memperbaiki
penampakan warna pada makanan yang warnanya memudar akibat
pengolahan, serta untuk memberi warna pada produk tertentu yang tidak
memiliki warna, misalnya produk-produk confectionery, dan minuman ringan
(Henry, 1996).
Secara umum, pewarna makanan dibedakan dalam tiga kategori yaitu
pewarna sintetik, pewarna identik alami, dan pewarna alami. Zat warna
makanan adalah zat warna alami atau buatan yang boleh ditambahkan ke
dalam makanan dan minuman untuk memperoleh warna makanan dan
minuman yang diinginkan. Pewarna sintetik pertama kali ditemukan oleh Sir
William Henry Perkins pada tahun 1856. Penemuan ini mendorong penemuan
terhadap pewarna sisntetik lainnya. Zat warna sintetik untuk jenis-jenis
tertentu dalam penggunaanya sering kali menimbulkan masalah kesehatan
6 yang diizinkan dan dilarang. Zat warna alami adalah pewarna organik yang
diperoleh dari sumber alami, contohnya adalah curcumin (dari turmeric), bixin
(dari annatto), dan antosianin (dari buah-buahan dan tumbuhan berwarna
merah). Zat warna alami sejak dahulu digunakan untuk pewarna makanan dan
sampai sekarang umumnya dianggap lebih aman daripada pewarna sintetis.
Zat warna identik alami adalah pewarna yang struktur kimianya identik
dengan pewarna alami namun dibuat melalui sintesis kimia, contohnya
-caroten, riboflavin, dan canthaxantin (Henry, 1996).
Pigmen alami mempunyai kestabilan yang berbeda terhadap berbagai
kondisi pengolahan (Winarno, 2002). Suhu proses pengolahan produk yang
menggunakan zat warna alami dianjurkan tidak terlalu tinggi dan dalam waktu
yang singkat, sehingga dapat mengurangi laju kerusakan pigmen tersebut
selama pemasakan atau pemanasan (Hutchings, 1999).
C. ANTOSIANIN
Antosianin dan antoxantin tergolong pigmen yang disebut flavonoid
yang umumnya larut dalam air. Flavonoid mengandung dua cincin benzena
yang dihubungkan oleh tiga atom karbon. Ketiga karbon tersebut dirapatkan
oleh sebuah atom oksigen sehingga terbentuk cincin diantara dua cincin
benzena (Winarno, 2002). Struktur umum antosianin dapat dilihat pada
Gambar 2.
Gambar 2. Struktur umum antosianidin
Antosianin merupakan pigmen alami yang dapat menghasilkan warna
biru, ungu, violet, magenta, merah, dan kuning. Konsentrasi pigmen sangat
berperan dalam penentuan warna (Hue). Antosianin adalah pigmen larut air
yang banyak terdapat pada bunga, buah, dan daun tumbuhan. Berdasarkan
7 dilakukan pada minuman yang dibuat dari rosela memperlihatkan tidak adanya
efek toksik (Askari et al., 1996).
Antosianin termasuk ke dalam senyawa fenolik yang dinamakan
flavonoid. Antosianin adalah glikosida dari polihidroksi dan polimetoksi
dengan 2-phenilbenzopyrylum atau garam flavinium (Kong, et. al., 2003). Monosakarida utama yang terdapat pada antosianin adalah glukosa (90 %),
serta rhamnosa, galaktosa, xylosa, dan arabinosa (Andersen dan Jordheim
(2006) diacu dalam Ovando et. al. (2009)). Gula yang terikat pada antosianin dapat terasilasi dengan asam-asam aromatik seperti p-coumaric, caffeic, ferulic, sinapic, galic, atau p-hydroxy benzoic acid, dan atau dengan asam-asam alifatik seperti asam-asam malonat, asetat, malat, suksinat, dan oksalat
(Jackman dan Smith, 1996).
Sampai sekarang terdapat lebih dari 500 jenis antosianin dan 23 jenis
antosianidin (Ovando et al., 2009). Hanya ada enam jenis antosianidin yang terdapat dalam buah dan sayuran yaitu cyanidin (50 %), delphinidin (12 %),
pelargonon (12 %), peonidin (12 %), petunidin (7 %) dan malvidin (7 %).
Ikatan glikosida yang terdapat pada antosianin umumnya dalah monosida,
3-biosida, 3,5- dan 3,7- diglikosida (Kong et. al. (2003) diacu dalam Ovando et. al. (2009)). Gugus pengganti pada struktur kation flavilium pada antosianidin dapat dilihat pada Tabel 2.
Tabel 2. Gugus pengganti pada struktur kation flavilium pada antosianidin (Jackman dan Smith, 1996)
Antosianidin Gugus pada karbon nomor:
3’ 4’ 5’
Pelargonin H OH H
Sianidin OH OH H
Delfinidin OH OH OH
Peonidin Ome OH H
Petunidin Ome OH OH
8 Flavonoid larut dalam air dan sangat reaktif sehingga mudah
teroksidasi atau tereduksi. Flavonoid juga dapat membentuk garam jika
bereaksi dengan asam atau basa (Hutchings, 1999). Faktor-faktor yang
mempengaruhi kestabilan antosianin diantaranya adalah pH, suhu
penyimpanan, struktur kimia, konsentrasi, cahaya, oksigen, pelarut, serta
keberadaan enzim, flavonoid lain, protein dan ion logam (Ovando et al., 2009).
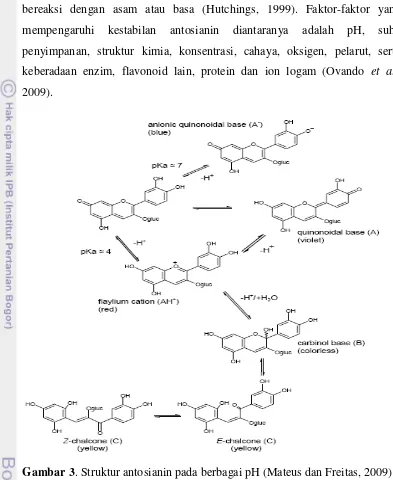
Gambar 3. Struktur antosianin pada berbagai pH (Mateus dan Freitas, 2009) Struktur kimia dan stabilitas antosianin dipengaruhi oleh pH larutan
seperti yang dapat dilhat pada Gambar 3. Pada pH 1, antosianin terdapat
dalam bentuk flavilium yang memberikan warna ungu dan merah. Pada pH
2-4, antosinin terdapat dalam bentuk quinoidal. Pada pH 5-6, terdapat dalam
bentuk chalcone dan basa carbinol yang tidak berwarna. Pada pH lebih dari 7,
9 Struktur sekunder akan terbentuk melalui transfer proton membentuk basa
quinoidal yang kebiruan atau melalui hidrasi membentuk pseudobasa carbinol
yang dapat mengalami tautomerisasi membentuk retro-chalcone yang tidak
berwarna.
Seperti reaksi kimia pada umumnya, stabilitas antosianin dan laju
degradasinya dipengaruhi oleh suhu. Deprotonisasi kation flavilium pada
antosianin merupakan reaksi eksoterm, sedangkan hidrasi kation dan
terbukanya cincin pyrylium merupakan reaksi endoterm. Dengan
meningkatnya suhu, pembentukan chalcone akan meningkat (Jackman dan
Smith, 1996). Pada kondisi aerobik, meningkatnya substitusi metoksil,
glikosil, dan atau asil akan meningkatkan stabilitas thermal antosianin.
Kinetika degradasi antosianin dapat diamati berdasarkan konstanta
laju reaksi dan waktu paruh. Degradasi antosianin mengikuti kinetika
degradasi orde pertama (Ersus dan Yurdagel, 2007). Pada reaksi ordo pertama
ini, jika diplotkan ln [C] yang tersisa terhadap waktu, akan diperoleh
hubungan linier. Melalui grafik tersebut, dapat diperoleh konstanta laju reaksi
(k) dengan mengunakan persamaan:
Ln [C]= -kt + ln [C]o
Dengan [C] = konsentrasi antosianin, [C]o = konsentrasi awal, dan t = waktu.
Absorbansi maksimum cyanidin-3-galaktosida adalah pada panjang
gelombang 530 nm (Ersus dan Yurdagel, 2007), sedangkan menurut Iglesias
et. al. (2008), absorbansi maksimum cyanidin-3-galaktosida yang terdapat dalam apel adalah 532 nm. Tsai et. al. (2001) mengukur total antosinin dalam rosela sebagai delphinidin pada panjang gelombang 520 nm. Pengukuran ini
dilakukan dalam pelarut metanol yang ditambahkan asam asetat 5 %. Du dan
Francis (1973) mengukur total antosianin dalam rosela sebagai
delphinidin-3-glukosida pada panjang gelombang 543 nm dengan nilai koefisien molar
10
D. PENGUKURAN WARNA
1. Spektroskopi
Spektroskopi merupakan metode yang secara luas digunakan
untuk analisis kualitatif dan kuatitatif. Pengukuran dilakukan berdasarkan
jumlah radiasi yang diabsorbsi atau diemisikan oleh analit (Pemer, 2003).
Spektroskopi UV dan sinar tampak merupakan ciri tunggal yang paling
berguna untuk menganalisis struktur flavonoid (Markham, 1998).
Spektroskopi absorbsi memiliki prinsip dasar yaitu bila suatu cahaya putih
atau radiasi dilewatkan melalui larutan berwarna maka radiasi dengan
panjang gelombang tertentu akan diserap secara selektif dan radiasi
lainnya akan diteruskan. Absorbansi maksimum dari larutan berwarna
terjadi pada daerah berlawanan. Larutan warna merah akan menyerap
radiasi maksimum warna hijau, warna kuning akan menyerap radiasi
maksimum pada warna biru violet.
Analisis kuantitatif secara spektroskopi dilakukan dengan
memakai persamaan Lambert-Beer, yaitu:
Pada persamaan ini, A adalah daya serap atau absorbansi, ε adalah absorptivitas molar, c adalah konsentrasi sampel (mol/ L), dan d adalah
diameter sel (cm).
2. Chromameter
Chromameter adalah alat yang digunakan untuk mengukur warna
dari suatu bahan. Pada chromameter, warna dideskripsikan melalui notasi
warna. Notasi warna adalah suatu cara sistematik atau objektif untuk
menyatakan atau mendeskripsikan suatu jenis warna. Di antara sistem
warna terdapat tiga macam sistem notasi warna yaitu ICI (International Commission ON Illumination), Munsell, dan Hunter.
Sistem notasi ICI didasarkan pada konsep bahwa semua jenis
11 ( 520 nm), dan biru ( 380 nm). Masing-masing warna ini dinyatakan
dengan nilai X untuk merah, Y untuk hijau, dan Z untuk biru (Soekarto,
1990).
Cara pengukuran warna dengan sistem warna Munsel dilakukan
dengan mengukur komponen warna dalam besaran value, hue, dan chroma. Value menunjukkan gelap terangnya warna, nilai hue mewakili panjang gelombang dominan yang menentukan warna sampel, sedangkan
chroma menunjukkan intensitas warna. Ketiga komponen ini diukur dengan menggunakan alat khusus yang mengukur nilai khromasitas
permukaan suatu bahan. Nilai yang diperoleh berbeda untuk setiap warna,
kemudian nilai-nilai tersebut diplotkan ke dalam diagram kromasitas
(Winarno, 2002).
Sistem notasi warna yang paling banyak digunakan adalah sistem
notasi hunter yang mempunyai tiga parameter untuk mendeskripsikan
warna, yaitu L, a, dan b (Soekarto, 1990). Nilai L menyatakan parameter
kecerahan yang memiliki nilai 0 (Hitam) sampai 100 (putih). Nilai a
menyatakan warna kromatik campuran merah sampai hijau dengan nilai a+
dari 0 sampai +100 untuk warna merah dan niai a- dari 0 sampai -80 untuk
warna hijau. Nilai b menyatakan warna kromatik campuran biru sampai
kuning dengan nilai +b dari 0 sampai +70 untuk warna kuning dan nilai –b dari 0 sampai -70 untuk warna biru (Soekarto, 1990).
E. MIKROENKAPSULASI
Mikroenkapsulasi adalah suatu teknik penyalutan zat aktif (padatan,
cairan, atau gas) dengan zat lain untuk melindunginya dari pengaruh
lingkungan (Dubey et. al., 2009). Menurut Adameic dan Marciniak (2004), mikroenkapsulasi didefinisikan sebagai teknologi penyalutan zat aktif (core)
yang berupa padatan, cairan, maupun gas dalam kapsul yang sangat kecil
(diameter kapsul 1-800 µm) dengan suatu bahan matrix (carrier) untuk
melindungi sifat-sifat tertentu selama penyimpanan, distribusi dan
penggunaan. Mikroenkapsulasi dapat memberi perlindungan pada bahan inti
12 2002). Enkapsulasi pewarna alami dapat menurunkan laju degradasi pigmen
dan dapat meningkatkan umur simpan pewarna (Gradinaru et. al., 2003) Zat aktif yang terkurung dalam mikrokapsul disebut inti atau core.
Dinding penyalut disebut skin, shell, atau film pelindung. Proses
mikroenkapsulasi bahan-bahan inti tersebut dibungkus oleh dinding polimer
tipis. Mikrokapsul dapat diklasifikasikan menjadi tiga kategori yaitu
monocore, polycore, dan matriks seperti yang dapat dilihat pada Gambar 4.
Mikrokapsul monocore mempunyai ruang partikel (core) tunggal, sedangkan
polycore memiliki beberapa ruang partikel (core) yang ukurannya
berbeda-beda yang dilapisi dinding penyalut. Pada tipe matriks, partikel-partikel zat
aktif terintegrasi dalam matriks bahan penyalut (Dubey et. al., 2009).
Gambar 4. Perbedaan tipe mikrokapsul (Dubey et. al., 2009)
Menurut Adameic dan Marciniac (2004), tujuan terpenting dari proses
enkapsulasi adalah melindungi zat aktif dari faktor eksternal seperti suhu,
kelembapan, interaksi dengan zat lain, atau radiasi UV, mereduksi evaporasi
atau perpindahan zat aktif ke lingkungan,serta melindungi sifat tertentu dari
zat aktif, seperti bau, flavour, dan aktivitas katalitik.
Ada beberapa teknik mikroenkapsulai yang biasa digunakan, yaitu
pembentukan polimer dengan reaksi kimia, spray drying, fluidised bed coating, melt solidifiation, co-extrusion, layer-by-layer deposition, supercritical fluid expansion, dan spinning disk (Dubey et. al., 2009).
F. MALTODEKSTRIN
Dekstrin yang dihasilkan dari hidrolisis asam atau pemanasan kering
(roasting) sering disebut pirodekstrin. Selain proses hidrolisis, pada saat membuatan pirodekstrin terjadi juga repolimerisasi sehingga terbentuk
13 tersedia secara komersial. Maltodekstrin merupakan salah satu jenis
pirodekstrin yang termasuk kelompok dekstrin putih yang secara luas
digunakan oleh industri pangan.
Maltodekstrin merupakan produk hidrolisis pati yang mengandung
unit -D-glukosa yang sebagian besar terikat melalui ikatan 1.4 glikosidik
dengan dextrose equivalent (DE) kurang dari 20. Rumus umum maltodekstrin adalah [C6H10O5]n.H2O (Kennedy et al., 1995). Devidek et al. (1990)
mendefinisikan maltodekstrin sebagai turunan pati yang dihasilkan dari
degradasi rantai amilosa dan amilopektin secara kimiawi atau enzimatis
menjadi dekstrin (< 62 %), maltosa (>6%), glukosa (>6%) dan mempunyai
DE 3-20.
Maltodekstrin adalah polimer dari glukosa dengan panjang ikatan
rata-rata 5-10 unit glukosa per molekul. Maltodekstrin banyak digunakan
dalam indrustri makanan sebagai bahan pengisi. Idealnya maltodekstrin sedikit
berasa dan berbau, namun maltodekstrin dengan DE 20 menghasilkan rasa
manis. Maltodekstrin merupakan zat yang larut dalam air dan dapat
melindungi zat yang dienkapsulasi dari oksidasi (Shahidi dan Han (1993)
diacu dalam Ersus dan Yurdagel (2007)). Maltodekstrin memiliki viskositas
yang rendah dan terdapat dalam bobot molekul yang berbeda (Ersus dan
Yurdagel, 2007).
Maltodekstrin bersifat kurang hidroskopis, kurang manis, memiliki
kelarutan tinggi,dan cenderung tidak membentuk zat warna pada reaksi
pencoklatan. Maltodekatstrin dari sirup glukosa dalam industri pangan banyak
digunakan sebagai bahan pengisi, mengurangi tingkat kemanisan produk, dan
bahan campuran yang baik untuk produk-produk tepung. Penggunaannya
sebagai bahan pengisi dapat mengurangi biaya produksi.
Menurut Kennedy et al. (1995), aplikasi maltodekstrin pada produk pangan antara lain pada:
1. Produk bakery, misalnya pada cakes, muffin, dan biscuit sebagai
14 2. Makanan beku. Maltodekstrin memiliki kemampuan mengikat air (water holding capacity) dan bobot molekul rendah sehingga dapat mempertahankan produk tetap beku.
3. Makanan berkalori rendah. Penambahan maltodekstrin dalam jumlah yang
besar tidak akan meningkatkan kemanisan produk seperti halnya gula.
G. SPRAY DRYING
Mikroenkapsulasi dengan spray drying merupakan metode yang paling banyak digunakan secara komersial. Metode ini biasanya digunakan
untuk enkapsulasi aroma, minyak, dan flavor. Spray drying merupakan proses transformasi suatu bahan dari wujud cair menjadi bentuk kering dalam suatu
proses transformasi suatu bahan dari wujud cair menjadi bentuk kering dalam
suatu proses yang kontinyu. Bahan disemprotkan dan diatomisasi membentuk
droplet ke dalam suatu media pengering yang panas, kemudian air dalam
bentuk droplet akan menguap meninggalkan bahan kering (Dubey et. al., 2009). Spray drying terdiri dari empat tahapan proses, yaitu atomisasi bahan melalui sebuah penyemprot, kontak antara droplet dengan udara pengering,
evaporasi uap air, dan pemisahan produk kering dari udara kering.
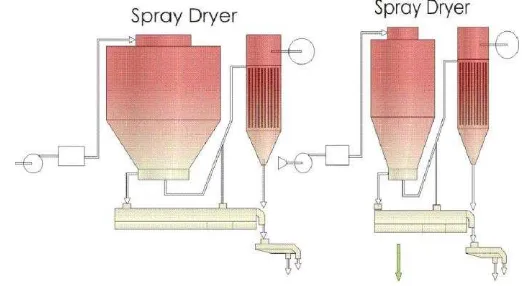
Menurut Wirakartakusumah (1992), spray dryer digunakan untuk menghasilkan tepung dari suspensi cairan. Seperti proses pengeringan lainnya,
prinsip pengeringan semprot cukup sederhana. Cairan disemprotkan ke dalam
aliran gas panas, air dalam tetesan (droplet) menguap dengan cepat
meninggalkan tepung kering. Tepung dipisahkan dari udara yang
mengangkutnya dengan menggunakan separator atau kolektor tepung.
Walaupun suhu udara yang masuk ruang pengering sangat tinggi, kecepatan
penguapan yang tinggi menyebabkan pendinginan yang berarti, sehingga
dapat menghindarkan bahan dari pemanasan yang berlebihan, bahkan tidak
ada kontak bahan basah maupun produk kering dengan medium yang panas
sekali. Skema spray dryer dapat dilihat pada Gambar 5.
Bahan yang akan dikeringkan dengan menggunakan spray dryer diusahakan mengandung total padatan yang tinggi sekitar 30-40 % dengan
15 dapat berlangsung lebih cepat dan degradasi karena panas dapat dikurangi.
Pada penelitian sebelumnya yang dilakukan oleh Andrade dan Flores (2001),
ekstrak antosianin dievaporasi hingga mencapai total padatan 12 Brix
sebelum dikeringkan dengan spray dryer.
Gambar 5. Skema spray dryer (Anonim, 2008)
Pengeringan bahan pangan dengan metode spray drying dinilai lebih efisien dan ekonomis dibandingkan dengan metode lain. Terdapat beberapa
keuntungan metode pengeringan semprot, antara lain yaitu produk menjadi
kering tanpa bersentuhan dengan plat logam, temperature produk rendah
(termasuk pada saat temperatur udara pemanas relatif tinggi, waktu
pengeringan yang relatif singkat, serta menghasilkan produk akhir yang stabil,
mudah ditangani, dan memudahkan transportasi.
H. TRAY DRYING
Salah satu proses yang penting dalam mikroenkapsulasi adalah
pengeringan. Tujuan utama pengeringan yaitu mempertahankan produk
selama penyimpanan karena dengan berkurangnya kadar air maka
pertumbuhan mikroba dapat ditekan sehingga kerusakan produk dapat
dihindari.
Pengeringan lapis tipis (film) digunakan untuk menghasilkan
produk-produk yang kering dari bahan cair atau semi cair (Bolland, 2000). Menurut
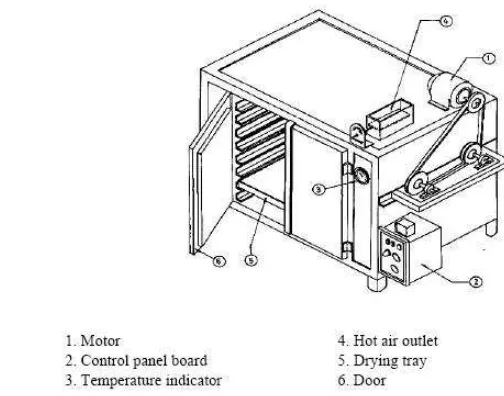
Kasuna et al. (2001), ubi-ubian seperti ubi jalar dengan tebal 5 mm dapat dikeringkan dengan metode tray drying pada suhu 55 C dan 65 C. Tray Dryer terdiri dari coil pemanas, blower, drying chamber, outlet udara, dan termostat
16 adalah proses pengeringan dan bahan yang akan dikeringkan dibuat dalam
bentuk lapisan atau irisan tipis dengan menggunakan medium udara panas
sehingga efisiensi pengeringan menjadi semakin meningkat karena semakin
besar luas permukaan. Semakin besarnya luas permukaan mengakibatkan
kecepatan pengeringan semakin tinggi sehingga dihasilkan produk kering
dengan lapisan atau irisan yang tipis.
III. METODE PENELITIAN A. BAHAN DAN ALAT
Bahan-bahan yang digunakan dalam penelitian ini adalah rosela
(Hibiscus sabdariffa L.), akuades, etanol, maltodekstrin, metanol 26.4 M, HCl 35 %, kertas saring Whatman nomor 1 dan nomor 42.
Alat yang digunakan pada penelitian ini adalah blender, kain saring,
penyaring vacuum, vaccum evaporator, corong Buchner, homogenizer, refrigerator, neraca analitik, spray dryer, tray dryer, chromameter, spektrofotometer UV-VIS, kuvet, inkubator, sealer, cawan aluminium, cawan porselen, oven vacuum, desikator, tabung reaksi, rak tabung reaksi, pipet,
erlenmeyer, gelas piala, gelas ukur, labu takar, sudip, gelas pengaduk, botol
kemasan, dan botol pereaksi.
B. METODE PENELITIAN
Penelitian ini terbagi menjadi beberapa tahap penelitian, yaitu ekstraksi
pigmen dari rosela, penentuan pembuatan pewarna bubuk dari ekstrak metode
spray drying dan tray drying serta karakterisasi produk, dan pengujian stabilitas pewarna bubuk.
1. Ekstraksi pigmen dari Rosela
Ekstraksi pigmen bertujuan mendapatkan senyawa antosianin dari
rosela melalui metode ekstraksi secara maserasi. Ekstraksi pigmen
antosianin dilakukan dengan menggunakan metode maserasi yang
merupakan modifikasi dari metode Tensiska dan Natalia (2007). Metode
Tensiska dan Natalia menggunakan alkohol sebagai pelarut, sedangkan
pada penelitian ini digunakan pelarut air seperti yang telah dilakukan oleh
Kristie (2008). Diagram alir metode ekstraksi antosianin dari rosela dapat
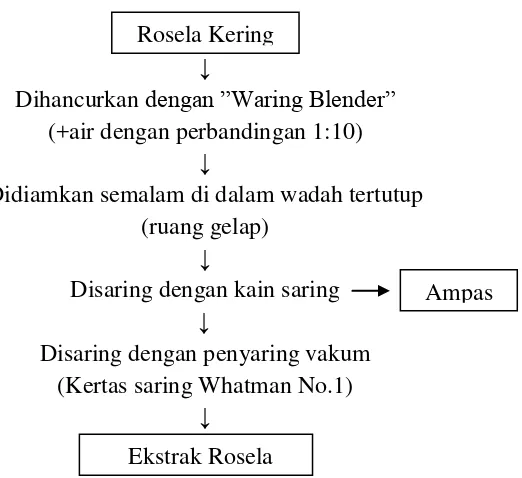
dilihat pada Gambar 7. Ekstrak rosela selanjutnya dikarakterisasi untuk
dengan menganalisis total padatan dan total antosianin yang terkandung
18
↓
Dihancurkan dengan ”Waring Blender” (+air dengan perbandingan 1:10)
↓
Didiamkan semalam di dalam wadah tertutup (ruang gelap)
↓
Disaring dengan kain saring
↓
Disaring dengan penyaring vakum (Kertas saring Whatman No.1)
↓
Gambar 7. Metode ekstraksi pigmen antosianin
2. Pembuatan dan Sediaan Bubuk Pewarna Rosela
1. Metode Spray Drying
Pada pembuatan sediaan bubuk pewarna dengan metode spray drying, digunakan maltodekstrin sebagai bahan pengisi dengan konsentrasi 5 %, 10 %, dan 15 % dari jumlah ekstrak encer (total
padatan 3%) sehingga proporsi padatan terhadap penambahan
maltodekstrin adalah 3 : 5, 3 : 10, dan 3 : 15. Sejumlah maltodekstrin
ditimbang (5 %, 10 %, dan 15 % dari 100 gram ekstrak encer (total
padatan 3%)) kemudian ditambahkan ekstrak pigmen rosela sebanyak
100 ml. Campuran tersebut dihomogenisasi 11000 rpm selama 1
menit dengan homogenizer lalu dikeringkan dengan alat spray drying dengan suhu inlet 170 C dan suhu outlet 88 C. Bubuk pewarna yang
dihasilkan selanjutnya dilakukan analisis kadar air, kadar abu,
kelarutan, dan total antosianin.
2. Metode Tray Drying
Pembuatan sediaan bubuk pewarna dengan metode tray drying dilakukan pada suhu lebih rendah daripada metode spray drying yaitu
Rosela Kering
Ekstrak Rosela
19 50 C. Ekstrak pigmen rosela dipekatkan hingga mencapai total
padatan 20 % dengan menggunakan rotavapour pada suhu 65 C.
Bahan pengisi yang digunakan adalah maltodekstrin. Maltodekstrin
dicampur dengan ekstrak rosela dengan perbandingan gram
maltodekstrin dan ml ekstrak 6 : 6, 7 : 6, dan 8 : 6 sehingga proporsi
padatan terhadap maltodekstrin adalah 3 : 15, 3 : 17.5, dan 3 : 20.
Kemudian dihomogenisasi dengan mixer dengan skala kecepatan pada no 1 selama 1 menit. Campuran tersebut dibentuk lapisan tipis pada
tray kemudian dikeringkan dengan tray dryer pada suhu 50 C. Setelah dikeringkan selama 4 jam, lapisan dikeruk dan dilakukan
pengecilan ukuran dengan blender kering. Bubuk pewarna yang
dihasilkan selanjutnya dilakukan analisis kadar air, kadar abu,
kelarutan, dan total antosianin. Bubuk pewarna dengan penurunan
jumlah antosianin paling rendah selama pengeringan selanjutnya
dipilih untuk diuji stabilitasnya. Gambar pembuatan bubuk pewarna
dapat dilihat pada Lampiran 30.
3. Pengujian Stabilitas Bubuk Pewarna
Pengujian stabilitas bubuk pewarna dilakukan dengan mengukur
total antosianin dan warna larutan bubuk pewarna yang telah disimpan
pada suhu tertentu setiap interval waktu tertentu. Pengukuran intensitas
warna dilakukan dengan menggunakan chromameter sedangkan analisis
total antosianin dilakukan dengan menggunakan spektrofotometer.
Disiapkan 30 buah botol plastik yang masing-masing berisi 1 gram sampel
bubuk pewarna kering. Bubuk pewarna kering tersebut disimpan pada
suhu 35 °C (10 botol), 45 °C (10 botol), dan 55 °C (10 botol). Bubuk
pewarna yang disimpan pada suhu 35 °C diukur intensitas warna dan total
antosianin setiap interval waktu 7 hari, bubuk pewarna yang disimpan
pada suhu 45 °C diukur intensitas warna dan total antosianinnya setiap
interval waktu 3 hari, sedangkan bubuk pewarna yang disimpan pada suhu
55 °C diukur intensitas warnanya setiap interval waktu 1 hari. Sebelum
20 dahulu dengan akuades sehingga konsentrasinya mencapai 1 %. Degradasi
pigmen diplot dengan menghubungkan total antosianin dengan waktu
proses pemanasan berdasarkan kinetika reaksi orde pertama (Ersus dan
Yurdagel, 2007).
Pengamatan kinetika degradasi antosianin dilakukan melalui
persamaan matematis yang diinterpretasikan sebagai berikut :
=
ln Ct-ln Co = - kt
ln Ct = -kt + ln Co
keterangan:
Ct = konsentrasi pigmen pada waktu tertentu
Co = konsentrasi awal pigmen
k = konstanta laju reaksi (hari-1)
t = waktu (hari)
Berdasarkan kurva hubungan ln C dengan waktu diperoleh persamaan
garis dengan nilai k sebagai slope dari kurva. Berdasarkan persamaan
tersebut juga dapat dihitung waktu paruh (t1/2). Setelah nilai k pada
berbagai suhu didapat, selanjutnya dibuat grafik hubungan 1/T (K-1)
dengan nilai ln k (hari-1) sehingga diperoleh persamaan:
k = ko e-Ea/RT
ln k = ln ko – Ea/RT keterangan :
k = tetapan laju reaksi
ko = faktor frekwensi
Ea = energi aktivasi (kalori atau Joule)
R = tetapan gas (1.987 kal/mol K atau 8.3145 J/mol K)
T = suhu mutlak (K)
C. METODE ANALISIS
Pewarna bubuk yang dihasilkan dianalisis karakteristik fisik dan
21 padatan, kadar abu (AOAC, 1995), kelarutan (Purba, 2003) dan
pengukuran warna dengan Chromameter (modifikasi Hutching, 1999) dan
spektrofotometer (Iglesias et. al., 2008). Sediaan pewarna bubuk yang memiliki karakteristik terbaik digunakan selanjutnya untuk diuji
stabilitasnya.
1. Kadar Air dan Total Padatan, Metode Oven (AOAC, 1995)
Cawan aluminium kosong dikeringkan dalam oven 105 C
selama 15 menit, lalu didinginkan dalam desikator dan ditimbang
sebagai bobot cawan kosong. Sejumlah sampel sediaan pewarna
tertentu dimasukkan ke dalam cawan aluminium lalu ditimbang,
kemudian dikeringkan dalam oven vakum 70 ºC semalam. Setelah
dikeringkan. Didinginkan dalam desikator dan ditimbang.
Pengeringan dilakukan kembali hingga diperoleh bobot konstan.
keterangan:
a = bobot cawan aluminum (gram)
b = bobot sampel (gram)
c = bobot cawan aluminum dan sampel setelah dikeringkan (gram)
2. Penentuan kadar abu (AOAC, 1995 )
Cawan porselen kosong dikeringkan dalam oven 105 C
selama 15 menit, lalu didinginkan dalam desikator dan ditimbang
sebagai bobot cawan kosong. Sejumlah sampel sediaan pewarna
tertentu dimasukkan ke dalam cawan porselen lalu ditimbang,
kemudian dikeringkan dalam tanur sampai terbentuk abu. Proses
pengabuan dilakukan dalam dua tahap yaitu pertama pada suhu
22 selesai, cawan diinginkan dalam desikator kemudian ditimbang.
Pengabuan dilakukan kembali hingga diperoleh bobot konstan.
3. Kelarutan, metode gravimetri (Purba, 2003)
Satu gram sediaan pewarna bubuk dilarutkan dalam 150 ml
akuades dan disaring dengan menggunakann kertas saring Whatman
No. 42 dengan bantuan pompa vakum. Sebelum digunakan, kertas
saring terlebih dahulu dikeringkan dalam oven 105 C selama 30
menit dan ditimbang. Setelah penyaringan, kertas saring beserta
residu dikeringkan dalam oven 105 C selama tiga jam, didinginkan
dengan desikator dan ditimbang. Pengeringan dilakukan hingga
diperoleh bobot yang konstan.
Keterangan:
a = berat kertas saring dan residu (gram)
b = berat kertas saring (gram)
c = berat sampel yag digunakan
KA = kadar air sampel ( % b/b)
4. Analisis antosianin (Iglesias et al., 2008)
Analisis total antosianin dilakukan dengan metode
spektrofotometri pada panjang gelombang 543 nm (Iglesias et al., 2008). Sampel ekstrak antosianin dipipet sebanyak 0.1 ml. Kemudian
ditambahkan metanol 26.4 M dan HCl 35 % dengan perbandingan
98:2 sampai dengan volume 10 mL. Sampel yang telah terekstrak
disimpan dalam ruang gelap yang ditutup dengan aluminium foil
selama 1 malam pada suhu 40C. Ekstrak diukur dengan
spektrofotometer pada absorbansi 543 nm. Untuk sampel bubuk,
sampel ditimbang sebanyak 0.3 gram dilarutkan dengan 5 ml akuades
23 metanol 26.4 M dan HCl 35 % dengan perbandingan 98 : 2. Sampel
yang telah terekstrak disimpan dalam ruang gelap yang ditutup
dengan aluminium foil selama 1 malam pada suhu 4 0C. Ekstrak
disaring dengan kertas Whatman no. 1 dan filtratnya diukur dengan
spektrofotometer pada absorbansi 543 nm
A= εxbxc
Jumlah antosianin (mg/ml sampel) =
Keterangan :
A = absorbansi
ε = emisifitas antosianin (2.9 x 104 liter/mol) b = lebar kuvet (1.1cm)
c = konsentrasi ekstrak (mol/liter)
BM = massa molekul relatif delphinidin 3-glukosida (501 gr/mol)
5. Pengamatan Warna Menggunakan Chromameter ( Francis, 1999)
Intensitas warna diukur dengan menggunakan Minolta Chroma Meters CR-310. Prinsip dari Minolta Chroma Meters adalah pengukuran perbedaan warna melalui pantulan cahaya oleh
permukaan sampel. Chromameter adalah suatu alat untuk analisis
warna secara terstimulus untuk mengukur warna yang dipantulkan
suatu permukaan. Data pengukuran yang diperoleh dapat berupa nilai
absolut maupun nilai selisih dengan warna standar. Pada chromameter
ini digunakan sistem warna L, a, dan b. L menunjukkan kecerahan, a
dan b adalah koordinat-koordinat kromatisitas, dimana a untuk warna
hijau (a negatif) ke merah ( a positif), b untuk warna biru (b negatif)
sampai kuning (b positif).
Sebanyak 0.2 g pewarna bubuk dilarutkan terlebih dahulu
dengan 10 ml akuades yang memiliki pH 7.0. Sebelum dilakukan
pengukuran chromameter dikalibrasi dulu dengan menggunakan
24 dan y = 0.3338. Setelah dikalibrasi zat warna diukur intensitas
warnanya.
Perubahan warna sampel yang telah disimpan dengan warna
sampel mula-mula dapat ditentukan dengan nilai E. Untuk
mengetahui tingkat ketajaman warna yang dihasilkan daptat dilihat
dari nilai chroma (C), sedangkam untuk mengetahui warna sampel
dapat diketahui dari nilai Hue.
E = [( L)2+( a)2+( b)2]
o
Hue = tan-1(b/a)
C = (a2+b2)1/2
D. RANCANGAN PERCOBAAN
Rancangan percobaan yang digunakan dalam penelitian pembuatan
sediaan pewarna bubuk untuk menentukan konsentrasi maltodekstrin yang
tepat dan untuk memilih sampel yang diuji stabilitasnya adalah rancangan
acak lengkap, yaitu sebagai berikut:
Yij = + Ai + ij
Yijk = Nilai amatan
= Rataan umum
Ai = Pengaruh konsentrasi bahan pengisi ke-i
25
IV. HASIL DAN PEMBAHASAN
A. EKSTRAKSI PIGMEN ANTOSIANIN DARI ROSELA
Ekstraksi antosianin dilakukan dengan pelarut air menggunakan metode
maserasi selama 24 jam. Ekstrak antosianin yang diperoleh berwarna merah
pekat seperti yang terlihat pada Gambar 8. Pelarut air digunakan karena air
bersifat polar dan tidak bersifat toksik. Menurut Amr dan Al-Tamimi (2007)
diacu dalam Ovando et. al. (2009) ekstraksi dengan metanol yang diasamkan lebih efektif dibandingkan dengan etanol dan aquades. Namun metanol
bersifat toksik sehingga jarang digunakan pada bahan pangan.
Ekstraksi antosianin dari 100 g rosela dengan satu liter air akan
menghasilkan 850 ml ekstrak. Selanjutnya dilakukan analisis total antosianin
dalam ekstrak. Total antosianin ekstrak diperoleh sebesar 0.49 mg/ ml ekstrak.
Gambar 8. Ekstrak antosianin
B. KARAKTERISTIK SEDIAAN BUBUK PEWARNA ROSELA
METODE SPRAY DRYING
Teknik yang dilakukan pada pembuatan sediaan bubuk pewarna adalah
teknik mikroenkapsulasi. Metode mikroenkapsulasi yang dilakukan pada
penelitian ini adalah metode spray drying dan tray drying. Pada metode spray drying, bahan disemprotkan dan diatomisasi membentuk droplet ke dalam suatu media pengering yang panas, kemudian air dalam bentuk droplet akan
menguap meninggalkan bahan kering (Dubey et. al., 2009). Ekstrak dengan total padatan 3 % ditambahkan bahan penyalut maltodekstrin. Proporsi total
padatan ekstrak terhadap maltodekstrin adalah 3 : 5, 3: 10, dan 3: 15. Bubuk
26 pada Gambar 9, sedangkan Gambar 10 memperlihatkan bubuk pewarna
setelah dilarutkan. Bubuk pewarna rosela yang dilarutkan dengan akuades
terlihat berwarna merah dengan intensitas warna paling pekat adalah bubuk
pewarna dengan proporsi total padatan ekstrak terhadap maltodekstrin adalah
3 : 5. Larutan bubuk pewarna dengan proporsi total padatan ekstrak terhadap
maltodekstrin 3 : 15 berwarna lebih pucat.
A B C
Gambar 9. Bubuk pewarna rosela (proporsi total padatan terhadap penambahan maltodekstrin A= 3 : 5, B = 3 : 10, C = 3 : 15)
Gambar 10. Bubuk pewarna rosela setelah dilarutkan dalam air (proporsi total padatan terhadap penambahan maltodekstrin A= 3 : 5, B = 3 : 10, C = 3 : 15)
Bubuk pewarna yang dihasilkan selanjutnya dianalisis sifat fisik dan
kimianya, meliputi kadar air, kadar abu, kelarutan, total antosianin dan warna.
Hasil analisis dan perhitungan kadar air, kadar abu, kelarutan, dan total
antosianin bubuk pewarna rosela yang dibuat dengan metode spray drying dapat dilihat pada Lampiran 1. Kadar air pada produk yang berbentuk bubuk
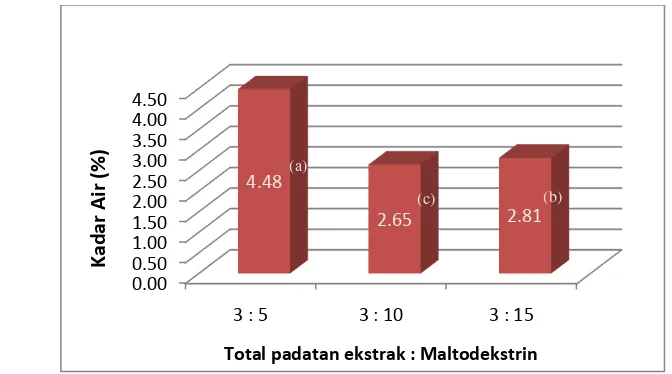
akan mempengaruhi umur simpan produk. Diagram kadar air bubuk pewarna
(metode spray drying) yang diperoleh dapat dilihat pada Gambar 11. Kadar air terbesar terdapat pada bubuk pewarna dengan proporsi total padatan ekstrak
terhadap maltodekstrin 3 : 5 yaitu 4.48 %. Perbedaan ini disebabkan proporsi
maltodekstrin tersebut kurang cukup untuk menyalut asam dan gum yang
27 yang agak lengket. Sifat gum yang dapat membentuk gel akan menghambat
pengeringan karena air yang terperangkap dalam gel sulit diuapkan sehingga
terbentuk bubuk yang semi basah. Bubuk yang semi basah ini sangat mudah
sekali menempel pada dinding drying chamber pengering. Akibatnya bubuk yang dihasilkan akan berbentuk gumpalan-gumpalan yang semi basah (Purba,
2003). Pada penelitian yang dilakukan Purba (2003), pigmen brazilin yang
ditambahkan gum arab sebanyak 2 %, 3 % dan 4 % mengalami penggumpalan
karena terbentuknya gel saat dikeringkan dengan spray dryer. Berdasarkan uji statistik (Lampiran 3), konsentrasi maltodekstrin memberikan pengaruh nyata
terhadap kadar air produk. Hal ini dapat dilihat dari uji statistik dengan metode
duncan bahwa ketiga sampel berada dalam subset yang berbeda.
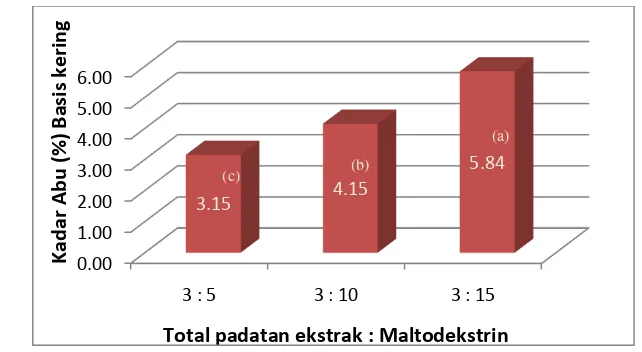
Gambar 11. Diagram kadar air bubuk pewarna rosela (metode spray drying) Hasil penelitian terhadap kadar abu menunjukkan kadar abu tertinggi
adalah 5.84 % yaitu pada bubuk pewarna rosela dengan proporsi total padatan
ekstrak terhadap maltodekstrin 3 : 15. Kadar abu terendah adalah 3.15 % yaitu
bubuk pewarna rosela dengan proporsi total padatan ekstrak terhadap
maltodekstrin 3 : 5. Diagram perbandingan kadar abu dapat dilihat pada
Gambar 12. Total abu yang tinggi mengindikasikan kandungan mineral yang
tinggi. Mineral tersebut dapat berasal dari matodekstrin yang ditambahkan serta
dari rosela itu sendiri. Menurut Maryani dan Kristiana (2005), dalam 100 gram
rosela terkandung 1 gram abu yang di dalamnya terdapat mineral kalsium,
Total padatan ekstrak : Maltodekstrin
28
Gambar 12. Diagram kadar abu bubuk pewarna rosela (metode spray drying)
Beberapa ion logam dapat berinteraksi dengan antosianin membentuk
kompleks. Beberapa kation logam dapat menyebabkan bathocromic shift yaitu pergeseran panjang gelombang maksimum. Hal ini dapat diamati apabila
terjadi perubahan warna menjadi kebiruan dan kadang-kadang menyebabkan
pengendapan pigmen. Warna biru dapat terbentuk karena pembentukan
komlpeks antara antosianin dan beberapa ion logam seperti aluminium, besi,
tembaga, timah dan magnesium (Ovando et. al., 2009). Pada sampel yang diamati tidak terjadi perubahan warna merah menjadi biru. Berdasarkan uji
statistik (Lampiran 4), ketiga sampel berada pada subset yang berbeda. Dengan
demikian dapat diketahui bahwa konsentrasi maltodekstrin memberikan
pengaruh nyata terhadap kadar abu produk.
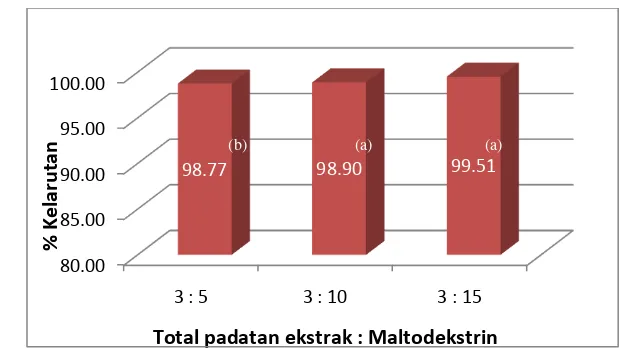
Berdasarkan uji kelarutan bubuk pewarna, diperoleh nilai kelarutan
tertinggi adalah 99.51 % yaitu bubuk pewarna dengan proporsi total padatan
ekstrak terhadap maltodekstrin 3 : 15, sedangkan nilai kelarutan terendah
adalah 98.77 % yaitu bubuk pewarna dengan proporsi total padatan ekstrak
terhadap maltodekstrin 3 : 5. Perbedaan ini disebabkan oleh perbedaan kadar
air bubuk pewarna. Semakin tinggi kadar air produk bubuk, semakin sulit
produk dilarutkan dalam air karena produk cenderung membentuk butiran yang
lebih besar tetapi tidak porous. Diagram kelarutan bubuk pewarna dapat dilihat
pada Gambar 13.
Total padatan ekstrak : Maltodekstrin
(c) (b)