(
Gardenia jasminoides
Ellis)
IDA BAGUS KETUT WIDNYANA YOGA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul : IDENTIFIKASI KOMPONEN PEMBENTUK GEL (KPG) DAN POTENSI ANTIOKSIDAN DAUN KACAPIRING (Gardenia jasminoides Ellis) adalah benar merupakan karya sendiri di bawah arahan Komisi Pembimbing, dan belum pernah dipublikasikan. Semua sumber data dan informasi telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, September 2008
IDA BAGUS KETUT WIDNYANA YOGA. NRP. F251060011. Identification of Gel Forming Component (GFC) and Antioxidant Potency of Kacapiring Leaf (Gardenia jasminoides Ellis). Under direction of NURI ANDARWULAN and ENDANG PRANGDIMURTI.
Leaf of Kacapiring (Gardenia jasminoides Ellis) is a part of plant which has hydrocolloid component and can form gel. The aims of this research were (1) to evaluate physical and chemical properties of leaves and gel, (2) to extract, isolate, fractionate and identify gel forming component (GFC), and (3) to analyse the potency of antioxidant capacity of its gel.
The research was devided into three steps as follows (1) Physical characterization were done for the dimension of leaves, and gel properties by sensory analysis. Chemical components of leaf and gel were quantified by proximatanalysis and mineral component was analyzed by atomic absorption spectrophotometer (AAS) such as Cu, Fe, Mg and Ca. Dietary fibre component was analyzed by enzymatic method and estimation of pectic substances was done by spectrophotometer (2) Isolation of GFC was done by extraction using 0.028 M ethylendiamintetraacetate (EDTA). GFC was fractionated by ultrafiltration membrane. Monomers of GFC was identified by paper chromatography, and (3) Bioactive components such as, chlorophyll total was analyzed by spectrophotometer and its derivations of acetone extract (99.9%) by thin layer chromatography (TLC), meanwhile phenolic total and antioxidant capacity were analyzed by spectrophotometer.
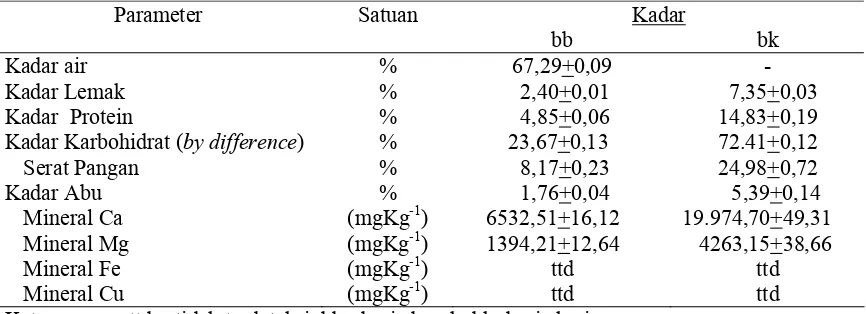
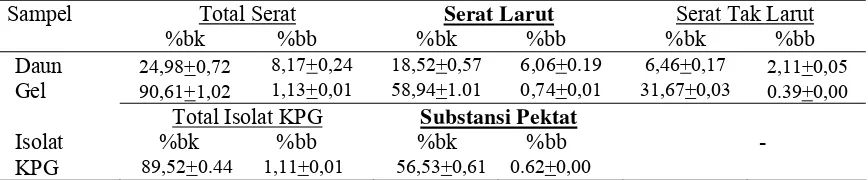
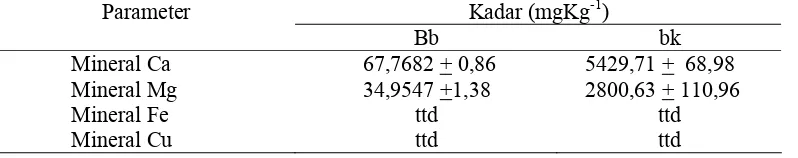
The results showed that kacapiring leaves contained water, ash, protein, fat, and carbohydrate. The mineral content in leaf and gel consisted of Ca of 19974.70+49.31 and 5429.71+68.98 mgKg-1db, Mg of 4263.15+38.66 and 2800.63+110.96 mgKg-1 db respectively, while Fe and Cu were not detected. The best gel can be obtained by AQ (1:15) treatment. Dietary fibre of leaf and gel contained of 24.98+0.72 and 90.61+1.02 %db respectively. Pectic substances of GFC isolate contained 56.53+0.61 %db galacturonic acid as pectin monomers. Isolate of 0.25% GFC was fractionated by ultrafiltration membrane and 96.78 % of retentate was separated in 5 μm membrane filter. Analysis bypaper chromatography showed that GFC isolate contained galacturonic acid and glucose. Bioactive component of kacapiring leaves and gel contained chlorophyll total of 4926.25+190.31 and 1166.86+8.73 mgKg-1db. Both of them had 5 fractions by acetone extract, i.e. chlorophyll a, chlorophyll b, lutein (chlorophyll derivations), feofitine and carotene. Phenolic total in leaves and gel contained 5215.91+2.97 and 2648.16+56.22 GAE/g db, and antioxidant capacity had 1.5 x 10-1+0.00 and 3.1x10-3 +0.00 mM TEAC/mg dw respectively.
IDA BAGUS KETUT WIDNYANA YOGA. NRP. F251060011. Identifikasi Komponen Pembentuk Gel (KPG) dan Potensi Antioksidan Daun Kacapiring (Gardenia jasminoides Ellis). Dibimbing oleh NURI ANDARWULAN dan ENDANG PRANGDIMURTI.
Daun kacapiring (Gardenia jasminoides Ellis) adalah salah satu bahan pangan yang mengandung hidrokoloid, dan mampu membentuk gel. Gel dapat digunakan sebagai sumber pangan berserat. Penelitian ini bertujuan untuk (1) mengkaji sifat fisik-kimia gel dan daun kacapiring, (2) mengisolasi dan mengidentifikasi komponen pembentuk gel, serta (3) menganalisis komponen bioaktif yang berpotensi sebagai antioksidan.
Metode penelitian dibagi menjadi tiga tahap. Tahap pertama dilakukan identifikasi varietas daun, serta melakukan pengukuran dimensi daun. Karakteristik fisik gel diamati secara subyektif dengan uji organoleptik, kekentalan, pH dan sineresis. Analisis komponen kimia daun kacapiring dilakukan dengan uji proksimat. Analisis kadar mineral seperti Cu, Fe, Mg dan Ca (metode AAS), analisis kadar serat pangan (metode enzimatis), dan uji substansi pektat (metode spektrofotometri) dengan standar asam galakturonat. Tahap kedua adalah isolasi komponen pembentuk gel (KPG). Gel terbaik ditambahkan larutan EDTA 0,028 M 20%, dipanaskan pada suhu 90oC selama 15 menit, pH diatur sampai 3 dan ditambahkan etanol 96% (1:1,5). Fraksinasi larutan isolat KPG 0,25% b/v dilakukan dengan membran ultrafiltrasi 5
μm, 3 μm, 1,2 μm dan 0,6 μm. Hidrolisis KPG menggunakan enzim karbohidrase kompleks dan identifikasi monomer isolat KPG dilakukan secara kualitatif dengan uji Fehling dan kromatografi kertas, menggunakan standar gula seperti asam galakturonat, glukosa, laktosa, rafinosa, fruktosa dan galaktosa. Tahap ketiga adalah analisis komponen bioaktif seperti analisis kadar klorofil dan turunannya dengan spektrofotometer dan thin layer chromatography (TLC), analisis total fenol menggunakan reagen Folin chiocalteu dan asam galat sebagai kurva standar, dengan spektrofotometer. Kapasitas antioksidan dianalisis menggunakan radikal bebas 2,2-diphenyl-1-picrylhydrazyl (DPPH) dengan spektrofotometer menggunakan kurva standar Trolox®. Data organoleptik dianalisis dengan analysis of varians (ANOVA) dan uji lanjut dengan uji Duncan, sedangkan data lainnya dianalisis secara deskriptif. Hasil penelitian menunjukkan bahwa daun kacapiring mengandung kadar air, abu, protein, lemak dan karbohidrat. Kadar mineral pada daun dan gel adalah Ca (19.974,70+49,31 dan 5429,71+68.98 mgKg-1bk), Mg (4263,15+38,66 dan 2800,63+110,96 mgKg-1bk), sedangkan mineral Fe dan Cu tidak terdeteksi. Gel terbaik diperoleh pada perlakuan rasio daun dengan aquades 1:15. Kadar serat pangan daun dan gel terbaik adalah 24,98+0,72 dan 90,61+1,02 %bk. Hasil uji substansi pektat isolat KPG diperoleh sebesar 56,53+0,61 %bk sebagai asam galakturonat.
© Hak Cipta milik IPB, tahun 2008
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a.Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b.Pengutipan tidak merugikan kepentingan yang wajar IPB.
(
Gardenia jasminoides
Ellis)
IDA BAGUS KETUT WIDNYANA YOGA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NRP : F251060011 Program Studi : Ilmu Pangan
Disetujui Komisi Pembimbing
Dr. Ir. Nuri Andarwulan, M.Si. Dr. Ir. Endang Prangdimurti, M.Si. Ketua Anggota
Diketahui,
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Dr. Ir. Ratih Dewanti Hariyadi, M.Sc. Prof. Dr. Ir Khairil Anwar Notodiputro, M.S.
berkat rahmat-Nya, penulis akhirnya dapat menyelesaikan tugas akhir penelitian yang berjudul ”Identifikasi Komponen Pembentuk Gel (KPG) dan Potensi Antioksidan Daun Kacapiring (Gardenia jasminoides Ellis)”, tepat pada waktunya.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Dr. Ir. Nuri Andarwulan, M.Si, selaku Ketua Komisi Pembimbing dan Ibu Dr. Ir. Endang Prangdimurti, M.Si, selaku Anggota Komisi Pembimbing atas bimbingan, pustaka dan arahannya. Ibu Bintang Puspayoga dan Bapak Wirahadi Kusuma atas segala perhatian serta kiriman pustaka.
Ucapan terima kasih atas bantuan dana penelitian yang telah diberikan dari Proyek Beasiswa Unggulan Departemen Pendidikan Nasional Pusat Jakarta Tahap V Tahun 2007, Yayasan Dana Sejahtera Mandiri (Damandiri) dan Yayasan Van De Venter Maas di Jakarta.
Ayahanda tercinta (almarhum), Bunda serta 4 saudaraku tersayang. Dayu Panca dan keluarga Palembang, Ayah Made Suwena (alm), Ayah Ketut Jaya, Ajik Agung Raka. Teman-teman asrama Pinus Nyoman, Pak Dewa, Pak Lasya (IKIP Singaraja). Teman-teman di Gardu Raya 20 RT II/RW I Margajaya Dramaga Bogor. Bapak Dr. Sucipta, Ibu Timur Ina, Prof. Badra Arihantana, Dayu Bintang serta teman-teman dan rekan kerja di laboratorium FTP Universitas Udayana, terima kasih atas motivasinya. Seluruh staf pengajar Program Studi Ilmu Pangan, staf laboratorium SEAFAST CENTER dan Labortorium ITP (Ibu Ariyanti, Mas Taufiq, Bapak Wachid), staf administrasi kuliah dan seluruh teman-teman IPN 2004, 2005 dan 2006. Ucapan terima kasih juga disampaikan kepada Kepala Laboratorium Penyakit Hewan FKH IPB, Laboratorium di Sucofindo Bekasi dan Laboratorium Bioteknologi IPB atas ijin penggunaan alat–alat analisisnya.
Penulis menyadari bahwa karya tulis ilmiah ini masih jauh dari sempurna. Oleh karena itu saran dan kritik yang bersifat membangun sangat diharapkan agar dapat memberikan informasi dalam pengembangan karya tulis ilmiah ini lebih lanjut. Semoga karya tulis ilmiah ini bermanfaat bagi kita semua.
Penulis dilahirkan di Desa Blahkiuh, Kecamatan Abiansemal, Kabupaten Badung-Bali pada tanggal 19 April 1980 sebagai anak ke 4 dari 5 bersaudara. Orang tua penulis adalah Bapak Ida Bagus Putu Bhasma B.A. (Almarhum) dan Ibu Ida Ayu Anom Kendran.
Sekolah Dasar dilewatkan penulis di SD Senter No 2 Blahkiuh lulus tahun 1992, melanjutkan ke SMP di SMPN 1 Abiansemal, tamat tahun 1995 dan SMA di SMAN 1 Abiansemal hingga tahun 1998. Penulis melanjutkan kuliah Diploma 3 di Akademi Gizi Denpasar sampai tahun 2001. Pada tahun yang sama penulis diterima bekerja di Laboratorium Teknologi Hasil Pertanian Universitas Udayana Bali, sebagai teknisi hingga sekarang. Tahun 2003 penulis melanjutkan kuliah ke jenjang Strata 1 di Fakultas Pertanian Universitas Warmadewa Jurusan Teknologi Hasil Pertanian hingga tahun 2005. Tahun 2006 atas proyek PKIPT (Peningkatan Kinerja Infrastruktural Perguruan Tinggi Negeri) DIKTI tahun 2006 penulis diberi kesempatan untuk melanjutkan kuliah Strata 2 di Sekolah Pascasarjana, Program Studi Ilmu Pangan Institut Pertanian Bogor.
DAFTAR TABEL ... xi Waktu dan Tempat Penelitian... 26
Bahan dan Alat... 26
Metode Penelitian... 27
Prosedur Analisis ... 30
Teknik Analisis Data... 38
HASIL DAN PEMBAHASAN Karakterisasi Sifat Fisik-Kimia Daun dan Gel Daun Kacapiring ... 39
Karakteristik Fisik-Kimia Daun Kacapiring ... 39
Karakteristik Organoleptik Gel Daun Kacapiring... ... 42
Karakteristik Kimia Gel Daun Kacapiring... 47
Isolasi, Fraksinasi, dan Identifikasi Komponen Pembentuk Gel ... 50
Isolasi Komponen Pembentuk Gel ... 50
Fraksinasi Komponen Pembentuk Gel ... 53
Identifikasi Komponen Pembentuk Gel ... 55
Karakteristik Komponen Bioaktif ... 58
Kadar Klorofil ... 58
Kadar Total Fenol ... 64
Kapasitas Antioksidan ... 66
Informasi Zat Gizi dan Non Gizi Gel dan Daun Kacapiring ... 70
SIMPULAN DAN SARAN Simpulan... 72
Saran... 72
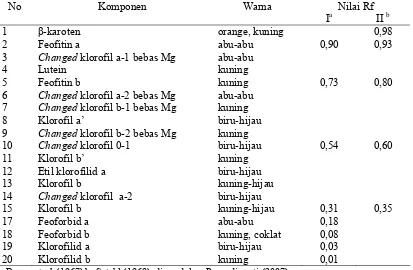
1 Klasifikasi tanaman kacapiring(Gardenia jasminoides Ellis) 4 2 Standar nilai Rf dan posisi relatif turunan klorofil dan beberapa
pigmen lain pada plat TLC selulosa
36
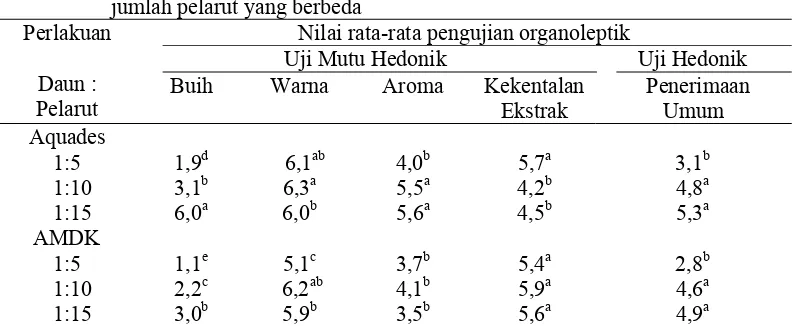
3 Komposisi kimia daun kacapiring 38 4 Hasil pengujian organoleptik gel daun kacapiring dengan
perbandingan jenis dan jumlah pelarut yang berbeda
42
5 Komposisi serat pangan daun dan gel kacapiring serta kadar substansi pektat
48
6 Komposisi mineral gel daun kacapiring (mgKg-1bk) 49 7 Hasil fraksinasi 100 ml KPG 0,25% dengan membran 5 μm
(MWCO 1000-2000 kDa)
54
8 Nilai Rf standar gula dan sampel hidrolisat isolat KPG 56 9 Kadar klorofil daun dan gel daun kacapiring (mgKg-1 bk) 58 10 Nilai Rf masing-masing spot ekstrak aseton daun dan gel pada plat
TLC selulosa
61
11 Panjang gelombang maksimum turunan klorofil, lutein dan karoten 62 12 Kadar total fenol daun kacapiring 64 13 Kadar total fenol beberapa daun indigenous Jawa Barat (Batari
2007)
65
14 Kapasitas antioksidan daun dan gel daun kacapiring mM TEAC/mg berat kering dibandingkan dengan kapasitas antioksidan ekstrak daun suji dan ekstrak teh
68
Halaman
1 Tanaman, bunga dan buah kacapiring (Gardenia jasminoides Ellis) (PPT 2007).
5
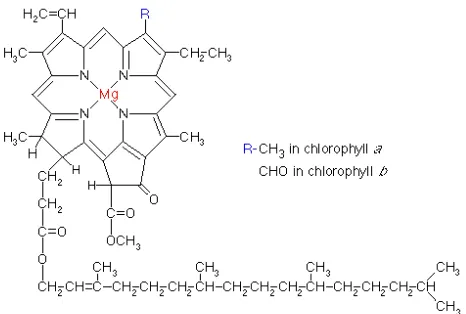
2 Struktur kimia klorofil (Nollet 2000). 24 3 Pengaruh waktu pembentukan dan penyimpanan gel pada suhu ruang
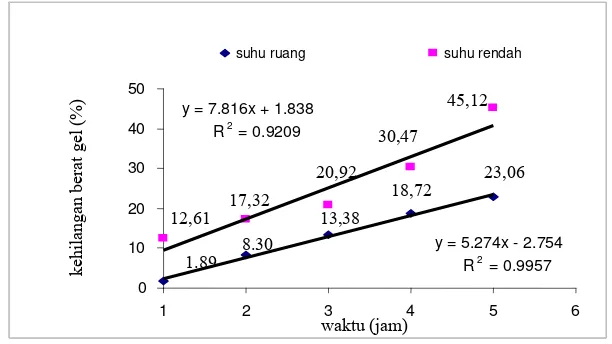
(25 oC ) dan suhu rendah (8oC) terhadap kehilangan berat gel selama 5 jam.
45 6
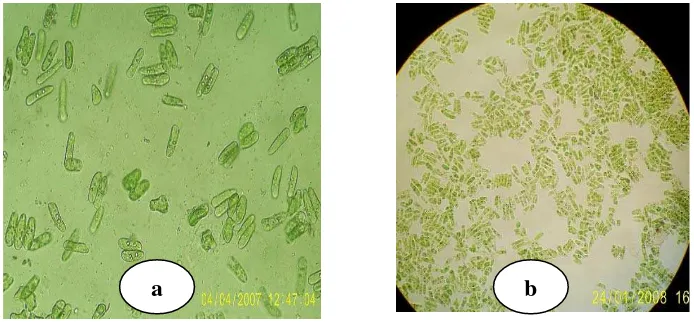
4 Morfologi kloroplas gel segar (a) dan endapan isolat (b) dengan mikroskop pada pembesaran 400x, hasil isolasi dengan penambahan EDTA 0,028 sebanyak 20%.
52
5 Hasil isolasi KPG daun kacapiring. (a) Isolat KPG basah dari filtrat hasil isolasi yang ditambahkan HCl 0,1N sampai pH 3 dan etanol 96% (1: 1,5) dan (b) Isolat KPG kering beku.
53
6 Hasil pemisahan standar dan sampel menggunakan teknik kromatografi kertas, konsentrasi standar 1% dan sampel 2%. (Keterangan : 1 = standar glukosa, 2= fruktosa, 3= laktosa, 4=galaktosa, 5= asam galakturonat, dan 6= rafinosa, S1 = sampel ulangan 1, S2= sampel ulangan 2, a=spot 1, b= spot 2).
56
7 Hasil pemisahan ekstrak aseton 99,9% bubuk gel dan daun kacapiring pada plat TLC selulosa dengan larutan pengembang petroleum eter : aseton : n-butanol (90 :10 : 0.45)
61
8 Spektrum serapan klorofil a, klorofil b dan karoten pada panjang gelombang 400-700 nm (Nollet 2000).
61
9 Spektrum klorofil a. Spot berwarna hijau muda dilarutkan dalam aseton 99,9% dan dibaca pada panjang gelombang 350-750 nm.
63
10 Spektrum klorofil b. Spot berwarna hijau dilarutkan dalam aseton 99,9% dan dibaca pada panjang gelombang 350-750 nm.
63
11 Spektrum lutein. Spot berwarna kuning muda dilarutkan dalam etanol 99,9% dan dibaca pada panjang gelombang 350-750 nm.
63
12 Spektrum feofitin. Spot berwarna abu dilarutkan dalam aseton 99,9%, dan dibaca pada panjang gelombang 350-750 nm
63
13 Spektrum karoten. Spot berwarna kuning tua dilarutkan dalam heksan 99,9% dan dibaca pada panjang gelombang 350-750 nm.
64
14 Perubahan warna standar antioksidan trolox, yang direaksikan dengan 0,1 mM larutan DPPH, diinkubasi 30 menit dan dibaca pada panjang gelombang 517 nm.
1 Komposisi kimia daun kacapiring dan kadar air sampel 82
2 Rendemen bubuk daun yang dikeringkan dengan freeze dryer 83 3 Kriteria, skala numerik dan hasil uji organoleptik 84
4 Analisis pH dan viskositas gel terbaik 87 5 Kehilangan berat gel selama 5 jam peyimpanan pada suhu ruang
(27oC)
88
6 Kehilangan berat gel selama 5 jam peyimpanan pada suhu rendah (8 oC)
89
7 Komposisi kimia gel daun kacapiring 90
8 Rendemen bubuk gel yang dikeringkan dengan freeze dryer 91 9 Analisis kadar serat pangan (% bk) 92
10 Analisis substansi pektat 95
11 Rendemen komponen pembentuk gel (KPG) 96 12 Fraksinasi komponen pembentuk gel dengan konsentrasi 0,25% 97
13 Nilai rata-rata Rf fraksi monomer hidrolisat isolat KPG. 98
14 Analisis kadar total klorofil (mg L-1) 99
15 Nilai Rf fraksi ekstrak aseton bubuk daun dan bubuk gel. 101
16 Panjang gelombang maksimum dan nilai absorbansi ektrak aseton bubuk daun dan bubuk gel.
101
PENDAHULUAN
Latar Belakang
Dewasa ini, dasar pertimbangan konsumen di negara-negara maju dalam memilih bahan pangan, bukan hanya bertumpu pada kandungan gizi dan kelezatannya, tetapi juga pengaruhnya terhadap kesehatan (Astawan 2006). Penyakit degeneratif yang muncul oleh pola konsumsi pangan yang salah mengakibatkan timbulnya kecenderungan di masyarakat untuk mengonsumsi makanan yang lebih aman dan mampu meningkatkan status kesehatan, salah satunya dengan pangan fungsional.
Pangan fungsional adalah pangan yang secara alamiah maupun telah mengalami proses, mengandung satu atau lebih senyawa berdasarkan kajian ilmiah mempunyai fungsi-fungsi fisiologis tertentu yang bermanfaat bagi kesehatan, serta dikonsumsi sebagaimana layaknya makanan atau minuman. Pangan fungsional mempunyai karakteristik sensori berupa penampakan, warna, tekstur dan cita rasa yang dapat diterima konsumen, selain tidak memberikan kontraindikasi dan tidak menimbulkan efek samping pada jumlah penggunaan yang dianjurkan terhadap metabolisme zat gizi lainnya. Golongan senyawa yang dianggap mempunyai fungsi fisiologis dalam bahan pangan adalah senyawa alami di luar zat gizi dasar yang bersangkutan dan mempunyai sifat membantu pencegahan terhadap suatu penyakit (BPOM 2005).
Terkait dengan tujuan tersebut di atas, dalam rencana strategis Departemen Pertanian melalui program pembangunan pertanian jangka menengah periode tahun 2005 sampai tahun 2009 menetapkan beberapa kebijakan. Salah satu kebijakannya dijabarkan dalam pengembangan teknologi pengolahan pangan tradisional yang mendukung ketahanan pangan serta pengkajian teknologi inovatif spesifik lokasi dan agribisnis unggulan daerah (Deptan 2004). Oleh karena itu, upaya pengembangan potensi daun kacapiring perlu dilakukan untuk meningkatkan nilai tambah sumber daya tanaman tersebut.
digunakan sebagai obat sakit gigi dan demam. Bunga diolah menjadi minyak atau bahan kosmetika. Batangnya digunakan sebagai bahan baku dupa untuk aroma terapi (PPT 2007). Buah kacapiring dimanfaatkan untuk pewarna alami makanan, antitumor, antihiperlipid, juga berfungsi sebagai senyawa antihepatik, diuretik, laksatif, dan koleratik (Zhou et al. 2007). Daun kacapiring sementara digunakan sebagai obat panas dalam, sariawan dan terapi diit diabetes (Dalimartha 2005). Daun berwarna hijau tua, mengandung klorofil yang merupakan pigmen alami utama dedaunan. Klorofil yang diekstrak dari daun alfalfa berfungsi sebagai anti peradangan, antibakteri, antiparasit, dan antioksidan (Rahmayanti & Sitanggang 2006). Identifikasi fitokimia daun kacapiring menunjukkan bahwa daun kacapiring mengandung senyawa flavonoid, saponin, tanin, asam galat, steroid atau terpenoid (Fatmawati 2003). Senyawa fitokimia ini berfungsi sebagai antioksidan alami, sehingga daun kacapiring sangat berpotensi untuk dikembangkan menjadi produk obat-obatan tradisional. Oleh karena multi guna tanaman itu, maka Pemerintah kota Denpasar-Bali menjadikan tanaman kacapiring sebagai maskot kota (PPT 2007).
Sifat fungsional daun kacapiring yang diekstrak dengan air, mempunyai kemampuan membentuk gel. Gel merupakan hidrokoloid alami yang mengandung sebagian besar air dengan sifat khas seperti padatan, khususnya sifat elastis dan kekakuan (Fardiaz 1989). Gel daun mengandung komponen bioaktif seperti serat pangan. Serat pangan memiliki peranan yang sangat penting untuk mencegah terjadinya obesitas, aterosklerosis, jantung koroner, kanker usus dan diabetes (Nawirska & Kwasniewska 2005), serta beberapa mekanisme dalam menangkal racun (detoksifikasi), efek antibakteri dan antioksidan pada saluran pencernaan manusia (Muchtadi 2000).
Glicksman (1969), menyatakan bahwa gelasi terjadi melalui terbentuknya jaringan tiga dimensi oleh molekul primer dengan memerangkap sejumlah air di dalamnya dan membentuk ikatan silang antar polimer. Fenomena tersebut dipengaruhi oleh konsentrasi, suhu, pH, dan adanya ion atau komponen aktif lainnya.
meningkat. Alginat misalnya memiliki sifat yang mirip dengan hidrokoloid dari gel daun. Kebutuhan alginat pada tahun 2006 sebanyak 10.730 ton dan prediksi pada tahun 2010 meningkat sebesar 14.330 ton (Anggadiredja et al. 2006). Kebutuhan alginat dari data tersebut menunjukkan angka yang cukup besar, sehingga perlu dicarikan alternatif sumber hidrokoloid baru yang mempunyai sifat fungsional sama. Sifat fungsional komponen pembentuk gel daun kacapiring harus dipelajari secara mendasar untuk mengetahui karakteristik sifat fungsional yang dominan. Sifat-sifat tersebut dipengaruhi oleh berat molekul, konsentrasi, keberadaan mineral, kondisi lingkungan dan unit gula penyusunnya (Southgate 1991 diacu dalam Artha 2001).
Tujuan Penelitian
Tujuan penelitian ini adalah: (1) melakukan kajian terhadap sifat fisik-kimia daun dan gel daun kacapiring. (2) melakukan identifikasi komponen pembentuk gel (KPG) pada gel daun kacapiring dan (3) menganalisis komponen bioaktif (serat pangan, klorofil, total fenol) serta kapasitas antioksidan.
Manfaat Penelitian
TINJAUAN PUSTAKA
Tanaman Kacapiring (Gardenia Jasminoides Ellis)
Botani dan Klasifikasi
Kacapiring adalah spesies tanaman perdu berumur tahunan dari suku Rubiaceae, bunganya berwarna putih dan sangat harum. Tanaman ini dikenal dengan nama binomial Gardenia jasminoides Ellis yang berarti seperti melati, walaupun tidak ada hubungannya dengan marga Jasminum/ melati (http://www. wikipedia.org/wiki/Gardenia). Kacapiring berasal dari Cina dan Jepang. Kacapiring biasa ditemukan sebagai tanaman hias di pekarangan pada daerah dengan ketinggian 400 meter di atas permukaan laut. Kacapiring dapat berbuah pada ketinggian sekitar 3000 kaki di atas permukaan laut. Kacapiring merupakan perdu tegak dengan tinggi 1 sampai dengan 2 meter. Menurut Dalimartha (2005) klasifikasi nama daerah tanaman kacapiringdapat dilihat pada Tabel 1. Sedangkan botani tanaman kacapiring adalah sebagai berikut:
kingdom : Plantae
Tabel 1 Klasifikasi tanaman kacapiring (Gardenia jasminoides Ellis)
Sinonim Nama Daerah
a. Gardenia augusta Merr b. Gardenia florida I
c. Gardenia grandiflora Sleb d. Gardenia maruba Sieb e. Gardeniapictorum Hassk f. Gardenia radicans Thumb
a. Sumatra : meulu bruek, raja patih (Aceh)
b. Jawa : kacapiring (Sunda), peciring, cepiring, ceplok piring (Jawa)
c. Maluku : kacapiring, sangklapa
Tanaman kacapiring seperti terlihat pada Gambar 1 mempunyai batang bulat berkayu, bercabang, ranting muda, daunnya berlapis lilin dan tunggal. Daun letaknya berhadapan atau bercabang tiga, tebal dan licin seperti kulit, bertangkai pendek, bentuknya elips atau bulat telur sungsang, ujung dan pangkalnya runcing, tepi rata, permukaan atas mengkilap dengan panjang daun dari 4,5 sampai 13 cm, lebar daun antara 2 sampai 5 cm. Daun berwarna warna hijau tua dan berbau harum (Dalimartha 2005).
Gambar 1 Tanaman, bunga dan buah kacapiring (Gardenia jasminoides Ellis)
Buah kacapiring berbentuk bulat telur, kulitnya tipis, mengandung pigmen berwarna kuning dan berbiji banyak. Buah bisa dimakan, dan juga digunakan sebagai pewarna kuning pada makanan seperti kunyit. Buah memiliki rasa pahit, sifatnya dingin dengan afinitas ke meridian jantung, hati, paru-paru dan lambung. Senyawa pada buah memiliki fungsi membuang racun, menghilangkan lembab, meningkatkan fungsi hati, menenangkan emosi (sedatifa), melancarkan aliran empedu ke usus, antiradang, antibiotik, pereda demam (antipiretik), peluruh dahak, peluruh kencing (diuretik), penyejuk darah, penawar racun, menghentikan pendarahan dan menghancurkan pembekuan darah (Dalimartha 2005). Buah mengandung komponen crocin (salah satu jenis karotenoid) berwarna kuning cerah. Buah yang kering merupakan bahan pewarna tekstil dan pewarna kue tradisional Jepang (wagashi), asinan lobak (takuan) dan pewarna nasi dalam masakan lokal (Dalimartha 2005).
harum sehingga sering digunakan sebagai bahan baku minyak bunga. Bunga kacapiring digunakan sebagai penambah rasa pada daun teh di Cina. Keharuman bunganya sepintas mirip melati sehingga banyak menarik minat serangga seperti beberapa spesies Lepidoptera dan semut. Bunga merupakan komoditas bunga potong, digunakan dalam karangan bunga dan korsase. Tanaman kacapiring berkembang biak dengan cara stek atau cangkok (http://www. wikipedia.org/wiki/Gardenia)
Pemanfaatan dan Khasiat Tanaman Kacapiring
Daun kacapiring secara tradisional biasa digunakan obat untuk penyembuhan panas dalam. Daun juga digunakan sebagai substitusi dengan daun cincau hijau untuk membuat bahan makanan sejenis gel yang dijual sebagai bahan pengisi minuman segar. Gel dibuat dengan peremasan daun dalam media air hingga membentuk cairan keruh berwarna hijau membentuk gel. Gel berkhasiat untuk terapi beragam penyakit, di antaranya diabetes melitus, sariawan, demam dan sukar buang air besar (http://www.wikipedia.org/wiki/Gardenia). Daun yang lebat mampu menyejukkan udara dan menyerap zat beracun dari udara, sehingga tepat dijadikan tanaman penghijauan bagi kota-kota yang kadar polusinya tinggi (http://www.cybertokoh.com/mod.php).
Hasil penelitian para ahli terhadap tanaman kacapiring, menunjukkan bahwa kacapiring mengandung senyawa yang mudah menguap. Senyawa tersebut adalah linalool dan styrolyl (http://iptek.net.i/ind/pd_tanobat/view.php?id=143). Komponen kimia pada daun hasil penelitian Fatmawati (2003), menyampaikan bahwa daun kacapiring mengandung senyawa flavonoid, saponin, tanin, asam galat, dan steroid/ terpenoid yang merupakan kelompok senyawa fenolik.
Komponen kimia pada buah kacapiring adalah minyak atsiri, gardenin C14H12O6 atau C23H30O10, gardenosid, geniposide (Kang et al. 1997) adalah iridoid glukosida yang dihasilkan dari ekstraksi buah kacapiring, digunakan sebagai pewarna kuning alami pada makanan dan obat tradisional di Cina, genipin-1-glukoside, genipin-1-β-D-gentiobioside, gardoside (8,10
dehidrologanin), glikosid β-sitosterol, α-manittol, nonacosasone, crocetin, crocin
(Chen et al. 2007), klorogenin, tanin, dan dekstrosa (Dalimartha 2005). Zhou et al. (2007) mengisolasi kandungan buah kacapiring dan memperoleh 4 komponen utama yaitu shanzzhiside, deacetil-asperulosidik acid metil ester, gardenosid dan scandesidemetil ester yang dimurnikan dengan kristalografi dan kromatografi.
Hidrokoloid
Sifat-Sifat Fungsional Hidrokoloid
Hidrokoloid merupakan polimer larut air, mempunyai kemampuan mengentalkan atau membentuk sistem gel encer. Menurut Pomeranz (1991) hidrokoloid merupakan makromolekul hidrofilik yang dapat dilarutkan, didispersikan atau mengembang dalam air dan membentuk larutan yang kental (gel).
Hidrokoloid alami dari tanaman sudah lama dipergunakan sebagai bahan campuran pada pengolahan makanan. Berdasarkan komponen penyusunnya, sebagian besar hidrokoloid merupakan polisakarida (Walter 1991). Hidrokoloid dapat meningkatkan kekentalan larutan dan membentuk gel (Glicksman 1969). Hidrokoloid tergolong senyawa yang relatif sulit dicerna namun dalam pengolahan pangan, senyawa ini digunakan untuk memodifikasi tekstur suatu produk pangan karena hubungannya dengan penerimaan konsumen (Fardiaz 1989).
Hidrokoloid dibedakan menjadi hidrokoloid tradisional dan hidrokoloid komersial. Hidrokoloid tradisional sudah biasa dikonsumsi masyarakat pada suatu daerah tertentu, namun keterbatasan informasi sifat dasarnya menyebabkan penggunaan hidrokoloid tersebut menjadi sangat terbatas. Beberapa contoh hidrokoloid tradisional adalah Premna oblongifolia Merr (Untoro 1985), Cyclea barbata L. Miers) dan Mesona polutris B.L. Hidrokokoloid tradisional terkadang mempunyai keunggulan komparatif dibandingkan dengan hidrokoloid komersial, yaitu cepat mengalami gelasi pada air dingin. Sifat-sifat gel dapat ditingkatkan dengan menambahkan ion logam divalen tertentu seperti Ca, Mg, Ba, Cu, Fe, Pb, dan Hg (Kurniati 1999).
Berbagai jenis hidrokoloid dapat digunakan dalam industri pangan, baik yang berasal dari sumber alami maupun sintetis. Pemilihan jenis hidrokoloid yang digunakan untuk suatu produk pangan tergantung sifat-sifat hidrokoloid, sifat produk pangan yang diinginkan serta faktor pertimbangan biaya. Menurut Fardiaz (1989) berdasarkan sumber asalnya hidrokoloid dapat diklasifikasikan menjadi tiga kelompok yaitu hidrokoloid alami, hidrokoloid alami termodifikasi dan hidrokoloid sintetis. Hidrokoloid atau gum mempunyai banyak sifat fungsional yang berguna dalam aplikasi pangan (Fardiaz 1989).
Sifat utama hidrokoloid adalah mampu membentuk gel. Pembentukan gel merupakan fenomena yang menarik dan sangat kompleks. Gelasi melibatkan asosiasi (ikatan silang) dari rantai-rantai polimer untuk membentuk jaringan tiga dimensi secara kontinyu. Mampu memerangkap cairan, membentuk struktur yang kaku, kokoh, dan tahan mengalir di bawah suatu tekanan tertentu.
yang beragam. Perbedaan jenis gula bukan memberikan kontribusi terhadap geometri akhir, tetapi berpengaruh terhadap berat molekul (BM) dan sifat fungsional (Barbut & Foegeding 1993). Menurut Morris (1979) ada empat struktur dasar yang membentuk konformasi hidrokoloid, yaitu stuktur primer, sekunder, tersier dan kuartener.
Faktor-Faktor yang Mempengaruhi Pembentukan Gel
Faktor-faktor yang mempengaruhi pembentukan gel pada hidrokoloid, dapat berdiri sendiri atau berhubungan satu sama lain sehingga memberikan pengaruh yang kompleks. Faktor-faktor yang paling menonjol adalah konsentrasi, suhu, pH, dan adanya ion atau komponen aktif lainnya (Fardiaz 1989).
Konsentrasi
Konsentrasi hidrokoloid sangat berpengaruh terhadap kekentalan larutannya. Konsentrasi hidrokoloid yang rendah biasanya akan bersifat sebagai aliran Newtonian. Meningkatnya kosentrasi menyebabkan sifat aliran akan berubah menjadi non Newtonian. Hampir semua hidrokoloid memiliki kekentalan yang tinggi pada konsentrasi yang sangat rendah antara 1-5%, kecuali pada gum arab yang sifat Newtoniannya tetap dipertahankan sampai dengan konsentrasi 40%. Konsentrasi hidrokoloid pada daun cincau yang memiliki konsistensi sifat gel terbaik pada konsentrasi 5%. Pada konsentrasi yang lebih tinggi, gel yang dihasilkan lebih banyak mengandung buih sehingga mempengaruhi penampilan fisik serta mempercepat terjadinya sineresis, sedangkan pada konsentrasi lebih rendah, gel yang diperoleh bersifat lebih encer sehingga konsentrasi sangat mempengaruhi karaktersistik sifat gel yang dihasilkan (Untoro 1985).
Suhu
yang utuh. Pemanasan diperlukan terutama oleh sekelompok pektin yang memiliki jumlah grup metoksi tinggi, sedangkan hidrokoloid pada daun cincau merupakan kelompok pektin bermetoksi rendah, dimana dalam pembentukan gelnya tidak memerlukan proses pemanasan (Untoro 1985). Pengaruh panas akan menyebabkan struktur gel menjadi rusak, lunak dan warna gel kecoklatan karena proses oksidasi dan lepasnya mineral Mg yang mengikat klorofil (Ferruzi et al. 2001). Peningkatan suhu menyebabkan pergerakan molekul-molekul dalam larutan baik molekul polisakarida atau ion-ion mineral, sehingga menunda kesempatan terbentuknya jejaring yang teratur antara polimer dengan ion mineral. Gel yang disimpan pada suhu rendah akan memberikan kekompakan dan kekuatan gel yang lebih baik karena terbentuk matrik sistem gel yang lebih kuat, yaitu pada gel daun cincau memiliki karakteristik sifat fisik yang jauh lebih baik dan memiliki umur simpan yang lama (5oC selama 30 hari penyimpanan), dibandingkan pada suhu ruang (Untoro 1985).
Derajat keasaman ( pH )
Hidrokoloid pada umumnya membentuk gel dengan baik pada kisaran pH tertentu. Hal ini ditunjukkan oleh terjadinya peningkatan kekentalan dengan meningkatnya pH hingga mencapai titik tertentu dan kemudian akan makin menurun bila pH terus ditingkatkan. Gel daun cincau hijau memiliki sifat fisik gel terbaik pada pH rendah (asam) yaitu sekitar 5,55. Pada pH 4,0 larutan menjadi kental sekali dan bila pH diturunkan lagi, maka kekentalan akan menjadi semakin berkurang. Hal ini disebabkan oleh gugus-gugus asam polisakarida, sehingga sifat larutan tergantung pada gugus tersebut. Jika gugus tersebut karboksil asam lemah maka viskositas larutan sangat dipengaruhi oleh pH (Untoro 1985).
bermuatan dan gaya tolak menolak antar polimer tidak ada, yang mengakibatkan polimer cenderung mengumpul atau tidak tersebar dalam larutan yang mengakibatkan viskositasnya rendah (Untoro 1985).
Keberadaan Ion Logam
Beberapa jenis hidrokoloid membutuhkan ion-ion logam tertentu untuk membentuk gel, karena pembentukan gel tersebut melibatkan pembentukan jembatan melalui ion-ion selektif. Mineral dengan ion divalen dan multivalen bisa dipakai untuk membentuk gel seperti Ca2+, Ba2+
, Mg2+, Zn2+, Fe2+, Pb2+, Mn2+, Cu2+, Hg2+, Fe3+. Ion bervalensi tunggal dari KCl, NaCl dan NH4Cl tidak dapat digunakan untuk membentuk gel karena ion dengan valensi tunggal tidak bereaksi dengan polimer. Ion bervalensi tunggal tetap larut dalam air dan terimobilisasi dalam gel yang dapat mempertinggi tekanan osmosis dari air dalam gel sehingga mengurangi sineresis (Untoro 1985). Rendlemen (1966) menyatakan bahwa logam alkali dan alkali tanah dapat membentuk komplek dengan karbohidrat.
Penambahan garam mineral yang berlebihan menyebabkan penggumpalan atau “salting out”, dan keberadaan mineral akan menyebabkan terjadi kompetisi dengan hidrokoloid dalam mengikat air. Gel daun cincau dan alginat mempunyai mekanisme pembentukan gel secara kimia. Pembentukan gelnya dibantu oleh mineral tertentu, seperti kalsium yang membentuk jembatan ion sehingga mampu mengelasi OH pada gugus karboksilat. Ion kalsium yang ditambahkan pada pektin, pH 3 dan mengalami proses termal akan membentuk gel yang bersifat reversible. Logam divalen diperlukan untuk menghubungkan rantai-rantai asam pektinat sehingga dapat membentuk jaringan gel (Towle & Christensen 1973, diacu dalam Farida 2002).
Komponen aktif lainnya
Interaksi antara hidrokoloid biasanya bersifat sinergistik, apabila menghasilkan peningkatan kekentalan dalam bentuk campuran. Umumnya pengaruh komponen atau hidrokoloid lain dikontrol oleh pH dan konsentrasi (Fardiaz 1989).
Isolasi Komponen Pembentuk Gel (KPG)
Hidrokoloid pada tanaman sebagian besar berinteraksi dengan komponen lain membentuk struktur jaringan (Southgate 1991). Pemisahan hidrokoloid dari komponen tersebut memerlukan langkah sistematis seperti ekstraksi, filtrasi, sentrifugasi, penggumpalan dan pengeringan. Keberhasilan pemisahan suatu komponen tergantung dari konsentrasi, sifat fisiko-kimia dan tingkat kemurnian yang ingin dicapai (Southgate 1991).
Konsentrasi hidrokoloid pada tanaman diperkirakan berkisar antara 2,5% sampai 5% dari total berat keringnya (Walter 1991). Metode ekstraksi yang memadai diperlukan untuk memperoleh hasil yang baik. Phatak et al. (1988) menyebutkan bahwa salah satu faktor yang harus diperhatikan dalam isolasi hidrokoloid adalah pH. Penurunan pH dapat menyebabkan gugus aktif hidrokoloid mengalami protonasi sehingga menjadi reaktif dan gaya tolak elektrostatiknya akan semakin besar untuk menggerakkan rantai-rantai hidrokoloid. Penurunan pH juga menyebabkan ionisasi logam yang mempunyai tendensi untuk bereaksi dengan gugus aktif hidrokoloid. Hariyadi (1990), menyatakan nahwa reaksi tersebut perlu dikendalikan dengan menambahkan senyawa pengelasi logam seperti ethilendiamintetraacetate (EDTA). Penambahan EDTA dimaksudkan untuk membentuk kompleks antara mineral yang ada pada gel dengan EDTA (Nabrzyski 1997). EDTA adalah agen pengikat ion logam dan meningkatkan energi aktivasi dari reaksi inisiasi membentuk ikatan sigma dengan logam (Nostrandis 1976).
molekulnya (Bruneton 1999). Artha (2001) dalam penelitiannya melakukan fraksinasi komponen pembentuk gel daun cincau Cyclea barbata L. Miers dan memperoleh hasil bahwa isolat KPG terdiri dari sebagian komponen dengan berat molekul besar 1000-2000 kDa, yang tersusun oleh asam galakturonat sebagai rantai utama dan galaktosa pada rantai percabangannya. Beberapa faktor yang perlu dipertimbangkan selama fraksinasi, yaitu pH dan konsentrasi larutan hidrokoloid. Larutan hidrokoloid dengan pH antara 2,5 sampai 2,8, akan menyebabkan pori-pori membran cepat tersumbat. Hal ini disebabkan oleh gugus fungsional yang berprotonasi dapat berinteraksi dengan sisi aktif membran sehingga terjadi penyumbatan pada pori-pori membran. Macrae et al. (1993) menyatakan bahwa semakin tinggi konsentrasi hidrokoloid, maka pori-pori membran akan semakin cepat tersumbat. Setyaningsih (1998) berhasil melakukan fraksinasi peptida filtrat moromi dengan ultrafiltrasi menjadi fraksi dengan berat molekul antara 3 kDa sampai 10 kDa, dan antara 0,5 kDa sampai 3 kDa. Faksinasi larutan KPG juga dilakukan dengan memodifikasi kondisi tersebut (Artha 2001).
Berat molekul polisakarida berbeda satu sama lain, karena variasi alami berat molekul, ketidakakuratan dalam teknik separasi, purifikasi dan dispersi molekul. Penentuan berat molekul suatu polisakarida sangat sulit, namun informasi tentang berat molekul sangat penting untuk viskositas, pembentukan gel dan pembentukan film. Keberadaan gugus asam karboksilat pada polisakarida yang bersifat asam, menyebabkan perbedaan sifat di dalam suatu larutan. Viskositas hidrokoloid jika gugus asam karboksilatnya adalah asam lemah, maka viskositasnya sangat dipengaruhi oleh pH. Gugus karboksilat pada larutan netral adalah garam anion. Garam alkali metal biasanya mengalami ionisasi, sehingga menghasilkan viskositas yang tinggi dalam larutan. Faktor tambahan yang berkontribusi terhadap viskositas adalah kenaikan hidran sebagai akibat anion karboksilat. Repulsi ion antara anion karboksilat menyebabkan molekul polisakarida mendorong satu sama lain sehingga mencegah gelasi (Manullang 1997).
tersebut hanya sebagian kecil terionisasi dan sifat larutan lebih mendekati pada polisakarida netral. Grup asam yang tidak bermuatan, bertaut oleh ikatan hidrogen menyebabkan presipitasi gel. Kebutuhan akan asam dalam pembuatan jelly buah merupakan contoh dari pengaruh pH tersebut. Grup asam kuat seperti ester sulfat, ditemukan pada beberapa gum tanaman dan polisakarida dari hasil laut. Polisakarida ini tidak banyak dipengaruhi oleh pH. Interaksi antara grup anion dari polisakarida asam pada suasana netral disebabkan karena adanya garam kation polivalen, dan media asam (Manullang 1997).
Sebagian besar hidrokoloid tersusun oleh unit monomer berbeda, sehingga berpengaruh terhadap berat molekul (Walter 1991) dan struktur hidrokoloid yang dihasilkan (Pomeranz 1991). Struktur suatu hidrokoloid tergantung dari jenis gula penyusunnya (Bell 1989). Pendekatan yang mungkin dilaksanakan untuk mempelajari struktur suatu hidrokoloid adalah melakukan hidrolisis (Nollet 1990).
Hidrolisis bertujuan untuk mendapatkan unit penyusun-penyusun polimer hidrokoloid. Hidrolisis dapat dilakukan secara enzimatis atau dengan asam (Bellitz & Grosh 1999). Hidrolisis enzim biasanya dilakukan apabila jenis polimer hidrokoloid telah diketahui (Graham & Horace 1977, diacu dalam Artha 2001). Hidrolisis asam dilakukan apabila jenis polimernya belum diketahui (Houghthon & Raman 1998). Reaksi hidrolisis yang seimbang, menyebabkan tidak semua polisakarida dihidrolisis menjadi gula sederhana (Scott 1990), namun sebagian dalam bentuk disakarida atau oligosakarida (Nielsen 1998). Hidrolisis asam biasanya berlangsung secara acak, pemutusan ikatan glikosidik tidak teratur, sehingga hasilnya sulit diprediksi (Helmy & El-Motagali, 1992). Reaksi hidrolisis yang sulit dikontrol, akan menyebabkan enolisasi, yaitu lepasnya molekul air (Belitz & Grosch 1999), sehingga dihasilkan produk dehidrasi gula seperti furfural, furan, furaldehidmaupunfuranon.
(1978), pelarut yang paling banyak dipergunakan dalam analisis gula sederhana adalah campuran asetonitril : air. Perbandingan pelarut relatif bervariasi tergantung dari sampel yang dianalisis.
Gel Daun Kacapiring
Daun kacapiring mampu menghasilkan gel yang unik seperti gel pada daun cincau. Gel kacapiring dapat diperoleh dengan meremas-remas daun kacapiring segar di dalam sejumlah air sampai diperoleh air perasan yang kental, keruh berwarna hijau. Filtrat cairan yang disaring apabila dibiarkan beberapa waktu akan membentuk gel seperti bongkahan yang tidak tembus cahaya dan licin.
Daun cincau yang selama ini dikenal di Indonesia, digunakan untuk membuat bahan sejenis gel yang banyak dijual sebagai bahan pengisi minuman segar. Gel adalah sejenis makanan yang bersifat seperti agar-agar, dihasilkan dari hasil remasan daun yang ditambahkan air secukupnya sebagai pelarut. Gel daun umumnya dapat dibentuk pada suhu kamar antara 25oC sampai 30oC. Nasution (1999) meneliti gel cincau hijau dan memperoleh hasil bahwa pada konsentrasi 5% b/v, akan memberikan sifat-sifat gel baik seperti kekuatan pecah, titik pecah dan kekakuan. Konsentrasi 4% b/v, gel yang dihasilkan bersifat sangat elastis dan memerlukan waktu yang lebih lama untuk membentuk gel. Sifat sangat elastis mengakibatkan gel sangat sulit untuk dipotong. Ekstrak daun dengan rasio daun lebih dari 5% b/v, menghasilkan buih yang banyak dan mengganggu kekompakan. Gel daun kacapiring merupakan salah satu hidrokoloid. Semua hidrokoloid mampu memberikan kekentalan terhadap suatu larutan, tetapi hanya sedikit jenis hidrokoloid yang mempunyai sifat mampu membentuk gel. Gel merupakan suatu sistem koloid, dimana cairan terdispersi dalam padatan (Untoro 1985). Hidrokoloid mempunyai nilai guna yang penting karena sifat fungsional yang dimiliki. Hidrokoloid merupakan polimer-polimer rantai panjang yang larut atau terdispersi di dalam air dan menyebabkan viskositas larutan menjadi tinggi. Sifat mengental dalam air ini merupakan alasan utama dari kegunaan hidrokoloid.
adalah suatu sistem koloid yang butir terdispersinya padat. Butir-butir ini peroleh dengan cara menghancurkan butir-butir yang lebih besar yang dikenal dengan dispersi mekanik. Butir-butir ini bersambung membentuk suatu jaringan yang agak kaku dan memerangkap cairan pelarut di dalamnya.
Karbohidrat pada daun adalah gum alam. Gum diperoleh dari hasil ekstraksi tanaman dan kerusakannya sering terjadi karena sineresis. Sineresis terjadi karena kekuatan dari luar, seperti pemotongan dan putusnya ikatan benang fibriler. Komponen pembentuk gel pada daun kacapiring diduga merupakan senyawa hidrokoloid yang memiliki mekanisme gelasi mirip dengan daun cincau sehingga sifat fungsional yang ingin diketahui mengacu pada penelitin tentang daun cincau. Artha (2001) mengisolasi dan mengarakterisasi sifat fungsional komponen pembentuk gel cincau hijau Cyclea barbata L. Miers. Hasil karakterisasi yang diperoleh adalah gel cincau terbaik berdasarkan kadar air dan berat gel diperoleh pada perlakuan penambahan FeSO4, sedangkan persentase tertinggi pada penambahan CaCl2. Isolat KPG dengan konsentrasi 1.5% b/v bersifat sensitif terhadap ion kalsium, pH dan suhu 90oC. Kekentalannya meningkat dengan meningkatnya konsentrasi hidrokoloid dan penyimpanan pada suhu beku selama 1 bulan. Oleh karena itu KPG daun cincau baik digunakan sebagai bahan pengental untuk produk yang mengandung kalsium, mempunyai pH rendah sekitar 4,0 dan mengalami proses termal maupun proses pembekukan dan kurang tepat diterapkan pada produk pangan yang dihidangkan dalam keadaan panas.
Serat Pangan (Dietary fibre)
Serat pangan adalah senyawa bioaktif non gizi yang disebut fitokimia. Senyawa tersebut secara bersamaan memberikan dampak penting pada beberapa mekanisme enzim dalam menangkal racun (detoksifikasi), stimulasi ketahanan tubuh, metabolisme kolesterol, pengikatan zat karsinogenik dalam usus, efek antibakteri dan antioksidan. Komponen serat yang tinggi ditemukan pada dinding sel tanaman. Komponen ini termasuk senyawa struktural seperti selulosa, pektin dan lignin (Muchtadi 2000).
berbagai sayuran dan buah. Secara umum serat pangan adalah kelompok polisakarida dan polimer-polimer lain yang tidak dapat dicerna oleh sistem sekresi normal dalam lambung dan usus kecil (Winarno 1997). Beberapa jenis komponen serat dapat dicerna (difermentasi) oleh mikroflora dalam usus besar menjadi produk-produk fermentasi. Muchtadi (2000) menyebutkan bahwa total dietary fibre (TDF) terdiri dari komponen soluble dietary fibre (SDF), dan insoluble dietary fibre (IDF).
Soluble dietary fibre (SDF) adalah serat pangan yang dapat larut pada air hangat atau panas serta dapat terendapkan oleh air yang telah dicampur dengan empat bagian etanol. Gum, pektin, dan sebagian hemiselulosa larut yang terdapat dalam dinding sel tanaman merupakan sumber SDF. Insoluble dietary fibre (IDF), merupakan serat pangan yang tidak larut dalam air panas atau dingin. Sumber IDF adalah selulosa, lignin, sebagian besar hemiselulosa, sebagian kecil kutin, lilin tanaman dan kadang-kadang senyawa pektat yang tidak dapat larut. IDF merupakan kelompok terbesar dari TDF dalam makanan, sedangkan SDF hanya menempati jumlah sepertiganya (Muchtadi 2000). Serat tidak larut ada tiga macam yaitu selulosa, hemiselulosa dan lignin. Serat tidak larut banyak terdapat pada sayur, buah dan kacang-kacangan. Sedangkan serat larut adalah pektin, musilase dan gum. Serat larut juga banyak terdapat pada buah, sayur dan sereal, sedangkan gum banyak terdapat pada akasia.
total memberikan karakteristik fungsional pada serat meliputi kemampuan daya ikat air, kapasitas untuk mengembang, meningkatkan densitas kamba, membentuk gel dengan viskositas yang berbeda-beda, mengadsorpsi minyak, pertukaran kation, serta memberikan warna dan flavor (Muchtadi 2000).
Serat pangan secara kimia dapat diklasifikasikan sebagai polisakarida dan non polisakarida. Serat pangan yang merupakan kelompok polisakarida adalah selulosa, hemiselulosa (arabinoksilan, galaktomanan dan glukomanan), substansi pektat, β-glukan, musilase, gum dan polisakarida alga, sedangkan serat pangan yang tergolong non-polisakarida adalah lignin (Muchtadi 2000).
Pengaruh fisiologi serat pangan adalah menghasilkan sejumlah reaksi biologis. Hal ini tergantung pada sifat fisik-kimia masing-masing sumber serat, meliputi peningkatan masa feses, penurunan kadar kolesterol darah dan penurunan respon glikemik. Serat mengikat air dan asam empedu sehingga menyebabkan feses menjadi lunak, mudah didorong keluar. Mekanisme ini mampu menurunkan kolesterol dan resiko kanker, karena waktu transit yang lama dan senyawa karsinogenik yang bermukim dalam tubuh menjadi pendek sehingga kesempatan untuk membahayakan tubuh menjadi semakin kecil (Golberg 1994).
Serat mempunyai kemampuan berinteraksi dengan komponen makanan lain pada saluran pencernaan dan enzim pencernaan. Dinding sel buah sayur mengandung selulosa, polisakarida pektik dan siloglukan sebagai komponen utama polisakarida. Biji sereal mengandung arabinosilan (1-3,1-4)-β-D-glukan, dengan jumlah selulosa yang bervariasi dan hanya sedikit polisakarida pektik (Muchtadi 2000).
Antioksidan
Antioksidan adalah zat yang mampu mencegah atau memperlambat terjadinya proses oksidasi. Antioksidan pada konsentrasi yang tinggi dapat bersifat sebaliknya yaitu menjadi prooksidan atau meningkatkan oksidasi (Schuler 1990). Menurut Halliwell et al. (1992) antioksidan adalah zat yang dalam konsentrasi kecil dapat mencegah atau memperlambat laju oksidasi radikal bebas.
dan quencher dari bentuk singlet oksigen. Senyawa-senyawa ini umumnya golongan fenol atau polifenol yang berasal dari tanaman. Antioksidan alami yang paling umum adalah flavonoid (flavanol, isoflavon, flavon, katekin, dan flavonon), turunan dari asam sinamat, kaumarin, tokoferol, dan asam organik polifungsional.
Menurut Langseth (2000) katekin dan epigalokatekin, merupakan komponen fenolik yang terdapat pada teh hijau dan teh hitam. Senyawa ini memiliki aktivitas antioksidan sehingga dapat mencegah beberapa penyakit degeneratif seperti kanker dan atherosklerosis atau jantung koroner. Kadar polifenol pada daun teh antara 20% sampai 30%, sedangkan secangkir seduhan teh mengandung sampai 40 mg flavonoid. Daun kacapiring juga mengandung komponen bioaktif yang mungkin disebabkan adanya komponen fenolik, dan kandungan klorofilnya sebagai co-faktor dalam meningkatkan kemampuannya menangkap radikal bebas (Rahmayanti & Sitanggang 2006). Menurut Larson (1988) diacu dalam Andarwulan (1995) menyatakan bahwa senyawa antioksidan alami digolongkan sebagai komponen fenolik, protein, komponen nitrogen, karotenoid, dan komponen lain seperti vitamin C, keton, dan glikosida, yang memiliki mekanisme mengikat radikal bebas.
Radikal bebas secara kontinyu dibentuk oleh tubuh. Tubuh memiliki sistem antioksidan yang dapat menangkal radikal bebas, baik melalui proses enzimatis maupun non enzimatis. Antioksidan dapat diartikan sebagai senyawa pemberi elektron yang diperlukan oleh radikal bebas dalam menstabilkan dirinya, dan dapat juga menghentikan pembentukan radikal bebas (Atmosukarto 2003).
Antioksidan pada tanaman tinggi telah diuji secara in vitro, mampu memberikan perlindungan dari kerusakan akibat oksidasi, menghambat serta mengikat radikal bebas dan oksigen yang reaktif. Singlet oksigen dengan kuat diikat oleh karoten terutama β-karoten. Komponen fenolik berperan sebagai antioksidan tergantung pada nilai redoks dari grup hidroksil, dengan mekanisme mereduksi, donor hidrogen dan mengikat oksigen (Hudson 1990).
Wijeratne et al. (2006) menyatakan bahwa beberapa antioksidan alami antara lain asam amino dan dipeptida, hidrolisat protein, protein larut air, phospholipids, garam inorganik, tokoferol dan turunannya, karotenoid, asam askorbat, enzim antioksidan, komponen fenolik bagian tanaman yang dapat/ tidak dapat dimakan. Antioksidan pada makanan mampu meningkatkan perlawanan oksidasi dari serangan singlet oksigen, menurunkan konsentrasi oksigen, mencegah rantai inisiasi pertama dengan mengikat radikal bebas, mengikat ion sebagai katalis, dekomposisi produk utama, dari oksidasi menjadi produk non radikal dan memecah rantai substansi untuk mencegah bersambungnya abstraksi hidrogen dari substrat. Antioksidan alami pada makanan akan habis saat proses. Antioksidan pada berbagai variasi diet makanan lebih efektif melawan oksidasi dari pada satu atau dua komponen.
Senyawa Fenol
Senyawa fenolik yang terkandung dalam pangan merupakan salah satu hasil metabolisme sekunder tanaman. Secara kimia, senyawa fenolik terdiri dari sebuah cincin aromatik yang terdiri dari satu atau lebih senyawa hidroksil, termasuk turunan fungsionalnya. Pada umumnya fenol bersifat polimerik dan tidak larut dalam lignin sehingga terdapat di seluruh vascular. Beberapa fenol pada makanan dapat larut dalam air atau perlarut organik.Umumnya kandungan senyawa fenol berbeda satu dengan yang lain. Senyawa fenolik dalam bahan pangan terdapat dalam bentuk asam fenolik, flavonoid, lignan, stillbene, coumarin dan tanin.
keberadaan senyawa fenolik tertentu. Namun senyawa fenolik dalam jumlah yang besar dapat bersifat sebagai antinutrisi, sehingga perlu pertimbangan yang baik sebelum dikonsumsi.
Senyawa fenolik memiliki efek yang penting pada stabilitas oksidasi dan keamanan mikrobiologi pangan, seperti aktivitas biologis yang berhubungan dengan efek penghambatan pada metagenesis dan pembentukan karsinogen. Beberapa tanaman seperti biji-bijian, minyak, legum, rempah-rempah dan teh telah lama dikenal mengandung senyawa fenolik yang memiliki aktivitas antioksidan. Aktivitas antoksidan senyawa fenolik dari sumber-sumber tanaman lainnya juga terus diteliti oleh para pakar, antara lain terhadap aktivitas antioksidan dan kandungan senyawa fenolik pada beberapa buah dan sayuran.
Senyawa fenol dalam bahan pangan menurut Harborne (1987), dikelompokkan menjadi tiga yaitu : (1) fenol sederhana dan asam fenolat (p-kresol, 3-etil fenol, 3,4-dimetil fenol, hidroksiquinon, vanillin, asam galat), (2) turunan asam hidroksi sinamat (p-kumarat, kafeat, asam ferulat dan asam klorogenat) dan (3) flavonoid (katekin, flavon, flavonol dan glikosida).
Senyawa fenol alami telah diketahui lebih dari seribu struktur. Flavonoid merupakan golongan terbesar. Flavonoid adalah senyawa alami hasil sintesis tanaman yang terdapat pada semua bagian tanaman seperti buah, daun, kayu dan kulit kayu (Pratt 1992). Flavonoid dapat membantu reaksi redoks terhadap fungsi vitamin C pada pembuluh darah, dan sebagai antioksidan yang aktivitasnya tergantung pada bentuk, dosis, sistem enzim atau deoksidasinya. Senyawa flavonoid dapat digolongkan menjadi 3, yaitu (1) senyawa yang dapat menangkap radikal oksigen (misalnya kaemferol, naringenin, apigenin dan naringin), (2) senyawa yang dapat menghilangkan pengaruh radikal oksigen (misalnya miricetin, delpinidin atau quercetin), (3) senyawa yang bersifat sebagai antioksidan atau prooksidan tergantung pada konsentrasinya (misalnya phoretin, sianin, katekin, dan morin), serta (4) senyawa yang bersifat inaktif (misalnya rutin dan phyloridin) (Pratt 1992).
potensial diprediksikan sebagai donor atom H+ dan donor elektron yang mempunyai kemampuan sebagai antioksidan. Lignan dan fenol lain mempunyai nilai BDE tinggi antara 85,1 sampai 88,0 kkal/mol. Nilai BDE tinggi memiliki potensi yang rendah dalam mengikat radikal. Franke et al. (2005) melakukan penelitian terhadap pemberian orange jus yang mengandung vitamin C, flavanon termasuk glikosida, karoten (xantophil dan criptoxantin) dan asam folat diperoleh rasio kolesterol low density lipoprotein (LDL) dan high density lipoprotein (HDL) menurun. Oleh karena itu orange jus merupakan sumber makanan yang baik untuk meningkatkan sirkulasi dan konsentrasi komponen hidrofilik sebagai fitokimia lipofilik. Potensi antioksidan senyawa fitokimia yang menguntungkan adalah flavonoid (hesperetin dan narigenin predominan sebagai glikosida), karotenoid (xantophyl, kriptoxantin, karoten) dan vitamin C (Asplund 2002).
Reddy et al. (2004) menyatakan bahwa antioksidan alami mampu mencegah autooksidasi dari lemak dan minyak. Ekstrak tanaman yang dicampurkan pada biskuit seperti amla (Emnlica officianalis), daun drumstick (Moringa oleife)r dan raisin (Vitis vinifera), merupakan antioksidan alami. Semua ekstrak mampu memberikan penghambatan. Persentase antioksidannya tinggi, dianalisis secara in vitro, menggunakan metode β-karoten bleaching, dengan standar antioksidan adalah buthylated hydroksi anisol (BHA). Penambahan ekstrak tanamam biji fenugreek dan rimpang jahe yang di freeze dryer efektif mengontrol oksidasi lemak selama penyimpanan dingin (Mansour & Khalil 2000).
Klorofil
golongan fenol terbesar dan merupakan kandungan khas tumbuhan hijau, yang selalu disertai karoten (Markhan 1988). Faktor-faktor yang mempengaruhi sifat fisik-kimia klorofil adalah asam, suhu, cahaya, oksigen dan enzim (Lopes-Ayera et al. 1992).
Ferruzzi et al. (2001) menyatakan bahwa studi mengenai absorpsi dan metabolisme klorofil belum banyak dilakukan. Sifat klorofil yang mudah terdegradasi oleh asam, panas, cahaya, oksigen menjadi salah satu kendala pada studi-studi absorpsi klorofil. Disebutkan pula, bahwa hanya dalam waktu setengah jam pada fase lambung (pH 2), lebih dari 95% klorofil a dan b berubah menjadi bentuk feofitin (kehilangan mineral Mg), selanjutnya feofitin dimetabolisme oleh mikroflora usus antara lain menjadi feoforbid.
Klorofil dapat diserap oleh usus dikemukakan oleh Ferruzzi et al. 2001, dalam penelitiannya menggunakan pure bayam yang dicerna secara in vitro (menggunakan enzim-enzim pencernaan), pada sel Caco-2 sebagai model sel manusia. Klorofil alami terdegradasi selama pencernaan. Turunan-turunan klorofil kemudian bergabung dengan misel lipid setelah diinkubasi dengan sel Caco-2. Turunan-turunan klorofil yang bersifat lipolitik terakumulasi dalam sel. Oleh karena itu diduga bahwa turunan klorofil dapat diserap secara in vivo. Egner et al. (2001) berhasil membuktikan bahwa adanya penyerapan turunan klorofil dalam darah. Mereka melakukan studi interfensi sodium chopper chlorophyll (SCC), terhadap banyak manusia. Hasil intervensi dengan dosis 100 mg, 3 kali sehari selama 4 bulan, diperoleh bahwa pada serum darah subyek ditemukan bentuk klorin (suatu turunan klorofil), dan serum darah subyek berwarna hijau. Hal ini belum pernah ditemukan sebelumnya dan penemuan ini menunjukkan adanya penyerapan in vivo turunan klorofil.
antioksidannya. Logam yang terkelat mengakibatkan lebih terkonsentrasinya densitas elektron di pusat cincin dan menjauhi kerangka porfirinnya, sehingga meningkatkan kemampuannya mendonorkan elektron dari sistem porfirin yang terkonjugasi. Klorofil yang kehilangan group fitilnya menampakkan peningkatan antioksidasi. Kedua pernyataan di atas menunjukkan bahwa kerangka klorin/porfirin dan keberadaan logam terkelat adalah dua hal yang penting untuk kapasitas antioksidan. Struktur klorofil dapat dilihat pada Gambar 2.
Mekanisme antioksidasi klorofil
Endo et al. (1985) diacu dalam Prangdimurti (2007) mengemukakan tentang mekanisme antioksidatif klorofil dan turunannya. Mereka membandingkan aksi antioksidan antara klorofil a dan turunannya yaitu feofitin a, protoporfirin dan Mg-protoporfirin. Keempat senyawa memperlihatkan kapasitas antioksidatif terhadap metil linoleat dalam kondisi gelap dengan parameter bilangan peroksida (PV) dan bilangan karbonil (CV). Klorofil dan Mg-protoporfirin memperlihatkan aktivitas antioksidatif yang lebih besar dibandingkan feofitin dan protoporfirin dalam hal menghambat pembentukan peroksida. Pengujian menggunakan senyawa pirol yaitu penyusun struktur porfirin, tidak menunjukkan aktivitas antioksidatif yang berarti. Hasil ini menunjukkan bahwa stuktur porfirin penting untuk aksi antioksidatif klorofil dan keberadaan Mg, meningkatkan aktivitas antioksidan klorofil. Penelusuran lebih lanjut mengenai pengaruh Mg menyimpulkan bahwa Mg akan memberikan pengaruh terhadap aktivitas
antioksidan klorofil jika dalam bentuk terkelat dalam struktur klorofil, bukan dalam bentuk ionik (sebagai MgCl2).
Endo et al. (1985) memperlihatkan kemampuan klorofil dan feofitin dalam mendegradasi hidroperoksida, yaitu dengan cara menginkubasikan dalam substrat metil linoleat hidroperoksida. Hasilnya menunjukkan bahwa kedua senyawa tersebut tidak memiliki kemampuan mendegradasi hidroperoksida dengan parameter bilangan peroksida dan bilangan karbonil. Kemampuan menangkap radikal bebas 2,2-diphenyl-1-picrylhydrazyl (DPPH), menunjukkan bahwa klorofil memiliki kemampuan menangkap (scavenger) radikal lipid yang dihasilkan selama proses autooksidasi minyak sehingga dapat memutuskan rantai oksidasi.
Besarnya aktivitas antioksidan klorofil dengan menggunakan metode DPPH dilaporkan oleh Kristopo et al. (2006) diacu dalam Prangdimurti (2007), menggunakan klorofil yang diisolasi dari selaput hijau kecambah kacang hijau. Dari hasil penelitian tersebut dilaporkan bahwa pada konsentrasi 5 x 10-5 M aktivitas antioksidan klorofil a sebesar 10,857 + 0,277% dan klorofil b sebesar 8,937+ 0,454%.
Klorofil tertanam pada membran tilakoid dan terikat dengan protein integral diantara lipid bilayer. Ekstraksi klorofil dipermudah dengan bantuan detergen seperti tween 80. Tween 80 termasuk detergen ionik. Tween 80 berfungsi menekan pembentukan feofitin pada ekstraksi klorofil, dibandingkan detergen anionik seperti sodium dodecyl sulfate (SDS). Sodium dodecyl sulfate meningkatkan muatan negatif pada permukaan membran kloroplas dan menghasilkan akumulasi ion H+ sehingga pembentukan feofitin meningkat (Vargas dal Lopez 2003, diacu dalam Prangdimurti 2007).
BAHAN DAN METODE
Waktudan Tempat Penelitian
Penelitian ini dilaksanaan selama 11 bulan, dari bulan September 2007 sampai bulan Juli 2008. Bertempat di laboratorium Institut Pertanian Bogor, meliputi: (1) Laboratorium Kimia Keamanan dan Mutu Pangan SEAFAST CENTER IPB, (2) Laboratorium Pengembangan Proses dan Produk Pangan SEAFAST CENTER IPB, (3) Laboratorium Kimia Pangan Departemen Ilmu dan Teknologi Pangan Fateta IPB.
Bahan dan Alat
Bahan baku yang digunakan pada penelitian ini adalah daun kacapiring yang diperoleh di wilayah Kampus IPB Darmaga Bogor. Pemetikan dilakukan sore hari yaitu pada pukul 17.00 dengan tujuan untuk mengurangi laju penguapan sehingga mendapatkan sifat fisik dan kimia daun yang baik. Pemetikan daun dilakukan secara acak pada daun yang tidak tua dan tidak muda, yaitu pada posisi nomor 3, 4 dan 5 dari pucuk daun. Daun yang sudah dipetik selanjutnya disortasi dan disimpan di lemari pendingin pada suhu antara 4 oC sampai 8oC sebelum dianalisis.
Alat-alat yang diperlukan seperti timbangan analitik, lemari pendingin, freeze dyer, pH meter, waterbath, viscometer, stopwatch, pemanas listrik, tanur, gas nitrogen, kertas kromatografi (Whatman no 1), oven, magnetik stirrer, mikroskop, termometer, Amicon reservoir ultrafiltrasi, dan membran filter. Sedangkan istrumen yang diperlukan seperti atomic absorption spectrophotometer (AAS) dan spektrofotometer.
(Merck), o-hidroksidifenil (Wako), natrium tetraborat (Merck), enzim karbohidrase kompleks V2010 (Novozyme), DPPH (2,2-diphenyl-1- picrylhydrazyl), Trolox®, Folin–Ciocalteu.
Metode Penelitian
Karakterisasi sifat fisik dan kimia daun dan gel daun kacapiring
Tahap awal penelitian dilakukan kajian sifat fungsional daun kacapiring, meliputi karakterisasi fisik dan kimia daun segar. Karakterisasi fisik daun segar dilakukan pengukuran terhadap dimensi daun (panjang dan lebar), menggunakan jangka sorong, identifikasi varietas tanaman serta analisis komponen kimia. Analisis kimia pada daun segar bertujuan untuk mengetahui komposisi kimia secara umum pada daun kacapiring yang mungkin berkaitan erat dengan komponen penyusun gel. Analisis kimia yang dilakukan meliputi pengukuran kadar air dan total fenol.
Daun segar disimpan dalam bentuk bubuk kering hasil pengeringan beku, yang diayak 30 mesh. Bubuk daun dianalisis kadar air, kadar abu, kadar serat pangan, kadar protein, kadar lemak, dan kadar mineral (Fe, Cu, Mg dan Ca).
Gambaran sifat fungsional gel daun kacapiring diperoleh dengan ekstraksi menggunakan air minum dalam kemasan (AMDK) dan air destilasi (aquades). Aquades dipilih sebagai larutan pengekstrak karena memberikan rendemen yang lebih baik daripada pelarut organik (Ananta 2000), terutama untuk tujuan analisis fisik maupun kimia, yang berkaitan erat dengan sifat fungsional yang dimiliki, sedangkan AMDK digunakan sebagai pelarut karena telah diaplikasikan oleh masyarakat (di Bali) untuk tujuan konsumsi. Rasio antara daun segar dan air adalah 1:5, 1:10, dan 1:15 b/v. Hal ini bertujuan untuk mendapatkan karakteristik hasil ekstraksi terbaik dengan kriteria gel yang dihasilkan tidak berbuih dan kompak.
Uji organoleptik (mutu hedonik), dilakukan terhadap atribut gel, seperti buih, aroma, warna, dan kekentalan. Uji hedonik (kesukaan) hanya dilakukan terhadap atribut penerimaan secara umum (Soekarto 1985). Panelis yang digunakan adalah panelis tidak terlatih, sebanyak 26 orang. Panelis diminta untuk menyatakan kesan terhadap atribut gel sesuai kriteria yang disajikan dengan skala 1-7. Masing-masing panelis mendapatkan 6 buah sampel sekaligus setiap satu kali pengujian, dengan nomor sampel yang berbeda-beda, sehingga semua sampel mendapat kesempatan yang sama untuk diuji. Kriteria penerimaan umum dinyatakan sebagai kesan kesukaan panelis terhadap sampel yang disajikan, dengan tidak membandingkan antara sampel yang satu dengan yang lainnya. Kriteria dan skala numerik untuk uji organoleptik dapat dilihat pada Lampiran 3.
Hasil uji organoleptik setelah dianalisis dengan uji stastistik, akan mendapatkan karakteristik subyektif gel terbaik. Gel dengan karakter subyektif terbaik diuji sifat fisik lainnya, seperti pH, viskositas dan sineresis, yang bertujuan untuk memperoleh gambaran sifat-sifat fisik gel terbaik yang disukai panelis dibandingkan dengan gel daun cincau.
Derajat keasaman (pH) gel ditentukan dengan mengukur pH gel segar dengan alat pH meter, sebanyak 25 g gel segar ditempatkan pada beker gelas. pH meter dikalibrasi sebelum digunakan dengan pH buffer 7 dan 4, selanjutnya dilakukan pengukuran pada sampel dengan melakukan 2 kali ulangan pembacaan.
Kekentalan (viskositas) gel diukur dengan viskometer Brookfield, sebanyak 500 ml gel segar ditempatkan pada beker gelas (2 kali ulangan). Spindel dipilih sesuai dengan kekentalan gel. Nilai kekentalan diperoleh dengan rumus dial faktor (faktor pembacaan) x kecepatan putar spindel (cP = sentipoise/ mili Paskal detik). Sineresis pada gel diukur dengan menempatkan gel pada suhu ruang dan suhu rendah, yaitu dengan menghitung perubahan berat gel setiap 1 jam selama 5 jam. Gel terbaik dicetak pada tabung silinder (panjang 4 cm dan diameter 1,9 cm). Gel yang sudah dicetak disimpan pada suhu ruang (25oC) dan suhu rendah (8oC). Besarnya kehilangan berat gel menunjukkan semakin cepat terjadi sineresis.
serta mengetahui komposisi zat gizi dan non gizi yang dikandungnya. Analisis kimia yang dilakukan pada gel terbaik, meliputi analisis kadar air, kadar mineral (Fe, Cu, Mg dan Ca), kadar serat pangan, serta melakukan analisis kadar substansi pektat yang menunjukkan persentase asam galakturonat dengan metode spektrofotometri.
Isolasi, Fraksinasi dan Identifikasi Komponen Pembentuk Gel
Isolasi komponen pembentuk gel (KPG) dilakukan dengan mengikuti prosedur Farida (2002) yang dimodifikasi, yaitu menambahkan larutan EDTA 0,028 M pada gel terbaik, kemudian dipanaskan 90oC selama 15 menit sampai terbentuk endapan. Penambahan senyawa EDTA bertujuan untuk mengikat logam-logam pada gel, sehingga komponen gel dalam keadaan bebas dan terlarut. Gel yang telah dipanaskan disaring dengan kain saring untuk memisahkan endapan/residu dan diperoleh filtrat. Filtrat yang mengandung KPG diasamkan dengan HCl 0,1 N sampai pH 3 dan penambahan etanol 96% sebanyak 1:1,5, sehingga diperoleh gumpalan isolat KPG. Isolat yang diperoleh dikeringbekukan dan digiling sampai menjadi bubuk isolat KPG, selanjutnya dilakukan penimbangan untuk mengetahui rendemen dengan perhitungan :
KPG %bb = (berat KPG setelah kering beku / berat gel segar) x 100
Residu hasil isolasi KPG yang berwarna hijau diamati morfologinya di bawah mikroskop. Pengamatan ini bertujuan untuk mengetahui morfologi kloroplas pada endapan hasil pemanasan dan penambahan larutan EDTA serta membandingkan dengan gel segar. Sampel (residu endapan hasil isolasi KPG) ditempatkan pada gelas objek, selanjutnya ditutup dengan cover glass. Objek gelas ditempatkan pada mikroskop dan dilakukan pengamatan sampai pembesaran tertentu untuk memperoleh profil objek yang jelas.
Fraksinasi komponen pembentuk gel (Artha 2001).
stirer pelan-pelan sampai diperoleh cairan pekat. Sisa larutan isolat KPG difiltrasi bertahap, mulai dari 20 ml, 10 ml dan 20 ml, sehingga total sampel berjumlah 100 ml. Larutan difraksinasi dengan membran filter 5 μm. Fraksi tertahan ditampung, dikeringkan dan ditimbang sampai diperoleh berat konstan. Fraksi yang lolos difiltrasi kembali dengan membran filter 3 μm, 1,2 μm, dan 0,6 μm.
Data berat molekul KPG ditentukan dengan melakukan perkiraan berat molekul dengan asumsi bahwa: 1) F5: fraksi tertahan (tidak lolos) membran 5 μm (MWCO 1000-2000 kDa), 2) F3: fraksi yang lolos membran 5 μm dan tertahan pada membran 3 μm (MWCO 300 kDa), 3). F1,2: fraksi yang lolos membran 3 μm dan tertahan pada membran 1,2 μm (MWCO 100 kDa), dan F0,6 : fraksi yang lolos membran 1,2 μm dan tertahan pada membran 0,6 μm (MWCO 10 kDa).
Identifikasi monomer KPG dilakukan secara kualitatif dengan uji Fehling dan kromatografi kertas menggunakan standar glukosa, asam galakturonat, laktosa, rafinosa, fruktosa dan galaktosa dengan larutan indikator warna yang terdiri dari campuran anilin, difenilamin dan asam fosfat.
Analisis komponen bioaktif
Analisis komponen bioaktif dilakukan terhadap bubuk daun dan bubuk gel, bertujuan untuk memperoleh data tentang potensi daun dan gel yang berperan sebagai antioksidan dalam basis kering. Data yang diperoleh dikonversi ke dalam daun dan gel segar. Analisis komponen bioaktif meliputi analisis kadar total klorofil dengan spektrofotometer dan analisis kualitatif fraksi ekstrak aseton senyawa-senyawa turunan klorofil dengan kromatografi lapis tipis menggunakan plat selulosa, analisis kadar total fenol, dan kapasitas antioksidan dengan spektrofotometer.
Informasi zat gizi dan non gizi daun dan gel segar
Prosedur Analisis
Metode-metode pengamatan yang digunakan dalam pengumpulan data meliputi :
Kadar air metode oven (AOAC 1998)
Sampel ditimbang 3,0 g, dimasukkan ke dalam cawan porselin, selanjutnya dikeringkan dalam oven pada suhu 105oC hingga berat konstan.
Kadar air (% bb) = (kehilangan berat sampel/ berat sampel) x 100
Kadar abu metode gravimetri (AOAC 1998)
Sampel ditimbang 3,0 g dalam cawan pengabuan, sampel diarangkan sampai tidak berasap. Sampel yang sudah menjadi arang dimasukkan pada tanur suhu 600oC. Sampel yang sudah menjadi abu didinginkan dalam eksikator dan ditimbang.
Kadar abu(% bb)= (berat abu/ berat sampel) x 100
Kadar protein metode mikroKjeldahl (AOAC 1998)
Sampel ditimbang sebanyak 0,1 g, ditempatkan pada labu Kjeldahl, ditambahkan 1 gram katalisator (tablet Kjeldahl) dan 5 ml H2SO4 pekat. Campuran didestruksi sampai cairan tampak jernih, selanjutnya dilakukan penambahan aquades, indikator pp, antibuih dan NaOH 50 %. Hasil destruksi kemudian didestilasi, penampung destilat adalah 50 ml HCl 0,1 N dan indikator pp 3 tetes. Hasil destilasi ditampung hingga volume 100 ml. Destilat dititrasi dengan NaOH 0,2 N sampai larutan berubah warna. Volume titrasi dicatat dan blanko dibuat dengan menggunakan aquades sebagai sampel.
Protein (%bb) = volume titrasi (blanko-sampel) x N.NaOH x 14.008 x 6,25 x 100 berat sampel (g) x 1000
Kadar lemak metode ekstraksi Soxhlet (AOAC 1998)
menggunakan pelarut heksan selama 6 jam. Labu lemak hasil ekstraksi di oven dan ditimbang sampai tercapai berat konstan.
Lemak (%bb) = (berat lemak/ berat sampel) x 100
Analisis kadar serat pangan dengan metode enzimatis. Metode fraksinasi cepat enzimatik yang dikembangkan oleh Asp. et al. (1983) yang dimodifikasi.
Persiapan Sampel
Sampel diukur kadar airnya (kadar air I), kemudian di oven kembali untuk mengukur kadar air ke-2. Sebanyak 1,0 gram sampel dimasukkan ke dalam erlenmeyer, ditambahkan 25 ml buffer natrium fosfat dan dibuat menjadi suspensi. Kemudian ditambah 100 µl enzim termamyl, ditutup dan diinkubasi pada suhu 80oC + 15 menit dengan inkubasi bergoyang, selanjutnya diangkat dan didinginkan serta dilakukan pengaturan pH menjadi 1,5 dengan menambahkan HCl 4 N. Sampel selanjutnya ditambahkan enzim pepsin (0,1 mg/20 ml), diinkubasi pada suhu 37oC, sambil diagitasi +120 menit.
Pengaturan pH dilakukan hingga tercapai pH 6,8 dengan menambahkan NaOH 4N, kemudian ditambahkan enzim pankreatin (0,1 mg/20 ml), ditutup dan diinkubasi pada suhu 37oC selama 120 menit sambil diagitasi. pH diatur sampai 4,5 dengan menambahkan HCl 4N, selanjutnya disaring menggunakan kertas saring Whatman no 40 yang telah dikeringkan dan diperoleh berat konstan. Penyaringan dilakukan dengan pompa vakum dan pembilasan menggunakan air destilat sebanyak 2 x 10 ml, sehingga diperoleh residu dan filtrat.
Penentuan serat pangan tidak larut (Insoluble Dietary Fibre)