perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
i
KAJIAN PENGGUNAAN BERBAGAI KONSENTRASI BA DAN NAA TERHADAP PEMBENTUKAN TUNAS JARAK PAGAR
(Jatropha curcas L.) PADA KULTUR IN VITRO
Skripsi
Untuk memenuhi sebagian persyaratan guna memperoleh derajat Sarjana Pertanian di Fakultas Pertanian
Universitas Sebelas Maret
Jurusan/ Program Studi Agronomi
Disusun oleh :
CITRA OKTAVIANA YUSWINDASARI H 0106044
FAKULTAS PERTANIAN UNIVERSITAS SEBELAS MARET
commit to user
ii
HALAMAN PENGESAHAN
KAJIAN PENGGUNAAN BERBAGAI KONSENTRASI BA DAN NAA TERHADAP PEMBENTUKAN TUNAS JARAK PAGAR
(Jatropha curcas L.) PADA KULTUR IN VITRO
yang dipersiapkan dan disusun oleh CITRA OKTAVIANA YUSWINDASARI
H 0106044
telah dipertahankan di depan Dewan Penguji Pada tanggal 15 Oktober 2010
dan dinyatakan telah memenuhi syarat
Susunan Tim Penguji
Ketua Anggota I Anggota II
Prof. Dr. Ir. Ahmad Yunus, MS. NIP. 196107171986011001
Dr. Samanhudi, SP., MSi. NIP. 196806101995031003
Ir. Maidatun Kamilah H, MP. NIP. 196807221997022001
Surakarta, Oktober 2010 Universitas Sebelas Maret Surakarta
Fakultas Pertanian Dekan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
iii
KATA PENGANTAR
Segala puji bagi Allah SWT atas segala limpahan rahmat-Nya kepada penulis sehingga penyusunan skripsi dengan judul “Kajian Penggunaan
Berbagai Konsentrasi BA dan NAA terhadap Pembentukan Tunas Jarak Pagar (Jatropha curcas L.) pada Kultur In Vitro” dapat diselesaikan dengan baik tanpa halangan yang berarti.
Penulis menyadari bahwa dalam penyelesaian skripsi ini tidaklah lepas dari dukungan berbagai pihak, oleh karena itu penulis menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Prof. Dr. Ir. Suntoro, MS selaku Dekan Fakultas Pertanian Universitas Sebelas Maret Surakarta.
2. Ir. Wartoyo SP., MS selaku Ketua Jurusan Program Studi Agronomi FP UNS 3. Prof. Dr. Ir. Ahmad Yunus, MS. dan Dr. Samanhudi, SP., MSi. selaku
Pembimbing Utama dan Pendamping Skripsi atas segala bimbingan, ilmu serta pengarahan.
4. Ir. Maidatun Kamilah H, MP selaku Pembahas Skripsi yang telah memberikan saran dan masukan dalam penulisan skripsi ini.
5. Ir. Warsoko W. selaku Pembimbing Akademik
6. Keluargaku tersayang: Bapak, Ibu, dek Dhini, mas Ardian yang selalu mendukung dan mendoakan penulis sehingga penulis bisa menyelesaikan skripsi ini.
7. Rekan-rekan sesama penelitian kultur jaringan, teman-teman IMAGO 06 dan semua pihak yang telah membantu demi kelancaran penelitian dan penulisan
skripsi ini yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna.
Penulis mengharapkan kritik dan saran yang membangun. Demikian, semoga skripsi ini bermanfaat bagi penulis khususnya dan pembaca pada umumnya.
commit to user
iv DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
RINGKASAN ... ix
SUMMARY ... x
I. PENDAHULUAN... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 3
C. Tujuan Penelitian ... 4
D. Hipotesis... 4
II. TINJAUAN PUSTAKA ... 5
A. Jarak Pagar (Jatropha curcas L.) ... 5
B. Kultur Jaringan ... 7
C. Zat Pengatur Tumbuh ... 8
III.METODE PENELITIAN ... 10
A. Waktu dan Tempat Penelitian ... 10
B. Bahan dan Alat Penelitian ... 10
1. Bahan Penelitian ... 10
2. Alat Penelitian ... 10
C. Cara Kerja Penelitian ... 11
1. Rancangan Penelitian ... 11
2. Pelaksanaan Penelitian ... 11
3. Variabel Pengamatan ... 13
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
v
IV.HASIL DAN PEMBAHASAN ... 16
A. Kalus ... 16
1. Saat Muncul Kalus ... 16
2. Warna Kalus ... 18
3. Tekstur Kalus ... 19
4. Berat Segar Kalus... 21
B. Tunas ... 23
1. Saat Muncul Tunas... 23
2. Jumlah Tunas ... 25
C. Daun ... 27
1. Saat Muncul Daun ... 27
2. Jumlah Daun ... 28
D. Akar ... 31
1. Saat Muncul Akar ... 31
2. Jumlah Akar ... 32
V. KESIMPULAN DAN SARAN ... 35
A. Kesimpulan ... 35
B. Saran ... 35
DAFTAR PUSTAKA ... 36
commit to user
vi
DAFTAR TABEL
Nomor Judul Halaman
1. Pengaruh konsentrasi BA dan NAA terhadap warna kalus ... 18
2. Pengaruh konsentrasi BA dan NAA terhadap tekstur kalus ... 20
3. Pengaruh NAA terhadap purata berat segar kalus ... 23
4. Pengaruh NAA terhadap purata jumlah daun ... 30
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
vii
DAFTAR GAMBAR
Nomor Judul Halaman 1. Pengaruh konsentrasi BA dan NAA terhadap saat muncul kalus
(HST) ... 16
2. (a) Kalus jarak pagar berwarna hijau kekuningan (Skor 2) ... 18
(b) Kalus jarak pagar berwarna hijau kecoklatan (Skor 4) ... 18
3. Kalus yang terbentuk pada eksplan jarak pagar ... 21
4. Pengaruh konsentrasi BA dan NAA terhadap berat segar kalus ... 22
5. Pengaruh konsentrasi BA dan NAA terhadap saat muncul tunas (HST) ... 24
6. Pengaruh konsentrasi BA dan NAA terhadap jumlah tunas ... 26
7. Pengaruh konsentrasi BA dan NAA terhadap saat muncul daun (HST) ... 28
8. Pengaruh konsentrasi BA dan NAA terhadap jumlah daun ... 29
9. Pengaruh konsentrasi BA dan NAA terhadap saat muncul akar (HST) ... 31
10. Akar yang terbentuk pada eksplan ... 32
commit to user
viii
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Hasil pengamatan saat muncul kalus (HST) ... 42
2. Hasil pengamatan warna kalus ... 42
3. Hasil pengamatan tekstur kalus ... 43
4. Hasil pengamatan berat segar kalus ... 43
5. Hasil pengamatan saat muncul tunas (HST) ... 44
6. Hasil pengamatan jumlah tunas ... 44
7. Hasil pengamatan saat muncul daun (HST) ... 45
8. Hasil pengamatan jumlah daun ... 45
9. Hasil pengamatan saat muncul akar (HST)... 46
10. Hasil pengamatan jumlah akar ... 46
11. Analisis ragam berat segar kalus (transformasi ) ... 47
12. Analisis ragam jumlah daun (transformasi ) ... 47
13. Analisis ragam jumlah akar (transformasi ) ... 47
14. Komposisi media Murashige dan Skoog ... 48
15. Cara menentukan konsentrasi BA dan NAA ... 49
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
1
I. PENDAHULUAN
A. Latar Belakang
Krisis energi yang terjadi terutama dari bahan bakar fosil yang bersifat
non renewable disebabkan semakin menipisnya cadangan minyak bumi.
Untuk mengatasi hal tersebut, pemerintah dan masyarakat perlu mengupayakan diversifikasi energi atau mencari alternatif lain dan segera mensosialisasikan kampanye hemat energi guna mengurangi ketergantungan kepada bahan bakar fosil. Salah satu program diversifikasi adalah mengembangkan bahan bakar nabati (biofuel), meliputi biodiesel, bioetanol dan biooil. Biodiesel sebagai subtitusi minyak solar, bioetanol sebagai substitusi premium dan biooil sebagai substitusi minyak tanah atau minyak bakar (Anwar et al., 2010).
Beberapa tanaman yang berpotensi sebagai bahan bakar nabati antara
lain kelapa sawit, jagung, singkong, tebu dan lain sebagainya yang merupakan minyak pangan (edible oil), sehingga penggunaanya akan bersaing dengan kebutuhan konsumsi. Salah satu tanaman yang termasuk non
edible oil adalah jarak pagar. Minyak jarak pagar atau biasa disebut curcas
biodiesel merupakan sumber minyak terbarukan (reneweble fuels) sehingga
berpotensi sebagai sumber bahan bakar alternatif pengganti bahan bakar minyak (BBM) di Indonesia.
commit to user
Semakin meningkatnya permintaan dan kebutuhan akan bahan tanaman jarak pagar, maka perlu dilakukan upaya perbanyakan tanaman dalam jumlah besar dan dalam waktu yang singkat. Penyediaan bibit unggul merupakan salah satu faktor pendukung keberhasilan pengembangan jarak pagar. Perbanyakan tanaman secara konvensional masih dibatasi oleh kemampuan tanaman untuk menghasilkan bibit baru dalam jumlah banyak, seragam dan dalam waktu singkat. Sampai saat ini bibit jarak pagar diproduksi dengan dua cara, yaitu dengan menggunakan biji dan stek. Penggunaan biji untuk perbanyakan tanaman dalam jumlah banyak akan mengurangi jumlah biji yang dapat diolah menjadi minyak. Teknik perbanyakan melalui stek menghasilkan tanaman dengan jumlah terbatas, membutuhkan pohon induk yang cukup banyak sementara pohon induk yang tersedia sangat terbatas selain itu dikhawatirkan akan merusak tanaman induk (Lizawati et al., 2009).
Untuk mengatasi masalah tersebut dapat ditempuh melalui teknik kultur jaringan. Kultur jaringan tanaman merupakan teknik menumbuh-kembangkan bagian tanaman, baik berupa sel, jaringan atau organ dalam kondisi aseptik secara in vitro. Teknik ini dicirikan oleh kondisi aseptik, penggunaan media kultur buatan dengan kandungan nutrisi lengkap dan ZPT (zat pengatur tumbuh), serta kondisi ruang kultur yang suhu dan pencahayaannya terkontrol (Yusnita, 2004).
Perbanyakan tanaman melalui teknik kultur jaringan menawarkan peluang besar untuk menghasilkan jumlah bibit tanaman yang banyak dalam waktu relatif singkat sehingga ekonomis. Teknik perbanyakan ini dapat dilakukan sepanjang tahun tanpa bergantung musim. Selain itu perbanyakan dengan teknik in vitro mampu mengatasi kebutuhan bibit dalam jumlah besar, serentak, dan bebas penyakit sehingga bibit yang dihasilkan lebih sehat dan seragam.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
3
mengarahkan pertumbuhan melalui zat pengatur tumbuh, (2) Eksplan yaitu bagian kecil jaringan atau organ yang dipisahkan dari tanaman induk kemudian dikulturkan. Keberhasilan pertumbuhan eksplan tergantung pada ukuran, umur fisiologis, serta genotipe eksplan, (3) Zat Pengatur Tumbuh (ZPT) yang berfungsi untuk menstimulasi pertumbuhan, misalnya pertumbuhan kalus, akar, dan tunas, dan (4) Lingkungan meliputi cahaya, suhu, kelembaban, pH dan wadah untuk kultur (Puslitbangbun, 2007).
Zat pengatur tumbuh (ZPT) adalah senyawa organik yang dalam jumlah sedikit dapat merangsang, menghambat, dan mengubah proses fisiologi tumbuhan. Auksin dan sitokinin adalah zat pengatur tumbuh yang sering ditambahkan dalam media tanam karena mempengaruhi pertumbuhan dan organogenesis dalam kultur jaringan dan organ. Penambahan sitokinin pada media kultur jaringan akan merangsang pembelahan sel, sedangkan auksin berperan dalam pembesaran sel, sehingga interaksi keduanya dapat
meningkatkan pertumbuhan dan ukuran sel. ZPT yang digunakan dalam penelitian ini adalah BA (Benzyladenin) dari golongan sitokinin dan NAA
(Naphthaleneacetic Acid ) dari golongan auksin.
B. Perumusan Masalah
Kultur jaringan merupakan salah satu alternatif pemecahan masalah untuk mendapatkan bibit jarak pagar dalam jumlah banyak dalam waktu yang singkat. Salah satu faktor yang mendukung keberhasilan perbanyakan jarak pagar melalui kultur jaringan adalah ZPT.
commit to user C. Tujuan Penelitian
Mendapatkan konsentrasi BA dan NAA yang tepat terhadap pertumbuhan tunas eksplan jarak pagar secara in vitro.
D. Hipotesis
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
5
II. TINJAUAN PUSTAKA
A. Jarak Pagar (Jatropha curcas L.)
Tanaman jarak pagar termasuk famili Euphorbiaceae, satu famili dengan karet dan ubi kayu. Klasifikasi tanaman jarak pagar adalah sebagai berikut:
Divisio : Spermatophyta Subdivisio : Angiospermae Klasis : Dicotyledoneae
Ordo : Euphorbiales
Familia : Euphorbiaceae
Genus : Jatropha
Spesies : Jatropha curcas L. (Hambali et al., 2006).
Jarak pagar mempunyai habitus perdu. Tanaman perdu adalah tumbuhan berkayu yang tetap rendah, umumnya memiliki tinggi 3-4 meter. Perdu menghasilkan percabangan banyak dari pangkal atau dasar tanaman. Habitus perdu pada tanaman jarak pagar memberikan keuntungan pada kegiatan budidaya tanaman dibandingkan habitus pohon karena proses pemanenan buah jarak pagar lebih mudah dilakukan pada habitus perdu (Saparni, 2008).
commit to user
Buah jarak pagar termasuk buah sejati tunggal yang kering. Bentuk buah jarak pagar ovoid, ujung buah cenderung runcing sedangkan pangkal buah cenderung membulat. Biji jarak pagar berbentuk ellipsoid (bulat telur), hal ini diduga berkaitan dengan bentuk buah yang juga berbentuk bulat telur (ovatus) (Nugroho, 2008). Buah jarak pagar biasa disebut kapsul. Kapsul dipanen setelah masak untuk mendapatkan kadar minyak yang optimal. Penentuan tingkat kemasakan dilihat dari penampakan warna kulit. Kapsul masak ditandai dengan perubahan warna kulit dari hijau menjadi kuning (Saparni, 2008).
Minyak jarak pagar atau biasa disebut curcas biodiesel tidak bersifat toksik, kadar sulfur rendah atau bahkan tidak ada, volatilitas rendah dan memiliki kandungan oksigen lebih tinggi sehingga lebih menjamin proses pembakaran yang sempurna, daya pelumasnya tinggi sehingga meningkatkan efisiensi fungsi mesin. Selain itu emisinya bersih sehingga berpeluang
mengurangi polusi udara berupa karbon monoksida, hidrokarbon, dan racun-racun lainnya (Prana, 2006).
Secara agronomis tanaman ini dapat tumbuh dengan baik pada berbagai kondisi lahan bahkan pada lahan marginal sekalipun. Tanaman ini tidak membutuhkan perawatan dan pengolahan lahan yang terlalu intensif sehingga dapat mengurangi biaya produksi. Selain itu tanaman ini juga dapat bermanfaat untuk reklamasi lahan-lahan kritis (Barlanti, 2007). Tanaman dapat digunakan untuk mencegah erosi tanah, untuk mengembalikan (reclaim) tanah, sebagai pagar hidup, dan juga ditanam sebagai tanaman komersial (Heller, 1996).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
7
risiko infeksi oleh mikroba dan hama, mengurangi erosi genetik, kebutuhan ruang dan beban biaya tenaga kerja (Wei et al., 2004).
B. Kultur Jaringan
Kultur jaringan tanaman adalah suatu upaya mengisolasi bagian-bagian tanaman (protoplas, sel, jaringan, dan organ), kemudian mengkulturkannya pada nutrisi buatan yang steril dibawah kondisi lingkungan yang terkendali sehingga bagian-bagian tanaman tersebut dapat beregenerasi menjadi tanaman lengkap kembali (Zulkarnain, 2009).
Kultur jaringan akan lebih besar persentase keberhasilannya bila menggunakan jaringan meristem. Jaringan meristem adalah jaringan muda, yaitu jaringan yang terdiri dari sel-sel yang selalu membelah, dindingnya tipis belum mempunyai penebalan dari zat pektin, plasmanya penuh dan vakuolanya kecil-kecil (Hendaryono dan Wijayani, 1994).
Bagian tanaman yang akan dikulturkan disebut eksplan. Eksplan bisa berupa mata tunas, anthera, batang, daun dan akar yang masih muda dan terdiri dari sel-sel meristematis, yang mana sel-selnya masih aktif membelah-belah dan apabila dikulturkan pada media yang sesuai secara in vitro, maka eksplan tersebut akan tumbuh dan berkembang biak menjadi banyak (Nugroho dan Sugito, 2004).
Salah satu bagian jaringan meristem pada tanaman terdapat pada bagian tunas. Eksplan berupa tunas pucuk merupakan eksplan yang paling tinggi persentasenya menghasilkan planlet, terutama jika ditumbuhkan pada media tanpa auksin (Irawati, 2000).
Media yang tepat untuk digunakan dalam kultur jaringan belum dapat dipastikan karena masih ada faktor-faktor yang berpengaruh, seperti jenis tanaman yang dikulturkan, umur tanaman induk, umur eksplan, jenis eksplan yang digunakan, kebutuhan zat pengatur tumbuh, dan proses yang dilakukan dalam kultur jaringan (Wetherell, 1982).
commit to user
yang layak untuk memenuhi kebutuhan banyak sel tanaman dalam kultur (Wetter dan Constabel, 1991).
Dibandingkan dengan perbanyakan tanaman secara konvensional, perbanyakan tanaman secara kultur jaringan mempunyai beberapa kelebihan sebagai berikut:
1. Untuk memperbanyak tanaman tertentu yang sulit atau sangat lambat diperbanyak secara konvensional.
2. Perbanyakan tanaman secara kultur jaringan tidak memerlukan tempat yang luas.
3. Teknik perbanyakan secara kultur jaringan dapat dilakukan sepanjang tahun tanpa bergantung pada musim.
4. Bibit yang dihasilkan lebih sehat.
5. Memungkinkan dilakukannya manipulasi genetik. (Yusnita, 2004).
C. Zat Pengatur Tumbuh
Zat pengatur tumbuh pada tanaman adalah senyawa organik yang bukan hara yang dalam jumlah sedikit dapat mendukung (promote), menghambat dan merubah proses fisiologi tumbuhan (Abidin, 1995).
Zat pengatur tumbuh golongan auksin dan sitokinin dalam keseimbangannya merupakan keberhasilan penerapan teknik kultur jaringan. Sitokinin sebagai senyawa organik yang dikombinasikan dengan auksin akan mendorong pembelahan sel dan menentukan arah diferensiasi sel tanaman, jika konsentrasi auksin dalam jaringan tanaman tinggi maka kemungkinan akan terbentuk kalus dan akar, bila konsentrasi sitokinin tinggi maka kemungkinan akan terbentuk tunas (Wattimena, 1988).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
9
mencukupi untuk pertumbuhan jaringan eksplan. Auksin mempunyai peranan terhadap pertumbuhan sel, dominasi apikal dan pembentukan kalus. Kisaran konsentrasi auksin yang biasa digunakan adalah 0,01 – 10 ppm.
NAA merupakan golongan auksin sintetis yang mempunyai sifat lebih stabil daripada IAA, karena tidak mudah terurai oleh enzim-enzim yang dikeluarkan oleh sel atau oleh pemanasan pada proses sterilisasi, tetapi NAA mempunyai sifat yang tidak baik karena mempunyai kisaran kepekatan yang sempit. Batas kepekatan yang meracun dari zat ini sangat mendekati kepekatan optimum untuk perakaran. Dengan demikian perlu kewaspadaan dengan pemakaiannya agar kepekatan optimum ini tidak terlampaui (Hendaryono dan Wijayani, 1994).
Zat pengatur tumbuh NAA dapat berperan sebagai perangsang terbentuknya enzim-enzim yang aktif dalam pembelahan sel. Tanpa pemberian NAA, walaupun telah diberikan sitokinin, eksplan yang ditumbuhkan secara
in vitro belum mampu berakar, sedangkan pada media MS dengan adanya penambahan NAA dapat merangsang pertumbuhan akar (Simatupang, 1991).
Penggunaan sitokinin mempunyai peranan penting jika bersamaan dengan auksin yaitu merangsang pembelahan sel dalam jaringan yang dibuat eksplan serta merangsang pertumbuhan tunas dan daun (Wetherell, 1982).
commit to user
10
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juli sampai Agustus 2010 bertempat di Laboratorium Fisiologi Tumbuhan dan Bioteknologi Fakultas Pertanian Universitas Sebelas Maret Surakarta.
B. Bahan dan Alat Penelitian 1. Bahan Penelitian
a. Eksplan jarak pagar (Jatropha curcas L.) berupa pucuk tanaman (berasal dari biji yang dikecambahkan secara steril)
b. Media MS (Murashige & Skoog)
c. ZPT BA (Benzyladenin) dan NAA (Naphthaleneacetic Acid) d. Alkohol
e. Clorox (sunclin) f. Sabun cuci 2. Alat Penelitian
a. Laminar Air Flow Cabinet
(LAFC)
b. Autoclave
c. Magnetic stirrer
d. Petridish e. Labu takar f. Beker glass g. Pipet
h. Timbangan analitik i. Botol-botol kultur j. Rak kultur
k. Plastik pp 0,3 mm l. Pinset besar dan kecil, m.Aluminium foil
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
11
C. Cara Kerja Penelitian 1. Rancangan Penelitian
Penelitian ini menggunakan rancangan lingkungan berupa Rancangan Acak Lengkap (RAL) yang disusun secara faktorial terdiri atas dua faktor perlakuan sebagai berikut:
a. Faktor pertama yaitu konsentrasi BA: B1 : Perlakuan tanpa penambahan BA
B2 : Perlakuan dengan penambahan BA 0,5 ppm B3 : Perlakuan dengan penambahan BA 1 ppm B4 : Perlakuan dengan penambahan BA 1,5 ppm b. Faktor kedua yaitu konsentrasi NAA:
N1 : Perlakuan tanpa penambahan NAA
N2 : Perlakuan dengan penambahan NAA 0,5 ppm N3 : Perlakuan dengan penambahan NAA 1 ppm
N4 : Perlakuan dengan penambahan NAA 1,5 ppm Sehingga diperoleh 16 kombinasi perlakuan, yaitu :
Kemudian masing-masing kombinasi perlakuan diulang tiga kali. 2. Pelaksanaan Penelitian
a. Pembuatan larutan stok
Pembuatan larutan stok dengan cara menimbang bahan-bahan kimia hara makro, mikro dan vitamin sesuai komposisi media MS (Lampiran 14) yang telah dikalikan menjadi beberapa kali konsentrasi, misalnya untuk unsur hara makro dikalikan 10 dan unsur hara mikro dikalikan 100 kali konsentrasi. Kemudian melarutkan bahan-bahan kimia tersebut ke dalam aquadest. Larutan tersebut diaduk sampai
commit to user
homogen dengan magnetic stirrer, lalu dimasukkan dalam botol yang diberi label dan disimpan dalam refrigerator.
b. Penyiapan media
Media yang digunakan adalah media MS. Dalam setiap pembuatan media, dibuat ¼ liter (250 ml), untuk 10 botol kultur. Pembuatannya dengan cara mencampurkan larutan stok, BA dan NAA sesuai dengan konsentrasi yang diinginkan (Lampiran 15) serta gula 7,5 g kemudian dilarutkan dengan aquades sampai 250 ml. Larutan dikondisikan pada pH 6,3 dengan menambahkan NaOH untuk menaikkan pH dan HCl untuk menurunkan pH. Larutan ditambah agar-agar 2 g, kemudian diaduk dengan magnetic stirrer dan dipanaskan
hingga mendidih. Larutan dituangkan ke dalam botol kultur ±25 ml/botol, kemudian ditutup dengan plastik PP 0,3 mm dan diikat
dengan karet. Media dimasukkan ke dalam autoclave untuk disterilisasi dengan tekanan 1,5 kg/cm2 selama 45 menit. Botol-botol kultur berisi media selanjutnya disimpan pada rak-rak kultur.
c. Sterilisasi botol dan alat
Alat-alat yang harus disterilkan adalah botol kultur, petridish,
scalpel, pinset, dan pisau pemes. Alat-alat tersebut dicuci sampai bersih
lalu dikeringkan. Setelah kering, baru dimasukkan ke dalam autoclave
pada tekanan 1,5 kg/cm2 selama 45 menit. d. Pengecambahan biji
Penanaman biji dilakukan di dalam Laminar Air Flow Cabinet
(LAFC). LAFC adalah tempat menanam eksplan dan subkultur dengan kondisi aseptik. Sebelum penanaman, biji dicuci dengan menggunakan air sabun dan dibilas hingga tidak berbusa. Kulit biji dikupas dengan menggunakan tang. Sebelum ditanam biji disterilisasi dengan larutan clorox 100 % selama 1 menit. Kemudian dengan menggunakan pinset
dan scalpel biji dibuka dan diambil embrionya. Setelah itu menanam
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
13
mulut botol selalu didekatkan dengan api bunsen. Kemudian menutup botol dengan aluminium foil dan melapisi dengan plastik pp.
e. Penanaman eksplan
Penanaman eksplan dengan cara memotong pucuk tanaman yang telah dikecambahkan secara steril (umur 10 HST) dengan menggunakan pisau scalpel. Sebelum botol ditanami, terlebih dahulu di bagian mulut botol dipanaskan agar tidak terjadi kontaminasi. Dengan hati-hati tutup botol selanjutnya dibuka. Eksplan ditanam, kemudian menutup botol dengan aluminium foil dan melapisi dengan plastik pp. Setelah itu menanam eksplan dalam botol, selama penanaman mulut botol selalu didekatkan dengan api bunsen. Kemudian menutup botol dengan aluminium foil dan melapisi dengan plastik pp.
f. Pemeliharaan
Pemeliharaan botol-botol kultur dilakukan dengan cara
meletakkan pada rak-rak kultur. Botol-botol tersebut setiap dua hari sekali disemprot dengan spirtus untuk mencegah kontaminasi.
D. Variabel Pengamatan 1. Saat Muncul Kalus
Diamati dan dicatat saat muncul kalus (dinyatakan dalam Hari Setelah Tanam, HST), ditandai dengan munculnya jaringan berwarna kehijauan pada permukaan eksplan.
2. Warna Kalus
Pengamatan warna kalus dilakukan pada akhir pengamatan (30 HST) dengan mengamati secara visual. Penentuan warna kalus ditetapkan berdasarkan skoring :
0 : putih
1 : hijau keputihan 2 : hijau kekuningan 3 : hijau
commit to user 3. Tekstur Kalus
Pengamatan tekstur kalus dilakukan pada akhir pengamatan (30 HST) dengan mengamati tekstur kalus yang terbentuk, apakah termasuk kalus yang kompak atau remah.
4. Berat Segar Kalus
Berat segar kalus dinyatakan dalam gram (g) dan pengukuran berat segar kalus dilakukan pada akhir pengamatan (30 HST). Berat segar kalus dihitung dengan menggunakan rumus:
Wk = Wt – Wo Keterangan:
Wk = berat segar kalus (g)
Wt = berat botol + penutup + kalus (g) Wo = berat botol + penutup (g)
5. Saat Muncul Tunas
Diamati dan dicatat saat munculnya tunas (dinyatakan dengan HST). Terbentuknya tunas ditandai dengan adanya tonjolan berwarna putih kehijauan (± 2 mm) pada permukaan eksplan bagian atas.
6. Jumlah Tunas
Jumlah tunas diamati pada akhir pengamatan (30 HST), dilakukan dengan menghitung jumlah tunas yang muncul.
7. Saat Muncul Daun
Penentuan saat muncul daun dalam penelitian ini didasarkan pada daun yang telah membuka sempurna.
8. Jumlah Daun
Jumlah daun dihitung pada saat akhir pengamatan (30 HST) dengan cara menghitung jumlah daun yang terbentuk.
9. Saat Muncul Akar
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
15
10. Jumlah Akar
Jumlah akar dilakukan pada akhir pengamatan (30 HST), dengan menghitung jumlah akar primer yang muncul pada eksplan.
E. Analisis Data
commit to user
16
IV. HASIL DAN PEMBAHASAN
A. Kalus
1. Saat Muncul Kalus
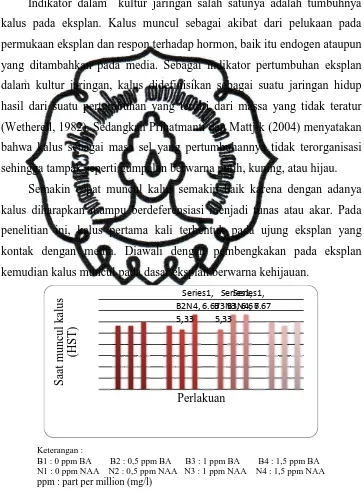
Indikator dalam kultur jaringan salah satunya adalah tumbuhnya kalus pada eksplan. Kalus muncul sebagai akibat dari pelukaan pada permukaan eksplan dan respon terhadap hormon, baik itu endogen ataupun yang ditambahkan pada media. Sebagai indikator pertumbuhan eksplan dalam kultur jaringan, kalus didefinisikan sebagai suatu jaringan hidup hasil dari suatu pertumbuhan yang terdiri dari massa yang tidak teratur
(Wetherell, 1982). Sedangkan Prihatmanti dan Mattjik (2004) menyatakan bahwa kalus sebagai masa sel yang pertumbuhannya tidak terorganisasi sehingga tampak seperti gumpalan berwarna putih, kuning, atau hijau.
Semakin cepat muncul kalus semakin baik karena dengan adanya kalus diharapkan mampu berdeferensiasi menjadi tunas atau akar. Pada penelitian ini, kalus pertama kali terbentuk pada ujung eksplan yang kontak dengan media. Diawali dengan pembengkakan pada eksplan kemudian kalus muncul pada dasar eksplan berwarna kehijauan.
Keterangan :
B1 : 0 ppm BA B2 : 0,5 ppm BA B3 : 1 ppm BA B4 : 1,5 ppm BA N1 : 0 ppm NAA N2 : 0,5 ppm NAA N3 : 1 ppm NAA N4 : 1,5 ppm NAA
ppm : part per million (mg/l)
Gambar 1. Pengaruh konsentrasi BA dan NAA terhadap saat muncul kalus (HST).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
17
Berdasarkan Gambar 1 dapat diketahui bahwa hampir semua perlakuan mampu memunculkan kalus. Terbentuknya kalus merupakan akibat dari pelukaan pada permukaan eksplan dan pengaruh perlakuan zat pengatur tumbuh yang diberikan pada medium kultur (Zulkarnain, 2009). Terbentuknya kalus terjadi pada bagian luka bekas irisan kemudian berlanjut dengan pertumbuhan kalus sebagai akibat dari proliferasi sel-sel penyusun kalus. Hal ini sesuai dengan pendapat Dodds dan Robert (1982) cit. Utami et al. (2007) yang menyatakan bahwa terjadinya kalus ditempat irisan bertujuan untuk menutup luka. Dalam hal ini zat pengatur tumbuh yang diberikan yaitu BA dan NAA.
Pada perlakuan tanpa NAA (0 ppm) tidak tumbuh kalus. Hal ini disebabkan auksin endogen yang terdapat dalam eksplan belum mampu untuk menginduksi terbentuknya kalus. Auksin umumnya ditambahkan ke dalam nutrisi media untuk menginduksi kalus dari eksplan (George dan
Sherrington, 1984). Wattimena (1992) menyatakan untuk pembentukan kalus dibutuhkan konsentrasi auksin tinggi (NAA) dengan konsentrasi sitokinin yang rendah (BA). Ditambahkan oleh Pierik (1987) bahwa auksin dikenal sebagai hormon yang mampu berperan menginduksi kalus.
commit to user 2. Warna Kalus
Variabel warna kalus diamati pada 30 HST atau pada akhir pengamatan. Perbedaan warna kalus menunjukkkan tingkat perkembangan dari kalus. Kualitas kalus yang baik memiliki warna hijau. Warna kalus mengindikasikan keberadaan klorofil dalam jaringan, semakin hijau warna kalus semakin banyak pula kandungan klorofilnya. Warna terang atau putih dapat mengindikasikan bahwa kalus masih cukup baik (Fatmawati, 2008). Berdasarkan warna kalus juga dapat diketahui apakah suatu kalus masih memiliki sel-sel yang aktif membelah atau masih hidup ataukah telah mati.
Tabel 1. Pengaruh konsentrasi BA dan NAA terhadap warna kalus
BA (ppm) NAA (ppm)
0 0,5 1 1,5
0 - 2 4 2
0,5 - 4 2 2
1 - 4 2 2
1,5 - 2 2 2
Keterangan skoring warna kalus :
0 = Putih 1 = Hijau keputihan 2 = Hijau kekuningan 3 = Hijau 4 = Hijau kecoklatan
ppm : part per million (mg/l)
a b
Gambar. 2 (a) Kalus jarak pagar berwarna hijau kekuningan (skor 2), (b) Kalus jarak pagar berwarna hijau kecoklatan (skor 4).
Berdasarkan Tabel 1 diketahui bahwa sebagian besar kalus yang dihasilkan pada penelitian ini berwarna hijau kekuningan (Gambar 2 a) dan terdapat pula kalus yang berwarna hijau kecoklatan (Gambar 2 b). Pertama kali muncul kalus berwarna hijau kekuningan dan selanjutnya
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
19
semakin bertambahnya umur kalus warna kaluspun berubah menjadi semakin gelap dan akhirnya menjadi cokelat
Warna hijau kekuningan menunjukkan warna paling cerah dengan kandungan klorofil lebih banyak bila dibandingkan dengan kalus hijau kecoklatan. Warna kalus menunjukkan tingkat perkembangan kalus yang terbentuk. Warna kalus semakin gelap (menjadi cokelat) berarti pertumbuhan kalus semakin menurun. Jika hal ini terjadi diperlukan subkultur untuk proliferasi kalus lebih lanjut. Pada akhir pengamatan, warna kalus pada perlakuan B1N3, B2N2, dan B3N2 berubah menjadi hijau kecoklatan, hal ini menandakan kalus mengalami proses penuaan (senesensi) sehingga memerlukan subkultur. Penuaan atau senesensi ini dapat terjadi karena adanya perombakan butir-butir klorofil dan protein dalam sel.
Biasanya pertumbuhan yang cepat dan warna kalus yang cenderung
terang mengindikasikan bahwa kondisi kesehatan kultur tersebut cukup baik. Sedangkan warna coklat hingga hitam secara umum menunjukkan keadaan kalus yang sel-selnya telah mati.Kalus akan menunjukkan warna kuning bening dan akan berubah menjadi kecoklatan seiring dengan pertumbuhan kalus yang semakin tua (Abdullah et al., 1998).
Terbentuknya warna kalus dipengaruhi oleh adanya zat pengatur tumbuh auksin dan sitokinin. Seperti yang dinyatakan oleh Santoso dan Nursandi (2004) bahwa dalam aktivitas kultur jaringan, auksin sangat dikenal sebagai hormon yang menghambat kerja sitokinin membentuk klorofil dalam kalus, sedangkan hormon sitokinin berfungsi mendorong pembentukan klorofil pada kalus.
3. Tekstur Kalus
commit to user
terbentuk dari sekumpulan sel yang mudah lepas sedangkan kalus kompak terdiri dari sekumpulan sel yang kuat (Syahid et al., 2010).
Pierik (1987) menyatakan bahwa tekstur kalus dapat bervariasi dari remah sampai kompak. Perbedaan tekstur kalus tergantung pada jenis tanaman yang digunakan, komposisi nutrisi yang terdapat didalam media, zat pengatur tumbuh, dan kondisi lingkungan kultur.
Penentuan tekstur kalus dapat dilakukan dengan cara mengambil kalus tersebut dari dalam botol. Kalus yang remah akan mudah terurai ketika diambil dengan pinset sedangkan kalus yang kompak tidak mudah terurai karena tekstur kalus cenderung keras. Kalus yang muncul pada seluruh perlakuan bersifat remah (Tabel 2), sel-sel kalus yang terbentuk antara satu sel dengan sel yang lain dengan mudah bisa dipisahkan.
Tabel 2. Pengaruh konsentrasi BA dan NAA terhadap tekstur kalus
BA (ppm) NAA (ppm)
0 0,5 1 1,5
0 - remah remah remah
0,5 - remah remah remah
1 - remah remah remah
1,5 - remah remah remah
Keterangan:
ppm : part per million (mg/l)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
21
Gambar 3. Kalus yang terbentuk pada eksplan jarak pagar.
Kalus yang baik diasumsikan memiliki tekstur remah (friable) (Gambar 3). Tekstur kalus yang remah dianggap baik karena memudahkan dalam pemisahan menjadi sel-sel tunggal pada kultur suspensi, disamping itu akan meningkatkan aerasi oksigen antar sel.
Menurut Syahid et al. (2010) bahwa aplikasi kombinasi auksin dan sitokinin pada konsentrasi tepat mampu menghasilkan kalus dengan struktur remah. Penambahan sitokinin ke dalam media yang sudah mengandung auksin dapat merangsang pertumbuhan kalus karena kedua zat pengatur tumbuh tersebut bekerja secara sinergis. Adanya sitokinin yang dapat meningkatkan pembelahan sel dalam proses sitokinesis
terutama pada saat sintesis RNA dan protein akan memacu aktivitas auksin dalam pembelahan sel membentuk kalus
4. Berat Segar Kalus
Berat segar kalus dihitung pada 30 HST atau akhir pengamatan. Berat segar kalus merupakan parameter pertumbuhan kalus, karena merupakan hasil dari pembelahan dan perbesaran sel.
Berat basah yang dihasilkan sangat tergantung pada kecepatan sel-sel tersebut membelah diri, memperbanyak diri, dan dilanjutkan dengan membesarnya kalus. Zat pengatur tumbuh auksin dan sitokinin yang diberikan pada perbandingan yang tepat dapat menginisiasi pembelahan sel dan meningkatkan pertumbuhan sel (Rahayu et al., 2003).
commit to user Keterangan :
B1 : 0 ppm BA B2 : 0,5 ppm BA B3 : 1 ppm BA B4 : 1,5 ppm BA N1 : 0 ppm NAA N2 : 0,5 ppm NAA N3 : 1 ppm NAA N4 : 1,5 ppm NAA
[image:30.595.156.514.112.514.2]ppm : part per million (mg/l)
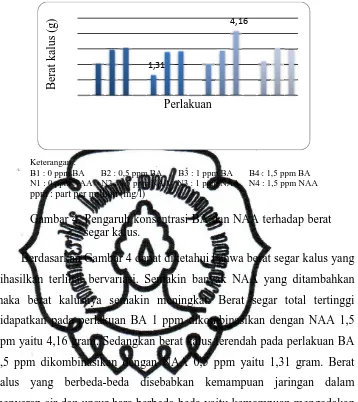
Gambar 4. Pengaruh konsentrasi BA dan NAA terhadap berat segar kalus.
Berdasarkan Gambar 4 dapat diketahui bahwa berat segar kalus yang dihasilkan terlihat bervariasi. Semakin banyak NAA yang ditambahkan maka berat kalusnya semakin meningkat. Berat segar total tertinggi
didapatkan pada perlakuan BA 1 ppm dikombinasikan dengan NAA 1,5 ppm yaitu 4,16 gram. Sedangkan berat kalus terendah pada perlakuan BA
0,5 ppm dikombinasikan dengan NAA 0,5 ppm yaitu 1,31 gram. Berat kalus yang berbeda-beda disebabkan kemampuan jaringan dalam menyerap air dan unsur hara berbeda-beda yaitu kemampuan mengadakan proses difusi, osmosis dan tekanan turgor sel (Sriyanti (2000) cit. Widyawati (2009).
Tingginya berat segar kalus yang diperoleh berhubungan dengan tekstur kalus yang diperoleh yaitu remah. Menurut Syahid et al. (2010) semakin remah kalus yang diperoleh, semakin cepat proses pembelahan selnya sehingga massa kalus makin banyak dan bobot meningkat.
Berdasarkan hasil sidik ragam (Lampiran 11) menunjukkan bahwa pemberian NAA berpengaruh sangat nyata terhadap berat segar kalus sedangkan pemberian BA dan interaksi antara keduanya tidak berpengaruh nyata. Auksin umumnya ditambahkan ke dalam nutrisi media untuk menginduksi kalus dari eksplan (George dan Sherrington, 1984).
1,31
4,16
B
er
at
ka
lus
(
g
)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
23
[image:31.595.150.511.238.482.2]Penambahan NAA pada media menyebabkan sel-sel kalus aktif dalam pembelahan sel, pembesaran sel, menaikkan tekanan osmotic dan meningkatkan sintesis protein (Widyawati, 2009). Menurut Wetherell (1982) penambahan auksin dalam jumlah yang lebih besar, atau penambahan auksin yang lebih stabil misalnya NAA atau 2,4 D cenderung menyebabkan terjadinya pertumbuhan kalus dari eksplan. Mekanisme kerja auksin salah satunya adalah mempengaruhi perpanjangan sel. Auksin mendorong elongasi sel pada koleoptil dan ruas-ruas tanaman. Elongasi sel terutama terjadi pada arah vertikal dan diikuti dengan pembesaran sel dan peningkatan bobot basah. Sitokinin memiliki aktivitas utama dalam mendorong terjadinya pembelahan sel (Wattimena, 1988).
Tabel 3. Pengaruh NAA terhadap purata berat segar kalus
NAA (ppm) Purata berat kalus (gram)
0 0,00 a
0,5 1,90 b
1 2,93 c
1,5 3,27 c
Keterangan : Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada DMRT 5%
Setelah dilakukan uji Duncan 5% (Tabel 3) dapat diketahui bahwa perlakuan tanpa NAA (0 ppm) memberikan pengaruh yang berbeda nyata dengan perlakuan NAA 0,5 ppm, 1 ppm, dan 1,5 ppm. Akan tetapi penggunaan NAA 1 ppm memberikan pengaruh yang tidak berbeda nyata dengan NAA 1,5 ppm. Dapat dikatakan bahwa pemberian 1 ppm NAA paling optimal untuk berat segar kalus karena peningkatan konsentrasinya memberikan pengaruh yang tidak berbeda nyata secara DMRT 5% pada variabel berat segar kalus.
B. Tunas
1. Saat Muncul Tunas
commit to user
tanaman. Pengaruh konsentrasi BA dan NAA terhadap eksplan jarak pagar disajikan pada Gambar 5.
Keterangan :
B1 : 0 ppm BA B2 : 0,5 ppm BA B3 : 1 ppm BA B4 : 1,5 ppm BA N1 : 0 ppm NAA N2 : 0,5 ppm NAA N3 : 1 ppm NAA N4 : 1,5 ppm NAA
[image:32.595.158.515.158.487.2]ppm : part per million (mg/l)
Gambar 5. Pengaruh konsentrasi BA dan NAA terhadap saat muncul tunas (HST).
Pada penelitian ini, hampir semua perlakuan mampu merangsang pembentukan tunas kecuali pada perlakuan tanpa BA maupun NAA. Hal ini disebabkan tidak adanya zat pengatur tumbuh yang ditambahkan walaupun pada eksplan sudah terdapat zat pengatur tumbuh endogen tetapi belum mampu untuk merangsang pembentukan tunas.
Hal ini didukung oleh pendapat Wattimena (1992) bahwa zat
pengatur tumbuh adalah salah satu faktor yang penting diantara faktor lainnya yang dapat mempengaruhi pertumbuhan organ dari potongan jaringan yang ditanam baik jenis maupun konsentrasinya. Menurut Pierik (1987) BA termasuk golongan sitokinin merupakan ZPT yang banyak digunakan untuk memacu inisiasi dan poliferasi tunas. Terutama dalam mendorong pembelahan sel, menginduksi tunas adventif dan dalam konsentrasi tinggi menghambat inisiasi akar.
Pada perlakuan BA 0,5 ppm dan NAA 0 ppm menunjukkan pengaruh paling cepat dalam merangsang kemunculan tunas yaitu pada 9,67 hari setelah tanam. Hal serupa juga ditunjukkan pada penelitian Kaewpoo dan Te-chato (2009) dan pada penelitian Hartono (2010) bahwa
9,67
S
aa
t m
unc
ul
t
una
s
(H
S
T)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
25
perlakuan BA 0,5 ppm mampu mempengaruhi saat muncul tunas tercepat. Pada perlakuan tanpa BA eksplan mampu membentuk tunas. Seperti diungkapkan oleh George dan Sherrington (1984) bahwa sitokinin alami yang terkandung didalam tubuh eksplan dapat merangsang eksplan untuk membentuk tunas.
Penambahan NAA tidak mampu mempercepat saat muncul tunas. Hariyanti et al. (2004) menyatakan bahwa pemberian auksin eksogen yang semakin meningkat, pengaruh hambatannya terhadap waktu pembentukan tunas semakin meningkat pula. Pada penelitian ini, pengaruh penambahan NAA terhadap saat muncul tunas terlihat bervariasi. Menurut Hendaryono dan Wijayani (1994) bahwa pada kadar yang tinggi auksin lebih bersifat menghambat daripada merangsang pertumbuhan.
Pada penelitian Widyawati (2009), penambahan NAA juga tidak mampu mempercepat saat kemunculan tunas. Hal ini dimungkinkan
bahwa didalam eksplan telah terkandung auksin endogen yang kadarnya tidak sama persis. Keseragaman ukuran dan cara pengambilan eksplan kemungkinan besar tidak diikuti dengan keseragaman hormon endogen tanaman sehingga penambahan auksin eksogen ke dalam media kultur akan menimbulkan respon yang bervariasi.
2. Jumlah Tunas
Dalam penelitian ini, jumlah tunas diamati pada akhir penelitian yaitu 30 HST. Dalam kultur jaringan jumlah tunas dapat diindikasikan sebagai keberhasilan dalam multiplikasi. Semakin banyak tunas yang terbentuk maka semakin tinggi tingkat multiplikasinya.
commit to user Keterangan :
B1 : 0 ppm BA B2 : 0,5 ppm BA B3 : 1 ppm BA B4 : 1,5 ppm BA N1 : 0 ppm NAA N2 : 0,5 ppm NAA N3 : 1 ppm NAA N4 : 1,5 ppm NAA
ppm : part per million (mg/l)
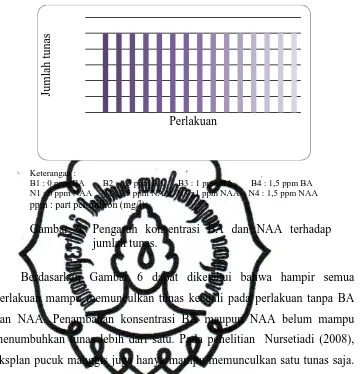
Gambar 6. Pengaruh konsentrasi BA dan NAA terhadap jumlah tunas.
Berdasarkan Gambar 6 dapat diketahui bahwa hampir semua
perlakuan mampu memunculkan tunas kecuali pada perlakuan tanpa BA dan NAA. Penambahan konsentrasi BA maupun NAA belum mampu
menumbuhkan tunas lebih dari satu. Pada penelitian Nursetiadi (2008), eksplan pucuk manggis juga hanya mampu memunculkan satu tunas saja. Hal ini juga diduga karena jenis eksplan yang digunakan. Diduga eksplan pucuk mempunyai kecenderungan memunculkan bakal tunas satu. Tunas yang terbentuk berasal dari hasil pemanjangan tunas pucuk batang tanaman.
Penambahan konsentrasi BA sampai 1,5 ppm memberikan hasil yang sama dengan perlakuan tanpa BA. Hal ini dimungkinkan pemberian BA dengan konsentrasi 1,5 ppm belum mampu untuk multiplikasi tunas.
Penambahan hormon eksogen akan berpengaruh terhadap jumlah dan kerja
hormon endogen untuk mendorong pertumbuhan dan perkembangan
eksplan (Gunawan 1998).
Menurut George dan Sherrington (1984) bahwa konsentrasi sitokinin yang lebih tinggi dibandingkan dengan konsentrasi auksin akan memacu multiplikasi tunas. Riyadi dan Tahardi (2009) menyatakan bahwa proses
Jum
la
h
tuna
s
[image:34.595.156.516.109.483.2]perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
27
multiplikasi tunas tanaman memerlukan adanya hormon tumbuh eksternal khususnya golongan sitokinin seperti BA karena untuk mendapatkan tingkat multiplikasi tunas yang tinggi, sitokinin internal masih kurang.
C. Daun
Daun dinyatakan sebagai lembaran berwarna hijau baik yang masih menggulung maupun telah terbuka (Prihatmanti dan Mattjik, 2004). Daun mempunyai fungsi utama sebagai organ utama fotosintesis pada tumbuhan tingkat tinggi (Gardner et al., 1991). Penentuan saat muncul daun pada penelitian ini didasarkan pada daun yang telah membuka sempurna. Hal ini sesuai dengan penelitian yang dilakukan oleh Widyawati (2009) dan Hanifah (2007) pada eksplan jarak pagar.
1. Saat Muncul Daun
Pengamatan daun sangat penting sebagai acuan apakah pertumbuhan dan perkembangan tanaman berlangsung dengan baik karena daun merupakan perkembangan lebih lanjut dari tunas yang telah tumbuh pada eksplan. Tanda paling awal akan adanya perkembangan daun menurut Salisbury dan Ross (1992) adalah pembelahan poliklinal sel terluar yang diikuti dengan pertumbuhan sel anak yang menyebabkan timbulnya tonjolan yaitu primordial daun. Pertumbuhan daun merupakan proses diferensiasi tunas dan dengan penambahan zat pengatur tumbuh auksin dan sitokinin dapat mendorong proses diferensiasi tersebut.
commit to user Keterangan :
B1 : 0 ppm BA B2 : 0,5 ppm BA B3 : 1 ppm BA B4 : 1,5 ppm BA N1 : 0 ppm NAA N2 : 0,5 ppm NAA N3 : 1 ppm NAA N4 : 1,5 ppm NAA
ppm : part per million (mg/l)
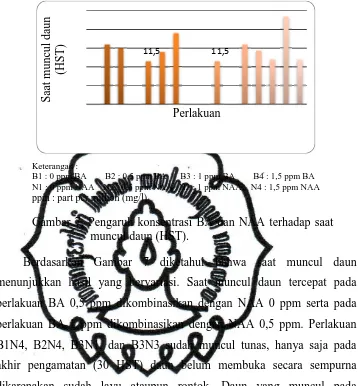
Gambar 7. Pengaruh konsentrasi BA dan NAA terhadap saat muncul daun (HST).
Berdasarkan Gambar 7 diketahui bahwa saat muncul daun menunjukkan hasil yang bervariasi. Saat muncul daun tercepat pada perlakuan BA 0,5 ppm dikombinasikan dengan NAA 0 ppm serta pada perlakuan BA 1 ppm dikombinasikan dengan NAA 0,5 ppm. Perlakuan B1N4, B2N4, B3N1, dan B3N3 sudah muncul tunas, hanya saja pada akhir pengamatan (30 HST) daun belum membuka secara sempurna dikarenakan sudah layu ataupun rontok. Daun yang muncul pada penelitian ini keseluruhan berwarna hijau.
2. Jumlah Daun
Jumlah daun dihitung berdasarkan akumulasi jumlah dari daun yang terbentuk sampai akhir pengamatan yaitu 30 HST. Hal ini dikarenakan, dalam perjalanannya banyak daun yang layu ataupun rontok. Perontokan daun ini diduga karena eksplan sudah memasuki fase penuaan dan karena nutrisi dalam media sudah berkurang. Widyawati (2009) melaporkan bahwa planlet jarak pagar yang daunnya mengalami kerontokan kemungkinan besar disebabkan oleh asupan hara yang semakin berkurang dalam media karena diserap oleh tanaman untuk pertumbuhan dan perkembangannya. Perontokan daun juga mungkin disebabkan karena
11,5 11,5
S
aa
t m
unc
ul
da
un
(H
S
T)
[image:36.595.154.512.113.499.2]perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
29
siklus tanaman jarak pagar yang memasuki fase perontokan daun, seperti yang biasanya terjadi pada budidaya di lapangan.
Sedangkan Lizawati et al. (2009) menyatakan bahwa gugur daun diduga berkaitan dengan adanya produksi gas etilen, kekurangan hara pada media dan terjadinya toksisitas. Kekurangan hara diduga akibat dari habisnya hara yang terdapat pada media dalam botol, oleh karena itu perlu dilakukan subkultur pada 4 minggu setelah tanam agar gugur daun tidak menyebabkan kematian. Hal ini diperkuat oleh Magdalita et al. (1997) cit. Lizawati et al. (2009) menyatakan bahwa pengaruh akumulasi etilen adalah mempercepat penuaan dan perontokan daun.
Salah satu proses fisiologi yang terjadi pada kultur in vitro adalah senesen yaitu suatu proses yang dapat mempercepat proses penuaan walaupun nutrisi pada media dan sirkulasi gas masih mencukupi. Proses senesen pada kultur in vitro dapat terjadi melalui bentuk yang
berbeda-beda seperti daun menguning dan kalus berubah secara gradual menjadi abu-abu lalu coklat. Kekurangan nutrisi dari media dan akumulasi racun pada kultur juga merupakan penyebab senesen (Cachita dan Craciun (1990) cit. Prihatmanti dan Mattjik (2004).
Keterangan :
B1 : 0 ppm BA B2 : 0,5 ppm BA B3 : 1 ppm BA B4 : 1,5 ppm BA N1 : 0 ppm NAA N2 : 0,5 ppm NAA N3 : 1 ppm NAA N4 : 1,5 ppm NAA
[image:37.595.150.516.222.694.2]ppm : part per million (mg/l)
Gambar 8. Pengaruh konsentrasi BA dan NAA terhadap jumlah daun.
Series1, B1N3, 2
Series1, B3N4, 2
Jum
la
h
da
un
commit to user
Berdasarkan Gambar 8 dapat diketahui bahwa jumlah daun yang dihasilkan bervariasi. Perlakuan BA 0,5 ppm dikombinasikan dengan NAA 1 ppm serta perlakuan BA 0,5 ppm dikombinasikan dengan NAA 1,5 ppm menghasilkan jumlah daun terbanyak yaitu dua helai.
Berdasarkan hasil sidik ragam (Lampiran 12) menunjukkan bahwa pemberian NAA memberikan pengaruh yang nyata terhadap jumlah daun, sedangkan pemberian BA serta interaksi antara keduanya tidak memberikan pengaruh yang nyata. Wetherell (1982) menyebutkan bahwa perbandingan sitokinin-auksin yang tinggi, baik untuk pembentukan daun. Namun, pada penelitian ini jumlah daun yang muncul pada eksplan terlihat bervariasi. Variasi jumlah daun ini dimungkinkan karena adanya hormon endogen yang kadarnya tidak persis sama sehingga responnya terhadap penambahan zat pengatur tumbuh juga bervariasi. Gunawan (1987) cit. Widyawati (2009) menyebutkan bahwa interaksi dan
[image:38.595.148.514.226.512.2]peimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel endogen menentukan arah perkembangan suatu kultur. Penambahan auksin atau sitokinin eksogen mengubah level zat pengatur tumbuh endogen sel.
Tabel 4. Pengaruh NAA terhadap purata jumlah daun
NAA (ppm) Purata jumlah daun
0 0,42 a
0,5 1,08 b
1 0,67 ab
1,5 0,25 a
Keterangan: Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada DMRT 5%
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
31
D. Akar
Akar merupakan salah satu organ penting tanaman. Menurut Prihatmanti dan Mattjik (2004), akar dinyatakan sebagai tonjolan berbentuk kerucut dan berbulu putih (bulu akar) dengan ujung berwarna kuning dan akan tumbuh memanjang. Akar terutama berfungsi sebagai penopang tubuh tanaman dan untuk penyerapan air dan mineral. Dua fungsi lain yang berkaitan dengan akar adalah sebagai tempat penyimpanan dan sebagai pengangkut (Zulkarnain, 2009).
1. Saat Muncul Akar
Saat munculnya akar menjadi faktor yang penting dalam pertumbuhan tanaman karena tanaman akan lebih mudah menyerap unsur-unsur yang terdapat dalam media kultur.
Keterangan :
B1 : 0 ppm BA B2 : 0,5 ppm BA B3 : 1 ppm BA B4 : 1,5 ppm BA N1 : 0 ppm NAA N2 : 0,5 ppm NAA N3 : 1 ppm NAA N4 : 1,5 ppm NAA
ppm : part per million (mg/l)
Gambar 9. Pengaruh konsentrasi BA dan NAA terhadap saat muncul akar (HST).
Berdasarkan Gambar 9 dapat diketahui bahwa perlakuan BA 1,5 ppm dikombinasikan dengan NAA 0,5 ppm menunjukkan kemunculan akar tercepat. Hal senada juga ditunjukkan pada penelitian Artemesia oleh Fitriani (2008) dan pada penelitian Gladiol kultivar Malang Strip dan White Friendship oleh Badriah et al. (1998), inisiasi akar tercepat
Series1, B4N2, 6
S
aa
t m
unc
ul
a
ka
r
(H
S
T)
[image:39.595.135.515.190.589.2]commit to user
diperoleh dari media yang mengandung 0,5 ppm NAA. Sebagian eksplan tidak mampu menumbuhkan akar. Hal ini diduga karena auksin yang terdapat pada eksplan digunakan untuk pembentukan kalus. Menurut Beyl (2005) cit. Sukmawati (2010) bahwa pada umumnya konsentrasi auksin yang rendah menyebabkan inisiasi akar sedangkan konsentrasi auksin yang tinggi dapat menyebabkan terbentuknya kalus.
Zat pengatur tumbuh NAA dapat berperan sebagai perangsang terbentuknya enzim-enzim yang aktif dalam pembelahan sel. Tanpa pemberian NAA, walaupun telah diberikan sitokinin, eksplan yang ditumbuhkan secara in vitro belum mampu berakar, sedangkan pada media
MS dengan adanya penambahan NAA dapat merangsang pertumbuhan akar (Simatupang, 1991).
Akan tetapi pada perlakuan BA 0,5 ppm dikombinasikan dengan NAA 1,5 ppm tidak menunjukkan kemunculan akar. Variasi saat muncul akar ini dimungkinkan karena adanya hormon endogen yang kadarnya tidak persis sama sehingga responnya terhadap penambahan zat pengatur tumbuh juga bervariasi.
2. Jumlah Akar
[image:40.595.143.511.237.500.2]Jumlah akar yang banyak dapat mengoptimalkan penyerapan nutrisi yang ada pada media kultur. Secara visual, akar yang terbentuk pada eksplan berwarna putih, mempunyai percabangan dan terbentuk pada dasar eksplan (Gambar 10).
Gambar 10. Akar yang terbentuk pada eksplan.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
33
Keterangan :
B1 : 0 ppm BA B2 : 0,5 ppm BA B3 : 1 ppm BA B4 : 1,5 ppm BA N1 : 0 ppm NAA N2 : 0,5 ppm NAA N3 : 1 ppm NAA N4 : 1,5 ppm NAA
ppm : part per million (mg/l)
Gambar 11. Pengaruh konsentrasi BA dan NAA terhadap jumlah akar.
Dalam penelitian ini, akar yang dihitung adalah akar primer yang terbentuk. Terbentuknya akar bukan berasal dari kalus, melainkan dari pangkal batang yang membesar. Berdasarkan Gambar 11 dapat diketahui bahwa jumlah akar terbanyak didapatkan pada perlakuan BA 1 ppm dikombinasikan dengan NAA 1,5 ppm dan perlakuan BA 1,5 ppm dikombinasikan dengan NAA 1 ppm yaitu 5.
[image:41.595.159.514.110.488.2]Dari hasil sidik ragam (Lampiran 13) diketahui bahwa pemberian NAA serta interaksi antara BA dan NAA memberikan pengaruh yang nyata. Menurut Bhojwani dan Radzan (1983) cit. Panjaitan (2005), ZPT NAA merupakan golongan auksin yang digunakan untuk pembesaran dan diferensiasi akar. Ditambahkan oleh Bantawa et al. (2009) bahwa NAA merupakan auksin yang paling baik untuk induksi akar.
Tabel 5. Pengaruh Interaksi BA dan NAA terhadap purata jumlah akar
NAA (ppm) BA (ppm)
0 0,5 1 1,5
0 0,00 a 0,00 a 0,00 a 0,33 ab
0,5 3,33 cde 3,33 cde 3,33 cde 0,33 ab
1 3,00 cde 3,67 de 1,33 abcd 5,00 e
1,5 2,67 bcde 0,00 a 5,00 e 1,33 abc
Keterangan : Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada DMRT 5%
Series1, B3N4, 5
Series1, B4N3, 5
Jum
la
h
aka
r
[image:41.595.157.493.641.734.2]commit to user
Interaksi BA dan NAA yang sangat nyata menunjukkan bahwa perlakuan sitokinin (BA) tidak dapat dilepaskan dari pengaruh auksin (NAA), sehingga dalam penggunaan sitokinin, baik efek mendorong maupun menghambat proses pembelahan sel tergantung dari adanya fitohormon lainnya, terutama auksin (Wattimena, 1988).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
35
V. KESIMPULAN DAN SARAN
A. Kesimpulan
1. Rata-rata saat muncul tunas tercepat pada perlakuan BA 0,5 ppm tanpa NAA yaitu 9,67 HST.
2. Penggunaan berbagai konsentrasi BA dan NAA tidak mampu merangsang multiplikasi tunas.
B. Saran