POLIMORFISME -173 G KE C GEN MACROPHAGE MIGRATION INHIBITORY FACTOR DENGAN KADAR ANGIOTENSIN II DAN MACROPHAGE INHIBITORY FACTOR SEBAGAI FAKTOR RISIKO
SINDROM NEFROTIK RESISTEN STEROID
DISERTASI
OKE RINA RAMAYANI NIM 088102002
PROGRAM STUDI DOKTOR (S-3) ILMU KEDOKTERAN FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA MEDAN
POLIMORFISME -173 G KE C GEN MACROPHAGE MIGRATION INHIBITORY FACTOR DENGAN KADAR ANGIOTENSIN II DAN MACROPHAGE INHIBITORY FACTOR SEBAGAI FAKTOR RISIKO
SINDROM NEFROTIK RESISTEN STEROID
DISERTASI
Diajukan sebagai Salah Satu Syarat untuk memperoleh Gelar Doktor dalam
Program Studi Ilmu Kedokteran pada Fakultas Kedokteran Universitas Sumatera Utara di bawah Pimpinan
Rektor Universitas Sumatera Utara
Prof. Dr. dr. Syahril Pasaribu, DTM&H, M.Sc(CTM),Sp.A(K) Untuk Dipertahankan Dihadapan Sidang Ujian Terbuka
Universitas Sumatera Utara
Oleh
Oke Rina Ramayani NIM 088102002
PROGRAM STUDI DOKTOR (S3) ILMU KEDOKTERAN FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA MEDAN
Judul Penelitian : Polimorfisme -173 G ke C gen macrophage migration inhibitory factor dengan kadar angiotensin II dan macrophage inhibitory factor sebagai faktor risiko sindrom nefrotik resisten steroid
Nama Mahasiswa : Oke Rina Ramayani No Induk Mahasiswa : 088102002
Program Studi : Doktor Ilmu Kedokteran
Menyetujui
Promotor
Prof. dr.H. Aznan Lelo, PhD,SpFK
Co Promotor
Prof. Dr.dr.H.Nanan Sekarwana,MARS,SpA(K)
Co Promotor
PROMOTOR
Prof. dr. H. Aznan Lelo,PhD,SpFK Guru Besar Tetap Farmakologi
Fakultas Kedokteran Universitas Sumatera Utara Medan
KO-PROMOTOR
Prof. Dr.dr.H.Nanan Sekarwana,MARS,SpA(K) Guru Besar Tetap Ilmu Kesehatan Anak Fakultas Kedokteran Universitas Padjajaran
Bandung
KO-PROMOTOR
Dr. dr.Hj.Partini P.Trihono,MMPaed,SpA(K) Doktor Ilmu Kesehatan Anak
Telah diuji pada Ujian Tertutup Tanggal 16 Desember 2013
PANITIA PENGUJI DISERTASI
Ketua : Prof. dr. H. Aznan Lelo,PhD,SpFK
Anggota : Prof. Dr.dr.H.Nanan Sekarwana,MARS,SpA(K)
Dr.dr.Hj.Partini P.Trihono,MMPaed,SpA(K)
dr.H.Ahmad Hamim Sadewa, PhD
Prof.dr.H.Harun Rasyid Lubis, SpPD-KGH
Dr. dr. Rosita Juwita Sembiring, SpPK
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Sumatera Utara, saya yang bertandatangan dibawah ini:
Nama : Oke Rina Ramayani
NIM : 088102002
Program Studi : Ilmu Kedokteran Jenis Karya : Disertasi
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-eksklusif ( Non-exclusive Royalty Free Right) atas disertasi saya yang berjudul:
POLIMORFISME -173 G KE C GEN MACROPHAGE MIGRATION INHIBITORY FACTOR DENGAN KADAR ANGIOTENSIN II DAN MACROPHAGE INHIBITORY FACTOR SEBAGAI FAKTOR RISIKO
SINDROM NEFROTIK RESISTEN STEROID
Beserta perangkat yang ada (jika diperlukan), dengan Hak Bebas Royalti Non-eksklusif ini Universitas Sumatera Utara berhak menyimpan, mengalih media/formatkan, mengelola data bentuk database, merawat, dan mempublikasikan disertasi saya tanpa meminta izin dari saya sebagai penulis dan sebagai pemilik hak cipta.
Demikian pernyataan ini saya perbuat dengan sebenarnya,
Dibuat di Medan
Pada tanggal 7 Januari 2014
Yang menyatakan
HALAMAN PERNYATAAN ORISINALITAS
Hasil penelitian ini adalah hasil karya sendiri, dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Oke Rina Ramayani NIM : 088102002
Materai 6000
RIWAYAT HIDUP
Nama : Oke Rina Ramayani
Tempat/tanggal lahir : Medan, 1 Februari 1974
Agama : Islam
Nama ayah : Prof.Dr.H.Rusdidjas, SpA(K)
Nama ibu : Prof.Dr.H.Rafita Ramayati, SpA(K)
Nama anak :Rasyid Ridha
Putri Ramayuli
Riwayat pendidikan:
1. Lulus S1 Fakultas Kedokteran Universitas Sumatera Utara (1997)
2. Lulus Spesialis Anak Fakultas Kedokteran USU (2005)
Riwayat pekerjaan:
1. Dokter PTT Puskesmas Tanjung Morawa, Kabupaten Deli Serdang,
Sumatera Utara (tahun 1998 – 2000)
2. Staf Pengajar Ilmu Kesehatan Anak Fakultas Kedokteran Universitas
Sumatera Utara (tahun 2005-sekarang)
Organisasi:
1. Anggota Ikatan Dokter Indonesia/IDI
2. Anggota Ikatan Dokter Anak Indonesia
UCAPAN TERIMA KASIH
Assalamu’alaikum Wr.Wb Dengan mengucapkan puji syukur ke hadirat Allah SWT yang sudah
melimpahkan rahmat dan karunia-Nya, serta telah memberikan
kesempatan kepada promovendus sehingga mampu menyelesaikan
penulisan disertasi ini. Shalawat kepada suri tauladan manusia, Rasulullah
Muhammad SAW semoga kita mendapat syafaat Baginda kelak di hari
Kebangkitan. Promovendus menyadari penelitian dan penulisan disertasi ini
masih jauh dari kesempurnaan. Oleh sebab itu, dengan segala kerendahan
hati promovendus mengharapkan masukan yang berharga dari semua
pihak pada masa yang akan datang. Pada kesempatan ini pula
perkenankan promovendus menyatakan penghargaan dan ucapan terima
kasih yang sebesar-besarnya kepada:
Rektor Universitas Sumatera Utara, Prof. Dr. dr. Syahril Pasaribu,
DTM&H,MSc(CTM),SpA(K); Dekan Fakultas Kedokteran USU,
Prof.dr.Gontar Alamsyah Siregar,SpPD,KGEH; Pembantu Dekan I,
Prof.dr.Guslihan Dasa Tjipta,SpA(K); Ketua Program Studi S-3 Kedokteran,
Prof.dr.Chairuddin P.Lubis, DTM&H, MSc, CTM, SpA(K); Sekretaris
Program Studi S-3, Prof.Dr.dr.Delfitri Munir,Sp.THT-KL; seluruh jajaran
yang telah memberi izin, dukungan serta motivasi kepada promovendus
untuk menyelesaikan Program Pascasarjana di USU.
Orang tua kandung promovendus: Ayahanda Prof.dr.H.Rusdidjas,
memberi kasih sayang, serta mendidik promovendus hingga saat ini.
Promovendus persembahkan gelar ini untuk keduanya disertai do’a ananda
agar mendapat kebahagiaan dunia dan akhirat.
Promotor dan kopromotor: Prof.dr.H.Aznan Lelo, PhD, SpFK,
Prof.Dr.dr.H.Nanan Sekarwana, MARS,SpA(K), dan Dr.dr.Hj. Partini P
Trihono, MMPaed,SpA(K) yang telah memberikan bimbingan ilmu kepada
promovendus dan dorongan semangat kerja keras untuk menyelesaikan
disertasi ini. Kepada ketiganya serta keluarga tersayang, promovendus
selalu berdo’a untuk kesehatan dan kebahagiaan dunia akhirat.
Selanjutnya, promovendus juga mengucapkan terima kasih dan
penghargaan setinggi-tingginya kepada tim penguji disertasi
Alm.Prof.dr.Iskandar Z.Lubis, SpA(K), Dr.Ahmad Hamim Sadewa, PhD,
Prof.dr.Harun Rasyid Lubis,SpPD-KGH, Dr.dr.Rosita Juwita Sembiring,
SpPK, dr.Putri Chairani Eyanoer, MS Epi, PhD serta seluruh staf pengajar
di lingkungan program S-3 Kedokteran FK USU.
Kepala Bagian Anak FK USU, Sekretaris Bagian Anak FK USU,
Ketua Program Studi Ilmu Kesehatan Anak dan seluruh staf pengajar di
lingkungan Departemen Ilmu Kesehatan Anak FK USU, Ketua dan
pengurus IDAI, Cabang Sumatera Utara, yang telah memberi masukan dan
pengertian kepada promovendus untuk menyelesaikan disertasi ini
Seluruh pimpinan dan staf Lembaga Penelitian USU, Laboratorium
Terpadu FK USU, Laboratorium Biokimia FK UGM, Laboratorium Prodia,
RS H. Adam Malik, RS Columbia Asia, RS Malahayati, dan RS Santa
sakit, dan memberi izin fasilitas, sarana serta bantuan tenaga dalam
pelaksanaan penelitian.
Teman teman seperjuangan di bidang Nefrologi Anak terutama
Alm.dr.Dahler Bahrun, SpA(K), dr Syafruddin Haris SpA(K), dr Rosmayanti
Siregar,SpA, dr Afdal SpA, dr.Hertanti SpA, dr.Muhammad Nur,SpA,
promovendus ucapkan terima kasih yang sebesar-besarnya atas masukan
ilmu dan input pasien dari teman teman semua.
Teman-teman yang promovendus sayangi seperti Kak Bugis, Bang
Hendi, Kak Yuli, Kak Beqi, Bang Irfan, Bang Indra, Alm. Agustiar, Hema
Masyithah, Kak Mardiah, Maria Novalentina, Budi Lestari serta semua pihak
yang tidak dapat disebutkan satu persatu, yang telah memberikan bantuan
dalam terlaksananya penelitian serta penulisan disertasi ini.
Akhirnya, kepada Abanganda dr.Kiking Ritarwan,MKT,SpS(K),
drg.Andayani Prasulandari Trisnawiyasanti, Lulu Anindita Putri, Shafira
Pramesti Putri, Auryn Pradipta Ritarwan dan kedua buah hati promovendus:
Rasyid Ridha dan Putri Ramayuli, terima kasih atas kasih sayang dan
pengertian yang diberikan selama ini. Akhirnya promovendus berharap
semoga penelitian ini bermanfaat bagi kita semua. Amiin
Wassalamualaikum Wr.Wb.
Medan
ABSTRAK
Latar belakang: Penderita sindroma nefrotik resisten steroid (SNRS)
cenderung berlanjut ke penyakit ginjal tahap akhir. Alel C -173 gen MIF (macrophage migration inhibitory factor) berkaitan dengan gangguan keseimbangan sitokin MIF dengan glukokortikoid, sehingga penderita SN resisten terhadap terapi steroid. Studi in vitro menunjukkan sitokin MIF diatur oleh angiotensin II. Induksi regulasi MIF oleh angiotensin II memengaruhi perkembangan hipertensi.
Tujuan: Hubungan alel C -173 gen MIF dengan keberadaan MIF
serum dan pengaturan oleh angiotensin II plasma pada individu SNRS belum diketahui.
Metode: Studi sekat lintang dilakukan pada 120 anak (steroid resisten,
steroid sensitif dan anak sehat) sejak November 2011 hingga September 2012. Data yang dikumpulkan meliputi pemeriksaan fisis, tekanan darah, rasio albumin kreatinin urin, alel G atau C -173 gen MIF, MIF serum, dan angiotensin II plasma.
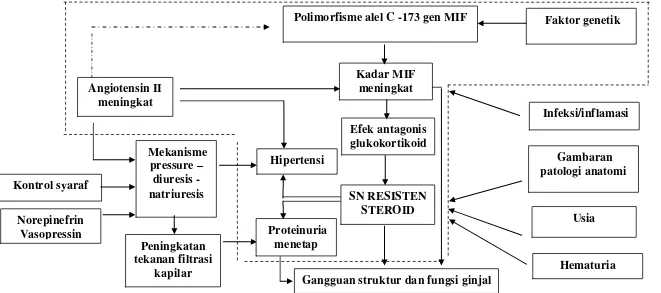
Hasil: Frekuensi alel C tiga kali lebih tinggi pada SNRS dibandingkan dengan SNSS dan anak sehat (OR 2,79;IK 95% 1,13 sampai 6,89). Kadar MIF serum lebih tinggi pada SNRS (median 31,9 kisaran 14,3 sampai 117,2 ng/mL) dibandingkan dengan kedua grup lain (p=0,04). Kelompok SNRS menunjukkan kadar angiotensin II plasma (median 22,7 kisaran 3,1 sampai 153,4 pg/mL) lebih tinggi dibandingkan dengan grup lain (p=0,01). Korelasi angiotensin II plasma dengan MIF serum adalah korelasi positif yang sangat lemah (rho = 0,27; p=0.003). Pada analisis multivariat ditemukan bahwa alel C, hipertensi sistolik, dan diastolik sebagai variabel yang bermakna terhadap risiko SNRS. Variabel angiotensin II plasma dan MIF serum memengaruhi secara nyata terhadap variabel hipertensi, apabila tidak dimasukkan ke dalam model, sehingga tetap dipakai sebagai model terbaik.
Simpulan: Frekuensi alel C, kadar angiotensin II plasma, dan MIF
serum lebih tinggi pada SNRS. Alel C, hipertensi sistolik, hipertensi diastolik, kadar angiotensin II plasma dan MIF serum merupakan model terbaik untuk analisis model keberadaan resisten steroid.
ABSTRACT
Background: Steroid-resistant nephrotic syndrome (SRNS) patients
tend to progress to end-stage renal disease (ESRD). The MIF high producer -173 C allele has been associated with alterations in balance between MIF and glucocorticoids; resulting in NS patients resistant to steroid therapy. In vitro studies demonstrate cytokine MIF is regulated by angiotensin II. Induction of MIF by angiotensin II affects the development of hypertension.
Aim: Relationship MIF gene -173 C allele with the presence of serum MIF and plasma angiotensin II regulation for the individual SRNS is unknown.
Methods: A cross-sectional study was conducted with 120 consecutive
children consisting of three groups (steroid-resistant, steroid-sensitive, and well children) between November 2011 and September 2012. Data were collected consist of physical examinations, blood pressure, urinary albumin-creatinine ratio, allele of -173 gene MIF, serum MIF and plasma angiotensin II.
Results: The C allele was three times more frequent in SRNS than
SSNS and well children (OR 2.79 95% CI 1.13 to 6.89). Group SRNS had significantly higher serum MIF (median 31.9 (14.3 to 117.2) ng/mL) compared to the levels in other groups (p=0.04). Marked increases in median plasma angiotensin II was observed in group SRNS (median 22.7 (3.1 to 153.4) pg/mL) compared with other groups (p=0.01). Plasma angiotensin II concentrations were very weak positive correlated with serum MIF (rho= 0.27; p=0.003). Although multivariate analysis found that the C allele, systolic and diastolic hypertension,as significant variables on the risk of SRNS, but variable levels plasma angiotensin II and serum MIF significantly affect variable hypertension, if not incorporated into this models.
Conclusions: C allele polymorphism of the -173 MIF gene, plasma
angiotensin II and serum MIF concentrations, are higher in SRNS. The C allele, systolic and diastolic hypertension, levels of plasma angiotensin II and serum MIF are the best fit model for steroid-resistant analysis models.
Key words: steroid-resistant nephrotic syndrome, polymorphism -173
RINGKASAN
Sindroma nefrotik (SN) merupakan manifestasi glomerulopati yang sering dijumpai pada anak. Keadaan ini ditandai dengan proteinuria masif, hipoalbuminemia, edema dan hiperkolesterolemia. Lebih kurang 85%-90% SN pada anak merupakan sindroma nefrotik sensitif steroid (SNSS), hanya 10%-15% merupakan sindroma nefrotik resisten steroid (SNRS). Persentase kelompok ini relatif kecil namun dapat berkembang menjadi gagal ginjal tahap akhir dalam waktu 1-4 tahun, oleh karena itu prediksi terjadinya resisten steroid menjadi isu yang penting.
Perkembangan studi tentang biologi sel dan molekular berperan dalam membantu klinisi menentukan respon terapi steroid. Individu dengan polimorfisme G ke C -173 gen MIF memiliki risiko resisten terhadap terapi steroid. Banyak penelitian menyebutkan hal itu, tetapi belum jelas menerangkan apakah alel C sebagai faktor risiko, terkait dengan kadar MIF serum yang tinggi
Umumnya sitokin-sitokin proinflamasi ditekan oleh aksi anti inflamasi glukokortikoid. Sebaliknya pelepasan sitokin MIF dipicu oleh glukokortikoid dan bekerja antagonis. Konsekuensi klinis hal ini adalah efek glukokortikoid dapat dihambat oleh MIF apabila konsentrasi MIF serum meningkat dan menyebabkan kerusakan pada ginjal tetap berlanjut. Aksi antagonis MIF terhadap efek glukokortikoid diatur oleh angiotensin II secara lokal (intrarenal) maupun sistemik. Persistensi angiotensin II sistemik menyebabkan perkembangan hipertensi dan proteinuria, dan kerusakan ginjal progresif. Subjek SN dengan alel C gen -173 MIF memiliki risiko resisten terhadap steroid, namun apakah subjek ini juga mengalami peningkatan kadar angiotensin II plasma dan MIF serum sehingga resisten terhadap terapi steroid, belum diketahui.
.
dosis penuh prednison (2 mg/kg/hari). Data yang dikumpulkan melalui rekam medis meliputi: identitas subjek, anamnesis gejala pada awal masuk, ureum dan kreatinin darah, pengobatan yang diterima dan luaran. Data yang dikumpulkan pada saat studi meliputi pemeriksaan fisis (umur saat penelitian, berat dan tinggi badan, tekanan darah), proteinuria kuantitatif, genotip polimorfisme -173 G ke C gen MIF, kadar angiotensin II plasma dan MIF serum.
Frekuensi alel C tiga kali lebih tinggi pada SNRS dibandingkan dengan SNSS dan anak sehat (OR 2,79;IK 95% 1,13 sampai 6,89). Kadar MIF serum lebih tinggi pada SNRS (median 31,9 kisaran 14,3 sampai 117,2 ng/mL) dibandingkan dengan kedua grup lain (p=0,04). Kelompok SNRS menunjukkan kadar angiotensin II plasma (median 22,7 kisaran 3,1 sampai 153,4 pg/mL) lebih tinggi dibandingkan dengan grup lain ( p=0,01). Korelasi angiotensin II plasma dengan MIF serum adalah korelasi positif yang sangat lemah (rho = 0,27; p = 0,003). Pada analisis multivariat ditemukan bahwa alel C, hipertensi sistolik, dan diastolik sebagai variabel yang bermakna terhadap risiko SNRS. Variabel angiotensin II plasma dan MIF serum memengaruhi secara nyata terhadap variabel hipertensi, apabila tidak dimasukkan ke dalam model, sehingga tetap dipakai sebagai model terbaik. Akhirnya, angiotensin II memengaruhi regulasi MIF, merupakan mekanisme yang berkontribusi terhadap perkembangan/pemeliharaan hipertensi.
Simpulan studi ini adalah frekuensi alel C, kadar angiotensin II plasma, dan MIF serum lebih tinggi pada SNRS. Alel C, hipertensi sistolik, hipertensi diastolik, kadar angiotensin II plasma dan MIF serum merupakan model terbaik untuk analisis model keberadaan resisten steroid. Mengingat simpulan studi ini, maka analisis polimorfisme gen MIF dilakukan atas indikasi tertentu (SNRS yang disertai hipertensi) dan perlu dikembangkan obat anti-MIF/penghambat MIF sebagai terapi
SUMMARY
Nephrotic syndrome (NS) is a manifestation of glomerulopathy that often found in children. It is characterized by massive proteinuria, hypoalbuminemia, oedema and hypercholesterolemia. Approximately 85%-90% NS in children are steroid-sensitive nephrotic syndrome (SSNS), only 10%-15% patients are steroid-resistant nephrotic syndrome (SRNS). The percentage of this group is relatively small, but can progress to end stage renal failure within 1-4 years. Therefore, the prediction of steroid resistance is an important issue
The development of the study of cell and molecular biology play a role in helping clinicians determine the response to steroid therapy. Individuals with polymorphism G to C -173 MIF gene have a risk to steroid resistance.
.
Many studies mentioned about risk of resistance steroid in allele C -173 MIF gene but have not been clearly defined whether this allele as a risk factor associated with serum MIF levels.
Generally, many proinflammatory cytokines suppressed by anti-inflammatory action of glucocorticoids. This MIF cytokine is induced by glucocorticoids, and then acts to counter-regulate the inflammatory action of glucocorticoids. Higher MIF levels can inhibit the action glucocorticoids and regulated by angiotensin II, either locally or systemically. Persistence angiotensin II in systemic causes an increase in the development of hypertension and proteinuria, and could progressive to kidney damage. While MIF is central to determining chronicity in steroid resistance, data regarding serum MIF, plasma angiotensin II levels and hypertension regulation in SRNS are scarce.
creatinine, treatment received and luaran. Data collected during the study include physical examination (age at study, weight and height, blood pressure), quantitative proteinuria, genotyping polymorphisms -173 G to C MIF gene, plasma angiotensin II and serum MIF levels
The C allele was three times more frequent in SRNS than SSNS and well children (OR 2.79 95% CI 1.13 to 6.89). Group SRNS had significantly higher serum MIF (median 31.9 (14.3 to 117.2) ng/mL) compared to the levels in other groups (p=0.04). Marked increases in median plasma angiotensin II was observed in group SRNS (median 22.7 (3.1 to 153.4) pg/mL) compared with other groups (p=0.01). Plasma angiotensin II concentrations were very weak positive correlated with serum MIF (rho= 0.27; p=0.003).
.
Although multivariate analysis found that the C allele, systolic hypertension, and diastolic as significant variables on the risk of SNRS, but variable plasma angiotensin II and serum MIF significantly affect variable hypertension, if not incorporated into this models
The C allele polymorphism of -173 MIF gene, plasma angiotensin II and serum MIF concentrations, are higher in SRNS. Systolic and diastolic hypertension, C allele, levels of plasma angiotensin II and serum MIF are the best fit model for steroid-resistant analysis models.
. Finally, angiotensin II induced MIF regulation may represent a mechanism that contributes to the development/maintenance of hypertension.
DAFTAR ISI
Halaman
ABSTRAK... i
ABSTRACT………. ii
RINGKASAN……… iii
SUMMARY……… v
DAFTAR ISI ... ... vii
DAFTAR TABEL... ix
DAFTAR GAMBAR... x
DAFTAR LAMPIRAN... xi
DAFTAR SINGKATAN DAN ISTILAH... xii
BAB I PENDAHULUAN………... 1
1.1 Latar Belakang... 1.2 Rumusan Masalah... 1.3 Tujuan Penelitian... 1.3.1. Tujuan umum... 1.3.2. Tujuan khusus…………... 1.4 Manfaat Penelitian... 1.4.1. Manfaat teori………... 1.4.2. Manfaat bagi masyarakat………. 1.4.3. Manfaat aplikatif ... 1.4.4. Manfaat bagi pengembangan ilmu dan penelitian... 1.5. Orisinalitas……… 1.6. Potensi Hak Atas Kekayaan Intelektual………….. 1 6 7 7 7 7 7 8 8 8 8 8 BAB II TINJAUAN PUSTAKA ... 9
2.1. Tinjauan Pustaka... 2.1.1. Sindroma Nefrotik, Sindroma Nefrotik Resisten Steroid……….... 2.1.2. Hipertensi sebagai Luaran Klinis SNRS…… 2.1.3. Genotip MIF dan Respon terhadap Glukokortikoid ……….. 2.1.4. Peran Angiotensin II Regulasi Tekanan Darah………. 2.1.5. Angiotensin II sebagai Regulator MIF... 2.1.6. MIF dan Sensitivitas Glukokortikoid... 2.1.7. Hubungan Peningkatan MIF dan Angiotensin II dengan Kerusakan Ginjal …. 2.2. Kerangka Pemikiran, dan Premis ... 2.3 Kerangka Konsep Penelitian………. 2.4 Hipotesis Penelitian ………. 9 9 11 13 18 21 25 30 32 36 37 BAB III METODE PENELITIAN ... 39
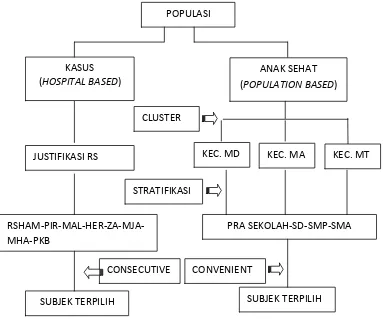
3.1 Desain Penelitian... 3.2 Tempat dan Waktu Penelitian ... 3.3 Populasi Penelitian dan Justifikasi... 3.4 Subjek Penelitian dan Cara Pemilihan Subjek …. 3.5 Estimasi Besar Sampel ...
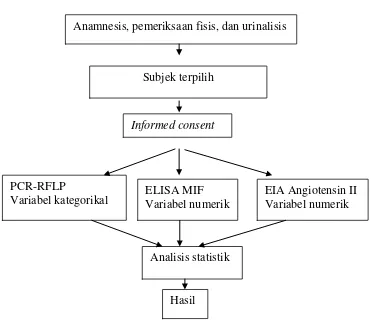
3.6 Kriteria Inklusi dan Eksklusi ... 3.6.1. Kriteria Inklusi untuk Kasus……… 3.6.2. Kriteria Inklusi untuk Grup Pembanding…… 3.6.3. Kriteria Eksklusi………. 3.7 Informed Consent dan Ethical Clearence... 3.8 Alur Kerja... 3.9 Data yang Dikumpulkan... 3.10 Pemeriksaan... 3.10.1. Pemeriksaan Antropometris……… 3.10.2. Pemeriksaan Fisis Tekanan Darah ………... 3.10.3. Pemeriksaan Proteinuria Kuantitatif……….. 3.10.4. Analisis Genotip Polimorfisme-173 G ke C
Gen MIF………. 3.10.5. Analisis Angiotensin II Plasma………. 3.10.6. Analisis MIF Serum………. 3.11 Identifikasi Variabel………. 3.12 Definisi Operasional……… 3.13 Pengolahan dan Analisis Data...
45 45 45 46 46 47 47 48 48 48 49 50 51 52 52 53 55
BAB IV HASIL PENELITIAN……….
4.1 Demografi Subjek Penelitian... 4.2 Distribusi dan Hubungan Alel C -173 Gen MIF Menurut Grup………. 4.3 Sebaran dan Hubungan Konsentrasi Angiotensin II Plasma dan MIF Serum Menurut Grup ………. 4.4 Korelasi Antara Angiotensin II dan MIF………. 4.5 Analisis Multivariat……… 4.6 Pengujian Hipotesis……….
56 56 58 61 62 63 66
BAB V PEMBAHASAN ……… 68
5.1 Polimorfisme -173 G Ke C Gen MIF Sebagai Faktor Risiko SNRS... 5.2 Kadar MIF Serum dan Antagonisme Steroid: Faktor Risiko SNRS ……….……… 5.3 Kadar Angiotensin II Plasma dan Hipertensi:
Faktor Risiko SNRS………. 5.4 Analisis Korelasi dan Multivariat Frekuensi Alel
MIF, Kadar Angiotensin II Plasma dan Kadar MIF Serum Secara Bersama sama dengan Hipertensi Terhadap Risiko SNRS……… 5.5 Hipertensi, Angiotensin II Sistemik dan Peranan
dalam Gangguan Struktur/Fungsi Ginjal………….. 5.6 Hubungan Sitokin MIF Terhadap Proteinuria
Menetap dan Gangguan Struktur/Fungsi Ginjal…. 5.7 Kelebihan dan Kelemahan Studi ...
68 72 74 76 80 82 84
BAB VI SIMPULAN DAN SARAN ………. 86
DAFTAR PUSTAKA... 88
DAFTAR TABEL
No Judul Halaman
1. Faktor Risiko Genetik Resisten Steroid pada SN………. 15 2. Asal Subjek Penelitian……… 56 3. Karakteristik Demografi Subjek Penelitian ……… 57 4. Perbedaan Frekuensi Hipertensi diantara Grup………… 57 5. Frekuensi Tata Laksana yang Diperoleh Subjek SN…… 58 6. Distribusi Antara Grup dan Frekuensi Alel………. 59 7. Hubungan Grup dengan Alel C -173 Gen MIF………….. 59 8. Kondisi Genotip Polimorfisme -173 G Ke C Gen MIF di
dalam Studi……….. 60
9. Hubungan Angiotensin II dan MIF Antara Grup ……….. 62 10. Analisis Bivariat Faktor Risiko Resisten Steroid pada
SN……….. 63
11. Model Pertama Keberadaan Resisten Steroid…………... 64 12. Model Kedua Keberadaan Resisten Steroid……….. 64 13. Nilai Kekuatan Interaksi Variabel Pada Model………….. 65 14. Perbandingan dengan Studi Lain tentang Frekuensi Alel
DAFTAR GAMBAR
No Judul Halaman
1. Hubungan Glomerulopati dengan Hipertensi ... 13 2. Struktur Gen MIF Manusia... 16 3. Hubungan antara MIF, Glukokortikoid dan
Inflamasi……… 17
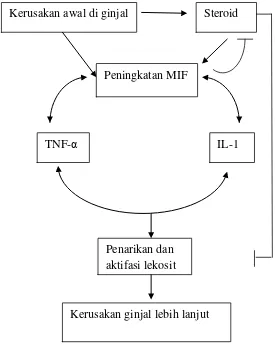
4. Struktur Tiga Dimensi MIF Manusia……… 25 5. Target Kerja Glukokortikoid dan MIF ……….. 28 6 Hubungan Peningkatan MIF dengan Kerusakan
Ginjal……… 31
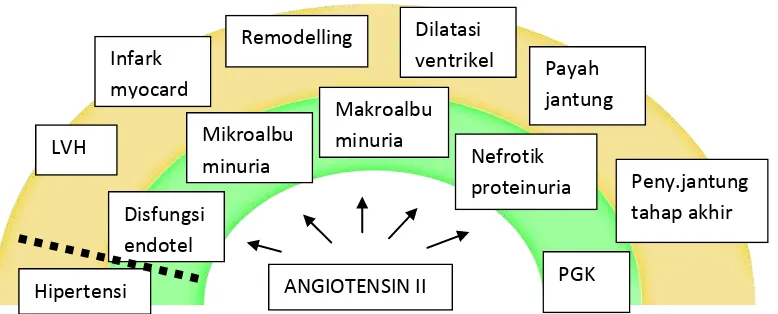
7. Peranan Angiotensin II dalam Kerusakan
Ginjal……….. 32
8. Kerangka Konsep Penelitian………. 38 9. Cara Pemilihan Subjek Studi………. 42 10. Alur Kerja ………..…………... 47 11. Gambaran Elektroforesis Produk PCR Setelah
Digesti dengan Enzim Alu I dari Ketiga Genotip… 60 12 Boxplot Kadar Angiotensin II pada Setiap Grup…. 61 13. Boxplot Kadar MIF pada Setiap Grup……….. 61 14. Scatter Plot Kadar MIF dan Angiotensin II………. 62 15. Ilustrasi Keadaan Respon Individu Terhadap
Steroid Dihubungkan dengan SNP -173 G Ke C
DAFTAR LAMPIRAN
No Judul Halaman
1. Tabel Tekanan Darah Anak Laki-laki... 102 2. Tabel Tekanan Darah Anak Perempuan………….. 103 3 Lembar Penjelasan Subjek/Orang Tua………. 104 4. Lembar Persetujuan Setelah Penjelasan... 106 5. Status Pemeriksaan... 107 6. Persetujuan Komite Etik……… 108
7. Prosedur Operasional Standar Pemeriksaan
Polimorfisme -173 G Ke C Gen MIF……….. 109 8. Prosedur Operasional Standar Pemeriksaan
Angiotensin II Plasma... 110 9. Prosedur Operasional Standar Pemeriksaan MIF
DAFTAR SINGKATAN DAN ISTILAH
ACE = Angiotensin converting enzyme
ACEI = Angiotensin converting enzyme inhibitor
ADH = Anti diuretic hormone
Ang II = Angiotensin II AP-1 = Activator protein-1
ARB = Angiotensin receptor blocker
AT1 AT
R = Angiotensin II type 1 receptor 2
bp = base pair
R = Angiotensin II type 2 receptor
CD = Cluster of differentiation
CDC = Centers for Disease Control and Prevention
cPLA2 = cytoplasmic phospho lipase A2
CREB = cAMP response element binding protein
CVO = Circumventricular organ
DNA = Deoxyribosa Nucleic Acid
EDTA = Ethylen diamine tetra acetate
eGFR = estimated glomerular filtration rate
EIA = Enzyme immune assay
ELISA = Enzyme linked immunosorbent assay
ERK 1/2 = Extracelllular signal-regulated kinase 1/2
ESCAPE = Effect of strict blood pressure control and ACE inhibition on the progression of CRF in pediatric patients
HPA = Hypothalamic pituitary axis
HTD = Hipertensi diastolik HTS = Hipertensi sistolik
IFN = Interferon
IK 95% = Interval kepercayaan 95% IκB = Inhibitor of NF-κB
IL = Interleukin
MAPK = Mitogen activated protein kinase
MDR-1 = Multi drug resistance-1
MHC = Major histocompatibility complex
MIF = Macrophage migration inhibitory factor
mRNA = massengers ribosa nucleic acid
Na K ATP ase= Natrium kalium adenosine tryphosphatease
NCHS = National Center for Health Statistics
NF-κB = Nuclear factor-κB
NHBPEP = National High Blood Pressure Education Program
NKF-K/DOQI= National Kidney Foundation Kidney Disease Outcomes Quality Initiative
NR3C1 = Nuclear receptor subfamily 3, group C, member 1
OR = Odds ratio
PCR-RFLP = Polymerase chain reaction-restriction fragment length polymorphism
PGK = Penyakit ginjal kronik rpm = round per minute
SB = Simpangan baku SN = Sindroma nefrotik
SNP = Single nucleotide polymorphism
SNRS = Sindrom nefrotik resisten steroid SNSS = Sindrom nefrotik sensitif steroid SRAA = Sistim renin angiotensin aldosteron SSP = Susunan saraf pusat
TDS = Tekanan darah sistolik TDD = Tekanan darah diastolik
Th = Thelper
TLR = Toll-Like receptor
TNF α = Tumor necrosis factorα
UACR = Urinary albumine creatinine ratio
ABSTRAK
Latar belakang: Penderita sindroma nefrotik resisten steroid (SNRS)
cenderung berlanjut ke penyakit ginjal tahap akhir. Alel C -173 gen MIF (macrophage migration inhibitory factor) berkaitan dengan gangguan keseimbangan sitokin MIF dengan glukokortikoid, sehingga penderita SN resisten terhadap terapi steroid. Studi in vitro menunjukkan sitokin MIF diatur oleh angiotensin II. Induksi regulasi MIF oleh angiotensin II memengaruhi perkembangan hipertensi.
Tujuan: Hubungan alel C -173 gen MIF dengan keberadaan MIF
serum dan pengaturan oleh angiotensin II plasma pada individu SNRS belum diketahui.
Metode: Studi sekat lintang dilakukan pada 120 anak (steroid resisten,
steroid sensitif dan anak sehat) sejak November 2011 hingga September 2012. Data yang dikumpulkan meliputi pemeriksaan fisis, tekanan darah, rasio albumin kreatinin urin, alel G atau C -173 gen MIF, MIF serum, dan angiotensin II plasma.
Hasil: Frekuensi alel C tiga kali lebih tinggi pada SNRS dibandingkan dengan SNSS dan anak sehat (OR 2,79;IK 95% 1,13 sampai 6,89). Kadar MIF serum lebih tinggi pada SNRS (median 31,9 kisaran 14,3 sampai 117,2 ng/mL) dibandingkan dengan kedua grup lain (p=0,04). Kelompok SNRS menunjukkan kadar angiotensin II plasma (median 22,7 kisaran 3,1 sampai 153,4 pg/mL) lebih tinggi dibandingkan dengan grup lain (p=0,01). Korelasi angiotensin II plasma dengan MIF serum adalah korelasi positif yang sangat lemah (rho = 0,27; p=0.003). Pada analisis multivariat ditemukan bahwa alel C, hipertensi sistolik, dan diastolik sebagai variabel yang bermakna terhadap risiko SNRS. Variabel angiotensin II plasma dan MIF serum memengaruhi secara nyata terhadap variabel hipertensi, apabila tidak dimasukkan ke dalam model, sehingga tetap dipakai sebagai model terbaik.
Simpulan: Frekuensi alel C, kadar angiotensin II plasma, dan MIF
serum lebih tinggi pada SNRS. Alel C, hipertensi sistolik, hipertensi diastolik, kadar angiotensin II plasma dan MIF serum merupakan model terbaik untuk analisis model keberadaan resisten steroid.
ABSTRACT
Background: Steroid-resistant nephrotic syndrome (SRNS) patients
tend to progress to end-stage renal disease (ESRD). The MIF high producer -173 C allele has been associated with alterations in balance between MIF and glucocorticoids; resulting in NS patients resistant to steroid therapy. In vitro studies demonstrate cytokine MIF is regulated by angiotensin II. Induction of MIF by angiotensin II affects the development of hypertension.
Aim: Relationship MIF gene -173 C allele with the presence of serum MIF and plasma angiotensin II regulation for the individual SRNS is unknown.
Methods: A cross-sectional study was conducted with 120 consecutive
children consisting of three groups (steroid-resistant, steroid-sensitive, and well children) between November 2011 and September 2012. Data were collected consist of physical examinations, blood pressure, urinary albumin-creatinine ratio, allele of -173 gene MIF, serum MIF and plasma angiotensin II.
Results: The C allele was three times more frequent in SRNS than
SSNS and well children (OR 2.79 95% CI 1.13 to 6.89). Group SRNS had significantly higher serum MIF (median 31.9 (14.3 to 117.2) ng/mL) compared to the levels in other groups (p=0.04). Marked increases in median plasma angiotensin II was observed in group SRNS (median 22.7 (3.1 to 153.4) pg/mL) compared with other groups (p=0.01). Plasma angiotensin II concentrations were very weak positive correlated with serum MIF (rho= 0.27; p=0.003). Although multivariate analysis found that the C allele, systolic and diastolic hypertension,as significant variables on the risk of SRNS, but variable levels plasma angiotensin II and serum MIF significantly affect variable hypertension, if not incorporated into this models.
Conclusions: C allele polymorphism of the -173 MIF gene, plasma
angiotensin II and serum MIF concentrations, are higher in SRNS. The C allele, systolic and diastolic hypertension, levels of plasma angiotensin II and serum MIF are the best fit model for steroid-resistant analysis models.
Key words: steroid-resistant nephrotic syndrome, polymorphism -173
BAB I
PENDAHULUAN
1.1 Latar Belakang
Sindroma nefrotik (SN) merupakan manifestasi glomerulopati yang
sering dijumpai pada anak. Sindroma nefrotik merupakan keadaan klinis
yang ditandai dengan proteinuria masif, hipoalbuminemia, edema dan
hiperkolesterolemia (Vogt dan Avner, 2007). Angka kejadian SN di
Amerika berkisar antara 2-7 kasus baru per 100.000 anak per tahun (Eddy
dan Symons, 2003). Anak-anak keturunan Asia Selatan memiliki tingkat
insidens 7,4 per 100.000 anak per tahun dan anak ras lain mencapai 1,6
per 100.000 anak per tahun (McKinney et al., 2001). Di Indonesia,
insidens SN dilaporkan 6 per 100.000 anak per tahun pada anak berusia
kurang dari 14 tahun (Wirya, 1992). Data penyakit ginjal anak di
Indonesia yang dikumpulkan dari tujuh Pusat Pendidikan Dokter Spesialis
Anak memperlihatkan bahwa SN merupakan penyakit yang paling sering
dijumpai (35%) di poliklinik nefrologi (UKK Nefrologi, 2008).
Luaran klinis penyakit ini bergantung pada umur saat presentasi,
gambaran histopatologis, keberadaan hematuria dan hipertensi, gangguan
fungsi ginjal, dan respons terhadap terapi steroid (Bagga dan Mantan,
2005). Prognosis SN pada anak berkorelasi dengan spektrum respons
terapi steroid, yaitu mulai dari SN sensitif steroid (SNSS) hingga SN
resisten steroid (SNRS). Kira-kira 90% anak dengan SN idiopatik sensitif
terhadap steroid (Cattran, 2000). Insidens kasus SNRS pada anak
mencapai 0,3 per 100.000 anak per tahun (Mc Kinney et al., 2001).
SNRS merupakan penyebab tersering penyakit ginjal tahap akhir
pada anak. Walaupun persentase penderita anak dengan SNRS kecil,
grup ini berisiko mengalami komplikasi ekstrarenal dan berkembang
menjadi penyakit ginjal tahap akhir (Niaudet et al., 2004). Prediksi
terhadap kemungkinan menjadi resisten terhadap steroid menjadi amat
penting bagi seorang anak penderita SN agar terhindar dari penyakit ginjal
tahap akhir dan biaya pengobatan yang cukup mahal.
Perkembangan studi tentang biologi sel dan molekular membantu
klinisi dalam menentukan respon terapi. Gen ataupun petanda protein
menjadi tujuan kajian tentang respon steroid pada SN (Yi dan He, 2006).
Adapun faktor yang diduga berpengaruh terhadap respon terapi steroid
adalah jumlah reseptor glukokortikoid dan faktor genetik (Haack et al.,
1999). Individu dengan perubahan gen macrophage migration inhibitory
factor (MIF) nukleotida tunggal G ke C (single nucleotide G to C
polymorphism) pada posisi -173 berisiko resisten terhadap terapi steroid
oleh karena hambatan glukokortikoid endogen dan penurunan respon
terhadap glukokortikoid eksogen. Hal ini menyebabkan individu dengan
polimorfisme G ke C rentan terhadap penyakit inflamasi yang seharusnya
dapat ditata laksana dengan steroid (Vivarelli et al., 2008; Aeberli et al.,
2006), dan berkaitan dengan perburukan fungsi ginjal (Vivarelli et al.,
2008). Polimorfisme secara fungsional berhubungan dengan ekspresi
secara in vivo (Donn et al., 2002). Walaupun demikian berbagai penelitian
di atas belum jelas menerangkan apakah polimorfisme -173 G ke C gen
MIF sebagai faktor risiko pada individu SNRS berhubungan dengan
peningkatan level MIF serum.
Macrophage migration inhibitory factor (MIF) merupakan suatu
sitokin yang bersifat pleiotrophic (suatu sitokin yang bekerja terhadap
berbagai jenis sel yang menimbulkan berbagai efek). Sumber utama MIF
berasal dari berbagai organ dan distribusinya hampir merata di seluruh
jaringan tubuh. Hal ini mendukung teori bahwa pelepasan MIF ke sirkulasi
darah terjadi dari penyimpanan MIF di intra sel (Lue, 2003). MIF tersimpan
pada sitoplasma sel dan pengeluarannya ke ekstrasel dirangsang oleh
berbagai faktor, misalnya oleh angiotensin II (Rice et al.,2003). Studi in
vitro menunjukkan bahwa pelepasan MIF dari intrasel diatur oleh
angiotensin II (Rice et al.,2003), tetapi penelitian in vivo tentang hal ini
belum ada.
Sumber utama MIF di ginjal berasal dari sel-sel glomerulus
terutama podosit dan sel-sel epitel tubulus (Hattori et al., 1999) Peranan
MIF dalam memicu kerusakan ginjal terjadi melalui dua cara yaitu
merangsang pembentukan banyak mediator inflamasi (IL-1B, TNF-α, IL-6, nitric oxide, reactive oxygen species) dan bekerja antagonis terhadap
glukokortikoid (Stosic et al., 2009). Apabila efek glukokortikoid tidak
bekerja pada sel-sel di ginjal, proses kerusakan ginjal akan berlanjut dan
ditandai dengan proteinuria menetap, walaupun setelah diberikan dosis
Efek MIF yang kedua ini menjadi dasar bagi penelitian
penyakit-penyakit yang menggunakan steroid sebagai terapi utama, termasuk juga
SN. Meskipun demikian, bukan berarti efek yang pertama tidak berperan
di dalam patogenesis SN karena efek yang pertama ini dipengaruhi oleh
gambaran/corak histopatologis penderita SN yang juga memunyai
peranan di dalam resistensi terapi steroid. Prosedur biopsi ginjal relatif
invasif pada anak-anak sedangkan pengukuran kadar MIF dalam darah
relatif kurang invasif sehingga dipakai untuk menerangkan peranannya
dalam antagonisme steroid.
Sitokin-sitokin proinflamasi, selain MIF, ditekan oleh aksi anti
inflamasi glukokortikoid. Sebaliknya, pelepasan sitokin MIF dipicu oleh
glukokortikoid dan selanjutnya, bekerja sebagai antagonis glukokortikoid
(Petrovsky et al., 2003; Lan,2008). Konsekuensi klinis hal ini adalah efek
glukokortikoid dapat dihambat oleh MIF apabila konsentrasi MIF serum
meningkat dan menyebabkan kerusakan pada ginjal tetap berlanjut.
Penelitian Yang et al.(1998) menemukan bahwa apabila efek MIF
dinetralkan secara imunologis,akan terjadi peningkatan kadar serum
kortikosteron endogen. Hal ini berkorelasi dengan perbaikan proteinuria,
dan perbaikan kerusakan histologis pada glomerulus. Apabila kadar MIF
serum terlalu meningkat (di atas 100 pg/mL), berarti telah terjadi
kerusakan ginjal yang berat. Hal ini dibuktikan oleh Bruchfeld et al.(2009)
bahwa kadar MIF serum pada penderita penyakit ginjal kronik derajat 3-5
(kerusakan ginjal berat) lebih tinggi secara bermakna dibandingkan
Glukokortikoid memicu pengeluaran MIF dari dalam sel dan
bersirkulasi di plasma. Apabila pengeluaran MIF telah terjadi maka ia
bekerja antagonis terhadap glukokortikoid. Aksi antagonis MIF terhadap
efek glukokortikoid diatur oleh angiotensin II (Gasparo et al., 2000),
Keberadaan angiotensin II di jaringan ginjal dipengaruhi oleh
pengambilan (uptake) angiotensin II dari sirkulasi ataupun dari
pembentukan lokal di jaringan ginjal. Kedua hal ini menyebabkan
peningkatan kadar angiotensin II di sirkulasi apabila terjadi atau
berlangsung secara terus menerus (van Kats et al., 2001).
Regulasi MIF oleh peningkatan angiotensin II menyebabkan
perkembangan hipertensi dan proteinuria (Rice et al., 2003; Busche et al.,
2001; Wolf et al., 2003). Hipertensi dan proteinuria pada penderita SNRS
memunyai peran penting dalam perburukan fungsi ginjal (Meer et al.,
2010).
Peranan MIF terhadap glukokortikoid ditunjukkan dengan model
tikus defisiensi MIF yang diperankan oleh tikus delesi gen MIF (MIFP ־ P/P
־ P). Sebaliknya, tikus transgenik memiliki kadar MIF yang berlebihan. Pada
tikus delesi gen MIF terjadi peningkatan sensitivitas glukokortikoid (Aeberli
et al., 2006a; Aeberli et al., 2006b).
Pada subjek manusia dengan alel C memiliki kadar MIF yang lebih
tinggi daripada subjek GG homozigot (Donn et al., 2002; De Benedetti et
al., 2003). Subjek penderita SN dengan alel C -173 gen MIF memiliki
risiko resisten terhadap steroid (Berdelli et al., 2005; Vivarelli et al., 2008).
II dan peningkatan kadar MIF sehingga resisten terhadap terapi steroid,
belum pernah diteliti (sepanjang pengetahuan peneliti). Oleh karena itu,
kami ingin meneliti tentang hubungan polimorfisme -173 G ke C gen MIF,
dengan peningkatan kadar angiotensin II plasma dan MIF serum secara
bersama-sama dengan hipertensi pada anak penderita SN resisten steroid
dibandingkan dengan penderita SN sensitif steroid dan anak sehat.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan, dapat dirumuskan
pertanyaan penelitian sebagai berikut:
1.2.1 Apakah frekuensi alel C -173 gen MIF lebih tinggi pada anak
SNRS dibandingkan dengan SNSS dan anak sehat?
1.2.2 Apakah kadar angiotensin II plasma lebih tinggi pada anak SNRS
dibandingkan dengan SNSS dan anak sehat?
1.2.3 Apakah kadar MIF serum lebih tinggi pada anak SNRS
dibandingkan dengan SNSS dan anak sehat?
1.2.4 Apakah terdapat korelasi positif antara kadar MIF serum dan
kadar angiotensin II plasma?
1.2.5 Apakah frekuensi alel C -173 gen MIF, peningkatan kadar
angiotensin II plasma, dan MIF serum secara bersama-sama
1.3 Tujuan Penelitian
1.3.1 Tujuan Umum
Menentukan dasar hubungan polimorfisme -173 G ke C gen MIF, dengan
kadar angiotensin II plasma, dan MIF serum terhadap respon steroid
sehingga pasien SNRS terhindar dari progresivitas ke arah gagal ginjal.
1.3.2 Tujuan Khusus
1.3.2.1 Menganalisis data frekuensi genotip polimorfisme -173 G ke C gen
MIF pada anak penderita SNRS, SNSS, dan anak sehat
1.3.2.2 Menganalisis sebaran kadar angiotensin II plasma pada anak
penderita SNRS, SNSS, dan anak sehat
1.3.2.3 Menganalisis sebaran kadar MIF serum pada anak penderita
SNRS, SNSS, dan anak sehat
1.3.2.4 Menganalisis korelasi kadar angiotensin II plasma dan MIF serum.
1.3.2.5 Menganalisis hubungan alel C -173 gen MIF, peningkatan kadar
angiotensin II plasma,dan kadar MIF serum secara bersama-sama
dengan hipertensi terhadap risiko SNRS
1.4 Manfaat Penelitian
Hasil penelitian ini diharapkan akan berguna bagi dunia ilmu pengetahuan
dan kehidupan anak. Adapun manfaatnya sebagai berikut:
1.4.1 Manfaat teori. Studi ini meningkatkan pemahaman dan
pengetahuan tentang patofisiologi SNRS sehingga membantu
1.4.2 Manfaat bagi masyarakat. Studi ini membantu perencanaan
strategi pengobatan lebih awal terhadap anak SNRS sehingga
dapat mengurangi komplikasi akibat pemberian steroid jangka
panjang.
1.4.3 Manfaat aplikatif. Studi ini membantu anak SNRS dalam
mendapatkan terapi agresif selain steroid.
1.4.4 Manfaat bagi pengembangan ilmu dan penelitian. Sebagai
rujukan penelitian berikutnya yang berkaitan dengan SN.
1.5 Orisinalitas
Berdasarkan penelusuran kepustakaan, peneliti belum menemukan
penelitian tentang peran polimorfisme -173 G ke C gen MIF disertai
peningkatan kadar angiotensin II plasma dan MIF serum secara bersama
sama dengan hipertensi sebagai faktor risiko SNRS.
1.6 Potensi Hak atas Kekayaan Intelektual
Peranan polimorfisme -173 G ke C gen MIF, peningkatan kadar
angiotensin II plasma, dan MIF serum secara bersama-sama dengan
hipertensi dapat membantu klinisi dalam penatalaksanaan anak SNRS
BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Pustaka
2.1.1 Sindroma Nefrotik, Sindroma Nefrotik Resisten Steroid
Sindroma nefrotik ditandai dengan gangguan selektif permeabilitas
kapiler glomerulus sehingga terjadi kehilangan protein melalui urin.
Proteinuria pada anak SN relatif selektif yang terdiri atas albumin dengan
kisaran nefrotik proteinuria mencapai 1000 mg/m2
Kejadian proteinuria merupakan kelainan dasar pada SN. Sebagian
besar proteinuria berasal dari kebocoran glomerulus (proteinuria
glomerular). Filter kapiler glomerulus terdiri atas tiga lapisan, yaitu endotel,
membran basalis, dan sel epitel (podosit) dengan foot processes serta slit
diafragma. Glomerulus memiliki muatan negatif (charge selective barrier)
akibat adanya residu asam sialat pada glikokaliks yang melapisi epitel dan
endotel, serta adanya proteoglikan heparan sulfat pada membran basalis.
Muatan negatif sangat berkurang pada penderita SN sehingga
kemampuan menahan protein yang bermuatan negatif berkurang pula.
Steroid dapat mengembalikan kandungan sialoprotein kembali normal
sehingga penderita SN mengalami remisi. Selain gangguan pada muatan
negatif, pendataran foot process (gangguan pada size selective barrier)
juga diduga menjadi sebab terjadinya kebocoran protein (Haycock, 2003; per hari atau rasio
protein kreatinin pada random (spot) urin mencapai 2 mg/mg (Bagga dan
Jalanko, 2003). Sel ini diduga mengalami perubahan morfologi selama
kejadian proteinuria.
Berbagai penelitian jangka panjang menunjukkan respon terhadap
pengobatan steroid lebih sering dipakai untuk menentukan prognosis
dibandingkan dengan gambaran patologi anatomi. Klasifikasi SN lebih
didasarkan pada respon klinik, yaitu SNSS dan SNRS. SN pada anak
85%-90% merupakan SNSS, hanya 10%-15% merupakan SNRS
(Niaudet, 1999), hal ini menunjukkan bahwa sebagian besar populasi
anak penderita SN dapat terhindar dari prosedur invasif.
Kelompok SNRS adalah penderita yang tidak mengalami remisi
setelah diberikan terapi steroid dalam waktu empat minggu. Kelompok ini
terbagi atas dua kategori, yaitu resisten steroid primer dan resisten steroid
sekunder (Niaudet, 1999; Fydryk dan Querfeld, 2002). Persentase
kelompok ini relatif kecil, tetapi dapat berkembang menjadi gagal ginjal
tahap akhir dalam waktu 1-4 tahun. Oleh karena itu prediksi terjadinya
resisten steroid menjadi isu yang penting (Niaudet, 1993).
Banyak hal yang berkaitan dengan prediksi resisten steroid pada
anak, walaupun demikian secara garis besar dibagi atas karakteristik klinis
dan histologis. Para klinisi cenderung menggunakan karakteristik klinis
untuk prediksi tersebut, misalnya umur saat presentasi pertama kali,
keberadaan hematuria dan atau hipertensi.
Umur saat presentasi pertama kali di bawah usia 1 tahun, setelah
usia 6 tahun atau setelah pubertas memiliki kemungkinan menjadi resisten
dan sangat jarang terjadi di bawah 6 bulan (Haycock,2003). Puncak
insidens SNSS maupun SNRS adalah umur prasekolah, sebanyak 80%
berumur kurang dari 6 tahun dengan median umur 2,5 tahun untuk SNSS
dan 6 tahun untuk SNRS (Niaudet,1999).
Begitu juga faktor hematuria dan atau hipertensi dapat menjadi
prediksi resisten steroid, masing-masing 30% dan 50%. Keadaan
hipertensi ditemukan pada 13% hingga 20,7% pada SNSS dan meningkat
menjadi 27% sampai 51,4% (masing masing untuk tekanan darah diastolik
dan tekanan darah sistolik) pada SNRS (ISKDC.,1978). Hematuria
mikroskopik ditemukan pada 22,7% kasus SNSS dan meningkat menjadi
67% pada SNRS (Niaudet,1999).
Kadar rasio protein kreatinin urin menjadi dasar bagi klinisi dalam
menentukan respon atau tidak terhadap terapi steroid. Penelitian Partini,
(2007) menemukan pasien SNRS mengalami kadar rasio protein kreatinin
urin yang berbeda secara bermakna bila dibandingkan dengan anak
tanpa penyakit ginjal ataupun anak dengan SN remisi (p<0,0001). Hal ini
menunjukkan bahwa rasio protein kreatinin urin pada pasien SNRS dapat
digunakan sebagai pedoman klinis respon terapi steroid.
2.1.2 Hipertensi sebagai Luaran Klinis SNRS
Hipertensi merupakan salah satu karakteristik klinik sebagai
prediksi resistensi steroid. Kemungkinan terjadinya resistensi steroid pada
anak SN yang mengalami hipertensi adalah 50%-60% (ISKDC, 1981;
Pengaturan tekanan darah amat dipengaruhi oleh pengaturan
volume cairan ekstrasel. Peningkatan volume cairan ekstrasel akan
meningkatkan volume darah dan tekanan darah sehingga pemantauan
jumlah cairan ekstrasel dilakukan dengan pemantauan tekanan darah.
Hipertensi pada SN ini diakibatkan perubahan aktivitas vasopresor atau
volume intravaskular, sedangkan aktivitas plasma renin dapat menurun
atau meningkat. Pada penurunan aktivitas plasma renin biasanya terjadi
retensi natrium, peningkatan volume ekstraselular, penurunan laju filtrasi
glomerulus dan normotensi. Pada penderita dengan peningkatan aktivitas
plasma renin memunyai volume arteri plasma efektif yang rendah dan laju
filtrasi glomerulus yang normal. Edema intrarenal menyebabkan
penurunan laju filtrasi glomerulus yang dapat menyebabkan ekspansi
volume plasma. Terapi kortikosteroid merupakan penyebab utama
hipertensi kronik karena kortikosteroid dapat meningkatkan respon
vaskular terhadap norepinefrin dan angiotensin II. Penderita hipervolemia
yang mengalami penurunan aktivitas plasma renin, lebih sering
mengalami hipertensi akibat terapi kortikosteroid (Gruskin et al., 1999).
Sebaliknya pada penderita hipovolemia dapat juga terjadi hipertensi akibat
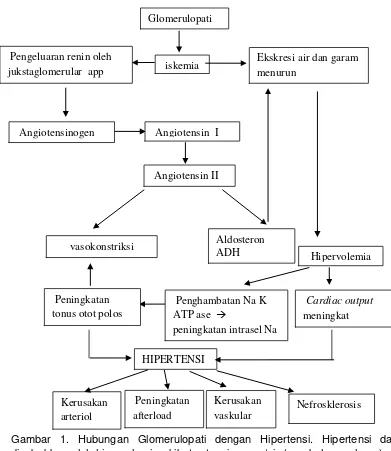
respon vasokonstriksi yang diperantarai oleh angiotensin (Gambar 1).
Respon peningkatan tekanan darah akibat angiotensin II ini dapat
diukur dengan kadar angiotensin II di plasma. Penelitian Vollard, et al.
(1999) menemukan bahwa solid phase immobilized epitope immunoassay
merupakan cara yang sensitif dan spesifik dalam pengukuran angiotensin
Gambar 1. Hubungan Glomerulopati dengan Hipertensi. Hipertensi dapat disebabkan oleh hipervolemia akibat retensi garam/air (perubahan volume) atau perubahan vasopresor oleh angiotensin II sekunder dari iskemia.
2.1.3 Genotip MIF dan Respon Terhadap Glukokortikoid
Perkembangan studi tentang biologi sel dan molekular berperan
dalam membantu klinisi menentukan respon terapi. Gen ataupun petanda
protein menjadi tujuan studi-studi respon terhadap steroid (Yi dan He,
2006). Faktor yang berpengaruh terhadap respon terapi steroid adalah vasokonstriksi
Glomerulopati
iskemia Ekskresi air dan garam menurun
Pengeluaran renin oleh jukstaglomerular app
Angiotensinogen Angiotensin I
Angiotensin II
Aldosteron
ADH Hipervolemia
Peningkatan tonus otot polos
Penghambatan Na K ATP ase
peningkatan intrasel Na
Cardiac output meningkat
HIPERTENSI
Kerusakan arteriol
Peningkatan afterload
Kerusakan vaskular
jumlah dan afinitas reseptor glukokortikoid yang rendah (Haack et al.,
1999)
Efek biologis glukokortikoid terjadi melalui ikatan glukokortikoid
dengan reseptor glukokortikoid di membran sel. Ekspresi reseptor
glukokortikoid dijumpai pada berbagai jenis sel, termasuk di podosit (Yan
et al.,1999). Konfigurasi kompleks glukokortikoid dengan reseptor
berfungsi mempertahankan reseptor glukokortikoid punya afinitas tinggi
terhadap glukokortikoid (Barnes,2010).
Perubahan protein atau perubahan kuantitas reseptor
glukokortikoid menyebabkan resisten terhadap glukokortikoid.
Kebanyakan pasien anak dengan SN idiopatik memiliki jumlah reseptor
glukokortikoid yang banyak sehingga sensitif terhadap steroid, sedangkan
mereka yang mengalami nefritik nefrosis memiliki jumlah reseptor yang
sedikit sehingga resisten terhadap steroid (Yi dan He, 2006). Kandidat gen
di bawah ini umumnya bekerja dengan cara perubahan protein ataupun
perubahan kuantitas reseptor glukokortikoid (Tabel 1).
Apabila jumlah reseptor glukokortikoid berkurang ataupun afinitas
terhadap reseptor berkurang, respon individu terhadap steroid akan
berkurang. Begitu juga bila ada fosforilasi reseptor yang memengaruhi
sensitivitas terhadap glukokortikoid ataupun adanya peningkatan isoform
reseptor β glukokortikoid (Pujols et al., 2002) yang menyebabkan terhambatnya pengikatan glukokortikoid oleh reseptor α glukokortikoid dan menurunnya respon terhadap terapi steroid (Wikstrom, 2003;Towers et al.,
Tabel 1. Faktor Risiko Genetik Resisten Steroid pada SN
Gen Peneliti Jumlah peserta
ACE insersi dan delesi
Sasongko, et al., 2005 85 kasus/ 68 kontrol
IL-4 Tripathi, et al., 2008 Acharya, et al., 2005
35 kasus/115 kontrol 84 kasus/ 61 kontrol IL-12 B Jan, et al., 2008 79 kasus/ 87 kontrol
IL-13 Wei, et al., 2005 72 kasus/78 kontrol
Paraoxonase-1 Biyikli, et al., 2006 55 kasus/ 30 kontrol
MIF Berdelli, et al., 2005 Vivarelli, et al., 2008
214 kasus/103 kontrol 257 kasus/353 kontrol Apolipoprotein E Kim, et al., 2003
Bruschi, et al.,2003
190 kasus/132 kontrol 139 kasus/70 kontrol MDR-1 Funaki, et al., 2008
Stachowski, et al., 2000
14 pasien 39 pasien
NR3C1 Cho, et al., 2009 190 kasus/100 kontrol
Hal ini menunjukkan bahwa respon individu terhadap glukokortikoid
banyak dipengaruhi oleh kontrol gen atau perubahan struktur molekular
reseptor glukokortikoid. Pemberian glukokortikoid pada individu dengan
respon yang rendah akan meningkatkan efek samping pemakaian obat ini
bahkan risiko keparahan penyakit akan meningkat.
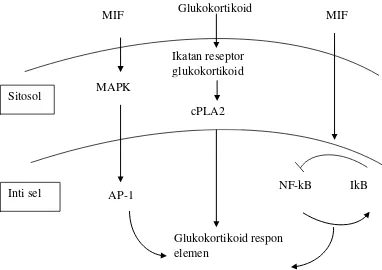
Posisi 5’ dari gen macrophage migration inhibitory factor (MIF)
mengandung elemen pengatur respon glukokortikoid (glucocorticoid
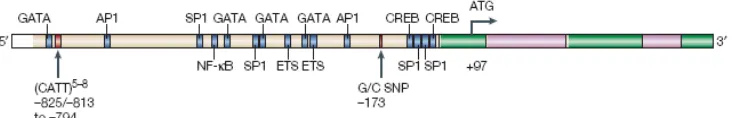
responsive element). Gen MIF pada genom manusia (Gambar 2) berlokasi
pada bagian long arm dari kromosom 22 (Arenberg dan Bucala, 2003;
Gambar 2. Struktur Gen MIF Manusia. Gen MIF mengandung tiga ekson pendek (107, 172, dan 66 pasangan basa) dan dua intron (188 dan 94 pasangan basa). Regio 5’ mempunyai dua polimorfisme yaitu pada posisi -794 dan -173 (Calandra dan Roger, 2003).
Individu dengan perubahan gen macrophage migration inhibitory
factor (MIF) nukleotida tunggal G ke C (single nucleotide G to C
polymorphism) pada posisi -173 memunyai risiko untuk resisten terhadap
terapi steroid. Hal ini menyebabkan individu dengan polimorfisme G ke C
rentan terhadap penyakit inflamasi yang seharusnya dapat ditata laksana
dengan steroid. Individu alel C dengan penyakit SN berisiko terjadinya
hambatan glukokortikoid endogen dan penurunan respon terhadap
glukokortikoid eksogen oleh MIF (Vivarelli et al.,2008).Peningkatan kadar
MIF menghalangi efek glukokortikoid (Gambar 3) sehingga proses
antiinflamasi glukokokortikoid tidak bekerja (Aeberli et al., 2006a).
Gen MIF diekspresikan pada berbagai tipe sel dan diatur oleh
berbagai stimuli. Genotip MIF individual akan mengatur respons fisiologis
MIF dan selanjutnya, mengatur kemampuan MIF dalam antagonistik efek
glukokortikoid. Skrining genotif MIF pada saat awitan penyakit penting Hal ini
memengaruhi perkembangan penyakit SN menjadi resisten steroid dan
dalam mengidentifikasi pasien yang membutuhkan terapi agresif selain
steroid (Vivarelli et al., 2008).
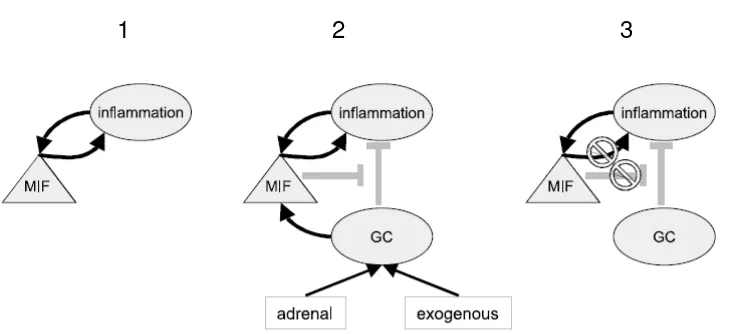
[image:44.595.127.492.162.329.2]1 2 3
Gambar 3. Hubungan antara MIF, Glukokortikoid dan Inflamasi. Gambar 3.1. Sitokin MIF mempengaruhi inflamasi begitu juga sebaliknya. 3.2. Glukokortikoid yang berasal dari adrenal maupun eksogen bekerja menghambat inflamasi, namun di sisi lain bekerja menginduksi MIF. 3.3. Efek MIF terhadap induksi glukokortikoid bekerja antagonis sehingga inflamasi terus berlangsung.
Aksi MIF dan efek terhadap glukokortikoid memberikan ide pada
berbagai penelitian untuk mencari variasi genetik MIF yang dapat
mempengaruhi ekspresi dan kegunaan fungsional. Glukokortikoid
endogen atau eksogen bekerja menghambat inflamasi, tetapi menginduksi
MIF, yang selanjutnya menghambat efek glukokortikoid. Antagonisme MIF
menghambat efek langsung MIF terhadap inflamasi dan kemudian,
menetralisasi antagonis glukokortikoid terhadap inflamasi (Morand, 2005).
Konsekuensinya adalah aktivitas MIF ini menjadi target potensial dalam
mengobati penyakit tersebut. Efek antagonis terhadap aksi glukokortikoid
memberikan efek yang menguntungkan terhadap netralisasi MIF bersama
Promoter MIF mengandung polimorfisme nukleotida tunggal G ke C
(single nucleotide G to C polymorphism) pada posisi -173. Studi Berdeli et
al., 2005 di Turki menemukan peran alel C merupakan faktor risiko terjadi
resisten steroid (OR= 3,6; 95 CI% 2,2 sampai 6,0). Penderita dengan
genotip CC menunjukkan umur yang lebih muda saat awitan proteinuria
dan berisiko lebih tinggi mengalami gangguan fungsi ginjal menetap
(OR=5,43, p=0,013). Penelitian lain oleh Vivarelli et al., 2008 menemukan
hubungan polimorfisme MIF dengan progresivitas menuju PGK tahap
akhir, ditunjukkan dengan analisis survival dalam 5 tahun sejak awitan
penyakit. Penderita SN dengan alel C mengalami luaran klinis yang lebih
jelek dibandingkan penderita SN dengan alel G .
Kedua penelitian tersebut di atas belum jelas menerangkan apakah
polimorfisme -173 G ke C gen MIF sebagai faktor risiko SNRS
berhubungan dengan level MIF serum. Polimorfisme secara fungsional
berhubungan dengan ekspresi MIF yang lebih tinggi secara in vitro dan
peningkatan level MIF serum secara in vivo (Donn et al., 2002). Penelitian
lain oleh De Benedetti,et al.(2003) pada penderita juvenil arthritis
menemukan kadar MIF serum lebih tinggi pada subjek yang memiliki alel
C (median 20,8 ng/ml) dibandingkan genotip GG (median 10,8 ng/ml)
(p=0.017), namun belum ada penelitian pada penderita SNRS.
2.1.4 Peran Angiotensin II Regulasi Tekanan Darah
Pengaturan tekanan darah di dalam tubuh dapat dibagi tiga bagian,
yaitu mekanisme cepat, jangka menengah, dan jangka panjang.
umpan balik baroreseptor, respons iskemik SSP, dan kemoreseptor.
Kombinasi ketiga mekanisme ini bekerja sangat kuat dan cepat dalam
mengatur tekanan darah. Selanjutnya, terdapat mekanisme kontrol
tekanan darah yang bersifat jangka menengah (dalam 30 menit sampai
dengan beberapa jam setelah pengaturan akut) yang diperankan oleh
mekanisme vasokonstriktor renin angiotensin; stres dan relaksasi
pembuluh darah; dan pergeseran cairan melalui dinding kapiler untuk
mengatur volume darah. Mekanisme kontrol tekanan darah yang bersifat
jangka panjang diperankan ginjal melalui mekanisme pengaturan volume
darah dan sistem renin angiotensin aldosteron (Guyton, 1991).
Dua hal utama yang mempengaruhi tekanan darah adalah curah
jantung dan tahanan sistemik vaskular. Keduanya diatur oleh kombinasi
mekanisme jangka pendek (termasuk intermediet) ataupun jangka
panjang. Mekanisme jangka pendek mengatur tahanan sistemik vaskular,
kapasitansi kardiovaskular, dan penampilan kardiak (frekuensi jantung
dan kontraksi). Pada mekanisme jangka panjang curah jantung diatur oleh
alir balik vena. Alir balik vena diatur oleh volume darah dan amat berkaitan
dengan volume cairan ekstrasel serta keseimbangan sodium (Navar dan
Hamm, 1999).
Regulasi jangka panjang tekanan darah berhubungan erat dengan
kemampuan ginjal dalam mengekskresikan sodium klorida untuk
mempertahankan balans sodium yang normal, volume cairan ekstrasel,
dan volume darah. Oleh karena itu, penyakit ginjal merupakan penyebab
akan terjadi interaksi umpan balik positif yang menyebabkan terjadinya
hipertensi progresif dan kerusakan ginjal lebih lanjut.
Peningkatan asupan sodium klorida pada orang normal
menyebabkan pengaturan mekanisme humoral, neural, dan parakrin
yang memengaruhi hemodinamik renal dan sistemik serta peningkatan
ekskresi sodium tanpa peningkatan tekanan darah. Apabila terjadi
penurunan ekskresi sodium, dapat menyebabkan peningkatan kronik
volume cairan ekstrasel dan volume darah sehingga terjadi hipertensi
(Navar dan Hamm,1999). Pengaturan ekskresi sodium dan air diperantarai
secara langsung dan tidak langsung oleh angiotensin II.
Pembentukan angiotensin II dimulai dari rangsangan terhadap
aktivasi pengeluaran renin yaitu apabila terjadi penurunan asupan sodium,
penurunan tekanan arterial, dan penurunan volume cairan ekstrasel
(Navar dan Hamm, 1999). Enzim renin ini akan memecah
angiotensinogen menjadi bentuk dekapeptida yang inaktif yaitu
angiotensin I selanjutnya diperantarai Angiotensin converting enzyme
(ACE) akan memecah angiotensin I menjadi angiotensin II suatu
oktapeptida yang aktif. Semua komponen SRAA tersebut membentuk
sistem endokrin bersirkulasi yang mengatur keseimbangan sodium dan
tekanan darah (Atlas et al., 2007; Carey et al., 2003).
Aksi angiotensin II dalam pengaturan cepat tekanan darah
diperankan oleh sifat vasokonstriksi langsung terhadap arteriol/vena
ataupun melalui aktivitas saraf simpatis (Hildebrant, 2007). Angiotensin II
menstimulasi sekresi hormon aldosteron oleh korteks adrenal yang juga
bekerja menurunkan ekskresi sodium dan air. Kedua efek ini cenderung
meningkatkan volume darah dan berperan penting dalam pengaturan
lambat tekanan darah (Victor, 2005). Angiotensin II juga memfasilitasi
aksi simpatis, yaitu melalui peningkatan norepinefrin dan katekolamin. Hal
ini menyebabkan peningkatan tahanan sistemik vaskular dan tekanan
darah (Paradis dan Schiffrin, 2009).
Efek peningkatan tekanan darah oleh angiotensin II ini, pada
jangka pendek berguna untuk proteksi kapilar renal dari kerusakan.
Sebaliknya, pada jangka panjang, keadaan ini menyebabkan
terganggunya aliran darah renal (renal blood flow), retensi garam dan air,
proteinuria dan penurunan laju filtrasi glomerulus (Kaplan, 2006).
2.1.5 Angiotensin II sebagai Regulator MIF
Angiotensin II merupakan suatu peptida dan dapat mencapai
/bekerja pada ginjal melalui tiga jalur, yaitu 1) melalui sirkulasi darah; 2)
melalui konversi angiotensin I menjadi angiotensin II dari aliran darah
yang terjadi pada sel endotelial ginjal, dan 3) melalui pembentukan lokal
angiotensin II di dalam ginjal. Organ target angiotensin II terletak di
adrenal, ginjal, otak, pituitary gland, otot polos vaskular, dan sistem nervus
simpatis (Gasparo et al., 2000) sehingga angiotensin II selain bekerja
pada organnya sendiri (autocrine hormone) dan organ yang berdekatan
(paracrine hormone) juga bekerja pada organ-organ yang jauh melalui
Efek angiotensin II pada keadaan SNRS sering dihubungkan
dengan keadaan hipertensi. Hipertensi merupakan salah satu luaran klinis
yang berhubungan secara bermakna dengan PGK (Kaplan dan
Lieberman,1990), termasuk juga pada penderita SNRS (Otukesh et
al.,2009). Regulasi tekanan darah oleh angiotensin II sistemik pada
penderita SN diatur bukan hanya di perifer (renal), tetapi juga di susunan
saraf pusat (DiBona,2001;Camici,2007).
Vasokonstriksi arteriol aferen dan eferen (terutama arteriol eferen)
menyebabkan terjadi peningkatan tekanan kapiler glomerulus.
Peningkatan tekanan kapiler intraglomerular menyebabkan kerusakan
mekanis pada ketiga tipe sel glomerulus (podosit, sel endotel, dan sel
mesangial), yang akan meningkatkan ukuran radius pori membran
glomerulus. Hal ini mengganggu fungsi selektif membran glomerulus dan
meningkatkan protein pada filtrat glomerulus. Protein ini akan
diendositosis oleh sel epitel tubulus. Sebaliknya, peningkatan reabsorbsi
albumin di tubulus akan mengaktivasi angiotensin, sehingga terjadi suatu
vicious circle. Apabila hal ini berkepanjangan,akan terjadi kerusakan
nefron bahkan terjadi kerusakan ginjal/ glomerulosklerosis (Kaplan,2006;
Meer et al., 2010).
Infus angiotensin II secara kronik pada binatang percobaan dengan
nefrosis berat menunjukkan terjadi hipertensi, peningkatan permeabilitas
kapiler glomerulus, dan peningkatan albuminuria (Herizi et al., 1998).
Hal ini menyebabkan peningkatan permeabilitas vaskular, induksi infiltrasi
lekosit, dan hipertensi sistemik.
Selain sebagai mediator hemodinamik yang menyebabkan
hipertensi, angiotensin II juga menyebabkan pengambilan/rekrutmen dan
proliferasi sel mononuklear. Pengambilan dan proliferasi sel monosit
bersirkulasi menyebabkan penumpukan makrofag di jaringan. Pengaturan
akumulasi makrofag di jaringan ini diperankan oleh sitokin MIF (Lan,
2008). Hal ini menstimulasi migrasi sel sel imunokompeten (limfosit dan
makrofag) ke dalam interstisial ginjal (Ruster dan Wolf, 2006). Penarikan
sel-sel inflamasi ke glomerulus dan tubulointerstisium berperan penting
dalam proteinuria persisten dan hipertensi. Peningkatan level angiotensin
II dapat menyebabkan hipertensi dan berkontribusi terhadap progresivitas
penyakit ginjal dengan cara menstimulasi inflamasi dan fibrosis ginjal
(Wolf et al., 2003).
Angiotensin II memperantarai akumulasi makrofag dan sel T
melalui MIF (Rice et al., 2003). Model tikus percobaan dengan hipertensi
menunjukkan peningkatan ekspresi MIF (44,9% ± 22,6%) dan sebaliknya,
blokade angiotensin II dengan antagonis AT1R (Irbesartan) menunjukkan
penurunan ekspresi MIF pada glomerulus dan tubulus (2,8% ± 2,4%). Efek
angiotensin II pada AT2R umumnya bekerja kontradiksi dibandingkan efek
pada AT1R (Carey dan Siragy, 2003). Peningkatan ekspresi MIF
berkorelasi dengan peningkatan makrofag atau sel T. Hal ini mendukung
Produksi sistemik ataupun lokal angiotensin II dan MIF penting
dalam perkembangan kerusakan ginjal. Pembentukan lokal angiotensin II
oleh sel mesangial ataupun makrofag setelah suatu kerusakan ginjal
menyebabkan sekresi MIF dari sel epitel tubulus kemudian meningkatkan
aktivasi makrofag dan sel T yang akan meningkatkan kerusakan ginjal
lebih lanjut, sedangkan, angiotensin II sistemik lebih berperan dalam hal
kerusakan ginjal melalui efek hipertensi seperti yang ditunjukkan dalam
binatang coba dengan hipertensi (one clip Goldblatt hypertension). Hal ini
menyebabkan ekspresi MIF meningkat pada ginjal (Rice et al., 2003).
Walaupun studi genetik belum menemukan kaitan kausalitas antara
plasma angiotensin II dan sekuens asam amino pada model tikus
hipertensi (Hubner et al., 1999), namun angiotensin II berkaitan dengan
peningkatan aktivasi NFkB dan AP-1(Ruiz-Ortega et al., 2001). Kedua
kompleks protein yang merupakan faktor transkripsi ini, menjadi dasar
bagi para ilmuwan menerangkan peranan angiotensin II pada ekspresi
gen sitokin.
Ekspresi gen MIF pada manusia diatur oleh angiotensin II melalui
regio promoter. Lokasi ini mempunyai sekuensial ikatan DNA untuk faktor
transkripsi seperti NFkB dan AP-1. Induksi angiotensin II terhadap faktor
transkripsi menyebabkan peningkatan ekspresi MIF (Sun et al., 2004) dan
berperan pada perkembangan hipertensi (Busche et al.,2001).
Konsekuensi klinis hal ini adalah peningkatan angiotensin II memengaruhi
2.1.6 MIF dan Sensitivitas Glukokortikoid
Dekade terakhir ini para ahli menemukan peranan MIF sebagai
sitokin dalam kerusakan ginjal (Lan, 2008). Sumber utama MIF berasal
dari sel imun (limfosit, makrofag, monosit, eosinofil, netrofil dan sel mast)
dan sel nonimun (ginjal, kelenjar pituitary, liver, ovarium, testis, dan
keratinosit). Pada tahun 1989, MIF untuk pertama kalinya berhasil
dikloning dari limfosit T manusia dan berfungsi untuk mengatur fungsi
makrofag, imunitas limfosit, dan fungsi endokrin.
Efek biologis uta