EFEKTIVITAS ISOLAT
Methylobacterium
spp. PADA
PERTUMBUHAN DAN PRODUKSI KEDELAI
MARIA
‘
AZIZAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Efektivitas Isolat
Methylobacterium spp. pada Pertumbuhan dan Produksi Kedelai adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2014 Maria ‘Azizah
RINGKASAN
MARIA ‘AZIZAH. Efektivitas Isolat Methylobacterium spp. pada Pertumbuhan
dan Produksi Kedelai. Dibimbing oleh ENY WIDAJATI, FAIZA C. SUWARNO dan BUDI NUGROHO.
Methylobacterium dikenal sebagai bakteri yang dapat menghasilkan zat pengatur tumbuh yaitu auksin, sitokinin dan giberelin. Bakteri Methylobacterium
dapat digunakan sebagai pupuk hayati karena zat pengatur tumbuh yang dihasilkan mampu menstimulasi perkecambahan benih, mematahkan dormansi benih, meningkatkan pertumbuhan tanaman dan meningkatkan hasil panen. Tujuan penelitian ini untuk mempelajari pengaruh aplikasi Methylobacterium pada viabilitas benih, pertumbuhan dan produksi tanaman kedelai.
Penelitian dilaksanakan dengan dua percobaan. Percobaan pertama dilakukan menggunakan rancangan acak lengkap dua faktor. Faktor pertama adalah aplikasi Methylobacterium yang terdiri atas tiga taraf yaitu kontrol (tanpa perendaman), perendaman dengan media AMS, dan perendaman dengan isolat
Methylobacterium. Faktor kedua adalah lama perendaman, yang terdiri atas empat taraf yaitu perendaman 15 menit, 30 menit, 45 menit dan 60 menit.
Percobaan kedua bertujuan untuk mengetahui pengaruh aplikasi isolat
Methylobacterium pada pertumbuhan dan produksi tanaman kedelai. Percobaan dilaksanakan menggunakan rancangan petak terbagi. Petak utama
Methylobacterium spp terdiri atas empat taraf, yaitu kontrol (tanpa penyemprotan), semprot media AMS tanpa isolat Methylobacterium spp dan aplikasi
Methylobacterium dengan penyemprotan pada 14 HST dan 28 HST. Anak petak adalah dosis pemupukan NPK terdiri atas empat taraf ( kontrol, 1/3, 2/3 dan dosis penuh). Dosis pupuk yang digunakan adalah 50 kg N ha-1, 100 kg P
2O5 ha-1 dan 100 kg K2O ha-1.
Hasil percobaan pertama menunjukkan bahwa perlakuan perendaman benih dengan isolat Methylobacterium tidak berpengaruh nyata terhadap viabilitas benih dengan tolok ukur daya berkecambah, indeks vigor, kecepatan tumbuh bobot kering kecambah normal dan rata rata bobot kecambah.
Hasil percobaan kedua menunjukkan bahwa aplikasi Methylobacterium dan pemupukan dosis penuh berpengaruh nyata pada peubah tinggi tanaman, jumlah daun, bobot kering tanaman, jumlah polong dan produksi dibandingkan dengan kontrol. Kelimpahan koloni Methylobacterium pada daun saat tanaman berumur 35 HST adalah 3.2 x 102 - 1.18x 104 cfu g-1 daun. Aplikasi isolat Methylobacterium dapat meningkatkan serapan N, P, dan K dibandingkan dengan kontrol. Kombinasi yang paling efektif pada pertumbuhan dan produksi kedelai adalah penyemprotan isolat Methylobacterium spp. pada tanaman dengan pemupukan NPK 1/3 dosis (16.5 kg N ha-1, 33.3 kg P
2O5 ha-1 dan 33.3 kg K2O ha-1).
SUMMARY
MARIA AZIZAH. Effectiveness of Methylobacterium spp Isolates on Soybean Growth and Yield. Supervised byENY WIDAJATI, FAIZA C. SUWARNO and BUDI NUGROHO.
Methylobacterium known of its plant growth regulators production such as auxin, cytokinins and gibberellins. The bacteria are used as a biological fertilizer or substance to stimulate seed germination, break seed dormancy, improve plant growth, and increase crop yields. The aim of this research was to study the effect of application Methylobacterium spp on seed germination, plant growth and yield of soybean.
The research consised of two exsperiment. The first experiment was arrange in completely randomized design by two factor. The first factor is the application of Methylobacterium that consist of 3 levels (control, soaking with AMS media, and soaking with Methylobacterium isolate). The second factor was soaking time that consist of 4 level (15, 30, 45 and 60 minutes soaking).
The second experiment aimed to determine the effect of Methylobacterium isolates applications on growth and yield of soybean. The experiment was arranged in split plot design. The main plot was divided to 3 level (control, foliar spray with AMS media, and foliar spray with Methylobacterium isolate at 14 and 28 DAS) and the The sub-plot consist of 4 level (control, 1/3, 2/3 and a rate of fertilizer). The full dose of fertilizer contain 50 kg N ha-1, 100 kg P2O5 ha-1 dan 100 kg K2O ha-1
The result of the first experiment showed that Methylobacterium isolate application by soaking seed can’t increase seed germination, vigor index, germination speed, and normal seedling dry weight.
Results of the second experiment showed that applications of Methylobacterium spp isolates and full dose of fertilizer significantly affected plant height, number of leaves, plant dry weight, number of pods and yield compare to control. The number of Methylobacterium colonies were observed on the leaves at 35 days after planting that were 3.2x102 – 1.18x104 cfu g-1 leaf. Applications of
Methylobacterium spp isolates can increase N, P, and K nutrien uptake compare to control. The most effective combination to increase soybean growth and yield was spraying Methylobacterium isolate on the leaf with 1/3 dose NPK fertilizer(16.5 kg N ha-1, 33.3 kg P
2O5 ha-1 dan 33.3 kg K2O ha-1).
©
Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu dan Teknologi Benih
EFEKTIVITAS ISOLAT
Methylobacterium
spp. PADA
PERTUMBUHAN DAN PRODUKSI KEDELAI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN
BOGOR
BOGOR
2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tesis yang berjudul “Efektivitas Isolat
Methylobacterium spp. pada Pertumbuhan dan Produksi Kedelai” disusun penulis sebagai syarat untuk memperoleh gelar master pada Program Studi Ilmu dan Teknologi Benih, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Kementrian Pendidikan dan Kebudayaan Republik Indonesia atas Beasiswa Unggulan (BU) yang penulis terima selama menempuh kuliah di Sekolah Pascasarjana IPB. Terima kasih kepada Ibu Dr. Ir. Eny Widajati, MS, Ibu Dr. Ir. Faiza C. Suwarno, MS dan Bapak Dr. Ir. Budi Nugroho, MSi selaku pembimbing atas bimbingan, saran dan waktu yang telah dicurahkan dalam penyelesaian karya ilmiah ini. Terima kasih kepada Prof. Dr. Ir. Munif Ghulamahdi selaku penguji luar komisi yang telah memberikan saran untuk perbaikan dalam penulisan karya ilmiah ini. Ucapan terima kasih juga penulis sampaikan kepada Ibu Dra. Selly Salma, MSi (Lab Biologi Tanah Balai Penelitian Tanah, Cimanggu Bogor) atas izin beliau menggunakan isolat Methylobacterium spp strain TD-J7 dan TD-TPB3 dalam penelitian ini. Terima kasih kepada staf Lab Biologi Tanah Balai Penelitian Tanah, Lab Benih Departemen Agronomi dan Hortikultura atas kerjasama selama penelitian ini. Ucapan terima kasih juga penulis sampaikan kepada Ayah, Ibu, dan Adik atas dukungannya kepada penulis selama menempuh studi. Kepada teman teman keluarga Ilmu dan Teknologi Benih angkatan 2011 terima kasih atas dorongan semangat yang telah diberikan.
Semoga karya ilmiah ini dapat memberikan manfaat kepada yang membutuhkannya.
Bogor, November 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 3
Methylobacterium spp. 3
Budidaya Kedelai dengan Agen Hayati 5
BAHAN DAN METODE 7
Alat dan Bahan Penelitian 7
Lokasi dan Waktu Penelitian 7
Prosedur Percobaan 7
HASIL DAN PEMBAHASAN 13
Percobaan 1. Pengaruh Perendaman Benih dengan Isolat
Methylobacterium spp. terhadap Viabilitas Benih Kedelai. 13 Percobaan 2. Uji efektivitas isolat Methylobacterium untuk
meningkatkan pertumbuhan dan produksi tanaman kedelai. 15
SIMPULAN DAN SARAN 21
Simpulan 21 Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 25
DAFTAR TABEL
1. Pengaruh perendaman dengan isolat Methylobacterium dan waktu
perendaman benih terhadap viabilitas benih. 13
2. Pengaruh interaksi perlakuan perendaman benih dengan isolat
Methylobacterium dan waktu perendaman terhadap Indeks Vigor
dan Bobot Kering Kecambah Normal. 14
3. Pengaruh aplikasi Methylobacterium dan tingkat pemupukan terhadap
pertumbuhan tanaman tolok ukur tinggi tanaman. 15
4. Pengaruh interaksi antara pemupukan dan aplikasi Methylobacterium
pada 28 HST pada tolok ukur tinggi tanaman. 16
5. Pengaruh aplikasi Methylobacterium dan tingkat pemupukan terhadap
jumlah daun. 17
6. Pengaruh aplikasi Methylobacterium dan tingkat pemupukan pada
bobot kering tanaman kedelai 17
7. Pengaruh aplikasi Methylobacterium dan tingkat pemupukan pada
tolok ukur jumlah polong, produksi dan produksi per tanaman. 18 8. Kelimpahan bakteri Methylobacterium daun kedelai pada 35 HST. 19 9. Serapan unsur N, P dan K jaringan tanaman kedelai. 20
DAFTAR GAMBAR
DAFTAR GAMBAR
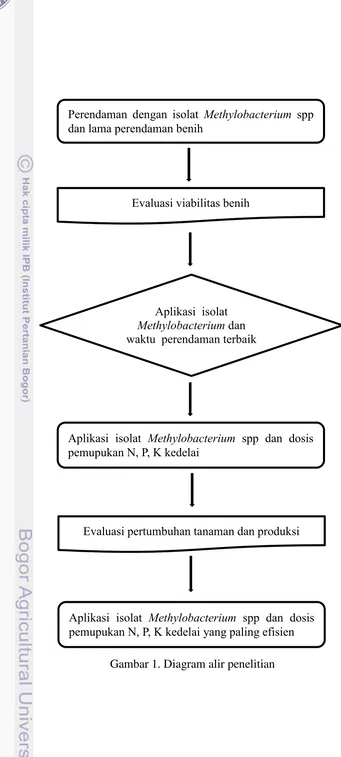
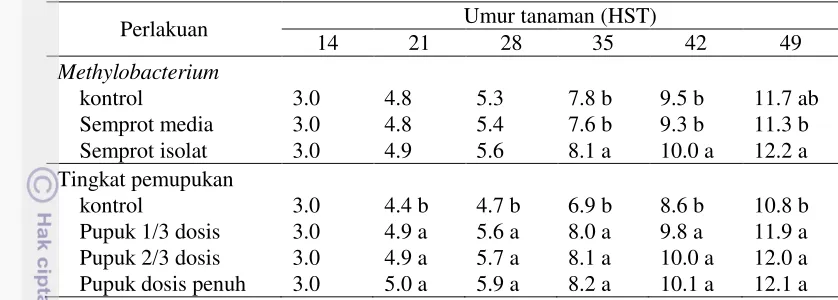
1. Diagram alir penelitian 8
2. Isolat Methylobacterium TD-J7 dan TD-TPB3 yang siap digunakan. 11
3. Koloni Methylobacterium spp 12
DAFTAR LAMPIRAN
1. Deskripsi kedelai varietas Kaba 25
2. Kadar IAA, Asam Giberelin dan Trans Zeatin pada 17 Suspensi Kultur
Methylobacterium spp. 26
3. Komposisi 1 L media Amonium Mineral Salt (AMS). 26
4. Komposisi Trace Element per 100 ml 27
5. Hasil analisis tanah awal percobaan 28
6. Hasil analisis tanah akhir percobaan 29
PENDAHULUAN
Latar Belakang
Kedelai (Glycine max L. Merril) termasuk komoditas pangan yang penting di Indonesia. Kedelai menjadi bahan baku berbagai bahan makanan dan industri sehingga kebutuhan kedelai dalam negeri setiap tahun tinggi. Produksi nasional kedelai tahun 2013 adalah 807,568 ton, dengan produktivitas 14.57 kuintal ha-1 (BPS 2013). Rata-rata produktivitas kedelai ini tergolong rendah jika dibandingkan dengan potensi produksi varietas kedelai yang ditanam. Kebutuhan kedelai berkisar antara 2- 3 juta ton per tahun dan hanya mampu memenuhi 36.59% kebutuhan kedelai per tahun sehingga 63.41% kebutuhan disuplai dari impor (Facino 2012). Kebutuhan kedelai tersebut akan semakin meningkat seiring dengan peningkatan jumlah penduduk Indonesia. Peningkatan kebutuhan kedelai ini harus diimbangi dengan peningkatan produktivitasnya.
Berbagai upaya dapat dilakukan untuk meningkatkan produksi kedelai nasional. Upaya yang dilakukan antara lain peningkatan areal penanaman kedelai, penggunaan benih unggul berdaya hasil tinggi, penggunaan varietas tahan cekaman lingkungan, penggunaan pemupukan yang tepat, serta peningkatan mutu benih dengan aplikasi mikroba maupun zat pengatur tumbuh. Benih bermutu merupakan salah satu komponen produksi yang menentukan keberhasilan suatu usaha pertanian untuk mendukung program ketahanan pangan. Teknologi alternatif untuk meningkatkan mutu benih dan bibit tanaman adalah melalui pemanfaatan mikroba yang dapat berasosiasi dengan tanaman serta berperan dalam meningkatkan viabilitas benih dan pertumbuhan tanaman.
Bakteri Methylobacterium spp atau dikenal sebagai Pink Pigmented Facultative Methylotroph (PPFM) adalah bakteri dari kelompok α-Proteobacteria yang merupakan mikrobiota normal pada filosfer pada hampir semua jenis tanaman, lumut dan paku-pakuan. Methylobacterium bersimbiosis dengan tanaman dengan memanfaatkan methanol yang dikeluarkan tanaman (Kutschera 2007 Schauer & Kutschera, 2011). Selain itu, Methylobacterium sp. dapat menstimulasi pertumbuhan tanaman dan perkecambahan benih, merangsang pertumbuhan akar, menstimulasi terbentuknya IAA, protein quinon dan vitamin B12 (Lidstrom & Christoserdova 2002) serta trans-zeatin (Koenig et al. 2002) dan dihydrozeatin ribosid (Ryu et al. 2006).
Aplikasi Methylobacterium dapat merangsang pertumbuhan akar padi (Senthilkumar et al. 2009) cabai dan tomat (Yim et al. 2010) serta meningkatkan ketegaran bibit cabai dan tomat (Deka Boruah et al. 2010). Methylobacterium spp. dapat meningkatkan viabilitas benih padi (Madhaiyan et al. 2004), kacang tanah (Madhaiyan et al. 2006), kedelai (Holland & Polacco 1994; Meenakshi & Savalgi 2009), cabai (Deka Boruah et al. 2009) dan kakao (Sadikin 2009). Aplikasi
Methylobacterium dapat merangsang pertumbuhan akar kecambah Ginko biloba
2
Penggunaan pupuk pupuk hayati berupa mikroba sangat penting untuk meningkatkan efisiensi pemupukan N. Pupuk hayati yang berasal dari mikroba penghasil hormon tumbuh dan anti patogen perlu digunakan untuk memperbaiki pertumbuhan dan perlindungan tanaman (Saraswati 2007). Isolat Methylobacterium
digunakan sebagai pupuk hayati karena mampu menghasilkan zat pengatur tumbuh tanaman. Methylobacterium spp strain TD-J7 dapat menghasilkan zat pengatur tumbuh auksin 9.13 ppm, trans-zeatin 74.37 ppm dan gibrelin 98.75 ppm dan pada isolat strain TD-TPB3 menghasilkan IAA 96.56 ppm, trans zeatin 33.14 ppm dan giberelin 129.83 ppm (Widajati et al. 2008).
Aplikasi PPFM secara signifikan meningkatkan pertumbuhan dan hasil tanaman kapas (Raja & Sundaran 2006), jagung semi (Rathika et al. 2009). Teknik aplikasi Methylobacterium spp isolat TD-TPB3 pada kedelai varietas Kaba dengan cara perendaman yang dilanjutkan dengan penyemprotan pada daun umur 10 HST + 20 HST meningkatkan tinggi tanaman 35 HST, bobot kering tajuk, bobot kering akar, jumlah polong, polong isi, bobot 100 butir dan produksi (Danial 2011). Aplikasi Methylobacterium spp TD-J7+TD-TPB3 direndam dan disemprot pada 15 HST dan 15+30 HST memberikan respon terhadap umur berbunga, jumlah bunga, bobot kering tajuk, jumlah polong bernas, polong hampa, jumlah biji, bobot biji dan produksi total yang sama dan nyata lebih tinggi dibandingkan tanpa aplikasi isolat (Hidayat 2014). Berdasarkan penelitian sebelumnya maka perlu dipelajari bagaimana efektivitas isolat Methylobacterium terhadap viabilitas benih, pertumbuhan dan produksi tanaman kedelai serta peranannya dalam meningkatkan efisiensi penggunaan pupuk NPK pada tanaman kedelai.
Tujuan Penelitian
1. Mempelajari efektivitas perendaman benih dengan isolat Methylobacterium
spp pada viabilitas benih kedelai.
3
TINJAUAN PUSTAKA
Methylobacterium spp.
Bakteri Methylotroph merupakan bakteri yang mempunyai lingkungan penyebaran yang luas, baik di air, tanah, udara maupun permukaan tanaman. Bakteri dari genus Methylobacterium sudah banyak diteliti sebagai salah satu contoh bakteri fakultatif methylotrof. Bakteri ini diklasifikasikan sebagai
α-proteo bacteria dan dapat tumbuh pada senyawa C1 seperti methanol dan metilalamin sebaik pada senyawa C2, C3, dan C4 (Lidstrom & Christoserdova 2002).
Methylobacterium spp dapat ditemukan pada permukaan daun tanaman nangka, rambutan, belimbing dan sawo (Ismail 2002), tanaman sayuran lalapan seperti poh-pohan, selada, kemangi, dan kecambah kacang hijau (Riupassa 2003). . Kelimpahan bakteri PPFM pada daun poh-pohan dan kemangi asal Bogor terdapat 104 cfu g-1 daun, kecambah kacang hijau (taoge) 8.75x102 cfu g-1 daun (Riupassa 2003), daun
Coelogyne pandurata (anggrek hitam), Curculigo latofolia (ulap doyo), Nepenthes
spp (kantung semar) dan Durio kutejensis (durian lai) asal Kalimantan Timur berkisar 103 cfu g-1 daun (Salma 2004), tanaman pangan (padi, jagung dan kedelai) serta tanaman hortikultura (mentimun, tomat, terong, cabai merah, gambas dan labu) berkisar 102-105 cfu g-1 tanaman (Salma et al. 2005). Isolasi dari beberapa daun clover merah dan gandum menunjukkan kelimpahan populasi PPFM menurun dari musim semi ke musim panas, namun meningkat lagi saat akhir musim panen (Omer 2004).
Methylobacterium spp berperan dalam meningkatkan viabilitas benih-benih yang telah lama disimpan dan bermutu rendah. Pada kondisi tercekam, terjadi peningkatan daya berkecambah benih sebesar 70% setelah diberi perlakuan inokulasi dengan suspensi kultur Methylobacterium sp. (Holland & Polacco 1994).
Methylobacterium spp menghasilkan Pyrrolo quinoline quinon (PQQ), berkarakteristik sebagai vitamin B12 dan antioksidan. PQQ efektif dalam melindungi mitokondria dari kerusakan akibat stress oksidatif, yang dapat menginduksi peroksida lemak, pembentuk protein karbonil, dan menonaktifkan fungsi mitokondria. Keberadaan PQQ dapat menghambat proses kemunduran benih (He et al. 2003). Selain itu terdapat spesies Methylobacterium yang dapat membentuk nodul pada akar yaitu Methylobacterium nodulans yang dapat bersimbiosis membentuk nodul pada legum dari genus Crotalaria (Sy et al. 2001; Jourand et al. 2004; Renier et al. 2008), legum spesies Lotononis bainesii, L. listii
dan L. solitudinis (Ardley et al. 2009), dan Crotalaria juncea dan Sesbania aculeata
(Madhaiyan et al. 2009).
Hasil ekstraksi tanaman cabai yang diberi perlakuan Methylobacterium
4
et al. 2006). Aplikasi Methylobacterium oryzae secara signifikan menunjukkan peningkatan akumulasi trans-zeatin dan dihidrozeatin ribosid pada ekstrak tanaman cabai dan tomat (Yim et al. 2010).
Kutschera (2007) menyatakan bahwa mekanisme hubungan simbiosis antara tanaman dengan Methylobacterium adalah Methylobacterium spp memanfaatkan produk buangan dari tanaman yang berupa methanol sebagai sumber energinya. Mikroba menghasilkan sitokinin dan auksin yang disekresikan keluar tubuhnya, yang selanjutnya dimanfaatkan oleh tanaman untuk menstimulasi pertumbuhan.
Isolat Methylobacterium banyak dimanfaatkan untuk menstimulasi perkecambahan dan meningkatkan viabilitas benih. Isolat TD-TPB3 memberikan pengaruh terbaik pada viabilitas benih kakao dibanding isolat lainnya yang ditunjukkan oleh daya berkecambah (73.78 %), kecepatan tumbuh (0.2 % etmal-1) dan bobot kering tajuk (4.27 g) (Sadikin 2009). Aplikasi Methylobacterium spp pada tahap persemaian dapat meningkatkan daya tumbuh bibit dan keserempakan tumbuh secara nyata, juga dapat meningkatkan jumlah gabah bernas per malai dan bobot gabah bernas per rumpun (Safariyah 2009). Selain itu isolat TD-TPB3 dapat meningkatkan viabilitas dan vigor benih padi pada parameter KCT sebesar 13.55% KN etmal-1 menjadi 18.66% KN etmal-1 dan indeks vigor 22.67% menjadi 70.67% pada benih dengan viabilitas awal sedang (Kurniati 2009).
Pemanfaatan isolat Methylobacterium spp sebagai bahan untuk mematahkan dormansi fisiologis benih padi (after ripening) telah dilakukan pada beberapa varietas padi. Isolat Methylobacterium spp dapat mematahkan dormansi benih padi varietas Ciherang pada pada after ripening 5 minggu (Amin 2008), mematahkan dormansi benih padi pada minggu ke-2 after ripening (Safariyah 2009).
Perendaman benih padi dengan isolat Methylobacterium dapat meningkakan pertumbuhan tanaman dengan meningkatkan jumlah daun dan anakan. Hasil penelitian Wibowo (2011) menunjukkan bahwa perlakuan perendaman benih padi sawah varietas Ciherang dengan campuran isolat Methylobacterium spp. TD-J10 dan TD-TPB3 merupakan perlakuan yang menghasilkan jumlah daun terbanyak yaitu 30 helai pada 6 MST dan 36 helai pada 7 MST. Kombinasi antara perlakuan perendaman benih dengan pemupukan dosis penuh memberikan hasil jumlah daun terbanyak pada 6 MST sejumlah 41 helai dan pada 7 MST sejumlah 51 helai. Kombinasi antara perlakuan perendaman benih dengan pemupukan dosis penuh menunjukkan jumlah anakan terbanyak 12 anakan pada 6 MST dan 15 anakan pada 7 MST.
Isolat Methylobacterium dapat dimanfaatkan sebagai bahan invigorasi benih. Invigorasi adalah peningkatan kembali vigor benih yang telah menurun dengan memanfaatkan berbagai macam bahan yang dapat menstimulasi perkecambahan. Isolat bakteri Methylobacterium spp TD-G3 dapat digunakan untuk invigorasi benih padi varietas IR-64 dengan viabilitas awal 70% dengan meningkatkan kecepatan tumbuh 9.98 %. Pada benih dengan viabilitas awal 82% dengan isolat TD-J7, TD-G3, TD-J10, TD-TPB3, dan TD-L2 dapat meningkatkan kecepatan tumbuh masing masing sebesar 11.14%, 11.31%, 11.75%, 12.45%, dan 13.13% (Fitriarini 2008).
5 kedelai dengan Methylobacterium terbukti efektif untuk meningkatkan nilai indeks vigor benih kedelai varietas Argomulyo dengan DB awal 78-94% sehingga mendapatkan hasil indeks vigor rata-rata sebesar 8.9-20.6 % dan panjang hipokotil meningkat 1.5-2.5 cm dibandingkan kontrol. Selain itu, pada coating benih untuk penyimpanan dengan formula arabic gum, arabic gum+tokoferol 800 ppm, dan arabic gum+TD-TM3 secara konsisten dapat mempertahankan viabilitas benih sampai dengan periode simpan 6 bulan yang nyata lebih tinggi dibandingkan kontrol berdasarkan kecepatan tumbuh (KCT) dan daya berkecambah (DB) serta memiliki nilai vigor (IV) yang tidak berbeda nyata dengan kontrol.
Hasil penelitian Deka Boruah et al. (2010) inokulasi Methylobacterium sp dengan aktivitas 1-aminocyclopropane-1-carboxylate Deaminase (ACCD)+IAA atau tanpa IAA meningkatkan ketegaran bibit cabai dan tomat yang terlihat dari rata-rata panjang nodul dan bobot spesifik daun, namun pengaruh ini setara dengan aplikasi IAA dengan konsentrasi yang rendah.
Budidaya Kedelai dengan Agen Hayati
Perlakuan benih dengan mikroba dapat melindungi tanaman tidak hanya pada tahap pembibitan atau pesemaian, tetapi selama siklus hidup tanaman tersebut (Copeland & McDonald 2001). Pada budidaya kedelai, khususnya di lahan kering, penggunaan pupuk kimia perlu dibarengi dengan pupuk mikroba. Penggunaan pupuk mikroba, sangat penting untuk meningkatkan efisiensi pemupukan N. Pupuk mikroba penghasil hormon tumbuh dan anti patogen perlu digunakan untuk memperbaiki pertumbuhan dan perlindungan tanaman (Saraswati 2007). Mikroba berguna (effective microorganism) sebagai komponen habitat alam mempunyai peran dan fungsi penting dalam mendukung terlaksananya pertanian ramah lingkungan melalui berbagai proses, seperti dekomposisi bahan organik, mineralisasi senyawa organik, fiksasi hara, pelarut hara, nitrifikasi dan denitrifikasi. Dalam aliran pertanian input organik, mikroba diposisikan sebagai produsen hara, tanah dianggap sebagai media biosintesis, dan hasil kerja mikroba dianggap sebagai pensuplai utama kebutuhan hara bagi tanaman. Semakin tinggi populasi mikroba tanah semakin tinggi aktivitas biokimia dalam tanah dan semakin tinggi indeks kualitas tanah (Saraswati & Sumarno 2008).
Beberapa jenis Methylobacterium berhubungan dengan metabolisme nitrogen pada tanaman dengan menggunakan urease bakteri (Holland & Pollaco 1992). Beberapa strain Methylobacterium dapat mengefisienkan fiksasi nitrogen dengan membentuk bintil pada simbiosis dengan tanaman kacang-kacangan (Sy et al. 2001). Beberapa strain bakteri Methylobacterium sp. dapat menghasilkan sitokinin trans-zeatin yang disekresikan pada media kultur yang dapat menstimulasi perkecambahan benih kedelai (Koenig et al. 2002).
Inokulasi isolat bakteri Methylobacterium yang dikombinasikan dengan
6
benih kedelai juga dapat meningkatkan bobot tanaman, jumlah daun dan berat kering akar dengan penanaman dalam pot di rumah kaca (Radha et al. 2009).
Bintil akar kedelai meningkat pada hari ke 45 dan 60 setelah tanam pada perlakuan inokulasi Methylobacterium sp. dan B. japonicum pada benih dan ditambah penyemprotan dibandingkan dengan perlakuan inokulasi benih menggunakan Bradyrhizobium japonicum saja. Total bobot kering kedelai meningkat 41.67% pada perlakuan inokulasi Methylobacterium sp. dan B. japonicum dengan penyemprotan pada 20, 30 dan 45 hari dibandingkan dengan kontrol. Total bobot kering kedelai meningkat 41.67% pada perlakuan inokulasi
Methylobacterium sp. dan B.japonicum dengan penyemprotan pada 20, 30 dan 45 hari dibandingkan dengan kontrol (Meenakashi & Savalgi 2009).
Pengaruh Methylobacterium oryzae CBMB20 pada pertumbuhan tanaman signifikan pada perlakuan pemupukan cabai yang lebih rendah. Pertumbuhan tanaman cabai tidak berbeda nyata pada perlakuan pemupukan 100% dan 300% pada tanaman yang diberi perlakuan Methylobacterium oryzae CBMB20 dan penyemprotan 1% methanol. Dengan aplikasi Methylobacterium oryzae CBMB20 dan penyemprotan methanol maka aplikasi pemupukan dapat dikurangi tanpa adanya penurunan akumulasi biomassa dan daya hasil tanaman (Chauhan et al. 2010).
BAHAN DAN METODE
Alat dan Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah benih kedelai varietas Kaba dengan dengan deskripsi varietas pada Lampiran 1. Viabilitas awal benih yang digunakan adalah 90%. Isolat bakteri Methylobacterium spp. yang digunakan adalah strain TD-J7 dan TD-TPB3 koleksi Laboratorium Biologi Tanah Balai Penelitian Tanah Cimanggu, Bogor. Isolat bakteri Methylobacterium spp TD-J7 diisolasi dari permukaan daun jagung dan TD-TPB3 diisolasi dari permukaan daun terong bulat (Lampiran 2). Media perbanyakan bakteri adalah media selektif
Amonium Mineral Salt (AMS) cair dan media AMS padat untuk pengamatan populasi bakteri dengan komposisi pada Lampiran 3 dan Lampiran 4. Bahan lain yang digunakan antara lain akuades, bacto agar, alkohol, media pengecambahan benih kertas stensil, kantong plastik, polybag, media tanam tanah, pupuk Urea, SP-36 dan KCl. Peralatan yang digunakan dalam penelitian meliputi alat pengecambah benih tipe IPB 72-1, water bath sonicator, autoclave, laminar air flow, cawan petri, pipet volumetrik, bunsen, hand sprayer, erlenmeyer, autoklaf, pHmeter, timbangan analitik, oven, dan alat pertanian.
Lokasi dan Waktu Penelitian
Percobaan pertama dilakukan di Laboratorium Kesehatan Benih Departemen Agronomi dan Hortikultura Institut Pertanian Bogor. Perbanyakan bakteri dilakukan di Laboratorium Biologi Tanah, Balai Penelitian Tanah, Cimanggu Bogor. Penanaman dilakukan di rumah kaca Kebun Percobaan Cikabayan University Farm Institut Pertanian Bogor. Penelitian dilakukan mulai bulan Desember 2012 sampai Juli 2013.
Prosedur Percobaan
8
Gambar 1. Diagram alir penelitian
Aplikasi isolat Methylobacterium spp dan dosis pemupukan N, P, K kedelai yang paling efisien
Perendaman dengan isolat Methylobacterium spp
dan lama perendaman benih
Evaluasi viabilitas benih
Aplikasi isolat
Methylobacterium dan waktu perendaman terbaik
Aplikasi isolat Methylobacterium spp dan dosis pemupukan N, P, K kedelai
9 Percobaan 1. Pengaruh Lama Perendaman Benih dengan Isolat
Methylobacterium spp. terhadap Viabilitas Benih Kedelai.
Penelitian ini bertujuan untuk mengetahui efektivitas isolat
Methylobacterium spp terhadap viabilitas benih kedelai. Percobaan dilaksanakan menggunakan rancangan acak lengkap (RAL) 2 faktor. Faktor pertama adalah media perendaman benih yang terdiri dari tiga taraf, yaitu (1) tanpa perendaman, (2) perendaman dengan media AMS, (3) perendaman dengan isolat
Methylobacterium sp. Faktor kedua adalah waktu perendaman yang terdiri atas 4 taraf, yaitu: 15 menit, 30 menit, 45 menit dan 60 menit perendaman benih. Percobaan diulang 3 kali. Setiap satuan percobaan ditanam 50 butir benih. Isolat
Methylobacterium yang digunakan dalam percobaan adalah campuran isolat TD-J7 dan TD-TPB3. Isolat yang digunakan untuk perendaman benih adalah 25 mL campuran isolat TD-J7 dan TPB-3 untuk 50 butir benih.
Model liner percobaan adalah: Yijk= µ + αi + βj + (αβ)ij + εijk
Yijk : Nilai pengamatan pada faktor perendaman benih ke-i faktor waktu perendaman ke-j dan ulangan ke-k
µ : Nilai rata-rata umum
αi : Pengaruh perlakuan perendaman benih ke-i (i= 1, 2, dan 3)
βj : Pengaruh perlakuan waktu perendaman ke-j, (i= 1, 2, 3, dan 4)
(αβ)ij : Interaksi antara perlakuan perendaman benih dan waktu perendaman.
εijk : Pengaruh galat percobaan
Percobaan dilakukan di laboratorium dengan uji kertas digulung didirikan dalam plastik (UKDdp). Kertas yang digunakan adalah kertas stensil ukuran folio. Setiap gulungan ditanam 25 butir benih sehingga setiap satuan percobaan ditanam 2 gulungan. Gulungan selanjutnya disimpan pada alat pengecambah benih IPB 72-1. Pengamatan perkecambahan dilakukan pada 3 dan 5 hari setelah tanam. Tolok ukur yang diamati adalah daya berkecambah benih (DB), indeks vigor (IV), kecepatan tumuh (KCT) dan bobot kering kecambah normal (BKKN).
Daya berkecambah benih dan indeks vigor dihitung dengan rumus:
DB = KN1+KN2 × 100%
Jumlah benih yang ditanam
IV = KN1 × 100%
Jumlah benih yang ditanam
Keterangan: DB = Daya berkecambah benih (%), IV = indeks vigor (%), KN1 = jumlah kecambah normal pada hitungan pertama (3 HST), KN2 = jumlah kecambah normal pada hitungan kedua (5 HST)
10
KCT =
% KN ke-1
+ ... +
% KN ke-n
etmal etmal
Keterangan : % KN ke-1 : Persentase jumlah kecambah normal pada hari ke-1 setelah tanam dan % KN ke-n : Persentase Jumlah kecambah normal pada pengamatan terakhir.
Pengamatan Bobot Kering Kecambah Normal (BKKN) dilakukan dengan mengukur bobot kering kecambah yang tumbuh dengan normal pada hari terakhir penghitungan kecambah. Kecambah yang tumbuh normal pada hari ke-5 dicabut dari media, kotiledonnya dibuang, dimasukkan dalan kantong kertas, selanjutnya dikeringkan menggunakan oven suhu 60 ºC selama 3x24 jam. Kecambah yang telah kering lalu ditimbang sebagai bobot kering kecambah normal. Selain itu dilakukan pengamatan rata rata bobot kecambah dengan menghitung BKKN yang dibagi dengan jumlah kecambah normal yang tumbuh pada hari ke-5.
Percobaan 2. Uji efektifitas isolat Methylobacterium untuk meningkatkan pertumbuhan dan produksi tanaman kedelai.
Percobaan ini bertujuan untuk mengetahui pengaruh aplikasi isolat
Methylobacterium dan tingkat pemupukan pada pertumbuhan dan produksi tanaman kedelai. Rancangan yang digunakan dalam percobaan adalah rancangan petak terbagi (split plot). Petak utama adalah aplikasi isolat Methylobacterium spp yang terdiri dari tiga taraf, yaitu kontrol (tanpa penyemprotan), penyemprotan dengan media AMS dan aplikasi Methylobacterium dengan penyemprotan di permukaan tanaman saat tanaman berumur 14 dan 28 HST.
Anak petak adalah tingkat pemupukan NPK terdiri atas empat taraf, yaitu P0: kontrol (tanpa pemupukan NPK), P1: pemupukan NPK 1/3 dosis, P2: pemupukan NPK 2/3 dosis dan P3: pemupukan NPK dosis penuh. Dosis penuh pupuk NPK yang digunakan adalah 50 kg N ha-1, 100 kg P2O5 ha-1 dan 100 kg K2O ha-1. Percobaan diulang tiga kali sehingga didapatkan 36 satuan percobaan. Model rancangan percobaan yang digunakan adalah :
Yijk= µ + αi + βj + (αβ)ij + ρk+ (αρ)ik+ εijk
Yijk : Nilai pengamatan pada kelompok ke-i, aplikasi Methylobacterium ke-j, dan pemupukan ke-k
µ : Nilai rata-rata umum
αi : Pengaruh kelompok ke-i (j= 1, 2, dan 3)
βj : Pengaruh perlakuan petak utama ke-j, (i= 1, 2, 3, dan 4)
(αβ)ij : Interaksi antara perlakuan petak utama dan kelompok
ρk : Pengaruh anak petak ke-k (k= 1, 2, 3, 4, dan 5)
(αρ)ik : Pengaruh interaksi anak petak dan kelompok
εijk : Pengaruh galat percobaan pada aplikasi Methylobacterium ke-i, kelompok ke-j dan pemupukan ke-k
11 Pertumbuhan tanaman yang diamati antara lain tinggi tanaman, jumlah daun, jumlah cabang. Komponen produksi yang diamati antara lain jumlah polong, bobot biji per tanaman dan total produksi. Selain itu dilakukan pula pengamatan populasi isolat bakteri sebelum penyemprotan, kelimpahan bakteri setelah dilakukan penyemprotan kedua, dan serapan NPK.
Media tanam yang digunakan dalam penanaman kedelai di rumah kaca adalah top soil sebanyak 5 kg (berat kering udara). Setiap satuan percobaan ditanam 6 polybag kedelai. 2 polybag digunakan untuk pengamatan efisisensi pemupukan dan 4 polybag digunakan untuk pengamatan pertumbuhan dan produksi tanaman. Media tanam ditambahkan kapur sejumlah 20 kgL-1. Penentuan jumlah kapur berdasarkan hasil analisis awal tanah yang tercantum dalam Lampiran 5.
Perbanyakan bakteri
Prosedur pertama yang dilakukan sebelum pelaksanaan percobaan adalah perbanyakan isolat Methylobacterium spp. Isolat yang digunakan adalah campuran TD-J7 dan TD-TPB3. Perbanyakan kedua isolat dilakukan secara terpisah. Kegiatan perbanyakan isolat Methylobacterium spp diawali dengan pembuatan media kultur yaitu media AMS cair dengan bahan seperti yang tercantum pada Lampiran 3 dan Lampiran 4. Media yang telah siap selanjutnya diukur tingkat keasaman (pH) 7 menggunakan pHmeter. Media dituang dalam tabung erlenmeyer lalu disterilisasi dalam autoclave pada tekanan 1 atmosfer dan suhu 121oC selama 2 jam. Untuk pembuatan media AMS padat ditambahkan agar sebanyak 20 g L-1 media cair.
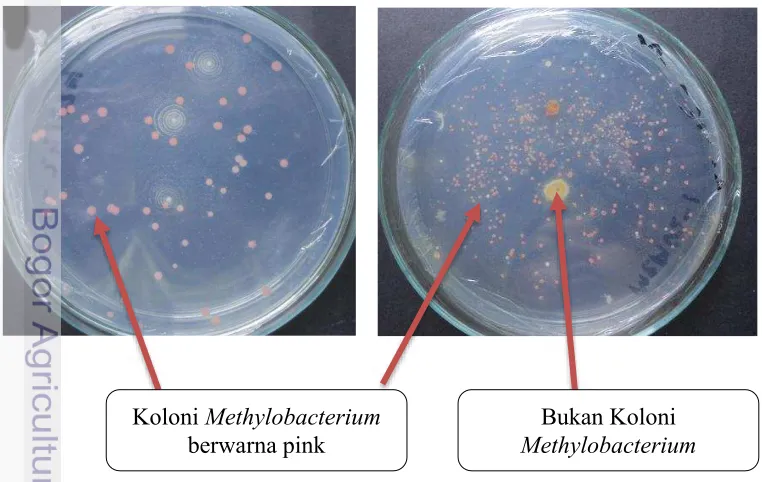
Penambahan methanol (10 mL L-1 media) dan inokulasi bakteri dilakukan saat media sudah dingin. Sebanyak 1 ose bakteri atau 1 mL stok kultur cair diinokulasikan pada media secara aseptik. Selanjutnya dilakukan inkubasi pada suhu ruang (±25°C) dan kultur dikocok menggunakan shaker selama tujuh hari. Panen kultur dilakukan setelah 7 hari dengan ciri ciri kultur cair sudah berwarna pink dengan populasi 107 cfu (colony forming unit) seperti yang terlihat pada Gambar 2. Kultur cair yang akan dipakai diuji populasinya dengan metode total plate count pada media AMS padat.
12
Kebutuhan penyemprotan pada tanaman kedelai ditentukan berdasarkan hasil penelitian Danial (2011) yaitu volume semprot pada daun tanaman kedelai untuk 40 tanaman adalah 120 mL pada 10 HST dan 200 mL pada 20 HST.
Pengamatan populasi bakteri di daun
Pengamatan kelimpahan populasi Methylobacterium dilakukan dengan metode total plate count dari contoh daun pada saat tanaman berumur 35 HST. Media yang digunakan AMS cair dan padat. Proses yang dilakukan dimulai dengan mengambil contoh daun diambil lalu disimpan dalam cool box untuk menghindari pembusukan. Contoh daun ditimbang sebanyak 1 gram, selanjutnya dicelup dalam larutan fungisida dan dibilas menggunakan akuades steril, dipotong lalu dimasukkan dalam botol berisi 10 mL media AMS cair kemudian ditambahkan methanol sebanyak 100µL per botol. Selanjutnya dilakukan peluruhan bakteri dengan sonikasi pada water bath sonicator selama 20 menit, selanjutnya setiap botol dikocok menggunakan rotary shaker selama 2 menit.
Sebelum penanaman dilakukan pengenceran sampai lima serial. Sebanyak 1 mL larutan AMS (berasal dari botol yang berisi daun) diencerkan pada larutan garam fisiologis sampai 5 serial pengenceran. Selanjutnya diambil 100µL larutan pada setiap konsentrasi untuk ditanam pada cawan petri yang berisi media AMS padat. Bakteri yang ditanam diratakan menggunakan segitiga penyebar sampai kering untuk menghindari kontaminasi.
Inkubasi dilakukan pada suhu ruang selama 7 hari. Pengamatan populasi
Methylobacterium dilakukan dengan menghitung jumlah koloni bakteri yang tumbuh pada cawan petri. Koloni yang dihitung adalah koloni yang berwarna pink seperti yang trlihat pada Gambar 3. Koloni yang berwarna selain pink dianggap sebagai kontaminan.
Gambar 3. Koloni Methylobacterium spp
Koloni Methylobacterium
13
HASIL DAN PEMBAHASAN
Percobaan 1. Pengaruh Perendaman Benih dengan Isolat Methylobacterium spp. terhadap Viabilitas Benih Kedelai.
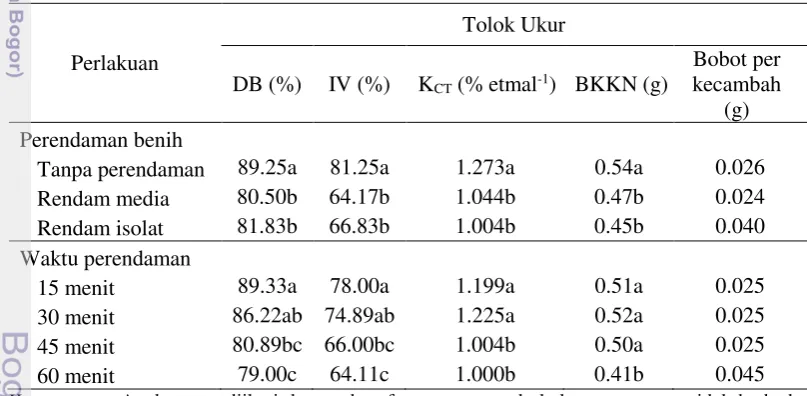
Aplikasi isolat Methylobacterium TD-J7 dan TD-TPB3 pada benih kedelai diharapkan dapat meningkatkan perkecambahan benih karena adanya zat pengatur tumbuh yang dihasilkan oleh bakteri. Hasil analisis ragam menunjukkan bahwa perlakuan perendaman benih pengaruh nyata pada tolok ukur Daya Berkecambah (DB), Indeks Vigor (IV), Kecepatan tumbuh (KCT), Bobot kering kecambah normal (BKKN) dan tidak berpengaruh nyata pada rata-rata bobot kecambah. Perlakuan waktu perendaman juga berpengaruh pada tolok ukur DB, IV, KCT, BKKN dan tidak berpengaruh nyata pada tolok ukur bobot kecambah. Namun, interaksi antara perlakuan perendaman dan waktu perendaman hanya berpengaruh pada tolok indeks vigor dan bobot kering kecambah normal. Viabilitas benih dengan tolok ukur DB, IV, KCT, BKKN perlakuan tanpa perendaman nyata lebih baik daripada perlakuan perendaman dengan media dan perendaman dengan isolat bakteri (Tabel 1). Dari hasil tersebut dapat dikatakan bahwa aplikasi Methylobacterium tidak dapat meningkatkan viabilitas benih pada benih yang mempunyai viabilitas awal yang tinggi.
Tabel 1. Pengaruh perendaman dengan isolat Methylobacterium dan waktu perendaman benih terhadap viabilitas benih.
Perlakuan
Tolok Ukur
DB (%) IV (%) KCT (% etmal-1) BKKN (g)
Bobot per kecambah
(g) Perendaman benih
Tanpa perendaman 89.25a 81.25a 1.273a 0.54a 0.026
Rendam media 80.50b 64.17b 1.044b 0.47b 0.024
Rendam isolat 81.83b 66.83b 1.004b 0.45b 0.040
Waktu perendaman
15 menit 89.33a 78.00a 1.199a 0.51a 0.025
30 menit 86.22ab 74.89ab 1.225a 0.52a 0.025
45 menit 80.89bc 66.00bc 1.004b 0.50a 0.025
60 menit 79.00c 64.11c 1.000b 0.41b 0.045
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%. DB = daya berkecambah, IV = indeks vigor, KCT = kecepatan tumbuh, BKKN = Bobot kering kecambah normal.
Perlakuan perendaman benih dengan Methylobacterium tidak dapat meningkatkan daya berkecambah benih. Perendaman benih merupakan salah satu metode yang dilakukan dalam mempercepat perkecambahan benih. Perendaman (priming) biasanya dilakukan untuk mempercepat proses imbibisi benih sehingga benih yang ditanam akan tumbuh dengan serempak. Hasil pada Tabel 1 menunjukkan bahwa lama perendaman benih kedelai dengan isolat
14
selama 15 menit menunjukkan nilai viabilitas yang paling tinggi dan semakin menurun seiring dengan peningkatan waktu perendaman. Semakin lama perendaman dilakukan justru menurunkan viabilitas benih pada semua tolok ukur yang diamati. Hal ini diduga karena perendaman tanpa menggunakan aerator menyebabkan semakin lama aerasi semakin buruk dan menyebabkan kondisi benih kedelai yang direndam an aerob yang justru menghambat perkecambahan benih. Aplikasi Methylobacterium pada benih kedelai lebih terlihat pada benih yang mempunyai viabilitas awal rendah (kurang dari 80%) daripada benih yang mempunyai viabilitas tinggi. Hal ini sesuai dengan penelitian Hapsari (2013) yang menunjukkan bahwa perendaman benih dengan Methylobacterium berpengaruh nyata pada peningkatan viabilitas benih kedelai yang mempunyai viabilitas awal 78% dan 83%, namun tidak pada benih dengan viabilitas awal 94%.
Hasil pada Tabel 2 menunjukkan bahwa perendaman benih kedelai dengan
Methylobacterium tidak memberikan pengaruh yang lebih baik dibandingkan dengan kontrol (tanpa perendaman). Pada tolok ukur indeks vigor, perlakuan kontrol secara nyata lebih baik dibandingkan dengan perendaman dengan isolat
Methylobacterium (30, 45 dan 60 menit perendaman) dan tidak berbeda nyata pada lama perendaman 15 menit. Pada tolok ukur bobot kering kecambah normal, kontrol tidak berbeda nyata dengan perlakuan Methylobacterium pada 15 dan 30 menit perendaman, namun berbeda pada 45 dan 60 menit perendaman.
Tabel 2. Pengaruh interaksi perlakuan perendaman benih dengan isolat
Methylobacterium dan waktu perendaman terhadap Indeks Vigor dan Bobot Kering Kecambah Normal.
perlakuan perendaman benih waktu perendaman
(menit) Tanpa perendaman Rendam media Rendam isolat
--- Indeks Vigor (%) ---
15 82.00 ab 75.33 b 76.67 b
30 88.00 a 63.33 c 73.33 b
45 74.00 b 61.33 c 62.67 c
60 81.00 ab 56.67 c 54.67 c
--- Bobot Kering Kecambah Normal (g) ---
15 0.51 ab 0.500 ab 0.51 ab
30 0.52 ab 0.51 ab 0.51 ab
45 0.58 a 0.46 bc 0.46 bc
60 0.54 ab 0.32 d 0.38 cd
Keterangan : Angka yang diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%.
15 untuk pertumbuhan kecambah sehingga mengakibatkan peningkatan akumulasi bobot kering kecambah (Copeland & McDonald 2001).
Penurunan viabilitas benih seiring dengan lamanya perendaman diduga karena benih tercekam dengan larutan garam yang ada pada media AMS. Hasil pengujian daya hantar listrik media AMS adalah 3154 µmosh cm-1. Daya hantar listrik media perendaman yang tidak merusak benih maksimum 2000 µmosh cm-1, Dengan konsentrasi garam yang tinggi maka benih tidak meningkat viabilitasnya justru tertekan pertumbuhannya karena cekaman abiotik.
Hasil dari percobaan pertama menunjukkan bahwa aplikasi kultur cair isolat
Methylobacterium dengan cara perendaman pada benih kedelai kurang tepat karena dapat menurunkan viabilitas benih kedelai. Semakin lama waktu perendaman benih semakin menurunkan viabilitas benih kedelai. Perendaman benih kedelai dengan kultur cair isolat Methylobacterium paling lama adalah 15 menit agar penurunan viabilitas tidak terlalu besar. Oleh karena itu perlu dilakukan penelitian lebih lanjut tentang media pembawa yang tepat dalam aplikasi isolat Methylobacterium pada benih kedelai.
Percobaan 2. Uji efektivitas isolat Methylobacterium untuk meningkatkan pertumbuhan dan produksi tanaman kedelai.
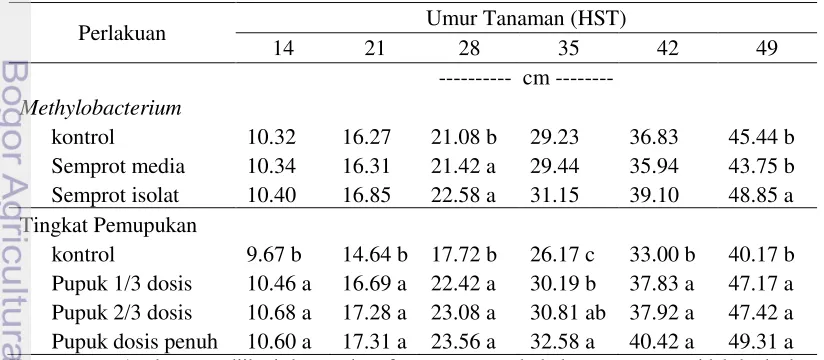
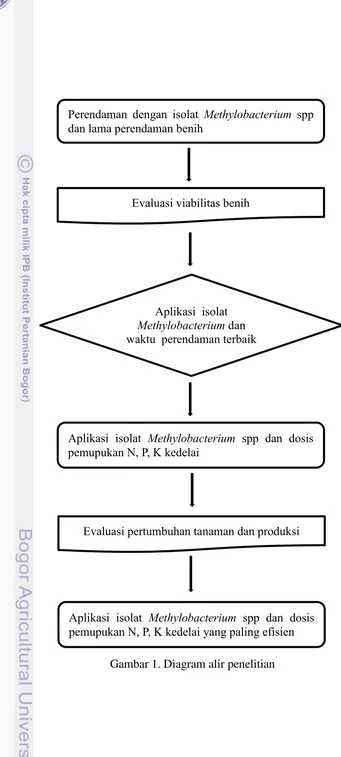
Penyemprotan tanaman dengan isolat pada permukaan daun bertujuan untuk menambahkan populasi Methylobacterium sehingga tanaman mendapatkan tambahan zat pengatur tumbuh selain yang berasal dari dalam tanaman itu sendiri. Aplikasi isolat Methylobacterium berpengaruh nyata meningkatkan tinggi tanaman pada 28 dan 49 HST dibandingkan dengan kontrol (Tabel 3). Perlakuan pemupukan berpengaruh nyata pada semua umur tanaman yang diamati. Pemupukan dengan dosis penuh berbeda nyata dengan kontrol, namun sebagian tidak berbeda nyata dengan pemupukan 1/3 dan 2/3 dosis pada semua umur tanaman. Interaksi antara pemupukan dengan aplikasi Methylobacterium menunjukkan pengaruh nyata pada 28 HST (Tabel 4).
Tabel 3. Pengaruh aplikasi Methylobacterium dan tingkat pemupukan terhadap pertumbuhan tanaman tolok ukur tinggi tanaman.
Perlakuan Umur Tanaman (HST)
14 21 28 35 42 49
--- cm ---
Methylobacterium
kontrol 10.32 16.27 21.08 b 29.23 36.83 45.44 b
Semprot media 10.34 16.31 21.42 a 29.44 35.94 43.75 b
Semprot isolat 10.40 16.85 22.58 a 31.15 39.10 48.85 a
Tingkat Pemupukan
kontrol 9.67 b 14.64 b 17.72 b 26.17 c 33.00 b 40.17 b
Pupuk 1/3 dosis 10.46 a 16.69 a 22.42 a 30.19 b 37.83 a 47.17 a
Pupuk 2/3 dosis 10.68 a 17.28 a 23.08 a 30.81 ab 37.92 a 47.42 a
Pupuk dosis penuh 10.60 a 17.31 a 23.56 a 32.58 a 40.42 a 49.31 a
16
Berdasarkan Tabel 4 dapat dilihat bahwa perlakuan Methylobacterium hanya berpengaruh nyata pada perlakuan tanpa pemupukan (kontrol). Interaksi antara aplikasi Methylobacterium dengan tingkat pemupukan tidak berpengaruh nyata pada tinggi tanaman pada 1/3, 2/3 dan dosis penuh. Hal ini menunjukkan bahwa pemupukan mempunyai peranan yang lebih dominan dibandingkan dengan pengaruh aplikasi Methylobacterium pada pertumbuhan tanaman kedelai. Danial (2011) menyatakan bahwa pengaruh aplikasi isolat Methylobacterium spp terhadap tinggi tanaman kedelai mulai terlihat setelah penyemprotan umur 20 HST dan pada perlakuan perendaman benih dengan isolat TD-TPB3 yang dilanjutkan dengan penyemprotan pada daun umur 10 HST + 20 HST menunjukkan tinggi tanaman kedelai yang tertinggi.
Tabel 4. Pengaruh interaksi antara pemupukan dan aplikasi Methylobacterium pada 28 HST pada tolok ukur tinggi tanaman.
Tingkat pemupukan Perlakuan Methylobacterium
kontrol Semprot media Semprot isolat
--- (cm) ---
kontrol 16.25 c 16.75 c 20.17 b
Pupuk 1/3 dosis 22.42 a 21.75 ab 23.08 a
Pupuk 2/3 dosis 22.08 ab 23.83 a 23.33 a
Pupuk dosis penuh 23.58 a 23.33 a 23.75 a
Keterangan : Angka yang diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%.
Daun merupakan organ penting dalam tanaman karena perannya dalam proses fotosintesis. Hasil pengamatan pada Tabel 5 menunjukkan bahwa perlakuan
Methylobacterium berpengaruh nyata meningkatkan jumlah daun pada saat tanaman berumur 35 dan 42 HST. Perlakuan penyemprotan dengan isolat
17 Tabel 5. Pengaruh aplikasi Methylobacterium dan tingkat pemupukan terhadap
jumlah daun.
Perlakuan Umur tanaman (HST)
14 21 28 35 42 49
Methylobacterium
kontrol 3.0 4.8 5.3 7.8 b 9.5 b 11.7 ab
Semprot media 3.0 4.8 5.4 7.6 b 9.3 b 11.3 b
Semprot isolat 3.0 4.9 5.6 8.1 a 10.0 a 12.2 a
Tingkat pemupukan
kontrol 3.0 4.4 b 4.7 b 6.9 b 8.6 b 10.8 b
Pupuk 1/3 dosis 3.0 4.9 a 5.6 a 8.0 a 9.8 a 11.9 a
Pupuk 2/3 dosis 3.0 4.9 a 5.7 a 8.1 a 10.0 a 12.0 a
Pupuk dosis penuh 3.0 5.0 a 5.9 a 8.2 a 10.1 a 12.1 a
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%.
Biomassa tanaman yang dihitung berdasarkan bobot kering tanaman menunjukkan laju pertumbuhan tanaman. Penghitungan biomassa tanaman pada penelitian ini dilakukan pada 35 HST dengan tujuan untuk mengetahui laju pertumbuhan tanaman pada fase vegetatif. Penyemprotan isolat Methylobacterium
dapat meningkatkan bobot kering tajuk dan total bobot kering tanaman kedelai (Tabel 6). Perlakuan pemupukan menunjukkan bahwa bobot kering tajuk pemupukan dosis penuh nyata lebih tinggi daripada perlakuan yang lain. Sedangkan pada bobot kering total perlakuan pemupukan penuh tidak berbeda nyata dengan 1/3 dosis pemupukan. Aplikasi Methylobacterium sp. dan Bradyrhizobium japonicum SB120 pada benih secara signifikan dapat meningkatkan parameter pertumbuhan tanaman kedelai meliputi bobot tanaman, jumlah daun, berat kering akar dan total bobot kering pada penanaman dalam pot di rumah kaca (Radha et al. 2009), total bobot kering kedelai meningkat 41.67% pada perlakuan inokulasi
Methylobacterium sp. dan B. japonicum (Meenakashi & Savalgi 2009). Selain itu inokulasi Methylobacterium suomiense dapat meningkatkan biomassa tanaman cabai sebesar 2.98% sampai 40.82% (Yim et al. 2009).
Tabel 6. Pengaruh aplikasi Methylobacterium dan tingkat pemupukan pada bobot kering tanaman kedelai
Perlakuan Bobot kering tanaman (g)
Akar Tajuk Total bobot kering tanaman
Methylobacterium
kontrol 0.114 1.295 b 1.295 b
Semprot media 0.144 1.488 b 1.488 b
Semprot isolat 0.283 1.914 a 1.914 a
Tingkat pemupukan
kontrol 0.109 1.704 b 1.244 c
Pupuk 1/3 dosis 0.250 1.360 b 1.610 ab
Pupuk 2/3 dosis 0.215 1.342 b 1.556 b
Pupuk dosis penuh 0.149 1.704 a 1.853 a
18
Perlakuan Methylobacterium dan tingkat pemupukan menunjukkan pengaruh yang nyata pada tolok ukur jumlah polong, produksi dan produksi per tanaman. Namun tidak terdapat interaksi antara dua perlakuan pada tolok ukur yang diamati. Jumlah polong pada perlakuan penyemprotan dengan isolat Methylobacterium
berbeda nyata dengan kontrol (Tabel 7). Tingkat pemupukan dosis penuh berbeda nyata dengan kontrol, namun tidak berbeda nyata dengan pemupukan 2/3 dosis. Aplikasi isolat Methylobacterium pada pertumbuhan tanaman cabai menunjukkan bahwa tingkat pemupukan dengan dosis yang lebih rendah lebih berpengaruh daripada pada pemupukan dosis tinggi (Chauhan et al. 2010). Produksi buah cabai pada aplikasi rendam benih+semprot Methylobacterium tiap 1 bulan tidak berbeda nyata pada tingkat pemupukan setengah dosis dengan satu dosis rekomendasi (Azizah 2011).
Semakin sering aplikasi isolat Methylobacterium maka pertumbuhan tanaman semakin meningkat. Meenakashi & Savalgi (2009) menyatakan bahwa total bobot kering kedelai meningkat 41.67% pada perlakuan inokulasi Methylobacterium sp.+
B.japonicum dengan penyemprotan pada 20, 30 dan 45 hari dibandingkan dengan kontrol. Selain itu Danial (2011) menyatakan bahwa teknik aplikasi
[image:30.595.89.485.435.607.2]Methylobacterium spp isolat TD-TPB3 pada kedelai varietas Kaba dengan cara perendaman yang dilanjutkan dengan penyemprotan pada daun umur 10 HST + 20 HST memberikan peningkatan pertumbuhan dan produksi tanaman. Peningkatan terjadi pada peubah tinggi tanaman 35 HST, bobot kering tajuk, bobot kering akar, jumlah polong, polong isi, bobot 100 butir dan produksi.
Tabel 7. Pengaruh aplikasi Methylobacterium dan tingkat pemupukan pada tolok ukur jumlah polong, produksi dan produksi per tanaman.
Perlakuan
Tolok Ukur Produksi
Jumlah polong Produksi (g) Bobot biji / tanaman
(g)
Methylobacterium
kontrol 13.42 b 11.73 b 2.93 b
Semprot media 12.00 b 11.05 b 2.76 b
Semprot isolat 19.50 a 19.47 a 4.87 a
Tingkat Pemupukan
kontrol 11.00 c 9.67 b 2.42 b
Pupuk 1/3 dosis 14.00 bc 13.79 a 3.45 a
Pupuk 2/3 dosis 16.67 ab 16.20 a 4.05 a
Pupuk dosis penuh 18.22 a 16.67 a 4.17 a
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%.
Zat pengatur tumbuh (auksin, sitokinin dan giberelin) diketahui berperan penting dalam pertumbuhan tanaman. Sitokinin berperan dalam morfogenesis, pertunasan, pembentukan kloroplas, pembentukan umbi pada kentang, pemecahan dormansi, dan pembukaan stomata (Wattimena et al. 1992). Aplikasi
19 sitokinin yaitu trans zeatin pada tanaman cabai yang diberi isolat Methylobacterium
sp. CBMB20 dan CBMB110.
Zat pengatur tumbuh yang dihasilkan oleh isolat Metylobacterium berperan penting pada peningkatan pertumbuhan tanaman. Methylobacterium spp. strain TD-J7 menghasilkan auksin 9.13 ppm, trans-zeatin 74.37 ppm dan gibrelin 98.75 ppm dan isolat strain TD-TPB3 menghasilkan IAA 96.56 ppm, trans zeatin 33.14 ppm dan giberelin 129.83 ppm (Widajati et al. 2008). Zat pengatur tumbuh yang dihasilkan bakteri dapat menstimulasi translokasi fotoasimilat dengan membantu proses pembungaan, pembuahan dan pembentukan biji yang sehingga dapat meningkatkan produktivitas tanaman (Amanullah et al. 2010).
Hasil penghitungan jumlah koloni pada permukaan daun saat tanaman berumur 35 HST menunjukkan bahwa kelimpahan Methylobacterium pada daun yang disemprot isolat adalah berkisar antara 3.2 x 102- 1.18 x 104 cfu gram-1 daun (Tabel 8). Kelimpahan paling besar terdapat pada perlakuan Methylobacterium
[image:31.595.115.496.377.486.2]yang diberi pupuk 1/3 dosis. Jumlah koloni yang terlihat lebih rendah dari populasi isolat yang disemprotkan (107 cfu mL-1 ) menunjukkan bahwa koloni isolat yang disemprotkan tidak mampu bertahan hidup seperti pada populasi awal. Hasil ini juga menunjukkan bahwa jumlah koloni yang telah diaplikasikan akan berkeseimbangan dengan populasi yang ada di alam.
Tabel 8. Kelimpahan bakteri Methylobacterium daun kedelai pada 35 HST.
Perlakuan Jumlah koloni
Tanpa isolat Methylobacterium 1.12 x 102
Semprot media AMS 3.50 x 102
Methylobacterium tanpa pemupukan 2.70 x 103
Methylobacterium + pupuk 1/3 dosis 1.18 x 104
Methylobacterium + pupuk 2/3 dosis 3.20 x 102
Methylobacterium + pupuk dosis penuh 5.40 x 103
Kelimpahan Methylobacterium yang berada di alam berbeda menurut jenis tanamannya. Pada daun poh-pohan dan kemangi asal Bogor terdapat 104 cfu g-1 daun, kecambah kacang hijau (taoge) 8.75x102 cfu g-1 daun (Riupassa 2003), tanaman pangan (padi, jagung dan kedelai) serta tanaman hortikultura (mentimun, tomat, terong, cabai merah, gambas dan labu) berkisar 102-105 cfu g-1 tanaman (Salma et al. 2004).
Hasil penghitungan kelimpahan bakteri yang telah diaplikasikan menunjukkan bahwa penyemprotan isolat yang masih hidup diduga kurang menguntungkan karena bakteri yang disemprotkan banyak yang mengalami kematian. Kelimpahan populasi Methylobacterium di permukaan tanaman dipengaruhi oleh musim tanam, iradiasi ultra violet dan suhu lingkungan (Omer et al. 2004). Perlu dipertimbangkan kembali apakah perlu dilakukan perbaikan cara aplikasi bakteri misalnya dengan menambahkan perekat agar bakteri tidak mudah tercuci. Selain itu dapat pula dilakukan pemanfaatan metabolit yang dihasilkannya saja yaitu auksin, sitokinin dan giberelin sehingga mengurangi biaya pembuatan isolat karena tidak perlu menggunakan isolat segar.
20
[image:32.595.87.485.172.309.2]P, dan K dibandingkan dengan kontrol (Tabel 9). Hasil tersebut juga menunjukkan bahwa perlakuan pemupukan berpengaruh penting terhadap penyerapan NPK tanaman. Semakin tinggi tingkat pemupukan maka unsur hara yang diserap oleh tanaman kedelai juga semakin tinggi.
Tabel 9. Serapan unsur N, P dan K jaringan tanaman kedelai.
Perlakuan total serapan N (g) total serapan P (mg) total serapan K (mg)
Methylobacterium
Kontrol 47.264 4.763 30.978
Semprot media 61.862 5.921 44.107
Semprot isolat 69.201 7.753 48.620
Tingkat pemupukan
Kontrol 49.957 4.636 16.492
Pupuk 1/3 dosis 57.822 6.244 44.220
Pupuk 2/3 dosis 58.640 6.098 47.519
Pupuk dosis penuh 71.349 7.604 56.709
Auksin berperan dalam mendorong pemanjangan sel, pembelahan sel, diferensiasi jaringan xilem dan floem, pembentukan akar. dapat menambahkan jumlah auksin tanaman. Hasil pada Tabel 6. menunjukkan bahwa penambahan jumlah auksin dengan penyemprotan isolat Methylobacterium pada tanaman dapat meningkatkan pertumbuhan akar. Semakin banyak akar pada tanaman maka penyerapan hara pada tanaman dapat menjadi lebih efisien seperti yang terlihat pada serapan N, P dan K tanaman kedelai pada tabel 9. Hal ini sejalan dengan penelitian Kim et al. (2010) yang menunjukkan bahwa kombinasi aplikasi Methylobacterium oryzae dan cendawan Arbuskula Mikorhiza secara signifikan meningkatkan akumulasi nitrogen (N) yang lebih besar pada akar dan tajuk tanaman cabai serta meningkatkan jumlah Fosfor (P) sampai 23.3% dibandingkan dengan tanpa inokulasi.
Berbagai faktor dapat mempengaruhi penyerapan hara pada tanaman kedelai. Ghulamahdi et al. (2006) menyatakan bahwa sistem budidaya jenuh mampu meningkatkan aktivitas nitrogenase, serapan N, P, K daun, bobot kering bintil, akar, batang, daun, polong, serta biji dibandingkan budidaya kering. Pertumbuhan kedelai pada sistem budidaya jenuh terus (BJ) lebih baik dibandingkan budidaya jenuh kering (BJK), dan budidaya jenuh kering (BJK) lebih baik dibandingkan budidaya kering (BK). Efisiensi Serapan N, laju pertumbuhan tanaman, efisiensi penggunaan N, laju pertumbuhan relatif, dan laju asimilasi bersih mempengaruhi hasil biji kedelai pada kondisi kekeringan (Agung & Rahayu 2004).
21
SIMPULAN DAN SARAN
Simpulan
1. Perendaman benih dengan Methylobacterium tidak berpengaruh nyata pada viabilitas benih dengan tolok ukur daya berkecambah, indeks vigor, kecepatan tumbuh bobot kering kecambah normal dan rata rata bobot kecambah.
2. Aplikasi Methylobacterium dan pemupukan dosis penuh berpengaruh nyata pada tolok ukur tinggi tanaman, jumlah daun, bobot kering tanaman, jumlah polong dan produksi dibandingkan dengan kontrol.
3. Kelimpahan koloni Methylobacterium pada daun saat tanaman berumur 35 HST adalah 3.2 x 102- 1.18 x 104 cfu g-1 daun.
4. Aplikasi penyemprotan tanaman dengan isolat Methylobacterium dapat meningkatkan serapan N, P, dan K dibandingkan dengan kontrol.
5. Kombinasi aplikasi isolat Methylobacterium dengan penyemprotan pada tanaman dengan pemupukan NPK 1/3 dosis (16.5 kg N ha-1, 33.3 kg P2O5 ha-1 dan 33.3 kg K2O ha-1) paling efektif pada pertumbuhan dan produksi kedelai.
Saran
Perlu dilakukan penelitian yang lebih lanjut mengenai media pembawa yang tepat dan cara aplikasi isolat Methylobacterium pada benih kedelai. Perlu dipertimbangkan juga waktu yang tepat dan cara aplikasi isolat Methylobacterium
yang baik pada tanaman kedelai.
DAFTAR PUSTAKA
Agung T, Rahayu AH. 2004. Analisis efisiensi serapan N, pertumbuhan, dan hasil beberapa kultivar kedelai unggul baru dengan cekaman kekeringan dan pemberian pupuk hayati. Agrosains 6(2):70-74.
Amin N. 2008. Pengaruh Methylobacterium spp terhadap pematahan dormansi benih padi (Oryza sativa L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor. Anitha K.G. 2010. Enhancing seed germination of mono and dicotyledons through
IAA production of PPFM. Trends Soil Sci. Plant Nutr. Journal. 1(1):14-18. Ardley JK, O'Hara GW, Reeve WG, Yates RJ, Dilworth MJ, Tiwari RP, Howieson
JG. 2009. Root nodule bacteria isolated from South African Lotononis bainesii, L. listii and L. solitudinis are species of Methylobacterium that are unable to utilize methanol. Archives of Microbiology, 191 (4):311-318. Azizah M. 2011. Pengaruh aplikasi isolat Methylobacterium spp terhadap
pertumbuhan dan daya hasil tanaman cabai (Capsicum annuum L.). [skripsi]. Bogor (ID): Institut Pertanian Bogor.
[BPS] Badan Pusat Statistik. 2013. Data Strategis BPS Tahun 2013. www.bps.go.id. (April 2013)
22
spray on growth of red pepper (Capsicum annuum L.) at different fertilizer levels. Korean J. Soil Sci. Fert. 43(4):514-521.
Copeland LO, Mc Donald MB. 2001. Principles of Seed Science and Technology. Chapman and Hall. Thomson publishing. Washington. 408p.
Danial D. 2011. Pengaruh Aplikasi Methylobacterium spp terhadap peningkatan vigor dan produksi tanaman kedelai. [tesis]. Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor.
Deka Boruah HP, Chauhan PS, Yim WJ, Han GH, Sa TM. 2010. Comparison of plant growth promoting Methylobacterium sp. and exogenous indole-3-acetic acid application on red pepper and tomato seedling development. Korean J. Soil Sci. Fert. 43(1): 96-104.
Facino A. 2012. Penawaran Kedelai Dunia dan Permintaan impor kedelai indonesia serta kebijakan perkedelaian nasional. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fitriarini D. 2008. Penggunaan Methylobacterium spp untuk Invigorasi Benih Padi (Oryza sativa L.). [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ghulamahdi M, Aziz SA, Melati M, Dewi N, Rais SA. 2006. Aktivitas nitrogenase, serapan hara dan pertumbuhan dua varietas kedelai pada kondisi jenuh air dan kering. Bul. Agron. 34(1):32-38.
Hapsari RT. 2013. Pemanfaatan Methylobacterium spp. pada invigorasi dan teknik coating untuk meningkatkan vigor benih kedelai. [tesis]. Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor.
He K, Nukada H, Urakami T, Murphy M. 2003. Antioxidant and pro-oxidant of pyrroloquinoline quinon (PQQ): Implication for its function in biological systems. Biochem Pharmacol. 65:67-74.
Hellmuth J, Kutschera U. 2008. The effect of growth-promoting methylobacteria on seedling development in Ginkgo biloba L. Journal of Applied Botany and Food Quality. 82:26-29.
Hidayat T. 2014. Efektivitas isolat Methylobacterium spp. untuk meningkatkan produksi tanaman kedelai (Glycine max L.). [tesis]. Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor.
Holland MA, Polacco JC. 1992. Urease-null and hydrogenase-null phenotypes of a phylloplane bacterium reveal altered nickel metabolism in two soybean mutants. Plant Physiol. 98:942–948.
Ismail YA. 2002. Kelimpahan dan keragaman genetik bateri pink pigmented facultative methylotroph dari sejumlah daun tanaman tropis. [tesis]. Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor.
Jourand P, Giraud E, Be´ na G, Sya A, Willems A, Gillis M, Dreyfus B, de Lajudie P. 2004. Methylobacterium nodulans sp. nov., for a group of aerobic, facultatively methylotrophic, legume root-nodule-forming and nitrogen-fixing bacteria. International Journal of Systematic and Evolutionary Microbiology. 54:2269-2273.
Kim K, Yim WJ, Trivedi P, Madhaiyan M, Deka Boruah HP, Islam M, Sa TM. 2010. Synergistic effects of inoculating arbuscular mycorrhizal fungi and
Methylobacterium oryzae strains on growth and nutrient uptake of Capsicum annuum . Plant and Soil. 327:429-440.
23 Kurniati E. 2009. Aplikasi Methylobacterium spp untuk Meningkatkan Viabilitas Benih dan Pertumbuhan Bibit Padi (Oryza Sativa L.). [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kutschera U. 2007. Plant associated methylobacteria as co-envolved photosymbionts. Plant Signaling & Behavior. 2(2):74-78.
Lidstrom ME, Christoserdova L. 2002. Plants in the pink: cytokinin production by
Methylobacterium. Journal of Bacteriology. 184(7):1818.
Madhaiyan M, Poonguzhali S, Senthilkumar M, Seshadri S, Chung H, Yang J, Sundaram S, Sa T. 2004. Growth promotion and induction of systemic resistence in rice cultivar Co-47 (Oryza sativa L.) by Methylobacterium spp. Bot. Bull. Acad. Sin. 45: 315-324.
Madhaiyan M, Surresh V, Anandham R, Senthilkumar M, Poonguzhali S, Sundaram SP, Sa T. 2006. Plant growth promoting Methylobacterium induces defense response in groundnut (Arachis hypogaea L.) compared with root pathogens. Journal Current Microbiology. 53(4): 270-276.
Madhaiyan M, Poonguzhali S, Senthilkumar M, Sundaram SP, Sa T. 2009. Nodulation and plant-growth promotion by methylotrophic bacteria isolated from tropical legumes. Microbiological Research. 164:114-120.
Meenakshi BC, Savalgi VP. 2009. Effect of co-inoculation of Methylobacterium
and B. japonicum on plant growth and dry matter content and enzyme activities in soybean. Karnataka J. Agric. Sci. 22(2):344-348.
Omer ZR, Tombolini R, Gerhardson B. 2004. Plant colonization by pink-pigmented facultative methylotrophic bacteria (PPFMs). FEMS Microbiology Ecology. 47:319-326.
Radha TK, Savalgi VP, Alagawadi AR. 2009. Effect of methylotrophs on growth and yield of soybean (Glycine max L. Merrill). Karnataka J. Agric. Sci. 22 (1):118-121.
Raja P, Sundaran Sp. 2006. Combined inoculation effect of pink pigmented facultative Methylobacterium (PPFM) and other bioinoculants on cotton. Asian J. of Bio Sci. 1(2):39-44.
Rathika S, Velayudham K, Muthukrishnan P, Thavaprakaash N. 2009. Influence of nutrients and plant growth regulators on growth and yield of baby corn. Madras Agric. J. 96(1-6):121-122.
Renier A, Jourand P, Rapior S, PoinsotV, Sya A, Dreyfusa B, Moulina L. 2008. Symbiotic properties of Methylobacterium nodulans ORS 2060T: A classic process for an atypical symbiont. Soil Biology & Biochemistry. 40:1404-1412.
Riupassa PA. 2003. Kelimpahan dan keragaman genetik bateri pink pigmented facultative methylotroph dari beberapa daun sayuran lalapan. [tesis]. Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor.
Ryu J, Madhaiyan M, Poonguzhali S, Yim W, Indiragandhi P, Kim K, Anandham R, Yun J, Kim KH, Sa T. 2006. Plant growth substances produced by Methylobacterium spp and their effect on tomato (Lycopersicon esculentum L.) and red pepper (Capsicum annuum L.) growth. Journal of Microbiology and Biotechnology 16:1622-1628.
24
Safariyah R. 2009. Efektivitas isolat Methylobacterium spp untuk mematahkan dormansi benih, meningkatkan pertumbuhan bibit dan hasil padi (Oryza sativa L.). [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Salma S, Suwanto A, Tjahjoleksono A, Meryandini A. 2005. Keanekaragaman bakteri filosfer dari beberapa tanaman asal Kalimantan Timur. Forum Pascasarjana. 28(1):1-10.
Salma S. 2004. Keanekaragaman bakteri filosfer dari beberapa tanaman asal kalimantan timur [tesis]. Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor.
Saraswati R, Sumarno. 2008. Pemanfaatan mikroba penyubur tanah sebagai komponen teknologi pertanian. Iptek Tanaman Pangan. 3(1):41-58.
Saraswati R. 2007. Potensi penggunaan pupuk mikroba secara terpadu pada kedelai. Teknik Produksi dan Pengembangan. Bogor (ID): Puslitbangtan.
Schauer S, Kutschera U. 2011 A novel growth-promoting microbe,
Methylobacterium funariae sp. nov., isolated from the leaf surface of a common moss. Plant Signaling & Behavior 6(4):510-515.
Senthilkumar M, Madhaiyan M, Sundaram SP, Kannaiyan S. 2009. Intercellular colonization and growth promoting effects of Methylobacterium sp. withplant-growth regulators on rice (Oryza sativa L. CvCO-43). Microbiological Research 164:92-104.
Sy A, Giraud E, Jourand P, Garcia N, Willems A, de Lajudie P, Prin Y, Neyra M, Gillis M, Boivin-Masson C, Dreyfus B. 2001. Methylotrophic
Methylobacterium bacteria nodulate and fix nitrogen in symbiosis with legumes. J. Bacteriol. 183(1):214-220.
Wattimena GA, Gunawan LW, Mattjik NA, Syamsudin E, Wiendi NMA, Ernawati A.1992. Bioteknologi Tanaman. Bogor (ID). Pusat Antar Universitas Bioteknologi IPB.
Wibowo RS. 2011. Pengaruh aplikasi Methylobacterium spp dan dosis pupuk N, P, K terhadap pertumbuhan tanaman padi sawah (Oryza sativa L.). [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Widajati E, Salma S, Kosmiatin M, Pratiwi E, Rahayu S. 2008. Potensi
Methylobacterium spp asal Kalimantan Timur untuk meningkatkan mutu benih dan kultur in vitro tanaman serta analisis keragamannya. Bogor (ID): LPPM IPB.
Yim WJ, Lee MK, Deka Boruah HP, Woo SM, Madhaiyan M, Sa TM. 2009. Inoculation effect Methylobacterium suomiense CBMB120-gfp29 on growth of red pepper grown in different level of compost and lime. The 9th International Conference of The East and Southeast Asia Federation of Soil Science Societies. 607-608.
25
LAMPIRAN
Lampiran 1. Deskripsi kedelai varietas Kaba Dilepas tahun : 22 Oktober 2001
SK Mentan : 532/Kpts/TP.240/10/2001 Nomor galur : MSC 9524-IV-C-7
Asal : Silang ganda 16 tetua Hasil rata-rata : 2.13 t/ha
Warna hipokotil : Ungu Warna epikotil : Hijau Warna kotiledon : Kuning Warna bulu : Coklat Warna bunga : Ungu Warna kulit biji : Kuning Warna polong masak : Coklat Warna hilum : Coklat Bentuk biji : Lonjong Tipe tumbuh : Determinit Umur berbunga : 35 hari Umur saat panen : 85 hari Tinggi tanaman : 64 cm Bobot 100 biji : 10.37 g Ukuran biji : sedang Kandungan protein : 44.0% Kandungan lemak : 8.0%
Kerebahan : Tahan rebah
Ketahanan terhadap penyakit : Agak tahan karat daun Sifat-sifat lain : Polong tidak mudah pecah Wilayah adaptasi : Lahan sawah
Pemulia : M. Mucklish Adie, Soegito, Darman MA dan Arifin
26
Lampiran 2. Kadar IAA, Asam Giberelin dan Trans Zeatin pada 17 Suspensi Kultur Methylobacterium spp.
No. Nama Isolat Asal Daun Konsentrasi zat pengatur tumbuh (ppm) Auksin Giberelin Trans zeatin
1 TD-Tpb1 Terong bulat 2.31 79.64 25.79
2 TD-Tpb2 Terong bulat 3.39 99.61 22.66
3 TD-Tpb3 Terong bulat 9.56 129.83 33.14
4 TD-J2 Jagung 2.08 Ttd 89.21
5 TD-J7 Jagung 9.13 98.75 74.37
6 TD-J10 Jagung 15.14 51.44 59.75
7 TD-K2 Kedelai 9.63 59.11 43.79
8 PPU-K2 Kedelai 3.69 92.89 27.9
9 PPU-K10 Kedelai 9.56 78.32 Ttd
10 TD-P4 Padi 9.32 Ttd 22.28
11 TD-P5 Padi 1.46 47.92 28.79
12 TD-G2 Gambas 1.81 49.99 26.82
13 TD-G3 Gambas 5.74 20.28 69.36
14