331
ISOLASI KOLAGEN DARI KULIT IKAN PATIN
(
Pangasius
sp.)
ST. KHADIJAH HARDYANTI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
333
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi Kolagen dari Kulit Ikan Patin (Pangasius sp.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
St. Khadijah Hardyanti
ABSTRAK
ST. KHADIJAH HARDYANTI. Isolasi Kolagen dari Kulit Ikan Patin (Pangasius
sp.). Dibimbing oleh KUSDIANTORO MOHAMAD dan I KETUT MUDITE ADNYANE.
Permintaan gelatin yang bersumber dari kolagen terus meningkat dari tahun ke tahun. Kulit ikan dapat dimanfaatkan sebagai sumber kolagen alternatif untuk menggantikan kolagen dari hewan darat seperti sapi atau babi terkait dengan kekhawatiran isu penyakit bovine spongiform encephalopathy, penyakit mulut dan kuku, serta keagamaan/kehalalan. Penelitian ini bertujuan menjajaki metode isolasi dan mengevaluasi kualitas kolagen dari kulit ikan patin (Pangasius sp.) secara kualitatif dan kuantitatif. Kolagen diekstraksi dari kulit ikan patin menggunakan natrium sitrat, kemudian penghitungan konsentrasi dan kemurnian (rasio A260/A280) dilakukan dengan spektrofotometer, pendeteksian jaringan kolagen dengan pewarnaan Cason’s trichrome, serta penentuan pola pita dan berat molekul protein hasil isolasi dengan sodium dodecyl sulphate polyacrilamid gel electrophoresis (SDS-PAGE). Efisiensi hasil isolasi kolagen ikan patin dalam penelitian ini diperoleh sebesar 2.75 ± 1.32 mg/g kulit (0.28%) dengan konsentrasi kolagen rata-rata 4.90 ± 1.92 mg/mL dan tingkat kemurnian rata-rata 1.32 ± 0.03. Kolagen hasil isolasi dari kulit ikan patin menunjukkan positif terhadap pewarnaan Cason’s trichrome sama seperti kolagen kulit sapi komersial, tetapi dengan potongan jaringan yang lebih kecil. Berdasarkan hasil SDS-PAGE, kolagen hasil isolasi dari kulit ikan patin memiliki dua pita protein yang sama dan satu pita protein yang berbeda dengan kolagen kulit sapi komersial.
335
ABSTRACT
ST. KHADIJAH HARDYANTI. Isolation of Collagen from Catfish (Pangasius
sp.) Skin. Supervised by KUSDIANTORO MOHAMAD and I KETUT MUDITE ADNYANE.
Demand of gelatin derived from collagen has been increased over the years. Skin of fish can be used as an alternative source for collagen to avoid the issue of bovine spongiform encephality (BSE), foot-and-mouth disease (FMD), and religion. This study aims to explore the method of collagen isolation and evaluate the quality of collagen isolated from skin of catfish (Pangasius sp.) qualilatively and quantitatively. Collagen extracted from the catfish’s skin using sodium citrate extraction, and then its concentration and purity (A260/A280 ratio) measured by spectrophotometer. Then, the presence of collagen tissue was detected by Cason's trichrome staining and the banding pattern and molecular weight proteins were detected by sodium dodecylsulphate polyacrilamid gel electrophoresis (SDS-PAGE). This study showed that the efficiency of the isolated collagen catfish is 2.75 ± 1.32 mg/g skin (0.28%) with an average collagen concentration of 4.90 ± 1.92 mg/mL and level of purity of 1.32 ± 0.03. Collagen isolated from catfish skin showed positive for Cason's trichrome staining, as well as commercial calfskin collagen, but with a smaller tissue pieces. Based on SDS-PAGE method, collagen isolated from catfish have two similar protein bands and one different band compared to the commercial calfskin collagen.
337
ISOLASI KOLAGEN DARI KULIT IKAN PATIN
(
Pangasius
sp
.
)
ST. KHADIJAH HARDYANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
3311
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat serta karunia-Nya sehingga skripsi yang berjudul “Isolasi Kolagen dari Kulit Ikan Patin (Pangasius sp.)” dapat diselesaikan.
Ucapan terima kasih penulis sampaikan kepada Drh. Kusdiantoro Mohamad, MSi, PAVet dan Drh. I Ketut Mudite Adnyane, MSi, PhD, PAVet selaku dosen pembimbing penelitian yang senantiasa memberikan dukungan, saran, motivasi, serta masukan dalam pengerjaan penelitian ini. Terima kasih kepada Drh. Wahono Esthi Prasetyaningtyas, MSi, PAVet serta almarhumah Dr. Drh. Ita Djuwita, MPhil, PAVet(K) atas saran dan pengetahuan yang diberikan selama ini. Terima kasih kepada ayah, ibu, kakak, adik atas kasih sayang dan doa yang dilimpahkan kepada penulis. Terima kasih kepada segenap staf di Laboratorium Embriologi dan Laboratorium Layanan dan Pendidikan yang telah mengajarkan banyak hal. Tidak lupa pula penulis sampaikan terima kasih kepada penghuni Cendana 53 yang telah menjadi keluarga baru selama penulis menyelesaikaan pendidikan di Bogor. Ucapan terima kasih juga penulis sampaikan kepada sahabat D’Angel Crew serta teman-teman seperjuangan di IPB, khususnya di Fakultas Kedokteran Hewan dan teman-teman yang tidak bisa disebutkan satu persatu.
Pada akhirnya penulis sadar bahwa karya ini masih jauh dari kata sempurna, oleh karena itu penulis mengharapkan kritik dan saran dari pembaca.
Penulis berharap skripsi ini dapat bermanfaat dan memberikan pengetahuan bagi pembaca.
Bogor, September 2014
3313
DAFTAR ISI
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
TINJAUAN PUSTAKA 2
Kolagen 2
Ikan Patin (Pangasius sp.) 2
(SDS PAGE) 3
METODE PENELITIAN 4
Waktu dan Tempat Penelitian 4
Alat 4
Bahan 4
Prosedur Penelitian 4
HASIL DAN PEMBAHASAN 6
Konsentrasi Kolagen Ikan Patin 6
Pendeteksian Jaringan Kolagen Ikan Patin 7
Berat Molekul dan Pola Pita Protein Kolagen Ikan Patin 8
SIMPULAN DAN SARAN 10
DAFTAR PUSTAKA 10
LAMPIRAN 12
DAFTAR TABEL
1 Hasil pengukuran konsentrasi kolagen yang diisolasi dari kulit ikan
patin 6
2 Estimasi perolehan kolagen hasil isolasi per bobot kulit dan bobot
badan ikan patin 7
DAFTAR GAMBAR
1 Pewarnaan khusus untuk kolagen 8
2 Pola pita protein kolagen kulit ikan patin 9
DAFTAR LAMPIRAN
1 Low molecular weight protein marker yang digunakan pada SDS PAGE 12 2 Perhitungan berat molekul protein kulit sapi komersial dan kulit ikan
PENDAHULUAN
Latar Belakang
Permintaan gelatin yang bersumber dari kolagen telah meningkat dari tahun ke tahun. Laporan terkini mengindikasikan produksi gelatin dunia mendekati angka 326 000 ton per tahun, dimana gelatin dari kulit babi sebesar 46%, kulit sapi sebesar 29.4%, tulang sapi sebesar 23.1%, dan sumber lain sebesar 1.5% (Karim dan Bhat 2009). Indonesia telah mengimpor lebih dari 6 200 ton gelatin pada tahun 2003 atau senilai US$6 962 237 dari berbagai negara (Perancis, Jepang, India, Brazil, Jerman, Cina, Argentina, dan Australia) untuk memenuhi kebutuhan dalam negeri.
Sumber utama kolagen untuk aplikasi industri adalah hewan darat seperti sapi dan babi, tetapi sumber ini mengakibatkan kecemasan bagi pengguna karena dapat menyebabkan wabah penyakit seperti penyakit prion bovine spongiform encephalopathy (BSE) dan penyakit mulut dan kuku (PMK). Selain itu, kolagen yang diekstrak dari babi tidak dapat digunakan oleh agama tertentu dengan alasan kehalalan sehingga diperlukan sumber kolagen alternatif. Ikan merupakan salah satu sumber alternatif kolagen karena tidak mungkin dihubungkan dengan penyakit prion, penyakit mulut dan kuku, atau kehalalan.
Indonesia merupakan negara maritim yang memiliki kekayaan laut yang melimpah dan beragam, salah satunya adalah ikan. Kulit ikan yang difillet
dianggap sebagai produk limbah, sehingga pemanfaatan kulit ikan sebagai sumber kolagen alternatif untuk menggantikan gelatin dari hewan mamalia (babi dan sapi) memiliki nilai tambah dan nilai ekonomi yang lebih tinggi.
Banyak masyarakat di daerah Jawa Barat yang membudidayakan ikan air tawar, salah satunya adalah ikan patin. Data statistik kelautan dan perikanan menunjukkan produksi budidaya ikan patin meningkat dari tahun ke tahun. Tahun 2012, produksi budidaya ikan patin di Jawa Barat sebesar 5 222 ton (KKP 2013). Hal ini menunjukkan potensi bagi pemanfaatan kulit ikan patin (Pangasius sp.) sebagai sumber kolagen atau gelatin.
Tujuan Penelitian
Penelitian ini bertujuan menjajaki metode isolasi dan mengevaluasi kualitas kolagen hasil isolasi dari kulit ikan patin (Pangasius sp.) secara kualitatif dan kuantitatif.
Manfaat Penelitian
Penelitian ini diharapkan memberikan metode isolasi kolagen serta informasi mengenai kemurnian kolagen dari kulit ikan patin (Pangasius sp.) yang dapat digunakan sebagai matriks ekstraseluler pada kultur sel in vitro (Montesano
2
TINJAUAN PUSTAKA
Kolagen
Kolagen merupakan komponen struktural utama dari jaringan ikat putih (white connetive tissue) yang meliputi hampir 30% dari total protein pada jaringan dan organ tubuh vertebrata dan invertebrata. Pada mamalia, burung, dan ikan kolagen terdapat di kulit, tendon, tulang rawan dan jaringan ikat, sedangkan pada avertebrata kolagen terdapat pada dinding sel (Bailey dan Light 1989).
Kolagen merupakan material yang mempunyai kekuatan rentang dan struktur yang berbentuk serat. Protein jenis ini banyak terdapat pada vertebrata tingkat tinggi. Hampir sepertiga protein dalam tubuh vertebrata berada sebagai kolagen. Semakin besar hewan, semakin besar pula bagian total protein yang merupakan kolagen. Kolagen juga merupakan komponen serat utama dalam tulang, gigi, tulang rawan, lapisan kulit dalam (dermis), tendon (urat daging) dan tulang rawan. Selain itu, bahan di bagian dalam lensa mata tersusun dari kolagen murni. Kolagen ada dalam semua organ yang menampilkan kekuatan dan kekakuan (Lehninger 1993).
Molekul dasar pembentuk kolagen disebut tropokolagen yang mempunyai struktur batang dengan BM 300 000, dimana di dalamnya terdapat tiga rantai polipeptida yang sama panjang, bersama-sama membentuk struktur heliks. Tiap tiga rantai polipeptida dalam unit tropokolagen membentuk struktur heliks tersendiri, bersama-sama dengan ikatan hidrogen antara group NH dari residu glisin pada rantai yang satu dengan group CO pada rantai lainnya. Cincin pirolidin, prolin, dan hidroksiprolin membantu pembentukan rantai polipeptida dan memperkuat struktur tiga heliks (Wong 1989).
Tropokolagen akan terdenaturasi oleh pemanasan atau perlakuan dengan zat seperti asam, basa, urea, dan kalium permanganat. Selain itu, serabut kolagen dapat mengalami penyusutan jika dipanaskan di atas suhu penyusutannya (Ts). Suhu penyusutan (Ts) kolagen ikan adalah 45 oC. Jika kolagen dipanaskan pada T>Ts (misalnya 65–70 oC), serabut tiga heliks yang dipecah menjadi lebih panjang. Pemecahan struktur tersebut menjadi lilitan acak yang larut dalam air menghasilkan gelatin. Menurut Fernandez-Diaz et al. (2001), kolagen kulit ikan lebih mudah hancur daripada kolagen kulit hewan lainnya, dimana kedua jenis kolagen ini akan hancur oleh proses pemanasan dan aktivitas enzim.
Ikan Patin (Pangasius sp.)
3
keras yang berubah menjadi senjata yang dikenal dengan patil. Di bagian permukaan punggung ikan patin terdapat sirip lemak yang berukuran kecil.
Di Indonesia, ada dua macam ikan patin yang dikenal yaitu patin lokal (Pangasius pangasius) atau sering pula disebut jambal (Pangasius djambal) dan patin bangkok atau patin siam (Pangasius hypophtalamus sinonim P. sutchi). Saanin (1984) mengatakan, patin jambal memiliki sungut rahang atas lebih panjang dari setengah panjang kepala, hidung sedikit menonjol ke muka serta mata agak ke bawah. Sedangkan Hernowo (2001) menjelaskan, patin siam merupakan ikan yang masuk ke Indonesia pada tahun 1972 dari Thailand.
Menurut Kordik (2005), sistematika ikan patin diklasifikasikan sebagai berikut:
Elektroforesis mampu memisahkan protein dengan baik berdasarkan titik isoelektrik dan berat molekul. Salah satu jenis elektroforesis yang digunakan secara luas saat ini adalah Sodium Dodecyl Sulphate Polyacrilamid Gel Electrophoresis (SDS PAGE). SDS PAGE dinilai lebih menguntungkan dibandingkan elektroforesis kertas dan elektroforesis pati. Hal ini disebabkan karena besarnya pori medium penyangga serta perbandingan konsentrasi akrilamida dan bis-metilen akrilamida. Selain itu, gel ini bersifat transparan (Bintang 2010).
Menurut Roe (2001) dan Ahmed (2005) SDS PAGE merupakan metode yang cukup cepat dalam identifikasi protein dan sering digunakan untuk memperkirakan berat molekul serta menentukan komposisi subunit dari suatu protein murni (Deutscher 1992). Penggunaan lain SDS PAGE adalah untuk memonitoring purifikasi protein, verifikasi konsentrasi protein, deteksi proteolisis, deteksi modifikasi protein, dan deteksi imunopresipitasi protein (Ahmed 2005).
4
Deteksi protein dalam gel dilakukan dengan berbagai macam pewarnaan seperti coomassie blue, silver nitrat, dan amido black. Coomassie blue merupakan pewarnaan yang cepat dan sering digunakan untuk visualisasi protein pada gel poliakrilamida (Bonner 2007).
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Layanan dan Pendidikan Fakultas Kedokteran Hewan, serta Laboratorium Embriologi, Departemen Anatomi Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan Februari 2013 sampai dengan Mei 2014.
Alat
Alat yang digunakan pada penelitian ini adalah peralatan bedah steril, botol Scott (pyrex) 50 ml dan 100 ml, gelas baker 250 mL, cawan petri kaca berdiameter 10 cm, tabung ependorf, timbangan, kantong dialisis (ukuran membran untuk BM 12000-14000), stirer (Jenway 1000), tabung sentrifugasi, ultrasentrifugasi (Himac / R20A2), nanodrop spektrofotometer, elektoforesis.
Bahan
Bahan yang digunakan adalah kulit ikan patin, kolagen kulit sapi (Sigma, USA), natrium asetat, natrium sitrat, asam asetat, NaCl 0.9%, air murni MilliQ, Alkohol 70%, dinatrium hidrogen fosfat, dan pewarna Cason’s trichrome.
Metode Penelitian
Persiapan Bahan Baku
Bahan yang digunakan untuk isolasi kolagen berasal dari kulit ikan patin yang diperoleh dari pasar tradisional. Kulit ikan patin dibersihkan dari lendir, lalu kulit dipreparir menggunakan skalpel agar terpisah dari otot. Kulit ikan patin dicuci dengan alkohol 70%, lalu dibilas 2-3 kali dengan NaCl 0.9%. Kulit ikan patin ditimbang lalu diambil sebanyak 24 gram untuk tiga kali ulangan (masing-masing 8 gram untuk satu kali ulangan).
Isolasi Kolagen dari Kulit Ikan Patin
Isolasi kolagen dari kulit ikan patin menggunakan metode dari Voytik-Harbin et al. (2011) dengan modifikasi. Kulit ikan patin yang telah ditimbang masing-masing 8 gram kemudian dipotong kecil-kecil lalu dimasukkan ke dalam botol Schott ukuran 50 ml yang berisi 32 ml natrium asetat, disimpan pada suhu 4
ᵒC selama satu malam. Campuran diaduk dengan magnetic stirrer selama 5-10
5
Setelah supernatan dibuang, endapan dilarutkan kembali dengan natrium asetat dengan volume yang sama dan prosedur diulang sebanyak tiga kali. Endapan selanjutnya dibilas dengan air MilliQ dingin dengan volume yang sama dan disentrifugasi selama 30-60 menit pada 4 ᵒC dengan kecepatan 2000 rpm (700g) dan dilakukan sebanyak tiga kali.
Endapan selanjutnya diekstrak dengan 0.075 M natrium sitrat dengan volume yang sama dan disimpan selama 15-18 jam (satu hari) pada suhu 4 ᵒC. Campuran diaduk dengan magnetic stirrer selama 5-10 menit beberapa kali selama proses penyimpanan untuk melarutkan kolagen. Campuran selanjutnya disentrifugasi selama 30-60 menit dengan suhu 4 ᵒC dan kecepatan 2000 rpm (700 g). Supernatan disimpan, endapan dilarutkan kembali dengan natrium sitrat untuk reekstraksi dengan prosedur yang sama dan diulang sampai 3 kali. Supernatan hasil reekstraksi digabung menjadi satu. Supernatan gabungan selanjutnya disentrifugasi selama 60 menit pada suhu 4 ᵒC dengan kecepatan 9750 rpm (17000 g) untuk penjernihan. Supernatan dikoleksi dan endapan dibuang. Selanjutnya supernatan didialisis dalam kantong dialysis (menahan molekul ≥ 12 kDa) secara ekstensif terhadap larutan 0.02 M dinatrium hidrogen fosfat pada suhu 4 ᵒC selama beberapa hari atau sampai dengan 1 minggu. Larutan dinatrium hidrogen fosfat diganti beberapa kali (setiap hari) sampai kolagen mengalami presipitasi (penggumpalan, butiran halus berwarna putih, terlihat kasat mata).
Larutan yang mengandung butiran halus kolagen hasil ekstraksi selanjutnya disentrifugasi selama 30-60 menit, suhu 4 ᵒC, dan kecepatan 2000 rpm (700 g). Supernatan dibuang, endapan dibilas dengan air MilliQ dingin dengan volume yang sama dan prosedur pembilasan diulang sampai 3 kali. Terakhir, endapan dilarutkan dengan 0.1 M asam asetat dengan volume secukupnya (300-500 µL) untuk melarutkan endapan kolagen. Larutan endapan kolagen dipindahkan ke tabung ependorf 1.5 mL dan disimpan pada 4 ᵒC atau untuk identifikasi kolagen.
Pemeriksaan Konsentrasi Kolagen
Konsentrasi kolagen diperiksa dengan menggunakan nanodrop spektrofotometer pada panjang gelombang 280 nm. Masing-masing dari tiga hasil isolasi kolagen kulit ikan patin diambil sebanyak 5 µL. Pemeriksaan larutan sampel dilakukan dua kali (duplo) untuk mendapatkan nilai absorbansi dan konsentrasi rata-rata.
Pendeteksian Jaringan Kolagen
6
Berat Molekul dan Pola Pita Protein Kolagen
Pengukuran berat molekul dan pola pita protein kolagen dianalisis menggunakan SDS-PAGE menggunakan metode Laemmli (1970). Berat molekul kolagen diukur dengan standar protein BM rendah, 10% gel pemisah dan 4% gel penahan. Gel dirunning dalam 600 ml buffer elektroforesis pH 8.3 mengandung 192 mM glisin, 0.1% SDS, dan 24.8 mM Trisbase (Tris hidroksi amino metan). Sebelum dimasukkan ke dalam sumur, sampel dan marker ditambahkan buffer sampel (rasio 1:1) kemudian diinkubasi dalam air mendidih selama 1 menit. Buffer sampel mengandung 1 gram SDS, 2 ml gliserol 50%, 2 ml bromophenol biru 0.1%, 1.25 ml TrisCl 1 M pH 6.8 yang ditambahkan aquades hingga volume akhir menjadi 10 ml. Total volume marker dan sampel adalah 20 µL. Elektroforesis dijalankan dengan kondisi 100 mA, 100 volt selama 90-120 menit. Deteksi pita protein menggunakan pewarna coomassie brilliant blue (CBB), yaitu dalam 100 ml larutan mengandung 40% metanol, 10% asam asetat dan 0.1% CBB R-250. Larutan peluntur yang digunakan mengandung 40% metanol dan 10% asam asetat.
HASIL DAN PEMBAHASAN
Konsentrasi Kolagen Ikan Patin
Kolagen ikan patin telah berhasil diisolasi. Analisis kuantitatif dengan spektrofotometer pada panjang gelombang 280 nm menunjukkan konsentrasi kolagen rata-rata 4.90 ± 1.92 mg/mL dan kemurnian dengan rasio nilai absorbansi pada panjang gelombang 260 nm dan 280 nm (A260/A280) rata-rata 1.32 ± 0.03 (Tabel 1).
Tabel 1 Hasil pengukuran konsentrasi kolagen yang diisolasi dari kulit ikan patin
Sampel Kolagen Konsentrasi (mg/mL) A260/A280
Patin 1 4.496 1.30
Patin 2 7.422 1.32
Patin 3 2.765 1.35
Rata-rata ± SD 4.90 ± 1.92 1.32 ± 0.03
Data diperoleh dari rata-rata dua kali pengukuran (duplo), SD= simpangan baku
7
Tabel 2 Estimasi perolehan kolagen hasil isolasi per bobot kulit dan bobot badan ikan patin
Sampel Bobot kulit (g/kg ikan) Estimasi perolehan kolagen (mg) /g kulit* /Kg ikan
Patin 1 29.4 2.53 74.4
Patin 2 31.6 4.17 131.8
Patin 3 31.8 1.56 49.6
Rata-rata ± SD 30.9 ± 1.1 2.75 ± 1.32 85.3 ± 42.2 *Konsentrasi kolagen x volume larutan kolagen hasil isolasi (=4.5 mL), SD= simpangan baku
Konsentrasi yang diperoleh dari larutan kolagen hasil isolasi tergantung pada volume pelarut (asam asetat) yang ditambahkan. Semakin banyak volume yang ditambahkan, konsentrasi kolagen yang didapatkan semakin kecil. Pada penelitian ini kolagen diencerkan dengan 500 µl pelarut dan diperoleh kolagen dengan konsentrasi yang tinggi (4.90 ± 1.92). Sebagai contoh, dalam pembuatan matriks kolagen untuk kultur in vitro digunakan kolagen dengan konsentrasi 3.3 mg/mL pelarut (Montesano et al. 1983). Dengan demikian, apabila kolagen hasil penelitian ingin digunakan untuk keperluan seperti kultur in vitro, maka dengan mudah dapat diencerkan.
Kemurnian protein diukur dengan spektrofotometer dengan melihat rasio nilai absorbansi pada panjang gelombang 260 nm dan 280 nm (A260/A280). Panjang gelombang 260 nm merupakan serapan maksimum untuk asam nukleat sedangkan panjang gelombang 280 nm merupakan serapan maksimum untuk protein (Bintang 2010). Protein hasil isolasi dikatakan murni apabila rasio A260/A280 ≤ 1.0 (Promega 2009). Hasil penelitian menunjukkan kemurnian kolagen ikan patin yang diisolasi dengan rasio A260/A280 sebesar 1.30-1.35, hal ini berarti kolagen yang diisolasi tidak sepenuhnya murni kolagen. Kontaminasi kemungkinan berasal dari DNA atau RNA pada saat ekstraksi jaringan kulit.
Efisiensi proses isolasi kolagen dalam penelitian ini masih rendah. Hasil yang didapatkan pada penelitian ini yaitu rata-rata 2.75 ± 1.32 mg/g bobot kulit (0.28%) lebih rendah dibandingkan dengan hasil yang dilaporkan oleh peneliti sebelumnya yaitu 1.27% dan 9.59% dari tulang rawan ikan hiu dengan metode
acid dan pepsin soluble extraction (Kittiphattanabawon et al. 2010). Perbedaan ini dapat disebabkan oleh proses pengadukan (stirring) pada penelitian ini tidak dilakukan secara terus-menerus, sebaliknya pada penelitian Kittiphattanabawon et al. (2010) pengadukan dilakukan secara terus-menerus serta dilakukan penambahan enzim pepsin yang dapat memecah protein menjadi molekul yang lebih kecil, sehingga akan membantu proses ekstraksi kolagen.
Pendeteksian Jaringan Kolagen Ikan Patin
8
Hasil pewarnaan juga menunjukkan kolagen ikan hasil isolasi berada pada potongan lebih kecil dibandingkan dengan potongan kolagen kulit sapi komersial.
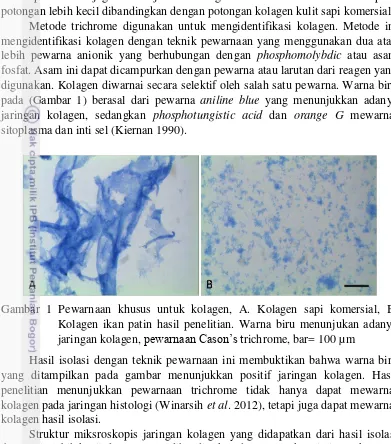
Metode trichrome digunakan untuk mengidentifikasi kolagen. Metode ini mengidentifikasi kolagen dengan teknik pewarnaan yang menggunakan dua atau lebih pewarna anionik yang berhubungan dengan phosphomolybdic atau asam fosfat. Asam ini dapat dicampurkan dengan pewarna atau larutan dari reagen yang digunakan. Kolagen diwarnai secara selektif oleh salah satu pewarna. Warna biru pada (Gambar 1) berasal dari pewarna aniline blue yang menunjukkan adanya jaringan kolagen, sedangkan phosphotungistic acid dan orange G mewarnai sitoplasma dan inti sel (Kiernan 1990).
Gambar 1 Pewarnaan khusus untuk kolagen, A. Kolagen sapi komersial, B. Kolagen ikan patin hasil penelitian. Warna biru menunjukan adanya jaringan kolagen, pewarnaan Cason’s trichrome, bar= 100 µm
Hasil isolasi dengan teknik pewarnaan ini membuktikan bahwa warna biru yang ditampilkan pada gambar menunjukkan positif jaringan kolagen. Hasil penelitian menunjukkan pewarnaan trichrome tidak hanya dapat mewarnai kolagen pada jaringan histologi (Winarsih et al. 2012), tetapi juga dapat mewarnai kolagen hasil isolasi.
Struktur miksroskopis jaringan kolagen yang didapatkan dari hasil isolasi ikan patin lebih kecil dan seragam dibandingkan dengan struktur jaringan kolagen kulit sapi komersial. Kumar et al. (2011) menyatakan bahwa kolagen yang diisolasi dari kulit dan tulang ikan memiliki struktur molekul yang lebih kecil dibandingkan dengan kolagen yang diisolasi dari sapi atau babi sehingga lebih mudah untuk diserap. Isolasi ini bertujuan untuk menunjang kultur in vitro,
sehingga jaringan kolagen hasil isolasi ikan patin diharapkan mampu berfungsi sebagai substrat pada kultur dengan lebih baik.
Berat Molekul dan Pola Pita Protein Kolagen Ikan Patin
9
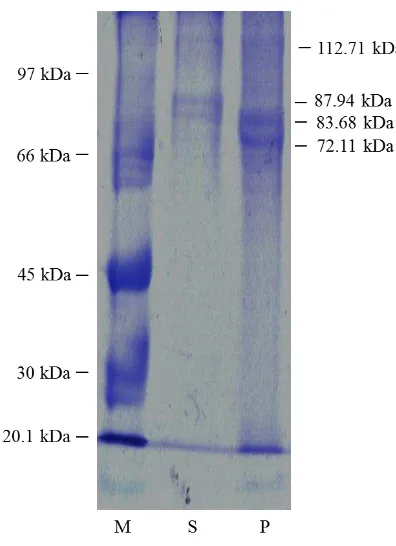
Gambar 2 Pola pita protein kolagen kulit ikan patin. Keterangan: M= low molecular weight protein marker, S= kolagen kulit sapi komersial (kontrol), P= kolagen dari kulit ikan patin.
Kolagen kulit sapi komersial yang digunakan sebagai kontrol pada penelitian ini telah diketahui berasal dari kolagen tipe 1 (Sigma, USA). Kolagen ikan patin menunjukkan berat molekul dan pita protein yang hampir sama dengan komersial. Oleh karena itu, ikan patin dapat dikatakan berasal dari kolagen tipe 1. Menurut Muyonga et al. (2004) kolagen tipe 1 umumnya ditemukan dalam jaringan ikat, termasuk tendon, tulang dan kulit. Nagai dan Suzuki (2010) juga telah melaporkan bahwa kolagen utama dari kulit ikan dan tulang mengandung kolagen tipe 1.
Kolagen memiliki banyak aplikasi dan kegunaan. Kolagen telah banyak digunakan untuk kepentingan biomedis, industri makanan, industri obat, dan industri kosmetik. Lee et al. (2001) menyatakan kolagen merupakan biomaterial yang penting bagi aplikasi medis karena sifatnya yang mudah didegradasi dengan antigenitas yang rendah. Kolagen dalam in vitro dipergunakan sebagai tissue engineering (Pachence 1996) diantaranya adalah pengganti jaringan kulit dan pembawa implan untuk protein penginduksi tulang (Lee et al. 2001).
Larutan kolagen banyak dipergunakan sebagai substrat extracelluler matrix
10
SIMPULAN DAN SARAN
Simpulan
Isolasi kolagen dari kulit ikan patin berhasil dilakukan dengan efisiensi 0.28%. Kolagen yang diisolasi menunjukkan positif terhadap pewarnaan Cason’s trichrome, memiliki dua pita protein yang sama dan satu pita protein yang berbeda dengan kolagen kulit sapi komersial.
Saran
Perlu dilakukan penelitian lanjutan untuk menguji efektivitas kolagen yang telah diisolasi sebagai matriks ekstraseluler pada kultur sel in vitro. Peningkatan efisiensi isolasi kolagen dapat digunakan enzim pepsin untuk memecah protein.
DAFTAR PUSTAKA
Ahmed H. 2005. Principles and Reactions of Proteins Extraction, Purification, and Characterization. USA (US): CRC Press.
Bailey AJ, Light ND. 1989. Connetive tissue in meat and meat products. Elsevier Applied Science. London
Bintang M. 2010. Teknik Penelitian Biokimia. Jakarta (ID): Erlangga.
Bonner PLR. 2007. Protein Purification. New York (US): Tailor and Francis Group.
Deutscher MP. 1992. Guide to Protein Purification. USA (US): Academic Pr. Djariah AS. 2001. Budi Daya Ikan Patin. Yogyakarta (ID): Kanisius.
Fernandez-Diaz MD, Montero P, Gomez-Guillen MC. 2001. Gel properties of collagens from skin of cod (Gadus morhua) and hake (Merluccius merluccius) and their modification by the coenhancers magnesium sulphate, glycerol and transglutaminase. Food Chem. 74:161–167.
Hames BD. 1998. Gel Elctrophoresis of Proteins. New York (US): Oxford University Press Inc.
Hernowo. 2001. Pembenihan Patin Skala Kecil dan Besar, Solusi Permasalahan. Jakarta (ID): Penebar Swadaya.
Johansson M, Mattsson G, Andersson A, Jansson L, Carlsson PO. 2006. Islet endothelial cells and pancreatic beta-cell proliferation: studies in vitro and during pregnancy in adult rats. Endocrinology. 147(5):2315-2324.
Karim AA, Bhat R. 2009. Review fish gelatin: properties challenges and prospects as an alternative to mammalian gelatins. Trends Food Sci Technol. 19:644-656. Kiernan JA. 1990. Histological and Histochemical Methods: Theory and Practice.
Inggris (GB): Pergamon Pr.
11
[KKP] Kementerian Kelautan dan Perikanan. 2013. Statistik perikanan budidaya kolam. [Internet]. [diunduh 2014 Mei 5]. Tersedia pada http://www.statistik. kkp.go.id
Kordik MGH. 2005. Budidaya Ikan Patin, Biologi, Pembenihan dan Pembesaran.
Yogyakarta (ID): Yayasan Pustaka Nusantara.
Kumar MH, Spandana V, Poonam T. 2011. Extraction and determination of collagen peptide and its clinical importance from tilapia fish scales
Oreochromis niloticus. Int Res J Pharm. 2(10):97-99.
Laemmli UK. 1970. Cleavage of structural protein during the assembly of the head of bacteriophage T4. Nature. 227:680-685.
Lee CH, Singla A, Lee Y. 2001. Biomedical application of collagen. J Pharmaceutics. 22:1-22.
Lehninger LA. 1993. Dasar-Dasar Biokimia. Maggy T, penerjemah. Jakarta (ID): Erlangga. Terjemahan dari: School of Medicine.
Montesano R, Orci L, Vassalli P. 1983. In vitro rapid organizations of endothelial cells into capillary-like networks is promoted by collagen matriks. J Cell Biol.
97:1648-1652.
Muyonga JH, Cole CGB, Duodu KG. 2004. Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus). Food Chem. 85:81-89.
Nagai T, Suzuki N. 2000. Preparation and characterization of several fish bone collagens. J Food Biochem. 24:427-436.
Pachence JM. 1996. Collagen-based devices for soft tissue repair. J Biomed.
33:35-40.
Pang Y, Greisler HP. 2010. Using a type 1 collagen-based system to understand cell-scaffold interactions and to deliver chimeric collagen-binding growth factors for vascular tissue engineering. J Investig Med. 58: 845-848.
Pierre C, Morrison JA, Rath P, Zigler RE, Engel LA, Fairchild CL, Shi H, Maruniak JA, Kirk MD. 2010. Developmental cues and persistent neurogenic potential within an in vitro neural niche. Dev Biol. 10:1-19.
Promega. 2009. Calculating Nucleic Acid or Protein Concentration. [Internet]. [diunduh 2014 Agustus 14]. Tersedia pada http://www.promega.com
Roe S. 2001. Protein Purification Techniques: A Practical Approach. Great Britain (GB): The bath Press.
Saanin H. 1984. Taksonomi dan Kunci Identifikasi Ikan Bagian I. Jakarta (ID): Bina Cipta.
Sosef MN, Baust JM, Sugimachi K, Fowler A, Thompkins RG, Toner M. 2005. Cryopreservation of isolated primary rat hepatocytes enhanced survival and long term hepatospecific function. Ann Surg. 241:125-133.
Susanto H, Amri K. 2002. Budi Daya Ikan Patin. Jakarta (ID): Penebar Swadaya. Voytik-Harbin, Sherry L, Zionsville, Kreger S, Richmond N, Bell B, Lafayette,
Balley J, penemu; Purdue Research Foundation. 2011 Des 27. Collagen preparation and method of isolation. Amerika Serikat (US) 8,084,055 B2. Winarsih W, Wientarsih I, Sutardi LN. 2012. Aktivitas salep ekstrak rimpang
kunyit dalam proses persembuhan luka pada mencit yang diinduksi diabetes. J Vet. 13(3):242-250.
12
LAMPIRAN
Lampiran 1 Low molecular weight protein marker yang digunakan pada
SDS PAGE
Nama Protein BM Log BM Run (cm) Pita (cm) Rf Phosphorylase 97000 4.986771734 4.5 0.6 0.13333
Albumin 66000 4.819543936 4.5 1.2 0.26667
Ovalbumin 45000 4.653212514 4.5 2.3 0.51111
Carbonic anhydrase 30000 4.477121255 4.5 3.1 0.68889 Trypsin inhibitor 20100 4.303196057 4.5 3.6 0.8 a- Lactalbumin 14400 4.158362492 4.5 4.1 0.91111
Lampiran 2 Perhitungan berat molekul protein kulit sapi komersial dan kulit ikan patin hasil SDS PAGE
Sampel Run (cm)
Pita
(cm) Rf A b BM
BM (kDa)
Jumlah pita S 4.5 0.3 0.06667 0.9698 51.166 112706 112.71 3
4.5 0.8 0.17778 0.9698 51.166 87940.9 87.94 4.5 0.9 0.2 0.9698 51.166 83683.5 83.68
P 4.5 0.3 0.06667 0.9698 51.166 112706 112.71 3 4.5 0.9 0.2 0.9698 51.166 83683.5 83.68
13
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Polewali Mandar, Sulawesi Barat pada 14 Januari 1992. Penulis merupakan anak kedua dari tiga bersaudara dari Muhammad Abduh dan Siti Nahariah. Penulis bersekolah dari sekolah dasar (SD) sampai dengan sekolah menengah atas (SMA) di Kabupaten Polewali Mandar. Sekolah Dasar Negeri 001 Polewali merupakan jenjang pendidikan pertama yang ditempuh penulis selama enam tahun dan lulus pada tahun 2004. Jenjang pendidikan selanjutnya adalah SMP Negeri 3 Polewali yang ditempuh selama tiga tahun dan lulus pada tahun 2007. Setelah lulus SMP, penulis melanjutkan sekolah di SMA Negeri 1 Polewali Kabupaten Polewali Mandar dan lulus pada tahun 2010. Penulis diterima di Fakultas Kedokteran Hewan (FKH) IPB melalui jalur Beasiswa Utusan Daerah (BUD) pada tahun 2010.