MOCHAMAD SYAIFUL RIJAL HASAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul “Polimorfisme
Gen Fekunditas (BMPR1B dan BMP15) pada Kambing Kacang, Samosir dan
Muara” adalah benar hasil karya saya sendiri dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2011
(BMPR1B and BMP15) on Kacang, Samosir and Muara goats. Under supervision
of ACHMAD FARAJALLAH and RADEN RORO DYAH PERWITASARI.
Several Indonesian local goats are prolific. Fecundity was controlled by
fecundity genes such as Bone Morphogenetic Protein Receptor 1B (BMPR1B),
Bone Morphogenetic Protein 15 (BMP15) and Growth Differentiation Factor 9
(GDF9). The present study aimed to identify the genetic diversity of fecundity
genes (BMPR1B and BMP15) on three Indonesian local goats, namely Kacang,
Samosir, and Muara, using PCR-RFLP and nucleotide sequencing methods. The PCR-RFLP’s showed that all sample of three Indonesian local goats are monomorphic. Verification result by nucleotide sequencing found two
substitution were G72T on BMPR1B gene exon 8 and G43A on BMP15 gene
exon 2. Both of the mutation were not part of recognizing site of restriction enzymes. Furthermore, the genetic diversity was identified for exon 1 and exon 2 of BMP15. Nucleotide sequence of exon 1 of BMP15 gene was monomorphic among the three Indonesian local goats. On the other hand, there are three mutant alleles were found on exon 2 among the three Indonesian local goats. Two mutant alleles of A325G and C398G were found on Kacang goats population. One mutant allele was C34T on Muara goats population. The population of Samosir goats have identically sequence of BMP15 exon 2. The phylogenetic tree based on coding sequence exon 2 showed that Kacang, Samosir and Muara goats clustered with several local goats in the world. Moreover, the phylogenetic tree also defined Kacang, Samosir and Muara goats as monoovulation group.
(BMPR1B dan BMP15) pada Kambing Kacang, Samosir dan Muara. Dibimbing
oleh ACHMAD FARAJALLAH dan RADEN RORO DYAH
PERWITASARI.
Indonesia memiliki potensi keanekaragaman hayati yang tinggi. Salah satunya adalah kambing lokal. Beberapa kambing lokal di Indonesia memiliki sifat unggul, antara lain bersifat prolifik. Sifat prolifik ini dikendalikan oleh gen
fekunditas, antara lain Bone Morphogenetic Protein Receptor 1B (BMPR1B),
Bone Morphogenetic Protein 15 (BMP15) dan Growth Differentiation Factor 9
(GDF9). Gen BMPR1B yang dikenal sebagai FecB terletak pada kromosom 6 dan
diekspresikan oleh sel oosit dan sel granulosa dalam ovarium. Mutasi pada FecB
yang berkaitan dengan sifat prolifik adalah substitusi A746G yang menyebabkan
substitusi asam amino Q249R. Adapun gen BMP15 yang dikenal sebagai FecX
terletak di kromosom X dan hanya diekspresikan di dalam sel-sel oosit. Beberapa
alel mutan pada gen BMP15 yang berhubungan dengan sifat prolifik adalah FecXI
(Inverdale), FecXH (Hanna), FecXB (Belclare), FecXG (Galway), FecXL (Lacaune)
dan FecXR (Rasa Aragonesa). Penelitian ini bertujuan untuk mengidentifikasi
keragaman genetik gen fekunditas (BMPR1B dan BMP15) pada kambing Kacang,
Samosir dan Muara menggunakan metode PCR-RFLP dan sekuensing nukleotida. Penelitian ini dibagi menjadi dua tahap. Tahap pertama, PCR-RFLP gen
BMPR1B ekson 8 dengan menggunakan enzim AvaII dan gen BMP15 ekson 2
dengan menggunakan enzim HinfI. Tahap kedua, sekuensing nukleotida gen
BMP15 ekson 1 dan 2.
Hasil PCR-RFLP, baik gen BMPR1B maupun gen BMP15 menunjukkan
bahwa semua sampel dari kambing Kacang, Samosir dan Muara merupakan tipe liar atau non-prolifik dan bersifat monomorfik. Hal ini tidak sesuai dengan data lapangan bahwa beberapa sampel yang diperoleh mempunyai jumlah anak sekelahiran lebih dari satu. Hasil ini mengindikasikan bahwa metode PCR-RFLP gen BMPR1B dan BMP15 tidak dapat dijadikan sebagai alat deteksi pada kambing Kacang, Samosir dan Muara. Hasil verifikasi dengan metode sekuensing menggunakan primer yang sama menunjukkan bahwa mutasi G72T pada gen
BMPR1B dan mutasi G43A pada gen BMP15 bukan bagian dari situs pengenalan dari enzim restriksi yang digunakan.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB yang wajar
MOCHAMAD SYAIFUL RIJAL HASAN
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Biosains Hewan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Mochamad Syaiful Rijal Hasan
NRP : G352090161
Disetujui
Komisi Pembimbing
Dr. Ir. Achmad Farajallah, M.Si Dr. Ir. R.R. Dyah Perwitasari, M.Sc Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Biosains Hewan
Dr. Bambang Suryobroto Dr. Ir. Dahrul Syah, M.Sc. Agr
Tanggal Ujian : 11 Juli 2011 Tanggal Lulus :
Fekunditas (BMPR1B dan BMP15) pada kambing Kacang, Samosir dan Muara
sebagai prasyarat untuk memperoleh gelar Magister Sains dari Mayor Biosains
Hewan, Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam,
Institut Pertanian Bogor.
Penulis mengucapkan terima kasih atas segala bimbingan dan saran
dalam menyelesaikan penelitian ini kepada Bapak Dr. Achmad Farajallah dan Ibu
Dr. R.R. Dyah Perwitasari selaku Dosen Pembimbing. Ucapan Terima kasih
penulis sampaikan kepada Prof. Drh. Arief Boediono PhD. selaku Penguji Luar
Komisi atas saran dan arahannya. Penulis juga menyampaikan terima kasih
kepada Departemen Agama Republik Indonesia atas Program Beasiswa Utusan
Daerah (BUD) pada Sekolah Pasca Sarjana Institut Pertanian Bogor. Ucapan
terimakasih juga penulis sampaikan atas sebagian bantuan dana penelitian dari
kegiatan Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi
(KKP3T) tahun 2010 dengan judul “Identifikasi Tiga Gen Fekunditas pada Empat
Jenis Kambing Lokal (Kacang, Peranakan Etawah, Samosir dan Muara)”.
Penulis menyampaikan terima kasih kepada Pimpinan dan Karyawan
Lokalit Kambing Potong Sei putih, Medan serta beberapa pemilik kambing di
Kabupaten Tapanuli Utara dan Kabupaten Samosir. Terima kasih juga kepada zoo
corner community, Dr. Aron Batu Bara, Wildan Najmal Muttaqin M.Si dan Eryk
Andreas M.Pt serta semua teman-teman atas kekeluargaannya.
Ungkapan terima kasih yang tiada tara penulis persembahkan kepada Aba,
Ummi dan Cak Lutfi atas dukungan do’a dan curahan kasih sayangnya. Ungkapan
cinta pada istri dan putraku (Alkhoiriyatur Raudiatul Jannah “DIAH” dan Sayyid
Husein Ahmadinejad “ZEN”) atas kesetiaan, ketulusan dan kesabarannya dalam
mengobarkan semangat tuk terus melangkah dalam susah dan senang menatap
masa depan. Akhirnya tiada gading yang tak retak. Semoga karya ilmiah ini
bermanfaat.
Bogor, Juni 2011
Penulis adalah putra kedua dari dua bersaudara dari pasangan H.M. Hasan
Abdus Syafik dan Hj. Siti Rohmah Eja Rahmawati. Penulis lahir di Jember-Jawa
Timur pada 02 Februari 1981. Penulis lulus dari SMUN Kalisat pada tahun 1998,
kemudian melanjutkan pendidikan pada jenjang sarjana di Fakultas Matematika
dan Ilmu Pengetahuan Alam (FMIPA), Jurusan Biologi, Universitas Negeri
Jember tahun 1999. Pada tahun 2004 penulis dapat menyelesaikan studi S1.
Penulis bekerja sebagai guru swasta yang memegang mata pelajaran
biologi di Madrasah Aliyah Al Badri di Jember hingga saat ini. Pada tahun 2009,
Alhamdulillah penulis mendapat kesempatan memperoleh beasiswa utusan daerah
di Sekolah Pascasarjana Program Studi BioSains Hewan, Institut Pertanian Bogor
DAFTAR TABEL………...….………..
Halaman
1 Penampilan Tiga Kambing Lokal Indonesia……….
2 Amplikon gen BMPR1B………...……….………...…...
3 Amplikon gen BMP15 ekson 2………...
4 Mutasi substitusi G→T gen BMPRIB nukleotida ke-72
pada kambing Kacang, Samosir dan Muara………..….
5 Mutasi substitusi G→A gen BMP15 nukleotida ke-43
pada kambing Kacang, Samosir dan Muara .………..…………..
6 Amplikon gen BMP15 ekson 1 dan 2 pada kambing Kacang………
7 Mutasi substitusi gen BMP15 pada kambing Kacang ………...
8 Mutasi substitusi C34T pada kambing Muara ………...…
9 Pohon filogeni kambing lokal Indonesia berdasarkan daerah
coding sequence gen BMP15 ekson 2 menggunakan program MEGA 4 dengan
metode Neighbour-joining dengan bootstrap 1000x. Angka di percabangan menunjukkan nilai bootstrap……...……..……
2
9
9
10
10
15
16
16
1 Jumlah sampel darah kambing………...……...
2 Alel mutan pada gen BMP15……….………….……….
7
18
DAFTAR LAMPIRAN
Halaman
1 Informasi sekuens gen BMP15 pada Capra hircus
breed Guizhou White………..
2 Beberapa spesies yang digunakan dalam analisis pohon filogeni gen
BMP15 ekson 2………
3 Hasil pensejajaran coding sequence Ekson 2 Gen BMP15 kambing
lokal Indonesia terhadap beberapa spesies Mamalia, burung dan ikan (No. merujuk pada nama spesies yang ada di lampiran 2). Nomor tiga baris di bagian atas dibaca secara vertikal).………….………… ……...
.
33
35
PENDAHULUAN
Latar Belakang
Indonesia memiliki sumber daya alam dengan keragaman genetik yang
melimpah. Salah satu diantaranya adalah ternak kambing lokal Indonesia yang
telah beradaptasi dengan kondisi geografis setempat. Kambing di Indonesia
merupakan ternak ruminansia kecil dengan jumlah paling tinggi di Asia Tenggara
(Sodiq & Taufik 2003).
Beberapa kambing lokal Indonesia seperti kambing Kacang, Samosir dan
Muara memiliki keunggulan karena bersifat prolifik (Gambar 1). Kambing
Kacang merupakan kambing asli Indonesia. Kambing Kacang merupakan
kambing penghasil daging dengan rata-rata litter size 1.56–1.98 anak per
kelahiran (Hoda 2008). Kambing Kacang memiliki ukuran tubuh sedang dengan
corak warna yang sangat beragam mulai dari putih, hitam, coklat ataupun
kombinasi dari ketiga warna tersebut. Kambing Samosir dipelihara oleh penduduk
di Pulau Samosir, Kabupaten Toba Samosir dan sering digunakan sebagai bahan
upacara persembahan salah satu aliran kepercayaan (Parmalim). Kambing
Samosir memiliki ciri khas berupa warna bulu dominan putih dengan ukuran
tubuh sedang. Adapun kambing Muara telah lama beradaptasi di Kecamatan
Muara Kabupaten Tapanuli Utara dengan kondisi topografi yang
bergunung-gunung. Ciri khas Kambing Muara adalah ukuran tubuhnya paling besar diantara
kambing Kacang maupun kambing Samosir. Kambing Muara memiliki corak
warna yang bervariasi seperti pada kambing Kacang.
Sifat prolifik yaitu kemampuan mempunyai anak lebih dari satu dalam
satu kali kelahiran. Sifat prolifik pada ternak ruminansia dapat dibedakan menjadi
dua kelompok, yaitu monozigot dan multizigot. Kelompok monozigot
mengovulasikan satu oosit, kemudian embrio muda yang terbentuk membelah
menjadi dua atau lebih embrio yang mampu hidup. Kelompok ini akan
menghasilkan anak kembar identik. Kelompok multizigot mengovulasikan lebih
dari satu oosit dalam suatu waktu. Apabila ada beberapa oosit yang berhasil
dibuahi maka ternak akan melahirkan lebih dari satu anak dalam satu kali periode
Gambar 1 Penampilan Tiga Kambing Lokal Indonesia.
Salah satu tahapan penting dalam sistem reproduksi adalah proses
pematangan folikel hingga siap untuk diovulasikan yang dikenal dengan
oogenesis. Folikel adalah oosit yang dilapisi oleh dua jenis sel somatik, yaitu sel
granulosa dan sel theka. Tahap perkembangan folikel meliputi primordial, primer,
sekunder, awal tersier (antral atau Graafian), akhir tersier dan pre ovulasi.
Rangkaian proses oogenesis melibatkan beragam sinyal baik berupa
hormon maupun faktor. Hormon merupakan sinyal molekul yang dihasilkan oleh
sel endokrin dan didistribusikan melalui aliran darah menuju sel target atau ke
seluruh tubuh. Beberapa hormon yang berperan dalam proses oogenesis antara
lain Follicle Stimulating Hormone (FSH), estrogen, luteinizing Hormone (LH) dan
progesteron. Hormon FSH berfungsi untuk merangsang pertumbuhan sel-sel
folikel di sekeliling ovum. Folikel primordial akan tumbuh menjadi folikel de
Graaf. Folikel de Graaf akan menghasilkan hormon estrogen yang berfungsi
merangsang kelenjar hipofisis untuk mensekresikan hormon LH. Hormon LH
akan merangsang terjadinya ovulasi. Sisa folikel dari proses ovulasi akan
progesteron berperan dalam menghambat kelenjar hipofisis untuk mensekresikan
FSH dan LH.
Faktor merupakan suatu sinyal molekular yang dihasilkan oleh suatu sel
untuk merangsang kerja dari sel lain di sekitarnya. Faktor diedarkan melalui difusi
cairan matriks ekstra selular. Faktor dikelompokkan sebagai sinyal parakrin. Salah
satu contoh sinyal parakrin yang berperan dalam proses oogenesis adalah anggota
super famili Transforming Growth Factor β (TGF β), diantaranya Bone
Morphogenetic Protein Receptor 1B (BMPR1B)dan Bone Morphogenetic Protein
15 (BMP15). BMP15 merupakan suatu faktor pertumbuhan yang berfungsi dalam
mengatur proliferasi dan diferensiasi sel granulosa di awal perkembangan folikel
(Otsuka et al. 2000). BMPR1B merupakan reseptor bagi beberapa faktor BMP
termasuk BMP15 (ten Dijke et al. 2003).
Sifat prolifik dikendalikan oleh gen-gen yang dikelompokkan sebagai gen
kesuburan (fecundity genes) (Davis 2004). Gen BMPR1B atau activin-like kinase
6 (ALK 6) dikenal sebagai FecB. Gen BMPR1B terletak pada kromosom 6 yang
diekspresikan oleh sel oosit dan sel granulosa. Mutasi substitusi A746G atau pada
tingkat asam amino mutasi Q249R pada FecB akan meningkatkan laju ovulasi
rata-rata 1.5 dan rataan litter size 1.0 pada heterozigot carrier. Mutasi yang sama
pada homozigot carrier akan meningkatkan laju ovulasi rata-rata 3.0 dengan
rataan litter size 1.5 (Mulsant et al. 2001; Souza et al. 2001; Wilson et al. 2001;
Davis 2005).
Gen BMP15 atau GDF9B dikenal sebagai FecX terletak di kromosom X
dan diekspresikan oleh sel oosit. Mutasi pada gen BMP15 pertama kali dilaporkan
oleh Galloway et al. (2000). Mutasi pada FecX berkorelasi dengan peningkatan
laju ovulasi dan litter size pada genotip heterozigot carrier, sedangkan pada
genotip homozigot carrier dapat menyebabkan sifat steril. Ada enam alel mutan
yang sudah diketahui pada gen BMP15 yaitu FecXI (Inverdale), FecXH (Hanna),
FecXB (Belclare), FecXG (Galway), FecXL (Lacaune) dan FecXR (Rasa Aragonesa)
(Galloway et al. 2000; Hanrahan et al. 2004; Bodin et al. 2007; Martinez-Royo et
al. 2008). Mutasi substitusi Q239Ter pada gen BMP15 yang berkorelasi dengan
sifat prolifik adalah FecXG. Situs mutan tersebut ternyata bisa dikenali sebagai
kemudian dikembangkan oleh Hanrahan et al. (2004) pada domba menggunakan
teknik PCR-RFLP (Polymerase Chain Reaction Restriction Fragment Length
Polymorphism).
Metode PCR-RFLP merupakan metode untuk mendeteksi ada tidaknya
mutasi pada situs pemotongan yang khas suatu enzim restriksi. Pada beberapa
populasi ternak, PCR-RFLP terbukti sebagai metode deteksi mutasi substitusi
yang cepat dan akurat. Pemanfaatan teknik PCR-RFLP dapat digunakan untuk
meningkatkan produktivitas hewan ternak melalui skrining dan pendeteksian hasil
persilangan (Pardhesi et al. 2005). Apabila mutasi substitusi tidak terjadi pada
situs pemotongan suatu enzim restriksi, maka metode pendeteksiannya bisa
dilakukan dengan metode SSCP (Single Strand Conformation Polymorphism)
ataupun perunutan nukleotida (DNA sequencing). Metode sekuensing DNA lebih
akurat dalam mendeteksi kejadian mutasi tetapi relatif mahal dan membutuhkan
waktu yang lama.
Tujuan penelitian
Penelitian ini bertujuan untuk mengidentifikasi keragaman gen fekunditas
(BMPR1B dan BMP15) pada tiga kambing lokal Indonesia, yaitu kambing
Kacang, Samosir dan Muara dengan menggunakan metode PCR-RFLP dan
sekuensing.
Manfaat Penelitian
Penelitian ini dapat dimanfaatkan sebagai informasi awal tentang
keragaman genetik gen fekunditas (BMPR1B dan BMP15) pada tiga kambing
lokal Indonesia yaitu kambing Kacang, Samosir dan Muara. Hasil yang
diharapkan adalah apabila metode deteksi cepat PCR-RFLP ditemukan
berkorelasi dengan sifat prolifik, maka hasilnya dapat digunakan sebagai metode
deteksi dini sifat prolifik.
GEN FEKUNDITAS (
BMPR1B
DAN
BMP15
) PADA
TIGA KAMBING LOKAL INDONESIA
PENDAHULUAN
Sifat prolifik adalah kemampuan untuk melahirkan lebih dari satu anak
sekaligus dalam satu kali periode kelahiran. Sifat prolifik dikendalikan oleh
gen-gen yang dikelompokkan sebagai gen-gen kesuburan (fecundity genes). Ada tiga jenis
gen Fec yang sudah diidentifikasi pada ruminansia kecil, yaitu Bone
Morphogenetic Protein Receptor type 1B (BMPR1B), Growth Differentiation
Factor 9 (GDF9) dan Bone Morphogenetic Protein 15 (BMP15) (Galloway et al.
2000; Souza et al. 2001; Hanrahan et al. 2004).
Gen BMPR1B atau activin-like kinase 6 (ALK 6) dikenal sebagai FecB.
Gen BMPR1B terletak pada kromosom 6 yang diekspresikan oleh sel oosit dan
sel-sel granulosa. Mutasi pada FecB terjadi karena substitusi A746G pada cDNA
yang menyebabkan substitusi asam amino Q249R (Mulsant et al. 2001; Souza et
al. 2001; Wilson et al. 2001). Mutan heterozigot carrier akan mengalami
peningkatan laju ovulasi rata-rata 1.5 dengan rataan litter size 1.0. Sedangkan
mutan homozigot carrier akan mengalami peningkatan yang lebih tinggi yaitu
laju ovulasinya rata-rata 3.0 dengan rataan litter size 1.5 (Davis 2005).
Gen BMP15 atau FecX terletak di kromosom X dan diekspresikan oleh sel
oosit. Anggota super famili Transforming Growth Factor β (TGF β) ini disebut
BMP15 karena secara struktural dapat dikelompokkan ke dalam anggota BMP
(Dube et al. 1998). Selain itu, BMP15 juga dikenal sebagai GDF9B karena
kemiripannya dengan GDF9 (Laitinen et al. 1999). Mutasi pada FecX berkorelasi
dengan peningkatan laju ovulasi dan litter size pada genotip heterozigot carrier,
sedangkan pada genotip homozigot carrier dapat menyebabkan sifat steril. Ada
lima alel akibat mutasi titik (single substitution) pada FecX yang telah ditemukan,
yaitu FecXI (Inverdale), FecXH (Hanna), FecXB (Belclare), FecXG (Galway) dan
FecXL (Lacaune) (Galloway et al. 2000; Hanrahan et al. 2004; Bodin et al. 2007).
Selain itu, ada satu alel yang disebabkan oleh mutasi delesi 17 pb yang disebut
FecXR (Rasa Aragonesa) (Martinez-Royo et al. 2008).
Metode PCR-RFLP (Polymerase Chain Reaction Restriction Fragment
dalam skala massal. Metode PCR-RFLP memanfaatkan adanya situs pemotongan
yang khas dari suatu enzim restriksi untuk mendeteksi terjadinya mutasi pada
suatu fragmen DNA. Metode sekuensing DNA menghasilkan data yang lebih
akurat karena berdasarkan perunutan nukleotida. Metode sekuensing relatif mahal
dan membutuhkan waktu yang lama.
Tujuan penelitian ini adalah untuk mengidentifikasi keragaman genetik
gen fekunditas (BMPR1B dan BMP15). Populasi ternak yang diteliti adalah tiga
kambing lokal Indonesia meliputi kambing Samosir, kambing Muara dan kambing
Kacang dengan metode PCR-RFLP dan sekuensing.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Mei 2010 sampai dengan Januari
2011 di Laboratorium bagian Fungsi Hayati dan Perilaku Hewan, Departemen
Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian
Bogor.
Pengambilan Sampel Darah Kambing
Sampel darah kambing Kacang yang digunakan adalah koleksi Loka
Penelitian Kambing Potong Sei Putih, Sumatera Utara. Berdasarkan catatan yang
tersedia, dari total 25 ekor kambing, 14 ekor bersifat prolifik atau setidaknya
pernah melahirkan anak lebih dari satu per kelahiran, sedangkan 11 ekor yang lain
selalu beranak tunggal (Tabel 1). Kambing Samosir diambil dari peternakan
rakyat di Kabupaten Samosir (60 ekor) dan Kambing Muara di peternakan rakyat
di Kabupaten Tapanuli Utara, Provinsi Sumatera Utara (35 ekor). Pembagian sifat
prolifik atau tidaknya didasarkan pada wawancara terhadap pemilik kambing.
Sampel darah diambil dari vena jugularis menggunakan jarum venoject
yang dihubungkan dengan tabung vakum sekitar 2 ml dari setiap ekor kambing.
Darah yang diperoleh langsung diawetkan dalam alkohol absolut 2x volume
darah.
Tabel 1 Jumlah sampel darah kambing
Jenis Kambing Prolifik Non Prolifik + Unknown Jumlah Kacang 14 11 25
Samosir 24 36 60
Muara 9 26 35
Total 47 73 120
Prolifik: jumlah anak 2-5, Non prolifik: jumlah anak 1, unknown: tidak diketahui
Ekstraksi DNA
Ekstraksi genom DNA dilakukan menggunakan Genomic DNA Mini Kit
for Fresh Blood (GeneAid) yang dimodifikasi untuk sampel darah yang diawetkan
dalam alkohol. Modifikasi yang dilakukan bertujuan untuk menghilangkan
alkohol sebelum dilakukan proses ekstraksi DNA. Sampel darah dalam alkohol
sebanyak 1mL disentrifugasi 2000 g selama 5 menit. Endapan sel dicuci dengan
menambahkan akuades steril hingga volume total 1.5 mL dan didiamkan selama
20 menit. Pencucian ini dilakukan sebanyak dua kali. Sel-sel darah yang telah
bersih dari alkohol disuspensikan dengan bufer pelisis 100 µL, kemudian
ditambahkan enzim Proteinase K 0.01-0.5 µg/mL dan diinkubasi pada suhu 60 0C
selama 30 menit. Pemisahan bahan organik non-DNA dan pemurnian molekul
DNA dilakukan sesuai dengan prosedur dari Genomic DNA Mini Kit.
Amplifikasi Gen BMPR1B dan BMP15
Ruas ekson 8 gen BMPR1B dan ekson 2 gen BMP15 diamplifikasi dengan
mesin TaKaRa Thermal Cycler dalam reaksi PCR 12 µL. Komposisi pereaksi
terdiri atas sampel DNA sekitar 10 ng, primer forward dan reverse masing-masing
0.5 µL 25 mM, dan KAPA Taq Ready Mix DNA polymerase 6 µL (KAPATaq
DNA polymerase 0.05 U/µL, bufer polimerase dengan Mg2+.25 mM dan setiap
dNTP masing-masing 0.4 mM). Kondisi PCR, yaitu predenaturasi 94 0C selama 5
menit, (denaturasi 94 0C selama 60 detik, penempelan primer 58 0C selama 90
detik, pemanjangan 72 0C 90 detik) sebanyak 30 siklus, pemanjangan akhir pada
suhu 72 0C selama 10 menit, dan penyimpanan dilakukan pada suhu 4 0C.
menggunakan penanda DNA Ladder 100 pb (Generay Biotech), kemudian
dilanjutkan dengan pewarnaan perak (Byun et al. 2009).
Primer yang digunakan untuk mengamplifikasi ruas ekson 8 dari gen
BMPR1B adalah primer forward AF84 5’-GTCGCTATGGGGAAGTTTGGATG
dan primer reverse AF85 5’-GATGTTTTCATGCCTCATCAACACGGTC yang
akan menghasilkan produk PCR sebesar 137 pb (Wilson et al. 2001). Primer yang
digunakan untuk mengamplifikasi ruas ekson 2 gen BMP15 adalah primer
forward AF86 5’-CTTCTTGTTACTGTATTTCAATGAGAC dan primer reverse
AF87 5’-GATGCAATACTGCCTGCTTG yang akan menghasilkan produk PCR
sebesar 135 pb (Hanrahan et al. 2004).
Analisis Gen BMPR1B dan BMP15
MenggunakanPCR-RFLP dan Sekuensing
Amplikon gen BMPR1B dipotong dengan enzim AvaII (G/GACC)
(Boehringer Mannheim, GmbH-Germany). Sebanyak 3 µL amplikon direaksikan
dengan enzim restriksi AvaII 7.5 U pada suhu 37 0C yang diinapkan semalaman.
Amplikon yang tidak terpotong disebut dengan tipe liar. Hewan tipe liar tidak
memiliki situs pemotongan sehingga panjang fragmen DNAnya tetap 137 pb.
Amplikon yang terpotong akan memiliki panjang fragmen DNA 109 pb dan 28 pb
disebut mutan homozigot carrier. Amplikon yang terpotong dan memiliki tiga
jenis fragmen DNA yaitu 137 pb, 109 pb dan 28 pb disebut mutan heterozigot
carrier.
Amplikon gen BMP15 dipotong dengan enzim Hinf I (G/ACT)
(Boehringer Mannheim, GmbH-Germany). Amplikon sebanyak 3 µL ditambah
enzim HinfI 7.5 U. Suspensi diinkubasi semalam pada suhu 37 0C. Amplikon
yang terpotong menjadi dua fragmen DNA masing-masing 110 pb dan 25 pb
disebut dengan hewan tipe liar. Amplikon yang tidak terpotong mempunyai
panjang fragmen DNA 135 pb disebut mutan FecXG .
Hasil PCR-RFLP kemudian diverifikasi dengan metode sekuensing.
Seluruh amplikon gen BMPR1B dicampur menjadi satu. Hal ini juga dilakukan
pada semua amplikon gen BMP15. Campuran amplikon dibagi menjadi dua
dilakukan pada campuran amplikon A dan B menggunakan primer yang sama
dengan amplifikasi awal.
HASIL
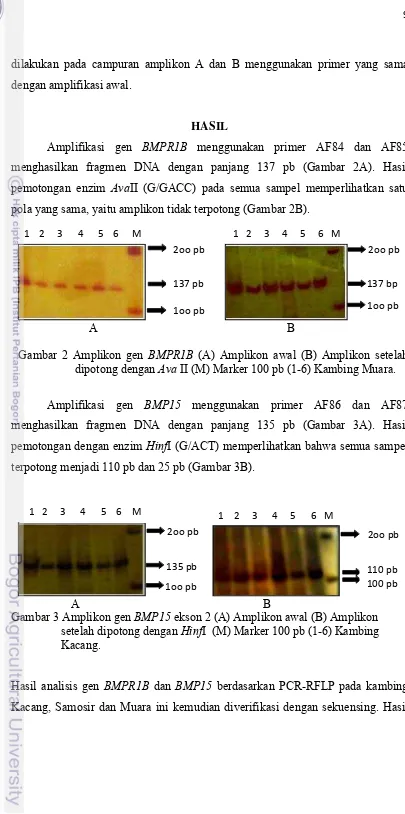
Amplifikasi gen BMPR1B menggunakan primer AF84 dan AF85
menghasilkan fragmen DNA dengan panjang 137 pb (Gambar 2A). Hasil
pemotongan enzim AvaII (G/GACC) pada semua sampel memperlihatkan satu
pola yang sama, yaitu amplikon tidak terpotong (Gambar 2B).
A B
Gambar 2 Amplikon gen BMPR1B (A) Amplikon awal (B) Amplikon setelah
dipotong dengan Ava II (M) Marker 100 pb (1-6) Kambing Muara.
Amplifikasi gen BMP15 menggunakan primer AF86 dan AF87
menghasilkan fragmen DNA dengan panjang 135 pb (Gambar 3A). Hasil
pemotongan dengan enzim HinfI (G/ACT) memperlihatkan bahwa semua sampel
terpotong menjadi 110 pb dan 25 pb (Gambar 3B).
A B
Gambar 3 Amplikon gen BMP15 ekson 2 (A) Amplikon awal (B) Amplikon
setelah dipotong dengan HinfI (M) Marker 100 pb (1-6) Kambing
Kacang.
Hasil analisis gen BMPR1B dan BMP15 berdasarkan PCR-RFLP pada kambing
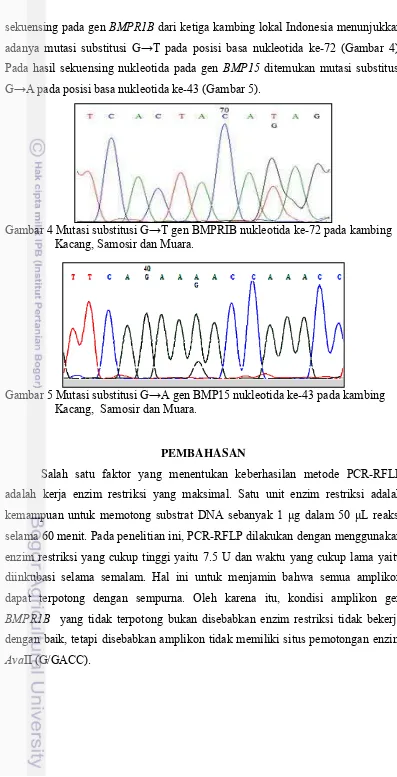
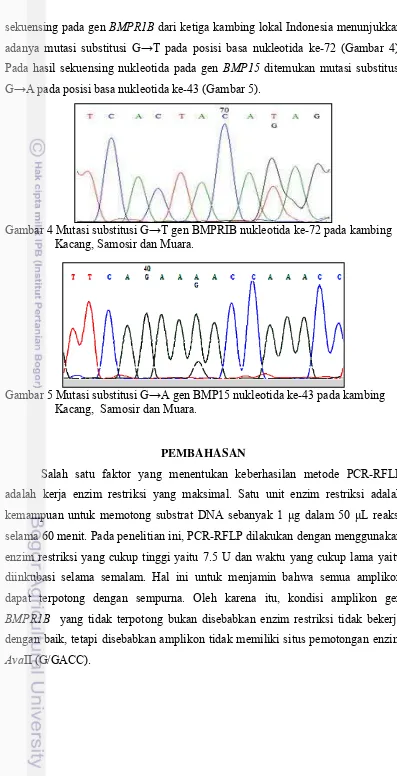
sekuensing pada gen BMPR1B dari ketiga kambing lokal Indonesia menunjukkan
adanya mutasi substitusi G→T pada posisi basa nukleotida ke-72 (Gambar 4).
Pada hasil sekuensing nukleotida pada gen BMP15 ditemukan mutasi substitusi
G→A pada posisi basa nukleotida ke-43 (Gambar 5).
Gambar 4 Mutasi substitusi G→T gen BMPRIB nukleotida ke-72 pada kambing
Kacang, Samosir dan Muara.
Gambar 5 Mutasi substitusi G→A gen BMP15 nukleotida ke-43 pada kambing
Kacang, Samosir dan Muara.
PEMBAHASAN
Salah satu faktor yang menentukan keberhasilan metode PCR-RFLP
adalah kerja enzim restriksi yang maksimal. Satu unit enzim restriksi adalah
kemampuan untuk memotong substrat DNA sebanyak 1 μg dalam 50 μL reaksi
selama 60 menit. Pada penelitian ini, PCR-RFLP dilakukan dengan menggunakan
enzim restriksi yang cukup tinggi yaitu 7.5 U dan waktu yang cukup lama yaitu
diinkubasi selama semalam. Hal ini untuk menjamin bahwa semua amplikon
dapat terpotong dengan sempurna. Oleh karena itu, kondisi amplikon gen
BMPR1B yang tidak terpotong bukan disebabkan enzim restriksi tidak bekerja
dengan baik, tetapi disebabkan amplikon tidak memiliki situs pemotongan enzim
Hasil PCR-RFLP gen BMPR1B dan BMP15 pada kambing Kacang,
Samosir dan Muara menyimpulkan bahwa ketiga kambing lokal Indonesia
merupakan tipe liar. Ternak dengan genotip tipe liar bersifat non prolifik (Wilson
et al. 2001; Hanrahan et al. 2004). Hal ini berlawanan dengan fakta bahwa
beberapa sampel yang diperoleh di lapangan dari ketiga kambing lokal Indonesia
ini bersifat prolifik. Oleh karena itu, metode PCR-RFLP terhadap gen BMPR1B
dan BMP15 tidak dapat digunakan sebagai alat untuk mendeteksi sifat prolifik
pada ketiga kambing lokal Indonesia. Selain pada kambing Indonesia, metode
PCR-RFLP juga tidak bisa digunakan untuk mendeteksi sifat prolifik berdasarkan
gen BMPR1B dan BMP15 kambing lokal Iran (Deldar-Tajangookeh et al. 2009),
enam jenis kambing China, yaitu Boer, persilangan Boer x Huanghuai (BH),
Huanghuai, Haimen, Nubi dan Matou (Hua et al. 2008). Selain pada kambing,
metode deteksi sifat prolifik menggunakan metode PCR-RFLP yang
dikembangkan oleh (Davis et al. 2002; Hanrahan et al. 2004), ternyata tidak bisa
bekerja dengan baik pada domba Sangsari Iran (Kasiriyan et al. 2009), 19 domba
prolifik dari berbagai negara (Davis et al. 2006), domba Shal (Ghaffari et al.
2009), lima jenis domba Mesir, yaitu Rahmani, Ossimi, Awassi, Barki dan
persilangan Awassi x Barki (EL-Hanafy & El-Saadani 2009), dan lima jenis
domba Mediterania dan Afrika Utara, yaitu Barbarine, Queue Fine de L’ Quest
(Tunisia), Noire de Thibar (Tunisia/Perancis), Sicilo-Sarde (Italia) dan D’man
(Maroko) (Vacca et al. 2010). Selain itu, Chu et al. (2010) mengungkapkan
bahwa polimorfisme gen BMPR1B pada kambing Jining Grey tidak berkorelasi
dengan sifat prolifik. Polley et al. (2009) menyatakan bahwa pada kambing Black
Bengal India, gen BMP15 adalah monomorfik, sedangkan polimorfisme pada gen
BMPR1B ditemukan berkorelasi dengan sifat prolifik.
Beberapa kejadian yang paralel dengan hasil PCR-RFLP gen BMPR1B
dan BMP15 yang monomorfik pada tiga kambing lokal Indonesia menunjukkan
bahwa SNP (single nucleotide polymorphisme) yang dijadikan dasar untuk
membuat metode PCR-RFLP hanya berlaku pada satu bangsa ternak saja. Hal ini
berarti analisis korelasi yang telah dibuat (Davis et al. 2002; Hanrahan et al. 2004)
hanya berlaku untuk satu bangsa ternak saja. Walaupun begitu, penetapan sifat
gen BMP1RB dan BMP15 bekerja pada sel granulosa (Dube et al.1998; Mulsant et
al. 2001) sehingga ada peluang kambing Kacang, Samosir dan Muara memiliki
lebih dari satu oosit yang diovulasikan.
SIMPULAN
Hasil PCR-RFLP gen BMPR1B dan BMP15 pada kambing Kacang,
Samosir dan Muara menunjukkan bahwa semua sampel merupakan tipe liar. Hasil
sekuensing pada kambing Kacang, Samosir dan Muara menunjukkan mutasi
substitusi G72T pada gen BMPR1B dan mutasi substitusi G43A pada gen BMP15.
Kedua mutasi ini tidak berkaitan dengan situs restriksi pada enzim AvaII dan
POLIMORFISME GEN
BMP15
PADA KAMBING KACANG,
SAMOSIR DAN MUARA
PENDAHULUAN
Super famili Transforming Growth Factor β (TGF β) merupakan suatu
faktor pertumbuhan berupa molekul protein yang berfungsi sebagai sinyal ekstra
seluler. Super famili TGF β terdiri dari TGF β 1,2,3 , Anti Mullerian Hormone
(AMH), 2 Inhibin (A dan B), 3 Aktivin (A,B, dan AB), sekitar 20 macam Bone
Morphogenetic Protein (BMP1 – BMP20) dan setidaknya 9 Growth Differentiation
Factors (GDF1-GDF9) (Dirangkum oleh Knight dan Glister 2006).
Gen Bone Morphogenetic Protein 15 (BMP15) atau FecX terletak di
kromosom X yang ekuivalen dengan Xp11.2-p11.4 pada manusia dan
diekspresikan hanya pada sel oosit (Galloway et al. 2000). BMP15 berfungsi
dalam mengatur proliferasi dan diferensiasi sel granulosa di awal perkembangan
folikel (Otsuka et al. 2000). Mutasi pada gen BMP15 dapat meningkatkan laju
ovulasi dan litter size pada mutan heterozigot carrier dan menyebabkan sifat steril
pada mutan homozigot carrier. Ada enam alel mutan pada Fec X yang telah
ditemukan yaitu lima alel berupa mutasi titik yaitu Fec XI (Inverdale), Fec XH
(Hanna), Fec XB (Belclare), Fec XG (Galway) dan Fec XL (Lacaune) (Galloway et
al. 2000; Hanrahan et al. 2004; Bodin et al. 2007) dan satu alel berupa mutasi
delesi 17 pb yaitu Fec XR (Rasa Aragonesa) (Martinez-Royo et al. 2008). Mutasi
substitusi pada Fec XI, Fec XL dan Fec XB menyebabkan adanya perubahan asam
amino non conserve berturut-turut pada posisi 31, 53 dan 99 pada proprotein
BMP15. Mutasi substitusi Fec XH dan Fec XG menyebabkan stop kodon prematur
berturut-turut pada posisi 291 dan 239 dari proprotein BMP15. Adapun mutasi
delesi (Fec XR) mengubah kerangka pembacaan kodon mRNA yang menyebabkan
stop kodon prematur pada posisi 208 dari proprotein BMP15.
Metode sekuensing merupakan pengembangan teknik yang berkaitan
dengan DNA. Metode ini menghasilkan informasi yang lebih akurat karena
berdasarkan pada perunutan nukleotida dari suatu fragmen DNA. Penelitian ini
bertujuan untuk mengidentifikasi keragaman genetik gen BMP15 pada tiga
BAHAN DAN METODE
Sampel DNA dan Amplifikasi Gen BMP15
Jumlah dan jenis sampel DNA kambing yang dipergunakan sama dengan
sampel DNA pada bab sebelumnya. Amplifikasi gen BMP15 dilakukan dengan
mesin TaKaRa Thermal Cycler. Primer yang digunakan untuk mengamplifikasi
gen BMP15 ekson 1 dan ekson 2 didesain dengan mengacu pada Capra hircus
breed Guizhou White berdasarkan data GenBank dengan No. Akses FJ429281
(http://www.ncbi.nlm.nih.gov) (Lampiran1). Pasangan primer forward AF218
5’-GATGCAAAGAGGACAATTTAGAAGACC dan primer reverse AF219
5’-CCCACCAGAACAATATAGTATGATAACTC digunakan untuk amplifikasi ekson 1.
Amplifikasi ekson 2 dilakukan dengan menggunakan pasangan primer forward
AF222 5’-TGCAGGCTCCTGGCACATACAGAC dan primer reverse AF223
5’-TCACCTGCATGTGCAGGACTGGG. Reaksi PCR dilakukan dalam volume 12 µL,
yang terdiri atas sampel DNA sekitar 10 ng, primer forward dan reverse
masing-masing 0.5 µL 25 mM, dan KAPA Taq Ready Mix DNA polymerase 6 µL
(KAPATaq DNA polymerase 0.05 U/µL, bufer polimerase dengan Mg2+.25 mM
dan setiap dNTP masing-masing 0.4 mM). Kondisi PCR, yaitu predenaturasi 94
0
C, selama 5 menit, (denaturasi 94 0C, 60’, penempelan primer ekson 1 60 0C,
90’, pemanjangan 72 0C, 90’) sebanyak 30 siklus, pemanjangan akhir pada suhu
72 0C selama 10 menit, dan penyimpanan dilakukan pada suhu 4 0C. Kondisi PCR
untuk ekson 2 sama kecuali penempelan primer yaitu 64 0C. Amplikon
dimigrasikan pada gel poliakrilamida 6% dengan penanda DNA Ladder 100 pb
(Generay Biotech) yang dilanjutkan dengan pewarnaan perak (Byun et al. 2009).
Penentuan Genotip dengan Metode Sekuensing
Amplikon dari jenis kambing yang sama dicampur, sehingga ada tiga
kelompok besar yaitu sampel kambing Kacang (K), kambing Samosir (S), dan
kambing Muara (M). Proses sekuensing dilakukan pada hasil pencampuran
amplikon dengan menggunakan primer yang sama seperti proses amplifikasi awal.
Hasil sekuensing berupa grafik elektroforegram diedit secara manual dengan
kemudian disejajarkan dan dianalisis lebih lanjut dengan program MEGA4.0
(Tamura et al. 2007) dan Genetyx-win 4.1.
Analisis filogeni kambing lokal Indonesia dilakukan berdasarkan daerah
coding sequence gen BMP15 ekson 2 menggunakan metode Neighbour-joining
(NJ) dengan bootstrap 1000x. Data sekuen pembanding yang digunakan diperoleh
dari data GenBank yaitu Pongo abelii : XM_002831651, Pan troglodytes :
XM_529247, Macaca mulatta : XM_001083980, Equus caballus :
XM_001496223, Jining Grey : EU743938, Homo sapiens : AF082350, Gallus
gallus : AY729025, Bos Taurus : DQ463368, Yunling Black : EU847284, Boer :
EU847289, Black Bengal : EU888137, Guizhou White : FJ429281, Markhoz :
GU732196, Ovis aries : AF236079, Mus musculus : NM_009757, Rattus
norvegicus : NM_021670, Bubalus bubalis : EF375880 dan Carassius gibelio :
HQ179985. (Lampiran 2 dan 3).
HASIL
Amplifikasi gen BMP15 ekson 1 yang diapit oleh primer forward AF218
dan primer reverse AF219 menghasilkan fragmen DNA sepanjang 574 pb
(Gambar 6A). Amplifikasi gen BMP15 ekson 2 yang diapit oleh primer forward
AF222 dan primer reverse AF223 menghasilkan fragmen DNA sepanjang 861 pb
(Gambar 6B).
A B
Gambar 6 Amplikon gen BMP15 ekson 1 dan 2 pada kambing Kacang (A) ekson
1 = 574 pb (B) ekson 2 = 861 pb (M) Marker 100 pb (1-6) Kambing Kacang.
Hasil sekuensing menunjukkan bahwa gen BMP15 pada daerah
ekson1 memiliki urutan nukleotida yang identik pada ketiga populasi kambing
lokal Indonesia (kambing Kacang, Samosir dan Muara). Pada daerah ekson 2
100 pb 574 pb
1 2 3 4 5 6 M 1 2 3 4 5 6 M
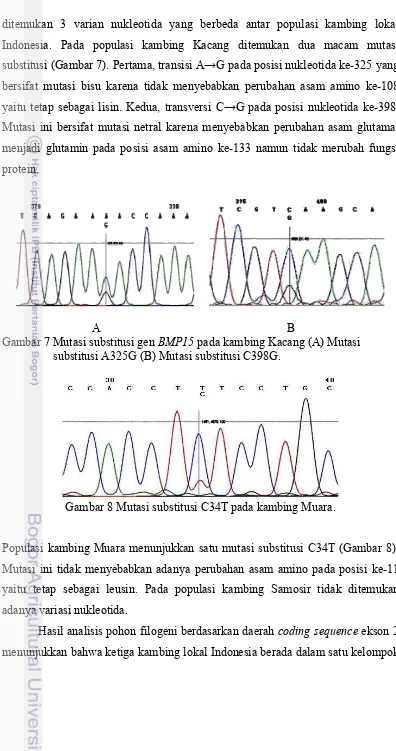
ditemukan 3 varian nukleotida yang berbeda antar populasi kambing lokal
Indonesia. Pada populasi kambing Kacang ditemukan dua macam mutasi
substitusi (Gambar 7). Pertama, transisi A→G pada posisi nukleotida ke-325 yang bersifat mutasi bisu karena tidak menyebabkan perubahan asam amino ke-108
yaitu tetap sebagai lisin. Kedua, transversi C→G pada posisi nukleotida ke-398.
Mutasi ini bersifat mutasi netral karena menyebabkan perubahan asam glutamat
menjadi glutamin pada posisi asam amino ke-133 namun tidak merubah fungsi
protein.
A B
Gambar 7 Mutasi substitusi gen BMP15 pada kambing Kacang (A) Mutasi
substitusi A325G (B) Mutasi substitusi C398G.
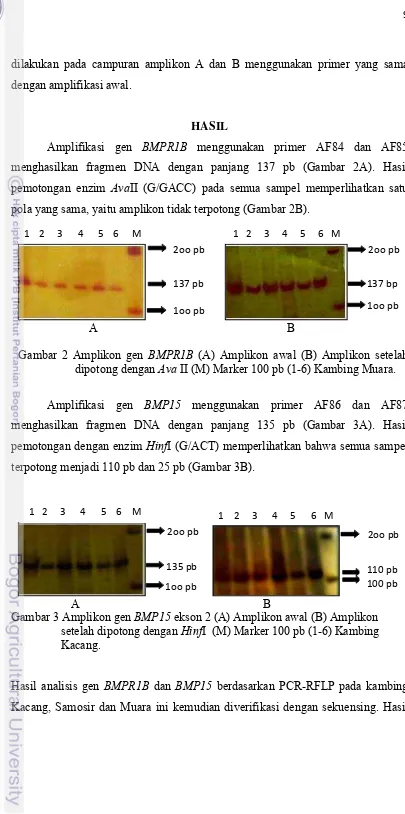
Gambar 8 Mutasi substitusi C34T pada kambing Muara.
Populasi kambing Muara menunjukkan satu mutasi substitusi C34T (Gambar 8).
Mutasi ini tidak menyebabkan adanya perubahan asam amino pada posisi ke-11
yaitu tetap sebagai leusin. Pada populasi kambing Samosir tidak ditemukan
adanya variasi nukleotida.
Hasil analisis pohon filogeni berdasarkan daerah coding sequence ekson 2
dengan berbagai jenis kambing di dunia, seperti Boer, Ghuizou White, Black
Bengal, Markhoz, ataupun Yunling Black (Gambar 9).
Gambar 7 Pohon filogeni kambing lokal Indonesia berdasarkan daerah coding sequence gen BMP15 ekson 2 menggunakan program MEGA 4 dengan metode Neighbour-joining dengan bootstrap 1000x. Angka di percabangan menunjukkan nilai bootstrap.
Pada pohon filogeni tampak percabangan yang memisahkan kelompok hewan
yang bersifat monoovulasi dengan kelompok hewan yang bersifat poliovulasi
dengan nilai bootstrap 100. Kelompok hewan yang bersifat monoovulasi meliputi
beberapa hewan ruminansia dan primata. Kelompok hewan yang bersifat
poliovulasi terdiri atas Mus musculus dan Rattus norvegicus yang merupakan
hewan rodensia. Adapun Gallus gallus dan Carassius gibelio terlihat berada pada
kelompok terluar dalam pohon filogeni.
PEMBAHASAN
Gen BMP15 pada kambing terdiri dari dua ekson dan satu intron yang
menyandikan sebanyak 394 asam amino berdasarkan Capra hircus breed Guizhou
White pada basis data GenBank dengan No. Akses FJ429281
menunjukkan bahwa ketiga populasi kambing lokal Indonesia (kambing Kacang,
Samosir dan Muara) memiliki urutan nukleotida yang identik pada ekson 1. Hal
ini kemungkinan karena pada daerah ekson 1 terdapat daerah yang menyandikan
bagian sinyal peptida dalam pembentukan protein BMP15 sehingga bersifat sangat
stabil. Ada enam alel mutan pada gen BMP15 yang telah diketahui berkorelasi
dengan sifat prolifik pada mutan heterozigot carrier dan menyebabkan sifat steril
pada mutan homozigot carrier. Mutasi pada keenam alel ini semuanya terjadi
pada bagian ekson 2 (Tabel 2).
Tabel 2. Alel mutan pada gen BMP15
Polimorfisme ditemukan pada gen BMP15 ekson 2 tiga kambing lokal
Indonesia. Pada populasi kambing Kacang ditemukan ada dua jenis mutasi.
Pertama, mutasi bisu yaitu transisi A325G . Kedua, mutasi netral yaitu transversi
C398G yang menyebabkan perubahan asam glutamat menjadi glutamin namun
tidak merubah fungsi BMP15. Asam glutamat adalah asam amino yang bermuatan
negatif sedangkan glutamin adalah asam amino dengan rantai samping yang tidak
bermuatan. Populasi kambing Muara hanya mempunyai satu mutasi bisu yaitu
C34T, sedangkan populasi kambing Samosir tidak mengalami mutasi.
Fungsi BMP15 pada setiap spesies bersifat khas (specific species) terkait
dengan perbedaan laju ovulasi antar species (Hashimoto et al. 2005). BMP15 pada
mamalia berfungsi sebagai faktor pertumbuhan dan proliferasi sel granulosa.
BMP15 juga berperan dalam menghambat sensitivitas folikel terhadap Follicle
Stimulating Hormone (FSH) dengan menekan ekspresi dari reseptor FSH (Otsuka
et al. 2000). Penelitian yang dilakukan oleh Yan et al. (2001) menunjukkan bahwa
tikus yang sudah diinaktivasi (knock out) gen BMP15 nya tidak menunjukkan sifat
(2008) menyimpulkan bahwa sifat poliovulasi ini ternyata dipengaruhi oleh
jumlah ekspresi gen BMP15 yang lebih sedikit. Hal ini berdasarkan penelitiannya
dengan menggunakan tikus transgenik oocyt specific overexpression BMP15.
Mutasi gen BMP15 pada ruminansia kecil menyebabkan sifat prolifik pada
genotip heterozigot dan sifat steril pada genotip homozigot (Galloway et al. 2000;
Hanrahan et al. 2004; Bodin et al. 2007; Martinez-Royo et al. 2008). Zhang et al.
(2009) mengungkapkan bahwa pada beberapa jenis sapi ditemukan adanya mutasi
delesi 4 pb yang menyebabkan perubahan reading frame dan menghasilkan stop
kodon prematur, namun mutasi ini tidak berkorelasi dengan sifat prolifik pada
genotip heterozigot. Polimorfisme gen BMP15 pada manusia diketahui
berhubungan dengan human dizygotic (DZ) namun tidak signifikan (Zhao et al.
2008). Pada ikan zebra, BMP15 berfungsi untuk mencegah terjadinya
perkembangan dan pematangan prematur oosit dengan menekan sensitivitas
folikel terhadap maturation inducing hormone (MIH) pada pertumbuhan awal dari
folikel (Clelland et al. 2007).
SIMPULAN
Hasil sekuensing daerah ekson 1 menunjukkan bahwa kambing Kacang,
Samosir dan Muara memiliki urutan basa nukleotida yang identik. Polimorfisme
ditemukan pada daerah ekson 2 karena ada tiga varian mutan. Populasi kambing
Kacang memiliki dua jenis alel mutan yaitu A325G dan C398G. Pada Populasi
kambing Muara ada satu alel mutan yaitu C34T, sedangkan populasi kambing
Samosir tidak memiliki varian mutan. Analisis pohon filogeni memperlihatkan
bahwa kambing Kacang, Samosir dan Muara terletak dalam satu kelompok
dengan beberapa kambing lokal di dunia. Pada pohon filogeni tampak
percabangan yang memperlihatkan hubungan genetik antara kelompok hewan
PEMBAHASAN UMUM
Hasil PCR-RFLP gen BMPR1B dan BMP15 pada tiga kambing lokal
Indonesia (kambing Kacang, Samosir dan Muara) memperlihatkan bahwa semua
sampel monomorfik yaitu bersifat tipe liar. Metode deteksi PCR-RFLP gen
BMPR1B dan BMP15 seperti yang dilaporkan pada beberapa penelitian (Galloway
et al. 2000; Wilson et al. 2001; Davis et al. 2002; Hanrahan et al. 2004)
mengungkapkan bahwa sampel yang bersifat tipe liar adalah non prolifik. Hal ini
tidak sesuai dengan fakta bahwa beberapa sampel kambing Kacang, Samosir dan
Muara yang diperoleh di lapangan bersifat prolifik. Hasil sekuensing gen
BMPR1B dan BMP15 dengan primer yang sama ternyata memperlihatkan adanya
polimorfisme pada kedua gen tersebut. Namun alel mutan yang ditemukan pada
gen BMPR1B dan BMP15 ini tidak berkorelasi dengan situs pemotongan enzim
restriksi. Hal ini menyimpulkan bahwa metode PCR-RFLP gen BMPR1B dan
BMP15 ini tidak dapat digunakan sebagai alat deteksi pada populasi kambing
Kacang, Samosir dan Muara. Deteksi sifat prolifik berdasarkan metode
PCR-RFLP gen BMPR1B pada beberapa jenis domba Cina menunjukkan bahwa gen
FecB berkaitan dengan sifat prolifik yang tinggi pada ternak seperti Huyang,
Small Tail Han, Cele, Duolang dan Chinese Merino strain prolifik, sebaliknya
pada ternak yang bersifat non prolifik seperti Mongolia, Chinese Merino, Tan,
Xinjiang, Hulunbeier, Inner Mongolia FineWool dan Northeastern Half-fuzz tidak
ditemukan gen FecB. Adanya perbedaan distribusi gen FecB pada beberapa jenis
domba Cina menunjukkan bahwa gen BMPR1B sangat berkorelasi dengan
perbedaan bangsa pada ternak (Dirangkum oleh Hua & Yang 2009). Untuk
mengembangkan metode penanda genetik seperti Marker-assisted selection
membutuhkan tahapan yang cukup panjang sehingga harus diperhatikan rasio
antara keuntungan dan biaya yang dibutuhkan (Davis & DeNise 1998). Pada
penelitian ini, selanjutnya lebih difokuskan untuk mengidentifikasi keragaman
genetik gen BMP15 ekson 1 dan ekson 2 pada ketiga kambing lokal Indonesia.
Sifat prolifik secara alamiah disebabkan pematangan folikel yang terjadi
secara serentak sehingga menghasilkan lebih dari satu folikel matang. Gen
menginduksi kerja dari sistem hormonal selama proses pembentukan folikel.
Protein BMP15 memiliki dua peran penting yaitu pertama, sebagai faktor
pertumbuhan dan proliferasi sel granulosa. Kedua, menghambat sensitivitas
folikel terhadap FSH dengan menekan ekspresi dari reseptor FSH (Otsuka et al.
2000). Ada enam alel mutan pada gen BMP15 yang diketahui berkorelasi dengan
sifat prolifik pada genotip heterozigot carrier dan sifat steril pada genotip
homozigot carrier yaitu T579A, C544T, C718T, G1100T, G635A dan delesi
525_541 (Galloway et al. 2000; Hanrahan et al. 2004; Bodin et al. 2007;
Martinez-Royo et al. 2008).
Mutasi yang terjadi pada gen BMP15 diketahui dapat menyebabkan
pertumbuhan dan proliferasi sel granulosa menjadi terhambat, sebaliknya ekspresi
dari reseptor FSH menjadi maksimal. Hal ini menyebabkan terbentuknya
beberapa folikel yang lebih kecil dan lebih sensitif terhadap FSH. Folikel-folikel
ini kemudian mengalami pematangan dini (Fabre et al. 2006). Kondisi prolifik
yang ditandai dengan adanya peningkatan laju ovulasi akan meningkatkan jumlah
anak yang dilahirkan. Pada penelitian ini, ada tiga alel mutan yang ditemukan
pada daerah ekson 2 yaitu A325G dan C398G pada kambing Kacang dan C34T
pada kambing Muara. Mutasi yang terjadi berupa mutasi bisu dan mutasi netral
sehingga tidak mengubah fungsi dari protein BMP15.
Penentuan sifat prolifik pada penelitian ini berdasarkan jumlah anak.
Adapun sifat prolifik dapat diindikasikan dengan dua parameter yaitu laju ovulasi
dan jumlah anak. Ada kemungkinan bahwa kambing yang beranak satu
sebenarnya mampu untuk mengovulasikan lebih dari satu oosit. Apabila kambing
memiliki lebih dari satu embrio maka akan membutuhkan lebih banyak suplai
makanan. Adanya defisiensi nutrisi dapat menyebabkan kegagalan reproduksi
(Hunter 1981). Umumnya manajemen pemberian pakan pada ternak masih
dilakukan secara tradisional, sehingga kurangnya suplai makanan dapat
berdampak terhadap kematian dini. Suplai makanan yang berkualitas dapat
menginduksi peningkatan laju ovulasi pada ruminansia kecil yang bersifat prolifik
ataupun non prolifik (Dirangkum oleh Robinson et al. 2006).
Sifat prolifik bersifat aditif karena ada beberapa faktor yang turut berperan
reproduksi. Ada beberapa faktor yang dapat menyebabkan kegagalan reproduksi
yaitu infeksi, defisiensi nutrisi, penyimpangan anatomi saluran kelamin, fase
luteal yang singkat (sekresi progesteron yang tidak memadai) atau korpus luteum
yang tetap utuh, perkembangan ovarium berkista, berahi yang tidak disertai
ovulasi atau berahi diam (ovulasi tanpa ditandai berahi) dan pengaruh merusak
dari estrogen tanaman (Hunter 1981).
Sifat prolifik dapat diinduksi dengan beberapa perlakuan variasi jenis
pakan (De Santiago-Miramontes et al. 2008) ataupun hormonal (Lehloenya &
Greyling 2009). Suplai makanan yang memadai dan pemberian mikro nutrisi juga
dapat memacu peningkatan laju ovulasi, meningkatkan kualitas sperma dan ovum,
berperan dalam perkembangan dan kelangsungan hidup embrio (Dirangkum oleh
Robinson et al. 2006). Sifat prolifik juga bersifat pleiotropik, yaitu dikendalikan
oleh beberapa gen. Ada kemungkinan selain gen BMPR1B dan BMP15, ada
beberapa gen lain yang mempengaruhi sifat prolifik pada kambing Kacang,
Samosir dan Muara. Pada penelitian He et al. (2010) yang menggunakan tiga
kambing lokal Cina mengungkapkan bahwa gen BMPR1B, BMP15 dan GDF9
adalah monomorfik. Polimorfisme ditemukan pada gen INHα yang berkorelasi
dengan sifat prolifik. INHα merupakan suatu glikoprotein yang berfungsi sebagai
inhibitor terhadap sintesis dan sekresi FSH dari kelenjar pituitari. Cao et al.
(2010) mengungkapkan bahwa sifat prolifik pada kambing Jining Grey berkaitan
dengan mutasi yang terjadi pada gen KiSS-1. KiSS peptin berfungsi untuk
menstimulasi GnRH untuk melepas FSH dan LH secara langsung melalui
SIMPULAN DAN SARAN
Hasil analisis gen BMPR1B dan BMP15 dengan metode PCR-RFLP
menunjukkan bahwa semua sampel dari ketiga kambing lokal Indonesia
monomorfik. Hasil sekuensing dengan primer yang sama menunjukkan adanya
mutasi substitusi G72T pada gen BMPR1B dan mutasi substitusi G43A pada gen
BMP15. Namun kedua mutasi ini tidak berkaitan dengan situs restriksi.
Hasil sekuensing nukleotida gen BMP15 daerah ekson 1 menunjukkan
bahwa ketiga kambing lokal Indonesia memiliki urutan nukleotida yang identik.
Polimorfisme ditemukan pada daerah ekson 2. Populasi kambing Kacang
memiliki dua varian alel mutan yaitu A325G dan C398G. Populasi kambing
Muara menunjukkan satu varian alel mutan yaitu C34T, sedangkan populasi
kambing Samosir tidak bervariasi. Hasil analisis pohon filogeni berdasarkan
coding sequence ekson 2 memperlihatkan bahwa ketiga kambing lokal Indonesia
berada dalam satu kelompok dengan kambing-kambing lokal di dunia dan
termasuk kelompok monoovulasi.
Penelitian ini memberi gambaran awal keragaman genetik gen fekunditas
(BMPR1B dan BMP15) pada kambing Kacang, Samosir dan Muara. Untuk itu,
perlu diteliti lebih lanjut pada fragmen yang lebih luas dari kedua gen. Selain itu,
perlu diteliti gen lain yang memiliki potensi polimorfisme yang berkaitan dengan
tingkat kesuburan kambing-kambing lokal Indonesia. Penelitian lanjutan tentang
gen yang berkaitan dengan sifat prolifik perlu dilakukan untuk mengembangkan
metode deteksi pada kambing lokal Indonesia. Peningkatan manajemen pakan
perlu dilakukan untuk memaksimalkan potensi sifat prolifik pada kambing lokal
DAFTAR PUSTAKA
Bodin L, Di Pasquale E, Fabre S, Bontoux M, Monget P, Persani L, Mulsant P. 2007. A novel mutation in the bone morphogenetic protein 15 gene causing defective protein secretion is associated with both increased ovulation rate and sterility in Lacaune sheep. Endocrinol 148:393–400.
Byun SO, Fang Q, Zhou H, Hickford JGH. 2009. An effective method for
silver-staining DNA in large numbers of polyacrylamide gels. Anal Biochem
385:174–175.
Cao GL, Chu MX, Fang L, Di R, Feng T, Li N. 2010. Analysis on DNA sequence of KiSS-1 gene and its association with litter size in goats. Mol Biol Repr
37:3921-3929.
Chu MX, Zhao XH, Zhang YJ, Jin M, Wang JY, Di R, Cao GL, Feng T, Fang L, Ma YH, Li K. 2010. Polymorphisms of BMPR-IB gene and their relationship with litter size in goats. Mol Biol Repr 37:4033-4039.
Clelland ES, Tan Q, Balofsky A, Lacivita R and Peng C. 2007. Inhibition of premature oocyte maturation: a role for bone morphogenetic protein 15 in zebrafish ovarian follicles. Endocrinol 148:5451-5458.
Davis GP, DeNise SK.1998. The impact of genetic markers on selection. J Anim
Sci 76:2331–2339.
Davis GH, Galloway SM, Ross IK, Gregan SM, Ward J, Nimbkar BV, Ghalsasi PM, Nimbkar C, Gray GD, Subandriyo, Inounu I, Tiesnamurti B, Martyniuk E, Eythorsdottir E, Mulsant P, Lecerf F, James P, Hanrahan, Bradford GE, Wilson T. 2002. DNA tests in prolific sheep from eight countries provide new evidence on origin of the booroola (FecB) mutation.
Biol Repr 66:1869–187.
Davis GH. 2004. Fecundity genes in sheep. Anim Repr Sci 82–83:247–253.
Davis GH. 2005. Major genes affecting ovulation rate in sheep. Genet Sel Evol
37:S11–S23.
Davis GH, Balakrishnan L, Ross IK, Wilson T, Galloway SM, Lumsden BM, Hanrahan JP, Mullen M, Mao XZ, Wang GL, Zhao ZS, Zeng YQ, Robinson JJ, Mavrogenis AP, Papachristoforou C, Peter C, Baumung R, Cardyn P, Boujenane I, Cockett NE, Eythorsdottir E, Arranz JJ, Notter
DR. 2006. Investigation of the booroola (FecB) and inverdale (FecXI)
Deldar-Tajangookeh H, Shahneh AZ, Zamiri MJ, Daliri M, Kohram H,
Nejati-Javaremi A. 2009. Study of BMP-15gene polymorphism in Iranian goats.
Afr J Biotechnol 8:2929-2932.
De Santiago-Miramontes MA, Rivas-Mu˜noz R, Mu˜noz-Guti´errez M, Malpaux B, Scaramuzzi RJ, Delgadillo JA. 2008. The ovulation rate in anoestrous female goats managed under grazing conditions and exposed to the male
effect is increased by nutritional supplementation. Anim Repr Sci 105:
409–416.
Dube JL, Wang P, Elvin J, Lyons KM, Celeste AJ, Matzuk MM. 1998. The bone
morphogenetic protein 15 gene is x-linked and expressed in oocytes. Mol
Endocrinol 12:1809–1817.
EL-Hanafy AA, El-Saadani MA. 2009. Fingerprinting of FecB gene in five
egyptian sheep breeds. Biotechnol Anim Husbandry 25:205-212.
Fabre S, Pierre A, Mulsant P, Bodin L, Pasquale E, Persani L, Monget P, Monniaux D. 2006. Regulation of ovulation rate in mammals: contribution
of sheep genetic models. Repr Biol Endocrinol
doi:10.1186/1477-7827-4-20
Galloway SM, McNatty KP, Cambridge LM, Laitinen MPE, Juengel JL, Jokiranta TS, McLaren RJ, Luiro K, Dodds KG, Montgomery GW, Beattie AE, Davis GH, Ritvos O. 2000. Mutations in an oocyte-derived growth factor
gene (BMP15) cause increased ovulation rate and infertility in a
dosage-sensitive manner. Nat Genet 25:279–283.
Ghaffari M, Nejati-Javaremi A, Rahimi G. 2009. Detection of polymorphism in BMPR-IB gene associated with twining in Shal sheep using PCR-RFLP method. Int J Agric Biol 11: 97–99.
Hanrahan JP, Gregan SM, Mulsant P, Mullen M, Davis GH, Powell R, Galloway
SM. 2004. Mutations in the genes for oocyte-derived growth factors GDF9
and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep (Ovis aries). Biol Reprod 70:900–909.
Hashimoto O, Moore RK, Shimasaki S. 2005. Posttranslational processing of
mouse and human BMP-15: potential implication in the determination of
ovulation quota. Proc Natl Acad Sci USA 102:5426–5431.
He Y, Ma X, Liu X, Zhang C, Li J. 2010. Candidate genes polymorphism and its association to prolificacy in Chinese Goats. J Agric Sci 2:88-92
Hoda A. 2008. Studi karakterisasi, produktivitas dan dinamika populasi kambing
Kacang (Capra hircus) untuk program pemuliaan ternak kambing di
Hua GH, Chen SL, Ai JT, Yang LG. 2008. None of polymorphism of ovine
fecundity major genes FecB and FecX was tested in goat. Anim Repr Sci
108:279–286.
Hua GH, Yang LG. 2009. A review of research progress of FecB gene in Chinese
breeds of sheep. Anim Repr Sci. 116:1–9.
Kasiriyan MM, Hafezeyan H, Sayahzadeh H, Jamshidi R, Asghari SR, Irajeyan
GH, Buesagh H. 2009. Genetic polymorphism FecB and BMP15 genes
and its association with litter size in Sangsari sheep breed of Iran. J Anim Vet Adv 8:1025-1031.
Hunter RHF. 1981. Fisiologi dan teknologi repruksi hewan betina domestik. Putra
H, penerjemah; Bandung: ITB Pr. Terjemahan dari: physiology and
technology of repruction in female domestic animals.
Knight PG and Glister C. 2006. Focus on TGF-β signalling TGF- β superfamily
members and ovarian follicle development. Repr 132: 191–206.
Laitinen M, Vuojolainen K, Jaatinen R, Ketola I, Aaltonen J, Lehtonen E, Heikinheimo M, Ritvos O. 1998. A novel growth differentiation factor-9 (GDF-9) related factor is co-expressed with GDF-9 in mouse oocytes
during Folliculogenesis. Mech Dev 78:135–140.
Lehloenya KC, Greyling JPC. 2010. The ovarian response and embryo recovery rate in Boer goat does following different superovulation protocols, during the breeding season. Small Ruminant Res 88:38–43.
Martinez-Royo A, Jurado JJ, Smulders JP, Marti JI, Alabart JL, Roche A, Fantova E, Bodin L, Mulsant P, Serrano M, Folch J, Calvo JH. 2008. A deletion in the bone morphogenetic protein 15 gene causes sterility and increased
prolificacy in Rasa Aragonesa sheep. Anim Genet 39:294–297.
Mc Mahon HE, Hashimoto O, Mellon PL and Shimasaki S. 2008. Oocyte-specific overexpression of mouse bone morphogenetic protein-15 leads to accelerated folliculogenesis and an early onset of acyclicity in transgenic mice. Endocrinol 149:2807-2815.
Mulsant P, Lecerf F, Fabre S, Schibler L, Monget P, Lanneluc I, Pisselet C, Riquet J, Monniaux D, Callebaut I, Cribiu E, Thimonier J, Teyssier J, Bodin L, Cognie Y, Chitour N, Elsen JM. 2001. Mutation in bone morphogenetic protein receptor-1B is associated with increased ovulation
rate in Booroola Merino ewes. Proc Natl Acad Sci 98:5104–5109.
Pardeshi VC, Sainani MN, Maddox JF, Ghalsasi PM, Nimbkar C, Gupta VS. 2005. Assessing the role of FecB mutation in productivity of Indian sheep.
Current sci 89: 887-890.
Polley S, De S, Batabyal S, Kaushik R, Yadav P, Arora JS, Chattopadhyay S, Pan
S, Brahma B, Datta TK, Goswami SL. 2009. Polymorphism of fecundity
genes (BMPR1B, BMP15 and GDF9) in the Indian prolific Black Bengal
goat. Small Ruminant Res 85:122–129.
Robinson JJ, Ashworth CJ, Rooke JA, Mitchell LM, McEvoy TG. 2006. Nutrition and fertility in ruminant livestock. Anim Feed Sci Technol 126:259–276.
Sodiq A, Tawfik ES. 2003. The role and breeds, management system, productivity and development strategies of goats in Indonesia: a review. J Agric Rur Dev in the Trop 104:71-89.
Souza CJ, MacDougall C, Campbell BK, McNeilly AS, Baird DT. 2001. The
Booroola (FecB) phenotype is associated with a mutation in the bone
morphogenetic receptor type 1B (BMPRIB) gene. J Endocrinol 169:R1–
R6.
ten Dijke P, Korchynskyi O, Valdimarsdottir G, Goumans MJ. 2003. Controlling
cell fate by bone morphogenetic protein receptors. Mol Cell Endocrinol
211:105-13.
Vacca GM, Dhaouadi A, Rekik M, Carcangiu V, Pazzola M, Dettori ML. 2010.
Prolificacy genotypes at BMPR1B, BMP15 and GDF9 genes in North
African sheep breeds. Small Ruminant Res 88:67–71.
Wilson T, Wu XY, Juengel JL, Ross IK, Lumsden JM, Lord EA, Dodds KG, Walling GA, McEwan JC, O’Connell AR, McNatty KP, Montgomery GW. 2001. Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor
(ALK-6) that is expressed in both oocytes and granulosa cells. Biol Repr
64:1225–1235.
Yan C, Wang P, DeMayo J, DeMayo FJ, Elvin JA, Carino C, Prasad SV, Skinner
SS, Dunbar BS, Dube JL, Celeste AJ and Matzuk MM. 2001. Synergistic roles
of bone morphogenetic protein 15 and growth differentiation. Mol
Endocrinol 15: 854-866.
Zhang L-P, Gan Q-F, Zhang X-H, Li1 D, Hou1 G-Y, Li1 J-Y, Gao1 X, Ren H-Y, Chen J-B, Xu1 S-Z. 2009. Detecting a deletion in the coding region of
the bovine bone morphogenetic protein 15 gene (BMP15). J Appl Genet
LAMPIRAN
Lampiran 1. Informasi sekuens gen BMP15 pada Capra hircus
breed Guizhou White
Capra hircus breed Guizhou White bone morphogenetic protein 15 precursor (Bmp15) gene, complete cds
LOCUS FJ429281 1536 bp DNA linear MAM 30-NOV-2008 DEFINITION Capra hircus breed Guizhou White bone morphogenetic protein 15 precursor (Bmp15) gene, complete cds.
ACCESSION FJ429281
VERSION FJ429281.1 GI:214010965 KEYWORDS .
JOURNAL Submitted (30-OCT-2008) School of Animal Science, Guizhou
/gene="Bmp15"
1 gatgcaaaga ggacaattta gaagacctct ttttggttca ggagatccta ccagaggaag 61 aaacatagga cctgcctgcc agcctttcat ttttccttgc cctatccttt gtggtagtgg 121 agcctggatg ctgttaccca tgtaaaagga aaggtttaaa gcgttatcct ttgggctttt 181 atcagaacat gttgctgaac accaagcttt tcaagatggt cctcctgagc atccttagaa 241 tccttcttct ttggggactg gtgcttttta tggaacatag ggtccaaatg acacaggtag 301 ggcagccctc tattgcccac ctgcctgagg cccctacctt gcccctgatt caggagctgc 361 tagaagaagc ccctggcaag cagcagagga agccgcgggt cttagggcat cccttacggt 421 atatgctgga gctgtaccag cgttcagctg acgcaagtgg acaccctagg gaaaaccgca 481 ccattggggc caccatggtg aggctggtga ggccgctggc tagtgtagca aggcctctca 541 gaggtgagtt atcatactat attgttctgg tggg [gap 100 bp] Expand Ns
Lampiran 2. Beberapa spesies yang digunakan dalam analisis pohon filogeni gen BMP15 ekson 2
No Spesies Jenis No. Akses Keterangan
01. Capra hircus Kambing Kacang - Penelitian ini
02. Capra hircus Kambing Samosir - Penelitian ini
03 Capra hircus Kambing Muara - Penelitian ini
04. Capra hircus Kambing Boer EU847289 Data Genbank
05. Capra hircus Kambing Black Bengal EU888137 Data Genbank
06. Capra hircus Kambing Markhoz GU732196 Data Genbank
07. Capra hircus Kambing Guizhou White FJ429281 Data Genbank
08 Capra hircus Kambing Yunling Black EU847284 Data Genbank
09. Capra hircus Kambing Jining Grey EU743938 Data Genbank
10. Ovis aries Domba AF236079 Data Genbank
11. Bos taurus Sapi Taurus DQ463368 Data Genbank
12. Bubalus bubalis Kerbau Lumpur EF375880 Data Genbank
13. Equus caballus Kuda XM_001496223 Data Genbank
14. Mus musculus Mencit NM_009757 Data Genbank
15. Rattus norvegicus Tikus sawah NM_021670 Data Genbank
16. Macaca mulatta Monyet mulata XM_001083980 Data Genbank
17. Pan troglodytes Simpanse XM_529247 Data Genbank
18. Pongo abelii Orang Utan XM_002831651 Data Genbank
19. Homo sapiens Manusia AF082350 Data Genbank
20. Gallus gallus Ayam AY729025 Data Genbank
Indonesia terhadap beberapa spesies Mamalia, burung dan ikan (No. merujuk pada nama spesies yang ada di lampiran 2). Nomor tiga baris di bagian atas dibaca secara vertikal).
1 1111111112 2222222223 3333333334 4444444445 5555555556 6666666667 7777777778 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 01.CCGCCATCAG CTTCACCTAA CTCATTCCCA CCTCTCCTGC CATGTGGAGC CCTGGGGGCA GAAAAGCCCA AC-CAATCAC 02... ... ... ... ... ... ... ..-... 21.--- ---.TTT..T GCACC.GAGG T...CTG..T ...CGCATCT T.CTTTTATC TGTG..G.A. GA---G....
1 1111111111 1111111111 1111111111 1111111111 1111111111 1111111111 8888888889 9999999990 0000000001 1111111112 2222222223 3333333334 4444444445 5555555556 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 01.TTTCCTTCTT CAGGAAGAGG CTCCCCAAAG CCTTCCCTGT TGCCCAAAAC TTGGACAGAG ATGGATATCA TGGAACATGT 02... ... ... ... ... ... ... ... 14...A... .TAA.TCG.. T...T... ...T.CCA ..T.T...G. C... ..A...T. CAC.TTG.A. 15...---.C.A. .TAA.TCG.. T..TG... ...TTCTG ..T.T...G. C....G.... ...A....T. CCC.CTG.A. 16...C. ...A.G...A T.TG...A T...A ..T.T..TG. ...A.... ... CAC... 17...C...C. ...A.G...A T...T....A ...A ..T.T..CG. ...A.... ... CAC..TT... 18...CT....C. ...A.G...A T...T....A ...A ..T.T..CG. ...A.... ... CAC...T... 19...C...C. ...A.G...A T...T....A ...A ..T.T..CG. ...A.... ... CAC...T... 20.G.GG.CG.C. .C----TGT. TG..GTGG.. .TGC.G.CTG CTG...G. CCC.G.G.-- ---..CTG CTC.G.CCCA 21.G.---CA... ..A---..TC T...TGC.G. TGAG.GTGTC AT.ATGGGT. C.C..AGCCT G....CCGA. .CTG.TG.CA