iii ABSTRACT
Stability and Antimicrobial Activity of Plantaricin Produced by Lactobacillus plantarum at Alkaline pH
Supriatna, D., I. I. Arief, and Jakaria
Plantaricin produced by L. plantarum is known to display an adaptive response to alkali stress that enhances its capacity to more effectively stable at alkali condition. The aim of the research was to examine the stability of plantaricin produced by L. plantarum 1A5, 1B1, 2B2 and 2C12 and its antimicrobial activity at alkaline pH. The experiment was done based on completely randomized design (CRD) with factorial arrangement 2 x 4, two levels of pH value and four levels of L. plantarum
strains in three replications. Variables analyzed were protein concentration, inhibition zone of the antagonistic test was assayed by agar well diffusion and antimicrobial activity of plantaricin against indicator bacteria at alkaline pH. Plantaricin was found to be sensitive to alkaline treatment. No interaction between pH and strains of L. plantarum to antimicrobial activity of plantaricin (P>0.05). Plantaricin showed antimicrobial activity against Gram positif and Gram negatif bacteria including S. typhimurium ATCC 14028, S. aureus ATCC 25923, E. coli
ATCC 25922, P. aeruginosa ATCC 27853 and B. cereus. Plantaricin produced by L. plantarum 1A5, 1B1, 2B2 and 2C12 was stable at alkaline pH but the stability of plantaricin decreased because of alkaline treatment to S. typhimurium ATCC 14028 (P<0.01). Stability of plantaricin after alkaline treatment showed plantaricin potentially could be used as biopreservative on alkali products.
PENDAHULUAN
Latar Belakang
Produk pangan alkali banyak terdapat di buah, sayuran dan beberapa produk
pangan asal ternak, seperti albumin telur. Nilai pH produk pangan alkali berkisar
7,2-10. Konsumsi terhadap produk pangan alkali sangat bermanfaat bagi kesehatan,
yakni untuk menjaga keseimbangan pH tubuh dan menurunkan resistensi tubuh
terhadap penyakit kronis, seperti hipertensi, kanker dan stroke. Bakteri patogen
dalam produk pangan alkali dapat menyebabkan kerusakan produk, menurunkan
daya simpan produk serta beresiko terhadap kesehatan apabila dikonsumsi. Senyawa
antimikrob alami yang stabil pada pengolahan produk pangan alkali sangat
diperlukan untuk dapat mengontrol pertumbuhan bakteri patogen dalam produk
pangan alkali sehingga dapat memperpanjang masa simpan produk.
Bakteri asam laktat menghasilkan suatu senyawa antimikrob yang disebut
bakteriosin. Bakteriosin ini sangat efektif untuk digunakan sebagai biopreservatif
menggantikan bahan pengawet sintesis lainnya. Oleh karena itu, bahan pengawet
alami lebih berpotensi untuk diaplikasikan sebagai pengganti bahan pengawet sintetis
karena tidak mengandung toksin, dapat didegradasi oleh enzim-enzim pencernaan
serta lebih aman untuk dikonsumsi. Bakteriosin dari makanan yang berhubungan
dengan bakteri asam laktat telah diidentifikasi, contohnya plantaricin.
Plantaricin merupakan salah satu jenis bakteriosin yang diproduksi oleh L.
plantarum. Arief et al. (2008) telah berhasil melakukan isolasi terhadap L. plantarum
1A5, 1B1, 2B2 dan 2C12 yang berasal dari daging sapi lokal Indonesia,
menghasilkan suatu senyawa antimikrob yang diidentifikasi awal sebagai
plantaricin. Penelitian terhadap senyawa antimikrob yang berpotensi untuk
digunakan sebagai biopreservatif khususnya untuk tipe pengolahan produk pangan
alkali perlu dilakukan, sehingga penelitian terhadap plantaricin asal galur L.
plantarum 1A5, 1B1, 2B2 dan 2C12 perlu diuji karakteristik stabilitas dan aktivitas
antimikrob plantaricin pada bakteri indikator terhadap pH alkali.
Tujuan
Penelitian ini bertujuan untuk mengetahui stabilitas dan aktivitas antimikrob
plantaricin asal galur L. plantarum 1A5, 1B1, 2B2 dan 2C12 pada bakteri indikator
2 TINJAUAN PUSTAKA
Bakteri Asam Laktat
Bakteri Asam Laktat (BAL) erat kaitannya dengan proses fermentasi pangan,
dan saat ini telah berkembang dalam industri pangan fermentasi. BAL sering
ditemukan secara alamiah dalam bahan pangan. Bakteri ini secara luas terdistribusi
pada susu, daging segar, sayuran, serta produk-produk lainnya. Peranan utama BAL
adalah sebagai kultur starter produk-produk yang melibatkan proses fermentasi untuk
memperoleh produk akhir dengan konsistensi tinggi, menstabilkan produk-produk
sehingga diperoleh cita rasa yang spesifik serta untuk mengawetkan produk yang
diinginkan (Smid dan Gorris, 2007). Selain itu, Leverentz et al. ( 2006) menyebutkan
bahwa BAL merupakan salah satu mikroorganisme yang dapat digunakan dalam
mengontrol pertumbuhan bakteri patogen dalam bahan pangan karena mampu
menurunkan pH dan menghasilkan bakteriosin.
BAL mempunyai karakteristik morfologi, fisiologi dan metabolit tertentu.
Deskripsi secara umum dari bakteri ini adalah termasuk dalam bakteri Gram positif,
tidak berspora, berbentuk bulat maupun batang dan menghasilkan asam laktat
sebagai mayoritas produk akhir selama memfermentasi karbohidrat (Axelsson,
2004). Lebih lanjut dinyatakan oleh Jay (1998) BAL bersifat mesofilik dan
termofilik, beberapa dapat tumbuh pada suhu 5 oC dan tertinggi 45 oC, dapat
bertahan pada pH 1,2-9,6 dan beberapa hanya dapat tumbuh pada kisaran pH yang
sempit (pH 4,0-4,5). Bakteri ini termasuk mikroorganisme GRAS (Generally
Recognized as Safe) atau golongan mikroorganisme yang aman ditambahkan dalam
makanan karena sifatnya yang tidak toksik dan tidak menghasilkan toksin, yang
dikenal dengan sebutan “food grade microorganism”, yaitu mikroorganisme yang
tidak beresiko terhadap kesehatan (Alakomi et al., 2000).
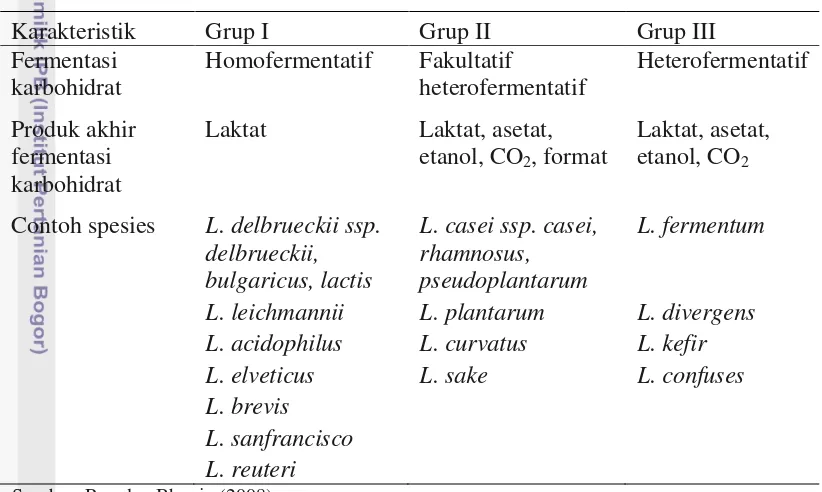
BAL terbagi dalam 8 genus antara lain Lactobacillus, Streptococcus,
Lactococcus, Pediococcus, Enterococcus, Leuconostoc, Bifidobacterium, dan
Corinebacterium. Berdasarkan tipe fermentasinya, BAL terbagi menjadi
homofermentatif dan heterofermentatif. Kelompok homofermentatif menghasilkan
asam laktat sebagai produk utama dari fermentasi gula sedangkan kelompok
heterofermentatif menghasilkan asam laktat dan senyawa lain yaitu CO2, etanol,
3 Lactobacillus
Lactobacillus merupakan bakteri Gram positif, tidak menghasilkan spora,
biasanya tidak bergerak, anaerob fakultatif, katalase negatif, koloninya dalam media
agar berukuran 2-5 mm, konfeks, opak, sedikit transparan, tidak berpigmen dan
metabolit utamanya adalah asam laktat. Tumbuh baik pada suhu 25-40 oC dan
tersebar luas di lingkungan terutama dalam produk-produk pangan asal hewan dan
sayuran. Bakteri ini menetap dalam saluran pencernaan unggas dan mamalia (Ray
dan Bhunia, 2008). Lactobacillus dibagi menjadi tiga grup, disajikan pada Tabel 1.
Tabel 1. Grup Spesies Lactobacillus sp
Karakteristik Grup I Grup II Grup III
Contoh spesies L. delbrueckii ssp. delbrueckii,
L. leichmannii L. plantarum L. divergens L. acidophilus L. curvatus L. kefir L. elveticus L. sake L. confuses L. brevis
L. sanfrancisco L. reuteri
Sumber: Ray dan Bhunia (2008).
Lactobacillus plantarum 1A5, 1B1, 2B2 dan 2C12
L. plantarum termasuk bakteri dalam filum Firmicutes, kelas Bacilli, ordo
Lactobacillales, family Lactobacillaceae dan genus Lactobacillus. L. plantarum
mempunyai kemampuan untuk menghambat mikroorganisme patogen pada bahan
pangan dengan daerah penghambatan terbesar dibandingkan dengan bakteri asam
laktat lainnya (Syahniar, 2009). L. plantarum tergolong dalam bakteri Gram positif,
berbentuk batang tunggal maupun rantai pendek, tidak berspora, katalase negatif, dan
anaerob fakultatif (Ray dan Bhunia, 2008).
L. plantarum 1A5, 1B1, 2B2 dan 2C12 merupakan isolat BAL yang diisolasi
4
2B2 dan 2C12 mampu bertahan dalam media NaCl 6,5%, tumbuh pada suhu 15 oC,
tumbuh baik pada 37 oC dan 45 oC, dan tahan pada kondisi usus (pH 7,2) dan
bertahan hidup lebih baik pada pH 2 (Wijayanto, 2009).
Senyawa Antimikrob
Senyawa antimikrob dapat bersifat bakterisidal (membunuh bakteri),
bakteristatik (menghambat pertumbuhan mikroba), fungisidal (membunuh kapang),
fungistatik (menghambat pertumbuhan kapang) dan germisidal (menghambat
germinasi spora bakteri). Kemampuan suatu zat antimikrob dalam menghambat
pertumbuhan mikroba dipengaruhi oleh beberapa faktor, antara lain konsentrasi zat
pengawet, waktu penyimpanan, suhu lingkungan, sifat-sifat mikroba (jenis,
konsentrasi, umur dan keadaan mikroba), sifat-sifat fisik dan kimia makanan,
termasuk kadar air, pH, jenis dan jumlah senyawa di dalamnya (Fardiaz, 1992).
Metabolit-metabolit bakteri asam laktat yang berfungsi sebagai senyawa
antimikrob antara lain asam organik (asam laktat dan asam asetat), bakteriosin,
hidrogen peroksida, diasetil, CO2 dan semua metabolit yang mempunyai aktivitas
antimikrob (Fardiaz, 1992; Jay et al., 2005; Settanni dan Corsetti, 2008).
Asam Organik
Penghambatan pertumbuhan pada mikroba oleh asam organik diakibatkan
adanya akumulasi anion. Anion menyebabkan berkurangnya kecepatan dari sintesis
makromolekul dan mempengaruhi transportasi antar membran sel. Bakteri asam
laktat dan juga bakteri lain meniadakan efek dari akumulasi anion dengan cara
mengurangi pH pada sitoplasma (Ouwehand dan Vesterlund, 2004).
Asam-asam organik yang dihasilkan oleh BAL mengakibatkan akumulasi
produk akhir asam dan penurunan pH yang akan menghambat pertumbuhan bakteri
baik Gram positif maupun bakteri Gram negatif. Turunnya pH internal menyebabkan
terdenaturasinya protein dan kehilangan viabilitasnya (Ray, 1992).
Bakteriosin
BAL memproduksi komponen antimikrob, salah satunya bakteriosin.
Kemampuan bakteriosin dalam melakukan aktivitasnya sebagai biopreservatif
dicapai oleh efek penghambatannya terhadap mikroorganisme patogen yang
5
Bakteriosin adalah peptida-peptida yang diproduksi oleh sejumlah bakteri
Gram positif dan Gram negatif (Aymerich et al., 2008). Bakteriosin yang
diproduksi oleh BAL dapat didefinisikan sebagai protein aktif atau kompleks
protein yang menunjukkan aksi bakterisidal melawan bakteri Gram positif, terutama
spesies yang berkerabat dekat dengan spesies penghasil (Jack et al., 1995; Ray dan
Bhunia, 2008; Parada et al., 2007). Penggunaan bakteriosin sebagai biopreservatif,
perlu memperhatikan dan menentukan jumlah konsentrasi bakteriosin yang harus
ditambahkan dalam produk pangan, dan efisiensi bakteriosin dalam mengontrol
bakteri-bakteri patogen (Ananou et al., 2005). Beberapa bakteriosin yang telah
berhasil dikarakterisasi, disajikan pada Tabel 2.
Tabel 2. Bakteriosin asal L. plantarum yang Telah Berhasil Dikarakterisasi
Spesies L. plantarum Jenis Bakteriosin Asal Isolasi Literatur
L. plantarum KLDS1.0391 plantaricin MG Industri Tortilla Gong et al.
(2010)
L. plantarum A-1 plantaricin ASM1 "Jiaoke", Fermentasi krim
Hata et al.
(2010)
L. plantarum OL15 plantaricin OL15
Algerian
Fermentasi minyak zaitun
Mourad et al. (2005)
L. plantarum C19 plantaricin C19 Fermentasi mentimun
Atrih et al.
(2001)
L. plantarum BFE 905 plantaricin D Salad Franz et al.
(1998)
L. plantarum 423 plantaricin 423 Sorgum Van Reenen
et al. (1998)
L. plantarum LL441 plantaricin C Keju Cabrales Gonzales et al. (1994)
Hidrogen Peroksida
BAL memproduksi H2O2 di bawah kondisi pertumbuhan aerob. BAL
mengsekresikan H2O2 tersebut sebagai alat pelindung diri yang mampu bersifat
bakteriostatik maupun bakterisidal. H2O2 merupakan salah satu agen pengoksidasi
kuat, dapat dijadikan sebagai zat antimikrob melawan bakteri, fungi dan bahkan virus
6
Kemampuan H2O2 untuk mengoksidasi menyebabkan perubahan tetap pada
sistem enzim sel mikroba sehingga digunakan sebagai antimikrob. Selain itu,
senyawa ini juga dapat terdekomposisi menjadi air dan oksigen. Kemampuan
bakterisidal dari H2O2 tergantung pada pH, konsentrasi, suhu, waktu dan tipe serta
jumlah mikroorganisme. Konsentrasi tertentu, spora bakteri ditemukan paling
resisten terhadap H2O2, diikuti dengan bakteri Gram positif. Bakteri yang paling
sensitif terhadap H2O2 adalah bakteri Gram negatif, terutama koliform (Ouwehand
dan Vesterlund, 2004).
Mekanisme Aksi Penghambatan oleh Bakteriosin
Beberapa bakteriosin mempunyai sifat bakterisidal melawan beberapa strain
dan spesies yang berelasi dekat tetapi beberapa dapat efektif melawan banyak strain
dalam spesies dan genera yang berbeda. Namun, sel penghasil bakteriosin akan
mengalami ketahanan terhadap bakteriosin yang dihasilkannya sendiri, disebabkan
memperoleh ketahanan protein yang spesifik. Bakteriosin ini pada umumnya sangat
efektif melawan sel dari bakteri Gram positif dan bakteri-bakteri lain yang
kekerabatannya dekat. Bakteriosin asal BAL tidak efisien dalam menghambat bakteri
Gram negatif karena membran terluarnya bersifat hidrofilik dan dapat menghalangi
aksi bakteriosin. Membran sitoplasma dari mikroorganisme Gram negatif
dikarakterisasi melalui keberadaan lapisan luar yang mengandung fosfolipida, protein,
polisakarida, lemak, dan substansi non permeabel (Ray dan Bhunia, 2008).
Aktivitas antimikrob bakteriosin merupakan interaksi awal antara
molekul-molekul kationik dari bakteriosin dengan polimer-polimer anionik di permukaan sel,
salah satunya adalah asam teikoat. Asam teikoat tersebut merupakan reseptor
bakteriosin yang hanya dihasilkan oleh bakteri Gram positif. Selanjutnya, aksi
bakterisidal dari bakteriosin melawan sel yang sensitif akan dihasilkan melalui
destabilisasi fungsi dari membran sitoplasma, berupa peningkatan permeabilitas
membran sehingga mengganggu keseimbangan barier dan dapat mengakibatkan
kematian sel (Jack et al., 2005). Mekanisme lainnya antara lain perubahan aktivitas
enzim, penghambatan germinasi spora dan inaktivasi pembawa anionik langsung
7 Pemurnian Protein
Purifikasi Parsial Menggunakan Amonium Sulfat
Penggunaan amonium sulfat dalam proses pemurnian protein telah banyak
digunakan. Day dan Underwood (2002) menyatakan bahwa proses pengendapan
merupakan awal proses pemurnian protein. Bahan yang biasa digunakan dalam
mengendapkan protein dalam larutan adalah amonium sulfat. Amonium sulfat
mampu membuka permukaan hidrofobik dari protein sehingga membentuk interaksi
hidrofobik dan membentuk presipitat atau endapan protein (Walker, 2000). Proses
pemurnian protein menggunakan amonium sulfat menghasilkan presipat yang masih
tercemar dengan garam dari amonium sulfat sehingga dilakukan proses dialisis.
Dialisis dapat menghilangkan pengotor-pengotor pada permukaan partikel protein
(Day dan Underwood, 2002).
Kromatografi Pertukaran Ion
Proses kromatografi pertukaran ion menggunakan resin sebagai bahan yang
dapat memurnikan protein. Day dan Underwood (2002) menyatakan bahwa resin
pertukaran ion diperoleh dengan memasukkan gugus yang dapat diionisasi ke dalam
matriks polimer. Secara komersial resin penukar ion terdiri dari resin penukar kation
(bermuatan negatif) akan mengikat ion positif dan resin penukar anion (bermuatan
positif) akan mengikat ion negatif. SP SepharoseTM merupakan salah satu penukar
kation yang kuat dan merupakan kelompok sulfopropil yang stabil baik secara fisik
maupun kimiawi (Wikstroms, 2002).
Kromatografi merupakan suatu metode pemisahan fisik, dimana
komponen-komponen yang dipisahkan didistribusikan diantara dua fasa, salah satu fasa tersebut
adalah suatu lapisan stationer dengan permukaan yang luas, yang lainnya sebagai
fluida yang mengalir lembut disepanjang landasan stationer. Kromatografi
pertukaran ion terdiri dari landasan stationer berupa padatan dan fasa bergerak
berupa cairan (Day dan Underwood, 2002). Buffer yang digunakan dalam
kromatografi penukar kation adalah buffer anion seperti asetat, barbiturat dan fosfat
(Wilson, 2000). Protein tidak akan terikat pada resin penukar ion dan akan mengalir
keluar kolom pada pH isoelektrik (pI). Protein akan bermuatan positif dan akan
berikatan dengan penukar kation (SP Sepharose) ketika pH di bawah pH isoelektrik
8 Mikroba Patogen pada Bahan Pangan
Bakteri patogen dibedakan atas penyebab intoksikasi yaitu keracunan yang
disebabkan oleh toksin yang dihasilkan bakteri patogen yang berkembang di dalam
bahan makanan, sedangkan infeksi yaitu bakteri yang menghasilkan racun di dalam
saluran pencernaan (Fardiaz, 1992).
Bakteri secara umum dibedakan menjadi dua bagian berdasarkan sifat
pewarnaan gram yaitu bakteri Gram positif dan Gram negatif. Perbedaan antara
bakteri Gram positif dan Gram negatif tergantung pada komposisi dalam dinding sel.
Dinding sel bakteri Gram positif sebagian besar terdiri dari lapisan peptidoglikan
(90%) dan bakteri Gram negatif mempunyai kandungan lipida yang tinggi pada
dinding selnya dalam bentuk liposakarida dan lipoprotein (Fardiaz, 1992). Perbedaan
antara bakteri Gram positif dan Gram negatif, disajikan pada Tabel 3.
Tabel 3. Perbedaan Antara Bakteri Gram Positif dan Bakteri Gram Negatif
Sifat Bakteri
Gram Positif Gram Negatif
Komposisi dinding sel lipida rendah (1-4%) lipida tinggi (11-12%)
Ketahanan terhadap antibiotik lebih sensitif lebih tahan
Penghambatan oleh pewarna basa lebih dihambat kurang dihambat
Kebutuhan nutrien relatif kompleks kompleks sederhana
Ketahanana terhadap perlakuan
fisik lebih tahan kurang tahan
Sumber: Buckle et al. (2007).
Kelompok bakteri patogen yang bersifat Gram positif diantaranya
Staphylococcus aureus, Listeria monocytigenes dan Bacillus cereus sedangkan
bakteri yang bersifat Gram negatif diantaranya Escherichia coli, Pseudomonas
aeruginosa dan Salmonella typhimurium.
Staphylococcus aureus
S. aureus termasuk famili Micrococcaceae, merupakan bakteri Gram positif,
berbentuk kokus yang terdapat dalam bentuk tunggal, berpasangan tetrad atau
kelompok, seperti buah anggur dengan diameter berkisar 0,5-1,5 µm, anaerob
fakultatif, tidak bergerak, tidak berspora dan biasanya termasuk katalase positif (Ray
dan Bhunia, 2008). Suhu optimum pertumbuhan S. aureus adalah 35-37 oC, suhu
9
4,0-9,8 dengan pH optimum sekitar 7,0-7,8. Hsieh et al. (1998) mencatat terjadinya
peningkatan besar dalam sensitivitas S. aureus terhadap kation dan antimikrob pada
kondisi pH alkali.
Bacillus cereus
B. cereus merupakan bakteri pembentuk spora tergolong dalam famili
Bacillaceae. B. cereus adalah bakteri Gram positif berbentuk batang, bergerak, dapat
membentuk spora, bersifat anaerobik fakultatif dan tersebar secara luas dalam tanah
dan air. Kemampuan membentuk spora memungkinkan mikroorganisme ini tetap
hidup pada pengolahan dengan pemanasan (Buckle et al., 2007). Ray dan Bhunia
(2008), menyatakan bahwa sel bakteri ini sensitif terhadap pasteurisasi, namun
sporanya dapat bertahan terhadap suhu tinggi. Suhu untuk pertumbuhan B. cereus
berkisar 4-50 oC, dengan suhu optimum pertumbuhannya adalah 35-40 oC. Parameter
pertumbuhan lainnya adalah bakteri ini dapat tumbuh pada pH 4,9-9,3 dengan aw
minimum 0,95 serta konsentrasi NaCl adalah 10%. Torkar dan Matijasi (2003)
menyatakan bahwa B. cereus stabil pada pH 3 hingga pH 10. Lebih lanjut, Padan et
al. (2005) dalam penelitiannya menyatakan bahwa perubahan asam teikoat
berkontribusi pada spesies Bacillus sp. pada pH alkali.
Pseudomonas aeruginosa
P. aeruginosa merupakan bakteri non-spora tergolong dalam famili
Pseudomonadaceae. Pseudomonas merupakan salah satu jenis bakteri Gram negatif,
berbentuk batang, berukuran 0,5-0,8 µm atau 1,5-3,0 µm, hampir semua strain adalah
motil dengan flagela tunggal, oksidatif positif, suhu optimum pertumbuhan adalah
37-42 oC, aerob, tidak toleran terhadap penurunan aw serta tumbuh pada aw minimum
0,98, secara umum dapat ditemukan di tanah, air, di permukaan tanaman dan hewan.
P. aeruginosa merupakan opportunistic pathogen, artinya bakteri ini akan
menyerang kekebalan dari inangnya dan menyebabkan infeksi. Uji laboratorium
terhadap P. aeruginosa menunjukkan bahwa bakteri ini tumbuh di media yang
mengandung asam asetat sebagai sumber karbon dan amonium sulfat sebagai sumber
nitrogen (Todar, 2009). Bakteri ini merupakan penyebab berbagai jenis kerusakan
10
dalam memproduksi enzim yang dapat memecah baik komponen lemak maupun
protein dari bahan pangan (Buckle et al., 2007).
Salmonella typhimurium
Salmonella sp. merupakan kelompok bakteri Gram negatif dan merupakan
bakteri patogen yang tidak diperkenankan ada dalam produk-produk pangan. Bakteri
ini dapat tumbuh pada kisaran suhu 5-45 oC dengan suhu optimum 37 oC, pH
optimum pertumbuhan adalah 6,5-7,5 (Portillo, 2000). Salmonella memiliki
ketahanan panas yang tinggi pada pH 5,5 dan aw rendah. Salmonella berbentuk
batang lurus, berukuran 0,7-1,5 µm x 2-5 µm, termasuk bakteri anaerob fakultatif
dan biasanya dapat bergerak menggunakan flagela peritrikus. Salmonella dapat
bergerak dengan metabolisme bersifat fakultatif anerob (Buckle et al., 2007). Bakteri
Gram negatif seperti Salmonella sp., lebih tahan terhadap bakteriosin yang berasal
dari BAL karena komposisi dari membrannya berbeda dengan mikroorganisme Gram
positif (Ray dan Bhunia, 2008; Drosinos et al., 2009).
Escherichia coli
E. coli termasuk dalam famili Enterobacteriaceae merupakan bakteri Gram
negatif yang berbentuk batang yang dengan ukuran 1,1-1,5 µm x 2,0-6,0 µm, soliter
maupun berkoloni, anaerobik fakultatif dan katalase positif. E. coli dapat tumbuh
optimum pada pH 7,0-7,5 dengan pH minimum 4,0 dan pH maksimum 8,5 (Fardiaz,
1992). Bakteri ini dapat tumbuh dalam kisaran suhu yang luas yaitu 1-45 °C (Pelczar
dan Chan, 2007). Membran luar E. coli meningkatkan kelangsungan hidup bakteri ini
dalam asam ekstrim, tetapi kelangsungan hidupnya berkurang di alkali ekstrim
(Yohannes et al., 2005).
Nilai pH Beberapa Produk Pangan
Produk pangan terdiri atas produk pangan asam dan produk pangan alkali.
Produk pangan asam merupakan produk pangan fermentasi yang mengandung asam,
seperti seperti yogurt, sosis, keju, salami, dsb. Produk pangan alkali, seperti album
telur (Sperber dan Doyle, 2009), natto dari kacang kedelai dan dadawa dari
kacang-kacangan (Wang dan Fung, 1996). Nilai pH olahan dari beberapa produk pangan
11
Tabel 4. Nilai pH Beberapa Produk Pangan
Produk Pangan Nilai pH
minuman bersoda 2,0
keju cheddar 5,2
daging giling 6,2
susu 6,4
ikan segar 6,7
keju peram >7,0
bubur jagung 8,5
albumin telur 8,6
nixtamalized corn 10,0
Sumber: Sperber (2009).
Konsumsi terhadap produk pangan alkali sangat bermanfaat untuk menjaga
keseimbangan pH tubuh, menjaga kesehatan tulang dan menurunkan resistensi
12 MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Bagian Teknologi
Hasil Ternak dan Laboratorium Terpadu, Fakultas Peternakan, Institut Pertanian
Bogor. Penelitian dilaksanakan dari bulan Maret 2011 hingga Oktober 2011.
Materi
Bahan-bahan utama yang digunakan adalah kultur L. plantarum 1A5, 1B1,
2B2 dan 2C12, koleksi Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak,
Fakultas Peternakan IPB. Bakteri indikator yang digunakan untuk uji antagonistik
adalah S. typhimurium ATCC 14028, S. aureus ATCC 25923, E. coli ATCC 25922,
P. aeruginosa ATCC 27853 dan B. cereus. Media yang digunakan yaitu de Man
Rogosa and sharpe agar (MRSA), de Man Rogosa and shrape broth (MRSB), yeast
extract, nutrien agar (NA), nutrient broth (NB), Mueller Hinton agar (MHA),
amonium sulfat, membran saring Sartorius, buffer kalium fosfat pH 6,8 (campuran
KH2PO4 dan K2HPO4), resin SP SepharoseTM fast-flow, kristal violet, larutan lugol
iodin, safranin, etanol 95%, NaOH 1 N, HCl 1 N dan larutan Mc. Farland no. 0,5.
Larutan pengencer yang digunakan adalah NaCl 0,85% dan akuades.
Alat-alat yang digunakan adalah tabung reaksi, jarum Ose, autoclave,
waterbath, cawan petri, timbangan, cooling box, gelas objek, gelas ukur, labu
Erlenmeyer, mikro pipet, pipet Pasteur, pemanas Bunsen, sentrifuse, membran filter
Millifore, alumunium foil, kapas, tip, botol Schott, ependorf, pH meter, kertas pH
universal, jangka sorong digital, inkubator, oven, refrigerator, vortex, cork borer,
mikroskop OPMIAS En Ver1.0 dan spektrofotometri UV-visible.
Prosedur
Penyegaran dan Pembiakan Kultur (Pelczar dan Chan, 2007)
Penyegaran dilakukan dengan cara kultur L. plantarum dan bakteri indikator
sebanyak 250 l diinokulasikan secara duplo pada media MRSB untuk kultur L.
plantarum dan media NB untuk bakteri indikator sehingga dihasilkan kultur
sebanyak 5 ml. Kultur kemudian diinkubasi pada suhu 37 oC selama 24 jam untuk
mendapatkan kultur antara. Sebanyak 1 ml kultur antara diinokulasikan kembali
13
Kultur diinkubasikan kembali sehingga didapatkan kultur kerja. Kultur kerja
ditumbuhkan pada media MRSA untuk kultur L. plantarum dan NA untuk bakteri
indikator, selanjutnya dihitung populasinya dan digunakan untuk pewarnaan Gram.
Karakteristik Morfologi dan Pewarnaan Gram (Pelczar dan Chan, 2007)
Kultur L. plantarum dan bakteri indikator yang tumbuh di media agar,
diperikasa sifat morfologinya untuk mengetahui kemurniannya. Pengujian morfologi
starter dengan bantuan pewarnaan Gram dan pengamatan dengan mikroskop pada
perbesaran 1000 kali. Pengujian pewarnaan Gram dilakukan dengan cara kultur
bakteri dioleskan pada gelas objek dengan jarum Ose dan difiksasi panas, kemudian
ditetesi dengan kristal violet, dibiarkan selama ± 1 menit. Preparat selanjutnya dibilas
dengan akuades dan dikeringudarakan. Preparat yang sudah kering ditetesi dengan
larutan lugol iodin dan didiamkan selama ± 1 menit, kemudian dibilas kembali
dengan akuades dan preparat selanjutnya ditetesi dengan alkohol 95% sebagai bahan
pemucat selama ± 5 detik, dibilas kembali dengan akuades dan dikeringudarakan.
Pewarnaan terakhir menggunakan safranin selama ± 30 detik dan dibilas kembali
dengan akuades, lalu preparat dikeringudarakan. Bakteri yang telah diwarnai
diperiksa di bawah mikroskop. Bakteri dikelompokkan menjadi bakteri Gram positif,
bila dapat mempertahankan zat warna ungu kristal dan tampak berwarna ungu tua.
Kelompok bakteri Gram negatif akan terlihat berwarna merah. Hasil pengamatan
morfologi kultur bakteri didokumentasikan menggunakan perangkat lunak OPMIAS
En Ver1.0 yang dihubungkan pada mikroskop.
Aktivitas Antimikrob Supernatan Bebas Sel
Sebanyak empat galur L. plantarum masing-masing diinokulasikan ke media
MRSB dan diinkubasikan pada suhu 37 °C selama 24 jam. Supernatan bebas sel
disentrifugasi pada kecepatan 10000 rpm selama 20 menit suhu 4 °C yang
selanjutnya disebut supernatan. Supernatan disaring dengan membran saring
Sartorius 0,22 µm kemudian dinetralkan dengan NaOH 1 N sampai pH 5,8-6,2.
Supernatan yang merupakan ekstrak kasar bakteriosin tersebut siap untuk diuji
14 Produksi dan Purifikasi plantaricin
Purifikasi bertujuan untuk mengetahui komponen-komponen senyawa kimia
yang dapat terpisah dan kandungan senyawa aktifnya. Purifikasi plantaricin terdiri
dari purifikasi parsial menggunakan presipitasi amonium sulfat, dialisis dan
kromatografi kolom.
Purifikasi Parsial Menggunakan Amonium Sulfat (Gong et al., 2010)
Sebanyak 1 liter media MRSB ditambahkan yeast extract 3% dan NaCl 1%
diinokulasi dengan 10% (v/v) kultur L. plantarum, selanjutnya diinkubasi pada suhu
37 oC selama 20 jam. Setelah itu, disimpan pada refrigerator suhu 4 oC selama 2 jam
kemudian dilakukan sentrifugasi pada kecepatan 10000 rpm selama 20 menit suhu 4
o
C. Setelah selesai dilakukan penyaringan dengan menggunakan membran saring
Sartorius diameter 0.22 µm dan selanjutnya supernatan bebas sel dinetralkan pH-nya
menjadi 5,8-6,2 dengan menggunakan NaOH 1 N.
Supernatan netral bebas sel yang telah disaring steril ditambahkan serbuk
amonium sulfat sebanyak 80% secara bertahap (20%, 40%, 60%, 80%) kemudian
dihomogenkan dan distirer secara perlahan pada suhu 4 oC selama 2 jam. Hasil yang
didapat pada tahap ini adalah presipitat bakteriosin. Pengecekan protein presipitat
bakteriosin diamati menggunakan spektrofotometer UV-visible pada panjang
gelombang 280 nm. Penggunaan padatan amonium sulfat (% penjenuhan) dapat
dilihat pada Lampiran 18.
Dialisis (Day dan Underwood, 2002)
Dialisis dilakukan dengan tujuan untuk desalting atau menghilangkan garam
amonium sulfat yang masih tercampur dengan presipitat bakteriosin. Buffer yang
digunakan adalah buffer kalium fosfat pH 6,8 (campuran KH2PO4 dan K2HPO4
dengan konsentrasi tertentu) dengan perbandingan 1:1000 (satu bagian presipitat dan
1000 bagian buffer). Dialisis dilakukan dengan menggunakan membran dialisis
diameter 20 µm pada buffer kalium fosfat selama 12 jam, dan dilakukan penggantian
buffer sebanyak 2 kali (2 jam dan 4 jam) pada suhu 4 oC. Setelah selesai, didapatkan
ekstrak plantaricin kasar. Pengecekan protein plantaricin kasar hasil dialisis diamati
15 Purifikasi Plantaricin Menggunakan Kromatografi Kolom (Hata et al., 2010)
Tahap selanjutnya adalah kromatografi kolom untuk menghasilkan
plantaricin murni. Resin yang digunakan adalah SP SepharoseTM-fast flow dengan
kolom terbuka (open column) Econo-Column Bio-Rad. Purifikasi parsial plantaricin
menggunakan kromatografi kolom dengan resin SP SepharoseTM-fast flow dapat
meningkatkan spesifik protein dari supernatan bebas sel sebesar 253 AU/mg dan
meningkat kembali pada proses kromatografi kolom menggunakan SP SepharoseTM
-fast flow menjadi 11.900 AU/mg.
Buffer yang digunakan adalah buffer potasium fosfat pH 6,8. Kolom terlebih
dahulu diisi dengan resin. Plantaricin kasar hasil dialisis dimasukkan ke dalam
kolom secara perlahan, dan dibawah kolom diberikan tabung penampung eluat yang
keluar dari kolom. Proses kromatografi dilakukan pada suhu 4 oC. Eluat pertama
adalah buffer dan selanjutnya adalah sampel plantaricin kasar. Kecepatan alir yang
diberikan adalah 0,8 ml/menit. Fraksi plantaricin murni yang diperoleh ditampung
setiap 3 ml per tabung penampung eluat. Pengecekan protein plantaricin murni hasil
kromatografi kolom diamati menggunakan spektrofotometer UV-visible pada
gelombang 280 nm.
Stabilitas Protein Plantaricin pada pH Alkali (Hata et al., 2010)
Plantaricin murni hasil purifikasi parsial menggunakan kromatografi kolom,
digunakan dalam pengujian stabilitas plantaricin terhadap pH alkali. Plantaricin
murni hasil kromatografi kolom diuji stabilitasnya terhadap pH yang berbeda, yaitu
1) pH 7 dan 2) pH 9. Plantaricin murni perlakuan pH alkali dilakukan dengan
menambahkan larutan NaOH 1 N menggunakan mikro pipet secara perlahan
kemudian dicek kondisi pH plantaricin murni menggunakan kertas pH universal
hingga pH 9. Pengujian stabilitas protein plantaricin murni setelah perlakuan pH
alkali dilakukan dengan melakukan pengecekan protein plantaricin murni
menggunakan spektrofotometer UV-visible pada panjang gelombang 280 nm.
Uji Aktivitas Antimikrob Plantaricin pada Kondisi Alkali terhadap Bakteri Indikator (Savadogo et al., 2006)
Plantaricin murni hasil kromatografi kolom diuji dengan menggunakan
metode difusi sumur. Kultur bakteri indikator patogen dan pembusuk makanan
16
ditambahkan media konfrontasi MHA sebanyak ± 20 ml. Setelah agar dalam cawan
mengeras, ditengah-tengah agar dibuat lubang sumur dengan menggunakan cork
borer berdiameter 5 mm. Plantaricin murnisebanyak 50 l dipipet ke dalam lubang
sumur kemudian cawan dilapisi kertas saring terlebih dahulu sebelum ditutup dan
disimpan dalam refrigerator (suhu ± 10 oC) selama 2 jam untuk memberikan
kesempatan plantaricin meresap ke dalam agar.
Seluruh cawan yang berisi bakteri indikator (S. typhimurium ATCC 14028, S.
aureus ATCC 25923, E. coli ATCC 25922, P. aeruginosa ATCC 27853 dan B.
cereus) dan plantaricin murni asal empat galur L. plantarum diinkubasi selama 24
jam pada suhu 37 oC. Zona hambat yang terbentuk di sekitar sumur pada seluruh
cawan diamati dan diukur diameternya dengan menggunakan jangka sorong.
Diameter dari masing-masing zona hambat diukur sebanyak tiga kali di daerah yang
berbeda yang kemudian hasilnya dirata-ratakan. Setiap pengujian diulang sebanyak
tiga kali dan pada setiap ulangan dilakukan secara duplo (Gambar 1). Zona hambat
yang diperoleh dikategorikan menurut daya hambatnya, dapat dilihat pada Tabel 5.
Keterangan:
A : Sumur untuk plantaricin murni (diameter 5 mm)
B : Zona hambat
C : Koloni bakteri indikator
Garis / / : Pengukuran diameter zona
Gambar 1. Metode Pengukuran Diameter Zona Hambat Bakteri.
Tabel 5. Kategori Zona Hambat Bakteri
Zona Hambat Bakteri Kategori
≥ 20 mm Sangat kuat
10-20 mm Kuat
5-10 mm Sedang
≤ 5 mm Lemah
Sumber: Davis dan Stout (1971). C
17 Rancangan dan Analisis Data
Rancangan dan analisis data pada penelitian ini meliputi identifikasi aktivitas
antimikrob supernatan bebas sel asal galur L. plantarum, konsentrasi protein
plantaricin pada masing-masing tahap produksi plantaricin, stabilitas dan aktivitas
plantaricin terhadap perlakuan pH alkali.
Identifikasi Aktivitas Antimikrob Supernatan Bebas Sel
Rancangan yang digunakan adalah rancangan acak lengkap (RAL) pola
searah dengan faktor perlakuan galur L. plantarum yang berbeda (L. plantarum 1A5,
1B1, 2B2 dan 2C12) dan jenis bakteri indikator (S. typhimurium ATCC 14028, S.
aureus ATCC 25923, E. coli ATCC 25922, P. aeruginosa ATCC 27853 dan B.
cereus) dengan tiga ulangan. Peubah yang diamati yaitu diameter zona hambat
supernatan netral bebas sel. Data dialisis secara deskriptif untuk memperjelas
pembahasan terhadap hasil yang diperoleh. Model matematis yang digunakan
berdasarkan Steel dan Torrie (1995) sebagai berikut:
Yij = + αi+ εij
Keterangan:
Yij = Hasil pengamatan pada perlakuan ke-i galur L. plantarum dan ulangan ke-j (j= 1, 2, 3)
= Pengaruh rata-rata galur L. plantarum
αi = Pengaruh level perlakuan ke-i dari level perlakuan galur L. plantarum yang berbeda (i= 1, 2, 3, 4)
εij = Pengaruh Galat perlakuan ke-i pada ulangan ke-j
Produksi Plantaricin
Rancangan yang digunakan adalah rancangan acak lengkap (RAL) pola
searah dengan faktor perlakuan galur L. plantarum yang berbeda (L. plantarum 1A5,
1B1, 2B2 dan 2C12) dengan tiga kali ulangan. Peubah yang diamati yaitu
konsentrasi protein plantaricin pada masing-masing tahap produksi plantaricin. Data
dialisis secara deskriptif untuk memperjelas pembahasan terhadap hasil yang
diperoleh. Model matematis yang digunakan berdasarkan Steel dan Torrie (1995)
18
Yij = + αi+ εij
Keterangan:
Yij = Hasil pengamatan pada perlakuan ke-i galur L. plantarum dan ulangan ke-j (j= 1, 2, 3)
= Pengaruh rata-rata galur L. plantarum
αi = Pengaruh level perlakuan ke-i dari level perlakuan galur L. plantarum yang berbeda (i= 1, 2, 3, 4)
εij = Pengaruh Galat perlakuan ke-i pada ulangan ke-j
Stabilitas dan Aktivitas Plantaricin terhadap Perlakuan pH Alkali
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL)
pola faktorial 2 x 4. Faktor pertama adalah perbedaan pH (pH 7 dan pH 9),
sedangkan faktor kedua adalah perbedaan galur L. plantarum (1A5, 1B1, 2B2 dan
2C12) dengan tiga ulangan. Peubah yang diamati adalah diameter zona hambat hasil
uji antagonistik dari plantaricin dengan perlakuan pH berbeda dan plantaricin asal
galur L. plantarum yang berbeda. Data diolah dengan analisis ragam (uji parametrik)
atau analysis of variance (ANOVA). Setiap analisis ragam yang menunjukkan bahwa
perlakuan berpengaruh nyata, maka dilanjutkan dengan uji Tukey. Apabila data tidak
memenuhi analisis ragam maka dilanjutkan uji non parametrik (Kruskall-Wallis).
Pembahasan secara deskriptif juga dilakukan untuk memperjelas pembahasan
terhadap hasil yang telah diperoleh. Model matematis yang digunakan berdasarkan
Steel dan Torrie (1995) sebagai berikut:
Yijk = µ + αi + βj + (αβ)ij + εijk
Keterangan:
Yijk = variabel respon akibat pengaruh perlakuan pH pada taraf ke-i dan galur
L. plantarum ke-j pada ulangan ke-k (K= 1, 2, 3)
µ = nilai tengah umum
αi = pengaruh taraf perlakuan pH ke-i terhadap diameter zona hambat (i= pH 7 dan pH 9)
βj = pengaruh taraf perlakuan galur L. plantarum ke-j terhadap diameter zona hambat (j= L. plantarum 1A5, 1B1, 2B2 dan 2C12)
(αβ)ij = pengaruh interaksi antara perlakuan ke-i dengan ke-j
19 HASIL DAN PEMBAHASAN
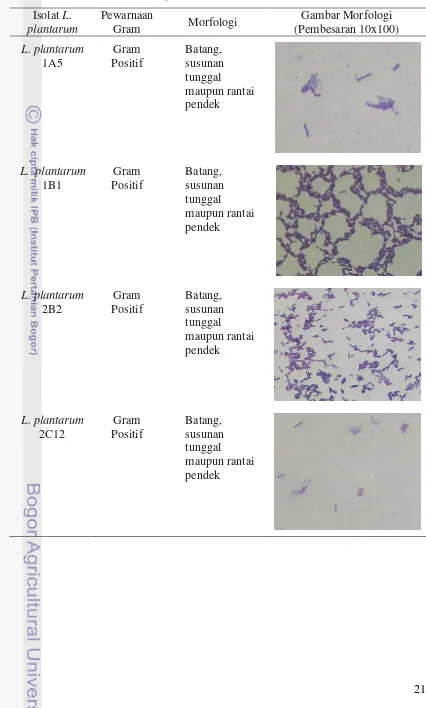
Karakteristik Morfologi Sel dan Pewarnaan Gram
Karakteristik morfologi L. plantarum yang telah didapat adalah Gram positif,
berbentuk batang tunggal dan koloni berantai pendek. Karakteristik morfologi
tersebut sesuai dengan Ray dan Bhunia (2008) bahwa L. plantarum tergolong bakteri
Gram positif, berbentuk batang tunggal maupun rantai pendek. Pemeriksaan
karakteristik kultur bakteri bertujuan untuk memastikan kemurnian kultur bakteri
yang digunakan. Karakteristik morfologi yang diperoleh tersebut menunjukkan
bahwa kultur homogen dan tidak tercemar, seperti yang diperoleh dalam penelitian
sebelumnya (Hidayati, 2006; Permanasari, 2008).
Karakteristik morfologi kelima bakteri indikator yang digunakan, antara lain
P. aeruginosa ATCC 27853 dan B. cereus berbentuk batang. Buckle et al. (2007)
menyatakan bahwa bakteri P. aeruginosa dan B. cereus memiliki morfologi
berbentuk batang. Hasil karakteristik morfologi bakteri S. typhimurium ATCC 14028
dan E. coli ATCC 25922 adalah berbentuk batang soliter maupun berkoloni
sedangkan S. aureus ATCC 25923 berbentuk kokus dalam susunan tunggal maupun
berkoloni seperti buah anggur. Ray dan Bhunia (2008) menyatakan bahwa S.
typhimurium memiliki morfologi berbentuk batang lurus, E. coli berbentuk batang,
sedangkan S. aureus berbentuk kokus, tetrad dan berpasangan seperti buah anggur.
Bakteri secara umum dibedakan menjadi dua berdasarkan pewarnaan Gram,
yaitu bakteri Gram positif dan Gram negatif. Pewarnaan Gram merupakan suatu
teknik pewarnaan secara mikroskopis untuk menentukan jenis bakteri sebagai bakteri
Gram positif dan Gram negatif dan sering digunakan untuk pengujian kemurnian
suatu bakteri. Teknik ini terdiri dari empat tahap, yaitu (a) tahap awal pewarnaan
dengan kristal violet, (b) fiksasi dengan iodin, (c) dekolorisasi dengan etanol dan (d)
pewarnaan dengan safranin. Perbedaan antara bakteri Gram positif dan Gram negatif
tergantung pada komposisi dinding sel (Pelczar dan Chan, 2007).
Hasil pewarnaan Gram terhadap kultur L. plantarum, serta bakteri indikator
S. aureus ATCC 25923 dan B. cereus menunjukkan bahwa bakteri-bakteri tersebut
tergolong dalam bakteri Gram positif. Hal ini disebabkan pada proses pewarnaan
Gram, kultur L. plantarum serta bakteri indikator S. aureus ATCC 25923 dan B.
20
iodin dan tetap mempertahankan warna ungu tersebut meskipun telah ditambahkan
alkohol 95% dan zat warna safranin.
Bakteri P. aeruginosa ATCC 27853, S. typhimurium ATCC 14028 dan E.
coli ATCC 25922, berdasarkan hasil pewarnaan Gram menunjukkan bahwa ketiga
bakteri ini tergolong dalam bakteri Gram negatif. Hal ini disebabkan ketiga bakteri
tersebut tidak dapat mempertahankan warna ungu dari zat pewarna kristal violet saat
ditambahkan alkohol 95% serta menyerap warna merah yang berasal dari safranin.
Perbedaan antara bakteri Gram positif dan Gram negatif tergantung pada
komposisi dalam dinding sel (Pelczar dan Chan, 2007). Dinding sel bakteri Gram
positif sebagian besar terdiri dari lapisan peptidoglikan (90%). Pelczar dan Chan
(2007) menyatakan bahwa bakteri Gram positif mempertahankan warna ungu
disebabkan dinding sel mengalami dehidrasi ketika ditetesi alkohol, sehingga
pori-pori menciut, daya rembes dinding sel dan membran menurun. Keadaan ini membuat
kompleks kristal violet dengan iodin tidak dapat keluar dari sel, akibatnya zat warna
safranin tidak dapat masuk ke dalam dinding sel.
Dinding sel bakteri Gram negatif mempunyai kandungan lipida yang tinggi
dalam bentuk lipopolisakarida dan lipoprotein (Fardiaz, 1992). Lipida pada dinding
sel bakteri Gram negatif akan larut oleh alkohol sehingga pori-pori mengembang dan
menyebabkan kompleks kristal violet dengan iodin keluar dari sel, akibatnya dinding
sel bakteri menjadi tidak berwarna. Dinding sel bakteri yang tidak berwarna tersebut
akan menyerap zat warna safranin sehingga sel bakteri akan tampak berwarna merah
ketika dilihat dibawah mikroskop (Pelczar dan Chan, 2007). Hasil pewarnaan Gram
dan pengamatan morfologi dari kultur L. plantarum 1A5, 1B1, 2B2 dan 2C12 serta
21
Tabel 6. Karakteristik Isolat L. plantarum
22
Tabel 7. Karakteristik Isolat Bakteri Indikator
Isolat Bakteri
23 Aktivitas Antimikrob Supernatan Bebas Sel
Kondisi asam dalam supernatan bebas sel akan mengurangi kemampuan
bakteriosin dalam menghambat bakteri indikator pada uji antagonistik. Oleh karena
itu, supernatan bebas sel yang dihasilkan dinetralkan hingga mencapai kondisi pH
5,8-6,2. Produksi maksimum dari bakteriosin didapatkan pada kondisi pH 6,5 dari
rentang pH 2 hingga pH 10, dan bakteriosin kehilangan aktivitas antimikrob pada
pH 12 (Bhattacharya dan Arijit, 2010). Kondisi pH supernatan bebas sel asal L.
plantarum, dapat dilihat pada Gambar 2.
Galur L. plantarum
Keterangan: pH awal = pH initial supernatan bebas sel
pH netral = pH netral supernatan bebas sel setelah penambahan NaOH 1 N
Gambar 2. Kondisi pH Supernatan Bebas Sel asal Galur L. plantarum pada Media MRSBdengan Yeast Extract (3%) dan NaCl (1%).
Nilai pH supernatan bebas sel berkisar 3,94-4,02. Kondisi asam dari
supernatan bebas sel ini disebabkan oleh adanya asam-asam organik yang terbentuk
sebagai metabolit primer dari bakteri asam laktat yang akan menghambat
pertumbuhan bakteri. Nilai pH supernatan bebas sel setelah penetralan berkisar
5,87-6,17. Asam organik rantai pendek, seperti asam asetat dan asam laktat
merupakan metabolit primer dari supernatan bebas sel yang dihasilkan oleh bakteri
asam laktat (Fardiaz, 1992; Jay et al., 2005; Settanni dan Corsetti, 2008).
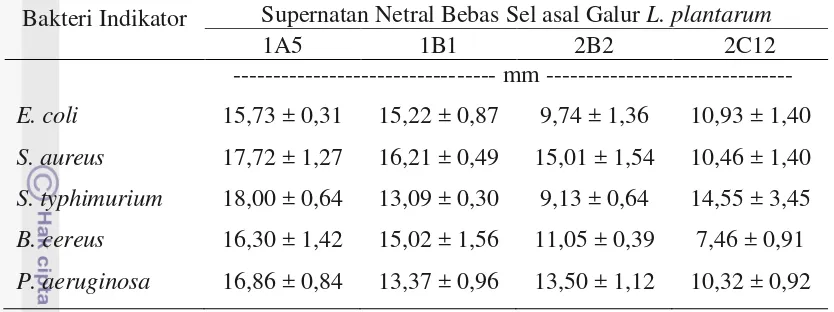
Aktivitas antimikrob supernatan netral bebas sel diuji melalui aktivitasnya
terhadap bakteri indikator. Hasil uji antagonistik supernatan netral bebas sel asal
empat galur L. plantarum terhadap masing-masing bakteri indikator ditunjukkan
dengan adanya diameter zona hambat disekitar sumur konfrontasi, dapat dilihat pada
24
Tabel 8. Diameter Zona Hambat Supernatan Netral Bebas Sel asal Galur L. plantarum terhadap Bakteri Indikator
Bakteri Indikator Supernatan Netral Bebas Sel asal Galur L. plantarum
1A5 1B1 2B2 2C12
--- mm ---
E. coli 15,73 ± 0,31 15,22 ± 0,87 9,74 ± 1,36 10,93 ± 1,40
S. aureus 17,72 ± 1,27 16,21 ± 0,49 15,01 ± 1,54 10,46 ± 1,40
S. typhimurium 18,00 ± 0,64 13,09 ± 0,30 9,13 ± 0,64 14,55 ± 3,45
B. cereus 16,30 ± 1,42 15,02 ± 1,56 11,05 ± 0,39 7,46 ± 0,91
P. aeruginosa 16,86 ± 0,84 13,37 ± 0,96 13,50 ± 1,12 10,32 ± 0,92
Keterangan : Diameter lubang sumur (5 mm) termasuk kedalam diameter zona hambat
Rataan diameter zona hambat dari masing-masing galur L. plantarum
berbeda-beda. Perbedaan aktivitas hambat dikarenakan bakteriosin mempunyai
aktivitas hambat terhadap bakteri spesifik, dan biasanya mempunyai hubungan
kekerabatan (filogenik) serta tergantung pada perbedaan jenis dinding sel bakteri
yang dihambat yang berpengaruh pada ketahanan suatu bakteri terhadap zat
antimikrob (Usmiati et al., 2009). Rataan diameter zona hambat dari supernatan
netral bebas sel berkisar 7,46-18,00 mm (Tabel 8). Rataan diameter zona hambat dari
supernatan netral bebas sel termasuk dalam kategori kuat (Davis dan Stout, 1971).
Supernatan netral bebas sel dari keempat galur L. plantarum mampu menghambat
bakteri indikator. Hasil ini sama dengan yang diperoleh Omemu dan Faniran (2011)
yang menyatakan bahwa supernatan netral bebas sel asal L. plantarum mampu
menghambat bakteri patogen.
Keempat galur L. plantarum mampu menghambat bakteri dari strain bakteri
Gram positif dan bakteri Gram negatif. Bakteri Gram negatif seperti E. coli ATCC
25922, P. aeruginosa ATCC 27853 dan S. typhimurium ATCC 14028, lebih tahan
terhadap bakteriosin yang berasal dari L. plantarum karena komposisi dari
membrannya berbeda dengan bakteri Gram positif. Hal ini berbeda dengan Drosinos
et al. (2009) yang menyatakan bahwa bakteriosin asal L. plantarum hanya akan
menghambat bakteri Gram positif atau bakteri-bakteri yang berkerabat dekat dengan
spesies penghasil, serta tidak efisien dalam menghambat bakteri Gram negatif karena
membran terluarnya bersifat hidrofilik dan dapat menghalangi aksi bakteriosin.
25
yang mengandung fosfolipida, protein, polisakarida, lemak dan substansi non
permeabel akan mempengaruhi aktivitas antimikrob bakteriosin dalam menghambat
bakteri Gram negatif.
Bakteriosin asal L. plantarum dikarakterisasi sebagai kompleks protein,
sangat sensitif terhadap perubahan pH lingkungan. Perubahan pH lingkungan
berpengaruh terhadap bakteriosin yang dihasilkan, selain pengaruh nutrien dan
temperatur (Todorov dan Dicks, 2005). Penurunan pH dalam bakteriosin asal L.
plantarum akan mempengaruhi susunan protein dari bakteriosin tersebut, sehingga
mempengaruhi aktivitas penghambatan senyawa antimikrob yang dihasilkan. Oleh
karena itu, supernatan netral bebas sel yang diperoleh perlu dilakukan tahap lanjutan
berupa purifikasi parsial.
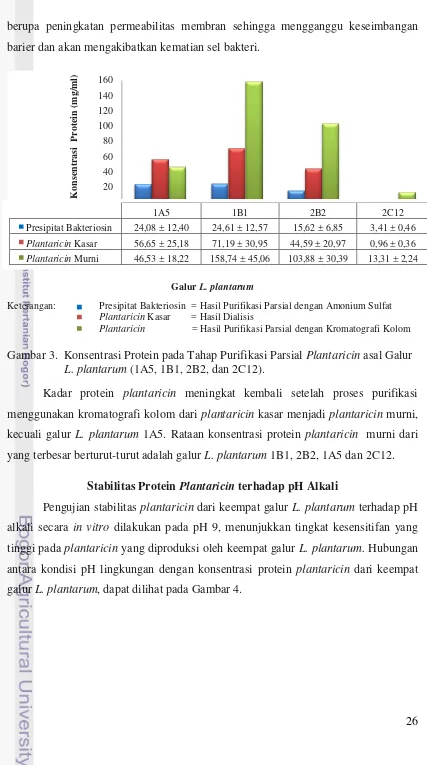
Purifikasi Parsial Plantaricin
Hasil kuantitatif kadar protein dari setiap tahapan purifikasi parsial
plantaricin menggunakan amonium sulfat, dialisis, dan purifikasi parsial
menggunakan kromatografi kolom dari masing-masing galur L. plantarum 1A5, 1B1,
2B2 dan 2C12, dapat dilihat pada Gambar 3. Secara deskriptif, hasil kuantitatif ini
menunjukkan bahwa rataan konsentrasi protein yang dihasilkan oleh galur L.
plantarum 1A5, 1B1, dan 2B2 merupakan nilai yang lebih tinggi dibandingkan
dengan galur L. plantarum 2C12.
Rataan kadar protein plantaricin kasar dari galur L. plantarum menunjukkan
terjadinya peningkatan dari presipitat bakteriosin menjadi plantaricin kasar kecuali
galur L. plantarum 2C12. Ekstrak plantaricin kasar dari keempat galur L. plantarum
menunjukkan jenis protein yang hidrofobik karena posisi endapan protein yang
terpresipitasi berada melayang di bagian atas supernatan bebas sel. Abo-Amer (2007)
menyatakan hal ini sebagai karakteristik protein yang hidrofobik terhadap plantaricin
AA135 yang dihasilkan oleh L. plantarum AA135. Karakteristik protein hidrofobik
dari ekstrak plantaricin kasar sangat diperlukan untuk aktivitasnya dalam
menghambat bakteri karena penghambatan oleh plantaricin tergantung pada interaksi
hidrofobik antara sel-sel bakteri dengan molekul-molekul plantaricin (Parada et al.,
2007). Lebih lanjut Jack et al. (2005) menyatakan bahwa interaksi antara
molekul-molekul kationik dari plantaricin dengan polimer-polimer anionik di permukaan sel
26
berupa peningkatan permeabilitas membran sehingga mengganggu keseimbangan
barier dan akan mengakibatkan kematian sel bakteri.
Galur L. plantarum
Keterangan: Presipitat Bakteriosin = Hasil Purifikasi Parsial dengan Amonium Sulfat
Plantaricin Kasar = Hasil Dialisis
Plantaricin = Hasil Purifikasi Parsial dengan Kromatografi Kolom
Gambar 3. Konsentrasi Protein pada Tahap Purifikasi Parsial Plantaricin asal Galur
L. plantarum (1A5, 1B1, 2B2, dan 2C12).
Kadar protein plantaricin meningkat kembali setelah proses purifikasi
menggunakan kromatografi kolom dari plantaricin kasar menjadi plantaricin murni,
kecuali galur L. plantarum 1A5. Rataan konsentrasi protein plantaricin murni dari
yang terbesar berturut-turut adalah galur L. plantarum 1B1, 2B2, 1A5 dan 2C12.
Stabilitas Protein Plantaricin terhadap pH Alkali
Pengujian stabilitas plantaricin dari keempat galur L. plantarum terhadap pH
alkali secara in vitro dilakukan pada pH 9, menunjukkan tingkat kesensitifan yang
tinggi pada plantaricin yang diproduksi oleh keempat galur L. plantarum. Hubungan
antara kondisi pH lingkungan dengan konsentrasi protein plantaricin dari keempat
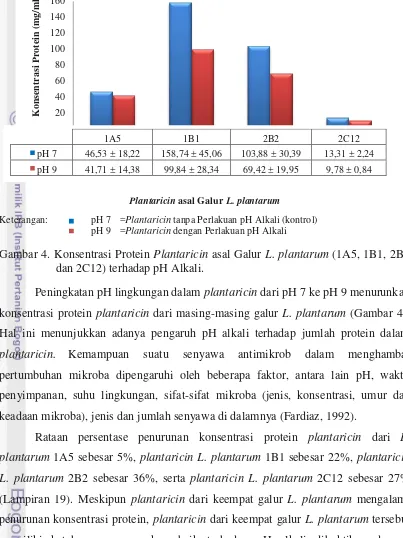
galur L. plantarum, dapat dilihat pada Gambar 4.
27 Plantaricin asal Galur L. plantarum
Keterangan: pH 7 =Plantaricin tanpa Perlakuan pH Alkali (kontrol) pH 9 =Plantaricin dengan Perlakuan pH Alkali
Gambar 4. Konsentrasi Protein Plantaricin asal Galur L. plantarum (1A5, 1B1, 2B2 dan 2C12) terhadap pH Alkali.
Peningkatan pH lingkungan dalam plantaricin dari pH 7 ke pH 9 menurunkan
konsentrasi protein plantaricin dari masing-masing galur L. plantarum (Gambar 4).
Hal ini menunjukkan adanya pengaruh pH alkali terhadap jumlah protein dalam
plantaricin. Kemampuan suatu senyawa antimikrob dalam menghambat
pertumbuhan mikroba dipengaruhi oleh beberapa faktor, antara lain pH, waktu
penyimpanan, suhu lingkungan, sifat-sifat mikroba (jenis, konsentrasi, umur dan
keadaan mikroba), jenis dan jumlah senyawa di dalamnya (Fardiaz, 1992).
Rataan persentase penurunan konsentrasi protein plantaricin dari L.
plantarum 1A5 sebesar 5%, plantaricin L. plantarum 1B1 sebesar 22%, plantaricin
L. plantarum 2B2 sebesar 36%, serta plantaricin L. plantarum 2C12 sebesar 27%
(Lampiran 19). Meskipun plantaricin dari keempat galur L. plantarum mengalami
penurunan konsentrasi protein, plantaricin dari keempat galur L. plantarum tersebut
memiliki ketahanan yang cukup baik terhadap pH alkali dibuktikan dengan
persentase penurunan protein sebesar <40%.
Hasil penelitian ini menunjukan adanya pengaruh pH alkali terhadap
plantaricin dari keempat galur L. plantarum. Gonzales et al. (1994) menyatakan hal
serupa, bahwa plantaricin C menghasilkan bakteriosin yang stabil pada pH asam dan
pH netral, namun aktivitas antimikrob plantaricin C menurun pada kondisi pH alkali.
28
Kondisi alkali dapat menginduksi solubilitas dari lapisan protein (Duncan et al.,
1972). Hal ini memperkuat dugaan bahwa plantaricin dari keempat galur L.
plantarum merupakan komponen antimikrob berbahan protein, yang bila dalam
kondisi alkali akan terhidrolisis, sehingga menyebabkan penurunan aktivitas
antimikrob dalam menghambat bakteri patogen.
Penelitian ini selain mengetahui stabilitas protein plantaricin terhadap pH
alkali, juga diamati uji antagonistik plantaricin terhadap bakteri indikator melalui uji
difusi sumur. Hasil uji antagonistik plantaricin asal galur L. plantarum terhadap
masing-masing bakteri indikator ditunjukkan dengan adanya diameter zona hambat.
Uji Aktivitas Antimikrob Plantaricin pada Bakteri Indikator Terhadap pH Alkali
Escherichia coli ATCC 25922
Stabilitas aktivitas antimikrob plantaricin setelah perlakuan pH alkali
terhadap E. coli ATCC 25922, dapat dilihat pada Tabel 9. Stabilitas aktivitas
antimikrob plantaricin tidak dipengaruhi oleh interaksi antara perlakuan pH yang
berbeda dan galur L. plantarum yang berbeda. Hasil ini menunjukkan bahwa
plantaricin memiliki aktivitas penghambatan terhadap E. coli ATCC 25922 yang
sama tanpa dipengaruhi oleh pH yang berbeda dan galur L. plantarum yang berbeda.
Tabel 9. Diameter Zona Hambat Aktivitas Antimikrob Plantaricin asal Galur L. plantarum pada pH Alkali terhadap E. coli ATCC 25922
Perlakuan Plantaricin Asal Galur L. plantarum Rata-rata
1A5 1B1 2B2 2C12
--- (mm) ---
pH 7* 9,43 ± 1,53 9,72 ± 0,22 9,52 ± 2,17 8,16 ± 0,23 9,21 ± 1,04
pH 9 9,17 ± 0,52 8,52 ± 0,51 9,08 ± 0,63 7,84 ± 0,30 8,65 ± 0,49
Rata-rata 9,30 ± 1,03 9,12 ± 0,37 9,30 ± 1,40 8,00 ± 0,27
Keterangan: Diameter lubang sumur ± 5 mm (termasuk ke dalam zona hambat) * = Kontrol
Rata-rata zona hambat aktivitas antimikrob plantaricin asal empat galur L.
plantarum 1A5, 1B1, 2B2 dan 2C12 berkisar 8,00-9,30 mm. Rataan diameter zona
hambat tersebut termasuk dalam kategori sedang (Davis dan Stout, 1971). E. coli
termasuk bakteri Gram negatif dengan pH pertumbuhan optimum pada 7,0-7,5
29 plantarum terhadap E. coli ATCC 25922disebabkan oleh pH lingkungan yang tidak
sesuai bagi pertumbuhan E. coli ATCC 25922. Yohannes et al. (2005) menyatakan
bahwa membran luar dari E. coli, pertumbuhannya menurun pada lingkungan alkali.
Salmonella typhimurium ATCC 14028
Stabilitas aktivitas antimikrob plantaricin asal empat galur L. plantarum pada
pH alkali terhadap S. typhimurium ATCC 14028, disajikan pada Tabel 10. Hasil
pengamatan menunjukkan bahwa rataan diameter zona hambat tidak dipengaruhi
oleh adanya interaksi antara perlakuan pH alkali dan galur L. plantarum. Perlakuan
pH yang berbeda berpengaruh nyata (P<0,05) terhadap diameter zona hambat. Hal
ini menunjukkan bahwa stabilitas aktivitas antimikrob plantaricin menurun akibat
pengaruh pH alkali.
Tabel 10. Diameter Zona Hambat Aktivitas Antimikrob Plantaricin asal Galur L. plantarum pada pH Alkali terhadap S. typhimurium ATCC 14028
Perlakuan Plantaricin Asal Galur L. plantarum Rata-rata
1A5 1B1 2B2 2C12
--- (mm) ---
pH 7* 9,40 ± 1,11 8,98 ± 1,07 8,82 ± 1,12 8,91 ± 0,55 9,03 ± 0,96a
pH 9 8,47 ± 0,66 8,52 ± 0,67 8,11 ± 1,00 8,22 ± 0,48 8,33 ± 0,70b
Rata-rata 8,94 ± 0,89 8,75 ± 0,87 8,47 ± 1,06 8,57 ± 0,52
Keterangan: Superskrip yang berbeda pada kolom yang sama menunjukkan nyata (P<0,05) Diameter lubang sumur ± 5 mm (termasuk ke dalam zona hambat)
* = Kontrol
Rata-rata zona hambat aktivitas antimikrob plantaricin asal galur L.
plantarum terhadap pH yang berbeda berkisar 8,33-9,03 mm. Rataan diameter zona
hambat tersebut termasuk dalam kategori sedang (Davis dan Stout, 2004).
Plantaricin dari keempat galur L. plantarum masih dapat menghambat S.
typhimurium ATCC 14028 dari strain bakteri Gram negatif meskipun dengan
aktivitas antimikrob plantaricin yang menurun. Portillo (2000) menyatakan bahwa
Salmonella sp. merupakan bakteri Gram negatif dan pH pertumbuhan optimum pada
6,5-7,5. Aktivitas penghambatan plantaricin dari keempat galur L. plantarum
terhadap S. typhimurium ATCC 14028 disebabkan oleh pH lingkungan yang tidak
sesuai bagi pertumbuhan S. typhimurium ATCC 14028. Lebih lanjut Ogunbanwo et
30
dapat menghambat bakteri Gram negatif seperti S. typhimurium. Aktivitas
penghambatan plantaricin terhadap S. typhimurium ATCC 14028, dapat dilihat pada
Gambar 5.
(A) (B)
Keterangan: A = pH 7 (Kontrol) B = pH 9 (Alkali)
Gambar 5. Zona Hambat Plantaricin asal Galur L. plantarum 1A5 terhadap S. typhimurium ATCC 14028: (A) L. plantarum 1A5 pada pH 7 (kontrol) dan (B) L. plantarum 1A5 pada pH 7 (alkali).
Pseudomonas aeruginosa ATCC 27853
Stabilitas aktivitas antimikrob plantaricin dari keempat galur L. plantarum
setelah perlakuan pH alkali terhadap P. aeruginosa ATCC 27853, dapat dilihat pada
Tabel 11. Analisis ragam menunjukkan bahwa aktivitas antimikrob plantaricin
terhadap P. aeruginosa ATCC 27853 tidak dipengaruhi oleh interaksi antara galur L.
plantarum dengan perlakuan pH. Stabilitas aktivitas antimikrob plantaricin terhadap
P. aeruginosa ATCC 27853, sangat nyata (P<0,01) dipengaruhi oleh galur L.
plantarum.
Tabel 11. Diameter Zona Hambat Aktivitas Antimikrob Plantaricin asal Galur L. plantarum pada pH Alkali terhadap P. aeruginosa ATCC 27853
Perlakuan Plantaricin Asal Galur L. plantarum Rata-rata
1A5 1B1 2B2 2C12
--- (mm) ---
pH 7* 9,03 ± 1,70 9,10 ± 1,55 8,37 ± 1,09 16,42 ± 4,46 10,37 ± 2,20
pH 9 8,16 ± 0,33 8,47 ± 0,93 8,39 ± 0,67 15,25 ± 4,33 10,07 ± 1,57
Rata-rata 8,60 ± 1,02B 8,79 ± 1,24AB 8,38 ± 0,88B 15,84 ± 4,40A
Keterangan: Superskrip yang berbeda pada baris yang sama menunjukkan nyata (P<0,01) Diameter lubang sumur ± 5 mm (termasuk ke dalam zona hambat)
* = Kontrol
31
Rata-rata zona hambat aktivitas antimikrob plantaricin asal empat galur L.
plantarum 1A5, 1B1, 2B2 dan 2C12 berkisar 8,38-15,84 mm. Rataan diameter zona
hambat tersebut termasuk dalam kategori kuat (Davis dan Stout, 1971). Interaksi
antara pH dengan galur L. plantarum yang berbeda tidak mempengaruhi aktivitas
plantaricin terhadap P. aeruginosa ATCC 27853. Hal ini menunjukkan bahwa
plantaricin dari keempat galur L. plantarum terhadap P. aeruginosa ATCC 27853
mempunyai aktivitas penghambatan yang tidak berbeda. Hasil uji lanjut
menunjukkan bahwa galur L. plantarum 2C12 menghasilkan rataan diameter zona
hambat yang berbeda nyata (P<0,01) terhadap P. aeruginosa ATCC 27853 dengan
galur L. plantarum lainnya. Namun, galur L. plantarum 2C12 menunjukkan aktivitas
yang tidak berbeda nyata dengan galur L. plantarum 1B1 (P<0,01).
P. aeruginosa merupakan opportunistic pathogen, artinya bakteri ini akan
menyerang kekebalan dari inangnya dan menyebabkan infeksi (Todar, 2009). Selain
itu, kemampuan dari P. aeruginosa dalam memproduksi enzim yang dapat memecah
komponen lemak dan protein (Buckle et al., 2007).
Staphylococcus aureus ATCC 25923
Stabilitas aktivitas antimikrob plantaricin setelah perlakuan pH alkali
terhadap S. aureus ATCC 25923, dapat dilihat pada Tabel 12. Stabilitas aktivitas
antimikrob plantaricin tidak dipengaruhi oleh interaksi antara perlakuan pH yang
berbeda dan galur L. plantarum yang berbeda. Hasil ini menunjukkan bahwa
plantaricin memiliki aktivitas penghambatan terhadap S. aureus ATCC 25923 yang
sama tanpa dipengaruhi oleh pH yang berbeda dan galur L. plantarum yang berbeda.
Tabel 12. Diameter Zona Hambat Aktivitas Antimikrob Plantaricin asal Galur L. plantarum pada pH Alkali terhadap S. aureus ATCC 25923
Perlakuan Plantaricin Asal Galur L. plantarum Rata-rata
1A5 1B1 2B2 2C12
--- (mm) ---
pH 7* 8,51 ± 0,35 8,50 ± 0,64 8,65 ± 0,85 11,96 ± 1,58 9,41 ± 0,86
pH 9 8,54 ± 0,61 8,57 ± 0,74 8,23 ± 0,63 9,31 ± 1,49 8,66 ± 0,87
Rata-rata 8,53 ± 0,48 8,54 ± 0,69 8,44 ± 0,74 10,64 ± 1,54 Keterangan: Diameter lubang sumur ± 5 mm (termasuk ke dalam zona hambat)
32
Rata-rata zona hambat aktivitas antimikrob plantaricin asal empat galur L.
plantarum 1A5, 1B1, 2B2 dan 2C12 berkisar 8,44-10,64 mm. Rataan diameter zona
hambat tersebut termasuk dalam kategori sedang (Davis dan Stout, 1971). Stabilitas
aktivitas antimikrob plantaricin stabil setelah perlakuan pH alkali terhadap S. aureus
ATCC 25923. S. aureus termasuk bakteri Gram positif, tumbuh pada pH 4,0-9,8
dengan pH optimum pertumbuhan pada 7,0-7,8 (Ray dan Bhunia, 2008). Hsieh et al.
(1998) menyatakan bahwa terjadinya peningkatan besar dalam sensitivitas S. aureus
terhadap kation dan aktivitas antimikrob pada kondisi pH alkali.
Bacillus cereus
Stabilitas aktivitas antimikrob plantaricin setelah perlakuan pH alkali
terhadap B. cereus, dapat dilihat pada Tabel 13. Stabilitas aktivitas antimikrob
plantaricin tidak dipengaruhi oleh interaksi antara perlakuan pH yang berbeda dan
galur L. plantarum yang berbeda. Hasil ini menunjukkan bahwa plantaricin memiliki
aktivitas penghambatan yang sama tanpa dipengaruhi oleh pH yang berbeda dan
galur L. plantarum yang berbeda.
Tabel 13. Diameter Zona Hambat Aktivitas Antimikrob Plantaricin asal Galur L. plantarum pada pH Alkali terhadap B. cereus
Perlakuan Plantaricin Asal Galur L. plantarum Rata-rata
1A5 1B1 2B2 2C12
--- (mm) ---
pH 7* 8,92 ± 1,14 9,10 ± 0,77 8,86 ± 0,90 8,57 ± 0,59 8,86 ± 0,85
pH 9 8,45 ± 0,58 8,89 ± 0,61 8,97 ± 0,97 9,15 ± 1,02 8,87 ± 0,80
Rata-rata 8,69 ± 0,86 9,00 ± 0,69 8,92 ± 0,94 8,86 ± 0,81
Keterangan: Diameter lubang sumur ± 5 mm (termasuk ke dalam zona hambat) * = Kontrol
Rata-rata zona hambat aktivitas antimikrob plantaricin asal empat galur L.
plantarum berkisar 8,69-9,00 mm. Rataan diameter zona hambat tersebut termasuk
dalam kategori sedang (Davis dan Stout, 1971). Torkar dan Matijasi (2003)
menyatakan bahwa B. cereus stabil pada pH 3 hingga pH 10. Lebih lanjut, Padan et
al. (2005) dalam penelitiannya menyatakan bahwa perubahan asam teikoat
berkontribusi pada spesies Bacillus sp. pada pH alkali. Gonzales et al. (1994) juga
menyatakan bahwa plantaricin C dapat menghambat pertumbuhan sel vegetatif B.
33 Plantaricin yang dihasilkan oleh keempat galur L. plantarum mampu
menghambat bakteri Gram positif dan bakteri Gram negatif, serta stabil terhadap
perlakuan pH alkali namun aktivitas antimikrob plantaricin menurun akibat
perlakuan pH alkali terhadap S. typhimurium. Hal ini sesuai dengan penelitian Gong
et al. (2010) yang menyatakan bahwa plantaricin MG dari L. plantarum
KLDS1.0391 menghasilkan senyawa antimikrob yang stabil pada pH 2 hingga pH 10
serta mampu menghambat bakteri Gram positif dan bakteri Gram negatif (E. coli,
Pseudomonas sp., Salmonella sp.) dengan nilai aktivitas penghambatan terbesar
terhadap E. coli dan S. typhimurium namun tidak terhadap Lactobacillus sp.
Karakteristik stabilitas dan aktivitas antimikrob plantaricin terhadap pH alkali
menunjukkan potensi plantaricin untuk dapat digunakan sebagai biopreservatif