PRODUKSI KOLAGENASE DARI ISOLAT Bacillus
licheniformis F-11.1 DAN F-11.4
CINDY THERESIA OCTIVIANTI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
CINDY THERESIA OCTIVIANTI. Produksi Kolagenase dari Isolat Bacillus licheniformis F-11.1 dan F-11.4. Dibimbing oleh SRI BUDIARTI dan MAGGY THENAWIDJAJA SUHARTONO. Hidrolisis enzimatik dengan kolagenase berperan meningkatkan nutrisi dan fungsional protein pangan. Penelitian ini bertujuan untuk memproduksi kolagenase dari Bacillus licheniformis F-11.1 dan F-11.4. Isolat B. licheniformis F-11.1 dan F-11.4 ditumbuhkan pada tiga macam media produksi, yaitu media Luria Bertani (LB) yang mengandung 5% kolagen (LBC), media LB 50% dengan 5% kolagen (LBHC), dan 5% kolagen (CLG). Aktivitas kolagenase, kadar protein, dan turbiditas sel B. licheniformis F-11.1 dan F-11.4 diukur setiap selang waktu 5 jam selama 50 jam waktu inkubasi. Hasil menunjukkan bahwa produksi kolagenase tertinggi isolat B. licheniformis F-11.1 dicapai pada media LBC dan LBHC dengan aktivitas spesifik masing-masing sebesar 2,057 U/mg dan 2,037 U/mg. Produksi kolagenase tertinggi isolat B. licheniformis F-11.4 dicapai pada media LBC dengan aktivitas spesifik sebesar 4,695 U/mg. Isolat F-11.4 pada media LBHC memiliki aktivitas spesifik tertinggi sebesar 2,811 U/mg. Media CLG memberikan aktivitas spesifik tertinggi untuk B. licheniformis F-11.1 dan F-11.4 masing-masing sebesar 0,807 U/mg dan 0,306 U/mg. Dari ketiga media percobaan disimpulkan bahwa media LBC dan LBHC merupakan media terbaik untuk produksi kolagenase B. licheniformis F-11.1 dan F-11.4.
Kata kunci: produksi, kolagenase, Bacillus licheniformis
ABSTRACT
CINDY THERESIA OCTIVIANTI. Collagenase Production of Bacillus licheniformis isolate F-11.1 and F-11.4. Supervised by SRI BUDIARTI and MAGGY THENAWIDJAJA SUHARTONO. Hydrolysis by collagenase enzyme could increase nutrition and function of food proteins. This research was conducted to produce collagenase enzyme from Bacillus licheniformis 11.1 and F-11.4. B. licheniformis isolate F-11.1 and F-11.4 were cultured in three types of production media, which is Luria Bertani (LB) media consisted of 5% collagen (LBC), 50% LB media consisted of 5% collagen (LBHC), and 5% collagen (CLG). The activity of collagenase, protein content, and cell turbidity of B. licheniformis F-11.1 and F-11.4 were measured every 5 hours during 50 hours incubation. The result showed that optimum collagenase production of B. licheniformis isolate F-11.1 was reached in LBC and LBHC media with activity of 2,057 U/mg and 2,037 U/mg, respectively. Optimum collagenase production of B. licheniformis isolate F-11.4 was reached in LBC media with activity of 4,695 U/mg. Isolate F-11.4 in LBHC media possesed the optimum collagenase activity of 2,811 U/mg. CLG media gave optimum collagenase activity of B. licheniformis F-11.1 and F-11.4 at 0,807 U/mg and 0,306 U/mg respectively. These research concluded that LBC and LBHC media was the best choice for collagenase production of B. licheniformis F-11.1 and F-11.4.
PRODUKSI KOLAGENASE DARI ISOLAT Bacillus
licheniformis F-11.1 DAN F-11.4
CINDY THERESIA OCTIVIANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Produksi Kolagenase dari Isolat
Bacillus licheniformis
F-11.1 dan
F-11.4
Nama
: Cindy Theresia Octivianti
NIM
: G34080121
Disetujui,
Pembimbing I,
Pembimbing II,
Dr. dr. Sri Budiarti
Prof. Dr. Ir. Maggy Thenawidjaja Suhartono
NIP. 195813081993032001
NIP. 195305071977012001
Diketahui,
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP. 196410021989031002
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas karunia-Nya sehingga laporan skripsi yang berjudul “Produksi Kolagenase dari Isolat Bacillus licheniformis F-11.1 dan F-11.4” dapat diselesaikan tepat pada waktunya. Penelitian ini dilaksanakan pada bulan Desember 2011 hingga Mei 2012, bertempat di Laboratorium Mikrobiologi dan Biokimia Pusat Pengembangan Sumberdaya Hayati dan Bioteknologi (PPSHB), Laboratorium Mikrobiologi dan Laboratorium Mikologi, Departemen Biologi, FMIPA, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr. dr. Sri Budiarti dan Ibu Prof. Dr. Ir. Maggy Thenawidjaja Suhartono selaku pembimbing yang telah memberikan bimbingan, saran, dan motivasi selama pelaksanaan penelitian hingga penulisan karya ilmiah ini. Terima kasih kepada Prof. Dr. Ir. Maggy Thenawidjaja Suhartono yang telah memberikan dana penelitian. Ucapan terima kasih juga penulis sampaikan kepada Dr. Yohana Caecilia Sulistyaningsih, M.Si selaku dosen penguji wakil komisi pendidikan yang telah bersedia menguji dan memberikan saran saat ujian dan penulisan karya ilmiah.
Penulis mengucapkan terima kasih kepada kepala Pusat Pengembangan Sumberdaya Hayati dan Bioteknologi (PPSHB)-IPB beserta seluruh staf Laboratorium Mikrobiologi dan Biokimia atas sarana, prasarana, dan bantuan selama penulis melakukan penelitian. Terima kasih penulis ucapkan pula kepada staf pengajar Bagian Mikrobiologi dan seluruh staf pengajar di Departemen Biologi IPB yang telah memberikan saran dan bantuan atas terselesaikannya karya ilmiah ini.
Penulis juga menyampaikan ungkapan terima kasih kepada Mama, Papa, Adik, Rezki Ariefianto, serta seluruh keluarga atas doa, kasih sayang, pengertian, dan dukungannya. Terima kasih pula penulis ucapkan kepada ibu Ika, pak Ace, ibu Diana, pak Pras, pak Jaka, kak Wenny, Isna, Olin, Goki, dan Malibu Crew yang selalu membantu selama penulis bekerja di laboratorium dan senantiasa memberi semangat. Penulis juga mengucapkan terima kasih kepada teman-teman di Laboratorium Mikrobiologi dan rekan-rekan “Biologi 45” atas bantuan dan dukungannya, serta seluruh pihak yang tidak dapat disebutkan satu persatu atas doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat, bagi penulis maupun pembaca.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Semarang pada tanggal 20 Oktober 1990 dari pasangan ayah Anthony Bernard Simanjuntak dan ibu Siti Zulfiah. Penulis merupakan anak pertama dari dua bersaudara.
Penulis menyelesaikan pendidikan di SMA Marsudirini Sedes Sapientiae Semarang pada tahun 2008. Pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama masa perkuliahan penulis menerima Beasiswa BBM (Bantuan Belajar Mahasiswa). Penulis juga berpartisipasi dalam kegiatan yang diselenggarakan HIMABIO seperti Biology on Experiment (2010) dan Grand Biodiversity dan Temu Alumni (2011). Pada tahun 2010, penulis melaksanakan studi lapangan di Taman Wisata Alam dan Cagar Alam Pangandaran dengan judul
laporan “Bakteri Penghasil Agarase yang Berasosiasi dengan Alga” di bawah bimbingan Ibu Prof. Dr. Anja Meryandini. Pada tahun 2011, penulis melaksanakan praktik lapangan di PT Nyonya
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ...viii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 2
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 2
Bahan ... 2
Metode ... 2
Penyiapan Kolagen Sebagai Substrat dan Media Pertumbuhan ... 2
Peremajaan Isolat dan Pembuatan Inokulum ... 2
Pengamatan Laju Pertumbuhan Sel dan Produksi Kolagenase ... 2
Uji Aktivitas Kolagenase dan Penentuan Kadar Protein ... 2
HASIL Laju Pertumbuhan Sel dan Produksi Kolagenase ... 3
Perbandingan Aktivitas Kolagenase Terbaik B. licheniformis F-11.1 dan F-11.4 pada Media LBC, LBHC, dan CLG... 4
PEMBAHASAN ... 5
SIMPULAN ... 6
SARAN ... 6
DAFTAR PUSTAKA ... 6
DAFTAR TABEL
Halaman
1 Aktivitas kolagenase terbaik isolat F-11.1 dan F-11.4 pada tiga media produksi ... 4
DAFTAR GAMBAR
Halaman
1 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.1 pada
media LBC ... 3
2 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.1 pada
media LBHC ... 3
3 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.1 pada
media CLG ... 3
4 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.4 pada
media LBC ... 4
5 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.4 pada
media LBHC ... 4
6 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.4 pada
media CLG ... 4
DAFTAR LAMPIRAN
Halaman
1 Metode pengukuran aktivitas kolagenase menurut Moore & Stein (1954) ... 10
2 Metode pengukuran kadar protein (Bradford 1976) ... 11
PENDAHULUAN
Latar Belakang
Enzim merupakan molekul polimer yang dihasilkan oleh semua sel hidup dan memiliki peranan penting sebagai biokatalisator pada reaksi biokimia. Spesifitas, efisiensi, dan kerja yang selektif membuat industri enzim berkembang pesat dan menempati posisi penting dalam dunia industri. Protease merupakan salah satu enzim komersial yang telah digunakan secara luas dalam bidang industri. Berdasarkan aktivitasnya, protease dibedakan menjadi proteinase (endopeptidase) yang menghidrolisis molekul protein menjadi polipeptida dan peptidase (eksopeptidase) yang menghidrolisis polipeptida menjadi asam amino (Rao et al. 1998).
Salah satu enzim golongan protease ialah kolagenase. Kolagenase adalah endopeptidase yang mampu mendegradasi ikatan polipeptida kolagen (Kim et al. 2002). Kolagen merupakan protein berbentuk serabut penyusun tubuh makhluk hidup. Protein ini merupakan struktur utama pada kulit dan tulang hewan (Bama et al. 2010). Kolagen terdiri atas tiga rantai polipeptida yang berulang dan mengandung lebih dari 1000 residu asam amino. Asam amino yang terkandung dalam kolagen antara lain, 35% glisin, 11% alanin, serta 21% prolin dan hidroksiprolin (Lehninger 1993).
Konformasi triple helix pada kolagen menyebabkan protein ini resisten terhadap sebagian besar proteinase. Namun, kolagenase mampu memecah tripolipeptida ini. Pada penelitian Chung et al. (2004), kolagenase bekerja efektif dan dapat memecah protein kolagen pada suhu tubuh 37oC. Menurut Sternlicht & Werb (2001), degradasi makromolekul kolagen oleh kolagenase berperan dalam proses biologis pada tubuh manusia seperti, embriogenesis, morfogenesis organ, dan perbaikan jaringan.
Kolagen telah banyak diekstraksi dari berbagai jenis ikan dan kulit hewan mamalia seperti sapi. Jenis ikan yang telah dilaporkan sebagai penghasil kolagen antara lain, ikan sardin (Sardinops melanosticus), ikan red sea bream (Pagrus major), dan ikan japanese sea bass (Lateobrax japonicus). Kulit, tulang, dan sisik merupakan bagian yang berpotensi sebagai sumber kolagen (Nagai et al. 2004). Pemanfaatan kolagen dari kulit ikan mempunyai resiko lebih rendah terkontaminasi patogen seperti bovine spongiform enchepalopathy (BSE) daripada kolagen dari kulit sapi. Selain itu, kolagen dari
kulit ikan juga relatif mudah diekstraksi dan memberikan hasil yang lebih tinggi dibandingkan kolagen dari kulit sapi (Yunoki et al. 2003).
Kolagenase dapat digunakan dalam proses pelunakan daging dan hidrolisis protein. Hultmann & Rustad (2004) melaporkan bahwa kolagenase endogen pada ikan salmon mampu memisahkan ikatan antara serat-serat daging dengan mycotoma sehingga daging ikan menjadi lunak. Hidrolisis protein secara enzimatik dapat meningkatkan kualitas protein. Proses hidrolisis yang sempurna dapat menghasilkan hidrolisat yang terdiri atas campuran 18-20 macam asam amino. Pada penelitian Kumaila (2008), hidrolisis protein kerang hijau dengan kolagenase menghasilkan
kadar α-amino nitrogen bebas sebesar 0,184 g/100 g. Enzim kolagenase juga berperan dalam proses penyembuhan luka (Riley & Herman 2005) dan perbaikan jaringan pada peradangan (Chung et al. 2004).
Kolagenase dihasilkan oleh beberapa mikroorganisme seperti, Streptomyces sp. strain 3B (Petrova et al. 2006), Clostridium hystolyticum (Bond & Wart 1984), Bacillus subtilis FS-2 (Nagano & To 1999), Bacillus subtilis CN2 (Tran & Nagano 2002), Vibrio alginolyticus (Reid et al. 1980), Achromobacter iophagus (Reid et al. 1978), Klebsiella pneumoniae CNL3, dan Bacillus cereus CNA1 (Suphatharaprateep et al. 2011). Kolagenase dilaporkan juga ditemukan di organ dalam ikan makarel (Park et al. 2002) dan organ dalam ikan filefish (Kim et al. 2002).
Sumber kolagenase yang digunakan dalam penelitian ini ialah Bacillus licheniformis F-11. Pada penelitian yang dilakukan Waldeck et al (2006), bakteri ini termasuk termofil dan digunakan untuk deproteinasi kulit udang pada produksi kitin dengan suhu optimum 55oC. Waldeck et al (2006) melaporkan bahwa bakteri ini dapat menggunakan kolagen sebagai substrat pertumbuhan.
Bacillus licheniformis F-11 yang digunakan dalam penelitian ini telah mengalami perlakuan mutagenik pada operon PGA (Asam Poliglutamat) dan Kitinase-AB menjadi strain F-11.1 dan F-11.4 (Hoffmann et al. 2010). Kedua strain tersebut berpotensi menghasilkan kolagenase karena kemampuan B. licheniformis F-11 menggunakan kolagen sebagai substrat. Baehaki et al. (2012) melaporkan bahwa kedua strain ini merupakan penghasil kolagenase.
2
gizinya yang tinggi. Hidrolisis secara enzimatik berperan meningkatkan nutrisi dan fungsional protein pangan (Suhartono 1989). Hidrolisat protein, khususnya dari ikan telah dilaporkan bersifat antioksidatif (Shahidi et al. 1995). Produksi enzim kolagenase diharapkan dapat meningkatkan nilai tambah limbah hasil perikanan untuk digunakan dalam proses hidrolisis protein khususnya kolagen.
Tujuan
Penelitian ini bertujuan untuk memproduksi kolagenase dari Bacillus licheniformis F-11.1 dan F-11.4.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2011 sampai Mei 2012 bertempat di Laboratorium Mikrobiologi dan Biokimia Pusat Pengembangan Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB, Laboratorium Mikrobiologi, dan Laboratorium Mikologi, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan yang digunakan dalam penelitian ini ialah isolat Bacillus licheniformis F-11.1 dan F-11.4 yang merupakan koleksi dari Laboratorium Mikrobiologi dan Biokimia Pusat Pengembangan Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB.
Metode
Penyiapan Kolagen Sebagai Substrat dan Media Pertumbuhan
Pembuatan substrat kolagen menggunakan metode Yuniarti (2010). Substrat kolagen yang digunakan berasal dari kulit ikan bandeng yang diperoleh dari pasar tradisional. Kulit ikan bandeng dibersihkan dari sisa daging, lemak, dan kotoran lainnya. Kulit kemudian dipotong sebesar 3x3 cm dan direndam dalam asam asetat 1,5% selama 24 jam dengan perbandingan (b/v) sebesar 1:2. Selanjutnya, kulit dicuci dengan akuades hingga pHnya mendekati netral (pH 7). Kulit yang telah mengembang diekstraksi menggunakan akuades dengan perbandingan (b/v) sebesar 2:1. Ekstraksi dilakukan selama 3 jam pada suhu 40oC. Hasil ekstraksi disaring dengan kertas saring menjadi larutan kolagen.
Peremajaan Isolat dan Pembuatan
Inokulum
Biakan bakteri disimpan dan diremajakan pada media agar-agar miring Luria Bertani
(LB). Inkubasi dilakukan selama 24 jam pada suhu 50oC untuk isolat B. licheniformis F-11.1 dan 40oC untuk isolat F-11.4. Sebanyak 2 lup isolat F-11.1 dan F-11.4 masing-masing ditumbuhkan pada 75 ml media kaldu LB sebagai inokulum. Inokulum diinkubasi dengan kecepatan 110 rpm selama 24 jam pada suhu 50oC untuk isolat F-11.1 dan 40oC untuk isolat F-11.4.
Pengamatan Laju Pertumbuhan Sel dan Produksi Kolagenase
Sebanyak 10% inokulum (OD= 0,8 pada
λ= 620 nm) dimasukkan ke dalam erlenmeyer yang berisi 200 ml media produksi dan diinkubasi dengan kecepatan 110 rpm. Produksi kolagenase dilakukan pada suhu 50oC untuk isolat F-11.1 dan 40oC untuk isolat F-11.4. Media produksi yang digunakan antara lain, LB + 5% kolagen (LBC), LB 50% + kolagen 5% (LBHC), dan 5% kolagen (CLG). Turbiditas sel diukur pada panjang gelombang 620 nm dengan spektrofotometer (Genesys 20) setiap selang waktu 5 jam selama 50 jam. Pada masing-masing waktu pengamatan diukur aktivitas enzim dan kadar proteinnya.
Ekstraksi kolagenase dilakukan dengan cara sentrifugasi media pertumbuhan bakteri dengan alat Tomy MRX-152 dengan kecepatan 4000 rpm suhu 4oC selama 20 menit. Supernatan yang mengandung ekstrak kasar enzim dipisahkan dari endapannya dan diuji aktivitasnya serta kadar protein.
Uji Aktivitas Kolagenase dan Penentuan Kadar Protein
3
akuades, sementara standar menggunakan L-leusin 5mM. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang menghasilkan 1 μmol leusin per menit. Aktivitas spesifik kolagenase (U/mg) merupakan nisbah aktivitas kolagenase (U/ml) terhadap kadar protein (mg/ml).
Penentuan kadar protein menggunakan metode Bradford (1976) (Lampiran 2). Sebanyak 100 µl enzim direaksikan dengan 5 ml larutan Bradford dan dikocok kuat. Larutan diinkubasi selama 10 menit pada suhu ruang dan dibaca pada panjang gelombang 595 nm sebagai sampel. Bovin Serum Albumin (BSA) digunakan sebagai standar dengan konsentrasi 0-0,5 mg/ml (Lampiran 3). Blanko menggunakan 100 µl akuades dicampur dengan 5 ml pereaksi Bradford, lalu dikocok dan diukur absorbansinya pada panjang gelombang 595 nm. Pengukuran kadar protein dan uji aktivitas enzim kolagenase masing-masing dilakukan dengan tiga kali ulangan.
HASIL
Laju Pertumbuhan Sel dan Produksi Kolagenase
Produksi kolagenase optimum selama pertumbuhan diketahui dari kurva pertumbuhan dan aktivitas spesifik enzim. Pengamatan pertumbuhan bakteri menggunakan metode turbidimetrik. Bakteri yang tumbuh akan menghasilkan pertambahan jumlah sel sehingga kurva pertumbuhannya dapat dibuat berdasarkan kekeruhan sel dalam media. B. licheniformis isolat 11.1 dan F-11.4 yang ditumbuhkan pada tiga macam media yaitu, LBC, LBHC, dan CLG menghasilkan aktivitas kolagenolitik yang berbeda pada 50 jam waktu inkubasi.
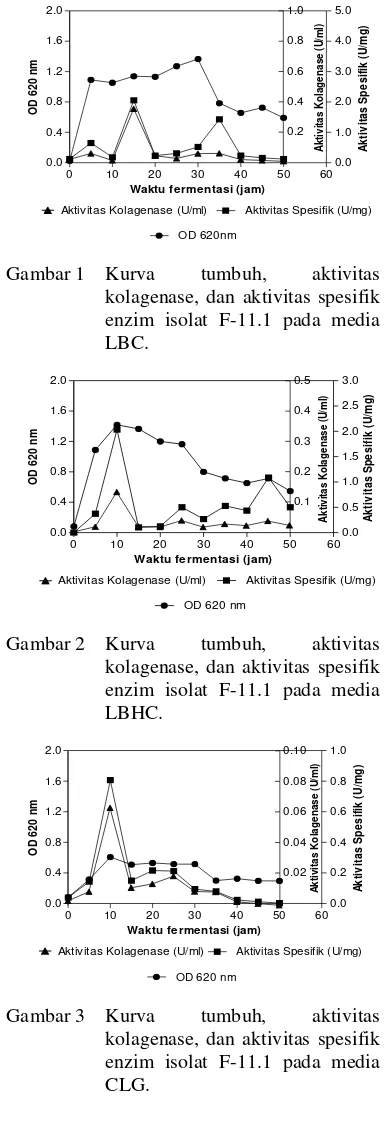
Pertumbuhan isolat F-11.1 pada media LBC menunjukkan bahwa selama waktu inkubasi 50 jam terjadi peningkatan jumlah sel dari jam ke-0 hingga jam ke-5, selanjutnya relatif stabil hingga jam ke-30. Aktivitas spesifik tertinggi terjadi pada jam ke-15 yaitu sebesar 2,057 U/mg, kemudian mengalami penurunan pada jam ke-20 (Gambar 1). Aktivitas spesifik kolagenase tertinggi dicapai saat fase stasioner.
Isolat F-11.1 di media LBHC mengalami pertambahan jumlah sel mulai dari jam ke-0 hingga jam ke-10 lalu mengalami penurunan pada jam ke-15. Peningkatan jumlah sel seiring dengan peningkatan nilai aktivitas spesifik kolagenase yang dihasilkan. Aktivitas spesifik tertinggi di media ini terjadi pada jam ke-10 yaitu sebesar 2,037 U/mg (Gambar 2).
Nilai tertinggi aktivitas spesifik ini dicapai pada akhir fase eksponensial.
Berdasarkan kurva pertumbuhan, isolat F-11.1 pada media CLG mengalami kenaikan jumlah sel mulai jam ke-0 hingga jam ke-10 waktu inkubasi, kemudian memasuki fase stasioner pada jam ke-15. Aktivitas spesifik tertinggi pada media CLG dicapai pada akhir fase eksponensial yaitu jam ke-10 dengan nilai 0,807 U/mg (Gambar 3).
Waktu fe rme ntasi (jam)
O D 6 2 0 n m A k ti v it a s S p e s if ik ( U/ m g )
0 10 20 30 40 50 60
0.0 0.4 0.8 1.2 1.6 2.0 0.0 1.0 2.0 3.0 4.0 5.0 OD 620nm
Aktivitas Spesifik (U/mg)
A k ti v it a s Ko la g e n a s e ( U /m l) 0.2 0.4 0.6 0.8 1.0
Aktivitas Kolagenase (U/ml)
Gambar 1 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.1 pada media LBC.
Waktu fe rme ntasi (jam)
O D 6 2 0 n m A k ti v it a s S p e s if ik ( U/ m g )
0 10 20 30 40 50 60
0.0 0.4 0.8 1.2 1.6 2.0 0.0 0.5 1.0 1.5 2.0 2.5 3.0
OD 620 nm
Aktivitas Spesifik (U/mg)
A k ti v it a s Ko la g e n a s e ( U /m l) 0.1 0.2 0.3 0.4 0.5
Aktivitas Kolagenase (U/ml)
Gambar 2 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.1 pada media LBHC.
Waktu fe rme ntasi (jam)
O D 6 2 0 n m A k ti v it a s S p e s if ik ( U/ m g )
0 10 20 30 40 50 60
0.0 0.4 0.8 1.2 1.6 2.0 0.0 0.2 0.4 0.6 0.8 1.0
OD 620 nm
Aktivitas Spesifik (U/mg)
A k ti v it a s Ko la g e n a s e ( U /m l) 0.02 0.04 0.06 0.08 0.10
Aktivitas Kolagenase (U/ml)
4
Selama waktu inkubasi 50 jam, jumlah sel isolat F-11.4 di media LBC mengalami peningkatan yang signifikan hingga jam ke-20, lalu relatif stabil pada jam ke-25 dan mulai menurun pada jam ke-40. Pertambahan jumlah sel ini diikuti pula dengan nilai aktivitas spesifiknya. Aktivitas spesifik tertinggi di media ini dicapai saat fase stasioner pada jam ke-35 yaitu sebesar 4,695 U/mg (Gambar 4).
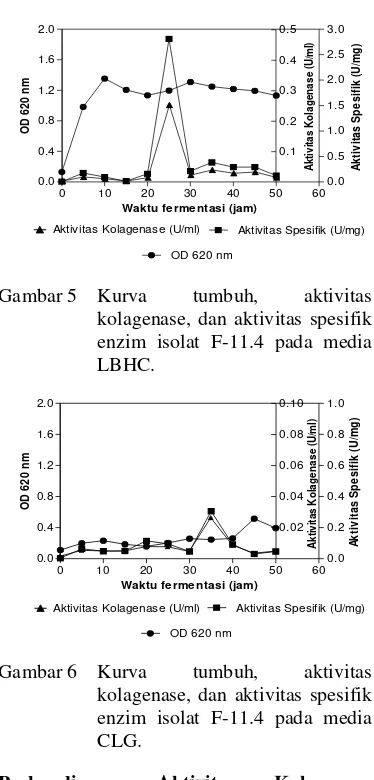
Berdasarkan kurva pertumbuhan isolat F-11.4 di media LBHC terlihat bahwa isolat ini mengalami pertambahan jumlah sel hingga jam ke-10, lalu relatif stabil pada jam ke-15. Aktivitas spesifik tertinggi di media ini terjadi saat fase stasioner yaitu pada jam ke-25 dengan nilai sebesar 2,811 U/mg (Gambar 5). Isolat F-11.4 yang tumbuh di media CLG mengalami fase lag yang panjang hingga jam ke-40, lalu memasuki fase eksponensial pada jam ke-45. Aktivitas spesifik tertinggi di media CLG dicapai saat fase adaptasi yaitu pada jam ke-35 dengan nilai sebesar 0,306 U/mg (Gambar 6).
Waktu fe rme ntasi (jam)
O D 6 2 0 n m A k ti v it a s S p e s if ik ( U/ m g )
0 10 20 30 40 50 60
0.0 0.4 0.8 1.2 1.6 2.0 0.0 1.0 2.0 3.0 4.0 5.0 OD 620nm
Aktivitas Spesifik (U/mg)
A k ti v it a s Ko la g e n a s e ( U /m l) 0.2 0.4 0.6 0.8 1.0
Aktivitas Kolagenase (U/ml)
Gambar 4 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.4 pada media LBC.
Waktu fe rme ntasi (jam)
O D 6 2 0 n m A k ti v it a s S p e s if ik ( U/ m g )
0 10 20 30 40 50 60
0.0 0.4 0.8 1.2 1.6 2.0 0.0 0.5 1.0 1.5 2.0 2.5 3.0
OD 620 nm
Aktivitas Spesifik (U/mg)
A k ti v it a s Ko la g e n a s e ( U /m l) 0.1 0.2 0.3 0.4 0.5
Aktivitas Kolagenase (U/ml)
Gambar 5 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.4 pada media LBHC.
Waktu fe rme ntasi (jam)
O D 6 2 0 n m A k ti v it a s S p e s if ik ( U/ m g )
0 10 20 30 40 50 60
0.0 0.4 0.8 1.2 1.6 2.0 0.0 0.2 0.4 0.6 0.8 1.0
OD 620 nm
Aktivitas Spesifik (U/mg)
A k ti v it a s Ko la g e n a s e ( U /m l) 0.02 0.04 0.06 0.08 0.10
Aktivitas Kolagenase (U/ml)
Gambar 6 Kurva tumbuh, aktivitas kolagenase, dan aktivitas spesifik enzim isolat F-11.4 pada media CLG.
Perbandingan Aktivitas Kolagenase
Terbaik B. licheniformis F-11.1 dan F-11.4 pada Media LBC, LBHC, dan CLG
Dari ketiga media produksi yang digunakan, media LBC dan LBHC lebih dapat meningkatkan aktivitas spesifik kolagenase pada isolat B. licheniformis F-11.1, sedangkan untuk isolat B. licheniformis F-11.4 aktivitas spesifiknya maksimum dicapai pada media LBC (Tabel 1). Aktivitas spesifik kolagenase kedua isolat B. licheniformis di media CLG lebih rendah dibandingkan pada media LBC dan LBHC.
Tabel 1 Aktivitas kolagenase terbaik isolat F-11.1 dan F-11.4 pada tiga media produksi.
Isolat Media Produksi Waktu inkubasi (Jam) Aktivitas Kolagenase (U/ml) Kadar Protein (mg/ml) Aktivitas Spesifik (U/mg) F-11.1 LBC 15 0,356 ± 0,039 0,173 ± 0,011 2,057 ± 0,092
[image:12.595.111.507.76.819.2] [image:12.595.324.511.84.474.2] [image:12.595.106.516.638.753.2]5
PEMBAHASAN
Media optimum untuk produksi enzim perlu dicari untuk mengetahui pertumbuhan terbaik dari bakteri dan aktivitas enzim tertinggi dalam suatu media. Apabila sel tumbuh baik dalam suatu media berarti media tersebut cocok untuk pertumbuhannya dan sel bakteri akan menghasilkan enzim-enzim ekstraseluler selama fase pertumbuhannya. Keadaan lingkungan yang baik bagi sintesis enzim biasanya juga baik bagi pertumbuhan bakteri (Suhartono 1992).
Pertumbuhan bakteri B. licheniformis F-11.1 dan F-11.4 lebih baik pada media LBC dibandingkan dengan media lain yaitu, media LBHC dan media CLG. Rendahnya pertumbuhan kedua isolat B. licheniformis pada media LBHC dan CLG dapat disebabkan karena nutrisi yang minim di kedua media tersebut. Media LBHC terdiri atas LB 50% dan 5% kolagen, sementara media CLG hanya terdiri atas 5% kolagen. Suhartono (1989) menyatakan bahwa mikrob memerlukan nutrien dengan komposisi tertentu untuk tumbuh dan membelah diri. Luria Bertani (LB) yang terkandung pada media LBC dan LBHC terdiri atas ekstrak khamir, tripton, dan NaCl. Penambahan atau pengurangan ekstrak khamir dalam medium dapat mempengaruhi kualitas nutrisi medium karena ekstrak khamir mengandung vitamin B dan substansi lain yang menunjang pertumbuhan seperti nitrogen organik dan senyawa karbon. Tripton merupakan sumber utama nitrogen organik (Pelczar & Chan 2007).
Bacillus licheniformis F-11.4 yang ditumbuhkan di media CLG mengalami fase lag dari jam ke-0 hingga jam ke-40. Hal tersebut karena komposisi media produksi berbeda dengan media inokulum sehingga bakteri melakukan adaptasi untuk menyesuaikan diri dengan kondisi lingkungan yang baru. Pada fase adaptasi ini belum terjadi pembelahan sel karena beberapa enzim belum disintesis. Jumlah sel pada fase ini mungkin tetap, namun kadang-kadang menurun. Jumlah awal sel yang semakin tinggi akan mempercepat fase adaptasi (Fardiaz 1992).
Kedua isolat B. licheniformis pada media LBC dan LBHC tidak mengalami fase adaptasi karena bakteri ditumbuhkan dalam media dan lingkungan yang sama dengan media inokulum. Selain jenis media, faktor pH, suhu, aerasi, dan ketersediaan oksigen juga mempengaruhi pertumbuhan bakteri (Suhartono 1992).
Berdasarkan hubungan antara kurva pertumbuhan dengan aktivitas spesifik kolagenase, diketahui bahwa produksi kolagenase B. licheniformis F-11.1 maksimum dicapai pada media LBC dan LBHC. Produksi kolagenase tertinggi di media LBC terjadi saat fase stasioner pada jam ke-15 yaitu sebesar 2,057 U/mg. Isolat F-11.1 di media LBHC mencapai produksi kolagenase tertinggi ketika fase eksponensial pada jam ke-10 yaitu sebesar 2,037 U/mg. Sementara, di media CLG isolat F-11.1 mencapai produksi kolagenase tertinggi saat sel berada dalam fase eksponensial pada 10 jam inkubasi. B. licheniformis F-11.1 di tiga media produksi memiliki waktu optimum produksi kolagenase yang hampir sama dengan Achromobacter iophagus di medium pepton yaitu pada 10-12 jam inkubasi. Aktivitas kolagenase tertinggi Achromobacter iophagus juga dicapai pada fase stasioner sebesar 0,156 U/ml (Reid et al. 1978). Nilai aktivitas tersebut lebih kecil bila dibandingkan dengan aktivitas kolagenase B. licheniformis F-11.1 di media LBC dan LBHC.
Produksi kolagenase Bacillus licheniformis F-11.4 maksimum dicapai pada media LBC. Aktivitas spesifik tertingginya terjadi pada jam ke-35 saat fase stasioner yaitu sebesar 4,695 U/mg. Umumnya enzim dihasilkan dalam jumlah sedikit selama fase pertumbuhan, tetapi terakumulasi dalam jumlah besar selama fase stasioner (Brock & Madigan 1991). Isolat F-11.4 yang tumbuh di media LBHC, produksi kolagenase tertinggi dicapai saat fase stasioner pada jam ke-25. Isolat F-11.4 di media LBHC memiliki waktu produksi optimum kolagenase yang sama dengan Klebsiella pneumoniae CNL3 yaitu pada 25 jam inkubasi (Suphatharaprateep et al. 2011). Sementara isolat F-11.4 di media CLG mencapai produksi kolagenase maksimumnya saat fase adaptasi pada jam ke-35. Produksi kolagenase maksimum saat fase adaptasi diduga karena masih banyak dan aktifnya enzim-enzim yang berasal dari inokulum dan dari sel-sel bakteri yang tumbuh. Kolagenase yang dihasilkan Bacillus licheniformis F-11.4 di tiga media produksi lebih kecil bila dibandingkan kolagenase dari Klebsiella pneumoniae CNL3 dan Bacillus cereusCNA1. Penelitian Suphatharaprateep et al (2011) menghasilkan aktivitas kolagenase sebesar 11 U/ml untuk Klebsiella pneumoniae CNL3 dan sebesar 24 U/ml untuk Bacillus cereusCNA1.
6
mengalami penurunan setelah waktu optimum tercapai. Hal tersebut karena substrat enzim telah berkurang. Selain itu, tingginya kandungan asam amino dalam media dapat berperan sebagai represor sintesis enzim atau terjadinya penguraian oleh enzim itu sendiri (autolisis) karena tidak ada lagi protein yang dapat digunakan sebagai substrat (Suhartono 1989).
Laju produksi enzim dapat dipengaruhi oleh umur inokulum karena menyebabkan lamanya fase lag. Fase lag terjadi karena penumpukan bahan-bahan toksik dan habisnya nutrien esensial di dalam sel selama pertumbuhan sebelumnya (Hadiutomo 1988). Kondisi tersebut dapat menghambat laju produksi enzim. Hal ini dapat dihindarkan dengan menggunakan inokulum yang berada pada fase eksponensial.
Bakteri umumnya mensintesis protease ekstraseluler untuk menghidrolisis substrat protein (polipeptida) di lingkungannya menjadi molekul yang lebih kecil (peptida atau asam amino) sehingga dapat diserap oleh sel. Penambahan kolagen 5% ke dalam media produksi berfungsi untuk menginduksi sel bakteri dalam mensintesis kolagenase. Beberapa enzim ada yang bersifat inducible enzyme (enzim yang terinduksikan). Enzim jenis ini dihasilkan oleh sel sebagai tanggapan terhadap adanya substrat (Pelczar & Chan 2007).
Produksi kolagenase kedua isolat B. licheniformis yang ditumbuhkan di media LBC dan LBHC lebih tinggi dibandingkan di media CLG. Hal tersebut karena adanya perbedaan faktor nutrisi. Tingginya aktivitas spesifik kolagenase di media LBC dan LBHC karena nutrisi yang terkandung di media tersebut lebih besar dibandingkan pada media CLG. Media Luria Bertani (LB) merupakan salah satu media yang dapat meningkatkan produksi protease. Hal ini didukung oleh penelitian Joo et al. (2002) yang menumbuhkan Bacillus horikoshii pada media LB dan menghasilkan aktivitas protease sebesar 29,8 U/ml pada jam ke-18 saat fase eksponensial. Banerjee & Bhattacharya dalam Anwar & Saleemuddin (1998) menyatakan bahwa penambahan nitrogen organik pada media tumbuh dapat meningkatkan produksi protease. Pepton dan tripton sebagai sumber nitrogen organik juga digunakan sebagai induser untuk meningkatkan produksi kolagenase dari Vibrio alginolyticus (Reid et al. 1980).
SIMPULAN
Media LBC (Luria Bertani + 5% kolagen) merupakan media optimum untuk pertumbuhan sel Bacillus licheniformis F-11.1 dan F-11.4. B. licheniformis F-11.1 dan F-11.4 menghasilkan kolagenase pada ketiga media produksi yaitu, LBC, LBHC, dan CLG. Produksi kolagenase isolat F-11.1 maksimum dicapai pada media LBC dan LBHC, yaitu masing-masing sebesar 2,057 U/mg dan 2,037 U/mg. Produksi kolagenase isolat F-11.4 maksimum dicapai pada media LBC dengan aktivitas spesifik sebesar 4,695 U/mg. Produksi kolagenase kedua isolat B. licheniformis di media CLG lebih rendah dibandingkan pada media LBC dan LBHC. Media LBC dan LBHC merupakan media terbaik untuk produksi kolagenase dari isolat B. licheniformis F-11.1 dan F-11.4.
SARAN
Perlu dilakukan penelitian lanjutan untuk menentukan kondisi optimum pertumbuhan Bacillus licheniformis F-11.1 dan F-11.4 serta produksi kolagenase pada berbagai pH, suhu, dan kecepatan agitasi.
DAFTAR PUSTAKA
Anwar A, Saleemuddin M. 1998. Alkaline proteases: A review. Bioresources Technol 64: 175-183.
Baehaki A, Suhartono MT, Sukarno, Syah D, Sitanggang AB, Setyahadi S, Meinhardt F. 2012. Purification and characterization of collagenase from Bacillus licheniformis F11.4. Afr J Microbiol Res 6(10): 2373-2379.
Bama P, Vijayalakshimi M, Jayasimman R, Kalaichelvan PT, Deccaraman M, Sankaranarayanan S. 2010. Extraction of collagen from cat fish (Tachysurus maculatus) by pepsin digestion and preparation and characterization of collagen chitosan sheet. Int J Pharm Pharm Sci 2(4): 133-137.
Bond MD, Wart HE. 1984. Purification and separation of individual collagenases of Clostridium histolyticum using red dye ligand chromatography. Biochem 23: 3077-3085.
7
Brock TD, Madigan MT. 1991. Biology of Microorganisms. Ed ke-6. New Jersey: Prentice Hall.
Chung L, Dinakarpandian D, Yoshida N, Fields JL, Fields GB, Visse R, Nagase H. 2004. Collagenase unwinds triple helical collagen proir to peptide bond hydrolysis. J EMBO 23: 3020-3030.
Fardiaz S. 1992. Mikrobiologi Pangan 1. Jakarta: Gramedia Pustaka Utama.
Hadiutomo RS. 1988. Metode-metode Untuk Bakteriologi. Bogor: Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor.
Hoffmann K, Daum G, Koster M, Kulicke WM. 2010. Genetic improvement of Bacillus licheniformis strains for efficient deproteinization of shrimp shells and production of high molecular mass chitin and chitosan. Appl Environ Microbiol 76(24): 8211-8221.
Hultmann L, Rustad T. 2004. Iced storage of Atlantic salmon (Salmo salar) – effects on endogenous enzymes and their impact on muscle proteins and texture. Food Chem 87: 31-41.
Joo HS, Kumar CG, Park GC, Kim KT, Paik SR, Chang CS. 2002. Optimization of the production of an extracellular alkaline protease from Bacillus horikoshii. Process Biochem 38: 155-159.
Kim SK, Park PJ, Kim JB, Shahidi F. 2002. Purification and characterization of collagenase from the tissue of filefish, Novoden modestrus. J Biochem Mol Biol 35(2): 165-171.
Kumaila R. 2008. Ekstraksi, karakterisasi, dan aplikasi enzim kolagenase dan organ dalam ikan tuna (Thunnus sp.) [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Lehninger. 1993. Dasar-dasar Biokimia 1.
Suhartono MT, penerjemah. Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry.
Moore S, Stein WH. 1954. A modified ninhydrin reagent for the photometric determination of amino acids and related compounds. J Biol Chem 211: 907-913. Nagai T, Izumi M, Ishii M. 2004. Fish scale
collagen. Preparation and partial characterization. Int J Food Sci Technol 39: 239-244.
Nagano H, To KA. 1999. Purification of collagenase and specificity of its related enzyme from Bacillus subtilis FS-2. Biosci Biotechnol Biochem 63(7): 181-183.
Pelczar MJ, Chan ECS. 2007. Dasar-Dasar Mikrobiologi 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta: UI Press. Terjemahan dari: Elements of Microbiology.
Petrova D, Derekova A, Vlahov S. 2006. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia microbiol 51(2): 93-98.
Rao MB, Tanksale AM, Ghatge MS, Deshpande VV. 1998. Molecular and biotechnological aspects of microbial proteases. Microbiol Mol Biol Rev 62(3): 597-635.
Reid GC, Woods DR, Robb FT. 1978. Regulation of extracellular collagenase production in Achromobacter iophagus. J Gen Microbiol 109: 149-154.
. 1980. Peptone induction and rifampin-insensitive collagenase production by Vibrio alginolyticus. J Bacteriol 142(2): 447-454.
Riley KN, Herman IM. 2005. Collagenase promotes the cellular responses to injury and wound healing in vivo. J Burns Wound 4:112-124.
Shahidi F, Han XQ, Synowiecki J. 1995. Production and characteristics of protein hydrolysates from capelin (Mallotus villosus). Food Chem 53: 285-293. Sternlicht MD, Werb Z. 2001. How matrix
metalloproteinases regulate cell behavior. Annu Rev Cell Dev Biol 17: 463–516. Suhartono MT. 1989. Enzim dan
Bioteknologi. Bogor: Depdikbud, DIKTI, Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor.
Suhartono MT. 1992. Protease. Bogor: Depdikbud, DIKTI, Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor.
Suphatharaprateep W, Cheirsilp B, Jongjareonrak A. 2011. Production and properties of two collagenases from bacteria and their application for collagen extraction. New Biotechnol 28(6): 649-655.
Tran LH, Nagano H. 2002. Isolation and characteristics of Bacillus subtilis CN2 and its collagenase production. J Food Sci 67: 1184-1187.
8
Yuniarti T. 2010. Purifikasi dan karakterisasi kolagenase dari organ dalam ikan bandeng (Chanos chanos, Forskal) [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
10
Lampiran 1 Metode pengukuran aktivitas kolagenase menurut Moore & Stein (1954)
Pereaksi Blanko (ml) Sampel (ml) Standar (ml)
Substrat kolagen 5% (b/v) 5,00 5,00 5,00
Bufer fosfat 50mM pH 9 1,00 1,00 1,00
Akuades 0,10 - -
L-leusin standar 5mM - - 0,10
Enzim - 0,10 -
Diinkubasi pada suhu 370C selama 60 menit
TCA 50% 0,20 0,20 0,20
Diinkubasi pada suhu ruang selama 10 menit, lalu disentrifugasi pada 5000 rpm selama 20 menit
Filtrat 0,20 0,20 0,20
Ninhidrin 0,1% 1,00 1,00 1,00
Diinkubasi pada suhu 1000C selama 20 menit
1-propanol 50% 5,00 5,00 5,00
Diukur dengan spektrofotometer pada λ=570 nm
Aktivitas enzim dihitung menurut rumus:
UA=
x P x
Keterangan: UA = Jumlah enzim yang dapat menghasilkan 1 mikromol produk leusin per menit (U/ml)
A = Absorbansi
11
Lampiran 2 Metode pengukuran kadar protein (Bradford 1976)
Komposisi pereaksi Bradford (Bradford 1976) lima kali terdiri atas:
Coomasie brilliant blue G-250 0,025 g
Etanol 95% 12,5 ml
Asam ortofosfat 25 ml
Akuades 250 ml
Sebelum digunakan untuk mengukur kadar protein, pereaksi diencerkan dengan akuades (perbandingan 1:4) dan larutan stok BSA (bovin serum albumin) yang digunakan adalah dengan konsentrasi akhir 1 mg/ml.
Kurva standar BSA dibuat dengan menambahkan 5 ml pereaksi Bradford ke dalam 0,1 ml larutan BSA dengan konsentrasi 0,00 mg/ml – 0,50 mg/ml. Selanjutnya campuran tersebut diinkubasi selama 10 menit pada suhu ruang dan absorbansinya dibaca pada panjang gelombang 595 nm. Sedangkan blanko dibuat dengan mencampurkan 0,1 ml akuades dengan pereaksi Bradford, kemudian dikocok dan diukur absorbansinya pada panjang gelombang 595 nm.
12
Lampiran 3 Kurva standar protein Bradford
y = 0.759x + 0.288 R² = 0.988
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
0.0 0.1 0.2 0.3 0.4 0.5 0.6
O
D 5
9
5
n
m