BAKU PAKAN IKAN NILA
Oreochromis niloticus
FERI KURNIAWATI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
PENINGKATAN KECERNAAN KULIT UBI KAYU Manihot utilissima SETELAH PERENDAMAN NaOH, FERMENTASI KAPANG, DAN FERMENTASI BAKTERI SEBAGAI BAHAN BAKU PAKAN IKAN NILA
Oreochromis niloticus
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Januari 2012
FERI KURNIAWATI. Peningkatan Kecernaan Kulit Ubi Kayu
Manihot utilissima setelah Perendaman NaOH, Fermentasi Kapang, dan Fermentasi Bakteri sebagai Bahan Baku Pakan Ikan Nila Oreochromis niloticus. Dibimbing oleh MIA SETIAWATI dan MULYASARI.Penelitian ini bertujuan untuk mengetahui peningkatan kecernaan kulit ubi kayu (Manihot utilissima) setelah perendaman dengan NaOH 3% selama 3 hari, fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium) 10% selama 7 hari, dan fermentasi bakteri Bacillus megaterium 15% selama 5 hari sebagai bahan baku pakan ikan nila. Pakan uji kecernaan pada ikan nila dilakukan dengan mencampurkan 30% kulit ubi kayu dengan 70% pakan acuan. Ikan uji yang digunakan adalah ikan nila dengan bobot rata-rata 16,62±0,03 gram yang dipelihara selama 28 hari dengan kepadatan 10 ekor/akuarium. Pemberian pakan dilakukan dua kali sehari secara at satiation dan pengumpulan feses dimulai pada hari ke-6. Hasil menunjukkan bahwa perendaman NaOH 3%, fermentasi gabungan kapang, serta fermentasi bakteri memberikan pengaruh yang berbeda nyata terhadap kontrol (P<0,05) dan dapat meningkatkan nilai kecernaan protein berturut-turut sebesar 5%, 15%, dan 10%, nilai kecernaan energi sebesar 20%, 18%, dan 16%, serta nilai kecernaan bahan sebesar 174%, 151%, dan 164%. Perlakuan kulit ubi kayu yang difermentasi dengan kapang menunjukkan nilai kecernaan yang terbaik sehingga berpotensi sebagai bahan baku pakan ikan nila.
FERI KURNIAWATI. Digestibility Enhancement of Cassava Peel Manihot utilissima after Immersion in NaOH, Mold Fermentation, and Bacteria Fermentation as Feed Raw Material for Nile Tilapia Oreochromis niloticus. Supervised by MIA SETIAWATI and MULYASARI.
This research aimed to determine digestibility enhancement of cassava peel
Manihot utilissima after immersion in 3% NaOH for 3 days,10% combined mold fermentation Trichoderma viride and Phanerochaete chrysosporium for 7 days, and 15% fermentation of Bacillus megaterium for 5 days as feed raw material for Nile tilapia. Test diet of digestibility Nile tilapia was carried out by mixing 30% cassava peel with 70% reference diet. Nile tilapia was used as an object in this research with an average weight of 16,62±0,03 gram. The object was conditioned for 28 days with a density of 10 fish/aquarium. Feeding done twice a day with satiation and feces collection was began day of sixth. The result of this research showed that 3% NaOH immersion, combination of mold fermentation and bacteria fermentation gives a significantly different effect of control (P<0,05) and was improved about 5%, 15%, and 10% of protein digestibility, 20%, 18%, and 16% of energy digestibility, and 174%, 151%, and 164% of material digestibility. The treatment for cassava peel are 10% combined fermentation of mold showed the best of digestibility so potentially as feed raw material for Nile tilapia.
BAKU PAKAN IKAN NILA
Oreochromis niloticus
FERI KURNIAWATI
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi & Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
setelah Perendaman NaOH, Fermentasi Kapang, dan Fermentasi Bakteri sebagai Bahan Baku Pakan Ikan Nila Oreochromis niloticus.
Nama : Feri Kurniawati
NIM : C14070016
Departemen : Budidaya Perairan
Disetujui,
Diketahui,
Ketua Departemen Budidaya Perairan
Dr. Odang Carman NIP. 19591222 198601 1 001
Tanggal Lulus :
PembimbingI
Dr. Mia Setiawati NIP. 19641026 199203 2 001
PembimbingII
Puji dan syukur kehadirat Allah SWT atas segala berkah dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ”Peningkatan Kecernaan Kulit Ubi Kayu Manihot utilissima setelah Perendaman NaOH, Fermentasi Kapang, dan Fermentasi Bakteri sebagai Bahan Baku Pakan Ikan Nila
Oreochromis niloticus". Skripsi ini disusun sebagai syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penelitian ini dilaksanakan pada bulan Mei-Juli 2011. Analisis proksimat, pembuatan pakan, dan pemeliharaan ikan dilakukan di Laboratorium Balai Penelitian dan Pengembangan Budidaya Air Tawar Sempur dan Laboratorium Nutrisi Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Ibu Dr. Mia Setiawati selaku dosen Pembimbing 1 dan Ibu Mulyasari STP, Msi. selaku Pembimbing 2, Bapak Dr. Alimuddin sebagai Dosen Penguji Tamu dan Ketua Program Studi, serta Bapak Dr. Zafril Imran Azwar dan Ibu Irma Melati yang telah memberikan bimbingan dan pengarahan selama penelitian dan penyusunan skripsi. Kepada papa, mama, dan adek (Dhidy Kurniawan dan Wiwin Kurnia Widyanti) atas doa dan dukungannya selalu. Kepada Bapak Bei, Bapak Yosep, Bapak Usman, Ibu Ati, Bapak Reza, Bapak Rizki, dan seluruh staf Balai Penelitian dan Pengembangan Budidaya Air Tawar Sempur, Yeni Elpia, Wira, Tina, Novi, Retno, Vida, Ursa Mayor, Laskar Bintang, teman-teman Laboratorium Nutrisi, comb44t, keluarga besar Forum Keluarga Muslim FPIK, Ranny M. Karimah dan Robi Amsyah (Unpad), adik-adik (Icha, Azah, Aza, Dewi, Vena, Nenden, Dila, Tyas, Dera, Binta, Sandya), Dinar’ers, Bapak Wasjan, Bapak Asep, Bapak Maryanta, Ibu Yuli, Ibu Retno, dan keluarga besar BDP atas dukungannya.
Semoga skripsi ini bermanfaat.
Bogor, Januari 2012
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Kampar pada tanggal 13 Desember 1988 dari pasangan Bapak Riyanto dan Ibu Riswanti. Penulis merupakan anak pertama dari tiga bersaudara.
Penulis menyelesaikan pendidikan TK Pertiwi Purwokerto tahun 1995, SDN 011 Tandun tahun 2001, SMPN 2 Tandun tahun 2004, SMA Negeri 1 Ujung Batu tahun 2007, kemudian melanjutkan studi di IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa perkuliahan penulis aktif di organisasi kemahasiswaan yaitu FOSMA ESQ IPB sebagai staf Sosial Kemasyarakatan dan FOSMA ESQ Bogor sebagai staf PSDM (2007-2008), Forum Keluarga Muslim FPIK sebagai staf divisi keputrian (2008-2009) dan sebagai kepala divisi keputrian (2009-2010), Himpunan Mahasiswa Akuakultur (HIMAKUA) sebagai staf divisi PSDM (2008-2009). Penulis pernah menjadi asisten Pendidikan Agama Islam (2010-2011), asisten praktikum Mata Kuliah Nutrisi Ikan dan Mata Kuliah Teknologi Produksi dan Pembuatan Pakan Ikan (2011).
Penulis juga pernah melakukan magang Pembenihan Abalone di Balai Besar Pengembangan Budidaya Air Laut Lampung pada bulan Februari 2009, Pembenihan Ikan Nila Oreochromis niloticus di BBI Cangkringan Yogyakarta pada bulan Juli 2009 serta praktik lapang Pembenihan Ikan Kerapu Bebek
Cromileptes altivelis di Balai Besar Pengembangan Budidaya Air Laut Lampung Juni-Agustus 2010.
DAFTAR TABEL ... i
DAFTAR LAMPIRAN ... ii
I. PENDAHULUAN ... 1
II. BAHAN DAN METODE ... 3
2.1 Penyiapan Bahan Baku Pakan ... 3
2.1.1 Perendaman Kulit Ubi Kayu dengan NaOH ... 3
2.1.2 Fermentasi Kulit Ubi Kayu dengan Gabungan Kapang Trichoderma viride dan Phanerochaete chrysosporium ... 3
2.1.3 Fermentasi Kulit Ubi Kayu dengan Bakteri Bacillus megaterium ... 3
2.2 Pakan Uji Kecernaan ... 4
2.3 Pemeliharaan Ikan dan Pengumpulan Data ... 4
2.4 Analisis Kimia ... 5
2.5 Analisis data ... 5
2.6 Kecernaan ... 5
III. HASIL DAN PEMBAHASAN ... 7
3.1 Hasil ... 7
3.2 Pembahasan ... 9
IV. KESIMPULAN DAN SARAN ... 14
4.1 Kesimpulan ... 14
4.2 Saran ... 14
DAFTAR PUSTAKA ... 15
LAMPIRAN ... 17
1. Komposisi pakan uji dan pakan acuan ikan nila Oreochromis niloticus ... 4 2. Komposisi proksimat bahan uji kulit ubi kayu dalam bobot kering ... 7 3. Komposisi proksimat pakan uji ikan nila Oreochromis niloticus dalam
bobot kering ... 7 4. Kecernaan protein, energi dan bahan pakan uji kulit ubi kayu pada ikan nila ... 8
ii
DAFTAR LAMPIRAN
Halaman
1. Pembuatan pakan uji untuk 1000 gram pakan ... 18
2. Skema tata letak akuarium perlakuan ... 18
3. Prosedur analisis proksimat... 18
3.1 Prosedur analisis kadar air ... 18
3.2 Prosedur analisis kadar serat kasar ... 19
3.3 Prosedur analisis kadar protein ... 19
3.4 Prosedur analisis kadar abu ... 20
3.5 Prosedur analisis kadar lemak ... 21
4. Analisis Cr2O3 ... 21
5. Analisis proksimat pakan acuan ... 22
6. Kecernaan protein pakan ikan nila Oreochromis niloticus ... 22
7. Kecernaan energi pakan ikan nila Oreochromis niloticus ... 23
8. Kecernaan bahan pada pakan ikan nila Oreochromis niloticus ... 24
9. Hasil analisis statistik kecernaan protein pakan ikan nila Oreochromis niloticus ... 25
10.Hasil analisis statistik kecernaan energi pakan ikan nila Oreochromis niloticus ... 26
1
I. PENDAHULUAN
Ikan nila Oreochromis niloticus merupakan ikan ekonomis penting yang sudah terkenal di kalangan masyarakat karena memiliki rasa daging yang enak dan mudah didapatkan. Ikan ini banyak dibudidaya oleh petani karena mudah membudidayakan dan memasarkannya. Pakan merupakan salah satu komponen penting dalam kegiatan budidaya ikan yang intensif. Harga pakan akan mempengaruhi biaya produksi dan keuntungan yang diperoleh dari usaha budidaya. Oleh karena itu, dibutuhkan bahan baku pakan ikan yang murah dan lebih efisien. Beberapa kriteria yang harus dipertimbangkan dalam mencari bahan baku pakan ikan antara lain dapat memenuhi kebutuhan nutrisi ikan, memiliki kualitas baik, tersedia dalam jumlah besar dan berkelanjutan, tidak bersaing dengan kebutuhan manusia, dan harga relatif murah (Suprayudi, 2010). Salah satu bahan pakan yang memenuhi kriteria tersebut adalah kulit ubi kayu. Kulit ubi kayu merupakan limbah dari mata rantai proses produksi pembuatan tepung tapioka dan juga keripik. Produksi ubi kayu di Indonesia tercatat oleh Badan Pusat Statistik (2011) sebesar 22.039.145 ton pada tahun 2009 dan pada tahun 2010 sebesar 23.918.118 ton. Setiap kilogram ubi kayu dapat menghasilkan 15–20% kulit ubi (Muhiddin et al., 2000) sehingga apabila dibuang maka akan mencemari lingkungan. Kulit ubi kayu masih mengandung bahan-bahan organik seperti karbohidrat, protein, lemak, dan mineral. Berdasarkan hasil penelitian Busairi dan Wikanastri (2009) kulit ubi kayu mengandung kadar protein 1,03%, lemak 1,74%, dan karbohidrat 78,20%.
Namun demikian, kulit ubi kayu mengandung serat yang cukup tinggi sehingga apabila dijadikan bahan baku pakan ikan maka nilai kecernaannya rendah. Pada serat kasar terdapat ikatan antara lignin, selulosa, dan hemiselulosa yang merupakan faktor utama penyebab rendahnya kecernaan pakan (Murni et al.,
2008). Perbaikan kandungan nutrisi kulit ubi kayu dapat dilakukan dengan perlakuan fisik, kimia, dan biologi. Perlakuan alkali pada limbah berserat umumnya dapat merusak ikatan antara komponen dinding sel dan menyuplai mineral ensensial (Winugroho, 1986).
2 Kandungan protein pada kulit ubi kayu dapat ditingkatkan melalui proses fermentasi. Fermentasi merupakan aplikasi metabolisme mikroba untuk mengubah bahan baku menjadi produk yang bernilai lebih tinggi, seperti asam-asam organik, protein sel tunggal, antibiotika dan biopolimer (Muhiddin et al., 2000). Proses fermentasi dengan teknologi yang sesuai dapat menghasilkan produk protein. Berdasarkan faktor yang mempengaruhi pemilihan substrat untuk fermentasi, limbah kulit ubi kayu termasuk substrat yang baik karena mengandung karbohidrat yang tinggi, protein, lemak, dan mineral yang merupakan bahan dasar potensial untuk proses biokonversi mikroba. Fermentasi padat dengan substrat kulit ubi kayu dilakukan untuk meningkatkan kandungan protein dan mengurangi masalah limbah pertanian. Mikroorganisme yang berperan dalam proses fermentasi antara lain kapang Trichoderma viride,
Phanerochaete chrysosporium, dan bakteri Bacillus megaterium. Kapang selulolitik yang cukup baik memproduksi enzim selulolitik yang berfungsi mendegradasi selulosa adalah T. viride (Pelczar et al., 1986). Soetopo dan Endang (2008) dalam hasil penelitiannya menyebutkan bahwa salah satu jamur yang mampu mendegradasi lignin dan selulosa adalah P. chrysosporium. Bakteri B. megaterium dapat menghidrolisis pati dan mampu menggunakan sitrat sebagai satu-satunya sumber karbon dalam pertumbuhannya serta mampu mereduksi nitrat menjadi nitrit (Arifin, 1996).
3
II. BAHAN DAN METODE
2.1 Penyiapan Bahan Baku Pakan
Kulit ubi kayu sebagai bahan baku pakan diberi beberapa perlakuan. Perlakuan kulit ubi kayu tersebut adalah perendaman dengan NaOH, fermentasi gabungan kapang (Trichoderma viride dan Phanerochaete chrysosporium) dan fermentasi dengan bakteri Bacillus megaterium.
2.1.1 Perendaman Kulit Ubi Kayu dengan NaOH
Kulit ubi kayu yang telah bersih dan kering ditimbang sebanyak 5 kg. Kulit ubi kayu tersebut dimasukkan ke dalam wadah baskom dan diberi NaOH 3%. Kulit ubi kayu direndam dengan larutan NaOH 3% selama 3 hari. Setelah 3 hari, kulit ubi kayu tersebut dicuci hingga pH netral kemudian dijemur. Setelah kering, kulit ubi kayu dihaluskan. Tepung kulit ubi kayu dianalisis dan dibuat pakan sebanyak 300 gram.
2.1.2 Fermentasi Kulit Ubi Kayu dengan Gabungan Kapang Trichoderma viride dan Phanerochaete chrysosporium
Kulit ubi kayu yang telah bersih dan kering kemudian dihaluskan. Sebanyak 1 kg tepung kulit ubi kayu ditambahkan air 150% atau sekitar 1500 ml. Adonan tersebut dimasukkan ke dalam plastik yang diberi lubang kemudian dikukus selama 30 menit. Setelah 30 menit adonan diangkat dan didinginkan. Kulit ubi kayu tersebut dimasukkan kembali ke dalam wadah dan diberi inokulan gabungan kapang T. viride dan P. chrysosporium sebanyak 10%. Tepung kulit ubi kayu dan kapang yang telah tercampur merata dibungkus dalam plastik yang diberi lubang-lubang kecil dan diinkubasi selama 1 minggu. Hasil fermentasi tersebut dianalisis proksimat dan dibuat pakan sebanyak 300 gram.
2.1.3 Fermentasi Kulit Ubi Kayu dengan Bakteri Bacillus megaterium
Sebanyak 1 kg tepung kulit ubi kayu ditambahkan air 150% atau sekitar 1500 ml. Adonan tersebut dimasukkan ke dalam plastik yang diberi lubang kemudian dikukus selama 30 menit. Setelah itu, adonan diangkat dan dibiarkan dingin. Kulit ubi kayu tersebut dimasukkan kembali ke dalam wadah plastik dan
4 diberi inokulan B. megaterium sebanyak 15%. Tepung kulit ubi kayu dan bakteri yang telah tercampur merata ditutup dengan plastik yang diberi lubang-lubang kecil dan diinkubasi selama 5 hari. Setiap hari selama masa fermentasi adonan diaduk. Hasil fermentasi tersebut dianalisis proksimat dan dibuat pakan sebanyak 300 gram.
2.2 Pakan Uji Kecernaan
Pakan yang digunakan dalam uji kecernaan terdiri dari pakan acuan dan pakan campuran bahan uji dengan perbandingan 70% pakan acuan dan 30% bahan kulit ubi kayu. Kromium trioksida (Cr2O3) yang digunakan sebagai
penanda dalam uji kecernaan ditambahkan pada setiap pakan uji dan pakan acuan sebanyak 0,5% (NRC, 1993). Semua pakan perlakuan dibentuk dalam pelet kering kemudian dianalisis proksimat. Proses pembuatan pakan dapat dilihat pada Lampiran 1. Komposisi pakan acuan dan pakan uji ditunjukkan pada Tabel 1. Tabel 1. Komposisi pakan uji dan pakan acuan ikan nila Oreochromis niloticus
Proporsi bahan Perlakuan pakan Pakan acuan Kontrol NaOH Kapang Bakteri
Pakan komersial (%) 68 68 68 68 98
Bahan uji (%) 30 30 30 30 0
CMC (%) 1,5 1,5 1,5 1,5 1,5
Cr2O3 (%) 0,5 0,5 0,5 0,5 0,5
Total (%) 100 100 100 100 100
Keterangan : Kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium)
Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium CMC = Carboxil Metil Celulose
2.3 Pemeliharaan Ikan dan Pengumpulan Data
5 Perlakuan pakan disusun dengan menggunakan metode rancangan acak lengkap. Skema tata letak akuarium dapat dilihat pada Lampiran 2. Pakan diberikan dua kali sehari yaitu pukul 09.00 dan 15.00 WIB. Pakan diberikan secara at satiation. Kegiatan harian yang dilakukan adalah pengukuran suhu, pemberian pakan dan pengumpulan feses. Pengukuran kecernaan dilakukan dengan mengumpulkan feses ikan dan dianalisis pada akhir pemeliharaan. Pengumpulan feses dilakukan lima hari setelah pemberian pakan perlakuan (Silva, 1989).
2.4 Analisis Kimia
Analisis proksimat yang dilakukan meliputi pengukuran kadar air, protein, lemak, abu, serat kasar, dan BETN. Pengukuran kadar air dengan melakukan pemanasan bahan di dalam oven pada suhu 100⁰C selama 6 jam, kadar protein
dihitung menggunakan metode Kjeldahl sedangkan lemak kering dan abu masing-masing diukur dengan metode Soxchlet dan pemanasan di dalam tanur 600⁰C,
serat kasar diukur dengan pelarutan sampel dengan asam dan basa kuat (Takeuchi, 1988). Metode analisis proksimat dapat dilihat pada Lampiran 3.
Analisis kecernaan dilakukan dengan pengukuran kromium (Cr2O3) pakan
dan feses ikan melalui pemanasan bahan dengan asam kuat (HNO3) dan (HCLO4)
kemudian dilakukan pembacaan absorban pada spektrofotometer dengan panjang gelombang 350 nm (Lied et al., 1982 dalam Tytler & Calow, 1985). Metode analisis Cr2O3 dapat dilihat pada Lampiran 4 (Takeuchi, 1988).
2.5 Analisis data
Penelitian ini menggunakan rancangan acak lengkap dengan lima perlakuan dan tiga ulangan. Data kecernaan protein, kecernaan energi dan kecernaan bahan pakan pada penelitian ini diolah menggunakan SPSS 16 serta uji lanjut menggunakan uji Duncan.
2.6 Kecernaan
Parameter kecernaan yang dihitung berdasarkan Watanabe (1988) dan NRC (1993) adalah sebagai berikut:
6 Energi tercerna kkal/100g pakan = Energi pakan – (Energi feses x n/n’) Kecernaan energi (%) = [Energi tercerna/Energi pakan] x 100% Kecernaan bahan (%) = (ADT-0,7AD)/0,3
Keterangan : a = % Cr2O3 dalam pakan
a’ = % Cr2O3 dalam feses
b = % protein dalam pakan b’ = % protein dalam feses n = mg Cr2O3/gram pakan
n’ = mg Cr2O3/gram feses
7
III. HASIL DAN PEMBAHASAN
3.1 Hasil
Pakan yang telah dibuat dianalisis untuk mengetahui komposisi proksimat pakan tersebut. Hasil analisis proksimat bahan dan pakan uji kulit ubi kayu terdapat pada Tabel 2 dan Tabel 3.
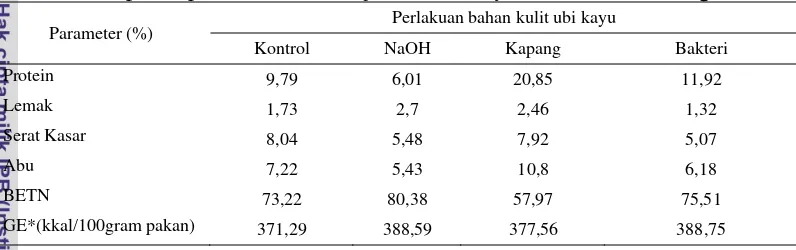
Tabel 2. Komposisi proksimat bahan uji kulit ubi kayu dalam bobot kering
Parameter (%) Perlakuan bahan kulit ubi kayu
Kontrol NaOH Kapang Bakteri
Protein 9,79 6,01 20,85 11,92
Lemak 1,73 2,7 2,46 1,32
Serat Kasar 8,04 5,48 7,92 5,07
Abu 7,22 5,43 10,8 6,18
BETN 73,22 80,38 57,97 75,51
GE*(kkal/100gram pakan) 371,29 388,59 377,56 388,75
Keterangan :
Kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium) Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
BETN = Bahan Ekstrak Tanpa Nitrogen *GE = Gross Energy
1 gram protein = 5,6 kkal GE 1 gram karbohidrat/BETN = 4,1 kkal GE
1 gram lemak = 9,4 kkal GE (Watanabe, 1988)
Tabel 3. Komposisi proksimat pakan uji ikan nila Oreochromis niloticus dalam bobot kering
Parameter (%) Perlakuan pakan kulit ubi kayu
Kontrol NaOH Kapang Bakteri
Protein 22,37 20,92 24,51 22,48
Lemak 5,47 5,39 5,11 6,20
Serat kasar 4,71 4,68 4,92 5,11
Kadar abu 10,60 9,95 11,55 10,41
BETN 43,15 40,94 46,09 44,20
GE* (kkal/100gram pakan) 353,605 335,672 374,259 365,388 Keterangan :
kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium) Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
BETN = Bahan Ekstrak Tanpa Nitrogen *GE = Gross Energy
1 gram protein = 5,6 kkal GE 1 gram karbohidrat/BETN = 4,1 kkal GE
1 gram lemak = 9,4 kkal GE (Watanabe, 1988)
8 Berdasarkan hasil proksimat komposisi bahan uji kulit ubi kayu (Tabel 2) diketahui bahwa kandungan protein tertinggi terdapat pada perlakuan kulit ubi kayu dengan fermentasi gabungan kapang T. viride dan P. Chrysosporium
20,85%. Nilai protein pada perlakuan fermentasi dengan bakteri B. megaterium
mengalami peningkatan dibandingkan nilai protein kontrol yaitu dari 9,79% menjadi 11,92%. Sebaliknya, pada perlakuan kulit ubi kayu dengan NaOH kandungan protein mengalami penurunan menjadi 6,01%. Kandungan serat kasar pada semua perlakuan mengalami penurunan. Pada Tabel 3 hasil proksimat komposisi pakan yang mengandung perlakuan kulit ubi kayu dalam jumlah yang sama yaitu 30%, memiliki nilai nutrien yang berbanding lurus dengan hasil proksimat bahan kulit ubi kayu yang direkayasa.
Kecernaan menunjukkan besarnya nutrien dalam pakan yang dapat diserap oleh tubuh ikan. Kulit ubi kayu yang direndam NaOH, difermentasi gabungan kapang T. viride dan P. crhysosporium, serta difermentasi bakteri B. megaterium
memberikan pengaruh terhadap nilai kecernaan. Nilai kecernaan protein, kecernaan energi, dan kecernaan bahan pakan pada ikan nila Oreochromis niloticus dapat dilihat pada Tabel 4.
Tabel 4. Kecernaan protein, energi, dan bahan pakan uji kulit ubi kayu pada ikan nila Oreochromis niloticus
Parameter
Perlakuan kulit ubi kayu
Kontrol NaOH Kapang Bakteri
Kapang = kulit ubi kayu fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium) Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
Nilai yang tertera merupakan nilai rata-rata ± standar deviasi. Huruf superskrip yang sama pada baris yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05).
9 kulit ubi kayu direndam NaOH tidak berbeda nyata dengan pakan yang mengandung kulit ubi kayu difermentasi bakteri dan pakan yang mengandung kulit ubi kayu kontrol (P>0,05). Nilai kecernaan energi dan kecernaan bahan pada pakan yang mengandung kulit ubi kayu direndam NaOH, difermentasi kapang, serta difermentasi bakteri menunjukkan hasil yang lebih tinggi dibandingkan pakan yang mengandung bahan kulit ubi kayu kontrol (P<0,05).
3.2 Pembahasan
Berdasarkan hasil rekayasa bahan kulit ubi kayu, pada perlakuan perendaman kulit ubi kayu dengan NaOH, kandungan protein mengalami penurunan sebesar 38% yaitu dari 9,79% menjadi 6,01% (Tabel 2). Penurunan kandungan protein pada kulit ubi kayu diduga disebabkan proses hidrolisis oleh NaOH yang meyebabkan molekul protein yang besar berubah menjadi lebih sederhana. Pencucian kulit ubi kayu dapat meyebabkan protein yang berukuran kecil terbawa oleh air. Hidrolisis protein dapat terjadi bila protein direndam asam, alkali kuat, atau dengan penggunaan enzim yang akan disertai dengan pembebasan asam amino penyusun molekul protein (Kirk dan Othmer, 1953). Protein akan terpisah menjadi beberapa asam amino bila dihidrolisis, namun ada beberapa protein terlepas menjadi asam amino dan masih tetap membentuk molekul-molekul protein yang berikatan (West dan Todd, 1964 dalam Gantiawan, 2002). Pada dinding sel tanaman terdapat serat kasar yang terdiri dari ikatan lignin, selulosa, dan hemiselulosa. Kandungan serat kasar pada perlakuan ini mengalami penurunan sekitar 32% yaitu dari 8,04% menjadi 5,48%. Penurunan kandungan serat kasar ini menyebabkan kandungan bahan ekstrak tanpa nitrogen (BETN) kulit ubi kayu meningkat dari 73,22% menjadi 80,38% (Tabel 2). Hal ini disebabkan oleh pengaruh perendaman kulit ubi kayu dengan NaOH sehingga ikatan kuat lignin pada dinding sel terurai menjadi bahan yang mudah dicerna. Perlakuan alkali seperti NaOH pada limbah berserat umumnya dapat merusak ikatan antara komponen dinding sel (Winugroho, 1986).
10 20,85% (Tabel 2). Mikroba yang digunakan dalam proses fermentasi padat dapat menghasilkan enzim yang akan mendegradasi senyawa-senyawa kompleks menjadi lebih sederhana dan mensintesis protein sehingga protein bahan meningkat (Busairi dan Wikanastri, 2009). Hal ini sesuai dengan penelitian Sukara (1987) yang membuktikan bahwa fermentasi singkong dengan T. viride
dapat meningkatkan protein sampai 20,5%. Fermentasi dengan P.crhrysosporium
dapat meningkatkan kandungan protein kasar kulit buah kakao 8,69% menjadi 13,84% (Suparjo et al., 2011). Selain itu, peningkatan nutrien dalam kulit ubi kayu diduga terdapat keseimbangan antara komposisi substrat dan nutrien yang dibutuhkan untuk hidup kapang sehingga massa kapang yang tumbuh semakin banyak. Peningkatan kandungan protein bahan merupakan refleksi jumlah massa sel (Muhiddin et al., 2000). Busairi dan Wikanastri (2009) menyatakan kulit ubi kayu mengandung bahan-bahan organik seperti karbohidrat, protein, lemak, dan mineral. Bahan-bahan organik tersebut dapat digunakan sebagai bahan dasar potensial untuk proses biokonversi oleh mikroba, antara lain dengan memanfaatkan kulit ubi kayu sebagai substrat pertumbuhan mikroba untuk memproduksi protein sel tunggal melalui proses fermentasi. Kapang bergantung kepada karbohidrat kompleks seperti oligosakarida sebagai nutrien. Karbohidrat kompleks tersebut diuraikan menjadi monosakarida dengan enzim ekstraseluler kemudian diserap kapang untuk diasimilasi (Bilgrami dan Verma, 1994 dalam
11 Pada perlakuan fermentasi dengan bakteri B. megaterium kandungan protein pada kulit ubi kayu mengalami kenaikan sekitar 22% yaitu dari 9,79% sebelum difermentasi menjadi 11,92% sedangkan kandungan serat kasar mengalami penurunan sebesar 37% yaitu dari 8,04% turun menjadi 6,94% setelah difermentasi (Tabel 2). Peningkatan kandungan protein pada fermentasi kulit ubi kayu menggunakan B. megaterium diduga disebabkan adanya keseimbangan nutrien pada substrat dengan kebutuhan nutrien bakteri tersebut sehingga dapat tumbuh dengan baik pada substrat tersebut. B. megaterium dapat tumbuh pada substrat kulit ubi kayu dan menghasilkan enzim yang dapat mendegradasi senyawa kompleks menjadi lebih sederhana serta mensintesis protein sehingga dapat meningkatkan protein bahan (Busairi dan Wikanastri, 2009). B. megaterium
dapat memproduksi enzim selulase-xilanase yang mendegradasi selulosa dan hemiselulosa (Shindu et al., 2006) sehingga pada fermentasi kulit ubi kayu dengan B.megaterium terjadi penurunan kandungan serat kasar yang tinggi. Penurunan kandungan serat kasar pada perlakuan ini menyebabkan kandungan bahan ekstrak tanpa nitrogen (BETN) meningkat dari 73,22% menjadi 75,51% (Tabel 2). Proses fermentasi dapat meningkatkan kandungan energi dan protein, menurunkan kandungan sianida dan serat kasar, serta meningkatkan daya cerna bahan yang berkualitas rendah (Busairi dan Wikanastri, 2009).
Kecernaan ikan terhadap suatu pakan dapat dilihat dari kecernaan protein, kecernaan energi, dan kecernaan bahan. Pengujian kecernaan perlu dilakukan untuk mengetahui potensi kulit ubi kayu yang direkayasa menjadi bahan baku pakan ikan (Watanabe, 1988). Faktor yang mempengaruhi tingkat kecernaan ikan antara lain metode pengolahan pakan, stadia ikan, kualitas bahan, ukuran pakan, dan aktivitas ikan (Halver, 1989).
12 tersebut merupakan protein yang masih terikat pada dinding selulosa sehingga sulit untuk dicerna. Kulit ubi kayu yang direndam NaOH mengalami penurunan kandungan protein yang disebabkan oleh pencucian dengan air pada saat penetralan pH setelah perendaman dengan NaOH sehingga protein yang tersisa merupakan protein yang masih terikat pada dinding sel kulit ubi kayu. Nilai kecernaan protein yang paling tinggi terdapat pada perlakuan kulit ubi kayu yang difermentasi dengan gabungan kapang T. viride dan P. chrysosporium yaitu 79,30% (Tabel 4). Nilai kecernaan protein fermentasi kapang tersebut mengalami peningkatan sebesar 15%. Sedangkan pada pakan yang mengandung bahan kulit ubi kayu difermentasi bakteri mengalami peningkatan kecernaan protein sebesar 10%. Tingginya nilai kecernaan protein menunjukkan bahwa ikan nila mampu menyerap nutrien dalam pakan yang mengandung bahan kulit ubi kayu difermentasi kapang dengan baik. Kecernaan protein yang cukup tinggi pada perlakuan ini diduga disebabkan oleh penurunan zat anti nutrisi yang terdapat pada kulit ubi kayu akibat proses pencucian, penjemuran, dan pengukusan sebelum dilakukan fermentasi. Zat anti nutrisi yang terdapat pada kulit ubi kayu antara lain asam sianida dan asam fitat (Oboh, 2006) yang memiliki kemampuan mengikat mineral serta membentuk senyawa kompleks dengan protein dan asam amino dalam pakan sehingga akan sulit dicerna tubuh (Widowati et al., 2001). Zat anti nutrisi tersebut dapat diturunkan dengan proses fermentasi (Oboh, 2006) dan melalui pengeringan, pemotongan, perendaman dan pengukusan (Murni et al., 2008).
13 pakan (karbohidrat, protein, lemak) yang dapat diserap ikan ke dalam tubuhnya (Silva, 1989). Menurut Pandian (1989), ikan herbivor yang cenderung omnivor seperti ikan nila lebih mampu menyerap energi yang bukan berasal dari protein. Tingginya nilai kecernaan energi menunjukkan bahwa ikan nila mampu memanfaatkan energi dari nutrien pakan seperti karbohidrat.
Kecernaan bahan menunjukkan persentasi bahan yang dapat dimanfaatkan oleh ikan. Nilai kecernaan bahan kulit ubi kayu hasil rekayasa mengalami peningkatan cukup signifikan dari kontrol (P<0,05). Kulit ubi kayu yang direndam NaOH, fermentasi kapang dan fermentasi bakteri mengalami peningkatan kecernaan bahan sebesar 174%, 151%, dan 164% (Tabel 4). Ketiga perlakuan tersebut dapat merubah komponen struktur bahan seperti penurunan kandungan serat kasar sehingga bahan mudah dicerna.
Rekayasa kulit ubi kayu dengan perendaman NaOH 3%, fermentasi kapang (T.viride dan P. chrysosporium), dan fermentasi bakteri B.megaterium
dapat memperbaiki kecernaan kulit ubi kayu. Rekayasa dengan fermentasi kapang (T.viride dan P. chrysosporium) menunjukkan peningkatan kandungan protein dan nilai kecernaan yang terbaik sehingga dapat dijadikan bahan baku pakan ikan nila.
14
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Perendaman NaOH, fermentasi gabungan kapang Trichoderma viride dan
Phanerochaete crhrysosporium, serta fermentasi bakteri Bacillus. megaterium
dapat meningkatkan nilai kecernaan protein sebesar 5%, 15%, dan 10%, nilai kecernaan energi sebesar 20%, 18%, dan 16%, serta nilai kecernaan bahan sebesar 174%, 151%, dan 164% pada ikan nila. Kulit ubi kayu setelah difermentasi gabungan kapang (T. viride dan P. chrysosporium) menunjukkan hasil yang terbaik dengan kecrnaan protein 79,30%, sehingga berpotensi sebagai bahan baku pakan ikan.
4.2 Saran
Saran yang dapat diberikan dari penelitian ini adalah perlu dilakukan penelitian lanjutan mengenai jumlah kulit ubi kayu fermentasi gabungan kapang
T. viride dan P.chrysosporium yang dapat digunakan dalam formulasi pakan ikan nila agar dapat memberikan pertumbuhan, efisiensi pakan dan keuntungan yang optimal.
15
DAFTAR PUSTAKA
Arifin, Z. 1996. Optimasi aktivitas protease Bacillus megaterium dan
Micrococcus luteus hasil isolasi dari teripang (Holothuria sp.) dan cumi-cumi (Loligo sp) [Skripsi]. Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Badan Pusat Statistik. 2011. Tanaman Pangan. http://www.bps.go.id/tnmn_pgn. (18 Desember 2011)
Busairi A.M, Wikanastri H. 2009. Pengkayaan protein kulit umbi ubi kayu melalui proses fermentasi: optimasi nutrien substrat menggunakan
response surface methodology. Prosiding Seminar Nasional Teknik Kimia Indonesia.Bandung.
Gandjar I, Wellyzar S, Ariyanti O. 2006. Mikologi dasar dan terapan. Yayasan Obor Indonesia.
Gantiawan Y. 2002. Modifikasi proses pembuatan produk hidrolisat secara enzimatik [skripsi]. Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Halver, E.J. 1989. Fish nutrition. School of Fisheries., University of Washington Seattle, Academic Press. Inc, Washington, p:117.
Kirk, R.E, D.F. Othmer.1953. Encyclopedia of chemical technology. Volume XI. The Intererscience Publishing.Inc. New York.
Muhiddin N.H, Nuryati J, Nyoman P.A. 2000. Peningkatan kandungan kulit ubi kayu melalui proses fermentasi. JMS 1: 1-12.
Murni R., Suparjo, Akmal, Ginting B.L. 2008. Buku ajar teknologi pemanfaatan limbah untuk pakan. Laboratorium Makanan Ternak, Fakultas Peternakan, Universitas Jambi. Jambi.
[NRC] National Research Council. 1993. Nutrient requirement of fish. National Academy Press, Washington DC. 43-44.
Oboh G. 2006. Nutrient enrichment of Cassava peels using a mixed culture of
Saccharomyces cerevisae and Lactobacillus spp. solid media fermentation techniques.Biotechnology 9: 46-48.
Pandian T.J. 1989. Protein Requirement of fish and prawns cultured in Asia, p.11-19. In S.S. De Silva (ed.) Fish Nutrition Research in Asia. Proceedings of the Third Asian Fish Nutrition Network Meeting. Asian Fish. Soc. Spec. Pubhl.4, 166 p. Asian Fisheris Society. Manila. Philippines.
Pelczar MJ, ECS Chan, N.R Krieg.1986. Microbiology. McGrow Hill. New York
16 Silva D. 1989. Digestibility evaluations of natural and artificial diets, p. 36-45. In
S.S. De Silva (ed.) Fish Nutrition Research in Asia. Proceedings of the Third Asian Fish Nutrition network Meeting. Asian Fish. Soc. Spec. Pubhl.4, 166 p. Asian Fisheris Society, Manila, Philippines.
Shindu I, Sanjay C, Neena C, Prince S. 2006. Production of cellulase-Free xylanase from Bacillus megaterium by Solid state fermentation for biobleaching of pulp. Current Microboilogy 53(2); 167-172
Soetopo S, Endang RCC. 2008. Efektivitas proses pengomposan limbah sludge
ipal industri kertas dengan jamur. Berita Selulosa 43: 93-100.
Sukara, E. 1987. Biokonversi langsung tepung singkong menjadi gula oleh kapang Rhizopus melalui proses fermentasi substrat cair. Pusat Penelitian dan Pengembangan Bioteknologi Bogor. Prosiding Seminar Pasca Panen Pertanian. p:16-23
Suparjo K.G, Wiryawan E.B, Laconi, D. Mangunwidjaja. 2011. Performa kambing yang diberi kulit buah kakao terfermentasi. Media Peternakan 34: 35-41.
Suprayudi, M.A. 2010. Bahan baku lokal: Tantangan dan harapan akuakultur masa depan [abstrak]. Simposium Nasional Bioteknologi Akuakultur III. IPB Convention Center, Bogor, Oktober 2010. p: 31.
Takeuchi T. 1988. Laboratory work chemical evaluation of dietary nutriens. In: Fish fish nutrition and mariculture. Watanabe, T. Department of Aquatic Biosience. Tokyo University of Fisheries. JICA p:179-226
Tytler P., Calow P. 1985. Fish energetics new perspectives. Croom Helm: Sydney. p:100, 125-140
Watanabe T. 1988. Fish nutrition and mariculture. Department of Aquatic Biosience. Tokyo University of Fisheries. JICA. p:79-82.
Widowati, S, Andriani D, E.I.Riyanti, P. Raharto, L.Sukarno. 2001. Karakteristik fitase dari Bacillus Coagulans [abstrak].Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman, Bogor.
17
LAMPIRAN
18 Lampiran 1. Pembuatan pakan perlakuan untuk 1000 gram pakan
1. Pakan komersil dihaluskan hingga menjadi tepung (bubuk)
2. Bahan uji sebanyak 30% dari total pakan (300 gram) dicampurkan ke dalam 680 gram pakan komersil dan diaduk hingga rata
3. Sebanyak 5 gram Cr2O3 dan 15 gram binder (CMC) dicampurkan ke dalam
pakan, aduk merata.
4. Tambahkan air 600 ml air panas ke dalam adonan pakan. 5.Pakan dicetak sesuai ukuran kemudian dikeringkan.
Lampiran 2. Skema tata letak akuarium perlakuan
C1 D1 B3 A3 A2 B2 C3 E1 A1 D2 E2 E3
B1 D3 C2
Keterangan : A= pakan acuan, B= pakan kulit ubi kayu kontrol, C= pakan kulit ubi kayu NaOH, D pakan kulit ubi kayu kapang, E= pakan kulit ubi kayu bakteri, 1,2,3= ulangan ke-.
Lampiran 3. Prosedur analisis proksimat Lampiran 3.1 Prosedur analisis kadar air
Kadar air = (X1 + A)- X2 x 100% A
Cawan porselen dipanaskan pada suhu 105-110 0C selama 1 jam, dan kemudian didinginkan dalam desikator dan ditimbang (X1)
Bahan ditimbang 2-3 gram (A) lalu dimasukkan ke dalam cawan
Cawan dan bahan dipanaskan selama 6 jam pada suhu 105-110 0C, didinginkan dan ditimbang (X2)
19 Lampiran 3.2 Prosedur analisis kadar serat kasar
Kadar serat kasar = (X2-X1-X3) x 100%
A
Lampiran 3.3 Prosedur analisis kadar protein Tahap oksidasi
Bahan ditimbang 0,5 gram (A), lalu dimasukkan ke dalam erlenmeyer ukuran 250
50 ml H2SO4 0,3 N ditambahkan dalam
Erlenmeyer, lalu dipanaskan di atas
Setelah 30 menit ditambahkan 25 ml NaOH 1,5 N, lalu dipanaskan kembali selama
30menit
Larutan disaring dengan bahan pembilasan secara berurutan sebagai berikut:
1. 50 ml air panas 2. 50 ml H2SO4
3. 50 ml air panas 4. 25 ml aseton
Kertas saring dipanaskan dalam oven, dinginkan, dan ditimbang
Kertas saring hasil penyaringan dimasukkan ke dalam cawan porselen Cawan porselen dipanaskan
pada suhu 105-110 0C selama 1 jam lalu didinginkan
Dipanaskan pada suhu 105-110 0C selama 1 jam, didinginkan, dan ditimbang (X2)
Dipanaskan dalam tanur pada suhu 600 0C hingga berwarna putih, didinginkan, dan ditimbang (X3)
Kertas saring dipanaskan pada labu
Buchner yang telah terhubung dengan vacum pump
Dimasukkan ke dalam labu Kjeldahl dan dipanaskan hingga berwarna hijau bening, didinginkan, dan diencerkan hingga volume 100 ml
Bahan ditimbang 0,5 gram
20 Lanjutan Lampiran 3.3
Tahap Destruksi
Tahap Titrasi
Kadar protein = 0,0007* x (Vb-Vs) x F x 6,25** x 20 x 100%
A Keterangan :
Vb = ml 0,05 N titran NaOH untuk blanko Va = ml 0,05 N titran NaOH untuk sampel A = Bobot sampel (gram)
* = Setiap 0,05 NaOH ekivalen dengan 0,0007 gram N ** =Faktor Nitrogen
Lampiran 3.4 Prosedur analisis kadar abu
10 ml H2SO4 0,05 N 2-3 tetes indikator phenopthalein
Dimasukkan ke dalam Erlenmeyer 250
Destruksi selama 10 menit dari tetesan pertama 5 ml larutan hasil oksidasi
dimasukkan ke dalam labu destilasi
Sampel Blanko Hasil destruksi dititrasi dengan NaOH 0,05 N
Dititrasi hingga 1 tetes setelah larutan menjadi bening
ml titran dicatat (V)
Cawan dan bahan dipanaskan di dalam tanur dengan suhu 600 0C, didinginkan dan ditimbang (X2)
21 Kadar abu = (X2-X1) x 100%
A
Lampiran 3.5 Prosedur analisis kadar lemak
Kadar Lemak = X2-X1 x 100% A
Lampiran 4. Analisis Cr2O3
……… Didinginkan
………. Didinginkan
Labu dipanaskan pada suhu 104-110 0C selama 1 jam, kemudian didinginkan dalam desikator dan ditimbang (X1)
Bahan ditimbang 2-3 gram (A) lalu dimasukkan ke dalam selongsong
Dimasukkan ke dalam Soxhlet dan diberi 100-150 ml N-Hexan hingga selongsong terendam. Sisa N-Hexan dimasukkan ke dalam labu
Labu dipanaskan di atas hot plate hingga larutan perendam selongsong dalam Soxhlet berwarna bening
Labu dan lemak yang tersisa dipanaskan dalam oven selama 15 menit, didinginkan, lalu ditimbang (X2)
Bahan ditimbang 0,1 gram lalu dimasukkan ke dalam labu Kjehdahl
Ditambahkan 5 ml HNO3
Dipanaskan hingga larutan tersisa ±1 ml
Ditambahkan 3 ml HClO4
Dipanaskan kembali hingga berwarna jingga
Diencerkan hingga volume 100 ml
22 Persamaan hubungan Cr2O3 dengan absorbansi adalah sebagai berikut :
Keterangan : X = Cr2O3 (mg)
Y = nilai absorbansi
Lampiran 5.Analisa proksimat pakan acuan
Parameter Protein Lemak
Serat
Lampiran 6. Kecernaan protein pakan ikan nila Oreochromis niloticus
Perlakuan
Kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang Trichoderma viride dan Phanerochaete chrysosporium Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
Nilai yang tertera merupakan nilai rata-rata ± standar deviasi. Huruf superskrip yang sama pada baris yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05).
23 Lampiran 7. Kecernaan energi pakan ikan nila Oreochromis niloticus
Perlakuan
energi (%) rata-rata±sd
pakan
Kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang Trichoderma viride dan Phanerochaete chrysosporium Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
24 Lampiran 8. Kecernaan bahan pada pakan ikan nila Oreochromis niloticus
Pakan uji Ulangan kecernaan pakan
Kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang Trichoderma viride dan Phanerochaete chrysosporium Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
25 Lampiran 9. Hasil analisis statistik kecernaan protein pakan ikan nila Oreochromis
niloticus
Test of Homogeneity of Variances
Kecernaan protein
Levene Statistic df1 df2 Sig.
3,178 4 10 ,063
ANOVA Kecernaan protein
Sum of Squares df Mean Square F Sig.
Between Groups 298,920 4 74,730 9,497 ,002 Within Groups 78,689 10 7,869
Total 377,609 14
Kecernaan protein Duncan
Perlakuan N
Subset for alpha = 0,05
1 2 3
Kontrol 3 67,3833
NaoH 3 70,8167 70,8167
Bakteri 3 74,2700 74,2700
Komersil 3 78,1867
Kapang 3 79,3033
Sig. ,165 ,163 ,062
26 Lampiran 10. Hasil analisis statistik kecernaan energi pakan ikan nila Oreochromis
niloticus
Test of Homogeneity of Variances Kecernaan energi
Levene Statistic df1 df2 Sig.
4,267 4 10 ,029
ANOVA Kecernaan energi
Sum of Squares df Mean Square F Sig.
Between Groups 236,216 4 59,054 4,205 ,030
Within Groups 140,448 10 14,045
Total 376,664 14
Kecernaan energi Duncan
perlakuan N
Subset for alpha = 0,05
1 2
kontrol 3 55,0567
bakteri 3 63,6267
kapang 3 64,7000
komersil 3 65,1033
NaoH 3 65,8333
Sig. 1,000 ,516
27 Lampiran 11. Hasil analisis statistik kecernaan bahan pada pakan ikan nila
Oreochromis niloticus
Test of Homogeneity of Variances Kecernaan bahan
Levene Statistic df1 df2 Sig.
5,318 4 10 ,015
Kecernaan bahan Duncan
perlakuan N
Subset for alpha = 0,05
1 2
kontrol 3 22,5767
komersil 3 56,4567
Kapang 3 56,5700
Bakteri 3 59,6367
NaoH 3 61,9067
Sig. 1,000 ,695
Means for groups in homogeneous subsets are displayed. ANOVA Kecernaan bahan
Sum of Squares Df Mean Square F Sig. Between Groups 3183,935 4 795,984 3,320 ,056 Within Groups 2397,805 10 239,781
BAKU PAKAN IKAN NILA
Oreochromis niloticus
FERI KURNIAWATI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
FERI KURNIAWATI. Peningkatan Kecernaan Kulit Ubi Kayu
Manihot utilissima setelah Perendaman NaOH, Fermentasi Kapang, dan Fermentasi Bakteri sebagai Bahan Baku Pakan Ikan Nila Oreochromis niloticus. Dibimbing oleh MIA SETIAWATI dan MULYASARI.Penelitian ini bertujuan untuk mengetahui peningkatan kecernaan kulit ubi kayu (Manihot utilissima) setelah perendaman dengan NaOH 3% selama 3 hari, fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium) 10% selama 7 hari, dan fermentasi bakteri Bacillus megaterium 15% selama 5 hari sebagai bahan baku pakan ikan nila. Pakan uji kecernaan pada ikan nila dilakukan dengan mencampurkan 30% kulit ubi kayu dengan 70% pakan acuan. Ikan uji yang digunakan adalah ikan nila dengan bobot rata-rata 16,62±0,03 gram yang dipelihara selama 28 hari dengan kepadatan 10 ekor/akuarium. Pemberian pakan dilakukan dua kali sehari secara at satiation dan pengumpulan feses dimulai pada hari ke-6. Hasil menunjukkan bahwa perendaman NaOH 3%, fermentasi gabungan kapang, serta fermentasi bakteri memberikan pengaruh yang berbeda nyata terhadap kontrol (P<0,05) dan dapat meningkatkan nilai kecernaan protein berturut-turut sebesar 5%, 15%, dan 10%, nilai kecernaan energi sebesar 20%, 18%, dan 16%, serta nilai kecernaan bahan sebesar 174%, 151%, dan 164%. Perlakuan kulit ubi kayu yang difermentasi dengan kapang menunjukkan nilai kecernaan yang terbaik sehingga berpotensi sebagai bahan baku pakan ikan nila.
FERI KURNIAWATI. Digestibility Enhancement of Cassava Peel Manihot utilissima after Immersion in NaOH, Mold Fermentation, and Bacteria Fermentation as Feed Raw Material for Nile Tilapia Oreochromis niloticus. Supervised by MIA SETIAWATI and MULYASARI.
This research aimed to determine digestibility enhancement of cassava peel
Manihot utilissima after immersion in 3% NaOH for 3 days,10% combined mold fermentation Trichoderma viride and Phanerochaete chrysosporium for 7 days, and 15% fermentation of Bacillus megaterium for 5 days as feed raw material for Nile tilapia. Test diet of digestibility Nile tilapia was carried out by mixing 30% cassava peel with 70% reference diet. Nile tilapia was used as an object in this research with an average weight of 16,62±0,03 gram. The object was conditioned for 28 days with a density of 10 fish/aquarium. Feeding done twice a day with satiation and feces collection was began day of sixth. The result of this research showed that 3% NaOH immersion, combination of mold fermentation and bacteria fermentation gives a significantly different effect of control (P<0,05) and was improved about 5%, 15%, and 10% of protein digestibility, 20%, 18%, and 16% of energy digestibility, and 174%, 151%, and 164% of material digestibility. The treatment for cassava peel are 10% combined fermentation of mold showed the best of digestibility so potentially as feed raw material for Nile tilapia.
1
I. PENDAHULUAN
Ikan nila Oreochromis niloticus merupakan ikan ekonomis penting yang sudah terkenal di kalangan masyarakat karena memiliki rasa daging yang enak dan mudah didapatkan. Ikan ini banyak dibudidaya oleh petani karena mudah membudidayakan dan memasarkannya. Pakan merupakan salah satu komponen penting dalam kegiatan budidaya ikan yang intensif. Harga pakan akan mempengaruhi biaya produksi dan keuntungan yang diperoleh dari usaha budidaya. Oleh karena itu, dibutuhkan bahan baku pakan ikan yang murah dan lebih efisien. Beberapa kriteria yang harus dipertimbangkan dalam mencari bahan baku pakan ikan antara lain dapat memenuhi kebutuhan nutrisi ikan, memiliki kualitas baik, tersedia dalam jumlah besar dan berkelanjutan, tidak bersaing dengan kebutuhan manusia, dan harga relatif murah (Suprayudi, 2010). Salah satu bahan pakan yang memenuhi kriteria tersebut adalah kulit ubi kayu. Kulit ubi kayu merupakan limbah dari mata rantai proses produksi pembuatan tepung tapioka dan juga keripik. Produksi ubi kayu di Indonesia tercatat oleh Badan Pusat Statistik (2011) sebesar 22.039.145 ton pada tahun 2009 dan pada tahun 2010 sebesar 23.918.118 ton. Setiap kilogram ubi kayu dapat menghasilkan 15–20% kulit ubi (Muhiddin et al., 2000) sehingga apabila dibuang maka akan mencemari lingkungan. Kulit ubi kayu masih mengandung bahan-bahan organik seperti karbohidrat, protein, lemak, dan mineral. Berdasarkan hasil penelitian Busairi dan Wikanastri (2009) kulit ubi kayu mengandung kadar protein 1,03%, lemak 1,74%, dan karbohidrat 78,20%.
Namun demikian, kulit ubi kayu mengandung serat yang cukup tinggi sehingga apabila dijadikan bahan baku pakan ikan maka nilai kecernaannya rendah. Pada serat kasar terdapat ikatan antara lignin, selulosa, dan hemiselulosa yang merupakan faktor utama penyebab rendahnya kecernaan pakan (Murni et al.,
2008). Perbaikan kandungan nutrisi kulit ubi kayu dapat dilakukan dengan perlakuan fisik, kimia, dan biologi. Perlakuan alkali pada limbah berserat umumnya dapat merusak ikatan antara komponen dinding sel dan menyuplai mineral ensensial (Winugroho, 1986).
2 Kandungan protein pada kulit ubi kayu dapat ditingkatkan melalui proses fermentasi. Fermentasi merupakan aplikasi metabolisme mikroba untuk mengubah bahan baku menjadi produk yang bernilai lebih tinggi, seperti asam-asam organik, protein sel tunggal, antibiotika dan biopolimer (Muhiddin et al., 2000). Proses fermentasi dengan teknologi yang sesuai dapat menghasilkan produk protein. Berdasarkan faktor yang mempengaruhi pemilihan substrat untuk fermentasi, limbah kulit ubi kayu termasuk substrat yang baik karena mengandung karbohidrat yang tinggi, protein, lemak, dan mineral yang merupakan bahan dasar potensial untuk proses biokonversi mikroba. Fermentasi padat dengan substrat kulit ubi kayu dilakukan untuk meningkatkan kandungan protein dan mengurangi masalah limbah pertanian. Mikroorganisme yang berperan dalam proses fermentasi antara lain kapang Trichoderma viride,
Phanerochaete chrysosporium, dan bakteri Bacillus megaterium. Kapang selulolitik yang cukup baik memproduksi enzim selulolitik yang berfungsi mendegradasi selulosa adalah T. viride (Pelczar et al., 1986). Soetopo dan Endang (2008) dalam hasil penelitiannya menyebutkan bahwa salah satu jamur yang mampu mendegradasi lignin dan selulosa adalah P. chrysosporium. Bakteri B. megaterium dapat menghidrolisis pati dan mampu menggunakan sitrat sebagai satu-satunya sumber karbon dalam pertumbuhannya serta mampu mereduksi nitrat menjadi nitrit (Arifin, 1996).
3
II. BAHAN DAN METODE
2.1 Penyiapan Bahan Baku Pakan
Kulit ubi kayu sebagai bahan baku pakan diberi beberapa perlakuan. Perlakuan kulit ubi kayu tersebut adalah perendaman dengan NaOH, fermentasi gabungan kapang (Trichoderma viride dan Phanerochaete chrysosporium) dan fermentasi dengan bakteri Bacillus megaterium.
2.1.1 Perendaman Kulit Ubi Kayu dengan NaOH
Kulit ubi kayu yang telah bersih dan kering ditimbang sebanyak 5 kg. Kulit ubi kayu tersebut dimasukkan ke dalam wadah baskom dan diberi NaOH 3%. Kulit ubi kayu direndam dengan larutan NaOH 3% selama 3 hari. Setelah 3 hari, kulit ubi kayu tersebut dicuci hingga pH netral kemudian dijemur. Setelah kering, kulit ubi kayu dihaluskan. Tepung kulit ubi kayu dianalisis dan dibuat pakan sebanyak 300 gram.
2.1.2 Fermentasi Kulit Ubi Kayu dengan Gabungan Kapang Trichoderma viride dan Phanerochaete chrysosporium
Kulit ubi kayu yang telah bersih dan kering kemudian dihaluskan. Sebanyak 1 kg tepung kulit ubi kayu ditambahkan air 150% atau sekitar 1500 ml. Adonan tersebut dimasukkan ke dalam plastik yang diberi lubang kemudian dikukus selama 30 menit. Setelah 30 menit adonan diangkat dan didinginkan. Kulit ubi kayu tersebut dimasukkan kembali ke dalam wadah dan diberi inokulan gabungan kapang T. viride dan P. chrysosporium sebanyak 10%. Tepung kulit ubi kayu dan kapang yang telah tercampur merata dibungkus dalam plastik yang diberi lubang-lubang kecil dan diinkubasi selama 1 minggu. Hasil fermentasi tersebut dianalisis proksimat dan dibuat pakan sebanyak 300 gram.
2.1.3 Fermentasi Kulit Ubi Kayu dengan Bakteri Bacillus megaterium
Sebanyak 1 kg tepung kulit ubi kayu ditambahkan air 150% atau sekitar 1500 ml. Adonan tersebut dimasukkan ke dalam plastik yang diberi lubang kemudian dikukus selama 30 menit. Setelah itu, adonan diangkat dan dibiarkan dingin. Kulit ubi kayu tersebut dimasukkan kembali ke dalam wadah plastik dan
4 diberi inokulan B. megaterium sebanyak 15%. Tepung kulit ubi kayu dan bakteri yang telah tercampur merata ditutup dengan plastik yang diberi lubang-lubang kecil dan diinkubasi selama 5 hari. Setiap hari selama masa fermentasi adonan diaduk. Hasil fermentasi tersebut dianalisis proksimat dan dibuat pakan sebanyak 300 gram.
2.2 Pakan Uji Kecernaan
Pakan yang digunakan dalam uji kecernaan terdiri dari pakan acuan dan pakan campuran bahan uji dengan perbandingan 70% pakan acuan dan 30% bahan kulit ubi kayu. Kromium trioksida (Cr2O3) yang digunakan sebagai
penanda dalam uji kecernaan ditambahkan pada setiap pakan uji dan pakan acuan sebanyak 0,5% (NRC, 1993). Semua pakan perlakuan dibentuk dalam pelet kering kemudian dianalisis proksimat. Proses pembuatan pakan dapat dilihat pada Lampiran 1. Komposisi pakan acuan dan pakan uji ditunjukkan pada Tabel 1. Tabel 1. Komposisi pakan uji dan pakan acuan ikan nila Oreochromis niloticus
Proporsi bahan Perlakuan pakan Pakan acuan Kontrol NaOH Kapang Bakteri
Pakan komersial (%) 68 68 68 68 98
Bahan uji (%) 30 30 30 30 0
CMC (%) 1,5 1,5 1,5 1,5 1,5
Cr2O3 (%) 0,5 0,5 0,5 0,5 0,5
Total (%) 100 100 100 100 100
Keterangan : Kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium)
Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium CMC = Carboxil Metil Celulose
2.3 Pemeliharaan Ikan dan Pengumpulan Data
5 Perlakuan pakan disusun dengan menggunakan metode rancangan acak lengkap. Skema tata letak akuarium dapat dilihat pada Lampiran 2. Pakan diberikan dua kali sehari yaitu pukul 09.00 dan 15.00 WIB. Pakan diberikan secara at satiation. Kegiatan harian yang dilakukan adalah pengukuran suhu, pemberian pakan dan pengumpulan feses. Pengukuran kecernaan dilakukan dengan mengumpulkan feses ikan dan dianalisis pada akhir pemeliharaan. Pengumpulan feses dilakukan lima hari setelah pemberian pakan perlakuan (Silva, 1989).
2.4 Analisis Kimia
Analisis proksimat yang dilakukan meliputi pengukuran kadar air, protein, lemak, abu, serat kasar, dan BETN. Pengukuran kadar air dengan melakukan pemanasan bahan di dalam oven pada suhu 100⁰C selama 6 jam, kadar protein
dihitung menggunakan metode Kjeldahl sedangkan lemak kering dan abu masing-masing diukur dengan metode Soxchlet dan pemanasan di dalam tanur 600⁰C,
serat kasar diukur dengan pelarutan sampel dengan asam dan basa kuat (Takeuchi, 1988). Metode analisis proksimat dapat dilihat pada Lampiran 3.
Analisis kecernaan dilakukan dengan pengukuran kromium (Cr2O3) pakan
dan feses ikan melalui pemanasan bahan dengan asam kuat (HNO3) dan (HCLO4)
kemudian dilakukan pembacaan absorban pada spektrofotometer dengan panjang gelombang 350 nm (Lied et al., 1982 dalam Tytler & Calow, 1985). Metode analisis Cr2O3 dapat dilihat pada Lampiran 4 (Takeuchi, 1988).
2.5 Analisis data
Penelitian ini menggunakan rancangan acak lengkap dengan lima perlakuan dan tiga ulangan. Data kecernaan protein, kecernaan energi dan kecernaan bahan pakan pada penelitian ini diolah menggunakan SPSS 16 serta uji lanjut menggunakan uji Duncan.
2.6 Kecernaan
Parameter kecernaan yang dihitung berdasarkan Watanabe (1988) dan NRC (1993) adalah sebagai berikut:
6 Energi tercerna kkal/100g pakan = Energi pakan – (Energi feses x n/n’) Kecernaan energi (%) = [Energi tercerna/Energi pakan] x 100% Kecernaan bahan (%) = (ADT-0,7AD)/0,3
Keterangan : a = % Cr2O3 dalam pakan
a’ = % Cr2O3 dalam feses
b = % protein dalam pakan b’ = % protein dalam feses n = mg Cr2O3/gram pakan
n’ = mg Cr2O3/gram feses
7
III. HASIL DAN PEMBAHASAN
3.1 Hasil
Pakan yang telah dibuat dianalisis untuk mengetahui komposisi proksimat pakan tersebut. Hasil analisis proksimat bahan dan pakan uji kulit ubi kayu terdapat pada Tabel 2 dan Tabel 3.
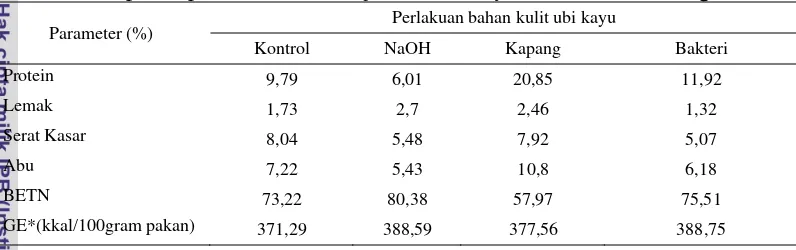
Tabel 2. Komposisi proksimat bahan uji kulit ubi kayu dalam bobot kering
Parameter (%) Perlakuan bahan kulit ubi kayu
Kontrol NaOH Kapang Bakteri
Protein 9,79 6,01 20,85 11,92
Lemak 1,73 2,7 2,46 1,32
Serat Kasar 8,04 5,48 7,92 5,07
Abu 7,22 5,43 10,8 6,18
BETN 73,22 80,38 57,97 75,51
GE*(kkal/100gram pakan) 371,29 388,59 377,56 388,75
Keterangan :
Kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium) Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
BETN = Bahan Ekstrak Tanpa Nitrogen *GE = Gross Energy
1 gram protein = 5,6 kkal GE 1 gram karbohidrat/BETN = 4,1 kkal GE
1 gram lemak = 9,4 kkal GE (Watanabe, 1988)
Tabel 3. Komposisi proksimat pakan uji ikan nila Oreochromis niloticus dalam bobot kering
Parameter (%) Perlakuan pakan kulit ubi kayu
Kontrol NaOH Kapang Bakteri
Protein 22,37 20,92 24,51 22,48
Lemak 5,47 5,39 5,11 6,20
Serat kasar 4,71 4,68 4,92 5,11
Kadar abu 10,60 9,95 11,55 10,41
BETN 43,15 40,94 46,09 44,20
GE* (kkal/100gram pakan) 353,605 335,672 374,259 365,388 Keterangan :
kontrol = kulit ubi kayu tanpa rekayasa NaOH = kulit ubi kayu direndam NaOH 3%
Kapang = kulit ubi kayu fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium) Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
BETN = Bahan Ekstrak Tanpa Nitrogen *GE = Gross Energy
1 gram protein = 5,6 kkal GE 1 gram karbohidrat/BETN = 4,1 kkal GE
1 gram lemak = 9,4 kkal GE (Watanabe, 1988)
8 Berdasarkan hasil proksimat komposisi bahan uji kulit ubi kayu (Tabel 2) diketahui bahwa kandungan protein tertinggi terdapat pada perlakuan kulit ubi kayu dengan fermentasi gabungan kapang T. viride dan P. Chrysosporium
20,85%. Nilai protein pada perlakuan fermentasi dengan bakteri B. megaterium
mengalami peningkatan dibandingkan nilai protein kontrol yaitu dari 9,79% menjadi 11,92%. Sebaliknya, pada perlakuan kulit ubi kayu dengan NaOH kandungan protein mengalami penurunan menjadi 6,01%. Kandungan serat kasar pada semua perlakuan mengalami penurunan. Pada Tabel 3 hasil proksimat komposisi pakan yang mengandung perlakuan kulit ubi kayu dalam jumlah yang sama yaitu 30%, memiliki nilai nutrien yang berbanding lurus dengan hasil proksimat bahan kulit ubi kayu yang direkayasa.
Kecernaan menunjukkan besarnya nutrien dalam pakan yang dapat diserap oleh tubuh ikan. Kulit ubi kayu yang direndam NaOH, difermentasi gabungan kapang T. viride dan P. crhysosporium, serta difermentasi bakteri B. megaterium
memberikan pengaruh terhadap nilai kecernaan. Nilai kecernaan protein, kecernaan energi, dan kecernaan bahan pakan pada ikan nila Oreochromis niloticus dapat dilihat pada Tabel 4.
Tabel 4. Kecernaan protein, energi, dan bahan pakan uji kulit ubi kayu pada ikan nila Oreochromis niloticus
Parameter
Perlakuan kulit ubi kayu
Kontrol NaOH Kapang Bakteri
Kapang = kulit ubi kayu fermentasi kapang (Trichoderma viride dan Phanerochaete chrysosporium) Bakteri = kulit ubi kayu fermentasi bakteri Bacillus megaterium
Nilai yang tertera merupakan nilai rata-rata ± standar deviasi. Huruf superskrip yang sama pada baris yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05).
9 kulit ubi kayu direndam NaOH tidak berbeda nyata dengan pakan yang mengandung kulit ubi kayu difermentasi bakteri dan pakan yang mengandung kulit ubi kayu kontrol (P>0,05). Nilai kecernaan energi dan kecernaan bahan pada pakan yang mengandung kulit ubi kayu direndam NaOH, difermentasi kapang, serta difermentasi bakteri menunjukkan hasil yang lebih tinggi dibandingkan pakan yang mengandung bahan kulit ubi kayu kontrol (P<0,05).
3.2 Pembahasan
Berdasarkan hasil rekayasa bahan kulit ubi kayu, pada perlakuan perendaman kulit ubi kayu dengan NaOH, kandungan protein mengalami penurunan sebesar 38% yaitu dari 9,79% menjadi 6,01% (Tabel 2). Penurunan kandungan protein pada kulit ubi kayu diduga disebabkan proses hidrolisis oleh NaOH yang meyebabkan molekul protein yang besar berubah menjadi lebih sederhana. Pencucian kulit ubi kayu dapat meyebabkan protein yang berukuran kecil terbawa oleh air. Hidrolisis protein dapat terjadi bila protein direndam asam, alkali kuat, atau dengan penggunaan enzim yang akan disertai dengan pembebasan asam amino penyusun molekul protein (Kirk dan Othmer, 1953). Protein akan terpisah menjadi beberapa asam amino bila dihidrolisis, namun ada beberapa protein terlepas menjadi asam amino dan masih tetap membentuk molekul-molekul protein yang berikatan (West dan Todd, 1964 dalam Gantiawan, 2002). Pada dinding sel tanaman terdapat serat kasar yang terdiri dari ikatan lignin, selulosa, dan hemiselulosa. Kandungan serat kasar pada perlakuan ini mengalami penurunan sekitar 32% yaitu dari 8,04% menjadi 5,48%. Penurunan kandungan serat kasar ini menyebabkan kandungan bahan ekstrak tanpa nitrogen (BETN) kulit ubi kayu meningkat dari 73,22% menjadi 80,38% (Tabel 2). Hal ini disebabkan oleh pengaruh perendaman kulit ubi kayu dengan NaOH sehingga ikatan kuat lignin pada dinding sel terurai menjadi bahan yang mudah dicerna. Perlakuan alkali seperti NaOH pada limbah berserat umumnya dapat merusak ikatan antara komponen dinding sel (Winugroho, 1986).
10 20,85% (Tabel 2). Mikroba yang digunakan dalam proses fermentasi padat dapat menghasilkan enzim yang akan mendegradasi senyawa-senyawa kompleks menjadi lebih sederhana dan mensintesis protein sehingga protein bahan meningkat (Busairi dan Wikanastri, 2009). Hal ini sesuai dengan penelitian Sukara (1987) yang membuktikan bahwa fermentasi singkong dengan T. viride
dapat meningkatkan protein sampai 20,5%. Fermentasi dengan P.crhrysosporium
dapat meningkatkan kandungan protein kasar kulit buah kakao 8,69% menjadi 13,84% (Suparjo et al., 2011). Selain itu, peningkatan nutrien dalam kulit ubi kayu diduga terdapat keseimbangan antara komposisi substrat dan nutrien yang dibutuhkan untuk hidup kapang sehingga massa kapang yang tumbuh semakin banyak. Peningkatan kandungan protein bahan merupakan refleksi jumlah massa sel (Muhiddin et al., 2000). Busairi dan Wikanastri (2009) menyatakan kulit ubi kayu mengandung bahan-bahan organik seperti karbohidrat, protein, lemak, dan mineral. Bahan-bahan organik tersebut dapat digunakan sebagai bahan dasar potensial untuk proses biokonversi oleh mikroba, antara lain dengan memanfaatkan kulit ubi kayu sebagai substrat pertumbuhan mikroba untuk memproduksi protein sel tunggal melalui proses fermentasi. Kapang bergantung kepada karbohidrat kompleks seperti oligosakarida sebagai nutrien. Karbohidrat kompleks tersebut diuraikan menjadi monosakarida dengan enzim ekstraseluler kemudian diserap kapang untuk diasimilasi (Bilgrami dan Verma, 1994 dalam
11 Pada perlakuan fermentasi dengan bakteri B. megaterium kandungan protein pada kulit ubi kayu mengalami kenaikan sekitar 22% yaitu dari 9,79% sebelum difermentasi menjadi 11,92% sedangkan kandungan serat kasar mengalami penurunan sebesar 37% yaitu dari 8,04% turun menjadi 6,94% setelah difermentasi (Tabel 2). Peningkatan kandungan protein pada fermentasi kulit ubi kayu menggunakan B. megaterium diduga disebabkan adanya keseimbangan nutrien pada substrat dengan kebutuhan nutrien bakteri tersebut sehingga dapat tumbuh dengan baik pada substrat tersebut. B. megaterium dapat tumbuh pada substrat kulit ubi kayu dan menghasilkan enzim yang dapat mendegradasi senyawa kompleks menjadi lebih sederhana serta mensintesis protein sehingga dapat meningkatkan protein bahan (Busairi dan Wikanastri, 2009). B. megaterium
dapat memproduksi enzim selulase-xilanase yang mendegradasi selulosa dan hemiselulosa (Shindu et al., 2006) sehingga pada fermentasi kulit ubi kayu dengan B.megaterium terjadi penurunan kandungan serat kasar yang tinggi. Penurunan kandungan serat kasar pada perlakuan ini menyebabkan kandungan bahan ekstrak tanpa nitrogen (BETN) meningkat dari 73,22% menjadi 75,51% (Tabel 2). Proses fermentasi dapat meningkatkan kandungan energi dan protein, menurunkan kandungan sianida dan serat kasar, serta meningkatkan daya cerna bahan yang berkualitas rendah (Busairi dan Wikanastri, 2009).
Kecernaan ikan terhadap suatu pakan dapat dilihat dari kecernaan protein, kecernaan energi, dan kecernaan bahan. Pengujian kecernaan perlu dilakukan untuk mengetahui potensi kulit ubi kayu yang direkayasa menjadi bahan baku pakan ikan (Watanabe, 1988). Faktor yang mempengaruhi tingkat kecernaan ikan antara lain metode pengolahan pakan, stadia ikan, kualitas bahan, ukuran pakan, dan aktivitas ikan (Halver, 1989).
12 tersebut merupakan protein yang masih terikat pada dinding selulosa sehingga sulit untuk dicerna. Kulit ubi kayu yang direndam NaOH mengalami penurunan kandungan protein yang disebabkan oleh pencucian dengan air pada saat penetralan pH setelah perendaman dengan NaOH sehingga protein yang tersisa merupakan protein yang masih terikat pada dinding sel kulit ubi kayu. Nilai kecernaan protein yang paling tinggi terdapat pada perlakuan kulit ubi kayu yang difermentasi dengan gabungan kapang T. viride dan P. chrysosporium yaitu 79,30% (Tabel 4). Nilai kecernaan protein fermentasi kapang tersebut mengalami peningkatan sebesar 15%. Sedangkan pada pakan yang mengandung bahan kulit ubi kayu difermentasi bakteri mengalami peningkatan kecernaan protein sebesar 10%. Tingginya nilai kecernaan protein menunjukkan bahwa ikan nila mampu menyerap nutrien dalam pakan yang mengandung bahan kulit ubi kayu difermentasi kapang dengan baik. Kecernaan protein yang cukup tinggi pada perlakuan ini diduga disebabkan oleh penurunan zat anti nutrisi yang terdapat pada kulit ubi kayu akibat proses pencucian, penjemuran, dan pengukusan sebelum dilakukan fermentasi. Zat anti nutrisi yang terdapat pada kulit ubi kayu antara lain asam sianida dan asam fitat (Oboh, 2006) yang memiliki kemampuan mengikat mineral serta membentuk senyawa kompleks dengan protein dan asam amino dalam pakan sehingga akan sulit dicerna tubuh (Widowati et al., 2001). Zat anti nutrisi tersebut dapat diturunkan dengan proses fermentasi (Oboh, 2006) dan melalui pengeringan, pemotongan, perendaman dan pengukusan (Murni et al., 2008).
13 pakan (karbohidrat, protein, lemak) yang dapat diserap ikan ke dalam tubuhnya (Silva, 1989). Menurut Pandian (1989), ikan herbivor yang cenderung omnivor seperti ikan nila lebih mampu menyerap energi yang bukan berasal dari protein. Tingginya nilai kecernaan energi menunjukkan bahwa ikan nila mampu memanfaatkan energi dari nutrien pakan seperti karbohidrat.
Kecernaan bahan menunjukkan persentasi bahan yang dapat dimanfaatkan oleh ikan. Nilai kecernaan bahan kulit ubi kayu hasil rekayasa mengalami peningkatan cukup signifikan dari kontrol (P<0,05). Kulit ubi kayu yang direndam NaOH, fermentasi kapang dan fermentasi bakteri mengalami peningkatan kecernaan bahan sebesar 174%, 151%, dan 164% (Tabel 4). Ketiga perlakuan tersebut dapat merubah komponen struktur bahan seperti penurunan kandungan serat kasar sehingga bahan mudah dicerna.
Rekayasa kulit ubi kayu dengan perendaman NaOH 3%, fermentasi kapang (T.viride dan P. chrysosporium), dan fermentasi bakteri B.megaterium
dapat memperbaiki kecernaan kulit ubi kayu. Rekayasa dengan fermentasi kapang (T.viride dan P. chrysosporium) menunjukkan peningkatan kandungan protein dan nilai kecernaan yang terbaik sehingga dapat dijadikan bahan baku pakan ikan nila.