EKSPLORASI BAKTERI DAN CENDAWAN ENDOFIT
SEBAGAI AGENS PENGENDALI PENYAKIT BLAS
(
Pyricularia oryzae
) PADA PADI SAWAH
IRWANTO SUCIPTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Eksplorasi Bakteri dan Cendawan Endofit Sebagai Agens Pengendali Penyakit Blas (Pyricularia oryzae) pada Padi Sawah adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Irwanto Sucipto
NRP A352130121
*Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak
RINGKASAN
IRWANTO SUCIPTO. Eksplorasi Bakteri dan Cendawan Endofit Sebagai Agens Pengendali Penyakit Blas (Pyricularia oryzae) pada Padi Sawah. Dibimbing oleh ABDUL MUNIF dan EFI TODING TONDOK.
Penyakit blas awalnya merupakan masalah utama pada pertanaman padi gogo di Indonesia namun saat ini juga telah menjadi masalah pada pertanaman padi sawah. Informasi terkait penggunaan bakteri dan cendawan endofit sebagai pengendali penyakit blas pada padi khususnya padi sawah masih sangat terbatas. Penelitian ini bertujuan untuk mendapatkan bakteri dan cendawan endofit sebagai pengendali penyakit blas. Penelitian ini terdiri atas 5 tahapan, yaitu 1) eksplorasi bakteri dan cendawan endofit dari tanaman padi, 2) seleksi bakteri dan cendawan endofit, 3) uji penghambatan bakteri dan cendawan endofit terhadap pertumbuhan P. oryzae, 4) uji penghambatan pertumbuhan P. oryzae di rumah kaca, 5) identifikasi bakteri dan cendawan endofit. Isolasi bakteri dan cendawan endofit menggunakan sterilisasi permukaan bertingkat dengan alkohol 70 % selama 0.5 menit kemudian dilanjutkan merendam sampel pada NaOCl 1 % selama 1 menit. Isolasi bakteri endofit dilanjutkan dengan menghancurkan bagian tanaman tersebut dengan mortar steril sampai halus dengan penambahan air 1:10. Sebanyak 0.1 ml diambil dari masing-masing suspensi daun, akar dan batang tersebut kemudian ratakan pada media tryptic soy agar (TSA) 20 %. Isolasi cendawan endofit dilakukan dengan meletakkan sampel pada media malt extract agar (MEA) 10% tanpa digerus dan diinkubasi selama 7 hari. Seleksi bakteri endofit dilakukan melalui 3 tahap yaitu pengujian reaksi hipersensitif (HR/hypersensitive reaction) terhadap tanaman tembakau, pengujian terhadap pertumbuhan benih padi (DPM/direct planting method) dan pengujian aktivitas hemolisis bakteri. Seleksi cendawan endofit dilakukan dengan pengujian cendawan endofit terhadap perkecambahan dan perkembangan benih padi. Uji penghambatan bakteri dan cendawan endofit terhadap pertumbuhan P. oryzae secara in vitro di lakukan untuk melihat kemampuan antibiosis pada bakteri dan cendawan endofit. Empat isolat bakteri dan cendawan endofit terbaik diambil untuk dilakukan uji penghambatan pertumbuhan P. oryzae di rumah kaca. Masing-masing isolat yang digunakan di rumah kaca diidentifikasi lebih lanjut.
Hasil perlakuan inokulasi bakteri dan cendawan endofit pada tanaman padi di rumah kaca menunjukkan adanya hubungan yang sesuai mulai dari hasil uji in vitro,
in vivo sampai hasil pengamatan pada pertumbuhan tanaman padi. Selain dapat menekan pertumbuhan penyakit blas di rumah kaca, perlakuan isolat EB9 dan CEA5 menunjukkan adanya pengaruh positif terhadap semua parameter pertumbuhan (tinggi tajuk, panjang akar, dan bobot biomassa) dibandingkan kontrol. Isolat bakteri endofit yang telah diuji memiliki homologi tertinggi dengan
Burkholderia sp. Hu35C, Burkholderia sp. WP1, B. gladioli strain IHB B 15121,
B. cepacia strain CH9, sedangkan isolat cendawan endofit yang telah diuji teridentifikasi sebagai Fusarium sp, Cladosporium sp, Phoma sp, Penicillium sp, berturut-turut untuk isolat EB 1, EB 9, EB 28, EA 35, CEA 5, CEA 3, CEB 3, dan CED 2.
SUMMARY
IRWANTO SUCIPTO. Exploration of Endophytic Bacteria and Fungi as Biocontrol Agent of Blast Disease (Pyricularia oryzae) on Rice. Supervised by ABDUL MUNIF and EFI TODING TONDOK.
Blast disease initially was the main problem in upland rice productivity in Indonesia but now also has been the main problem on lowland rice. Information related the use of endophytic bacteria and fungi for controlling blast disease in rice was still very limited. The objective of this research was to obtain endophytic bacteria and fungi as blast disease control was very important. This research consisted of 5 stages, namely 1) exploration of endophytic bacteria and fungi from rice, 2) selection of endophytic bacteria and fungi, 3) inhibition test of endophytic bacteria and fungi against P. oryzae growth, 4) inhibition test of blast disease in greenhouse 5) identification of endophytic bacteria and fungi. Isolation of endophytic bacteria and fungi using two steps of surface sterilization with alcohol 70 % for 0.5 minutes continued soaked the samples in NaOCl 1 % for 1 minute. Isolation endophytic bacteria followed by crush the samples with sterile mortar with the addition of water 1:10. As many as 0.1 ml taken from each suspension of leaves, roots and stems then plated on tryptic soy agar media (TSA) 20 %. Isolation of endophytic fungi was done by inoculating the samples to Malt extract agar media (MEA) 10 % without crushed and incubated for 7 days. Selection of endophytic bacteria was done through three assays, namely hypersensitive reaction test (HR) on tobacco plants, test on the growth of rice seed (DPM/ direct planting method) and testing of bacteria hemolysis activity. Selection of endophytic fungi was done by testing endophytic fungi against germination and development of rice seed. Inhibition test of endophytic bacteria and fungi on the growth of P. oryzae in vitro was aimed to see the antibiosis ability of endophytic bacteria and fungi. The best four isolates endophytic bacteria and fungi was taken to continue inhibition test of
P. oryzae in the greenhouse. Each isolates used in greenhouse was identified further. Endophytic bacteria and fungi which succeeded isolated were 162 isolates consisted of 115 endophytic bacteria and 47 endophytic fungi. Based on the results of the pathogenicity test and the potential as plant growth promoting rhizobacteria (PGPR) and plant growth promoting of fungi (PGPF), 19 endophytic bacteria and 14 endophytic fungi was used on in vitro test. Four isolates endophytic bacteria and 4 isolates endophytic fungi which have a highest antibiosis activity was continued on inhibition test of blast disease on rice, Kencana Bali varieties. Endophytic bacteria and fungi shown antibiosis mechanism, proved by clear zone between pathogen and endophytic microbe. In vivo test has shown that application of endophytic microbes were able to suppress severity of blas disease in rice to the level of emphasis disease of 30-70 %. The most stable of disease emphasis from the beginning observation until to the end of observation was showed by EB9 and CEA5 isolates.
control. Endophytic bacteria isolates tested have highest homology with
Burkholderia sp. Hu35C, Burkholderia sp. WP1, B. gladioli strain IHB B 15121,
B. cepacia strain CH9, while endophytic fungi isolates that has been tested identified as Fusarium sp, Cladosporium sp, Phoma sp, Penicillium sp, in succession for EB 1, EB 9, EB 28, EA 35, CEA 5, CEA 3, CEB 3, and CED 2.
© Hak Cipta Milik IPB, Tahun 2014 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
EKSPLORASI BAKTERI DAN CENDAWAN ENDOFIT
SEBAGAI AGENS PENGENDALI PENYAKIT BLAS
(
Pyricularia oryzae
) PADA PADI SAWAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Eksplorasi Bakteri dan Cendawan Endofit Sebagai Agens Pengendali Penyakit Blas (Pyricularia oryzae) pada Padi Sawah Nama : Irwanto Sucipto
NIM : A352130121
Disetujui oleh
Komisi Pembimbing
Dr Ir Abdul Munif, MSc Agr. Ketua
Dr Efi Toding Tondok, SP MSc. Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Prof Dr Ir Sri Hendrastuti Hidayat, MSc.
Tanggal Ujian: 30 Oktober 2015
Dekan Sekolah Pascasarjana
Dr IrDahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah dengan judul “Eksplorasi Bakteri dan Cendawan Endofit Sebagai Agens Pengendali Penyakit Blas (Pyricularia oryzae) pada Padi Sawah” dapat diselesaikan.
Terima kasih penulis ucapkan kepada Dr Ir Abdul Munif, MSc Agr, Dr Efi Toding Tondok, SP MSc selaku komisi pembimbing dan Ir Yadi Suryadi MSc selaku pembimbing lapangan yang telah memberikan petunjuk, saran dan motivasi bagi penulis baik dalam proses penelitian maupun penulisan karya ilmiah ini serta Dr. Ir. Kikin Hamzah Mutaqin M.Si selaku penguji luar komisi yang telah memberikan saran demi perbaikan penulisan karya ilmiah ini. Ucapan terima kasih juga penulis sampaikan kepada Kepala Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian yang telah memberikan izin
penggunaan Laboratorium Mikrobiologi dan rumah kaca “Moisture chamber for blast disease”. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, dan seluruh keluarga atas segala doa dan kasih sayangnya serta teman-teman departemen Proteksi Tanaman atas dukungannya dalam penyelesaian karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
Uji Penghambatan Pertumbuhan Pyricularia oryzae oleh Bakteri dan Cendawan Endofit
Uji Penghambatan Penyakit Blas pada Padi Sawah
Pengaruh Bakteri dan Cendawan Endofit terhadap Pertumbuhan Tanaman Padi
Identifikasi dan Karakterisasi Bakteri Endofit Identifikasi dan Karakterisasi Cendawan Endofit
Uji Kemampuan Bakteri dan Cendawan Endofit Mengolonisasi Tanaman Padi
HASIL DAN PEMBAHASAN
Kelimpahan Bakteri dan Cendawan Endofit Asal Tanaman Padi Patogenesitas Bakteri Endofit
Aktivitas Hemolisis Bakteri Patogenesitas Cendawan Endofit
Penghambatan Pertumbuhan Pyricularia oryzae oleh Bakteri dan Cendawan Endofit
Penghambatan Penyakit Blas pada Padi Sawah
Pengaruh Bakteri dan Cendawan Endofit terhadap Pertumbuhan Tanaman Padi
Identifikasi Bakteri Endofit Berdasarkan Analisis Genotipik Karakterisasi Bakteri Endofit
Identifikasi Cendawan Endofit Berdasarkan Analisis Morfologi Karakterisasi Cendawan Endofit
Kemampuan Bakteri dan Cendawan Endofit Mengolonisasi Tanaman Padi
SIMPULAN DAN SARAN Simpulan
Saran
DAFTAR PUSTAKA LAMPIRAN
RIWAYAT HIDUP
26
28 29 30 35 35
DAFTAR TABEL
1 Perbandingan karakteristik dari cendawan endofit
2 Klasifikasi cendawan endofit berdasarkan transmisi dan interaksi ekologi 3 Skala (skor) pengukuran keparahan penyakit blas
4 Jumlah isolat bakteri endofit asal tanaman padi dari beberapa daerah 5 Jumlah isolat cendawan endofit asal tanaman padi dari beberapa daerah 6 Hasil pengujian aktivitas hemolisis bakteri endofit pada agar darah 7 Pengaruh bakteri endofit terhadap pertumbuhan P. oryzae in vitro
8 Pengaruh cendawan endofit terhadap pertumbuhan P. oryzae in vitro
9 Pengaruh mikroba endofit terhadap respon pertumbuhan tanaman 10 Hasil karakterisasi bakteri endofit
11 Hasil karakterisasi isolat cendawan endofit
9
1 Fase interaksi kolonisasi bakteri endofit pada permukaan akar (Hallmann 2001)
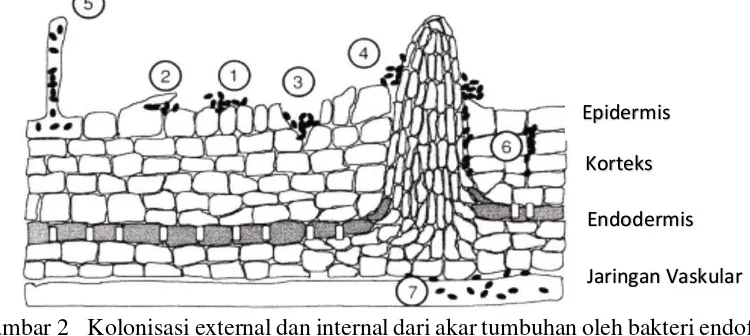
2 Kolonisasi external dan internal dari akar tumbuhan oleh bakteri endofit dapat terjadi secara: 1) acak di atas permukaan akar, 2) dibawah sel epidermis yang rusak, 3) berasosiasi dengan luka tumbuhan, 4) pada tempat pembentukan akar lateral, 5) secara intraseluler di sel epidermis akar termasuk rambut akar, 6) secara interseluler di dalam korteks akar atau 7) berasosiasi dengan jaringan vaskuler (Hallmann 2001)
3 Skema uji antagonis dari bakteri endofit terhadap P. oryzae secara in vitro
4 Skema uji antagonis dari bakteri endofit terhadap P. oryzae secara in vitro (a) perlakuan endofit, (b) perlakuan kontrol
5 Uji antagonis bakteri endofit (a) tidak memiliki zona hambat (b) memiliki zona hambat
6 Uji antagonis cendawan endofit (a) tidak memiliki zona hambat (b) memiliki zona hambat (c) P. oryzae tertekan oleh mekanisme kompetisi 7 Pengaruh mikroba endofit terhadap intensitas penyakit blas pada padi
varietas Kencana Bali di rumah kaca
8 Gejala penyakit blas pada tanaman padi: gejala awal blas daun (skor 1-3), b) gejala blas daun untuk perlakuan kontrol (skor 4-6), c) gejala blas daun untuk perlakuan kontrol (skor 7-9), d) dan e) gejala blas node untuk perlakuan kontrol
9 Bobot basah dan bobot kering tanaman padi setelah perlakuan mikroba endofit
10 Hasil amplifikasi gen 16S rRNA bakteri endofit asal tanaman padi menggunakan primer universal prokariota 27F/1492R. Marker 1kb DNA Ladder, (1) EB 1, (2) EB 6, (3) EB 7, (4) EB 9
11 Hasil identifikasi morfologi isolat cendawan endofit
DAFTAR LAMPIRAN
1 Hasil positif uji hipersensitif pada tanaman tembakau
2 Metode penanaman benih pada biakan bakteri: (a) gejala nekrotik pada kecambah, (b) pertumbuhan normal dari kecambah
3 Hasil positif uji aktivitas hemolisis bakteri pada agar darah
4 Hasil uji patogenesitas cendawan endofit: (a) gejala nekrotik pada kecambah, (b) pertumbuhan normal dari kecambah
5 Pertumbuhan tinggi tanaman padi pada beberapa perlakuan: A) Kontrol, B) EB 1, C) EB 9, D) EB 28, E) EA 35, F) CEA 3, G) CEA 5, H) CED 2, I) CEB 3
6 Pertumbuhan tanaman padi mulai dari akar sampai tinggi tajuk pada beberapa perlakuan: A) Kontrol, B) EB 1, C) EB 9, D) EB 28, E) EA 35, F) CEA 3, G) CEA 5, H) CED 2, I) CEB 3
7 Karakterisasi bakteri endofit (a) Reaksi positif pada uji Gram dengan KOH 3%, (b) Reaksi negatif pada uji Gram dengan KOH 3%, (c) Reaksi positif pada uji katalase dengan substrat H2O2, (d) Reaksi negatif pada uji katalase dengan substrat H2O2, (e) Reaksi positif pada uji kitinolitik, (f) Reaksi negatif pada uji kitinolitik, (g) Reaksi positif pada uji lipolitik, (h) Reaksi negatif pada uji lipolitik, (i) (j) Reaksi negatif pada media
King’s B, (k) (l) Reaksi negatif pada media YDCA
8 Analisis sikuen gen 16S rRNA 9 Hasil seleksi awal bakteri endofit 10 Hasil seleksi awal cendawan endofit
43 43
43 43
44
44
45
PENDAHULUAN
Latar Belakang
Padi merupakan salah satu tanaman pangan terpenting dan telah menjadi sumber karbohidrat utama dari setengah penduduk di dunia (Khush dan Jena 2009). Fluktuasi harga padi yang terjadi pada tahun 2007 telah mempengaruhi keamanan pangan pada beberapa negara berkembang dimana padi menjadi tanaman pangan pokok (Van Nguyen 2010). Di Indonesia, produksi padi pada tahun 2012 telah mengalami peningkatan jika dibandingkan tahun 2011. Peningkatan produksi padi tahun 2012 tersebut banyak terjadi di Pulau Jawa (BPS 2012). Peningkatan produksi padi tersebut merupakan kebutuhan mendesak di Indonesia dalam penyediaan kebutuhan pangan karena adanya aktivitas peningkatan populasi.
Lebih dari 90% padi dunia ditumbuhkan dan dikonsumsi di Asia dimana 60% penduduk dunia tinggal. Populasi konsumen padi terus meningkat dan permintaan akan padi juga meningkat. Meskipun potensi produksi padi 10 ton per hektar, petani rata-rata memanen hanya 5 ton per ha (Khush dan Jena 2009). Salah satu penyebab kesenjangan hasil ini karena kehilangan akibat cekaman biotik dan abiotik. Di antara cekaman biotik, penyakit blas merupakan salah satu yang paling penting dan merusak pada tanaman padi (Couch dan Kohn 2002). Penyakit blas mempengaruhi produksi padi pada semua kawasan penanaman padi (Khush dan Jena 2009). Penyakit blas dikenal sebagai penyakit demam pada padi (rice fever disease) di Cina pada awal tahun 1637, dilaporkan sebagai Imochi-byo di Jepang pada tahun 1704, dan disebut sebagai brusone di Itali pada tahun 1828. Penyakit ini juga dilaporkan di USA pada awal tahun 1876 dan pada tahun 1913 di India (Shafaullah
et al. 2011). Tsunoda et al. (1998) menambahkan selain di Indonesia, blas juga merupakan penyakit yang paling mengancam pertanamanan padi di Jepang. Pada awalnya, penyakit blas di Indonesia merupakan masalah utama yang terdapat pada produktivitas padi gogo (Kustianto et al. 1993; Santoso dan Nasution 2009) namun saat ini penyakit blas juga dapat dijumpai pada pertanaman padi sawah.
Penyakit blas pada padi yang disebabkan oleh Pyricularia oryzae dianggap sebagai penyakit paling penting karena penyebarannya yang luas dan menyebabkan kehilangan hasil yang parah (Zheng et al. 1998). Bagali et al. (2000) menyatakan perubahan yang cepat dari virulensi populasi patogen merupakan ancaman yang terus ada bila menggunakan varietas resisten untuk mengendalikan penyakit blas.
2
terhadap penggunaan pestisida dalam pertanian (Pal dan McSpadden Gardener 2006).
Seiring perkembangan waktu, terdapat tekanan publik berupa peraturan dan keinginan konsumen pangan untuk meminimalkan penggunaan bahan kimia di bidang pertanian sehingga beberapa peneliti memfokuskan pada upaya pengembangan input alternatif untuk mengendalikan penyakit tanaman tersebut. Di antara input alternatif tersebut mengacu pada praktek pengendalian hayati (Pal dan McSpadden Gardener 2006). Salah satu cara pengendalian hayati yang sangat efektif namun jarang digunakan adalah dengan menggunakan organisme antagonis yaitu bakteri dan cendawan endofit. Pengendalian hayati dengan menggunakan cendawan endofit dirasakan sebagai pengendalian yang tepat karena relung ekologi endofit berasal dari tanaman itu sendiri sehingga diasumsikan endofit mudah beradaptasi pada habitat baru. Malinowski dan Belesky (2000) menyatakan interaksi endofit dengan inang dapat menginduksi ketahanan inang dari serangan patogen penyebab penyakit. Berbeda dengan organisme seperti rizosfer atau filosfer, perbedaan habitat memungkinkan organisme sulit beradaptasi sehingga menyebabkan organisme filosfer dan rizosfer menjadi kurang efektif ketika diaplikasikan pada tanaman.
Kata endofit digunakan untuk bakteri atau cendawan yang hidup di dalam jaringan tanaman, untuk memenuhi seluruh atau sebagian siklus hidupnya dan tidak menimbulkan gejala pada tanaman inangnya (Petrini 1991). Bakteri dan cendawan endofit dalam arti luas merupakan organisme yang mengolonisasi jaringan tanaman tanpa menyebabkan efek langsung pada tanaman inangnya. Definisi tersebut mencakup seluruh interaksi simbiotik antara cendawan dan tanaman yaitu parasitisme, komensalisme, mutualisme (Stone et al. 2004). Penggunaan endofit yang dapat menekan penggunaan input kimia sintetis menjadikan endofit sebagai metode dalam meningkatkan ketahanan tanaman yang ramah lingkungan sehingga perkembangan endofit menjadi semakin pesat. Namun informasi terkait dalam penggunaan organisme antagonis yaitu bakteri dan cendawan endofit sebagai pengendali penyakit blas pada padi khususnya padi sawah masih sangat terbatas. Oleh karena itu, informasi terkait eksplorasi bakteri dan cendawan endofit sangat penting dilakukan untuk mendapatkan bakteri dan cendawan endofit potensial sebagai pengendali penyakit blas akibat P. oryzae pada padi sawah.
Tujuan Penelitian
Tujuan penelitian ini adalah mendapatkan bakteri dan cendawan endofit yang berasal dari padi sawah, yang berpotensi menekan keparahan penyakit blas pada padi sawah yang disebabkan oleh P. oryzae.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan pengetahuan terkait bakteri dan cendawan endofit yang terdapat pada padi sawah yang berpotensi menekan keparahan penyakit blas pada padi sawah yang diakibatkan oleh P. oryzae sehingga dapat mengoptimalkan pertumbuhan tanaman padi sawah.
Hipotesis
TINJAUAN PUSTAKA
Tanaman Padi di Indonesia
Tanaman padi yang dibudidayakan (Oryza sativa L.) termasuk dalam suku
Oryzeae dibawah sub famili Pooideae. Genus Oryza terbagi ke dalam beberapa bagian dan menempatkan O. sativa dibawah seri Sativa pada bagian Sativae. O. sativa merupakan tanaman asli pada benua Asia (Bardenas dan Chang 1965). Padi telah menjadi tanaman pangan sejak zaman prasejarah. Beberapa pihak menyebutkan bahwa tanaman padi berasal dari Cina, karena di wilayah ini banyak ditemukan jenis-jenis padi liar. Hal ini didasarkan pada teori N.I. Vavilov yang menyatakan bahwa daerah asal-usul suatu tanaman ditandai dengan terdapatnya pemusatan jenis-jenis liar tanaman tersebut. Bangsa Indonesia juga mempunyai cukup alasan untuk mengaku bahwa padi sebenarnya berasal dari pulau Jawa. Hal ini didasarkan pada hikayat Jawa Kuno, hikayat ini jelas menunjukkan simbol-simbol budidaya tanaman padi, yakni padi sawah yang diturunkan oleh Dewi Sri dan padi huma (gogo) dari Retna Dumila (Manurung dan Ismunadji 1988). Di Indonesia, padi ditanam diseluruh daerah, mulai dari dekat pantai sampai ke dataran tinggi di pegunungan. Umumnya padi diusahakan sebagai padi sawah (85-90%) dan sebagian kecil diusahakan sebagai padi gogo (10-15%). Padi tergolong tanaman yang toleran terhadap kondiri pengairan, bisa ditanam pada tanah darat dan disebut sebagai padi gogo atau padi ladang dan dapat ditanam pada tanah tergenang atau disebut sebagai padi sawah. Tanaman padi yang ditanam sebagai padi gogo selama sekitar 2 bulan kemudian berangsur-angsur digenangi dan akhirnya tumbuh sebagai padi sawah sampai panen disebut sebagai padi gogo rancah (Taslim dan Fagi 1988).
Keseluruhan organ tanaman padi terdiri atas dua kelompok, yakni organ vegetatif dan organ generatif. Bagian-bagian vegetatif meliputi akar, batang dan daun sedangkan bagian generatif terdiri atas malai, gabah dan bunga (Taslim dan Fagi 1988). Akar padi digolongkan ke dalam akar serabut. Akar primer (radikula) yang tumbuh sewaktu berkecambah bersama akar-akar lain yang muncul dari embrio disebut sebagai akar seminal yang jumlahnya antara 1-7. Apabila terjadi gangguan fisik terhadap akar primer, maka hal ini mempercepat pertumbuhan akar-akar seminal lainnya. Tanaman padi memiliki pola anakan berganda (anak-beranak), dari batang utama akan tumbuh anakan primer dan selanjutnya tumbuh anakan sekunder yang kemudian menghasilkan anakan tersier. Kapasitas anakan ini merupakan salah satu sifat utama yang penting pada varietas-varietas unggul. Daun tanaman padi tumbuh pada batang dalam susunan yang berselang-seling, satu daun pada tiap buku. Tiap daun terdiri atas (i) helai daun; (ii) pelepah daun yang membungkus ruas; (iii) telinga daun (auricle); (iv) lidah daun (ligule). Terdapatnya telinga daun dan lidah daun pada padi dapat digunakan untuk membedakannya dengan rumputan selagi keduanya dalam stadia bibit, karena daun rumput-rumputan hanya memiliki lidah atau telinga daun atau tidak ada sama sekali. Batang tanaman padi terdiri atas ruas yang dibatasi oleh buku. Daun dan tunas (anakan) tumbuh pada buku batang tanaman padi tersebut (Manurung dan Ismunadji 1988).
4
mengakibatkan produksi pangan harus ditingkatkan, khususnya beras yang merupakan bahan makanan pokok bagi sebagian besar penduduk Indonesia. Di Brazil tanaman ini penting sebagai pensuplai makanan dan salah satu tanaman yang bertanggung jawab terhadap pemasukan ekonomi yang besar untuk warga Brazil bagian selatan. Jika mempertimbangkan peningkatan populasi penduduk dunia yang akan meningkat kira-kira sampai 30-40 tahun ke depan (sampai 2040-2050), maka permintaan akan pangan mutlak akan meningkat dan hal ini akan menjadi penting dalam dunia pertanian pada semua bagian di dunia (Scheuermann et al.
2012).
Collard dan Mackill (2008) menyatakan peningkatan produksi tanaman akan sangat diperlukan kaitannya dalam memuncaknya berbagai permasalahan di masa mendatang seperti kelangkaan air, penurunan area lahan tanam, peningkatan polusi, kemunculan yang tak terhindarkan dari ras dan biotipe yang baru dari patogen dan hama, dan kemungkinan efek merugikan dari perubahan iklim.
Penyakit Blas
Penyakit blas pada padi yang disebabkan oleh Pyricularia oryzae
(teleomorph: Magnaporthe oryzae Couch) merupakan penyakit yang paling penting dan paling merusak pada tanaman padi (Couch dan Kohn 2002). Penyakit ini menyebar di seluruh dunia, terjadi pada seluruh area produksi padi dan dapat sangat merusak ketika kondisi lingkungan cocok. Keparahan penyakit bervariasi setiap tahunnya tergantung pada lokasi, kondisi cuaca serta praktek pengelolaan penanaman. Kehilangan hasil akibat penyakit blas pada padi dari suatu daerah di dunia diperkirakan berkisar antara 50-100%. Hal ini diperkirakan bahwa tiap tahunnya penyakit ini menghancurkan padi yang akan cukup dimakan oleh lebih dari 60 juta orang. Kehilangan hasil secara ekonomi tidak dapat terhitung, tetapi beberapa data menunjukkan nilainya lebih dari 70 milyar dolar pada beberapa negara di Asia (Scheuermann et al. 2012).
Blas dapat terjadi di semua bagian padi di atas permukaan tanah dari tanaman dan hal ini terdeteksi pada fase awal pertumbuhan sampai akhir masa produksi bulir (Scheuermann et al. 2012). Agrios (2005) menyatakan penyakit blas pada padi terjadi di seluruh dunia dan merupakan salah satu penyakit penting pada padi. Umumnya penyakit ini terjadi pada padi dengan tingkat irigasi atau curah hujan yang tinggi serta pupuk nitrogen yang tinggi. Beberapa epidemik blas pada padi telah terjadi di belahan dunia yang berbeda, mengakibatkan kehilangan hasil pada area tersebut berkisar antara 50-90% dari tanaman.
5
menambahkan blas juga mempengaruhi bagian collar, dimana kemungkinan dapat mematikan keseluruhan daun dan stem nodes.
Patogen cendawan blas pada padi telah diketahui sebagai P. oryzae tetapi tidak dapat dibedakan dari P. grisea, yang menyebabkan bintik daun berwarna abu-abu pada rumput-rumputan yang lain. Fase teleomorph yaitu Magnaporthe grisea
tidak ditemukan di alam tetapi dapat diproduksi setelah menyilangkan isolat kompaktibel yang sesuai di laboratorium. Cendawan memproduksi konidiofor yang simple, bewarna abu-abu, berbentuk pear, kebanyakan konidia mempunyai dua septa (Agrios 2005).
Patogen muncul sebagai miselium dan konidia pada jerami padi dan benih dan kemungkinan pada inang gulma. Pada daerah tropis, konidia muncul di udara sepanjang tahun. Cendawan memproduksi dan melepaskan konidia selama periode kelembapan relatif yang tinggi (90% atau ke atas). Konidia menjadi airborne dan mendarat di tanaman padi, melekat sangat kuat melalui lendir lengket yang dihasilkan di ujung konidia. Ketika daun padi atau permukaan batang basah, konidia berkecambah dan tabung kecambah memproduksi appressorium pada saat mempenetrasi permukaan tanaman. Appressorium juga dapat masuk melalui stomata. Produksi dan akumulasi melanin pada dinding sel appressorium penting untuk keberhasilan penetrasi. Bibit padi dan daun muda serta jaringan titik tumbuh lebih rentan dari pada tanaman dewasa dan bagian jaringan tanaman lainnya, pada temperatur optimum, lesio blas baru muncul dalam 4 sampai 5 hari setelah infeksi. Cuaca basah atau kelembapan relatif tinggi, konidia baru akan diproduksi dan dilepaskan dalam beberapa jam dari kemunculan lesio dan berlanjut untuk beberapa hari, dengan sebagian besar konidia dilepaskan pada tengah malam hingga matahari terbit.
Blas pada padi sangat menyukai kondisi pupuk nitrogen tinggi, periode kebasahan daun yang panjang dengan temperatur malam sekitar 20 oC. Patogen terdiri atas beberapa ras patogenik, tiap ras membawa gen virulensi berbeda. Beberapa gen utama untuk ketahanan terhadap blas telah teridentifikasi pada kultivar padi yang berbeda, tetapi tiap gen resisten cepat dipatahkan ketahanannya oleh kemunculan ras patogen baru (dalam 2 sampai 3 tahun) (Agrios 2005).
Bakteri Endofit
Bakteri endofit merupakan bakteri yang mengolonisasi tumbuhan secara internal tanpa merugikan terhadap tumbuhan (Hallmann et al. 1997b). Bakteri endofit umumnya diisolasi dari jaringan internal tumbuhan baik secara langsung melalui sentrifugasi atau secara tidak langsung melalui sterilisasi permukaan (Hallmann et al. 1997a).
6
Kolonisasi Bakteri Endofit
Sumber dari kolonisasi endofit sangat beragam dan dapat berkisar dari transmisi melalui benih dan material tanam vegetatif sebagai tempat masuk dari lingkungan sekitar seperti rhizosfer dan filosfer. Jika transmisi benih terjadi, bakteri akan menjadi pengkolonisasi sistemik yang sempurna, dapat tumbuh secara internal bersama tumbuhan dan mengolonisasi ovul (Hallmann 2001).
Interaksi yang kuat diantara tumbuhan inang dan bakteri endofit sudah ada sebelum kolonisasi endofit dan terlihat menjadi prasyarat untuk keberhasilan pertumbuhan dari tumbuhan inang. Sehubungan dengan karakteristik fase kolonisasi eksternal dan internal untuk kebanyakan asosiasi bakteri endofit dengan tumbuhan dapat terbagi menjadi interaksi prekolonisasi dan postkolonisasi (Hallmann 2001).
Interaksi Prekolonisasi
Interaksi prekolonisasi akan mencangkup pergerakan bakteri menuju akar, penempelan bakteri pada permukaan akar, proses pengenalan (recognition) tumbuhan-bakteri pada permukaan akar dan akhirnya penetrasi akar oleh bakteri, sedangkan interaksi postkolonisasi akan lebih mempertimbangkan multiplikasi dan penempatan bakteri di dalam jaringan akar, termasuk efek menguntungkan tumbuhan potensial (Gambar 1).
Gambar 1 Fase interaksi kolonisasi bakteri endofit pada permukaan akar (Hallmann 2001)
Pergerakan (Movement)
Bakteri endofit mungkin menemukan inangnya melalui kemotaksis atau melalui pertemuan yang tidak disengaja. Eksudat akar dilepaskan oleh tumbuhan memicu nutrisi yang dapat menarik bakteri endofit ke permukaan akar. Kontak bebas dengan akar mungkin menjadi penting dan sering diabaikan yang ternyata penting untuk menjadi prasyarat untuk penetrasi, terutama ketika mempertimbangkan efek dari faktor biotik seperti curah hujan dapat membantu pergerakan bakteri dalam tanah (Gambar 1).
Pelekatan (Attachment)
Reaksi inkompaktibel diantara tumbuhan dan bakteri patogen tumbuhan, dimana bakteri melekat pada dinding sel inang menginduksi kerusakan structural terhadap membran plasma, mengakibatkan pelepasan elektrolit dan kematian pada sel inang. Selama proses ini, kandungan fenolik yang bersifat racun juga dilepaskan dari sel inang untuk membunuh bakteri patogen di ruang interseluler. Bagaimanapun juga, pada interaksi kompaktibel pelekatan terhadap sel tumbuhan
Pergerakan
Pelekatan Pengenalan Penetrasi
7
dapat memicu pelepasan nutrient atau menstimulasi untuk pertumbuhan bakteri melalui tingkat degenerasi yang tingan dari membrane sel inang (Gambar 1).
Pengenalan (Recognition)
Masih terdapat pertanyaan apakah recognition merupakan hal penting yang menjadi persyaratan asosiasi endofit dan tumbuhan yang kompaktibel. Ketika bakteri endofit berada di dekat permukaan tumbuhan, terdapat pertanyaan yang muncul terkait mekanisme bakteri untuk recognition terhadap inang yang tepat atau mekanisme tumbuhan untuk recognition terhadap endofit yang sesuai. Jika recognition terjadi, kemudian membentuk specifik kontak diantara elisitor yang dilepaskan oleh bakteri maka reseptor koresponden dari tumbuhan inang harus telah dibentuk (Hallmann 2001).
Menurut Vance (1983), kontak ini mungkin terjadi secara ekstraseluler sebagai kejadian awal dalam asosiasi endofit dengan tumbuhan atau mungkin terjadi kemudian pada tingkat interseluler atau intraseluler. Lebih jauh lagi, hasil recognition ini dapat menjadi positif yaitu terjadinya asosiasi endofit dengan tumbuhan atau menjadi negatif yaitu kemungkinan terdapat respon seperti hipersensitif, induksi ketahanan, akumulasi fitoaleksin, dan pembentukan papilla yang membuat perkecualian terhadap bakteri dari tempat masuk ke dalam tumbuhan. Proses recognition akan menjelaskan kenapa hanya bakteri tertentu dari tanah, rhizosphere atau lingkungan filosfer dapat menjadi endofit dan tidak yang lain.
Hallmann (2001) menyatakan bagaimanapun juga, recognition dari bakteri endofit oleh tumbuhan dapat juga mengakibatkan stimulasi mekanisme pertahanan tumbuhan seperti reaksi hipersensitif atau akumulasi kandungan antrimikrobial dimana dapat menghambat kolonisasi endofit.
Penetrasi (Penetration)
Rute utama untuk masuknya bakteri endofit adalah: (1) lubang alami seperti hidatoda, stomata dan lentisel; (2) luka yang disebabkan abrasi oleh partikel tanah, serangan patogen, pembentukan akar lateral; (3) micropores; (4) kerusakan mekanik abiotik contoh hujan es. Bagaimanapun juga, hal yang pertama dan kemungkinan yang paling penting terhadap pintu masuk untuk bakteri endofit adalah melalui luka dan kehadiran micropores pada awal fase perkembangan akar. Jaringan akar muda biasanya lemah dan belum terdiferensiasi dan lapisan pelindung tanaman seperti lapisan lilin belum terbentuk untuk mencegah bakteri endofit dari pergerakan menuju lapisan yang dalam dari jaringan akar (Hallmann 2001).
Berdasarkan mode of entry yang disebutkan, bakteri mengambil keuntungan dari lubang alami atau buatan pada permukaan tumbuhan. Bagaimanapun juga, pertanyaan masih tetap sama apakah penetrasi bakteri endofit lebih banyak pasif atau lebih aktif. Penetrasi pasif alami dapat diasumsikan untuk lubang alami seperti hidatoda dan stomata, dimana pintu masuk didukung oleh sebuah lapisan film air yang membentang dari permukaan daun sampai pada hidatoda atau stomata. Bakteri yang telah mencapai hidatoda dan stoma dapat dengan mudah mengolonisasi ruang interseluler daun (Hallmann 2001).
Interaksi Postkolonisasi
8
mengolonisasi bagian tertentu dari tumbuhan secara extensive, menjadi pengkolonisasi sistemik atau tetap laten pada jaringan dimana penetrasi terjadi. Dengan demikian, asosiasi tumbuhan-bakteri endofit dapat menjadi baik netral terhadap tumbuhan atau positif ketika pertumbuhan tumbuhan dan/atau kesehatan terstimulasi. Kolonisasi external dan internal dari akar tumbuhan oleh bakteri endofit dapat terjadi secara: 1) acak di atas permukaan akar, 2) dibawah sell epidermis yang rusak, 3) berasosiasi dengan luka tumbuhan, 4) pada tempat pembentukan akar lateral, 5) secara intraseluler di sel epidermis akar termasuk rambut akar, 6) secara interseluler di dalam korteks akar atau 7) berasosiasi dengan jaringan vaskuler (Gambar 2) (Hallmann 2001).
Multiplikasi (Multiplication)
Kepadatan populasi endofit secara umum rendah dan jarang melebihi log 5 cfu/g jaringan tumbuhan segar. Hal ini membuat ilustrasi akan multiplikasi bakteri menjadi sangat sulit.
Kolonisasi (Localization)
Bakteri endofit telah dilaporkan mengolonisasi berbagai bagian tumbuhan seperti akar, umbi, batang, daun, buah dan benih. Kolonisasi bakteri pada sistem vaskular masih memerlukan perhatian lebih jauh untuk mengklarifikasi apakah bakteri endofit secara primer mengolonisasi xilem, floem, keduanya atau hanya pada ruang interseluler. Kolonisasi bakteri pada tumbuhan inang terbagi menjadi fase external dan internal. Secara external, bakteri endofit ditemukan secara random pada permukaan akar, dibawah sel epidermis atau terkonsentrasi di antara sel epidermis yang berasosiasi dengan luka dan permbentukan akar lateral (Hallmann 2001).
Gambar 2 Kolonisasi external dan internal dari akar tumbuhan oleh bakteri endofit dapat terjadi secara: 1) acak di atas permukaan akar, 2) dibawah sel epidermis yang rusak, 3) berasosiasi dengan luka tumbuhan, 4) pada tempat pembentukan akar lateral, 5) secara intraseluler di sel epidermis akar termasuk rambut akar, 6) secara interseluler di dalam korteks akar atau 7) berasosiasi dengan jaringan vaskuler (Hallmann 2001)
Meskipun bakteri endofit dilaporkan dapat muncul di ruang intraseluler tumbuhan, kebanyakan bakteri endofit ditemukan di ruang interseluler pada lapisan kortex tumbuhan dengan kepadatan yang tinggi. Jumlah yang tinggi dari bakteri endofit juga ditemukan pada asosiasi yang erat dengan jaringan vaskuler dan secara
Epidermis
Korteks
Endodermis
9
intraseluler pada sel epidermis akar termasuk rambut akar. Secara umum, keberhasilan kolonisasi bakteri membutuhkan ketersediaan nutrisi pada jaringan tumbuhan untuk metabolisme bakteri. Sangat sedikit diketahui mengenai ketersediaan ruang internal untuk kolonisasi endofit. Ruang interseluler atau bahkan sel epidermis yang dikolonisasi oleh bakteri endofit biasanya dibungkus oleh sel bakteri, sedangkan area yang berdekatan dengan sel tersebut menjadi area bebas bakteri (Hallmann 2001).
Cendawan Endofit
Menurut Petrini (1991), cendawan endofit adalah semua cendawan yang hidup di dalam organ tumbuhan yang sebagian atau seluruh hidupnya mengolonisasi jaringan tumbuhan secara internal tanpa mengakibatkan dampak merugikan terhadap inangnya.
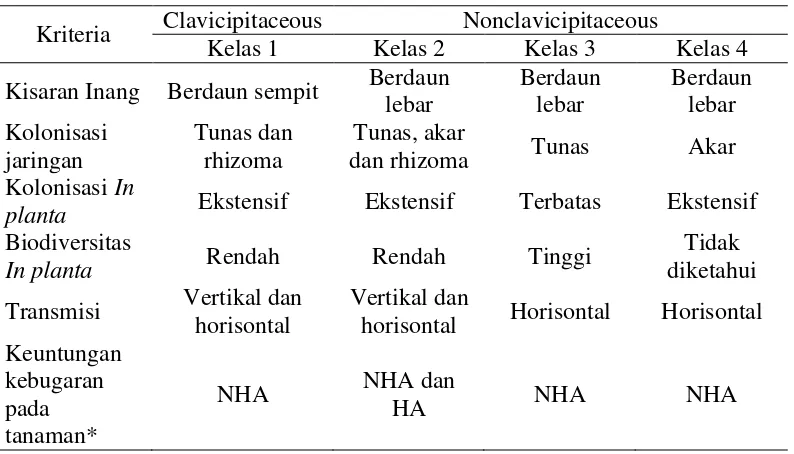
Stone et al. (2004) menyatakan tumbuhan tingkat tinggi dilengkapi dengan berbagai macam susunan lapisan yang menyusun struktur tubuh tumbuhan. Tumbuhan tersebut memiliki habitat beragam yang mendukung kumpulan berbagai macam spesies dari mikroorganisme. Cendawan yang merupakan salah satu komponen dominan dari kumpulan tersebut terdiri atas berbagai tipe yaitu pengkolonisasi permukaan daun dan ranting (epifit), jaringan internal dari daun (endofit daun), kulit kayu (bark endophytes), dan kayu (endofit xilem dan pengurai kayu). Hal ini sangat menarik walaupun belum jelas keterkaitannya, yaitu kolonisasi jaringan internal pada tanaman sehat oleh cendawan endofit membuka suatu wawasan baru bahwa tanaman tingkat tinggi diasumsikan seperti pelabuhan yang merupakan tempat berlabuh bagi cendawan tersebut. Stone et al. (2004) juga menyajikan perbandingan karakteristik dari cendawan endofit yang terdapat pada inang berdaun sempit dan inang berdaun lebar (Tabel 1).
Faeth (2002) melaporkan cendawan endofit, terutama yang berada dalam fase aseksual, kolonisasinya bersifat sistemik pada rumput. Hal tersebut merupakan bentuk mutualisme tanaman, dapat dilihat dari mikotoksin cendawan endofit, alkaloid pada rumput yang terinfeksi cendawan endofit, senyawa tersebut melindungi tanaman inang dari herbivora. Rodriguez et al. (2009) juga menyatakan semua tanaman pada ekosistem alami bersimbiosis dengan cendawan endofit. Kelompok cendawan yang beragam memberikan dampak besar pada komunitas tanaman melalui peningkatan kesehatan tanaman dengan memberikan toleransi terhadap cekaman biotik dan abiotik, meningkatkan biomasa dan menurunkan konsumsi air.
Tabel 1 Perbandingan karakteristik dari cendawan endofit
Cendawan endofit pada tanaman inang berdaun sempit
Cendawan endofit pada tanaman inang berdaun lebar
Mempunyai banyak spesies, beragam secara taksonomi
Kolonisasi jaringan terbatas
Memiliki spesies inang yang terbatas Tidak bersifat sistemik, ditransmisikan oleh spora
10
Rodriguez et al. (2009) mengklasifikasikan cendawan endofit kedalam empat grup berdasarkan transmisi dan interaksi ekologinya (Tabel 2). Endofit kelas 1 menginfeksi inang berdaun sempit, secara umum memiliki transmisi vertikal dan memproduksi mikotoksin contohnya endofit rumput Epichloe festuca dan Neotyphodium sp. Endofit kelas 2 mempunyai kisaran inang berdaun lebar dan memiliki transmisi secara vertikal dan horizontal contohnya Phoma, Colletotrichum sp., Fusarium sp., and Curvularia sp.. Endofit kelas 3 dan kelas 4 menginfeksi inang berdaun lebar, memiliki transmisi horizontal dan menginfeksi tunas dan akar. Keempat kelas endofit tersebut dilaporkan dapat meningkatkan pertumbuhan dari inang dan memberikan manfaat seperti meningkatkan toleransi tanaman terhadap kekeringan.
Tabel 2 Klasifikasi cendawan endofit berdasarkan transmisi dan interaksi ekologi
Kriteria Clavicipitaceous Nonclavicipitaceous
Kelas 1 Kelas 2 Kelas 3 Kelas 4
Kisaran Inang Berdaun sempit Berdaun lebar
planta Ekstensif Ekstensif Terbatas Ekstensif
Biodiversitas
In planta Rendah Rendah Tinggi
Tidak
*Keuntungan Nonhabitat-adapted (NHA) seperti toleransi terhadap kekeringan dan peningkatan pertumbuhan. Keuntungan Habitat-adapted (HA) muncul karena adanya tekanan selektif dari habitat spesifik seperti pH, temperatur dan salinitas.
Potensi Endofit Sebagai Agens Hayati
11
berkembang setelah aplikasi pestisida kimia sintetis menjadi metode dominan dari pengendalian patogen. Penggunaan pengendalian hayati berkembang karena para praktisi membutuhkan untuk mencari solusi terhadap masalah patogen ketika pestisida kimia tidak bekerja dengan baik atau tidak sesuai untuk pengendalian patogen yang spesifik. Dorongan utama lainnya dalam penggunaan pengendalian hayati adalah adanya fakta bahwa pestisida kimia dapat menyebabkan efek negatif terhadap kesehatan manusia dan pencemaran lingkungan sedangkan pengendalian hayati tidak meninggalkan residu kimia (Hajek 2004).
Fenomena aplikasi agens hayati termasuk didalamnya organisme endofit terhadap tanaman yang memberikan efek terhadap pengurangan insidensi atau keparahan penyakit dapat disebut sebagai pengendalian hayati. Mekanisme pengendalian hayati yang paling banyak dilakukan adalah antagonisme. Mekanisme yang termasuk dari antagonisme adalah mekanisme predasi, kompetisi dan antibiosis. Mekanisme alternatif dari pengendalian hayati adalah metabolit organisme yang mempengaruhi tanaman untuk meningkatkan ketahanan tanaman terhadap patogen, proses ini disebut sebagai induce systemic resistance (ISR). Ketahanan juga bisa didapatkan dari tanaman itu sendiri dengan adanya serangan dari patogen dan proses ini disebut sebagai systemic acquired resistance (SAR). Dengan demikian, ISR dipicu oleh mikroorganisme nonpatogen, sementara SAR dipicu oleh patogen atau kandungan kimia dari patogen (Kloepper dan Ryu 2006).
METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di laboratorium Mikrobiologi, rumah kaca Moisture Chamber for Blast Disease Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, dan laboratorium Mikologi Departemen Proteksi Tanaman Institut Pertanian Bogor. Waktu penelitian dimulai pada bulan September 2014 sampai September 2015
Metode Penelitian
Isolasi Bakteri dan Cendawan Endofit
Metode isolasi bakteri endofit menggunakan metode dari Munif et al.
(2012b). Isolasi dilakukan pada bagian akar, batang dan daun tanaman padi yang berasal dari Bogor, Sukabumi dan Blitar. Bahan tanaman dicuci dengan air mengalir sampai bersih, kemudian ± 1 g dipotong menjadi beberapa bagian dengan panjang 3-5 cm. Potongan daun dan akar disterilisasi menggunakan sterilisasi permukaan bertingkat menggunakan alkohol 70 % selama 0.5 menit kemudian dilanjutkan merendam sampel pada NaOCl 1 % selama 1 menit. Potongan bagian batang menggunakan alkohol 70 % selama 1 menit, dilanjutkan dengan merendam sampel pada NaOCl 1 % selama 2 menit kemudian dibilas dengan aquades steril sebanyak 3 kali lalu dikeringkan di atas tissue steril.
Uji sterilisasi permukaan dilakukan dengan menempelkan potongan sampel tanaman pada media tryptic soy agar (TSA) kosong untuk mengetahui keberhasilan hasil sterilisasi permukaan dan diinkubasi selama 2 hari. Apabila pada media tersebut terdapat mikroba yang tumbuh, berarti sterilisasi permukaan belum berhasil dan harus diulang sampai diperoleh akar yang benar-benar steril permukaannya. Setelah itu bagian tanaman yang telah disterilisasi permukaan dihancurkan dengan mortar steril sampai halus dengan penambahan air 1:10. Sebanyak 1 ml suspensi dicampur dengan 9 mL air steril dalam tabung reaksi, suspensi akar dibuat pengenceran berseri yaitu 10-2, 10-3, dan 10-4. Sebanyak 0.1 ml diambil dari masing-masing suspensi daun, akar dan batang tersebut kemudian ratakan pada media TSA 20 %. Setelah 1 hari sampai 2 hari diinkubasi pada pada suhu ruang, bakteri yang muncul dimurnikan.
Isolasi cendawan endofit dilakukan dengan meletakkan sampel pada media
malt extract agar (MEA) 10% tanpa digerus dan diinkubasi selama 7 hari. Uji kesterilan dilakukan untuk mengetahui tingkat sterilisasi permukaan bagian tanaman yang diisolasi dengan menggunakan air bilasan terakhir dari pencucian bagian tanaman dan dioleskan pada media potato dextrose agar (PDA) sebanyak 0.1 mL menggunakan mikropipet.
Bakteri dan cendawan pada media MEA 10% atau TSA 20%, selanjutnya dimurnikan berdasarkan bentuk dan warnanya. Masing-masing jenis disimpan pada media PDA untuk cendawan dan TSA 100% untuk bakteri sebagai bahan stok.
Seleksi Bakteri dan Cendawan Endofit
13
dan pengujian aktivitas hemolisis bakteri (Chang et al. 2000). Suspensi bakteri yang digunakan disiapkan pada media tryptic soy broth (TSB) dan digoyang menggunakan rotary shaker selama 24 jam. Suspensi bakteri yang telah disiapkan disuntikkan ke dalam daun tanaman tembakau. Reaksi positif ditandakan dengan munculnya gejala nekrotik dalam waktu 12-24 jam. Uji selanjutnya yaitu uji DPM, benih terlebih dahulu disterilkan menggunakan teknik sterilisasi permukaan dengan perendaman menggunakan alkohol 70% selama 30 detik dan NaOCl 1% selama 1 menit, dibilas sebanyak 2 kali menggunakan air steril. Benih padi ditanam dalam cawan petri yang telah ditumbuhi bakteri endofit hasil pemurnian yang berumur 24 jam, serta benih padi ditanam dalam cawan petri tanpa bakteri pada media TSA 20% sebagai perlakuan kontrol. Benih yang ditanam sejumlah 10 bulir pada setiap perlakuan. Pengamatan perkecambahan benih dilakukan setelah 14 hari dan menghitung persentase benih berkecambah normal, persentase benih berkecambah nekrotik, persentase benih tidak berkecambah, panjang akar dan tinggi tajuk. Perlakuan benih yang memiliki pertumbuhan melebihi perlakuan kontrol dan tidak menimbulkan nekrotik pada kecambah akan digunakan pada uji berikutnya. Pengujian aktivitas hemolisis bakteri dilakukan untuk mengetahui keamanan penggunaan bakteri tersebut dalam kehidupan manusia. Koloni bakteri ditumbuhkan pada media agar darah dan diinkubasi selama 3 sampai 7 hari pada suhu ruang. Media agar darah yang dipakai memiliki komposis TSA 100% dan darah kambing 5%, media TSA 100% yang telah di sterilisasi menggunakan autoklaf dengan suhu 121 oC selama 5 menit, kemudian dicampur dengan darah kambing 5% yang telah disaring menggunakan milipore 0.22 µ m. Indikasi positif bahwa bakteri tersebut dapat melakukan lisis pada agar darah adalah terbentuknya zona bening pada media disekitar koloni bakteri.
Pengujian cendawan endofit dilakukan sesuai dengan pengujian bakteri tahap kedua yaitu dengan pengujian cendawan endofit terhadap perkecambahan dan perkembangan benih padi. Cendawan endofit yang digunakan adalah cendawan yang berumur 5 hari pada media PDA. Benih terlebih dahulu disterilkan menggunakan teknik sterilisasi permukaan dengan perendaman menggunakan alkohol 70% selama 30 detik dan NaOCl 1% selama 1 menit, dibilas sebanyak 2 kali menggunakan air steril. Benih padi ditanam dalam cawan petri yang telah ditumbuhi cendawan endofit hasil pemurnian, serta benih padi ditanam dalam cawan petri tanpa cendawan pada media PDA sebagai perlakuan kontrol. Benih yang ditanam sejumlah sepuluh bulir pada setiap perlakuan. Pengamatan perkecambahan benih dilakukan setelah 14 hari dan menghitung persentase benih berkecambah normal, persentase benih berkecambah nekrotik, persentase benih tidak berkecambah, panjang akar dan tinggi tajuk. Perlakuan benih yang memiliki pertumbuhan melebihi perlakuan kontrol dan tidak menimbulkan nekrotik pada kecambah akan digunakan pada uji berikutnya
Uji Penghambatan Pertumbuhan Pyricularia oryzae oleh Bakteri dan Cendawan Endofit
Isolat P. oryzae menggunakan isolat P. oryzae strain R173 dari BB Biogen yang telah diuji virulensinya. Uji antagonisme cendawan endofit terhadap P. oryzae
14
hari sebelum ditanam P. oryzae, 4 plak P. oryzae diambil dari biakan yang telah berumur 7 hari dan ditanam pada media PDA yang terdapat cendawan endofit pada bagian tengah cawan petri dan tanpa ada cendawan endofit sebagai kontrol.
Uji antagonisme bakteri endofit terhadap P. oryzae dilakukan dengan menggunakan metode yang telah dimodifikasi dari Simanjuntak (2006) dengan 19 perlakuan dan 6 ulangan. Bakteri endofit dan patogen ditumbuhkan dalam satu cawan petri yang berisi media PDA, 2 plak P. oryzae diambil dari biakan yang telah berumur 7 hari dan ditanam pada kedua sisi cawan petri dimana terdapat bakteri endofit pada bagian tengah cawan petri. Diameter koloni diukur pada hari kelima setelah ditanam P. oryzae. Berikut adalah rumus persentase penghambatan oleh mikroba endofit:
P = ((R1-R2)/R1) x 100% Keterangan:
P = persentasi penghambatan oleh bakteri endofit
R1 = rata-rata diameter koloni cendawan patogen yang menjauhi koloni isolat bakteri endofit
R2 = rata-rata diameter koloni cendawan patogen yang mendekati koloni isolat bakteri endofit
Gambar 3 Skema uji antagonis dari bakteri endofit terhadap P. oryzae secara in vitro
Keterangan :
= biakan P. oryzae
= bakteri endofit
P = ((R1-R2)/R1) x 100% Keterangan:
P = persentasi penghambatan oleh cendawan endofit
R1 = rata-rata diameter koloni cendawan patogen pada perlakuan kontrol
R2 = rata-rata diameter koloni cendawan patogen pada perlakuan cendawan endofit
Gambar 4 Skema uji antagonis dari bakteri endofit terhadap P. oryzae secara in vitro (a) perlakuan endofit, (b) perlakuan kontrol
Keterangan :
= biakan P. oryzae
= cendawan endofit
R2
R1
15
Rancangan percobaan yang dilakukan pada pengujian penghambatan pertumbuhan P. oryzae oleh bakteri dan cendawan endofit adalah Rancangan Acak Lengkap (RAL). Data yang diperoleh dianalisis menggunakan program Statistical Analysis System (SAS). Perlakuan yang berpengaruh diuji lanjut dengan uji Tukey
pada taraf α = 0,05.
Uji Penghambatan Penyakit Blas pada Padi Sawah
Persiapan suspensi isolat cendawan endofit tidak memproduksi konidia.
Isolat cendawan endofit yang dipilih berdasarkan tingkat persentase pertumbuhan benih padi pada uji patogenesitas yang melebihi perlakuan kontrol dan tidak mengalami nekrotik pada kecambah. Masing-masing cendawan endofit diambil 3 potongan agar berdiameter 5 mm dan dimasukkan ke dalam potato dextrose broth
(PDB) 100 ml kemudian diaduk menggunakan rotary shaker dengan kecepatan 120 rpm selama 6 hari. Masa cendawan yang sudah berkembang dihomogenkan terlebih dahulu dengan cara mengaduk massa cendawan tersebut (Simanjuntak 2006). Pengamatan kepadatan propagul dilakukan menggunakan hemasitometer, dihitung dengan rumus :
Jumlah propagul per ml = (Jumlah Propagul 5 Kotak x 5 x 104 / Faktor Pengenceran)
Kepadatan yang diperoleh akan diencerkan sampai tingkat kerapatan 105
propagul/ml.
Persiapan suspensi isolat cendawan endofit yang memproduksi konidia.
Air steril sebanyak 10 ml dimasukkan ke dalam biakan murni cendawan endofit dalam cawan petri. Suspensi kemudian digerus-gerus dengan spatula sampai keruh. Apabila suspensi telah cukup keruh, dilakukan pengenceran suspensi sampai diperoleh tingkat kerapatan 105 propagul/ml Suspensi cendawan endofit yang telah diencerkan kemudian dihitung kerapatan sporanya dengan menggunakan hemasitometer (Hermawati 2007).
Persiapan suspensi isolat bakteri endofit. Bakteri endofit yang diperoleh dari hasil seleksi uji patogenesitas benih padi ditumbuhkan pada media TSA selama 2 hari, kemudian dipanen dan disuspensikan dengan 7-8 ml akuades steril dalam tabung reaksi kemudian dihitung kepadatan bakteri sampai diperoleh koloni 108 cfu/ml (Munif et al. 2012b).
Persiapan suspensi isolat cendawan Pyricularia oryzae. Pembuatan larutan konidia P. oryzae sebagai inokulum dilakukan dengan cara menggosok koloni berumur 10 hari pada media oat meal agar (OMA) menggunakan kuas No 10 dengan air steril ditambah streptomycin 100 ppm kemudian diinkubasi dalam
laminar air flow selama 2 × 24 jam. Masing-masing cawan petri ditambahkan air steril yang mengandung Tween 20 sebanyak 0,1%, kemudian disaring menggunakan saringan teh dan dimasukkan ke dalam erlenmeyer, dilakukan perhitungan tingkat kerapatan sampai 109 propagul/ml.
16
air steril 3 kali untuk sterilisasi benih padi. Benih selanjutnya direndam dalam suspensi cendawan dan bakteri endofit selama 6 jam dan ditanam dalam bak persemaian. ± 12-14 hari setelah tanam (hst), bibit yang telah tumbuh diinokulasi cendawan P oryzae dengan cara penyemprotan. Tanaman yang telah diinokulasi disimpan dalam kamar lembap selama 2x24 jam, kemudian dipindah ke dalam ruang pengkabut selama ± 1 minggu (Munif et al. 2012b). Pengamatan aktivitas cendawan P oryzae pada tanaman padi dilakukan pada minggu ke 3, 4 dan ke 5 setelah tanam (Sobrizal et al. 2010). Pengukuran keparahan penyakit dilakukan selama 3 hari sekali.
Rumus pengukuran keparahan penyakit :
S = Σ ( n x V ) / ( N x V ) x 100% Keterangan :
S = Keparahan penyakit,
n = jumlah daun dengan skor tertentu, v = skor daun yang terserang,
N = jumlah daun yang diamati, V = skala skor tertinggi (IRRI 1996).
Tabel 3 Skala (skor) pengukuran keparahan penyakit blas
Skor Kerusakan Daun Klasifikasi 0
Bercak kecil berwarna cokelat sebesar ujung jarum Bercak nekrotik kecil membulat, abu-abu, sedikit memanjang, panjang 1-2 mm, tepi cokelat, bercak banyak ditemukan di bagian bawah daun
Tipe bercak mirip dengan skor 2, tetapi sejumlah besar bercak sudah ditemukan pada bagian atas daun
Bercak khas blas (belah ketupat), panjang 3 mm atau lebih, luas daun terserang kurang dari 2 %
Bercak khas blas, panjang 3 mm atau lebih, luas daun terserang 2-10%
Bercak khas blas, panjang 3 mm atau lebih, panjang 3 mm atau lebih, luas daun terserang 11-25%
Bercak khas blas, panjang 3 mm atau lebih, luas daun terserang 26-50%
Bercak khas blas, panjang 3 mm atau lebih, luas daun terserang 51-75%, beberapa daun mulai mati
Semua daun mati, luas daun terserang lebih dari 75%
Sangat tahan
Rancangan percobaan yang dilakukan pada uji in vivo aktivitas endofit adalah Rancangan Acak Kelompok (RAK). Data yang diperoleh dianalisis menggunakan program Statistical Analysis System (SAS). Perlakuan yang berpengaruh diuji lanjut
dengan uji Duncan pada taraf α = 0,05.
Pengaruh Bakteri dan Cendawan Endofit terhadap Pertumbuhan Tanaman Padi
17
tinggi tajuk tanaman, pengukuran panjang akar, bobot basah dan bobot kering biomassa serta jumlah anakan tanaman padi. Tinggi tajuk tanaman diukur mulai dari pangkal batang hingga ke ujung daun terpanjang. Pengamatan dilakukan pada akhir pengamatan intensitas penyakit di rumah kaca. Bobot kering diukur setelah tanaman dikeringkan pada oven selama 12 jam dengan suhu 90 oC.
Identifikasi dan Karakterisasi Bakteri Endofit
Identifikasi bakteri endofit dilakukan dengan menggunakan metode PCR koloni. Gen 16S rRNA diamplifikasi menggunakan primer forward 27F (5’-AGA GTT TGA TCM TGG CTC AG-γ’) dan primer reverse 149βR (5’-TAC CTT GTT ACG ACT T-γ’). Total volume reaksi untuk PCR adalah 48 µl yang terdiri atas PCR master mix 25 µl, ddH2O 19 µl, 27F primer 2 µl, 1492R primer 2 µl and DNA
template 2 µl. Desain mesin PCR yang digunakan adalah satu siklus pradenaturasi pada suhu 95 oC selama 5 menit, diikuti 35 siklus denaturasi pada suhu 95 oC selama 1 menit, aneling pada 55 oC selama 1 menit, dan pemanjangan utas baru pada suhu 72 oC selama 2 menit. Reaksi diakhiri dengan 1 siklus pemanjangan akhir selama 10 menit pada suhu 72 oC. Produk PCR dikirim ke MACROGEN Inc., Korea Selatan, untuk sikuensing. Hasil sikuensing yang diperoleh kemudian dianalisis dengan program Basic Local Alaigment Search Tool (BLAST) pada situs Data Bank of Japan (DDBJ).
Karakterisasi bakteri endofit dilakukan dengan beberapa metode diantaranya adalah penentuan sifat Gram dengan KOH 3%, uji katalase, uji aktivitas kitinolitik uji aktivitas lipolitik, uji pelarut fosfat, uji fluorescent pada media Kings-B, uji warna koloni media YDCA. Penentuan sifat Gram dengan KOH 3% dilakukan dengan menggunakan metode Schaad (1988), yaitu dengan mengambil isolat bakteri sebanyak 1 ose penuh dan dicelupkan ke dua tetes KOH 3% sampai merata. Gram negatif pada bakteri ditunjukkan dengan munculnya lendir pada ose ketika ose yang berisi bakteri tersebut diangkat dari KOH 3% sedangkan untuk Gram positif tidak terbentuk lendir. Uji katalase menggunakan metode dari Sunatmo (2009) bertujuan untuk menguji kemampuan mikro penghasil enzim katalase dalam mendegradasi hidrogen peroksida (H2O2). Produksi katalase dapat dibuktikan dengan menambahkan 1 ose penuh bakteri ke dalam dua tetes H2O2 3%. Reaksi positif dari uji katalase ditandai dengan timbulnya gelembung gas dari oksigen bebas, sedangkan reaksi negatif tidak menunjukkan hal tersebut. Uji aktivitas kitinolitik dilakukan dengan menggunakan metode Pujiyanto et al. (2008) yaitu dengan cara menginokulasikan isolat bakteri pada media agar kitin dan diinkubasi selama 48-72 jam. Zona bening yang terbentuk pada sekitar isolat bakteri menunjukkan aktivitas kitinase pada bakteri tersebut. Uji aktivitas lipase dilakukan dengan menginokulasikan isolat bakteri pada media agar rhodamin-B dan diinkubasi selama 48 jam. Zona pendar berwarna oranye kemerahan di sekitar koloni bakteri di bawah sinar UV menunjukkan adanya aktivitas lipolitik Renjana
et al. (2012).
Identifikasi dan Karakterisasi Cendawan Endofit
18
Alexopoulos dan Mims (1996), Barnet dan Hunter (2006) dan Wanatabe (2002). Karakterisasi cendawan endofit yang dilakukan pengujian aktivitas kitinase dan pengujian aktivitas selulase. Uji aktivitas kitinolitik dilakukan dengan menginokulasikan isolat cendawan pada media agar kitin dan diinkubasi selama 48-72 jam. Zona bening di sekitar isolat cendawan menunjukkan aktivitas kitinase pada cendawan tersebut. Uji aktivitas selulase dilakukan dengan menginokulasikan isolat cendawan pada media selulase dan diinkubasi selama 48-72 jam. Zona bening di sekitar isolat cendawan menunjukkan aktivitas selulase pada cendawan tersebut.
Uji Kemampuan Bakteri dan Cendawan Endofit Mengolonisasi Tanaman Padi
Uji kemampuan kolonisasi dilakukan dengan terlebih dahulu melakukan sterilisasi menggunakan teknik sterilisasi permukaan dengan perendaman menggunakan alkohol 70% selama 30 detik dan NaOCl 1% selama 1 menit, dibilas sebanyak 2 kali menggunakan air steril kemudian benih direndam menggunakan suspensi bakteri dan cendawan endofit dan ditanam pada media WA. Bibit tanaman padi umur 2 minggu yang telah diinokulasi bakteri dan cendawan endofit diambil sebanyak 5 tanaman. Setelah itu dilakukan reisolasi pada bagian akar, batang dan daun. Reisolasi pada akar dilakukan secara pada bagian akar primer, reisolasi pada batang diambil 2 cm dari pangkal batang sedangkan reisolasi dari bagian daun diambil 2 cm dari pangkal daun. Tanaman dicuci dengan air mengalir sampai bersih, kemudian dipotong menjadi beberapa bagian. Potongan daun, akar dan batang disterilisasi menggunakan sterilisasi permukaan bertingkat menggunakan alkohol 70 % selama 0.5 menit kemudian dilanjutkan merendam sampel pada NaOCl 1 % selama 0.5 menit kemudian dibilas dengan aquades steril sebanyak 3 kali lalu dikeringkan di atas tisu steril.
Isolasi bakteri endofit dilanjutkan dengan menempelkan potongan sampel pada media TSA kosong untuk mengetahui keberhasilan hasil sterilisasi permukaan dan diinkubasi selama 2 hari. Apabila pada media tersebut terdapat mikroba yang tumbuh, berarti sterilisasi permukaan belum berhasil dan harus diulang sampai diperoleh akar yang benar-benar steril permukaannya. Setelah itu bagian tanaman yang telah disterilisasi permukaan dihancurkan dengan mortar steril sampai halus dengan penambahan air 1:10. Sebanyak 1 ml suspensi dicampur dengan 9 mL air steril dalam tabung reaksi, suspensi akar dibuat pengenceran berseri yaitu 10-2, 10 -3, dan 10-4. Sebanyak 0.1 ml diambil dari masing-masing suspensi daun, akar dan batang tersebut kemudian ratakan pada media TSA 20 %. Setelah 1 hari sampai 2 hari diinkubasi pada pada suhu ruang, bakteri yang muncul dimurnikan.
Isolasi cendawan endofit dilanjutkan dengan meletakkan sampel pada media
HASIL DAN PEMBAHASAN
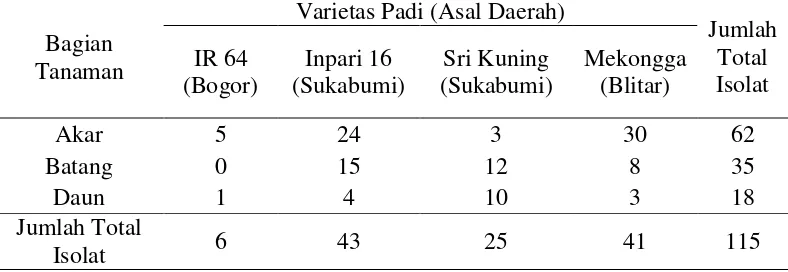
Kelimpahan Bakteri dan Cendawan Endofit Asal Tanaman Padi
Sebanyak 115 isolat bakteri endofit dan 47 isolat cendawan endofit berhasil diisolasi dari bagian akar, batang dan daun tanaman padi dari beberapa lokasi yaitu Bogor, Sukabumi dan Blitar. Jumlah mikroba endofit asal akar, batang dan daun tanaman padi tersebut bervariasi. Berdasarkan hasil isolasi, bakteri endofit lebih banyak didapat pada bagian akar (Tabel 4), sedangkan cendawan endofit lebih banyak didapat pada bagian daun (Tabel 5). Total bakteri endofit yang ditemukan adalah sebanyak 115 isolat dimana terbagi menjadi 62 isolat endofit asal bagian akar, 35 isolat endofit asal bagian batang, dan 18 isolat endofit asal bagian daun. Total cendawan endofit yang ditemukan adalah sebanyak 47 isolat dimana terbagi menjadi 8 isolat endofit asal bagian akar, 14 isolat endofit asal bagian batang dan 25 isolat endofit asal bagian daun. Hasil tersebut sesuai dengan pernyataan Hallmann (2001) menyatakan bahwa bakteri endofit telah banyak dilaporkan mengolonisasi pada berbagai bagian tanaman seperti akar, umbi, batang, daun, buah dan benih. Berbeda dengan cendawan endofit, Zakaria et al. (2010) dalam penelitiannya menunjukkan bahwa isolat cendawan endofit lebih banyak ditemukan pada bagian daun yaitu sejumlah 53 isolat pada bagian daun, 11 isolat pada bagian batang, dan 8 isolat pada bagian akar. Rodriguez et al. (2009) menyatakan bahwa cendawan yang memiliki kisaran inang berdaun sempit pada umumnya memiliki sistem transmisi secara vertikal dan horizontal. Sistem transmisi cendawan endofit secara vertikal melalui lapisan luar benih, benih, atau melalui bibit, sedangkan
Tabel 4 Jumlah isolat bakteri endofit asal tanaman padi dari beberapa daerah
Bagian
Tabel 5 Jumlah isolat cendawan endofit asal tanaman padi dari beberapa daerah
20
sistem transmisi cendawan endofit secara horizontal melalui spora terbawa udara (Hodgson et al. 2014). Hal tersebut menunjukkan pada penelitian ini bahwa isolat cendawan endofit lebih banyak ditemukan pada bagian daun dibandingkan isolat bakteri endofit yang lebih banyak ditemukan pada bagian akar. Penyebaran cendawan endofit secara horizontal memungkinkan cendawan endofit lebih bergerak bebas sehingga pada bagian daun memungkinkan cendawan endofit lebih banyak ditemukan dibandingkan bakteri endofit. Sistem transmisi bakteri endofit lebih mengarah pada sistem transmisi secara vertikal dan sistem invasinya ke akar terjadi secara pasif melalui lubang alami pada akar atau pada luka. Hallmann dan Berg (2006) menyatakan akar merupakan lokasi utama infeksi bakteri endofit pada tanaman menjadikan bakteri endofit seharusnya lebih banyak ditemukan pada akar. Kebutuhan bakteri yang membutuhkan lebih banyak air dan cendawan yang tahan kekeringan menjadi salah satu alasan lain bakteri lebih banyak mengolonisasi pada daerah perakaran.
Patogenesitas Bakteri Endofit
21
Aktivitas Hemolisis Bakteri
Uji agar darah adalah salah satu uji yang dapat menjadi indikasi apakah bakteri tersebut aman bagi kehidupan manusia. Satu dari sembilan belas bakteri menunjukkan dapat melakukan lisis pada agar darah (Lampiran 3). Terdapat 3 jenis kategori dari uji agar darah yaitu beta hemolysis ( ), alpha hemolysis (α), dan gamma hemolysis ( ). Beta hemolysis ( ) merupakan hemolysis yang sesungguhnya, terdapat zona bening disekitar koloni bakteri. Alpha hemolysis (α)
merupakan setengah dari lisis yang sebenarnya, atau lebih tepatnya pengurangan sel darah merah di sekitar koloni sehingga menyebabkan media menjadi berwarna kehijauan atau kecokelatan. Gamma hemolysis (γ) merupakan kondisi dimana lisis tidak terjadi pada agar darah (Buxton, 2005). Berdasarkan hasil uji dari agar darah pada penelitian ini hanya menunjukkan satu tipe dari hemolysis yaitu beta hemolysis (Tabel 6). Bakteri yang dapat melewati tes ini akan dilanjutkan dalam pengujian antagonis terhadap Pyricularia oryzae.
Tabel 6 Hasil pengujian aktivitas hemolisis bakteri endofit pada agar darah
No Kode
Tanda (-) pada pengujian agar darah menunjukkan bahwa bakteri tersebut tidak dapat melisis agar darah yang ditandai dengan tidak adanya zona bening, tanda (+) pada pengujian agar darah menunjukkan bahwa bakteri tersebut dapat melisis agar darah yang ditandai dengan adanya zona bening
Patogenesitas Cendawan Endofit
22
endofit yang menunjukkan reaksi positif pada uji patogenesitas berasal dari varietas IR 64 sejumlah 2 isolat berasal dari bagian batang, 1 isolat dari bagian daun; dari varietas INPARI 16 sejumlah 2 isolat dari bagian batang; dari varietas Sri Kuning sejumlah 2 isolat dari bagian akar, 4 isolat dari bagian batang, 4 isolat dari bagian daun.; dari varietas Mekongga sejumlah 3 isolat dari bagian akar, 15 isolat dari bagian daun.
Penghambatan Pertumbuhan Pyricularia oryzae oleh Bakteri dan Cendawan Endofit
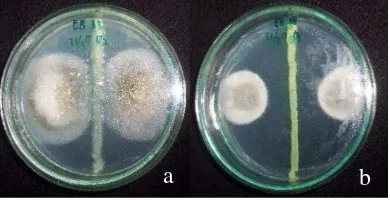
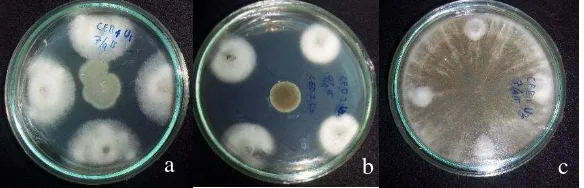
Sepuluh isolat bakteri endofit dan empat belas isolat cendawan endofit yang terpilih dilanjutkan pada uji penghambatan pertumbuhan P. oryzae untuk melihat sifat antibiosis dari kedua mikroba tersebut pada cendawan patogen P. oryzae. Berdasarkan hasil uji antagonis, semua isolat bakteri endofit memiliki aktivitas daya hambat dengan persentase daya hambat yang berbeda-beda (Tabel 7). Menurut hasil analisis ragam, daya hambat tertinggi yang mencapai lebih dari 50% ditunjukkan oleh isolat EB 1, yaitu sebesar 63.77 %, kemudian diikuti oleh isolat EB 28 dan EB 9 berturut-turut sebesar 62.32 dan 60.87%. Berbeda dengan cendawan endofit, mekanisme bakteri endofit yang ditunjukkan pada uji antagonis tersebut lebih menunjukkan pada mekanisme sifat antibiosis dari bakteri endofit sedangkan pada cendawan endofit terdapat dua mekanisme yang dapat dilihat pada uji penghambatan terhadap pertumbuhan P. oryzae yaitu mekanisme antibiosis dan kompetisi.
Tabel 7 Pengaruh bakteri endofit terhadap pertumbuhan P. oryzae in vitro
No Kode Isolat Daya Hambat % No Kode Isolat Daya Hambat % 1 EB 1 63.7 a 11 EB 32 16.6 de 2 EB 28 62.3 ab 12 EB 8 13.0 ef 3 EB 9 60.8 ab 13 EA 9 13.0 ef 4 EB 7 59.4 ab 14 EA 39 13.0 ef 5 EB 6 57.9 ab 15 EA 6 13.0 ef 6 EA 36 56.5 ab 16 EA 45 13.0 ef 7 EA 35 53.9 ab 17 EA 34 13.0 ef 8 EB 11 53.6 b 18 EA 2 4.3 fg 9 EA 8 36.9 c 19 Kontrol 0 g 10 EB 33 23.9 d
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang Tukey).
Gambar 5 Uji antagonis bakteri endofit (a) tidak memiliki zona hambat (b) memiliki zona hambat