PROSES PENCETAKAN ION DALAM SINTESIS HIBRIDA
ORGANO-SILIKA UNTUK ADSORPSI SELEKTIF ION Pb(II)
DARI LARUTAN
(Skripsi)Oleh
MUHAMMAD ISHOM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
IMPRINTING IONIC PROCESS IN THE SYNTHESIS OF ORGANO-SILICA HYBRID TO SELECTIVE ADSORPTION ION Pb(II) OF A AQUEOUS
SOLUTION
By
MUHAMMAD ISHOM
The synthesis of material amino silica hybrid (HAS) and merkapto silica hybrid (HMS) imprinted ions Pb(II) (HAS-t-Pb(II)) and (HMS-t-Pb(II)) has been conducted using a compound of active aminopropiltrimetoksisilan (APTMS) and
3-merkaptopropiltrimetoksisilan (3-MPTMS) with the precursor of the
tetraetilortosilikat (TEOS). Characterization result of materials synthesis using spectrophotometer infrared (IR) and Scanning Electron Microscope- Energy
Dispersive X-Ray Spectrometer (SEM-EDX). The levels of metal ions are analyzed using atomic absorption spectrophotometer (AAS). Comparison of ability of
adsorption material HAS with HAS-t-Pb(II) and HMS with HMS-t-Pb(II) done via a test that includes a rate, adsorption capacity and selectivity adsorption of metal ions, Pb(II). The rate of adsorption is determined using the pseudo first order kinetics with two rate constants (k2) to HAS-t-Pb(II) and HMS-t-Pb(II) each 1,07 and 33,30 g
mmol-1 min-1. Adsorption capacity of the material HAS-t-Pb (II) and HMS-t-Pb(II)
follow the Langmuir equation isoterm with each value 15,15 and 29,41 mol g-1. The Material HAS-t-Pb(II) and HMS-t-Pb(II) more selective of Pb(II) ions than Zn(II), Ni(II) and Cd(II) with selectivity coefficient (α)> 1. Selectivity material HAS-t-Pb(II) and HMS-t-Pb (II) each rising to 2,41 and 3,58 times more selective for the Pb(II) ions compared HAS and HMS material.
ABSTRAK
PROSES PENCETAKAN ION DALAM SINTESIS HIBRIDA ORGANO-SILIKA UNTUK ADSORPSI SELEKTIF ION Pb(II)
DARI LARUTAN
Oleh
MUHAMMAD ISHOM
Sintesis material hibrida amino silika (HAS) dan hibrida merkapto silika (HMS) tercetak ion Pb(II) (HAS-t-Pb(II) dan HMS-t-Pb(II)) telah dilakukan
menggunakan senyawa aktif aminopropiltrimetoksisilan (APTMS) dan 3-merkaptopropiltrimetoksisilan (3-MPTMS) dengan prekursor tetraetilortosilikat (TEOS). Karakterisasi material hasil sintesis tersebut menggunakan
spektrofotometer inframerah (IR) dan Scanning Electron Microscope- Energy Dispersive X-Ray Spectrometer (SEM-EDX). Kadar ion logam dianalisis
menggunakan spektrofotometer serapan atom (SSA). Perbandingan kemampuan adsorpsi material HAS dengan HAS-t-Pb(II) dan HMS dengan HMS-t-Pb(II) dilakukan melalui uji adsorpsi yang meliputi laju, kapasitas dan selektivitas adsorpsi terhadap ion logam Pb(II). Laju adsorpsi ditentukan menggunakan kinetika pseudo orde dua dengan nilai konstanta laju (k2)untuk HAS-t-Pb(II) dan
HMS-t-Pb(II) masing-masing 1,07 dan 33,30 g mmol-1 menit-1. Kapasitas adsorpsi material HAS-t-Pb(II) dan HMS-t-Pb(II) mengikuti persamaan isoterm Langmuir dengan nilai masing-masing 15,15 dan 29,41 mol g-1. Material HAS-t-Pb(II) dan HMS-t-HAS-t-Pb(II) lebih selektif terhadap ion HAS-t-Pb(II) dibandingkan Zn(II), Ni(II) dan Cd(II) dengan koefisien selektivitas (α) > 1. Selektivitas material
HAS-t-Pb(II) dan HMS-HAS-t-Pb(II) masing-masing meningkat hingga 2,41 dan 3,58 kali lebih selektif terhadap ion Pb(II) dibandingkan material HAS dan HMS.
PROSES PENCETAKAN ION DALAM SINTESIS HIBRIDA
ORGANO-SILIKA UNTUK ADSORPSI SELEKTIF ION Pb(II)
DARI LARUTAN
Oleh
Muhammad Ishom
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Judul Skripsi : PROSES PENCETAKAN ION DALAM SINTESIS HIBRIDA ORGANO-SILIKA UNTUK ADSORPSI SELEKTIF ION Pb(II) DARI LARUTAN
Nama Mahasiswa : Muhammad Ishom
Nomor Pokok Mahasiswa : 0717011049
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. Buhani, M.Si. Prof. Suharso, Ph.D. NIP 196904161994032003 NIP 196905301995121001
2. Ketua Jurusan Kimia
MENGESAHKAN
1. Tim Penguji
Ketua : Dr. Buhani, M.Si. …………....
Sekretaris : Prof. Suharso, Ph.D. …………....
Penguji
Bukan Pembimbing : Wasinton Simanjuntak Ph.D. …………....
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D. NIP 196905301995121001
RIWAYAT HIDUP
“
Orang yang suka berkata jujur akan mendapatkan 3 hal, yaitu:
KEPERCAYAAN, CINTA dan RASA HORMAT
”
(Sayidina Ali bin Abi Thalib)
“Tiga manusia sebagai
sumber kebaikan: manusia yang mengutamakan diam
(tidak banyak bicara), manusia yang tidak melakukan ancaman, dan manusia
yang banyak berzikir kepada Allah.”
(Mutiara Islam)
”Sesuatu yang indah adalah ketika selalu menggunakan kesabaran dan ilmu
dalam
menghadapi sesuatu”
(Muhammad Ishom)
”Diam bukanlah berarti tidak melakukan apa
-apa, layaknya kepompong yang
diam namun dibalik diamnya menuju suatu kesempurnaan”
Kupersembahkan karya sederhana ini kepada :
ALLAH S.W.T
Kedua orang tuaku,
yang telah memberikan rasa kasih dan sayang kalian dalam
semangat dan doa yang terbaik untukku
Kakak-kakakku tersayang, serta Adikku tercinta
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillah Puji dan syukur Penulis ucapkan kehadirat Allah SWT, atas segala rahmat dan karunia-Nya skripsi ini dapat diselesaikan.
Skripsi dengan judul "Proses Pencetakan Ion Dalam Sintesis Hibrida Organo-Silika Untuk Adsorpsi Selektif Ion Pb(II) Dari Larutan" adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan rintangan, namun itu semua dapat penulis lalui berkat rahmat dan ridha Allah SWT serta bantuan dan dorongan semangat dari orang-orang yang hadir
dikehidupan penulis. Dalam kesempatan ini, penulis menyampaikan terima kasih setulus-tulusnya kepada :
ii
2. Bapak Prof. Suharso, Ph.D., selaku pembimbing II penelitian dan selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam yang telah
memberikan kritik, saran dan arahan yang diberikan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
3. Bapak Drs. Wasinton Simanjuntak, Ph.D., selaku penguji penelitian yang telah memberikan semangat, motivasi, kritik, saran dan arahan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
4. Ibu Dian Herasari M.Si., selaku Pembimbing Akademik atas kesediaannya utuk memberikan bimbingan, bantuan, nasehat dan informasi yang
bermanfaat kepada penulis.
5. Ibu Dra.Zipora Sembiring, M.Si., yang telah memberikan bimbingan dan semangat kepada penulis selama menjalani perkuliahan.
6. Ibu Mita Rilyanti, M.Si., yang telah memberikan banyak motivasi dan semangat kepada penulis sehingga skripsi ini terselesaikan dengan baik. 7. Bapak Andi Setiawan, Ph.D., selaku ketua Jurusan Kimia FMIPA Unila. 8. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu
pengetahuan yang bermanfaat kepada penulis selama kuliah.
segala hal terbaik dan semua yang telah diberikan kepadaku serta bentuk pengorbananmu. Sekali lagi terima kasih banyak mama dan papa 10. Kepada Ayuk-ayukku yang amat sangat aku sayangi, Ummi Sa’adah,
Muhabibah, Istiqomah, Muhabibah, Siti Marfuah dan Nurul Khoeriyah yang selalu memberikan aku motivasi, dukungan yang tidak ada habisnya untuk terus melangkah. Serta terimakasih juga kepada adikku tercinta Fathurrohman yang selalu dapat menemaniku. Terima kasih banyak atas kerja keras kalian, aku sayang kalian semua.
11. Sahabat-sahabat terbaikku yang selalu menemaniku dan memberikan arahan, Hady Novadianto S.Si (Jambi), Y. Wikan A.N. S.Si (Gembul), Septiyan Try S., Mitra Septanto, Heryanto, Afriyorawan, Aprian Agung B., Gunadi, Dwi Fitrian S. Semoga kita masih tetap dapat tersenyum bersama, jalan-jalan, ngumpul meskipun untuk main PES, dan tertawa bersama, aamiin.
12. Teman seperjuangan penelitianku Andi Yuli Fitriani S.Si dan Mba Sumartini, terima kasih banyak atas segala bantuan dan semangatnya, semoga selalu diberikan jalan yang terbaik.
13. Teman-teman seperjuangan anorganisme : Dewi Asmarani S.Si (Bagong), Halimah S.Si, Mega Dewi F.S. S.Si, Rivera Siallagan S.Si, Yuni Rahmania S.Si (Bho), terima kasih banyak untuk kebersamaannya selama menjalankan penelitian dan perkuliahan. Tetap semangat dan sukses selalu.
iv
Puspa N. Cantik, Dwi Puji Astuti S.Si, (terima kasih banyak, kalian yang terbaik), Sunardi Sutrisna S.Si, Yulistiawan, Sudarmono, Maryadi S.G., Muhlasin, Adi Firman S., Putri Amalia S.Si, Astri Rahayu, Sari Handayani S.Si, Ratna Maulina S.Si, Winda Rahmawati, Febi Dis S.Si, Refi Indrarosa, Yanti Lianita Riri Napitupulu, Devi Ummaya, Fajar Ellin Renius Histalesy, terima kasih untuk perkenalan, kebersamaan dan keceriaan selama menjalankan perkuliahan, tetap semangat dan jangan menyerah, perjuangan kita masih panjang, sukses selalu untuk kita.
15. Kak Bowo, Kak Soni, Kak Slem, Kak Imam, Kak Tomi, Kak Alex, Kak Andi, Kak Firza, Kak Farid, Bang Yasir, Alan Gusmiadi, Iqbal F.,Riko, Nuraini (Nung), Dani, Yahya, Juju, Metha, Kiki, Vani, Sherly, Nurjanah, dan teman-teman semua yang tidak bisa saya sebutkan satu persatu. Terimakasih atas kebersamaannya selama ini, aku tidak akan melupakan jasa kalian semua, semangat ya teman-teman.
16. Bude Kantin, terimakasih atas segala nasihat dan dukungannya serta telah bersedia menjadi teman curhat selama ini. Terimakasih banyak budee, Mb Atis dan Mb Sirup.
17. Kakak-kakakku di kimia, Kak Prio, Kak purwanto, Mba Rusda Ulfa S.Si, Mba Okta S.Si, Mba Ayu Puspita S.Si, Mba Nindya S.Si, Mba Yuniarti S.Si, Mba Lince S.Si, Mba Sinta S.Si, Mba Y. Anggraini S.Si, Mba Eka Eva, Mba Helma untuk kebersamaan dan semangatnya.
19. Sahabat-sahabat terbaikku Ex-Hanif : Witono, Ardi Susanto, Ibrahim Toha (terima kasih banyak atas segala dukungan dan motivasi kalian, aku tidak akan pernah melupakan kalian), Arman, Zeli, Taufik, Hari, Herwin dan Adi. 20. Semua pihak yang telah membantu dan mendukung penulis dalam
penyusunan skripsi ini.
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Amin.
Bandar Lampung, Februari 2012 Penulis
I. PENDAHULUAN
A. Latar Belakang
Pencemaran lingkungan karena logam berat merupakan masalah yang sangat serius, ini karena penggunaan logam berat yang semakin meningkat seiring dengan perkembangan di bidang industri. Umumnya, logam berat yang sering ditemukan dalam limbah industri adalah kadmium (Cd), raksa (Hg), seng (Zn), besi (Fe) dan timbal (Pb) yang tidak dapat terdegradasi dan dapat meningkatkan jumlah mikrobiologi yang selanjutnya dapat menyebabkan banyak penyakit (Jin and Bai, 2002).
Penanganan terhadap logam berat khususnya logam Pb telah banyak dilakukan yaitu dengan mengurangi konsentrasi logam Pb atau logam berat lain dengan metode pengendapan, koagulasi, kompleksasi, ekstraksi pelarut, membran pemisah, penukar ion, dan adsorpsi. Metode adsorpsi, dari segi ekonomis merupakan metode yang paling menguntungkan dan banyak digunakan, karena metode ini cukup murah dan sederhana (Gupta et al., 2008) serta tidak adanya efek samping zat beracun (Blais et al., 2000).
interaksi pembentukan kompleks dan biasanya terjadi pada permukaan padatan adsorben yang memiliki kandungan gugus fungsional seperti –OH, -NH, -SH, dan
–COOH yang cukup banyak (Stum and Morgan, 1996). Penggunaan adsorben
sangat tergantung pada sifat permukaannya, sehingga perlu dilakukan modifikasi dengan pengikatan ujung gugus fungsional yang diinginkan terhadap organosilan yang sesuai. Dalam proses organosilanisasi dapat digunakan silika gel sebagai substrat, karena mampu bereaksi cepat dengan agen organosilan yang
permukaannya didominasi oleh gugus hidroksil.
Silika gel merupakan salah satu adsorben yang paling banyak digunakan dalam proses adsorpsi. Hal ini dikarenakan kemudahannya dalam diproduksi dan sifat permukaannya yang dapat dimodifikasi dengan mudah (Fahmiati, 2004). Silika gel dapat digunakan secara langsung untuk adsorben, namun untuk sebagian logam interaksinya terlalu lemah dengan permukaan silika gel. Hal ini karena keasaman gugus silanol (Si-OH) dan sifat donor dari permukaan atom oksigen yang lemah (Tokman et al., 2003). Akan tetapi kekurangan ini dapat diatasi dengan memodifikasi permukaan silika gel dengan menggunakan situs aktif yang sesuai untuk mengadsorpsi ion logam.
3
kondisi yang lunak (soft) dalam sintesis material oksida metastabil (amorf)
(Schubert and Husing, 2000) sehingga dapat dikerjakan pada laboratorium dengan peralatan yang terbatas dimana sulit dilakukan untuk proses sintesis yang
membutuhkan kondisi ekstrim. Modifikasi permukaan silika gel melalui proses sol-gel dapat dilakukan dengan imobilisasi gugus organik seperti merkapto (-SH) atau amino (-NH2) yang mampu secara efektif mengikat ion logam.
Imobilisasi gugus merkapto pada permukaan silika gel melalui proses sol-gel membentuk hibrida merkapto silika (HMS) diketahui dapat meningkatkan efektivitas adsorpsi terhadap ion logam (Narsito et al., 2004). Selain gugus merkapto, dapat juga digunakan gugus amino untuk imobilisasi permukaan silika gel menghasilkan hibrida amino silika (HAS) dalam upaya meningkatkan
efektivitas adsorpsi. Peningkatan efektivitas kedua gugus organo-silika tersebut dikarenakan atom S pada –SH ataupun N pada –NH2 lebih -bersifat basa lewis
dibandingkan atom O dari –OH pada silika gel. Peningkatan efektivitas adsorpsi juga dapat diikuti dengan meningkatkan selektivitas adsorpsi yaitu menggunakan teknik pencetakan ion.
Teknik pencetakan ion dapat meningkatkan selektivitas karena ion logam berperan sebagai cetakan yang terbentuk dari polimer yang akan mencetak ion logam tersebut (Buhani et al., 2009; Erzoz et al., 2004). Jadi, ion yang dicetakan akan dilepas dari matriks polimer sehingga akan menghasilkan hasil cetakan yang
selektif terhadap ion target. Selain itu, teknik pencetakan ini relatif murah dan
senyawanya stabil pada suhu kamar untuk waktu yang cukup lama. Penggunaan
analit dalam konsentrasi yang rendah dan untuk mengekstrak ion logam secara
selektif dari campuran ion logam.
Prekonsentrasi memungkinkan untuk penentuan konsentrasi analit yang rendah dan juga dapat menghilangkan matriks pengganggu (Atanassova et al., 2001). Teknik prekonsentrasi dapat digunakan dalam analisis menggunakan
spektrofotometer serapan atom (SSA). Hal ini karena SSA ini mempunyai
keterbatasan yang disebabkan adanya matriks pengganggu atau terlalu rendahnya konsentrasi unsur/senyawa itu sendiri (Sekhar, 2003). Contohnya logam Pb(II) yang mempunyai batas deteksi untuk analisis SSA hanya 500 ppb (0,500 ppm). Jika kandungan Pb yang akan dianalisa tersebut ≤ 0,500 ppm maka logam Pb tersebut tidak dapat terbaca dengan baik dalam SSA.
Dalam penelitian ini, digunakan metode pencetakan ion, dengan ion Pb(II)
sebagai ion cetakan. Polimer yang digunakan adalah hibrida organo-silika yang
dibuat melalui proses sol-gel. Untuk membandingkan selektivitas adsorpsi
terhadap ion Pb(II), maka digunakan adsorben hibrida organo-silika yang berbeda
yaitu gugus amino(-NH) yang bersifat basa keras dan gugus merkapto (-SH)
bersifat basa lunak.
Material hibrida organo-silika tercetak ion Pb(II) dan tidak tercetak ion
5
B. Tujuan Penelitian
Berdasarkan latar belakang masalah yang telah dipaparkan di atas, penelitian ini dilakukan dengan beberapa tujuan spesifik sebagai berikut :
1. Mensintesis dan mengkarakterisasi material HAS-t-Pb(II) dan HMS-t-Pb(II). 2. Menentukan laju dan kapasitas adsorpsi ion Pb(II) pada material HAS, HMS,
HAS-t-Pb(II), dan HMS-t-Pb(II) dalam larutan.
3. Membandingkan selektivitas adsorpsi material HAS-t-Pb(II) dan HMS-t-Pb(II) dengan HAS dan HMS terhadap logam target Pb(II) dengan pasangan ionnya Zn(II), Ni(II), dan Cd(II) dalam larutan.
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Adsorpsi
Adsorpsi merupakan proses akumulasi adsorbat pada permukaan adsorben yang disebabkan oleh gaya tarik antar molekul atau suatu akibat dari medan gaya pada permukaan padatan (adsorben) yang menarik molekul-molekul gas, uap atau cairan (Oscik, 1982). Sedangkan Alberty dan Daniel (1987)
mendefinisikan adsorpsi sebagai fenomena yang terjadi pada permukaan. Adsorpsi secara umum didefinisikan sebagai akumulasi sejumlah molekul, ion atau atom yang terjadi pada batas antara dua fasa. Adsorpsi menyangkut akumulasi atau pemusatan substansi adsorbat pada adsorben dan dalam hal ini dapat terjadi pada antar muka dua fasa. Fasa yang menyerap disebut adsorben dan fasa yang terserap disebut adsorbat. Kebanyakan adsorben adalah bahan-bahan yang memiliki pori karena berlangsung terutama pada dinding-dinding pori atau letak-letak tertentu didalam adsorben.
7
jika interaksi adsorben dan adsorbat melibatkan pembentukan ikatan kimia. Dalam proses adsorpsi melibatkan berbagai macam gaya yakni gaya van der Waals, gaya elektrostatik, ikatan hidrogen serta ikatan kovalen (Martell and Hancock, 1996).
Pada adsorpsi kimia terjadi pembentukan dan pemutusan ikatan, sehingga energi adsorpsinya berada pada kisaran yang sama dengan reaksi kimia. Ikatan antara adsorben dengan adsorbat cukup kuat sehingga tidak terjadi spesiasi, karena zat yang teradsorpsi menyatu dengan membentuk lapisan tunggal dan relatif reversibel. Batas minimal suatu adsorpsi dikategorikan sebagai kemisorpsi adalah memiliki harga energi adsorpsi sebesar 20,92 kJ/mol (Adamson, 1997). Energi yang menyertai adsorpsi kimia relatif tinggi yaitu berkisar 42-420 kJ/mol. Hal ini diperkuat oleh studi spektroskopi bahwa terjadi transfer elektron dan terbentuk ikatan kimia antara adsorben dan
adsorbat.
Proses adsorpsi larutan secara teoritis umunya berlangsung lebih lama dibandingkan proses adsorpsi pada gas, uap atau cairan murni (Shaw, 1983). Hal ini disebabkan pada adsorpsi larutan melibatkan persaingan antara komponen larutan dengan situs adsorpsi. Proses adsorpsi larutan dapat
Pada dasarnya, suatu adsorben harus memiliki luas permukaan spesifik yang tinggi, yaitu memiliki pori-pori berdiameter kecil agar proses retensi partikel adsorbat oleh adsorben berlangsung lebih efektif. Secara spesifik, ukuran pori juga menentukan adsorpsi suatu senyawa tertentu dalam larutan. Jika ukuran pori adsorben semakin kecil maka kemampuan adsorpsinya semakin besar, dengan anggapan bahwa komponen yang teradsorpsi dapat memasuki rongga porinya. Jumlah adsorben yang makin banyak akan memberikan luas
permukaan yang makin besar bagi adsorbat untuk terdesorpsi. Selain itu makin banyak jumlah adsorben juga akan memberi kesempatan kontak yang makin besar dengan molekul-molekul adsorbat (Sembodo, 2006).
B. Adsorpsi Ion Timbal (Pb(II))
Kemampuan ion Pb untuk berinteraksi membentuk senyawa kompleks dengan ligan bergantung pada polaritasnya, semakin tinggi daya polarisasi cenderung akan lebih disenangi oleh ligan. Hal ini dikarenakan pusat kerapatan
bermuatan positif sehingga menghasilkan interaksi yang kuat. Interaksi antara ion Pb(II) atau ion logam lainnya dengan adsorben dalam proses adsorpsi salah satunya adalah dipengaruhi oleh sifat logam dan ligan. Berdasarkan teori asam basa keras dan lunak (HSAB / Hard Soft Acid and Bases), suatu asam keras akan lebih menyukai basa keras, sedangkan asam lunak akan lebih menyukai basa lunak (Pearson, 1968).
9
kemampuannya dalam mengelusidasi ion Pb(II). Air dapat digunakan untuk mengelusi ion Pb(II) yang terjerat dalam rongga, kalium nitrat dapat untuk mengelusidasi ion yang terikat ionik lemah dan kuat, sedangkan
hidroksiamonium klorida dan natrium etilendiamin untuk mengelusidasi ion yang berikatan hidrogen dan berikatan secara kovalen koordinat.
Proses elusi (desorpsi) yang menunjukan mekanisme adsorpsi dari interaksi kation Pb(II) dengan adsorben yang terjadi pada sejumlah sisi aktif melalui suatu mekanisme. Interaksi antara ion Pb(II) dengan silika gel dan senyawa hibrida organo-silika berlangsung melalui berbagai mekanisme, bergantung pada sifat gugus fungsional pada silika gel dan hibrida organo-silika.
Menurut Martell dan Hancock (1996), adsorpsi dapat terjadi melalui beberapa mekanisme:
1. Mekanisme pemerangkapan
Silika gel maupun senyawa hibrida organo-silika merupakan adsorben yang berpori sehinga dimungkinkan untuk mengadsorpsi ion logam dengan
menjebaknya dalam pori-pori. Mekanisme ini akan terjadi apabila ukuran pori dari adsorben lebih besar daripada ukuran ion yang akan diadsorpsi.
2. Mekanisme pertukaran ion
dari selisih nilai elektronegatifitas dari masing-masing atom, maka ikatan pada gugus silanol lebih bersifat ionik dibandingkan ikatan pada gugus silakson yang cenderung lebih bersifat kovalen. Akibatnya, atom H pada gugus silanol akan lepas dan tergantikan oleh ion logam yang bersifat elektropositif.
Interaksi tersebut yang emungkinkan terjadinya adsorpsi ion logam melalui mekanisme pertukaran ion.
3. Pembentukan Ikatan Hidrogen
Dalam medium air, ion Pb(II) akan membentuk kompleks akuo oktahedral [Pb(H2O)6]2+. Ikatan hidrogen dapat terjadi antara oksigen dari gugus H2O
dalam kompleks oktahedral dengan gugus aktif siloksan dan silanol pada silika gel maupun gugus aktif pada hibrida organo-silika.
4. Pembentukan kompleks
Adsorpsi ion Pb(II) pada silika gel maupun hibrida organo-silika dapat terjadi melalui pembentukan kompleks antara gugus aktif adsorben sebagai ligan dengan ion Pb(II) sebagai atom pusat. Berdasarkan teori HSAB, ion Pb(II) merupakan golongan asam menengah, kemudian akan bereaksi dengan adsorben yang bersifat basa keras, menengah atau lunak yang memiliki gugus aktif dan membentuk suatu kompleks.
C. Parameter Adsorpsi 1. Kapasitas Adsorpsi
11
suatu perubahan konsentrasi pereaksi maupun produk dalam satuan waktu (Keenan,1984). Orde reaksi merupakan bagian dari persamaan laju reaksi. Orde reaksi terhadap suatu komponen menurut Atkins (1999) merupakan pangkat dari konsentrasi komponen itu, dalam persamaan laju reaksi.
1.1 Isoterm Adsorpsi Langmuir
Model kinetika adsorpsi Langmuir ini berdasarkan pada asumsi sebagai berikut: laju adsorpsi akan bergantung pada faktor ukuran dan struktur molekul adsorbat, sifat pelarut dan porositas adsorben, situs pada permukaan yang homogen dan adsorpsi terjadi secara monolayer. Proses adsorpsi heterogen memiliki dua tahap, yaitu : (a) perpindahan adsorbat dari fasa larutan ke permukaan adsorben dan (b) adsorpsi pada permukaan adsorben. Tahap pertama akan bergantung pada sifat pelarut dan adsorbat yang
terkontrol (Oscik,1982).
Bagian yang terpenting dalam proses adsorpsi yaitu situs yang dimiliki oleh adsorben yang terletak pada permukaan, akan tetapi jumlah situs-situs ini akan berkurang jika permukaan yang tertutup semakin bertambah (Husin and Rosnelly, 2005). Persamaan isoterm adsorpsi Langmuir tersebut dapat ditulis dalam bentuk persamaan linier :
(1)
Dimana C adalah konsentrasi kesetimbangan, m adalah jumlah zat yang teradsorpsi per gram adsorben, b adalah kapasitas adsorpsi dan K adalah
tetapan kesetimbangan adsorpsi. Dari kurva linier hubungan antara C/m
versus C maka dapat ditentukan nilai b dari kemiringan (slop) dan K dari intersep kurva. Energi adsorpsi (Eads) yang didefinisikan sebagai energi yang dihasilkan apabila satu mol ion logam teradsorpsi dalam adsorben dan nilainya ekuivalen dengan nilai negatif dari perubahan energi Gibbs standar, ΔG0 dapat dihitung menggunakan persamaan :
E = -ΔG0ads= RT ln K (2)
Dengan R adalah tetapan gas umum (8,314 J/mol K), T adalah temperatur (K) dan K adalah konstanta kesetimbangan yang diperoleh dari persamaan
Langmuir, sehingga energi total adsorpsi E harganya sama dengan negatif energi bebas Gibbs (Oscik, 1982).
1.2Isoterm Adsorpsi Freundlich
Model isoterm Freundlich menjelaskan bahwa proses adsorpsi pada bagian permukaan adalah heterogen dimana tidak semua permukaan adsorben mempunyai daya adsorpsi. Model isoterm Freundlich menunjukkan lapisan adsorbat yang terbentuk pada permukaan adsorben adalah multilayer. Hal tersebut berkaitan dengan ciri-ciri dari adsorpsi secara fisika dimana adsorpsi dapat terjadi pada banyak lapisan (multilayer) (Husin and Rosnelly, 2005). Bentuk persamaan Freundlich adalah sebagai berikut :
qe = Kf Ce 1/n (3)
13
Kf dan n adalah konstanta empiris yang tergantung pada sifat padatan, adsorbendan suhu (Soeprijanto et al., 2006). Penentuan konstanta Kf dan n
dapat dilakukan dengan linierisasi persamaan (3) :
log (qe) = log (Kf) +
� log (Ce) (4)
Kf dan n dapat dicari dengan membuat kurva ln(qe) berbanding ln(Ce). Kf
didapat dari titik potong dengan sumbu tegak dan n dari tangen arah garis lurus yang terbentuk. Koefisisen Kf sering dikaitkan dengan kapasitas adsorpsi
adsorben sehingga mencerminkan jumlah rongga dalam adsorben tersebut (Singh and Alloway, 2006).
1.3 Kinetika pseudo orde 1 dan orde 2
�
�� = ��� � +
�
�� (8)
Dengan qeadalah jumlah ion logam divalen yang teradsorpsi (mg/g) pada waktu keseimbangan, qt adalah jumlah ion logam divalent yang teradsorpsi pada waktu t (menit), k1 dan k2adalah konstanta kecepatan adsorpsi orde 1 dan orde 2 (menit-1).
2. Selektivitas Adsorpsi
Selektivitas adsorpsi merupakan kemampuan suatu adsorben untuk menyerap adsorbatnya. Selektivitas adsorpsi pada adssorben HAS (Hibrida Amino Silika) dan HMS (Hibrida Merkapto Silika) dipelajari dengan melakukan kompetisi adsorpsi ion Pb(II) terhadap pasangannya dengan ion Cd(II), Ni(II), Zn(II), dan Cu(II) dalam larutan. Ion-ion logam tersebut dipilih berdasarkan perbedaan jari-jari ionik dan perbedaan keasaman ion-ion logamnya (Buhani et al., 2010).
Untuk menentukan jumlah logam teradsorpsi, rasio distribusi dan koefisien selektivitas pada proses adsorpsi ion logam terhadap adsorben hibrida amino silika dan merkapto silika dapat digunakan persamaan berikut :
Q = (Co-Ca)V/W (9) D= Q/Ca
%A = (Co-Ca)/Co x 100
α = DM1/DM2
Dimana Q menyatakan jumlah logam teradsorpsi (mg/g), Co dan Ca
15
adalah massa adsorben (g), V adalah volume larutan ion logam (L), A (%) persentasi adsorpsi, D adalah rasio distribusi (mL/g), dan α adalah koefisien selektivitas (Buhani et al., 2009).
D. Silika Gel
Silika gel merupakan silika amorf yang tersusun dari tetrahedral SiO4 yang
tersusun secara tidak beraturan dan beragregasi membentuk kerangka tiga dimensi yang terbentuk karena kondensasi asam ortosilikat (Oscik, 1982). Struktur satuan mineral silika pada dasarnya mengandung kation Si4+ yang
terkoordinasi secara tetrahedral dengan anion O2-. Rumus kimia silika gel secara umum adalah SiO2.xH2O.
Silika gel memiliki sifat permukaan yang kompleks, gugus hidroksil yang tersebar tak berurutan dan masing-masing gugus terhidrasi dengan satu atau beberapa molekul air. Meskipun gugus silakson juga terdapat pada permukaan silika gel, namun adsorpsi spesifik pada material ini lebih tergantung pada gugus hidroksil (Oscik, 1982). Gugus hidroksil menempel kuat pada
permukaan silika gel sehingga permukaan ini lebih didominasi asam Bronsted. Adanya situs asam Bronsted pada permukaan menggunakan berbagai jenis gugus organik agar memiliki afinitas terhadap adsorbat tertentu (Shriver et al., 1990).
digunakan karena mempunyai beberapa kelebihan antara lain sangat inert, hidrofilik dan biaya sintesis yang cukup rendah. Di samping itu, bahan ini mempunyai kestabilan termal dan mekanik cukup tinggi, relatif tidak mengembang dalam pelarut organik jika dibandingkan dengan padatan polimer organik.
Kelemahan penggunan silika gel adalah rendahnya selektivitas dan efektivitas permukaan dalam berinteraksi dengan logam berat sehingga silika gel tidak mampu berfungsi sebagai adsorben yang efektif untuk logam berat. Hal ini terjadi karena situs aktif yang ada hanya berupa gugus silanol (Si-OH) dan siloksan (Si-O-Si). Akan tetapi kekurangan ini dapat diatasi dengan
memodifikasi permukaan dengan menggunakan situs aktif yang sesuai untuk mengadsorpsi ion logam berat yang dikehendaki. Silika yang belum
dimodifikasi terlebih dahulu dilaporkan dapat mengadsorpsi ion-ion logam berat seperti Na+, Mg2+, Ca2+, dan Fe3+ (Nuzula, 2004).
E. Modifikasi Permukaan Silika Gel
Modifikasi permukaan silika gel berhubungan dengan keseluruhan proses yang bertujuan untuk mengubah komposisi permukaan. Modifikasi akan mempengaruhi secara signifikan proses adsorpsi. Silika gel dapat digunakan langsung sebagai adsorben. Akan tetapi, untuk sebagian ion logam
17
Menurut Jal et al. (2004), berdasarkan jenis senyawa yang digunakan, modifikasi permukaan silika gel dapat dibedakan menjadi 2 jenis yaitu fungsionalisasi organik dimana agen pemodifikasi berupa gugus organik dan fungsionalisai anorganik diman gugus pemodifikasi dapat berupa senyawa organometalik atau oksida logam. Agen pemodifikasi dapat berinteraksi dengan silika gel melalui interaksi fisik dan kimiawi. Permukaan silika gel dapat dimodifikasi secara fisika dengan tujuan untuk mengubah perbandingan konsentrasi gugus silanol dan silakson atau secara kimia yang bertujuan untuk mengubah karakteristik kimia permukaan silika gel.
Modifikasi secara fisik. Modifikasi secara fisik dilakukan dengan penempelan secara fisik ligan pada padatan adsorben melalui impregnasi. Terada (1983) melaporkan bahwa 2-merkaptobenzimidazol (MBI) yang diimpregasikan pada padatan pendukung silika gel, karbon aktif dan politrifluorokloroetilen menggunakan bahan-bahan impregnan 2,5-dimerkapto-1,3,4-tiadizol (DMT), 2-merkaptobenzotiazol (MBT) dan 2-merkaptobenzimidazol (MBI) dapat digunakan untuk prekonsentrasi ion-ion logam pelarut air. Imobilisasi gugus tiol pada permukaan zeolit alam untuk adsorpsi Cu(II) dan Cd(II) juga telah dilakukan oleh Sriyanti et al. (2001) dan memberikan hasil rendah karena ligan kurang stabil dan dapat lepas kembali.
dengan permukaan gugus silanol dalam suatu langkah sehingga
memungkinkan pengikatan gugus fungsional terminal yang diinginkan pada permukaan (Jal et al., 2004).
Dalam suatu studi adsorpsi silika gel digunakan sebagai padatan pendukung yang diimpregnasikan dengan merkaptobenzotiazol (MBT) atau
2-merkaptobenzimidazol (MBI), Terada et al. (1983) melaporkan bahwa
adsorben ini sangat efektif mengadsorpsi Cu(II) dalam medium air. Lessi et al. (1996) kemudian memodifikasi permukaan silika gel dengan DMT dan
menghasilkan adsorben yang sangat stabil dalam etanol dan digunakan untuk mengadsorpsi Hg(II), Pb(II), Fe(II), Cd(II), Cu(II), Zn(II), Ni(II) dan Co(II) dalam etanol. Adsorben tersebut selanjutnya digunakan untuk pemisahan campuran biner ion-ion logam dalam etanol.
F. Proses Sol-gel
19
Pada proses sol-gel, bahan dasar yang digunakan untuk membentuk sol dapat berupa logam alkoksida seperti TEOS. Rumus kimia dari TEOS adalah Si(OC2H5 )4.
TEOS mudah terhidrolisis oleh air dan mudah digantikan oleh grup OH. Selanjutnya silanol (Si-OH) direaksikan antara keduanya atau direaksikan dengan grup alkoksida non hidrolisis untuk membentu ikatan siloxane (Si-O-Si) dan mulailah terbentuk jaringan silika. Reaksi tersebut dapat dilihat dari persamaan (Prassas, 2002):
Hidrolisis
≡Si-OR + H-OH ≡Si-OH + ROH
Polikondensasi
≡Si-OH + HO-Si≡ ≡Si-O-Si≡ + H2O
≡Si-OH + RO-Si≡ ≡Si-O-Si≡ + ROH
Jaringan silika amorf 3 dimensi (3D) dapat terbentuk pada temperatur ruang. Viskositas larutan secara kontinu meningkat dimana pada saat itu larutan akan menjadi gel. Parameter yang berpengaruh pada reaksi ini adalah pH,
(a) (b)
(b)
Proses sol-gel telah banyak dikembangkan terutama untuk pembuatan hibrida, kombinasi oksida anorganik (terutama silika) dengan alkoksisilan dan
digunakan sebagai adsorben. Adsorben hibrida amino silika dan hibrida merkapto silika merupakan adsorben yang efektif seperti yang telah dilakukan oleh Arakaki dan Airoldi (2000) dengan memodifikasi permukaan silika gel dengan cara mengikatkan gugus aktif merkapto (-SH) dari senyawa
penghubung 3-merkaptopropiltrimetoksisilan (3-MPTMS) yang diikuti pengikatan etilenimin(etn) menghasilkan padatan terimobilisasi yang stabil dan mampu mengekstrak Cu2+ pada medium air.
Sriyanti et al. (2005) membuat adsorben hibrida amino silika dari natrium silikat dan 3-aminopropiltrimetoksisilan (3-APTMS) menggunakan proses sol gel. Hasil yang diperoleh adalah kapasitas adsorpsinya meningkat pada pH gelasi 7.
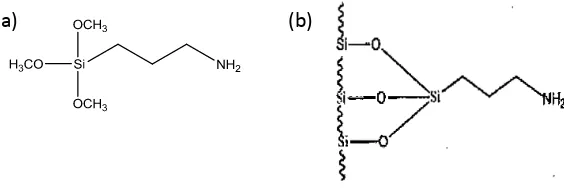
Gambar 2. A) 3-MPTMS dan B) HMS (Sumber : Buhani et al., 2009)
Gambar 3. (a) 3-APTMS dan (b) HAS (Sumber : Buhani et al., 2009)
21
G. Teknik Pencetakan Polimer
Pencetakan polimer merupakan metode yang banyak digunakan dalam proses adsorpsi suatu larutan, karena metode ini diketahui dapat meningkatkan kapasitas dan selektifitas adsorpsi melalui pencetakan dari polimer (Erzoz et al., 2004; Buhani et al., 2009). Terdapat dua metode pencetakan polimer,
yaitu molekul tercetak polimer dan ion tercetak polimer. kedua metode ini
tidak jauh berbeda, hanya saja metode ion tercetak polimer menggunakan ion
logam sedangkan molekul tercetak polimer menggunakan molekul sebagai
cetakan. Namun pada ion tercetak polimer masih tetap menggunakan sifat dari
molekul tercetak polimer (Bae et al., 1999).
1. Teknik Pencetakan Molekuler
Teknik pencetakan molekuler adalah metode yang dibuat untuk membentuk
suatu sisi aktif yang selektif terhadap molekul target melalui sintesis polimer
dengan membuat suatu cetakan (Sellergren, 2001; Cormack and Ellorza,
2004). Pencetakan molekuler dapat ditemukan dalam berbagai hasil, seperti
kromatografi cair (Kempe and Mosbach, 1995; Nicholls et al., 1995; Tamayo
et al., 2005), elektrokromatografi kapilar (Schweitz et al., 2001), dan ekstraksi
fase padat (Olsen et al., 1998). Schirmer dan Meisel (2008) melakukan sintesis dan evaluasi teknik pencetakan molekuler terhadap afinitas untuk
polipeptida nisin dan dihasilkan cetakan polimer yang memiliki afinitas yang
2. Teknik Pencetakan Ion
Teknik pencetakan ion bertujuan untuk mendapatkan adsorben yang selektif terhadap ion logam yang diinginkan. Teknik pencetakan ionik dapat
meningkatkan selektivitas karena ion logam berperan sebagai cetakan yang terbentuk dari polimer yang akan mencetak ion logam tersebut (Erzoz et al., 2004; Buhani et al., 2006). Jadi, ion cetakan akan dilepas dari matriks polimer
sehingga akan menyisakan hasil cetakan yang akan sangat selektif terhadap
ion yang dicetak. Selain itu, metode pencetakan ini relatif murah dan
senyawanya stabil pada suhu kamar untuk waktu yang cukup lama.
Teknik pencetakan ion memiliki keuntungan yang lebih besar dibandingkan teknik pencetakan molekuler dilihat dari penyiapannya yang simpel dan tingkat selektivitasnya yang sangat sesuai. Kenyataanya, kegunaan teknik pencetakan ionik sangat meyakinkan dalam pre-konsentrasi ekstraksi fasa-padat karena dapat digunakan pada konsentrasi analit yang rendah atau untuk pemisahan ion yang berikatan atau matriks kompleks.
23
Jadi, ion tercetak polimer untuk ekstraksi fasa-padat aplikasinya sangatlah cepat berkembang sebagai teknologi pencetakan ion (Daniel et al., 2005).
Buhani et al. (2009) membuat material merkapto-silika tercetak ionik
menggunakan proses sol-gel untuk digunakan sebagai adsorben yang selektif terhadap logam kadmium dan dibandingkan dengan yang tidak tercetak polimer. Hasilnya, teknik pencetakan ionik akan menghasilkan material yang selektif terhadap logam kadmium dan berbeda tingkat selektifnya
dibandingkan dengan yang tidak tercetak.
H. Karakterisasi
1. Scanning Electron Microscopy (SEM) dan Energy Dispersive X-Ray Spectrometer (EDX)
Untuk melakukan karakterisasi material yang heterogen pada permukaan bahan pada skala mikrometer atau bahkan submikrometer serta menentukan komposisi unsur sampel secara kualitatif maupun kuantitatif dapat dilakukan dengan menggunakan satu perangkat alat SEM yang dirangkaikan dengan EDX. Pada SEM dapat diamati karakteristik bentuk, struktur, serta distribusi pori pada permukaan bahan, sedangkan komposisi serta kadar unsur yang terkandung dalam sampel dapat dianalisis dengan menggunakan EDX. Karakterisasi menggunakan SEM-EDX dilakukan melalui adsorpsi isotermis gas oleh padatan sampel. Jumlah molekul gas yang diadsorpsi pada
Prinsip kerja SEM, dengan cara mengalirkan arus pada kawat filamen tersebut dan perlakuan pemanasan, sehingga dihasilkan elektron. Elektron tersebut dikumpulkan dengan tegangan tinggi dan berkas elektron difokuskan dengan sederetan lensa elektromagnetik. Ketika berkas elektron mengenai target, informasi dikumpulkan melalui tabung sinar katoda yang mengatur
intensitasnya. Setiap jumlah sinar yang dihasilkan dari tabung sinar katoda dihubungkan dengan jumlah target, jika terkena berkas elektron berenergi tinggi dan menembus permukaaan target, elektron kehilangan energi, karena terjadi ionisasi atom dari cuplikan padatan. Elektron bebas ini tersebar keluar dari aliran sinar utama, sehingga tercipta lebih banyak elektron bebas, dengan demikian energinya habis lalu melepaskan diri dari target. Elektron ini kemudian dialirkan ke unit demagnifikasi dan dideteksi oleh detektor dan selanjutnya dicatat sebagai suatu foto (Wagiyo dan Handayani, 1997). Pada EDX analisis kualitatif dilakukan dengan cara menentukan energi dari puncak yang ada dalam spektrum dan membandingkan dengan tabel energi emisi sinar-x dari unsur-unsur yang sudah diketahui. Analisa kuantitatif tidak hanya menjawab unsur apa yang ada dalam sampel tetapi juga konsentrasi unsur tersebut. Untuk melakukan analisa kuantitatif maka perlu dilakukan beberapa proses antara lain meniadakan background, dekonvolusi peak yang bertumpang tindih dan menghitung konsentrasi unsur (Larry, 2001).
2. Spektrofotometer IR
25
diserapnya. Vibrasi ulur dan tekuk adalah cara vibrasi yang dapat diekstitasi oleh sinar dengan bilangan gelombang (jumlah gelombang per satuan
panjang) dalam rentang 1200-4000 cm-1. Hampir semua gugus fungsi organik
memiliki bilangan gelombang serapan khas di daerah tertentu. Jadi daerah ini disebut daerah gugus fungsi dan absorpsinya disebut absorpsi khas.
Analisis menggunakan spektrofotometer IR digunakan sebagai indikasi kualitatif keberhasilan dalam suatu sintesis. Untuk mengetahui keberhasilan sintesis suatu material seperti HMS atau HAS dapat dilihat dari spektra yang dihasilkan. Pita serapan HMS atau HAS pada bilangan gelombang disekitar 3448,5 cm-1 yang merupakan vibrasi ulur gugus –OH dari Si-OH dan pita serapan pada bilangan gelombang disekitar 918,1 cm-1 yang merupakan
vibrasi ulur Si-O dari Si-OH. Menurut Wiliam dan Fleming pada Taslimah pada Mujiayanti (2005), gugus –SH menghasilkan pita serapan yang lemah pada spektra IR, lebih lemah dari gugus –OH. Vibrasi dari gugus –SH muncul pada bilangan gelombang sekitar 2600-2450 cm-1 (Mujiyanti, 2005). Serapan pada bilangan gelombang 3290,3 cm-1 yang menunjukan vibrasi ulur simetris
dari alifatik primer, serapan 2966,3 cm-1 yang menunjukan vibrasi ulur dari rantai alifatik –C-H, didukung dengan vibrasi bengkok simetris dari –CH2-
yang muncul pada serapan 1473,5 cm-1. Serapan yang muncul sekitar 1542,9 cm-1 merupakan vibrasi bengkok simetris dari -N-H (Silverstein et al., 1991).
3. Spektrofotometer Serapan Atom (SSA)
cahaya pada panjang gelombang tertentu yang energinya sesuai dengan energi yang diperlukan untuk transisi elektron-elektron dari atom yang bersangkutan di tingkat yang lebih tinggi, sedangkan energi transisi untuk masing-masing unsur adalah sangat khas. Metode ini sangat tepat untuk analisis zat pada konsentrasi rendah. Teknik ini mempunyai beberapa kelebihan dibandingkan dengan metode spektroskopi emisi konvensional. Pada metode konvensional emisi tergantung pada sumber eksitasi, bila eksitasi dilakukan secara termal maka akan tergantung pada temperatur sumber (Khopkar, 2001).
27
III. METODELOGI PENELITIAN
A.Waktu dan Tempat
Penelitian ini dilakukan pada bulan Juni tahun 2011 sampai dengan September tahun 2011 di Laboratorium Kimia Anorganik Jurusan Kimia Universitas Lampung, Laboratorium Biokimia Jurusan Kimia Universitas Lampung analisis menggunakan alat spektrofotometer IR dilakukan di Laboratorium Kimia Organik FMIPA Universitas Gajah Mada, analisis kandungan ion logam menggunakan SSA dilakukan di Laboratorium Kimia Analitik FMIPA Universitas Gajah Mada , dan karakterisasi menggunakan SEM-EDX dilakukan di Laboratorium Geologi Kuarter (P3GL) Bandung.
B. Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini antara lain alat-alat gelas
laboratorium, gelas plastik, pengaduk magnet, termometer, oven, pH indikator universal,Shaker, Sentrifuga, spektrofotometer IR, Scanning Electron
Microscope-Energy Dispersive X-Ray Spectrometer (SEM-EDX), Spektrofotometer serapan atom (SSA).
etanol p.a Merck, etanol teknis, akuades, HCl,KNO3,NH4OH, NaOH, Na2EDTA, 3-aminopropiltrimetoksisilan APTMS), 3-merkaptopropiltrimetoksisilan (3-MPTMS) dan kertas saring Whatman No.42.
C. Prosedur Penelitian
1. Sintesis
a. Silika-gel
Sebanyak 5 mL TEOS dicampurkan dengan 5 mL akuades dan 5 mL etanol yang dimasukkan dalam wadah plastik. Selanjutnya ditambahkan beberapa tetes HCl 1M sampai pH 2. Kemudian di aduk dengan pengaduk magnet selama 30 menit sampai larutan tersebut homogen. Selama pengadukan berlangsung, dimasukkan beberapa tetes NH4OH 1M sampai kondisi pH larutan menjadi 5. Setelah
terbentuk silika gel basah, gel disaring dan didiamkan selama 24 jam, digerus dengan mortar sampai ukuran partikelnya antara 100-200 mesh. Kemudian dilakukan pencucian sampai pH mendekati netral (pH≈7). Setelah itu dikeringkan dalam oven pada suhu 600 C.
b. Material HAS dari TEOS
29
Kemudian dilakukan pencucian sampai pada pH netral (pH≈7). Setelah itu
dikeringkan dalam oven pada suhu 600C (Sriyanti et al.,2005, Buhani et al.,2009).
c. Material HMS dari TEOS
Sebanyak 5 mL TEOS dicampurkan dengan 5 mL akuades dan 5 mL etanol yang dimasukkan dalam wadah plastik. Selanjutnya ditambahkan beberapa tetes HCl 1M sampai pH 2.Kemudian ditambahkan 2 mL 3-MPTMS. Campuran tersebut diaduk dengan pengaduk magnet selama 30 menit sampai larutan tersebut homogen. Selanjutnya, ditambahkan beberapa tetes NH4OH 0,1M sampai pH 5. Setelah terbentuk gel basah, gel disaring dan didiamkan selama 24 jam,digerus dengan mortar sampai ukuran partikelnya antara 100-200 mesh. Kemudian dilakukan pencucian sampai pH mendekati netral (pH≈7). Setelah itu dikeringkan dalam oven pada suhu 600C (Mujiyanti, 2005, Buhani et al., 2009).
d. Material HAS Tercetak ion Pb(II) (HAS t-Pb(II))
Larutan (a) disiapkan dari 4 mL Pb(NO3)20,1 M yang dicampurkan dengan2 mL 3-APTMS. Setelah itu campuran diaduk dengan pengaduk magnet selama 1 jam pada suhu 400-500C. Larutan (b), disiapkan dari5 mL TEOS dicampurkan dengan 5 mL akuades dan 5 mL etanol yang dimasukkan kedalam wadah plastik.
Untuk pelepasan ion logam dari matriks, gel kering yang telah tercetak ion direndam dalam 25 mL larutan Na2EDTA 0,1 M selama 24 jam dilanjutkan dengan penyaringan kemudian dibilas dengan 25 mL HCl 0,5 M dan dinetralkan dengan akuades sampai pH ≈7. Setelah itu, dikeringkan dengan oven pada suhu 600C selama 6 jam. Setelah diperoleh gel kering, digerus dengan mortar sampai ukuran partikelnya antara 100-200 mesh (Buhani et al., 2010).
e. Material HMS Tercetak ion Pb(II) (HMS t-Pb(II))
Larutan (a) disiapkan dari 4 mL Pb(NO3)2 0,1 M yang dicampurkan dengan2 mL 3-MPTMS. Setelah itu campuran diaduk dengan pengaduk magnet selama 1 jam pada suhu 400-500C. Larutan (b), disiapkan dari5 mL TEOS dicampurkan dengan 5 mL akuades dan 5 mL etanol yang dimasukkan kedalam wadah plastik.
Kemudan ditambahkan beberapa tetes HCl 0,1 M kedalam larutan sampai pH 2. Kemudian diaduk dengan pengaduk magnet selama 30 menit. Larutan (a) dan (b) dicampur dan ditambahkan larutan NH4OH 0,1M sampai pH 5 sambil dilakukan pengadukan selama 30 menit. Gel yang terbentuk disaring dan didiamkan selama 24 jam,digerus dengan mortar sampai ukuran partikelnya antara 100-200 mesh.
31
2. Karakterisasi
Material hasil sintesis dikarakterisasi meliputi gugus fungsinya dengan menggunakan spektrofotometer IR, morfologi dan komposisi unsur dengan menggunakan SEM-EDX, dan kadar ion logam dengan menggunakan SSA.
3. Uji adsorpsi a. Waktu Interaksi
Sebanyak 100 mg adsorben HAS-t-Pb(II) atau HMS-t-Pb(II) serta HAS atau HMS masing-masing ditambahkan 25 mL larutanPb(II) 100 mg/L dengan pH 5.
Kemudian dilakukan variasi waktu interaksi yaitu 5, 15, 30, 45, 60,dan 90 menit. Setelah dilakukan variasi waktu interaksi, masing-masing larutan di aduk
kemudian sentrifugasi. Setelah filtrat dan endapannya terpisah, filtrat dianalisis dengan AAS.
b. Kapasitas Adsorpsi
c. Selektivitas Adsorpsi
55
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil yang diperoleh dari penelitian yang telah dilakukan maka dapat disimpulkan sebagai berikut :
1. Laju adsorpsi ion Pb(II) pada material HAS-t-Pb(II) dan HMS-t-Pb(II) mengikuti kinetika pseudo orde dua dengan nilai k2 masing-masing sebesar 1,07 dan 33,30 g mmol-1menit-1.
2. Isoterm adsorpsi ion Pb(II) pada material HAS-t-Ni(II) dan HMS-t-Pb(II) cenderung mengikuti model isoterm adsorpsi Freundlich yang menghasilkan kapasitas adsorpsi masing-masing sebesar 15,15dan 28,57 mol g-1.
3. Energi adsorpsi ion Pb(II) pada material HAS-t-Pb(II) dan HMS-t-Pb(II) masing-masing sebesar 16,92 dan 16,67 kJ mol-1.
4. Material HAS-t-Pb(II) dan HMS-t-Pb(II) lebih selektif terhadap ion Pb(II) dibandingkan pasangan ion Zn(II), Ni(II),dan Cd(II) denganα>1.
B. Saran