MODIFIKASI SILIKA DENGAN 3-AMINOPROPILTRIMETOKSISILAN MELALUI
PROSES SOL GEL UNTUK ADSORPSI ION Cd(II) DARI LARUTAN
Buhani* dan Suharso
Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung, Indonesia
*E-mail: [email protected]
ABSTRACT
Synthesis of amino-silica hybrid (HAS) adsorbent has been performed through sol-gel process using active compound of 3-aminopropyl trimethoxysilane (3-APTMS) with tetraethyl ortosilicate (TEOS) precursor. Adsorption of Cd(II) ion by HAS adsorbent is optimum at pH 6 and follows Langmuir isotherm adsorption. Adsorption capacity of Cd(II) ion on HAS adsorbent is higher than on silica gel (SG) adsorbent with Cd(II) ion
adsorption capacity on SG, HAS-1, HAS-2, and HAS-3 for each of 9.749; 23.370; 28.823; 25.548 mg g-1,
respectively. Composition ratio of TEOS precursor volume and active compound of 3-APTMS is optimum at 1 : 0.2 in HAS synthesis.
Keywords: amino-silica hybrid, sol-gel, adsorption ABSTRAK
Sintesis adsorben hibrida amino-silika (HAS) telah dilakukan melalui proses sol-gel menggunakan senyawa aktif 3-aminopropiltrimetoksisilan (3-APTMS) dengan prekursor tetraetil ortosilikat (TEOS). Adsorpsi ion Cd(II) oleh adsorben HAS optimum pada pH 6 dan mengikuti isoterm adsorpsi Langmuir. Adsorpsi ion Cd(II) pada adsorben HAS lebih besar dari silika gel (SG) dengan kapasitas adsorpsi ion Cd(II) pada SG,
HAS-1, HAS-2 dan HAS-3 masing-masing adalah 9,749; 23,370; 28,823; 25,548 mg g-1. Perbandingan
komposisi jumlah volume prekursor TEOS dan senyawa aktif 3-APTMS optimal dalam sintesis HAS adalah 1 : 0,2.
Kata kunci: Hibrida amino-silika, sol-gel, adsorpsi
1. PENDAHULUAN
Silika gel merupakan padatan pendukung yang banyak digunakan dalam proses adsorpsi karena stabil pada kondisi asam, non swelling, memiliki karakteristik pertukaran massa yang tinggi, porositas dan luas permukaan spesifik serta memiliki daya tahan tinggi terhadap panas. Selain itu silika gel memiliki situs aktif berupa gugus silanol (≡SiOH) dan siloksan (≡Si-O-Si≡) di permukaan. Adanya gugus -OH memberikan
peluang secara luas untuk memodifikasi gugus tersebut menjadi gugus lain yang lebih aktif 1-3).
Kelemahan penggunaan silika gel sebagai adsorben adalah rendahnya efektivitas adsorpsi silika terhadap ion logam, ini disebabkan oleh rendahnya kemampuan oksigen (silanol dan siloksan) sebagai donor pasangan elektron, yang berakibat lemahnya ikatan ion logam pada permukaan silika.
Berbagai upaya telah dilakukan untuk memperbaiki kelemahan silika akibat ikatan langsung oksigen pada silika, antara lain dengan memodifikasi permukaan silika dengan senyawa organik mengandung ligan yang secara khusus diharapkan berinteraksi dengan ion logam. Modifikasi silika gel secara kimia atau organofungsionalisasi dapat dilakukan melalui dua jalur, yaitu jalur heterogen dan jalur homogen. Jalur heterogen (tidak langsung) terjadi melalui pengikatan langsung agen silan dengan gugus silanol pada silika gel kemudian diikuti dengan immobilisasi gugus aktif.
Teknik modifikasi permukaan silika gel secara langsung dengan mengembangkan reaksi antara gugus silanol dengan reagen silan yang berfungsi sebagai prekursor untuk immobilisasi molekul organik dan bersama-sama dengan gugus aktif lain yang diimmobilisasikan disebut sebagai jalur homogen (langsung). Pada umumnya, reagen silan bereaksi dengan permukaan gugus silanol dalam satu langkah sehingga
Apabila dibandingkan dengan jalur heterogen, immobilisasi melalui jalur homogen lebih sederhana dan cepat karena reaksi pengikatan berlangsung bersamaan dengan proses terbentuknya padatan. Selain itu senyawa aktif yang terikat pada permukaan silika lebih banyak, dan dari segi waktu preparasi lebih sederhana. Dengan demikian memberikan peluang untuk mendapatkan adsorben yang efektif dalam
mengadsorpsi ion logam5,6).
Proses sol-gel merupakan salah satu cara yang digunakan untuk memodifikasi permukaan silika gel melalui jalur homogen. Beberapa keunggulan teknik sol-gel yang antara lain, homogen, memiliki kemurnian tinggi, dapat dipreparasi pada temperatur rendah, bercampur dengan baik pada sistem multi-komponen, ukuran, bentuk dan sifat partikel dapat dikontrol, dan dapat dibuat material hibrida-organik serta dapat
digunakan untuk meningkatkan selektivitas dalam kromatografi7).
Dengan proses sol-gel diharapkan proses immobilisasi silika dengan gugus aktif lebih bersifat homogen sehingga akan diperoleh adsorben yang memiliki kesetabilan mekanik dan kimia yang baik. Pada penelitian ini telah dilakukan modifikasi permukaan silika melalui proses sol gel menggunakan prekursor TEOS dengan gugus amin dari senyawa 3-APTMS. Gugus tersebut dipilih untuk meningkatkan kapasitas adsorpsi adsorben terhadap ion logam Cd(II) dalam larutan. Selain itu juga dikaji pengaruh variasi volume senyawa aktif 3-APTMS pada prekursor TEOS terhadap karakteristik adsorben dan sifat adsorpsi HAS terhadap ion Cd(II) untuk mengetahui komposisi larutan prekursor dan senyawa aktif yang dapat menghasilkan adsorben dengan kapasitas adsorpsi besar.
2. METODE PENELITIAN 2.1. Bahan dan Alat
Bahan yang digunakan adalah 3-APTMS berasal dari Aldrich. TEOS, etanol, CdCl2.H2O, CH3COONa,
asam asetat, kertas saring Whatman 42, dan kertas indikator universal berasal dari E-Merck. HCl dan NaOH dari Alba.
Peralatan yang digunakan adalah perlatan gelas, timbangan analitik (Mettler AE 160), alat penggerus (lumpang dan mortar), ayakan ukuran 200 mesh ”Fischer”, Oven (Fisher Scientific), pengaduk magnet, sentrifugator (OSK 6474B Sentrifuge), dan pH meter. Spektrofotometer serapan atom (SSA) (Perkin Elmer
3110) dan spektrofotometer inframerah (IR)Prestige-21 Shimadzu masing-masing digunakan untuk analisis
logam dan identifikasi gugus fungsional.
2.2. Prosedur Penelitian
2.2.1. Pembuatan adsorben silika gel dan HAS
Sebanyak 10 mL TEOS, akuades dan etanol dimasukkan ke dalam gelas plastik, kemudian ditambah 1, 2, dan 4 mL 3-APTMS kemudian diaduk dengan pengaduk magnet. Setelah diaduk dengan pengaduk magnet ± 30 menit gel terbentuk. Gel yang terbentuk didiamkan selama 24 jam, disaring dan gel yang diperoleh dibilas dengan etanol. Kemudian dilanjutkan dengan pencucian dengan akuades hingga netral dan
dikeringkan pada temperatur 60oC selama 6 jam. Adsorben yang dihasilkan selanjutnya disebut sebagai
hibrida amino-silika (1 : 1 : 1 : 0,1) atau HAS-1, HAS-2 (1 : 1 : 1 : 0,2) dan HAS-3 (1 : 1 : 1 : 0,4).
Adsorben silika gel (SG), dibuat melalui prosedur yang sama dengan HAS tetapi tanpa penambahan senyawa aktif.
2.2.2. Karakterisasi adsorben
Untuk menentukan gugus-gugus fungsional yang ada di dalam adsorben dilakukan analisis dengan FTIR.
2.3. Adsorpsi
2.3.1. Pengaruh pH
Sebanyak 50 mg adsorben diinteraksikan dengan ion logam Cd(II) 100 mg L-1 pada pH yang bervariasi
: 2 - 8, larutan diberikan buffer Na-asetat/HCl (pH 2-3), Na-asetat/asam asetat (pH 4-6) dan diaduk selama satu jam. Kemudian larutan disentrifugasi, filtrat diambil untuk dianalisis kadar logam yang tersisa dalam
Sebanyak 50 mg adsorben diinteraksikan dengan larutan ion logam Cd(II) dengan variasi konsentrasi :
0,0 – 250,0 mg L-1. Adsorpsi dilakukan dalam sistem batch menggunakan pengaduk magnet dengan pH
optimum (a). Kemudian larutan disentrifugasi, filtrat diambil untuk dianalisis kadar logam yang tersisa dalam larutan dengan SSA.
3. HASIL DAN PEMBAHASAN 3.1. Sintesis Adsorben HAS
Pembuatan HAS dilakukan dengan menggunakan TEOS sebagai prekursor dan senyawa aktif 3-APTMS. Reaksi berlangsung pada kondisi basa sekitar pH 10 dan waktu pembentukan gel relatif cepat sekitar 30 menit. Skema pembentukan HAS dari prekursor TEOS ditampilkan pada Gambar 1.
C2H5O Si OC2H5 OH OC2H5 + H2N Si OCH3 OCH3 OCH3 Si Si Si O O O Si NH2 -3 C2H5OH + 3CH3OH
TEOS 3-APTMS HAS
Gambar 1. Skema sintesis HAS dari prekursor TEOS dengan 3-APTMS
Pada kondisi basa reaksi dapat berlangsung karena terjadi serangan nukleofilik atom silikon oleh ion
OH- atau SiO-. Ion OH- atau SiO- terbentuk oleh dissosiasi H+ dari molekul air atau gugus SiOH. Mekanisme
reaksi pembentukan gel HAS dari TEOS diawali dengan serangan anion hidroksida (OH-) pada reaksi
hidrolisis dengan mekanisme SN2 terhadap atom silikon dan menghasilkan ion silanolat dan melepas etanol
yang diikuti protonasi oleh H+ terhadap atom oksigen pada gugus metoksi (-OCH
3) dalam senyawa 3-APTMS.
Pada reaksi kondensasi, nukleofilik ion silanolat menyerang atom Si dari senyawa 3-APTMS dan membentuk ikatan siloksan (≡Si-O-Si≡) dengan melepas metanol.
3.2. Identifikasi Gugus Fungsional
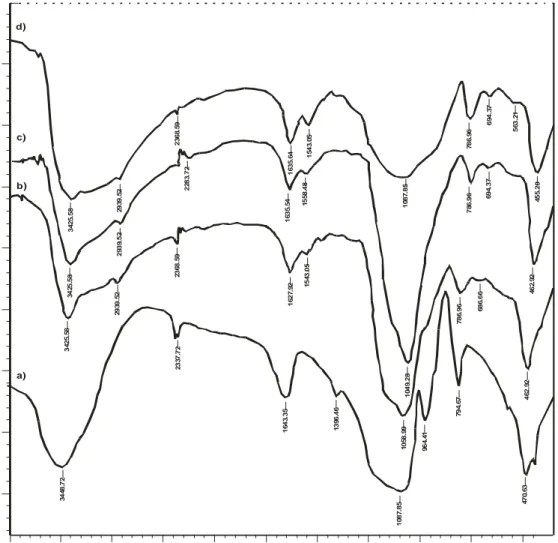
Proses modifikasi silika dengan 3-APTMS mengakibatkan adanya perubahan-perubahan pada pita serapan inframerah (Gambar 2b-d) dibandingkan dengan pita serapan SG (Gambar 2a), yaitu muncul pita
serapan baru pada 2939,52 yang merupakan vibrasi ulur dari gugus CH2. Dan hilangnya pita serapan pada
964,41 cm-1 (vibrasi ulur Si-O dari Si-OH) pada HAS karena berkurangnya jumlah gugus silanol akibat
terjadinya kondensasi dengan senyawa amin dan terbentuk serapan lebar disekitar 1640-1560 cm-1 yang
menunjukkan adanya vibrasi tekuk amina (N-H) primer. Perubahan lain adalah terjadinya pergeseran bilangan gelombang dan perubahan intensitas serapan tertentu pada HAS dibanding SG, menunjukkan telah
terbentuk senyawa yang berbeda8).
3.3. Pengaruh pH Adsorpsi
Pengaruh pH pada adsorpsi ion Cd(II) pada adsorben HAS seperti yang terdapat pada Gambar 3 menunjukkan bahwa adsorpsi ion Cd(II) oleh HAS-1, HAS-2 dan HAS-3 relatif kecil pada pH 2-3, ini terjadi karena pada pH asam proses adsorpsi ion Cd(II) oleh adsorben HAS tidak bisa maksimal. Pada kondisi
asam gugus amin (-NH2) pada adsorben HAS mengalami protonasi menjadi NH3+ sehingga interaksi antara
ion Cd(II) dengan situs aktif pada adsorben HAS cenderung terjadi secara elektrostatik. Sementara itu ion-ion logam dalam larutan sebelum teradsorpsi oleh adsorben terlebih dahulu mengalami hidrolisis, menghasilkan
proton (H+) dan kompleks hidrokso [M(OH)
n2-n]+ yang akan lebih teradsorpsi daripada kation logam bebas
(M2+)9). Pada kondisi asam jumlah kompleks hidrokso logam yang terbentuk lebih sedikit dan jumlah kation
logam bebas lebih banyak. Dalam kondisi asam permukaan adsorben juga bermuatan positif, sehingga akan terjadi tolakan antara permukaan adsorben dengan ion logam, akibatnya adsorpsi rendah.
% T ra n s m it a n s i 4000 3500 3000 2500 2000 1750 1500 1250 1000 750 500 Bilangan gelombang 1/cm 2 9 3 9 .5 2 2 3 6 8 .5 9 1 6 3 5 .6 4 154 3 .0 5 1 0 8 7 .8 5 7 8 6 .9 6 6 9 4 .3 7 5 6 3 .2 1 4 5 5 .2 0 3 4 2 5 .5 8 3 4 2 5 .5 8 2 9 3 9 .5 2 2 2 8 3 .7 2 1 6 3 5 .5 4 155 8 .4 8 1 0 4 9 .2 8 7 8 6 .9 6 69 4 .3 7 4 6 2 .9 2 3 4 2 5 .5 8 2 9 3 9 .5 2 2 3 6 8 .5 9 1 6 2 7 .9 2 15 4 3 .0 5 1 0 5 8 .9 9 7 8 6 .9 6 6 8 6 .6 6 4 6 2 .9 2 3 4 4 8 .7 2 2 3 3 7 .7 2 1 6 4 3 .3 5 1 3 9 6 .4 6 1 0 8 7 .8 5 9 6 4 .4 1 7 9 4 .6 7 4 7 0 .6 3 d) c) b) a)
Gambar 2. Spektra inframerah adsorben dari prekursor TEOS (a) silika, (b) HAS-1, (c) HAS-2 dan (d) HAS-3
0 10 20 30 40 50 60 70 1 2 3 4 5 6 7 8 9 pH interaksi C d t e ra d s o rp s i (% )
HAS-1 HAS-2 HAS-3
antara ion Cd(II) dengan situs aktif adsorben HAS secara kovalen koordinasi. Selain itu juga pada adsorben HAS dimungkinkan juga masih terdapat gugus –OH (silanol) dan –Si-O-Si- (siloksan) yang juga dapat berperan sebagai donor pada kondisi tersebut, karena cenderung bermuatan negatif. Interaksi ion Cd(II) dan pada adsorben HAS, merupakan interaksi yang kuat, sehingga proses adsorpsi yang terjadi pada pH 6 menghasilkan jumlah ion logam yang teradsorpsi maksimum. Pada pH 7 - 8 jumlah ion Cd(II) yang teradsorpsi mulai menurun karena pada pH tersebut ion Cd(II) sudah mulai mengendap.
3.4. Kapasitas dan Energi Adsorpsi
0 50 100 150 200 250 300 0 250 500 750 1000 1250 1500 1750 2000 2250 [Cd] kesetimbangan ( µmol/L) C d t e ra d s o rp s i ( µ m o l/ g )
SG HAS-1 HAS-2 HAS-3
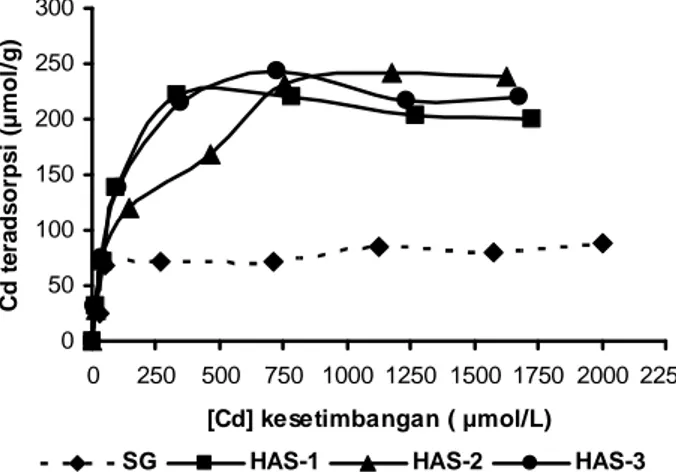
Gambar 4. Kurva hubungan antara jumlah ion logam teradsorpsi pada adsorben SG dan HAS yang terbuat
dari prekursor TEOS terhadap konsentrasi ion logam Cd(II) dalam keadaan setimbang
Dari Gambar 4 dapat dilihat bahwa adsorpsi ion Cd(II) oleh adsorben HAS menunjukkan kecenderungan peningkatan adsorpsi secara signifikan sesuai dengan meningkatnya konsentrasi ion logam yang dipaparkan, apabila dibandingkan dengan adsorben SG yang peningkatan adsorpsi ion logam terjadi secara perlahan-lahan. Peningkatan konsentrasi ion logam yang dipaparkan ternyata tidak meningkatkan jumlah ion logam teradsorpsi, ini menunjukkan bahwa adsorben sudah jenuh.
Data pada Gambar 4 dievaluasi menggunakan persamaan isoterm adsorpsi Freundlich dan Langmuir yang masing-masing terdapat pada Persamaan 1 dan 2, sedangkan energi adsorpsi ditentukan berdasarkan
persamaan energi bebas Gibbs Persamaan 3. Bentuk umum persamaaan Freundlich adalah qe = KfCe1/n ,
dimana Kf adalah faktor kapasitas adsorpsi dan n adalah faktor intensitas, dengan harga n berkisar antara
1-1010,11). Persamaan linier Freundlich dinyatakan sebagai berikut: e f e C n K q log 1log log = + (1)
Selanjutnya, plot log qe versus log Ce akan menghasilkan Kf dan eksponen n.
Isoterm Langmuir menggambarkan bahwa pada permukaan adsorben terdapat sejumlah tertentu situs aktif yang sebanding dengan luas permukaan. Persamaan Langmuir dinyatakan sebagai berikut :
m e m e Q KC Q q 1 1 1 = + (2)
Dimana Ce (mg L-1) adalah konsentrasi kesetimbangan larutan ion logam, qe (mg g-1) adalah kapasitas
adsorpsi ion logam pada saat kesetimbangan. Qm kapasitas adsorpsi monolayer adsorben dan K adalah
konstanta energi adsorpsi. Selanjutnya, plot log Ce/qe versus Ce akan menghasilkan garis lurus. Energi
adsorpsi ditentukan berdasarkan persamaan energi bebas Gibbs.
Energi adsorpsi = ∆Gº ads = - R T ln K (3)
Dengan E = energi adsorpsi (kJ mol-1), R = tetapan gas universal (8,314 J K-1 mol-1), T = temperatur (Kelvin)
dan K = tetapan kesetimbangan adsorpsi.
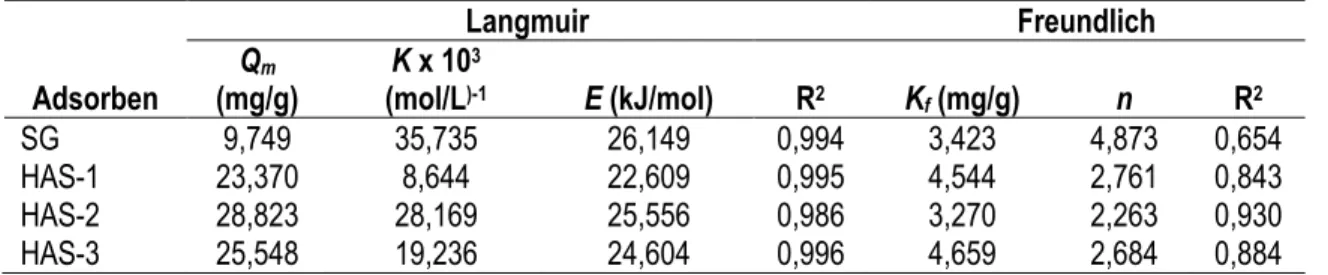
Data adsorpsi ion Cd(II)) pada adsorben SG dan HAS yang diperoleh dari hasil analisis menggunakan persamaan Langmuir dan Freundlich disajikan dalam Tabel 1.
Tabel 1. Parameter Langmuir adsorpsi ion Cd(II) pada SG dan HAS Adsorben Langmuir Freundlich Qm (mg/g) K x 103 (mol/L)-1 E (kJ/mol) R2 K f (mg/g) n R2 SG 9,749 35,735 26,149 0,994 3,423 4,873 0,654 HAS-1 23,370 8,644 22,609 0,995 4,544 2,761 0,843 HAS-2 28,823 28,169 25,556 0,986 3,270 2,263 0,930 HAS-3 25,548 19,236 24,604 0,996 4,659 2,684 0,884
Secara umum dari Tabel 1 dapat diamati bahwa pola isoterm adsorpsi ion Cd(II) cenderung mengikuti
isoterm adsorpsi Langmuir dengan harga koefisien regresi (R2) rata-rata 0,99. Hal ini memberikan indikasi
bahwa adsorpsi ion Cd(II) pada adsorben SG dan HAS tersebut bersifat monolayer. Menurut teori adsorpsi Langmuir proses adsorpsi merupakan interaksi antara adsorbat dengan situs aktif adsorben. Pada permukaan adsorben terdapat situs aktif dengan jumlah yang sebanding luas permukaan adsorben. Pada saat situs aktif tersebut belum jenuh oleh adsorbat peningkatan konsentrasi adsorbat disertai dengan peningkatan jumlah adsorbat yang teradsorpsi, tetapi bila situs aktif tersebut telah jenuh maka peningkatan
konsentrasi adsorbat tidak lagi disertai peningkatan jumlah adsorbat yang teradsorpsi secara signifikan12).
Dari Tabel 1 dapat dilihat secara umum tampak bahwa kapasitas adsorpsi adsorben yang berasal dari modifikasi silika gel dengan gugus amin dari senyawa 3-APTMS lebih besar dibandingkan dengan SG. Silika gel yang tidak dimodifikasi dapat mengadsorpsi ion logam melalui gugus silanol OH) dan siloksan (≡Si-O-Si≡), tetapi kurang efektif. Hal ini disebabkan pengaruh terikatnya langsung atom O pada Si, sehingga berpeluang terjadinya ikatan rangkap parsial antara O dan Si melalui πd-p yang menyebabkan rendahnya kemampuan O dalam struktur silika sebagai donor elektron.
Setelah dilakukan modifikasi melalui proses sol gel menggunakan senyawa aktif 3-APTMS ternyata meningkatkan jumlah ion Cd(II) yang teradsorpsi. Peningkatan kapasitas adsorpsi ini disebabkan bertambahnya jenis dan jumlah situs aktif yang berperan dalam mengadsorpsi ion logam selain gugus siloksan dan silanol yang terdapat pada silika gel. Pada adsorben HAS terdapat gugus aktif baru, yaitu gugus amina.
Lebih lanjut dari data yang terdapat pada Tabel 1 dapat diamati bahwa kapasitas adsorpsi ion Cd(II) pada adsorben HAS-2 lebih besar dari adsorben HAS-1 dan HAS-3, ini menunjukkan bahwa pada HAS-2
jumlah situs aktif gugus –NH2 yang diimmobilisasikan terdapat dalam jumlah yang lebih optimal dari adsorben
HAS-1 dan HAS-3. Dari data pengaruh pH (Gambar 3) dan kapasitas adsorpsi tersebut (Tabel 1) menunjukkan bahwa perbandingan komposisi jumlah volume senyawa aktif 3-APTMS secara stoikiometri pada sintesis HAS lebih tepat dengan perbandingan volume TEOS dan senyawa aktif 1 : 0,2.
4. KESIMPULAN
Pengaruh pH pada adsorpsi ion Cd(II) oleh adsorben HAS optimum pada pH 6 dan mengikuti isoterm adsorpsi Langmuir. Kapasitas adsorpsi ion Cd(II) pada adsorben HAS lebih besar 3 kali lipat dari adsorben SG. Dari data pengaruh pH dan kapasitas adsorpsi ion Cd(II) pada HAS menunjukkan bahwa perbandingan komposisi jumlah volume yang optimal dalam sintesis HAS adalah TEOS dan senyawa aktif 1 : 0,2.
DAFTAR PUSTAKA
1. Santos, E.A. Pagono, R.L., Simoni, J.A., Airoldi, C., Cestari, A.R., and Viera, E.F.S., 2001, The Influence
of the Counter Ion Competition and Nature of Solvent on the Adsorption of Mercury Halides on SH-modified Silica Gel, Colloid and Surface, 201: 25-282.
4. Jal, P.K., Patel, S., and Mishra, B.K., 2004, Chemical Modification of Silica Surface by Immobilization of Functional Groups for Extractive Concentration of Metal Ions, Talanta, 62: 1005-1028.
5. Alcantara, E.F.C, Faria, E.A., Rodrigues, D.V., Evangelista, S.M., De Oliveira, E., Zara, L.F., Rabelo, D.,
and Prado, A.G.S, 2007, Modification of Silica Gel by Attachment of 2-Mercaptobenzimidazole for Use in Removing Hg(II) from Aqueous Media : A Thermodynamic Approach, J. Colloid and Interface Sci., 311: 1-7.
6. Quintanilla, D.P., del Hierro, I., Fajardo, M., and Sierra I., 2006, 2-Mercaptothiazoline Modified
Mesoporous Silica for Mercury Removal from Aqueous Media, 2006, J. Hazard. Mater., B134: 245-256.
7. Kumar, A., Gaurav, Malik, A.K., Tewary, D.K, and Singh, B., 2008, A Review on Development of Solid
Phase Micro extraction Fibers by Sol-gel Methods and Their Application, Anal. Chim. Acta, 610: 1-14.
8. Machado, R.S.A., da Fonseca, M.G., Arakaki, L.N.H., Espinola, J.G.P., and Oliveira, S.F.,2004, Silica
Gel Containing Sulfur, Nitrogen and Oxygen as Adsorbent Centers on Surface for Removing Copper Aqueous/ Ethanolic Solution, Talanta, 63: 317-322.
9. Elliott, H.A., Liberati, M.R. and Huang, C.P., 1986, Competitive Adsorption of Heavy Metals by Soils, J.
Environ. Qual., 15 (3): 214-219.
10. Aklil A., Mouflih M., and Sebti S., 2004, Removal of Heavy Metal Ions From Water by Using Calcined
Phosphate as New Adsorbent, J. Hazard. Mater., A112: 183-190.
11. Buhani, Narsito, Nuryono dan Kunarti, E.S., 2010, Production of Metal Ion Imprinted Polymer from
Mercapto-Silica through Sol-Gel Process as Selective Adsorbent of Cadmium, Desalination, 251: 83-89.