IV. HASIL DAN PEMBAHASAN ... 35
4.1 Hasil Pengamatan ... 35
4.1.1 Daya Berkecambah ... 35
4.1.2 Kecambah Normal Kuat ... 37
4.1.3 Kecepata Kecambah Benih perhari ... 38
4.1.4 Bobot Kering Kecambah Normal ... 40
4.1.5 Panjang Kecambah Normal ... 41
4.2 Pembahasan ... 43
V. KESIMPULAN DAN SARAN ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
LAMPIRAN Tabel (7 – 22) ... 49
DAFTAR TABEL 3. Pengaruh dosis pupuk dan konsentrasi PEG-6000 pada keserempakan
berkecambah benih ... 28 4. Pengaruh dosis pupuk NPK susulan dan konsentrasi PEG-6000 pada
kecepatan berkecambah benih ... 29 5. Pengaruh dosis pupuk dan konsentrasi PEG-6000 pada bobot kering
kecambah normal ... 30 6. Pengaruh dosis pupuk NPK susulan dan konsentrasi PEG-6000 pada
panjang kecambah ... 31 7. Hasil pengamatan pengaruh dosis pupuk NPK susulan dan konsentrasi
PEG-6000 pada daya berkecambah benih ... 39 8. Uji homogenitas ragam untuk pengaruh dosis pupuk NPK tambahan dan
konsentrasi PEG-6000 pada daya berkecambah ... 39 9. Analisis ragam untuk pengaruh dosis pupuk NPK susulan dan
konsentrasi PEG-6000 pada daya berkecambah benih ... 40 10. Hasil pengamatan pengaruh dosis pupuk NPK susulan dan konsentrasi
PEG-6000 pada keserempakan berkecambah benih ... 40 11. Uji homogenitas ragam untuk pengaruh dosis pupuk NPK tambahan dan
konsentrasi PEG-6000 pada kerempakan berkecambah ... 41 12. Analisis ragam untuk pengaruh dosis pupuk NPK susulan dan konsentrasi
PEG-6000 pada keserempakan berkecambah benih ... 42 13. Hasil pengamatan pengaruh dosis pupuk NPK susulan dan konsentrasi
14. Uji homogenitas ragam untuk pengaruh dosis pupuk NPK tambahan dan konsentrasi PEG-6000 pada kecepatan berkecambah benih ... 43 15. Analisis ragam untuk pengaruh dosis pupuk NPK susulan dan konsentrasi
PEG-6000 pada kecepatan berkecambah benih ... 44 16. Hasil pengamatan pengaruh dosis pupuk NPK susulan dan konsentrasi
PEG-6000 pada bobot kering kecambah normal ... 44 17. Uji homogenitas ragam untuk pengaruh dosis pupuk NPK tambahan dan
konsentrasi PEG-6000 pada bobot kering kecambah normal ... 45 18. Analisis ragam untuk pengaruh dosis pupuk NPK susulan dan konsentrasi
PEG-6000 pada bobot kering kecambah normal ... 46 19. Hasil pengamatan pengaruh dosis pupuk NPK susulan dan konsentrasi
PEG-6000 pada panjang kecambah normal ... 46 20. Uji homogenitas ragam untuk pengaruh dosis pupuk NPK tambahan dan
konsentrasi PEG-6000 pada panjang kecambah normal ... 47 21. Analisis ragam untuk pengaruh dosis pupuk NPK susulan dan konsentrasi
DAFTAR GAMBAR
DAFTAR TABEL
Tabel Halaman
1. Pengaruh hidrasi-dehidrasi dan pemupukan NPK susulan pada daya
berkecambah) ... 36
2. Pengaruh hidrasi-dehidrasi dan pemupukan NPK susulan pada kecambah normal kuat. ... 37
3. Pengaruh hidrasi-dehidrasi dan pemupukan NPK susulan pada kecepatan berkecambah ... 39
4. Pengaruh hidrasi-dehidrasi dan pemupukan NPK susulan pada bobot kering kecambah normal ... 40
5. Pengaruh hidrasi-dehidrasi dan pemupukan NPK susulan pada panjang kecambah normal. ... 42 12. Analisis ragam untuk keserempakan berkecambah benih kedelai ... 55
13. Analisis ortogonal untuk keserempakan berkecambah benih kedelai ... 55
14. Hasil pengamatan untuk kecepatan berkecambah benih kedelai ... 56
15. Uji homogenitas untuk kecepatan berkecambah benih kedelai ... 57
17. Analisis ortogonal untuk kecepatan berkecambah benih kedelai ... 59
18. Hasil pengamatan untuk bobot kering kecambah normal benih kedelai .. 60
19. Uji homogenitas untuk bobot kering kecambah normal benih kedelai .... 61
20. Analisis ragam untuk bobot kering kecambah normal benih kedelai ... 62
21. Analisis ortogonal bobot kering kecambah normal benih kedelai ... 63
22. Hasil pengamatan untuk panjang kecambah normal benih kedelai ... 64
23. Uji homogenitas untuk panjang kecambah normal benih kedelai ... 65
24. Analisis ragam untuk panjang kecambah normal benih kedelai ... 66
25. Analisis ortogonal untuk panjang kecambah normal benih kedelai ….... 67
THE EFFECT OF HYDRATION-DEHYDRATION AND NPK FERTILIZER SUPPLEMENTARY ON VIABILITY OF SEED SOYBEAN (Glycine max [L.] Merr.)
ANJASMORO By
Teddy Adhitia(1), Yayuk Nurmiaty (2), Niar Nurmauli (2) ABSTRACT
Hydration dehydration is one of the seed treatments to improve seed viability which has suffered setbacks. Supplementary fertilization during flowering is one of the agronomic efforts in seed production for viability (germination and early vigor high).
This research aims to determine: 1) Determine the effect invigorasi by means of hydration-dehydration on seed sources that have been saved 8 months in influencing the viability of soybean seed varieties Ajasmoro. 2) Determine the effect of increasing doses of NPK fertilizer Supplementary during flowering are given on the plants from seed sources in invigorize by means of hydration-dehydration on seed viability of soybean varieties produce Anjasmoro. 3) To Know the plantsthat seed source response to hydration-dehydration in invigorize to increasing doses of NPK Supplementary at the time of flowering in soybean varieties anjasmoro produce seed viability. This research was conducted in the Laboratory of Plant Breeding and Seed Technology Faculty of Agriculture, Lampung University in August to October 2009. The design of treatment trials in the field follow the pattern of the factorial (3 X 3); each treatment combination was replicated 3 times. The first factor is how the hydration-dehydration of control (H0), sticking (H1), and immersion (H2). The second factor is a supplementary dose of NPK fertilizer at the time of flowering of dosages of 0 kg / ha (P0), 75 kg / ha (P1), 100kg/ha (P2). The similarities range between treatments were tested with Bartlett test and subsequent tests used Tukey test model. Results obtained data were analyzed by F test planned and continued separation of the median value of the ratio of orthogonal level 0.05 and 0.01. The results showed that (1) hydration-dehydration treatment did not affect seed viability based on the simultaneity variable germinate and seedling dry weight of normal, (2) Provision of supplementary doses of NPK fertilizer did not affect seed viability response on simultaneity variable germinate and seedling dry weight of normal, (3 ) Without supplementary fertilizer, hydration-dehydration (sticking) is better in producing germination, germination speed, and length of germination than soaking while supplementary NPK fertilizer when given at doses 75-100 kg / ha in the way of hydration-dehydration (immersion) is better in producing germination, speed of germination, and seedling length than is moistened.
PENGARUH HIDRASI-DEHIDRASI DAN PUPUK NPK SUSULAN PADA VIABILITAS BENIH KEDELAI (Glycine max [L.] Merr.)
VARIETAS ANJASMORO Oleh
Teddy Adhitia(1), Yayuk Nurmiaty (2), Niar Nurmauli (2) ABSTRAK
Hidrasi dehidrasi adalah salah satu perlakuan benih untuk memperbaiki viabilitas benih yang telah mengalami kemunduran. Pemupukan susulan pada saat berbunga merupakan salah satu upaya agronomik dalam produksi benih untuk mendapatkan viabilitas (daya berkecambah dan vigor awal yang tinggi).
Penelitian ini bertujuan untuk mengetahui: 1) Mengetahui pengaruh invigorasi dengancara hidrasi-dehidrasi pada benih sumber yang telah disimpan 8 bulan dalam mempengaruhi viabilitas benih kedelai varietas Ajasmoro yang dihasilkan. 2) Mengetahui pengaruh peningkatan dosis pupuk NPK susulan saat berbunga yang diberikan pada tanaman dari benih sumber yang diinvigorasi dengan cara hidrasi-dehidrasi dalam menghasilkan viabilitas benih kedelai varietas Anjasmoro. 3) Mengetahui respons tanaman yang benih sumbernya diinvigorasi dengan hidrasi-dehidrasi terhadap peningkatan dosis NPK susulan pada saat berbunga dalam menghasilkan viabilitas benih kedelai varietas Anjasmoro.
Penelitian ini dilaksanakan di Laboratorium Teknologi Benih dan Pemuliaan Tanaman Fakultas Pertanian Universitas Lampung pada bulan Agustus sampai dengan Oktober 2009. Rancangan perlakuan mengikuti percobaan di lapang yaitu pola faktorial (3 X 3); setiap kombinasi perlakuan diulang 3 kali. Faktor pertama adalah cara hidrasi-dehidrasi yaitu kontrol (H0), pelembaban (H1), dan perendaman (H2). Faktor kedua adalah dosis pemupukan NPK susulan pada saat berbunga yaitu dosis pupuk 0 kg/ha (P0), 75 kg/ha (P1), 100kg/ha (P2). Kesamaan ragam antarperlakuan diuji dengan uji Bartlett dan kemenambahan model diuji dengan uji Tukey. Hasil data yang didapat akan dianalisis dengan uji F terencana dan dilanjutkan pemisahan nilai tengah dengan perbandingan ortogonal pada taraf 0,05 dan 0,01.
Hasil penelitan menunjukkan bahwa (1) Perlakuan hidrasi-dehidrasi tidak mempengaruhi viabilitas benih berdasarkan variabel keserempakan berkecambah dan bobot kering kecambah normal; (2) Pemberian dosis pupuk NPK susulan tidak mempengaruhi tanggapan viabilitas benih pada variabel keserempakan berkecambah dan bobot kering kecambah normal; (3) Tanpa pupuk susulan, hidrasi-dehidrasi (pelembaban) lebih baik dalam menghasilkan daya berkecambah, kecepatan berkecambah, dan panjang berkecambah daripada perendaman sedangkan bila diberi pupuk NPK susulan pada dosis 75-100 kg/ha cara hidrasi-dehidrasi pada (perendaman) lebih baik dalam menghasilkan daya berkecambah, kecepatan berkecambah, dan panjang kecambah daripada yang dilembabkan.
48
49
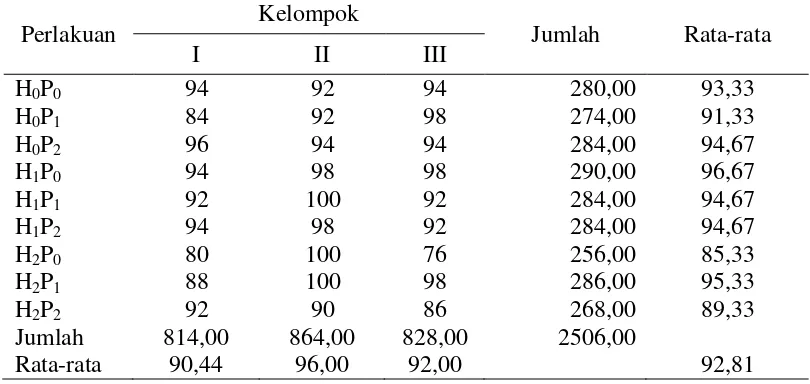
Tabel 6. Hasil pengamatan untuk daya berkecambah benih kedelai
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 94 92 94 280,00 93,33
H0P1 84 92 98 274,00 91,33
H0P2 96 94 94 284,00 94,67
H1P0 94 98 98 290,00 96,67
H1P1 92 100 92 284,00 94,67
H1P2 94 98 92 284,00 94,67
H2P0 80 100 76 256,00 85,33
H2P1 88 100 98 286,00 95,33
H2P2 92 90 86 268,00 89,33
Jumlah 814,00 864,00 828,00 2506,00
Rata-rata 90,44 96,00 92,00 92,81
Keterangan: H0 = Kontrol H1 = Pelembaban H2 = Perendaman
50
Tabel 7. Uji homogenitas ragam untuk daya berkecambah benih kedelai
51
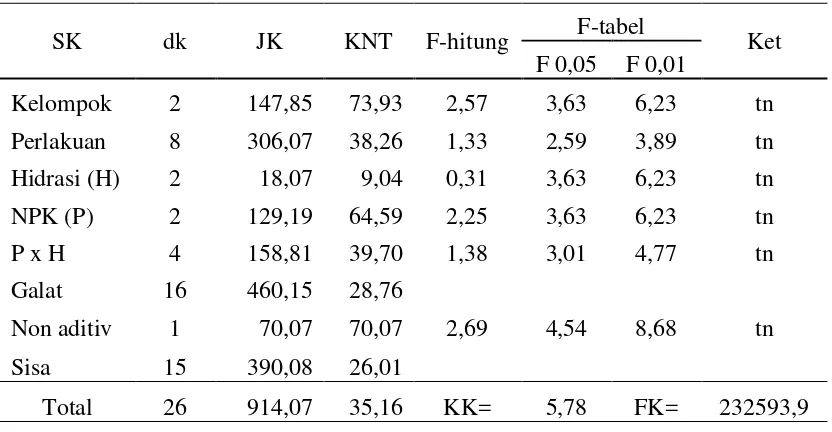
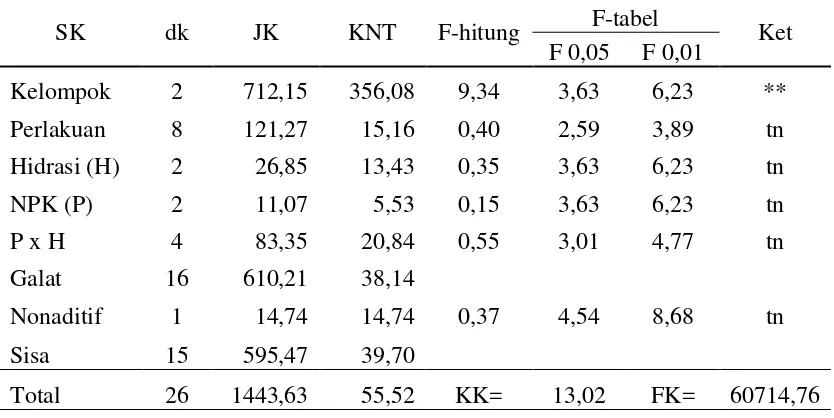
Tabel 8. Analisis ragam untuk daya berkecambah benih kedelai
SK dk JK KNT F-hitung F-tabel Ket
F 0,05 F 0,01
Kelompok 2 147,85 73,93 2,57 3,63 6,23 tn
Perlakuan 8 306,07 38,26 1,33 2,59 3,89 tn
Hidrasi (H) 2 18,07 9,04 0,31 3,63 6,23 tn
NPK (P) 2 129,19 64,59 2,25 3,63 6,23 tn
P x H 4 158,81 39,70 1,38 3,01 4,77 tn
Galat 16 460,15 28,76
Non aditiv 1 70,07 70,07 2,69 4,54 8,68 tn
Sisa 15 390,08 26,01
Total 26 914,07 35,16 KK= 5,78 FK= 232593,9 Keterangan:
52
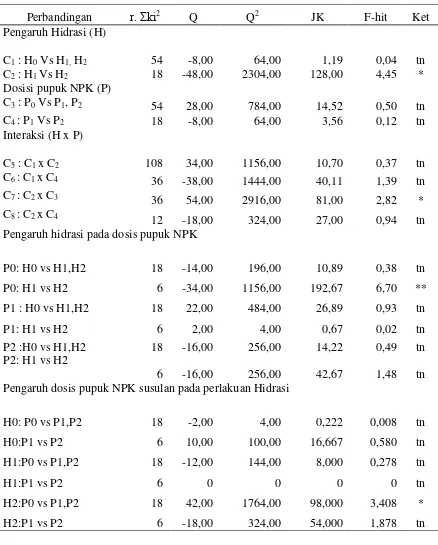
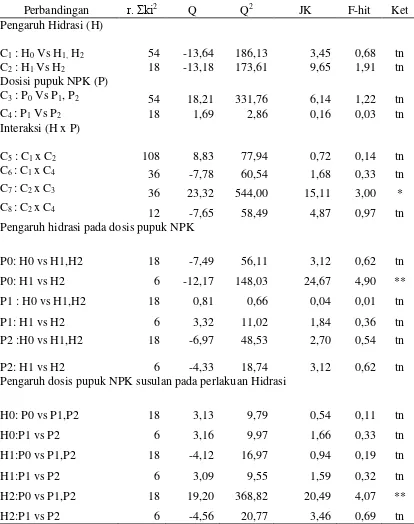
Tabel 9. Analisis ortogonal untuk daya berkecambah benih kedelai
Perbandingan r. Σki2 Q Q2 JK F-hit Ket
Pengaruh hidrasi pada dosis pupuk NPK
Pengaruh dosis pupuk NPK susulan pada perlakuan Hidrasi
53
Tabel 10. Hasil pengamatan untuk keserempakan berkecambah benih kedelai
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 47 39 57 142,89 47,63
H0P1 39 43 57 138,19 46,06
H0P2 41 47 53 141,75 47,25
H1P0 41 39 58 138,71 46,24
H1P1 41 51 56 147,53 49,18
H1P2 45 52 52 148,69 49,56
H2P0 35 55 47 137,26 45,75
H2P1 37 62 55 153,61 51,20
H2P2 39 47 45 131,72 43,91
Jumlah 366,11 436,06 478,18 1280,35
Rata-rata 40,68 48,45 53,13 47,42
Keterangan: H0 = Kontrol H1 = Pelembaban H2 = Perendaman
54
Tabel 11. Uji homogenitas ragam untuk keserempakan berkecambah benih
55
Tabel 12. Analisis ragam untuk keserempakan berkecambah benih kedelai
SK dk JK KNT F-hitung F-tabel Ket
Tabel 13. Analisis ortogonal untuk keserempakan berkecambah benih kedelai
56
Tabel 14. Hasil pengamatan untuk kecepatan berkecambah benih kedelai
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 25,20 24,73 24,43 74,37 24,79
H0P1 23,37 25,19 25,80 74,35 24,78
H0P2 27,89 25,47 24,15 77,51 25,84
H1P0 28,32 24,59 23,80 76,70 25,57
H1P1 24,47 24,63 24,00 73,10 24,37
H1P2 28,63 24,52 23,03 76,19 25,40
H2P0 21,00 24,90 18,63 64,54 21,51
H2P1 21,80 29,05 25,57 76,42 25,47
H2P2 26,35 22,38 23,13 71,86 23,95
Jumlah 227,02 225,47 212,55 665,04
Rata-rata 25,22 25,05 23,62 24,63
Keterangan: H0 = Kontrol H1 = Pelembaban H2 = Perendaman
57
Tabel 15. Uji homogenitas untuk kecepatan berkecambah benih kedelai
58
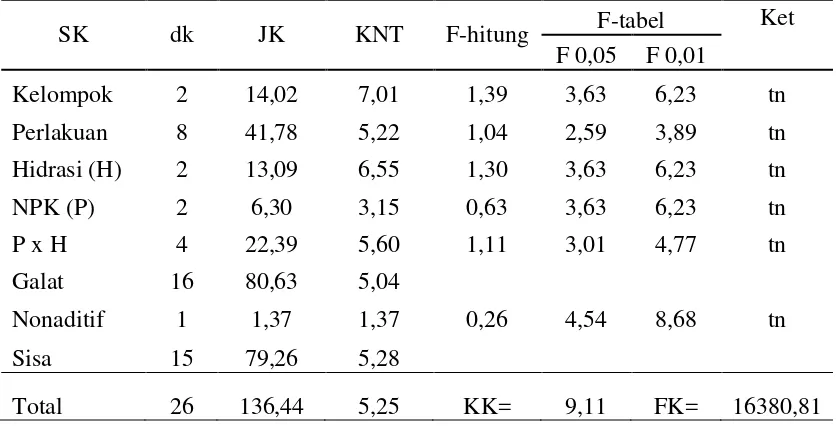
Tabel 16. Analisis ragam untuk kecepatan berkecambah benih kedelai
SK dk JK KNT F-hitung F-tabel Ket
F 0,05 F 0,01
Kelompok 2 14,02 7,01 1,39 3,63 6,23 tn
Perlakuan 8 41,78 5,22 1,04 2,59 3,89 tn
Hidrasi (H) 2 13,09 6,55 1,30 3,63 6,23 tn
NPK (P) 2 6,30 3,15 0,63 3,63 6,23 tn
P x H 4 22,39 5,60 1,11 3,01 4,77 tn
Galat 16 80,63 5,04
Nonaditif 1 1,37 1,37 0,26 4,54 8,68 tn
Sisa 15 79,26 5,28
Total 26 136,44 5,25 KK= 9,11 FK= 16380,81
Keterangan:
59
Tabel 17. Analisis ortogonal untuk kecepatan berkecambah benih kedelai
Pengaruh hidrasi pada dosis pupuk NPK
Pengaruh dosis pupuk NPK susulan pada perlakuan Hidrasi
60
Tabel 18. Hasil pengamatan untuk bobot kering kecambah normal benih kedelai.
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 0,08 0,09 0,08 0,24 0,08
H0P1 0,09 0,09 0,08 0,26 0,09
H0P2 0,07 0,09 0,08 0,24 0,08
H1P0 0,06 0,08 0,07 0,22 0,07
H1P1 0,08 0,10 0,08 0,26 0,09
H1P2 0,08 0,10 0,07 0,25 0,08
H2P0 0,05 0,10 0,10 0,25 0,08
H2P1 0,07 0,10 0,08 0,24 0,08
H2P2 0,07 0,10 0,08 0,25 0,08
Jumlah 0,65 0,84 0,72 2,21
Rata-rata 0,07 0,09 0,08 0,08
Keterangan: H0 = Kontrol H1 = Pelembaban H2 = Perendaman
61
Tabel 19. Uji homogenitas untuk bobot kering kecambah normal benih kedelai
62
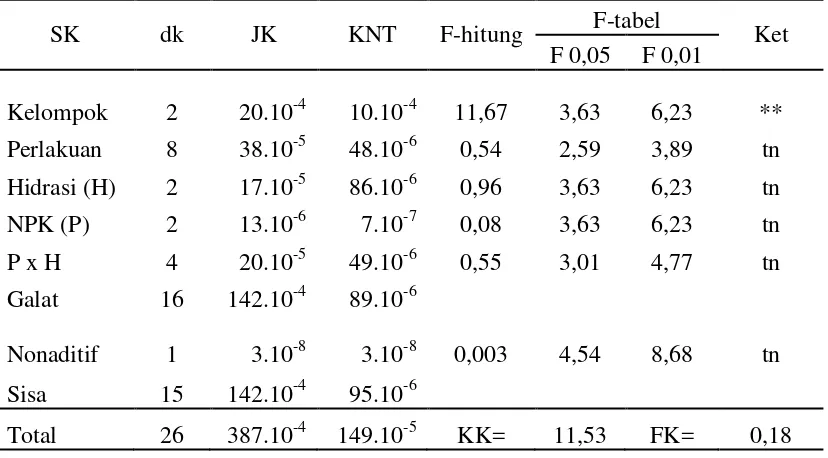
Tabel 20. Analisis ragam untuk bobot kering kecambah normal benih kedelai
SK dk JK KNT F-hitung F-tabel Ket
F 0,05 F 0,01
Kelompok 2 20.10-4 10.10-4 11,67 3,63 6,23 ** Perlakuan 8 38.10-5 48.10-6 0,54 2,59 3,89 tn Hidrasi (H) 2 17.10-5 86.10-6 0,96 3,63 6,23 tn NPK (P) 2 13.10-6 7.10-7 0,08 3,63 6,23 tn
P x H 4 20.10-5 49.10-6 0,55 3,01 4,77 tn
Galat 16 142.10-4 89.10-6
Nonaditif 1 3.10-8 3.10-8 0,003 4,54 8,68 tn Sisa 15 142.10-4 95.10-6
Total 26 387.10-4 149.10-5 KK= 11,53 FK= 0,18 Keterangan:
63
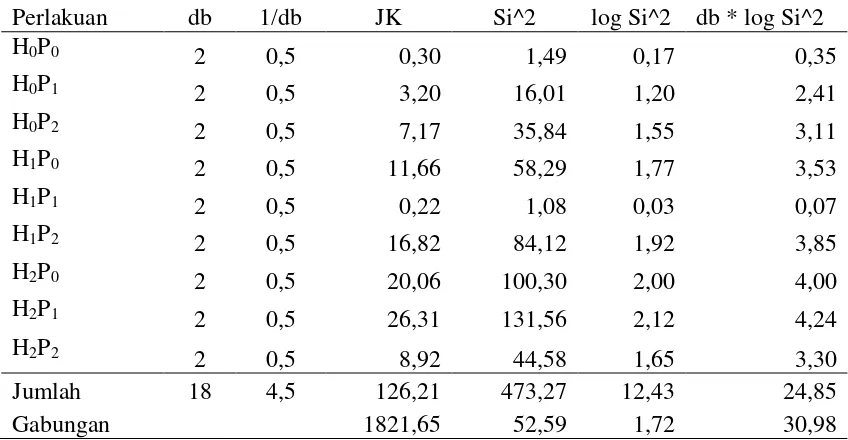
Tabel 21. Analisis ortogonal bobot kering kecambah normal benih kedelai
Perbandingan r. Σki2 Q Q2 JK F-hit Ket
Koefisien Hidrasi (H)
C1 : H0 Vs H1, H2 54 -0,02 0,00033 0,0000062 0,070 tn C2 : H1 Vs H2 18 0,01 0,00013 0,0000071 0,080 tn Dosisi pupuk NPK (P)
C3 : P0 Vs P1, P2 54 0,09 0,00838 0,000155 1,748 tn C4 : P1 Vs P2 18 -0,02 0,00029 0,000016 0,179 tn Interaksi (H x P)
C5 : C1 x C2 108 0,01 0,00020 0,0000018 0,020 tn C6 : C1 x C4 36 0,03 0,00096 0,000027 0,302 tn C7 : C2 x C3 36 -0,07 0,00539 0,000150 1,686 tn C8 : C2 x C4 12 0,01 0,00022 0,000018 0,203 tn Keterangan:
64
Tabel 22. Hasil pengamatan untuk panjang kecambah normal benih kedelai
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 25,14 26,78 25,98 77,89 25,96
H0P1 29,70 25,48 22,99 78,17 26,06
H0P2 27,77 26,93 21,64 76,35 25,45
H1P0 28,02 27,81 25,18 81,01 27,00
H1P1 29,07 26,61 24,13 79,80 26,60
H1P2 26,98 28,31 24,69 79,98 26,66
H2P0 20,05 26,06 20,86 66,97 22,32
H2P1 28,24 26,44 25,94 80,61 26,87
H2P2 27,50 26,27 19,64 73,41 24,47
Jumlah 242,47 240,68 211,05 694,20
65
Tabel 23. Uji homogenitas untuk panjang kecambah normal benih kedelai
66
Tabel 24. Analisis ragam untuk panjang kecambah normal benih kedelai.
SK dk JK KNT F-hitung F-tabel Ket
F 0,05 F 0,01
Kelompok 2 69,20 34,60 9,06 3,63 6,23 **
Perlakuan 8 53,91 6,74 1,76 2,59 3,89 tn
Hidrasi (H) 2 9,44 4,72 1,24 3,63 6,23 tn
NPK (P) 2 21,94 10,97 2,87 3,63 6,23 tn
P x H 4 22,53 5,63 1,47 3,01 4,77 tn
Galat 16 61,10 3,82
Nonaditif 1 0,61 0,61 0,15 4,54 8,68 tn
Sisa 15 60,50 4,03
Total 26 184,21 7,08 KK= 7,60 FK= 17848,55
Keterangan:
67
Tabel 25. Analisis ortogonal untuk panjang kecambah normal benih kedelai
Perbandingan r. Σki2 Q Q2 JK F-hit Ket
Pengaruh hidrasi pada dosis pupuk NPK
Pengaruh dosis pupuk NPK susulan pada perlakuan Hidrasi
Tabel 6. Hasil pengamatan untuk daya berkecambah benih kedelai
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 94 92 94 280,00 93,33
H0P1 84 92 98 274,00 91,33
H0P2 96 94 94 284,00 94,67
H1P0 94 98 98 290,00 96,67
H1P1 92 100 92 284,00 94,67
H1P2 94 98 92 284,00 94,67
H2P0 80 100 76 256,00 85,33
H2P1 88 100 98 286,00 95,33
H2P2 92 90 86 268,00 89,33
Jumlah 814,00 864,00 828,00 2506,00
Rata-rata 90,44 96,00 92,00 92,81
Keterangan: H0 = Kontrol H1 = Pelembaban H2 = Perendaman
Tabel 8. Analisis ragam untuk daya berkecambah benih kedelai
SK dk JK KNT F-hitung F-tabel Ket
F 0,05 F 0,01
Kelompok 2 147,85 73,93 2,57 3,63 6,23 tn
Perlakuan 8 306,07 38,26 1,33 2,59 3,89 tn
Hidrasi (H) 2 18,07 9,04 0,31 3,63 6,23 tn
NPK (P) 2 129,19 64,59 2,25 3,63 6,23 tn
P x H 4 158,81 39,70 1,38 3,01 4,77 tn
Galat 16 460,15 28,76
Non aditiv 1 70,07 70,07 2,69 4,54 8,68 tn
Sisa 15 390,08 26,01
Total 26 914,07 35,16 KK= 5,78 FK= 232593,9 Keterangan:
Tabel 9. Analisis ortogonal untuk daya berkecambah benih kedelai
Pengaruh hidrasi pada dosis pupuk NPK
Pengaruh dosis pupuk NPK susulan pada perlakuan Hidrasi
Tabel 10. Hasil pengamatan untuk keserempakan berkecambah benih kedelai
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 47 39 57 142,89 47,63
H0P1 39 43 57 138,19 46,06
H0P2 41 47 53 141,75 47,25
H1P0 41 39 58 138,71 46,24
H1P1 41 51 56 147,53 49,18
H1P2 45 52 52 148,69 49,56
H2P0 35 55 47 137,26 45,75
H2P1 37 62 55 153,61 51,20
H2P2 39 47 45 131,72 43,91
Jumlah 366,11 436,06 478,18 1280,35
Rata-rata 40,68 48,45 53,13 47,42
Keterangan: H0 = Kontrol H1 = Pelembaban H2 = Perendaman
Tabel 12. Analisis ragam untuk keserempakan berkecambah benih kedelai
Tabel 13. Analisis ortogonal untuk keserempakan berkecambah benih kedelai
Tabel 14. Hasil pengamatan untuk kecepatan berkecambah benih kedelai
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 25,20 24,73 24,43 74,37 24,79
H0P1 23,37 25,19 25,80 74,35 24,78
H0P2 27,89 25,47 24,15 77,51 25,84
H1P0 28,32 24,59 23,80 76,70 25,57
H1P1 24,47 24,63 24,00 73,10 24,37
H1P2 28,63 24,52 23,03 76,19 25,40
H2P0 21,00 24,90 18,63 64,54 21,51
H2P1 21,80 29,05 25,57 76,42 25,47
H2P2 26,35 22,38 23,13 71,86 23,95
Jumlah 227,02 225,47 212,55 665,04
Rata-rata 25,22 25,05 23,62 24,63
Keterangan: H0 = Kontrol H1 = Pelembaban H2 = Perendaman
Tabel 16. Analisis ragam untuk kecepatan berkecambah benih kedelai
SK dk JK KNT F-hitung F-tabel Ket
F 0,05 F 0,01
Kelompok 2 14,02 7,01 1,39 3,63 6,23 tn
Perlakuan 8 41,78 5,22 1,04 2,59 3,89 tn
Hidrasi (H) 2 13,09 6,55 1,30 3,63 6,23 tn
NPK (P) 2 6,30 3,15 0,63 3,63 6,23 tn
P x H 4 22,39 5,60 1,11 3,01 4,77 tn
Galat 16 80,63 5,04
Nonaditif 1 1,37 1,37 0,26 4,54 8,68 tn
Sisa 15 79,26 5,28
Total 26 136,44 5,25 KK= 9,11 FK= 16380,81
Keterangan:
Tabel 17. Analisis ortogonal untuk kecepatan berkecambah benih kedelai
Pengaruh hidrasi pada dosis pupuk NPK
Pengaruh dosis pupuk NPK susulan pada perlakuan Hidrasi
Tabel 18. Hasil pengamatan untuk bobot kering kecambah normal benih kedelai.
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 0,08 0,09 0,08 0,24 0,08
H0P1 0,09 0,09 0,08 0,26 0,09
H0P2 0,07 0,09 0,08 0,24 0,08
H1P0 0,06 0,08 0,07 0,22 0,07
H1P1 0,08 0,10 0,08 0,26 0,09
H1P2 0,08 0,10 0,07 0,25 0,08
H2P0 0,05 0,10 0,10 0,25 0,08
H2P1 0,07 0,10 0,08 0,24 0,08
H2P2 0,07 0,10 0,08 0,25 0,08
Jumlah 0,65 0,84 0,72 2,21
Rata-rata 0,07 0,09 0,08 0,08
Keterangan: H0 = Kontrol H1 = Pelembaban H2 = Perendaman
Tabel 20. Analisis ragam untuk bobot kering kecambah normal benih kedelai
SK dk JK KNT F-hitung F-tabel Ket
F 0,05 F 0,01
Kelompok 2 20.10-4 10.10-4 11,67 3,63 6,23 ** Perlakuan 8 38.10-5 48.10-6 0,54 2,59 3,89 tn Hidrasi (H) 2 17.10-5 86.10-6 0,96 3,63 6,23 tn NPK (P) 2 13.10-6 7.10-7 0,08 3,63 6,23 tn
P x H 4 20.10-5 49.10-6 0,55 3,01 4,77 tn
Galat 16 142.10-4 89.10-6
Nonaditif 1 3.10-8 3.10-8 0,003 4,54 8,68 tn Sisa 15 142.10-4 95.10-6
Total 26 387.10-4 149.10-5 KK= 11,53 FK= 0,18 Keterangan:
Tabel 21. Analisis ortogonal bobot kering kecambah normal benih kedelai
Perbandingan r. Σki2 Q Q2 JK F-hit Ket
Koefisien Hidrasi (H)
C1 : H0 Vs H1, H2 54 -0,02 0,00033 0,0000062 0,070 tn C2 : H1 Vs H2 18 0,01 0,00013 0,0000071 0,080 tn Dosisi pupuk NPK (P)
C3 : P0 Vs P1, P2 54 0,09 0,00838 0,000155 1,748 tn C4 : P1 Vs P2 18 -0,02 0,00029 0,000016 0,179 tn Interaksi (H x P)
C5 : C1 x C2 108 0,01 0,00020 0,0000018 0,020 tn C6 : C1 x C4 36 0,03 0,00096 0,000027 0,302 tn C7 : C2 x C3 36 -0,07 0,00539 0,000150 1,686 tn C8 : C2 x C4 12 0,01 0,00022 0,000018 0,203 tn Keterangan:
Tabel 22. Hasil pengamatan untuk panjang kecambah normal benih kedelai
Perlakuan Kelompok Jumlah Rata-rata
I II III
H0P0 25,14 26,78 25,98 77,89 25,96
H0P1 29,70 25,48 22,99 78,17 26,06
H0P2 27,77 26,93 21,64 76,35 25,45
H1P0 28,02 27,81 25,18 81,01 27,00
H1P1 29,07 26,61 24,13 79,80 26,60
H1P2 26,98 28,31 24,69 79,98 26,66
H2P0 20,05 26,06 20,86 66,97 22,32
H2P1 28,24 26,44 25,94 80,61 26,87
H2P2 27,50 26,27 19,64 73,41 24,47
Jumlah 242,47 240,68 211,05 694,20
Tabel 24. Analisis ragam untuk panjang kecambah normal benih kedelai.
SK dk JK KNT F-hitung F-tabel Ket
F 0,05 F 0,01
Kelompok 2 69,20 34,60 9,06 3,63 6,23 **
Perlakuan 8 53,91 6,74 1,76 2,59 3,89 tn
Hidrasi (H) 2 9,44 4,72 1,24 3,63 6,23 tn
NPK (P) 2 21,94 10,97 2,87 3,63 6,23 tn
P x H 4 22,53 5,63 1,47 3,01 4,77 tn
Galat 16 61,10 3,82
Nonaditif 1 0,61 0,61 0,15 4,54 8,68 tn
Sisa 15 60,50 4,03
Total 26 184,21 7,08 KK= 7,60 FK= 17848,55
Keterangan:
Tabel 25. Analisis ortogonal untuk panjang kecambah normal benih kedelai
Pengaruh hidrasi pada dosis pupuk NPK
Pengaruh dosis pupuk NPK susulan pada perlakuan Hidrasi
1
I. PENDAHULUAN
1.1 Latar Belakang dan Masalah
Tanaman kedelai (Glycine max [L.] Merr.) memiliki nilai ekonomi yang cukup tinggi sebagai sumber protein pada berbagai bahan makanan yang berbahan baku kedelai, seperti tempe, tahu, kecap, tauco, dan toge. Untuk bahan industri, dari biji kedelai dapat dibuat menjadi tepung kedelai maupun diambil minyaknya. Tepung kedelai dapat langsung digunakan untuk bahan makanan seperti: susu, vetsin, dan kue-kue. Minyak kedelai diolah untuk dijadikan margarin dan minyak goreng. Peranan kedelai dalam industri bukan makanan antara lain diolah
menjadi kertas, tinta cetak, bahan plastik, dan kosmetik (Suprapto,1999).
Produksi kedelai di Indonesia pada tahun 2009 dengan luas areal tanam 600 ribu hektar naik 31% dari tahun 2008. Namun demikian kenaikan itu belum
separuhnya memenuhi kebutuhan dalam negeri sehingga saat ini Indonesia masih mengimpor sekitar 1 juta ton kedelai dari Amerika maupun Brazil
(Murkan, 2008).
2
dengan luas tanam sekitar 1.050.000 hektar, luas panen 997.500 hektar dan produktivitas rata-rata 15,04 ku/ha.
Rendahnya produksi kedelai nasional beberapa tahun terakhir ini antara lain disebabkan oleh belum optimalnya budidaya kedelai sehingga produksi di tingkat petani hanya mencapai sekitar 1,3 ton/ha, sedangkan potensi produksi dari
varietas unggul yang dimiliki Indonesia saat ini dapat mencapai 2,0—2,5 ton/ha (Murkan, 2008).
Salah satu faktor pembatas produksi kedelai di daerah tropis adalah kemunduran benih yang cepat selama penyimpanan hingga mengurangi penyediaan benih berkualitas tinggi. Pengadaan benih kedelai dalam jumlah yang memadai dan tepat pada waktunya sering menjadi kendala karena daya simpan yang rendah. Sementara itu, pengadaan benih bermutu tinggi merupakan unsur penting dalam upaya peningkatan produksi tanaman. Pengadaan benih sering dilakukan beberapa waktu sebelum musim tanam sehingga benih harus disimpan dengan baik agar mempunyai daya tumbuh yang tinggi saat ditanam kembali. Kemunduran benih kedelai selama penyimpanan lebih cepat berlangsung dibandingkan dengan benih tanaman lain dengan kehilangan vigor benih yang cepat yang ditunjukkan penurunan perkecambahan benih. Benih yang
3
Faktor-faktor yang mempengaruhi viabilitas benih selama penyimpanan dibagi menjadi faktor internal dan eksternal. Faktor internal mencakup sifat genetik, daya tumbuh dan vigor, kondisi kulit dan kadar air benih awal. Faktor eksternal antara lain kemasan benih, komposisi gas, suhu dan kelembaban ruang simpan (Copeland dan Donald, 2001).
Salah satu cara untuk memperbaiki kondisi benih yang telah mundur (deteorated) adalah dengan metode invigorasi yang dapat memperbaiki kondisi benih yang telah menurun viabilitasnya. Invigorasi yaitu perlakuan fisik, fisiologis, dan biokimia untuk mengoptimalkan viabilitas benih sehingga benih mampu tumbuh cepat dan serempak pada kondisi yang seragam (Basu dan Rudrapal, 1982). Invigorasi didefinisikan sebagai suatu perlakuan pendahuluan pada benih melalui pengontrolan imbibisi air oleh potensial air yang rendah dari media imbibisi. Selama invigorasi terjadi perbaikan fisiologi dan biokimia yang berhubungan dengan peningkatan kecepatan tumbuh, peningkatan keserempakan
perkecambahan, dan peningkatan potensial perkecambahan (Khan, 1992). Prinsip dasar perlakuan invigorasi adalah mempertahankan benih dalam keadaan hidrasi sebagian selama periode tertentu sehingga perkecambahan seluruhnya tertunda. Selama proses invigorasi proses imbibisi air diatur oleh potensial osmotik larutan, sehingga mencegah munculnya radikula. Invigorasi diharapkan dapat
memperbaiki perkecambahan dan pertumbuhan kecambah saat tanam.
4
dalam benih untuk bekerja sama dengan sumber-sumber energi yang ada di luar atau di lingkungan tumbuh untuk menghasilkan pertanaman dan hasil yang maksimal. Perlakuan benih yang telah dikenal antara lain presoaking dan
conditioning. Menurut Khan (1992) presoaking adalah perendaman benih dalam sejumlah air pada suhu rendah sampai sedang, sedangkan conditioning adalah peningkatan mutu fisiologi dan biokimia (berhubungan dengan kecepatan dan perkecambahan, perbaikan serta peningkatan potensial perkecambahan) dalam benih oleh media imbibisi potensial air yang rendah (larutan atau media padatan lembab) dengan mengatur hidrasi dan penghentian perkecambahan.
Kemunduran benih (deteriorated) dapat dicirikan sebgai berikut:
1. Gejala Fisiologis: perubahan warna benih, mundurnnya perkecambahan, mundurnya toleransi terhadap penyimpanan, sangat peka terhadap radiasi, mundurnya pertumbuhan kecambah, mundurnya daya kevigoran (kekuatan tumbuh), meningkatnya jumlah kecambah abnormal
2. Gejala Biokhemis: perubahan dalam respirasi, perubahan enzim, perubahan pada membrane sel/ dinding sel, perubahan laju sintesis, perubahan persediaan makanan, kerusakan kromosom.
5
invigorasi menggunakan cara hidrasi-dehidrasi yang diterapkan pada benih sumber yang telah mengalami penyimpanan selama 8 bulan pada viabilitas benih kedelai varietas Anjasmoro.
Berbagai hasil penelitian menunjukkan bahwa perlakuan hidrasi-dehidrasi dapat meningkatkan viabilitas benih. Hasil penelitian Nuryanti (1996) memperlihatkan perlakuan hidrasi-dehidrasi pada benih padi menghasilkan peningkatan daya berkecambah sebesar 5% dan kecepatan berkecambah sebesar 7,789% per hari pada status daya berkecambah 90,7%, 81,3%, dan 50,7%. Selain itu juga menurut penelitian Erawan (1996) bahwa pada benih jagung dengan tingkat viabilitas tinggi (DB = 98,7%) dan rendah (DB = 36,0%), perlakuan hidrasi-dehidrasi tidak berpengaruh; perlakuan hidrasi-dehidrasi hanya berpengaruh pada tingkat
viabilitas sedang (DB = 58,7%).
Hasil penelitian Basu et al. (1978) menunjukkan bahwa perlakuan
6
Berdasarkan latar belakang yang ada penelitian ini dilaksanakan untuk menjawab masalah yang dirumuskan dalam pertanyaan sebagai berikut:
1. Bagaimana pengaruh invigorasi dengan cara hidrasi-dehidrasi pada benih sumber yang telah disimpan 8 bulan dalam meningkatkan viabilitas benih kedelai varietas Ajasmoro.
2. Bagaimana pengaruh peningkatan dosis pupuk NPK susulan saat berbunga yang diberikan pada tanaman dari benih sumber yang diinvigorasi dengan cara hidrasi-dehidrasi dalam menghasilkan viabilitas benih kedelai varietas
Anjasmoro.
3. Bagaimana respons tanaman yang benih sumbernya diinvigorasi dengan hidrasi-dehidrasi terhadap peningkatan dari NPK susulan pada saat berbunga dalam viabilitas benih kedelai varietas Anjasmoro.
1.2 Tujuan Penelitian
Berdasarkan identifikasi dan perumusan masalah, maka tujuan penelitian dirumuskan sebagai berikut:
1) Mengetahui pengaruh invigorasi dengan cara hidrasi-dehidrasi pada benih sumber yang telah disimpan 8 bulan dalam meningkatkan viabilitas benih kedelai varietas Ajasmoro.
2) Mengetahui pengaruh peningkatan dosis pupuk NPK susulan saat berbunga yang diberikan pada tanaman dari benih sumber yang diinvigorasi dengan cara hidrasi-dehidrasi dalam menghasilkan viabilitas benih kedelai varietas
7
3). Mengetahui respons tanaman yang benih sumbernya diinvigorasi dengan hidrasi-dehidrasi terhadap peningkatan dari NPK susulan pada saat berbunga dalam viabilitas benih kedelai varietas Anjasmoro.
1.3 Landasan Teori
Dalam rangka menyusun penjelasan teoretis terhadap pertanyaan yang telah dikemukakan, penulis menggunakan landasan teori sebagai berikut:
Secara fisiologis, perkecambahan benih adalah dimulainya lagi proses metabolisme yang tertunda serta berlangsungnya transkripsi genom.
Secara biokimia, perkecambahan merupakan diferensiasi lanjutan dari lintasan oksidatif dan lintasan sintetik serta perbaikan lintasan biokimia khusus dari pertumbuhan dan perkembangan vegetatif (Khan, 1992). Proses perkecambahan benih dipengaruhi oleh faktor genetik dan lingkungan. Faktor genetik yang berpengaruh adalah susunan kimiawi benih yang berhubungan dengan daya hidup benih. Perlakuan benih secara fisiologis untuk memperbaiki
perkecambahan benih melalui imbibisi air secara terkontrol telah menjadi dasar dalam invigorasi benih. Saat ini perlakuan invigorasi merupakan salah satu alternatif yang dapat digunakan untuk mengatasi mutu benih yang rendah yaitu dengan cara memperlakukan benih sebelum tanam untuk mengaktifkan kegiatan metabolisme benih sehingga benih siap memasuki fase perkecambahan.
8
menguntungkan. Invigorasi dimulai saat benih berhidrasi pada medium imbibisi yang berpotensial air rendah. Biasanya dilakukan pada suhu 15-20oC.
Setelah keseimbangan air tercapai selanjutnya kandungan air dalam benih dipertahankan (Khan, 1992)
Air masuk ke dalam benih melalui proses imbibisi yang merupakan proses fisik dan imbibisi air oleh benih sangat dipengaruhi oleh komposisi kimia benih, permeabilitas kulit benih dan jumlah air yang tersedia, baik air dalam bentuk cairan maupun uap air disekitar benih (Sadjad, 1975).
Fungsi air pada perkecambahan benih menurut Sumarno dan Widiyati (1985): 1. Air yang diserap oleh benih berguna untuk melunakkan kulit benih dan
menyebabkan pengembangan embrio dan endosperm, sehingga menyebabkan kulit benih menjadi pecah.
2 . Air memberi fasilitas untuk masuknya oksigen ke dalam benih .
Dinding sel yang berimbibisi bersifat permeabe1 sehingga gas dapat masuk ke dalam sel secara difusi. Pasokan oksigen meningkat apabila kulit benih menyerap air sehingga mengaktifkan pernafasan .
3. Air berguna untuk mengencerkan protoplasma sehingga dapat mengaktifkan fungsinya. Bila protoplasma mengandung air maka sel-sel hidup akan melaksanakan proses-proses kehidupan termasuk pencernaan, asimilasi dan tumbuh.
9
Akibat penyerapan air selama proses imbibisi terjadi pertambahan volume dan bobot basah benih. Pertambahan volume benih tersebut sangat cepat pada awal proses imbibisi dan semakin lama pertambahannya semakin lambat
(Leopold, 1983).
Pertambahan bobot basah benih selama imbibisi sangat cepat pada awalnya, kemudian konstan dan selanjutnya cepat kembali. Bewley dan Black (1985) membagi proses imbibisi menjadi tiga fase, yaitu fase pertama yang ditunjukkan dengan pengambilan air yang cepat, fase kedua ditunjukkan dengan
pembengkakkan setelah air mencapai bagian yang lebih dalam sampai radikel muncul, dan fase ketiga ditunjukkan dengan pengambilan air di bagian-bagian kulit benih yang lembab. Pada fase kedua boleh dikatakan pengambilan air hampir tidak ada.
Larson (1968), pada awal perkecambahan baik benih berkulit atau tanpa kulit akan menyeraip air, tetapi yang tanpa kulit menyerap air lebih banyak dengan kecepatan yang lebih tinggi, terutama pada empat jam pertama setelah imbibisi. Namun setelah berimbibisi selama 12 jam, kedua benih tersebut akan menyerap air dalam jumlah yang sama.
Kecepatan laju imbibisi juga akan meningkat jika kulit benih mengalami
10
Peningkatan laju imbibisi akan menurunkan daya tumbuh benih tergantung dari tingkat kerusakan kulit benihnya. Pada benih dengan kerusakan kulit ringan penurunan daya tumbuhnya lebih kecil dari pada benih dengan kerusakan kulit benih yang hebih berat. Penurunan kemampuan tumbuh ini disebabkan karena terjadi kerusakan membran sel akibat masuknya air terlalu cepat ke dalam benih. Membran sel dapat menjadi rusak karena terjadi gangguan terhadap intergritasnya, yaitu pada proses imbibisi normal membran yang terdiri dari protein dan fosfolipid yang membentuk pores heksagonal pada benih kering berubah menjadi dua lapis lamelar pada benih yang telah berimbibisi
(Sadjad, 1975).
Lapisan membran tersebut berupa gel yang terbentuk akibat hidrasi koloid-koloid hidrofil dan memiliki suatu tegangan tertentu karena hubungan timbal balik antara air dan polimer kulit.(Sadjad, 1975).
Integritas membran yang terganggu akan mengakibatkan kebocoran larutan bahan-bahan yang ada dari dalam benih secara difusi ke air perendaman atau media tumbuhnya (Larson, 1968; Powell dan Matthews, 1981; Bewley dan
11
mengimbibisi air, sedangkan pada benih berkulit proses imbibisinya terhambat oleh kulit benih. Bahan-bahan yang terlarut ke dalam air perendaman adalah karbohidrat dan protein. Karbohidrat yang ditemukan adalah glukosa, fruktosa, raffinosa, sukrosa dan maltosa, dan protein yang terlarut mencakup 12 macam asam amino; alanin, arginin, asparagin, asam aspartat , sistein, glutamin, asam glutamat, glisin, histidin, dan isoleusin (Larson, 1968) .
Kebocoran larutan dari dalam benih menyebabkan berkurangnya proses
anabolisme yang akhirnya mengakibatkan pengurangan penyaluran makanan dari kotiledon ke poros embrio (Powell dan Mathews, 1979) dan sel-sel dibagian permukaan kotiledon menjadi mati (Oliveira at al., 1984). Semakin cepat masuknya air ke dalam benih sel-sel kotiledon yang mati semakin meluas ke bagian yang lebih dalam, dalam ha1 ini kondisi kulit benih sangat menentukan laju masuknya air (Tully, Musgrave dan Leopold, 1981).
Selain dapat menurunkan daya tumbuh, kebocoran larutan dari dalam benih juga akan menyebabkan benih mudah terinfeksi cendawan, karena pada bagian tersebut tersedia bahan makanan bagi inokulum cendawan untuk hidup dan berkembang. Kemampuan hidup cendawan semakin meningkat karena pada bagian yang mengalami kebocoran larutan, sel-sel jaringannya menjadi mati, yang akhirnya menyebabkan benih tidak mampu tumbuh dan akhirnya mati (Powell dan Mathews , 1980).
12
lemak dalam benih (increase in fatty acid), laju perkecambahan rendah (slower germination rate), laju pertumbuhan kecambah lambat (slower rate of growth development), berkurangnya daya tahan menghadapi tekanan lingkungan, kecambah tidak mampu muncul di lahan, banyak kecambah abnormal.
Benih yang telah mengalami kebocoran akan mengalami penurunan jumlah benih yang tumbuh. Jumlah benih yang tumbuh disebabkan oleh rendahnya daya berkecambah benih. Menurut toruan (1985) menyatakan bahwa benih dengan tingkat kebocoran tinggi akan menghalami kehilangan zat metabolit yang
menyebabkan rendahnya daya berkecambah. Dengan begitu produksi benih akan berkurang.
Untuk menghasilkan benih yang bervigor prima salah satu upayanya dilakukan dengan pemupukan NPK susulan. Benih bermutu dengan vigor prima dapat dihasilkan melalui produksi dengan perlakuan-perlakuan agronomis tertentu (dalam hal ini pemupukan susulan) agar pada masa pembangunan benih (periode 1), tanaman dapat berproduksi optimal dan kandungan cadangan makanan yang juga maksimal.
13
cepat dan mencapai pertumbuhan maksimal untuk mendapatkan unsur hara di tanah (Kaspar, 1987).
Menurut Suprapto (2001) menyatakan bahwa 1) Nitrogen berguna untuk
pembentukan biji atau benih kedelai; 2) Penggunaan fosfat terbesar dimulai pada masa pembentukan polong yang berfungsi untuk mempercepat masa panen dan menambah kandungan nutrisi biji atau benih kedelai, dan; 3) Kalium berfungsi untuk merangsang pembentukan protein dan merangsang pembentukan biji kedelai.
Kemunduran benih (deteriorasi) adalah turunnya kualitas, sifat atau viabilitas benih yang mengakibatkan rendahnya vigor atau jeleknya pertanaman dan hasil; kejadian ini merupakan proses degenerasi yang tidak dapat balik dari kualitas suatu benih setelah mencapai kualitas yang maksimum (Suseno, 1975). Proses deteriorasi tidak dapat dicegah atau dihindarkan, melainkan yang dapat dilakukan hanyalah mengurangi kecepatannya. Selain itu, protein dalam benih memiliki sifat paling higroskopis dibandingkan dengan kandungan bahan organik yang lain sehingga hal ini menjadi penyebab rendahnya daya simpan benih kedelai.
Kandungan protein dalam kedelai sangat tinggi (Mugnisjah, 1995), kedelai
14
Berbagai cara dapat dilakukan sehubungan dengan perlakuan invigorasi benih sebelum tanam yaitu osmoconditioning, priming, moisturizing, hardening, humidification, solid matrix priming, matriconditioning dan hydropriming. Namun demikian cara yang umum digunakan adalah osmoconditioning
(conditioning yang menggunakan larutan osmotik seperti PEG, KNO3, KH2PO4, NaCl, dan manitol) dan matriconditioning (conditioning dengan menggunakan media padat lembab, seperti Micro-Cel E, Vermikulit, juga telah dipelajari beberapa media alternatif antara lain abu gosok dan serbuk gergaji). Perlakuan invigorasi benih telah banyak diteliti dan telah umum diketahui memberikan pengaruh positif pada berbagai perubahan fisiologis dan biokimia di dalam benih. Beberapa hasil penelitian antara lain: menunjukkan bahwa perlakuan invigorasi dapat mengurangi luka imbibisi pada benih buncis yang menua sebagai akibat dari peningkatan integritas membran
(Ptasznik dan Khan, 1993); meningkatkan viabilitas dan vigor benih cabai (Yunitasari dan Ilyas, 1994); kacang panjang (Shalahuddin dan Ilyas, 1994; Ilyas dan Suartini, 1997); mempercepat perkecambahan dan keserempakan tumbuh benih cabai dan meningkatkan vigor benih yang bermutu rendah (Ilyas, 1996; Ilyas et al., 2002)).
1.4 Kerangka Pemikiran
15
Perlakuan invigorasi umumnya dilakukan pada benih-benih yang telah mengalami kemunduran viabilitas oleh gejala. Biasanya kemunduran benih terjadi karena telah melalui masa penyimpanan, sehingga terjadi penurunan viabilitas dan vigor benih. Invigorasi salah satu perlakuan fisik, fisiologis, dan biokimia untuk mengoptimalkan viabilitas benih yang dapat diukur dari kecepatan tumbuh pada lingkungan sub-optimal, atau keserempakan tumbuhnya.
Proses invigorasi dapat dilakukan dengan cara perendaman, pelembaban, dan meletakkan benih pada tempat yang jenuh dengan uap air. Proses invigorasi menyebabkan benih berimbibisi yang akan mengaktifkan enzimatik pada metabolisme di dalam benih sehingga viabilitas benih akan menjadi optimal kembali.
16
Benih yang telah diinvigorasi menggunakan larutan osmotik dapat memperbaiki proses fisiologi dan biokimia sehingga benih akan tumbuh lebih cepat dan seragam.
Benih hasil invigorasi akan tumbuh normal atau bertambahnya daya tumbuh benih. Hal ini sesuai dengan penelitian Sutariati (2002) menyatakan bahwa pada tanaman cabai dengan perlakuan invigorasi pada tingkat vigor benih yang berbeda mampu meningkatkan vigor, daya berkecambah dan kecepatan perkecambahan. Pengaruh perlakuan invigorasi secara nyata nampak lebih efektif pada benih yang memiliki tingkat vigor sedang, sementara pada vigor tinggi, pengaruh perlakuan invigorasi secara statistik tidak berbeda nyata dengan kontrol.
Perlakuan invigorasi pada benih yang berviabilitas sedang atau yang telah terdeteriorasi diharapkan dapat meningkatkan sintesis RNA dan protein, pembentukan poliribosom, meningkatkan jumlah total RNA dan protein, serta meningkatkan beberapa enzim seperti asam fosfatase dan esterase.
Apabila invigorasi dilakukan pada benih yang berviabilitas rendah diharapkan dapat mengembalikan nilai viabilitas awal benih sehingga benih mampu tumbuh pada kondisi stres atau mempunyai daya simpan lebih lama.
17
tanaman kedelai membutuhkan banyak unsur hara untuk menjamin tersedianya asimilat pada saat pengisian polong. Pada masa pembungaan akar tanaman akan tumbuh secara cepat dan mencapai pertumbuhan maksimal untuk mendapatkan unsur hara di tanah.
Pada masa pembungaan akar tanaman akan tumbuh secara cepat dan mencapai pertumbuhan maksimal untuk mendapatkan unsur hara di tanah. Semakin meningkatnya pupuk NPK yang diberikan pada tanaman kedelai, maka laju serapan unsur hara akan meningkat sehingga mencukupi kebutuhan hara bagi tanaman. Hasil sintesis antara lain dalam bentuk pati, protein, dan lipid. Pada periode ini dibutuhkan banyak unsur hara untuk pengisian benih.
Dengan penambahan pupuk pada saat tanaman berbunga maka unsur hara yang tersedia bagi tanaman lebih banyak sehingga tanaman dapat menyerap unsur hara yang dibutuhkan lebih banyak. Pemupukan susulan dalam jumlah yang
mencukupi dapat memaksimalkan pengisian biji bagi tanaman.
18
dihasilkan akan lebih banyak. Asmilat tersebut digunakan untuk mensintesis molekul organik seperti asam amino, asam nukleat, pati dan lipid.
Hasil sintesis yang ditranslokasikan ke dalam benih akan menigkatkan ukuran benih sehingga ukuran benih semakin besar dan cadangan makanan benih semakin banyak. Bobot kering hipokotil benih akan meningkat dan kecambah normal kuat akan lebih banyak seiring dengan cadangan makanan benih yang meningkat dan cukup tersedia bagi benih untuk berkecambah. Dengan cadangan makanan yang banyak maka benih akan memiliki cukup energi untuk
berkecambah sehingga viabilitas benih akan meningkat ditandai dengan persentase daya kecambah tinggi yang mempengaruhi persen keserempakan kecambah benih yang juga tinggi. Produk asimilat ini dimanfaatkan oleh tanaman dalam proses pembelahan sel di seluruh jaringan tanaman, penambahan ukuran sel, jumlah sel, dan penggantian sel-sel yang rusak.
1.5 Hipotesis
Dari kerangka pemikiran yang telah dikemukakan dapat disimpulkan hipotesis sebagai berikut:
1. Invigorasi dengan cara hidrasi-dehidrasi dapat meningkatkan viabilitas kedelai Varietas Anjasmoro
2. Pemberian pupuk NPK susulan dapat meningkatkan viabilitas benih kedelai varietas Anjasmoro
19
II. TINJAUAN PUSTAKA
2.1 Morfologi Benih Kedelai
Kedelai merupakan terna dikotil semusim dengan percabangan sedikit, sistem perakaran akar tunggang, dan batang berkambium. Kedelai dapat berubah penampilan menjadi tumbuhan setengah merambat dalam keadaan pencahayaan rendah. Kedelai, khususnya kedelai putih dari daerah subtropik, juga merupakan tanaman hari pendek dengan waktu kritis rata-rata 13 jam. Kedelai akan segera berbunga apabila pada masa siap berbunga panjang hari kurang dari 13 jam.
Biji kedelai berkeping dua, terbungkus kulit biji dan tidak mengandung jaringan endosperma. Embrio terletak diantara keping biji. Warna kulit biji kuning, hitam, hijau, coklat. Pusar biji (hilum) adalah jaringan bekas biji melekat pada dinding buah. Bentuk biji kedelai umunya bulat lonjong tetapi ada pula yang bundar atau bulat agak pipih.
20
ungu berbunga ungu, sedang yang berhipokotil hijau berbunga putih. Kecambah kedelai dapat digunakan sebagai sayuran (tauge).
Tanaman kedelai mempunyai akar tunggang yang membentuk akar-akar cabang yang tumbuh menyamping (horizontal) tidak jauh dari permukaan tanah. Jika kelembaban tanah turun, akar akan berkembang lebih ke dalam agar dapat menyerap unsur hara dan air. Pertumbuhan ke samping dapat mencapai jarak 40 cm, dengan kedalaman hingga 120cm. Selain berfungsi sebagai tempat
bertumpunya tanaman dan alat pengangkut air maupun unsur hara, akar tanaman kedelai juga merupakan tempat terbentuknya bintil-bintil akar. Bintil akar tersebut berupa koloni dari bakteri pengikat nitrogen Bradyrhizobium japonicum yang bersimbiosis secara mutualis dengan kedelai. Pada tanah yang telah
mengandung bakteri ini, bintil akar mulai terbentuk sekitar 15—20 hari setelah tanam. Bakteri bintil akar dapat mengikat nitrogen langsung dari udara dalam bentuk gas N2 yang kemudian dapat digunakan oleh kedelai setelah dioksidasi menjadi nitrat (NO3).
Kedelai berbatang dengan tinggi 30–100cm. Batang dapat membentuk 3–6 cabang, tetapi bila jarak antar tanaman rapat, cabang menjadi berkurang, atau tidak bercabang sama sekali. Tipe pertumbuhan batang dapat dibedakan menjadi terbatas (determinate), tidak terbatas (indeterminate), dan setengah terbatas (semi-indeterminate). Tipe terbatas memiliki ciri khas berbunga serentak dan
21
bertahap dari bawah ke atas dan tumbuhan terus tumbuh. Tanaman berpostur sedang sampai tinggi, ujung batang lebih kecil dari bagian tengah. Tipe setengah terbatas memiliki karakteristik antara kedua tipe lainnya.
Bunga kedelai termasuk bunga sempurna yaitu setiap bunga mempunyai alat jantan dan alat betina. Penyerbukan terjadi pada saat mahkota bunga masih menutup sehingga kemungkinan kawin silang alami amat kecil. Bunga terletak pada ruas-ruas batang, berwarna ungu atau putih. Tidak semua bunga dapat menjadi polong walaupun telah terjadi penyerbukan secara sempurna. Sekitar 60% bunga rontok sebelum membentuk polong.
Buah kedelai berbentuk polong. Setiap tanaman mampu menghasilkan 100–250 polong. Polong kedelai berbulu dan berwarna kuning kecoklatan atau abu-abu. Selama proses pematangan buah, polong yang mula-mula berwarna hijau akan berubah menjadi kehitaman.
22
2.2 Invigorasi Benih
Benih kedelai cepat mengalami kemunduran di dalam penyimpanan, disebabkan kandungan lemak dan proteinnya relatif tinggi sehingga perlu ditangani secara serius sebelum disimpan karena kadar air benih akan meningkat jika suhu dan kelembaban ruang simpan cukup tinggi. Untuk mencegah peningkatan kadar air selama penyimpanan benih, diperlukan kemasan yang kedap udara dan uap air. Kemunduran benih dapat ditengarai secara biokimia dan fisiologi. Indikasi biokimia kemunduran benih dicirikan antara lain penurunan aktivitas enzim, penurunan cadangan makanan, meningkatnya nilai konduktivitas. Indikasi fisiologi kemunduran benih antara lain penurunan daya berkecambah dan vigor (Sadjad, 1980).
Invigorasi merupakan salah satu alternatif untuk mengatasi mutu benih yang rendah dengan cara memperlakukan benih sebelum ditanam. Invigorasi didefinisikan sebagai salah satu perlakuan fisik, fisiologik dan biokimia untuk mengoptimalkan viabilitas benih, sehingga benih mampu tumbuh cepat, dan serempak pada kondisi yang beragam (Basu dan Rudrapal, 1982). Perlakuan invigorasi dapat berupa hidrasi-dehidrasi, osmoconditioning dan
matriconditioning.
Hidrasi-dehidrasi merupakan suatu perlakuan pelembaban benih dalam suatu periode tertentu yang diikuti dengan pengeringan benih sampai kembali pada berat semula (Basu dan Rudrapal, 1982).
23
jenuh dengan uap air. Sedangkan proses pengembalian kadar air benih seperti semula dapat dilakukan dengan mengeringkan benih dengan cahaya matahari langsung, dengan oven suhu 30°C atau dengan mengangin-anginkan benih sampai tercapai berat awal.
2.3 Pengujian Viabilitas Benih Kedelai
Viabilitas benih adalah daya hidup benih yang ditunjukkan dalam fenomena pertumbuhan benih atau gejala metabolismenya. Gejala metabolisme atau pertumbuhan dapat ditunjukkan dari potensi tumbuh maksimum dan daya
berkecambah. Sadjad (1993) menyatakan bahwa viabilitas benih merupakan salah satu faktor penentu mutu benih terutama secara fisiologi yang ditentukan oleh daya berkecambah dan vigor benih.
Pengujian viabilitas mencakup pengujian daya berkecambah dan pengujian vigor. Daya berkecambah menunjukkan kemampuan benih untuk tumbuh dan
berkembang menjadi tanaman normal pada kondisi lingkungan yang optimum, sedangkan vigor benih mencerminkan kemampuan benih untuk tumbuh dan berkembang menjadi tanaman normal pada kondisi lingkungan yang beragam (Sadjad, 1994).
24
Pada periode I adalah periode pembangunan atau pertumbuhan dan perkembangan benih atau disebut juga periode penumpukan energi (energy deposit). Periode II yaitu periode penyimpanan benih atau periode mempertahankan viabilitas
maksimum atau disebut juga periode penambatan energi (energy transit). Periode III dinamai periode tanam atau periode kritikal atau periode penggunaan energi (energy release) dan mulai terjadi proses kemunduran vigor dan viabilitas benih. Pada semua periode, vigor aktual atau yang juga disebut vigor sesungguhnya atau vigor hakiki terus menurun secara gradual linear dari viabilitas benih maksimum sampai benih mati.
Ciri-ciri vigor menurut Sadjad (1980) dapat diperlihatkan oleh pertumbuhan yang cepat dan merata pada kondisi yang beragam. Lebih lanjut Sadjad (1993),
mendefinisikan vigor sebagai suatu kemampuan benih untuk tumbuh menjadi tanaman yang berproduksi normal dalam keadaan yang sub optimum, dan diatas normal pada keadaan optimum, atau mampu disimpan pada kondisi yang sub optimum dan tahan disimpan lama dalam keadaan optimum. Vigor benih yang tinggi dicirikan antara lain (1) tahan disimpan lama (2) tahan terhadap haman dan penyakit (3) pertumbuhan cepat dan merata (4) mampu menghasilkan tanaman dewasa yang normal dan berproduksi baik dalam keadaan lingkungan sub optimal (Sutopo, 2002).
25
kepekaan terhadap lingkungan yang ekstrim yang akhirnya dapat menurunkan produksi tanaman (Copeland dan McDonald,1995). Kemunduran benih tidak dapat dihentikan, tetapi dapat diperlambat, yaitu dengan mengendalikan faktor penyebabnya agar kemunduran benih dapat ditekan semaksimal mungkin. Benih yang telah disimpan mengalami deteriorasi sehingga daya tumbuhnya rendah. Untuk mengatasi rendahnya daya tumbuh benih yaitu dengan perlakuan benih. Perlakuan benih ini dapat dilakukan dengan cara invigorasi dengan hidrasi-dehidrasi pada benih kedelai.
2.4 Peranan Pemupukan NPK Tambahan terhadap Viabilitas Benih
Setiap tanaman memerlukan paling sedikit 16 unsur (ada yang menyebutkan zat) agar pertumbuhannya normal. Dari ke-16 unsur tersebut, 3 unsur (karbon, hidrogen, dan oksigen) diperoleh dari udara, sedangkan 13 unsur lagi disediakan oleh tanah. Jadi tanah sebagai dapur bagi tanaman setidaknya harus tersedia 13 menu agar pertumbuhannya normal. Ke-13 unsur tersebut adalah nitrogen (N), fosfor (P), kalium (K), kalsium (Ca), magnesium (Mg), sulfur atau belerang (S), klor (Cl), ferum atau besi (Fe), mangan (Mn), kuprum atau pembaga (Cu), zink atau seng (Zn), boron (B) dan molibdenum (Mo) (Ibra Wordpress, 2008).
26
Nitrogen
Nitrogen diserap tanaman dalam bentuk NO3- dan NH4+. Dalam jaringan tanaman, N merupakan komponen penyusun berbagai senyawa esensial bagi tanaman misalnya asam amino. Selain itu, N terkandung dalam klorofil, hormon sitokinin dan auksin (Lakitan, 2004).
Peranan utama nitrogen (N) bagi tanaman adalah untuk merangsang pertumbuhan secara keseluruhan, khususnya batang, cabang, dan daun. Selain itu, nitrogen pun berperan penting dalam pembentukan hijau daun yang sangat berguna dalam proses fotosintesis. Fungsi lainnya ialah membentuk protein, lemak, dan berbagai persenyawaan organik lainnya.
Fosfor
Fosfor (P) diserap tanaman dalam bentuk H2PO4-, HPO42-, PO4-, atau tergantung dari nilai pH tanah. Unsur fosfor (P) bagi tanaman berguna untuk merangsang pertumbuhan akar, khususnya akar benih dan tanaman muda. Selain itu, fosfor berfungsi sebagai bahan mentah untuk pembentukan sejumlah protein tertentu; membantu asimilasi dan pernapasan; serta mempercepat pembungaan, pemasalan biji, dan buah (Novizan, 2003).
Kalium
27
bagi tanaman dalam menghadapi kekeringan dan penyakit.
Kekurangan salah satu atau beberapa unsur hara akan mengakibatkan pertumbuhan tanaman tidak sebagaimana mestinya yaitu ada kelainan atau penyimpangan-penyimpangan dan banyak pula tanaman yang mati muda. Gejala kekurangan ini cepat atau lambat akan terlihat pada tanaman, tergantung pada jenis dan sifat tanaman. Ada tanaman yang cepat sekali memperlihatkan tanda-tanda kekurangan atau sebaliknya ada yang lambat. Pada umumnya pertama-tama akan terlihat pada bagian tanaman yang melakukan kegiatan fisiologis terbesar yaitu pada bagian yang ada di atas tanah terutama pada daun-daunnya.
Bila tidak ada faktor lain yang mempengaruhi, maka tanda-tanda kekurangan unsur hara terlihat sebagai berikut:
1. Kekurangan unsur hara Nitrogen (N)
a. Warna daun hijau agak kekuning-kuningan dan pada tanaman padi warna ini mulai dari ujung daun menjalar ke tulang daun selanjutnya berubah menjadi kuning lengkap, sehingga seluruh tanaman berwarna pucat
kekuning-kuningan. Jaringan daun mati dan inilah yang menyebabkan daun selanjutnya menjadi kering dan berwarna merah kecoklatan.
b. Pertumbuhan tanaman lambat dan kerdil
28
d. Dapat menimbulkan daun penuh dengan serat, hal ini dikarenakan menebalnya membran sel daun sedangkan selnya sendiri berukuran kecil-kecil
e. Dalam keadaan kekurangan yang parah, daun menjadi kering, dimulai dari bagian bawah terus ke bagian atas
2. Kekurangan unsur hara Fosfor (P)
a. Terhambatnya pertumbuhan sistem perakaran, batang dan daun
b. Warna daun seluruhnya berubah menjadi hijau tua/keabu-abuan, mengkilap, sering pula terdapat pigmen merah pada daun bagian bawah, selanjutnya mati. Pada tepi daun, cabang dan batang terdapat warna merah ungu yang lambat laun berubah menjadi kuning.
c. Hasil tanaman yang berupa bunga, buah dan biji merosot. Buahnya kerdil-kerdil, nampak jelek dan lekas matang
3. Kekurangan unsur hara Kalium (K)
Defisiensi/kekurangan Kalium memang agak sulit diketahui gejalanya, karena gejala ini jarang ditampakkan ketika tanaman masih muda.
a. Daun-daun berubah jadi mengerut alias keriting (untuk tanaman kentang akan menggulung) dan kadang-kadang mengkilap terutama pada daun tua, tetapi tidak merata. Selanjutnya sejak ujung dan tepi daun tampak
29
c. Buah tumbuh tidak sempurna, kecil, mutunya jelek, hasilnya rendah dan tidak tahan disimpan
30
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan Laboratorium Teknologi Benih dan Pemuliaan Fakultas Pertanian Universitas Lampung mulai bulan Agustus sampai Oktober 2009.
3.2 Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini adalah benih kacang kedelai (Glycine max [L.] Merr.) varietas Anjasmoro hasil pertanaman yang telah diinvigorasikan dengan cara hidrasi-dehidrasi (kontrol, direndam dan
dilembabkan) dan pupuk NPK susulan pada saat berbunga (dosis 0, 75, dan 100 kg/ha), kertas merang ukuran 20 cm x 25 cm, plastik ukuran 20 cm x 25 cm, kertas label, karet gelang, dan aquades.
31
3.3 Rancangan Penelitian dan Analisis Data
Untuk menjawab perumusan masalah dan menguji hipotesis, maka perlakuan berasal dari hasil penelitian di lapang yang disusun secara faktorial (3 x 3) dalam rancangan percobaan berupa rancangan kelompok teracak sempurna.
Faktor pertama adalah 3 cara hidrasi; kontrol (H0), pelembaban (H1), dan perendaman (H2). Faktor kedua adalah pemupukan susulan ( 0 kg/ha ( P0 ), 75 kg/ha ( P1 ), dan 100 kg/ha ( P2 ) NPK. Setiap satuan percobaan diulang 3 kali.
Data yang telah dirata-ratakan, kemudian diuji homogenitas ragamnya dengan uji Barlett. Jika hasil uji Barlett adalah homogen, maka data dianalisis. Analisis data dilakukan dengan analisis ragam dan kemenambahan model diuji dengan uji Tukey. Hasil data yang didapat akan dianalisis dengan uji F terencana dan dilanjutkan pemisahan nilai tengah dengan perbandingan ortogonal pada taraf 0,05 dan 0,01.
3.4 Pelaksanaan Penelitian
3.4.1 Penyiapan Benih
Pengujian viabilitas benih yang dilakukan merupakan hasil dari benih yang telah mengalami masa penyimpanan selama 8 bulan. Setelah mengalami masa
penyimpanan tersebut diduga benih telah mengalami kemunduran benih
32
memperlakukan benih sebelum ditanam yang dapat berupa perlakuan fisik, fisiologi, dan biokimia.
3.4.2 Penyediaan Media Tumbuh Benih
Kertas merang yang dibutuhkan untuk penelitian ini berukuran 21 X 30 cm. Setiap satuan percobaan dibutuhkan sebanyak 5 lembar kertas merang, yaitu 2 lembar kertas merang untuk lapisan atas dan 3 lembar kertas merang untuk lapisan bawah. Setiap 5 lembar kertas merang diperlukan 1 lembar plastik untuk melapisi kertas merang tersebut. Setiap gulungan kertas merang ditanam 25 butir benih untuk dikecambahkan.
3.4.3 Uji Viabilitas Benih
Uji viabilitas benih menggunakan metode uji kertas digulung didirikan dalam plastik (UKDdP). Untuk mendapatkan sampel kerja digunakan alat pembagi tepat. Kertas merang yang telah dilembabkan, tiga lembar kertas merang yang sudah lembab lapisan bawah ditanami benih sebanyak 25 butir benih, lalu ditutup 2 lembar kertas merang serta digulung dan dilapisi. Gulungan lalu diberi label sesuai dengan perlakuannya dan diletakkan dalam alat pengecambah benih (germinator IPB 73-2B).
3.5 Pengamatan Viabilitas Benih
33
1. Daya Berkecambah
Pengukuran daya berkecambah dilakukan dengan metode Kertas Digulung Didirikan dalam Plastik (UKDdp). Daya berkecambah benih dihitung
berdasarkan persentase kecambah normal pada hitungan pertama (5 x 24 jam) dan hitungan terakhir (7 x 24 jam). Jumlah Benih yang ditanam sebanyak 50 butir dengan 3 kali ulangan.. Persentase daya kecambah benih dihitung menggunakan rumus:
KN I + KN II
DB = x 100%
50 butir Keterangan :
DB : Daya berkecambah
∑ KNI : Jumlah kecambah normal pada pengamatan I (5 x 24 jam)
∑ KNII : Jumlah kecambah normal pada pengamatan II (7 x 24 jam)
2. Kecambah Normal Kuat
Kecambah normal kuat diukur melalui uji keserempakan berkecambah yaitu dengan menghitung persentase kecambah normal kuat pada hari ke-6. Benih yang ditanam sebanyak 50 butir dengan 3 kali ulangan. Persentase kecambah normal kuat benih dihitung dengan menggunakan rumus sebagai berikut
Jumlah Kecambah Normal Kuat
34
3. Bobot Kering Kecambah Normal
Pengamatan dilakukan dengan cara menimbang kecambah normal hasil pengamatan kecambah normal kuat setelah dibuang kotiledonnya kemudian dikeringkan dengan menggunakan oven pada suhu 600C selama 3 x 24 jam atau sampai konstan bobotnya. Pengukuran bobot kering rata-rata kecambah normal diperoleh dengan membagi angka pengukuran bobot kering tersebut dan jumlah kecambah normal yang ada.
4. Kecepatan Kecambah Benih perhari
Pengamatan dilakukan dengan menghitung persentase kecambah normal setiap hari dimulai dari hari ke-3 sampai dengan hari ke-7. Benih yang ditanam sebanyak 50 butir dengan 3 kali ulangan. Kecepatan berkecambah dihitung dengan menggunakan rumus sebagai berikut
(Xi + Xi+1) KCB = ---
Ti Keterangan :
KCB : Kecepatan berkecambah benih Ti : Jumlah et mal (hari) Pengamatan
Xi : Persentase kecambah normal pengamatan hari ke-i
5. Panjang kecambah normal
Pengukuran kecambah normal dari panjang titik tumbuh sampai pangkal akar. Pengukuran dilakukan pada kecamabah normal dari uji keserempakan
48
DAFTAR PUSTAKA
Barton. 1941 dalam Lita, 1998. Teknologi Benih. PT. Raja Grasindo Persada. Jakarta. 223 hlm.
Basu. R.N., K. Chattopadhyay, P.K. Bandopadhyay and S.L. Basak. 1978. Maintenance of vigour and viability ofstored jute seeds.
Seed Research. 6 (1) : I - 13.
Basu. R.N. And P.K. Bandopandhyay. 1983. Presentation of vigour, viability and yield potential of stored jute and mesta seeds. University college of Agriculture, Calcutta. 13pp.
Basu dan Rudrapal. 1982. Post Harvest seed “Physiology and Seed Invigoration
Treatments.” Proceeding of the Indian Statistical Institute Golden Jubilee International Conference on Frontiers of Research in Agriculture – Calcutta. India. 374-397p.
Bewley, J.D. and M. Black. 1985. Seed Physiology of Development and Germination. Plenum Press. New York and London. 367p.
Byrd, H.W. 1983. Pedoman Teknologi Benih. Diterjemahkan oleh PT Pembimbing Masa. Jakarta. 79 Hlm.
Copeland, L.O. and M.B. DcDonald. 2001. Principles of Seed Science and Technology. Second Edition. Macmillan Publishing Company. New York. 321 pp.
_____________________________. 2001. Principles of Seed Science and Technology Fourth Edition. Norwell. Massachusetts USA. 467 p.
Egly dan Krony, 1996. Suhu ruang simpan terhadap kualitas benih kedelai hitam dan kuning.
http://balittro.litbang.deptan.go.id/pdf/edisikhusus/2007_01/edisi_khusus 2007_01_05.pdf. Di unduh tanggal 14 februari 2010. 76hlm.
Epstein, E. 1972. Mineral Nutrition of Plant: Principles and Perspective. John Willey and Sons Inc. New York. 37p.
Hadiana,W.R. 1996. Peningkatan viabilitas dan vigor benih dengan perlakuan presoaking dan conditioning. Karya Ilmiah. Jurusan Budidaya Pertanian. Fakultas
49
Hanway dan Weber. 1977. Pengaruh Pemupukan N Susulan terhadap Pertumbuhan dan Hasil Empat Genotipe Kedelai (Glycine max L. [Merr.]). 80 hlm.
Ibra Wordpress. 2008. Gejala Kekurangan Unsur Hara bagi Tanaman. http://ibra76.wordpress.com/2008/09/...agi-tanaman-2/.
Ilyas, S., Shalahuddin dan Yunitasari. 1994. Matriconditioning benih cabai (Capsicum annuum L.) untuk memperbaiki performansi benih.
Keluarga benih 5(1): 59-67.
Ilyas, S. 1996. Perubahan fisiologis dan biokemis dalam proses ―Seed Conditioning‖. Keluarga Benih 6(2): 70-79.
Ilyas, S. and W. Suartini. 1998. Improving seed quality, seedling growth, and yield of yard-long bean (Vigna unguiculata (L.) Walp.) by seed conditioning and giberelic acid treatment. P. 292-301. In: A.G. Taylor and Xue-Lin Huang (eds) Progress in Seed Research: Proceeding of The Second International Conference on Seed Science and Technology, Guangzhou, China, 1997.
Juni Rahmanto H. Tanpa tahun. Pengaruh Hidrasi Pada Benih Yang Telah Mengalami Periode Simpan Dan Pupuk NPK Susulan Dalam Meningkatkan Produksi Kedelai (Glycine Max [L.] Merr.) Belum dipublikasikan.
Jutono. 1982. The application of Rhizobium-inoculant on soybean in Indonesia. Ilmu Pert. (Agric. Sci.) 3 (5): 215-222.
Kaspar, T.C. 1987. Growth and development of soybean root system. World soybean research confrence III: ( 832-847).
Khan, A.A. 1992. Preplant physiological seed conditioning.
In J. Janick (Ed.). Horticultural Review. Wiley and Sons Inc. New York. p.131 - 175 .
Lakitan, B. 1995. Hortikultura, Teori, Budidaya dan Pasca Panen. Jakarta: PT Raja Grafindo Persada. 144-145 hlm.
________. 2004. Dasar-dasar Fisiologi Tanaman cetakan kelima. Jakarta: PT Raja Grafindo Persada. 204 hlm.
Larson, L .A. 1968. The effect soaking peaseedswithor without seed coat has on seedling vigor. Growth.Plant Physiol. 43 : 255-259.
Leopold, A.C. 1383. Volumetric components of seed imbibition. PlantPhysiol. 73 : 677-680.