RENCANA PELAKSANAAN PEMBELAJARAN
Sekolah : SMA Negeri 1 BUKITKEMUNING Mata Pelajaran : Kimia
Kelas/Semester : XI/1
Materi Pokok : Thermokimia
Alokasi Waktu : 1 Minggu x 4 Jam pelajaran @ 45 Menit
A. Kompetensi Inti
1. Menghayati dan mengamalkan ajaran agama yang dianutnya
2. Menghayati dan mengamalkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan proaktif, dan menunjukan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia
3. Memahami, menerapkan, dan menganalisis pengetahuan faktual, konseptual, prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah
4. Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, bertindak secara efektif dan kreatif, serta mampu menggunakan metoda sesuai kaidah keilmuan
B. Kompetensi Dasar
1.1 Menyadari adanya keteraturan dari sifat hidrokarbon, termokimia, laju reaksi, kesetimbangan kimia, larutan dan koloid sebagai wujud kebesaran Tuhan YME dan pengetahuan tentang adanya keteraturan tersebut sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif. 1.2 Mensyukuri kekayaan alam Indonesia berupa minyak bumi, batubara dan gas alam serta
berbagai bahan tambang lainnya sebagai anugrah Tuhan YME dan dapat dipergunakan untuk kemakmuran rakyat Indonesia.
2.1 Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis, komunikatif) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
2.2 Menunjukkan perilaku kerjasama, santun, toleran, cinta damai dan peduli lingkungan serta hemat dalam memanfaatkan sumber daya alam.
2.3 Menunjukkan perilaku responsif dan pro-aktif serta bijaksana sebagai wujud kemampuan memecahkan masalah dan membuat keputusan
3.5 Menentukan H reaksi berdasarkan hukum Hess, data perubahan entalpi pembentukan standar, dan data energi ikatan.
Indikator :
3.4.1. Menghitung H reaksi berdasarkan data percobaan 3.4.2. Menghitung H reaksi berdasarkan hukum Hess
3.4.3. Menghitung H reaksi berdasarkan data perubahan entalpi pembentukan standar 3.4.4. Menghitung H reaksi berdasarkan data energi ikatan
4.5 Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan penentuan H suatu reaksi.
Indikator :
4.4.1 Merancang percobaan penentuan H suatu reaksi.
4.4.2 Melakukan percobaan penentuan H suatu reaksi dengan kalorimeter 4.4.3 Menyimpulkan percobaan penentuan H suatu reaksi dengan kalorimeter 4.4.4 Menyajikan hasil percobaan penentuan H suatu reaksi dengan kalorimeter 4.4.5 Membuat laporan hasil percobaan penentuan H suatu reaksi dengan kalorimeter 4.4.6 Menyajikan hasil perhitungan penentuan H reaksi berdasarkan hukum Hess 4.4.7 Menyajikan hasil perhitungan H reaksi berdasarkan data perubahan entalpi pembentukan standar
C. Tujuan Pembelajaran
Setelah pembelajaran peserta didik dapat :
1. Bekerjasama, konsisten, disiplin, rasa percaya diri, dan toleransi dalam perbedaan strategi berpikir dalam memilih dan menerapkan strategi menyelesaikan masalah dalam pelajaran
Thermokimia
2. Berprilaku jujur, tangguh menghadapi masalah, kritis dan disiplin dalam melakukan tugas belajar Thermokimia
3. Bersikap tanggung jawab, rasa ingin tahu, jujur dan perilaku peduli lingkungan dalam belajar Thermokimia
4.
Menghitung
H reaksi berdasar data percobaan
5. Menghitung
H reaksi berdasarkan hukum Hess,6. Menghitung
H reaksi berdasarkan data perubahan entalpi pembentukan standar 7. Menghitung
H reaksi berdasarkan data energi ikatan8. Merancang percobaan penentuan
H suatu reaksi dengan kalorimeter 9. Melakukan percobaan penentuan
H suatu reaksi.10. Menyimpulkan percobaan penentuan
H suatu reaksi.11. Membuat laporan hasil percobaan penentuan
H suatu reaksi.12. Menyajikan hasil perhitungan penentuan H reaksi berdasarkan hukum Hess
13. Menyajikan hasil perhitungan H reaksi berdasarkan data perubahan entalpi pembentukan standar
14. Menyajikan hasil perhitungan H reaksi berdasarkan data energi ikatan
D. Materi Pembelajaran
1. Fakta: Kalorimetri :
Pertemuan 2 b.
3. Prinsip
Q = m.C . ∆T Hukum Hess 4. Prosedur:
- Langkah-langkah praktikum menghitung ∆H reaksi dengan kalorimeter -Cara menghitung ∆H reaksi dengan hukum Hess
E. Metode Pembelajaran
Pendekatan : Scientific Learning
Model Pembelajaran : Discovery Learning (Pembelajaran Penemuan) dan Problem Based Learning (Pembelajaran Berbasis Masalah)/projek
F. Media, Alat, Bahan dan Sumber Pembelajaran
Media :
Worksheet atau lembar kerja (siswa) lembar penilaian
Alat/Bahan :
Penggaris, spidol, papan tulis Laptop & media ppt & flash Alat dan bahan pada :LKS LKS termokimia
Sumber Belajar :
Buku Kimia Siswa Kelas XI, Kemendikbud, tahun 2013 Buku Kimia SMA XI, Unggul Sudarmo, Erlangga (hal. 56-90) Dwiwahyunanti.blogspot.com
http://my-diaryzone.blogspot.com/2010/11/belajar-kimia-hukum-hess.html
G. Langkah-langkah Pembelajaran Pertemuan 2a ( 2 X 45 menit)
Kegiatan Deskripsi Kegiatan Alokasi
Waktu
Pendahuluan Fase Menyampaikan tujuan dan memotivasi
1. Guru memberikan salam dan menanyakan kabar para siswa 2. Guru mengingatkan kembali materi yang berhubungan : reaksi
eksoterm, reaksi endoterm, ∆Hf, ∆Hd, ∆Hc, persamaan termokimia, sistem, lingkungan
3. Motivasi : Pada pertemuan sebelumnya, kita sudah belajar sistem terisolasi, terbuka dan tertutup (sambil menunjukkan kalorimeter) , menurut kalian kalorimeter termasuk sistem yang mana? Bagaimana kita bisa menentukan harga suatu ∆H dengan kalorimeter?
4. Guru menyampaikan tujuan pembelajaran
10 menit
Inti Fase mengamati
1. Guru membagi siswa ke dalam kelompok-kelompok yang terdiri dari 6 orang dengan tingkat kemampuan yang heterogen
2. Guru menampilkan gambar calorimeter.
Kegiatan Deskripsi Kegiatan Alokasi Waktu
3. Guru menyampaikan tujuan pembelajaran. Fase menanya
1. Siswa menuliskan pertanyaan –pertanyaan dari hasil pengamatanya dalam bentuk catatan kecil.
2. Antar siswa dalam kelompoknya saling bertanya tentang penemuannya 3. Siswa bertanya kepada guru apabila ada hal tidak dipahami tentang
penemuannya dalam fase pengamatan.
4. Siswa menggali informasi tentang fungsi dari calorimeter.
5. Siswa dalam kelompok mencari informasi merancang percobaan untuk mengukur ∆H dengan kalorimeter
Fase mengeksplorasi
1. Masing – masing kelompok melakukan eksperimen yang bertujuan mengetahui perubahan suhu pada calorimeter. (LKS Kimia XI/ termokimia 4)
2. menghubungkan antara fakta dari hasil pengamatan dengan konsep yang ditemukan dari hasil menggali informasi dari internet maupun guru.
Fase mengasosiasi
1. Masing – masing kelompok mengolah data hasil ekseperimen dan menyimpulkan hasil eksplorasinya.
Fase mengkomunikasikan
1. Siswa menuliskan hasil eksperimennya dalam sebuah laporan tertulis (dikumpulkan pada pertemuan berikutnya)
2. Guru meminta setiap kelompok untuk mempresentasikan hasil percobaan yang melibatkan perubahan suhu baik eksoterm maupun edoterm yang diperoleh masing-masing kelompok pada fase sebelumnya (selama diskusi berlangsung guru berkeliling memantau kerja dari tiap-tiap kelompok)
3. Menyampaikan hasil diskusi berupa kesimpulan berdasarkan hasil analisis secara lisan (presentasi di depan kelas) : o Mempresentasikan hasil diskusi kelompok secara klasikal
o Mengemukanpendapat atas presentasi yang dilakukan dan ditanggapi oleh kelompok yang mempresentasikan
o Bertanya atas presentasi yang dilakukan dan peserta didik lain diberi kesempatan untuk menjawabnya.
o Menyimpulkan tentang point-point penting yang muncul dalam kegiatan pembelajaran yang baru dilakukan.
4. Mengerjakan soal latihan yang terdapat pada buku pegangan Siswa atau lembar kerja yang telah disediakan.
5. Siswa bertanya tentang hal yang belum dipahami, atau guru melemparkan beberapa pertanyaan kepada siswa.
6. Menyelesaikan uji kompetensi yang terdapat pada buku Pegangan Siswa atau pada lembar kegiatan Siswa untuk
Mengecek penguasaan Siswa terhadap materi pelajaran Penutup 1. Guru dan siswa membuat kesimpulan hasil pembelajaran.
2. Guru memberikan PR
3. Guru menginformasikan tentang materi yang akan dipelajari Pada pertemuan akan datang
H.Penilaian Hasil Belajar
Teknik Penilaian : Pengamatan, tes tertulis
2. Prosedur Penilaian :
No Aspek yang dinilai Teknik Penilaian Waktu Penilaian
1. Sikap
a. Terlibat aktif dalam pembelajaran
calorimeter.
b. Bekerjasama dalam kegiatan kelompok. c. Toleran terhadap
perbedaan pendapat
Pengamatan Selama Praktikum dan saat diskusi
2. Pengetahuan
Mendeskripsikan berbagai masalah calorimeter.
Menghitung harga ∆H dengan data percobaan
Pengamatan dan tes tertulis
Selama proses diskusi kelompok dan presentasi Setelah pelaksanaan diskusi
3. Keterampilan
a. Unjuk kerja praktikum menghitung ∆H reaksi dengan kalorimeter . b. Laporan (portofolio)
hasil praktikum
Rubrik Pengamatan
Rubrik Penilaian
Penyelesaian tugas (baik individu maupun kelompok) dan saat praktikum
I. Instrumen Penilaian Hasil Belajar (Terlampir) Tugas Portofolio
Membuat laporan tentang calorimeter yang melibatkan perubahan suhu.
Observasi
Sikap ilmiah saat diskusi dan presentasi dengan lembar pengamatan Ketrampilan Unjuk Kerja
Pertemuan 2b (2jam) : HUKUM HESS
Kegiatan Deskripsi Kegiatan Alokasi
Waktu
Pendahuluan Fase Menyampaikan tujuan dan memotivasi
1. Guru memberikan salam dan menanyakan khabar para siswa
2. Guru menyampaikan materi yang berhubungan dengan perubahan suhu 3. Guru menyampaikan tujuan pembelajaran
10 menit
Inti
Fase mengamati
Guru membagi siswa ke dalam kelompok-kelompok yang terdiri
dari 6 atau 7 orang dengan tingkat kemampuan yang heterogen
Guru menampilkan gambar reaksi satu tahap
Guru menampilkan gambar reaksi dua tahap.
Siswa mengamati powerpoint presentasi Hukum Hess
Fase Menanya
Siswa mempelajari penentuan ∆H reaksi berdasarkan Hukum Hess
Siswa diminta untuk berpikir tentang beberapa masalah, misalnya:
“Bagaimana cara menentukan ∆H reaksi berdasarkan Hukum
Kegiatan Deskripsi Kegiatan AlokasiWaktu
Hess?”, “Apa maksud dari kalor raksi tidak bergantung pada lintasan
atau jalannya reaksi?”, “Apa maksud dari kalor reaksi hanya
ditentukan oleh keadaan awal dan keadaan akhir?”
Mengorganisasi siswa dalam belajar
Membentuk kelompok belajar secara heterogen
Siswa menerima informasi kegiatan yang harus dilakukan, yaitu
mendiskusikan cara menentukan ∆H reaksi berdasarkan Hukum
Hess
Fase Mengeksploarasi
Siswa mendikusikan cara menentukan ∆H reaksi berdasarkan
Hukum Hess
Siswa menggali informasi tentang hukum Hess (Buku Siswa Kimia
XI, Erlangga, Unggul Sudarmo hal72-73)
Siswa mendiskusikan hukum Hess dengan bantuan langkah
pemecahan masalah yang berupa pertanyaan-pertanyaan pada LKS
non eksperimen
Fase mengeksplorasi
Masing – masing kelompok menyelesaikan soal dari hukum Hess.
(Buku Kimia XI, Erlangga ,Unggul hal 75.No1, 3,9) dan LKS
XI/termokimia 4
Siswa menghubungkan antara fakta dari hasil pengamatan dengan
konsep yang ditemukan dari hasil menggali informasi dari buku,
internet maupun guru.
Masing – masing kelompok menyimpulkan hasil eksplorasinya.
Fase mengkomunikasikan
Guru meminta Siswa untuk mempresentasikan hasil eksplorasinya
mengenai hukum Hess
Siswa mempresentasikan hasil diskusi kelompok dengan menuliskan
penyelesaian soal (masalah) di papan tulis
Siswa mengerjakan soal-soal mengenai hukum Hess
Penutup 1. Guru dan siswa bersama – sama membuat kesimpulanhasil pembelajaran.
2. Guru memberikan PR tentang bahan –bahan kimia yang ada dirumah siswa masing –masing secara individu kepada siswa.
3. Guru menginformasikan tentang materi yang akan dipelajari pada pertemuan yang akan dating
4. Guru mengakhiri pelajaran dan memberikan pesan untuk selalu belajar dan tetap semangat.
15 menit
H.Penilaian Hasil Belajar
No Aspek yang dinilai Teknik Penilaian Waktu Penilaian
1. Sikap
a. Terlibat aktif dalam pembelajaran hokum Hess
b. Bekerjasama dalam kegiatan kelompok. c. Toleran terhadap
perbedaan pendapat
Pengamatan Selama pembelajaran dan saat diskusi
2. Pengetahuan
Mendiskripsikan
berbagai masalah hokum Hess.
Pengamatan dan tes tertulis
Selama proses diskusi kelompok dan presentasi Setelah pelaksanaan diskusi
3. Keterampilan
c. Terampil menerapkan konsep/prinsip dan strategi pemecahan masalah yang relevan yang berkaitan dengan hokum Hess .
Pengamatan Penyelesaian tugas (baik individu maupun kelompok) dan saat diskusi
II. Instrumen Penilaian Hasil Belajar (Terlampir)
Tugas Portofolio : Membuat laporan tentang calorimeter yang melibatkan perubahan suhu.
Observasi : Sikap ilmiah saat diskusi dan presentasi dengan lembar pengamatan
Bukitkemuning, 14 Juli 2014
Mengetahui,
Guru Mata Pelajaran
Kepala SMAN 1 Bukitkemuning
Dra. Sri Mastini Dwi Wahyunanti, S.Pd
NIP. 19641028 199103 2 003
NIP. 19711011 199301 2 001
Lampiran
LKS Kimia XI/Termokimia 3
Alat:
Kalorimeter sederhana
termometer
Bahan
NaOH 0,2 M
HCl 0,2 M
b.
Prosedur Kerja
Mengukur ΔH menggunakan kalorimeter sederhana
1. Sediakan kalorimeter sederhana yang terbuat dari 2 wadah minuman styrofoam berukuran
250 ml. Tutup wadah dengan gabus yang sudah dilubangi untuk penempatan termometer
(lihat gambar 2.8)
2. Ambil 50 ml larutan NaOH 0,2 M dan 50 ml larutan HCl 0,2 M. Ukur suhu masing-masing
larutan. Ambil nilai rata-ratanya dan catat.
3. Masukkan larutan NaOH kedalam kalorimeter lalu tambahkan HCl. Tutup kalorimeter dan
aduk rata dengan termometer.
4.
Ukur dan catat suhu tersebut.
c.
Data Pengamatan
Data Hasil Pengamatan
Suhu larutan NaOH =
Suhu larutan HCl =
Suhu rata-rata (suhu awal) =
Suhu akhir =
Kenaikan suhu =
Apakah reaksi yang terjadi termasum eksoterm atau endoterm ?
Hitung kalor reaksi per mol NaOH. Asumsikan kalor jenis larutan = 4,18 j/g°C dan kerapatan
larutan= 1.000 g/L.
Berapa perubahan entalpi reaksi?
Tulis persamaan termokimianya!
Soal Kognitif Tertulis : Pertemuan 2b. Hukum Hess
menjadi 33
oC. Jika kalor jenis larutan dianggap sama dengan air yaitu 4,18 Jgr
-1K
-1Tentukanlah perubahan entalpi reaksi :
NaOH
(aq)+ HCl
(aq)→ NaCl
(aq)+ H
2O
(l)2. Kedalam kalorimeter dicampurkan 100 mL larutan HCl 2M dengan 100 mL larutan NaOH
1M menyebabkan suhu larutan naik dari 25
0C menjadi 31,5
0C. Jika kalor jenis larutan
dianggap sama dengan kalor jenis air yaitu 4,2 J g
-10C
-1, kapasitas kalor kalorimeter = 0 dan
massa jenis air = 1 g cm
-3, tentukan ∆H reaksi.
Kunci Jawaban Soal Tertulis
1. Kunci Jawaban
Skor
Reaksi antara NaOH dengan HCl mengakibatkan kenaikan suhu dari 27
0C
menjadi 33
0C. sehingga dengan demikian reaksi tersebut tergolong reaksi
Eksoterm.
Massa larutan (m) = 10 gr + 10 gr = 20 gr
karena kalor jenis larutan sama denga kalor jenis air sehingga massa
jenis larutan juga sama dengan massa jenis air yaitu 1 grL.
Kalor jenis larutan = 4,18 Jgr
-1K
-1,
kenaikan suhu (∆t) = 33
0C – 27
0C = 6
0C = 6K
Qreaksi = m
larx C
larx ∆t
= 20 gr x 4,18 Jgr
-1K
-1x 6K
= 501,6 J
Kalor di atas adalah kalor yang timbul dari reaksi 10 mL NaOH 1M
dengan 10 mL HCl 1M .
10 mL NaOH 1M mengandung 10 mmol NaOH = 0,01 mol NaOH
0,1
L HCl 1M mengandung 10 mmol HCl = 0,01 mol HCl
∆H reaksi harus dihitung sesuai dengan stoikiometri reaksi.
Jadi ∆H reaksi dihitung berdasarkan reaksi 1 mol NaOH dengan 1 mol
HCl ( sesuai dengan koefisien reaksi )
jadi Q(1mol NaOH + 1 mol HCl ) = 50160 J = 50,16 KJ
Reaksi berlangsung dengan eksoterm, sehingga ∆H = -Q
∆H = -50,16 KJ
2
2
2
2
2
Jumlah Total
10
2. Kunci Jawaban
Skor
Jumlah mol HCl = 100 mL x 2 M = 200 mmol = 0,2 mol
Jumlah mol NaOH = 100 mL x 1 M = 100 mmol = 0,1 mol
2
Menurut Persamaan reaksi mol HCl dengan mol NaOH adalah sama
( koefisiennya sama ) tetapi jumlah mol yang direaksikan berbeda,
oleh karena itu mol NaCl yan terbentuk dihitung berdasarkan mol
yang habis bereaksi yaitu NaOH ( jumlah molnya paling kecil ), jadi
mol NaCl = mol NaOH = 0,1 mol
2
Volume larutan = 100 mL + 100 mL = 200 mL
Massa larutan = massa air = 200 mL x 1 g mL
-1= 200 g
Maka Kalor yang diterima larutan :
Q
reaksi+ Q
larutan= 0
Q
reaksi= -Q
larutan= -5460 J
Q
larutan= m x c x ∆t
= 200 g x 4,2 J g
-1K
-1x (31,5 – 25)K = 5460 J
∆H
reaksiuntuk 0,1 mol = -5460 J
∆H
reaksiuntuk 1 mol = -54600 J/mol
Kalor yang dilepaskan reaksi adalah: 54600 J/mol
2
2
2
Jumlah Total
10
PENILAIAN UNJUK KERJA PRAKTIKUM KALOR REAKSI
Mata Pelajaran
: Kimia
No
Aspek Keterampilan
Skor
YA TIDAK
1
Membaca panduan percobaan
2
Mengecek kesesuaian alat dan bahan yang disiapkan di meja
dengan yang ada di buku panduan
3
Menyiapkan alat dan bahan dengan teliti
4
Menyiapkan kertas untuk mencatat percobaan
1
Mengukur suhu HCl dan NaOH dengan thermometer
2
Menimbang HCl dan NaOH dengan teliti
3
Mencampurkan larutan HCl dan NaOH
4
Mengukur suhu campuran dalam kalorimeter dengan teliti
5
Terampil menggunakan peralatan praktikum sesuai fungsinya
1
Mengecek kembali hasil-hasil pengukurannya
2
Membersihkan alat dan dikembalikan pada tempatnya
3
Menganalisis data percobaan yang telah diperoleh
4
Membuat laporan sederhana hasil percobaan
Total
Deskriptor PenilaianDeskriptor Skor
A. Persiapan
1. Bila 4 hal yang dilakukan dengan baik
2. Bila 4 hal dilakukan , tetapi ada yang tidak sempurna 3 Bila 3 hal yang dilakukan
4. Bila 2 hal yang dilakukan 5. Bila 1 hal dilakukan
5 4 3 2 1 B. Kegiatan Inti
1. Bila 5 hal yang dilakukan dengan baik 2. Bila 4 hal dilakukan
3. Bila 3 hal yang dilakukan 4. Bila 2 hal yang dilakukan 5. Bila 1 hal dilakukan
5 4 3 2 1 C. Kegiatan Akhir
1. Bila 4 hal yang dilakukan dengan baik
2. Bila 4 hal dilakukan , tetapi ada yang tidak sempurna 3 Bila 3 hal yang dilakukan
4. Bila 2 hal yang dilakukan 5. Bila 1 hal dilakukan
5 4 3 2 1
PENILAIAN LAPORAN HASIL PRAKTIKUM
Tabel 1. Skor Penilaian Laporan Praktikum
No Aspek Skor Maksimum
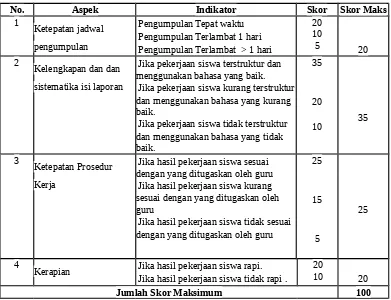
1. Ketepatan jadwal pengumpulan 20
2. Kelengkapan dan sistematika isi laporan 35
3. Ketepatan Prosedur Kerja 25
4. Kerapian 20
Total 100
Tabel 2. Rubrik Penilaian Laporan Praktikum
No. Aspek Indikator Skor Skor Maks
1
Ketepatan jadwal pengumpulan
Pengumpulan Tepat waktu Pengumpulan Terlambat 1 hari Pengumpulan Terlambat > 1 hari
20 10
5 20
2
Kelengkapan dan dan sistematika isi laporan
Jika pekerjaan siswa terstruktur dan
menggunakan bahasa yang baik.
Jika pekerjaan siswa kurang terstruktur
dan menggunakan bahasa yang kurang baik.
Jika pekerjaan siswa tidak terstruktur
dan menggunakan bahasa yang tidak baik.
35
20
10 35
3
Ketepatan Prosedur Kerja
Jika hasil pekerjaan siswa sesuai
dengan yang ditugaskan oleh guru
Jika hasil pekerjaan siswa kurang
sesuai dengan yang ditugaskan oleh guru
Jika hasil pekerjaan siswa tidak sesuai
dengan yang ditugaskan oleh guru
25
15
5
25
4
Kerapian Jika hasil pekerjaan siswa rapi.
Jika hasil pekerjaan siswa tidak rapi .
20
10 20
Jumlah Skor Maksimum 100
LEMBAR PENILAIAN SIKAP PENILAIAN DIRI
Satuan Pendidikan : SMANegeri 1 BUKITKEMUNING
[image:11.612.71.462.256.556.2]2.1 Menunjukkan perilaku santun dan peduli dalam melaksanakan komunikasi interpersonal dengan guru dan teman
2.2 Mengembangkan perilaku jujur, disiplin, percaya diri, dan bertanggung jawab dalam melaksanakan komunikasi transaksional dengan guru dan teman
2.3 Menunjukkankan perilaku tanggung jawab, peduli, kerjasama, dan cinta damai, dalam melaksanakan komunikasi fungsional
Indikator:
1. Memiliki motivasi internal selama proses pembelajaran
2. bekerjasama dalam menyelesaikan tugas kelompok
3. menunjukkan sikap konsisten dalam proses pembelajaran
4. menunjukkan sikap disiplin dalam menyelesaikan tugas individu maupun kelompok
5. menunjukkan rasa percaya diri dalam mengemukakan gagasan, bertanya, atau menyajikan
hasil diskusi
6. Menunjukkan sikap toleransi dan saling menghargai terhadap perbedaan pendapat/cara dalam
menyelesaikan masalah
7. Menunjukan sikap positip (individu dan sosial) dalam diskusi kelompok
8. Menunjukkan sikap ilmiah pada saat melaksanakan studi literatur atau pencarian informasi
9. Menunjukkan perilaku dan sikap menerima, menghargai, dan melaksanakan kejujuran, kerja
keras, disiplin dan tanggung jawab
PENILAIAN DIRI
Nama
:
Kelas
:
Kelompok : ………
Untukpertanyaan 1 sampaidengan6,tulismasing-masinghurufsesuaidenganpendapatmu!
A = Selalu B = Sering C = Jarang D = Tidak pernah
1
Saya memiliki motivasi dalam diri saya sendiri selama proses pembelajaran
2
Saya bekerjasama dalam menyelesaikan tugas kelompok
3
Saya menunjukkan sikap konsisten dalam proses pembelajaran
4
Saya menunjukkan sikap disiplin dalam menyelesaikan tugas individu maupun kelompok
5
Saya menunjukkan rasa percaya diri dalam mengemukakan gagasan, bertanya, atau
menyajikan hasil diskusi
6
Saya menunjukkan sikap toleransi dan saling menghargai terhadap perbedaan
pendapat/cara dalam menyelesaikan masalah
7
Sayamenunjukansikappositip (individudan12ocial) dalamdiskusikelompok
8
Sayamenunjukkansikapilmiahpadasaatmelaksanakanstudi12iteratureataupencarianinformasi9
Sayamenunjukkanperilakudansikapmenerima, menghargai, danmelaksanakankejujuran,
kerjakeras, disiplindantanggungjawab
Pedoman Penskoran:
Skor 4, jika A = Selalu Skor 3, jika B = Sering
Skor 2, jika C = Jarang Skor 1, jika D = Tidakpernah
Mengetahui
Guru KIMIA,
SiswaPesertaDidik,
Dwi Wahyunanti, S.Pd
………
Lampiran : Penilaian Kognitif HUKUM HESS
Penilaian pengetahuan (kognitif)
Indikator Pencapaian
Kompetensi
Soal
Kunci
Skor Max
3.5.1 Menentukan ∆H reaksi
berdasarkan Hukum Hess
C(s) + O2(g) → CO2 (g) ΔH° = -393,5 kJ H2(g) + ½ O2(g) → H2O (g) ΔH° = -283,8 kJ 2C(g) + H2(g) → C2H2 (g) ΔH° = +226,7 kJ
Atas dasar reaksi diatas, maka tentukan
perubahan entalpi (∆H) untuk reaksi
C2H2(g) + 5/2 O2(g) → H2O (g)+ 2CO2(g) !
C(s) + O
2(g) → CO
2(g) ΔH° = − 393,5 kJ
H
2(g) + ½ O
2(g) → H
2O (g) ΔH° = − 283,8 kJ
2C(g) + H
2(g) → C
2H
2(g) ΔH° = + 226,7 kJ
2C
2H
2(g) + 5 O
2(g) → 2H
2O (g) + 4CO
2(g)
ΔH° = −2595,4 kJ
1
1
1
1
1
Diberikan data perobahan
entalpi siswa dapat
menentukan ∆H reaksi dengan
mengunakan hukum hess.
Diberikan data sebagai berikut
H
2(g)+F
2(g)
2HF(g) ∆H = -537 kJ
C(s)+2F
2(g)
CF
4(g) ∆H = -680 kJ
2C(s)+2H
2(g)
C
2H
4(g)
∆H = +52,3 kJHitung ∆H dengan mengunakan hukum hess dari
reaksi
C2H4(g)+ 6F2(g) 2CF4(g) + 4HF(g)
(H
2(g)+F
2(g)
2HF(g) ∆H = -537 kJ)x2
(C(s)+2F
2(g)
CF
4(g) ∆H = -680 kJ) x2
C
2H
4(g)
2C(s)+2H
2(g)
∆H = - 52,3 kJ---
C2H4(g)+ 6F2(g) 2CF4(g) + 4HF(g)
Menjadi :
2H
2(g)+2F
2(g)
4HF(g) ∆H = -1074 kJ
2C(s)+4F
2(g)
2 CF
4(g) ∆H = -1360 kJ
C
2H
4(g)
2C(s)+2H
2(g)
∆H = - 52,3 kJ---
C2H4(g)+ 6F2(g) 2CF4(g) + 4HF(g)
∆H = -2486,3
1
1
2
LEMBAR PENILAIAN SIKAP
TEMAN SEBAYA
SatuanPendidikan : SMA Negeri ………..
Mata Pelajaran : Kimia
Kelas : XI (Sebelas)
Kompetensi dasar
:
2.4 Menunjukkan perilaku santun dan peduli dalam melaksanakan komunikasi interpersonal dengan guru dan teman
2.5 Mengembangkan perilaku jujur, disiplin, percaya diri, dan bertanggung jawab dalam melaksanakan komunikasi transaksional dengan guru dan teman
2.6 Menunjukkankan perilaku tanggung jawab, peduli, kerjasama, dan cinta damai, dalam melaksanakan komunikasi fungsional
Indikator:
1. Siswa tidak meniru (menyontek) hasil kerja teman ketika mengerjakan tugas individu 2. Siswa tangguh dalam menyelesaikan masalah
3. Siswa menunjukkan sikap kritis dalam diskusi kelompok maupun klasikal
4. Siswa menunjukkan sikap disiplin dalam menyelesaikan tugas individu maupun kelompok
Instrumen
Kategori: 86 – 100 : SangatBaik 71 – 85 : Baik
55 – 70 : Cukup < 55 : Kurang
………, 14 Juli 2014 Mengetahui
Kepala SMAN ……… Guru Mata Pelajaran
……… .. ………..
Petunjuk:
Berilahtanda (X) padapilihan yang paling menggambarkankondisitemansejawatkamudalamkurunwaktu 1 (satu) mingguterakhir.
Nama Teman yang Dinilai : ……….. Kelas : ………
TidakPernah
Jarang
Sering Selalu
3
No. AspekPenilaian 4 2 1
1. Siswabertanyakepadatemanketikamengerjakantugasindividu
2. Siswa meniru/menyontek pekerjaan teman pada saat ulangan
3. Siswatidakmengeluhketikamenyelesaikantugasindividuataukelompok
4. Siswa menuntaskan tugas yang diberikan guru
5. Siswa bertanya kepada guru atau teman ketika proses pembelajaran berlangsung
6. Siswa mengumpulkan tugas tepat waktu
Jumlah Total Skor
Keterangan:
TidakPernah (intensitas sikap yang diamati tidak muncul)
Jarang (intensitasnyasikap yang diamatisebagiankecilmuncul)
Sering (intensitasnyasikap yang diamatisebagianbesarmuncul)
Tes tertulis Soal : 1.
Kunci soal :
a.
Prosedur Penilaian: tugas tersruktur
b.
Instrumen Penilaian
1)
Jelaskan bagaimana bunyi hukum kekekalan energi!
Jawaban : “setiap reaksi memiliki ∆H yang tetap dan tidak bergantung pada jalan reaksi atau
jumlah tahap reaksi”
2)
Diketahui persamaan termokimia sebagai berikut :
C
4H
9OH
(l)+ 6 O
2(g)→ 4 CO
2 (g)+ 5 H
2O
(g)∆H = -2456 kJ
(C
2H
5)
2O
(l)+ 6 O
2 (g)→ 4 CO
2(g)+ 5 H
2O
(g)∆H = -2510 kJ
Hitunglah perubahan entalpi untuk reaksi (C
2H
5)
2O
(l)→ C
4H
9OH
(l)!
Jawaban :
(C
2H
5)
2O
(l)+ 6 O
2 (g)→ 4 CO
2(g)+ 5 H
2O
(g)∆H = -2510 kJ
4 CO
2 (g)+ 5 H
2O
(g)→ C
4H
9OH
(l)+ 6 O
2∆H = +2456 kJ
(C
2H
5)
2O
(l)→ C
4H
9OH
(l)∆H = - 54 kJ
3)
Diketahui: ∆H
0f H
2O
(l)= -285,5 kJ mol
-1∆H
0f CO
2(g)
= -393,5 kJ mol
-1∆H
0f C
3
H
8(g)= -103 kJ mol
-1Tentukan :
a.
∆H
0cC
3H
8b.
Kalor yang dilepas jika 10 gram C
3H
8dibakar sempurna
Jawaban :
a.
C
3H
8(g)+ 5O
2(g)→ 3CO
2(g)+ 4H
2O
(l)∆H = ∑∆Hf hasil reaksi - ∑∆Hf pereaksi
∆H = [(3 x -393,5)+(4 x -285,5)] – [1x -103]
b.
Mol C
3H
8= massa/ Mr
= 10/ 44 = 0,23 mol
Karena 1 mol melepaskan kalor sebesar – 2219 kJ mol
-1, jadi untuk 0,23 mol dibebaskan energi
sebesar = 0,23 x -2219
= -510,37 kJ
4)
Diketahui ∆H
0f C
4
H
10= - 126,5 kJ/mol, ∆H
0f CO
2= -393,5 kJ/mol ∆H
0f H
2O = -285,6 kJ /mol
tentukan perubahan entalpi pada pembakaran 11,6 gram C
4H
10Jawaban:
C
4H
10(g)+ 13/2 O
2(g)→ 4CO
2(g)+ 5H
2O
(g)Mol C
4H
10= 11,6 gram/ 58 = 0,2 mol
∆H = ∑∆Hf hasil reaksi - ∑∆Hf pereaksi
= [(4 x -393,5) + (5x -285,6)] – [(1x-126,5) + (13/2 x 0)]
= [-1574 + (-1428)] – [-126,5] = -3002 + 126,5 = -2875,5 kJ/mol
Karena 1 mol melepaskan kalor sebesar -2875,5 kJ mol
-1, jadi untuk 0,2
Dibebaskan energi sebesar = 0,2 x -2875,5 = -575,1 kJ/0,2 mol
5)
Diketahui energi ikatan rata – rata, H-H = 436 kJ mol
-1, Br-Br = 192 kJ mol
-1, dan H-Br =
366 kJ mol
-1. Hitunglah ∆H
0f HBr?(skor 20)
Jawaban :
H
2(g)+ Br
2(g)→ 2HBr
(g)∆H = ∑ Energi ikatan pereaksi - ∑ Energi ikatn hasil reaksi
= [(1 x H-H)+(1x Br-Br)] – [2 H-Br]
= [436 + 192] – [2 x 366] = -104 kJ mol
-16)
Jika diketahui energi ikatan rata-rata :
C = C = 607 kJ mol
-1C – H = 413 kJ mol
-1Br – Br = 193 kJ mol
-1C – C = 346 kJ mol
-1C – Br = 276 kJ mol
-1Hitung perubahan entalpi pada reaksi:
C
2H
4(g)+ Br
2(g)→ CH
2Br-CH
2Br
Jawaban :
∆H = ∑ Energi ikatan pereaksi - ∑ Energi ikatn hasil reaksi
∆H = [(4 x C-H) + (1 x C-C)+(1xBr-Br)] – [(4 x C-H)+(2C-Br)+(1 x C-C)]
= 193 – (2 x 276) = -359 kJ mol
-13. Pedoman Penilaian