LAPORAN PRAKTIKUM KIMIA DASAR II
TERMOKIMIA
Dosen Pengampu : Dr. Kartimi, M.Pd
Oleh :
Nama : SITI AZIZAH
Nim : 1413162042
Kelas : Biologi A
Kelompok : 6
Asisten Praktikum : Diana Yulianti,
Rina Rahmawati
LABORATORIUM BIOLOGI
JURUSAN BIOLOGI FAKULTAS TARBIYAH
INSTITUT AGAMA ISLAM NEGERI (IAIN)
SYEKH NURJATI CIREBON
Termokimia
A. Tujuan
1. Menentukan tetapan calorimeter (harga air calorimeter) 2. Menentukan kalor reaksi berbagai reaksi kimia
B. Dasar Teori
Setiap zat mengandung energi. Entalpi adalah energi yang terkandung di dalam zat.Perubahan seluruh energy zat di dalam reaksi disebut dengan perubahan entalpi reaksi.Panas reaksi adalah energi yang dilepaskan atau diserap bila jumlah mol masing –masing zat sama dengan koefisien reaksinya. Panas pembentukan adalah energy yang dilepaskan atau diserap pada pembentukan 1mol zat dari unsur – unsurnya.
Reaksi eksoterm, yaitu reaksi yang melepaskan kalor, reaksi yang memindahkan kalor ke lingkungan. Reaksi eksoterm merupakan reaksi yang memancarkan (melepaskan) kalor saat reaktan berubah menjadi produk. Reaktan memiliki tingkat energi yang lebih tinggi dibandingkan produk, sehingga energi dibebaskan pada perubahan reaktan menjadi produk. Sebaliknya, pada reaksi endoterm terjadi hal yang berlawanan. Reaksi endoterm, yaitu reaksi yang menyerap (membutuhkan) kalor, reaksi yang memindahkan kalor dari lingkungan ke sistem.Pada reaksi endoterm, terjadi penyerapan kalor pada perubahan dari reaktan menjadi produk.
(Anonim,2012.http://purnamadina.blogspot.com/2012/10/laporan-praktikum-kimia.html)
(ammonia, untuk organisme perairan, urea, untuk organisme darat) atau konsumsi oksigen. Lavosier (1780) mengatakan bahwa produksi panas dapat diperkirakan dari konsumsi oksigen dengan menggunakan regresi acak. Hal itu membenarkan teori energi dinamik. Pengeluaran panas oleh makhluk hidup juga dapat dihitung oleh perhitungan kalorimetri langsung (direct calorymetry), dimana makhluk hidup ditempatkan didalam kalorimeter untuk dilakukan pengukuran.
Jika benda atau system diisolasi dari alam, maka temperatur harus tetap konstan. Jika energi masuk atau keluar, temperatur akan berubah. Energi akan berpindah dari satu tempat ke tempat lainnya yang disebut dengan panas dan kalorimetri mengukur perubahan suhu tersebut, bersamaan dengan kapasitas panasnya, untuk menghitung perpindahan panas. Sebagai contoh, jika energi dari reaksi kimia eksotermal diserap air, perubahan suhu dalam air akan mengukur jumlah panas yang ditambahkan. Kalorimeter digunakan untuk menghitung energi dari makanan dengan membakar makanan dalam atmosfer dan mengukur jumlah energi yang meningkat dalam suhu kalorimeter.
Bahan yang masuk kedalam kalorimetri digambarkan sebagai volume air, sumber panas yang dicirikan sebagai massa air dan wadah atau kalorimeter dengan massanya dan panas spesifik. Keseimbangan panas diasumsikan setelah percobaan perubahan suhu digunakan untuk menghitung energi tercapai.
Kelorimeter adalah suatu sistem terisolasi (tidak ada pertukaran materi maupun energi dengan lingkungan diluar kalorimeter). Dengan demikian, semua kalor yang dibebaskan oleh reaksi yang terjadi didalam kalorimeter tidak ada yang terbuang keluar kalorimeter. Dengan mengukur kenaikan suhu di dalam kelorimeter, kita dapat menentukan jumlah kalor yang diserap oleh air serta perangkat kalorimeter berdasarkan rumus :
dengan, q = jumlah kalor
Tetapan kalorimeter adalah banyak kalor yang diperlukan untuk menaikkan suhu kalorimeter beserta isinya 10. Kalor netralisasi adalah
kalor yang dihasilkan atau diperlukan untuk membentuk 1 mol H2O dari reaksi antara asam dan basa. Kalor netralisasi termasuk reaksi eksoterm karena pada reaksi ini terjadi kenaikan suhu. Kalor reaksi (entalpi reaksi; panas reaksi) adalah kalor yang diserap atau yang dibebaskan suatu reaksi kimia pada tekanan tetap: ∆H. Kalor reaksi atau entalpi reaksi merupakan perbedaan antara “entalpi hasil reaksi” dan “entalpi reaksi”. ∆H = HHasil reaksi - Hpereaksi
(Anonim, 2010. http://kamuskimia.net84.net/cari3.php?kunci=71)
C. Alat dan Bahan 1. Alat
a. Kalorimeter
1. Penentuan Tetapan Kalorimeter
a. 25 mL air dimasukkan ke dalam calorimeter dengan pipet tetes atau gelas ukur, suhunya dicatat selama 3 menit sampai konstan (t1).
b. 25 mL air dimasukkan dalam gelas kimia lalu dipanaskan sampai suhunya lebih tinggi diatas suhu kamar (±500C), dicatat suhunya
(t2).
c. Air yang panas dimasukkan ke dalam calorimeter yang telah berisi air dingin lalu dikocok sambil suhu campuran diukur setiap 30 detik.
d. Dibuat grafik dengan mengalurkan harga suhu (sumbu Y) dan waktu (sumbu X).
e. Dilakukan interpolasi grafik sampai pada waktu 0 detik. Pada waktu mendekati 0 detik menunjukkan suhu campuran (t3)
f. Tetapan calorimeter dihitung. 2. Penentuan kalor reaksi Zn-CuSO4
a. 25 mL CuSO4 0,25 M dimasukkan ke dalam calorimeter, suhunya
dicatat (t4).
b. Serbuk Zn ditimbang menggunakan neraca digital sebanyak 0,75 gram dengan ketelitian decimal.
c. Serbuk Zn dimasukkan ke dalam calorimeter yang berisi larutan CuSO4. Dikocok dan dicatat suhu campuran reaksi (t5) setiap 30
detik sampai suhu konstan.
d. Dibuat grafik seperti percobaan 1 dan ditentukan suhu campuran reaksi (t5) yaitu waktu mendekati 0 detik.
e. Kalor reaksi yang terukur dihitung. 3. Penentuan kalor netralisasi HCl-NaOH
a. 25 mL HCl 0,5 M dimasukkan ke dalam gelas kimia dan 25 mL NaOH 1 M dimasukkan ke dalam gelas kimia yg lain.
b. Kedua gelas kimia tersebut disimpan didalam bak berisi air selama ±5 menit, kemudian suhu salah satu pereaksi diukur (t6), dengan
cara dua gelas kimia direndam, diharapkan suhu kedua pereaksi itu sama.
c. Kedua larutan tersebut dicampurkan ke dalam calorimeter, kemudian dikocok.
e. Kalor netralisasi yang terukur dihitung.
E. Hasil Pengamatan
1. Penentuan Tetapan Kalorimeter Tabel
Sampel Volume (mL) Temperatur Pada 30 detik
= 1. 25. 4,18 (32-30) = 25. 4,18 (2)
= 2090C
*q2 = m C t
= ρ . m. C. (t3-t2)
= 1. 25. 4,18 (32-50) = 25. 4,18 (-18) = -18810C
*q3= q2-q1
= -1881 – 209 = -20900C
*k= qt33 = −209032 = -65,31 J
2. Penentuan kalor reaksi Zn-CuSO4
Tabel
Sampel Volume (mL) Temperatur Pada 30 detik
ke-1 2 3 4 5
CuSO4 25 mL 310 310 310 310 310
Zn - - -
-Campuran - 320 320 320 320 320
F.
1 2 3 4 5
Tabel
Sampel Volume (mL) Temperatur pada 30 detik
= 56. 3,89 (1) = 217,89 J *q8 = k t
= k . (t7-t6)
*q9= q7+q8
= 217,84 + 195,93 = 413,77 J/mol
* Hr= 0,10q9 = 413,770,10 = 4137,7 J/mol
G. Pembahasan
Berdasarkan praktikum kali ini tentang “termokimia”, seperti yang telah dijelaskan dalam teori bahwa Termokimia merupakan bagian dari ilmu kimia yang mempelajari tentang perubahan kalor. Dengan menggunakan alat-alat dan bahan-bahan yaitu Gelas ukur, Gelas kimia, Pipet tetes, Termometer, Stopwatch, Neraca digital, Larutan HCl, Larutan CuSO4, Aquades, Larutan NaOH, Larutan Zn. Percobaan dilakukan 3 kali
yaitu Penentuan Tetapan Kalorimeter, Penentuan kalor reaksi Zn-CuSO4,
Penentuan kalor netralisasi HCl-NaOH.
Percobaan pertama dilakukan dengan mencampurkan air dengan suhu yang berbeda. Suhu rendah dan suhu tinggi pada calorimeter. Pada percobaan ini yang diamati adalah suhu campuran dari dua suhu air yang berbeda. Air dingin memiliki suhu 300C sedangkan air yang mendidih
memiliki suhu 500C. Jika dilihat dari hasil pengamatan, maka suhu
campuran air setelah dicampurkan dengan cara dikocok dalam kalorimeter yang terlihat adalah 320C. Pengukuran suhu dilakukan dari mulai 30 detik
pertama hingga 30 detik ke 5. Pada 30 detik ke 5, nilai suhu konstan tetap sebesar 320C. Dari hasil percobaan ini dapat diketahui bahwa tidak terlihat
adanya penurunan suhu. Hal ini tidak sesuai dengan teori dalam termodinamika dikenal dengan sebutan reaksi eksoterm yakni perpindahan kalor dari sistem ke lingkungan sehingga suhu lingkungan menjadi lebih panas. Hal ini terjadi karena factor human eror, salah satunya adalah masih terdapatnya udara dalam calorimeter yang menyebabkan suhu tidak dapat turun lagi. Kemudian factor kesalahan dalam melihat nilai suhu pada
thermometer. (Anonim, 2012.
http://ndah-smile.blogspot.com/2012/03/laporan-praktikum-kimia-dasar-2.html) Percobaan kedua yaitu penentuan kalor reaksi Zn-CuSO4.
serbuk Zn. Suhu awal CuSO4 bernilai 310C. Jika dilihat dari hasil
pengamatan, maka suhu campuran larutan CuSO4, setelah dicampurkan
dengan serbuk Zn dengan cara dikocok dalam calorimeter, suhu campuran pada 30 detik pertama adalah 320C. Pada 30 detik ke lima suhu tetap
sebesar 320C. Dari hasil percobaan ini dapat diketahui bahwa hal tersebut
tidak sesuai dengan teori yang menyatakan terjadinya reaksi endoterm pada percobaan ini yakni terjadi perpindahan kalor dari lingkungan ke sistem sehingga suhu lingkungan turun dan menjadi lebih dingin. Meskipun tidak sesuai dengan teori, tetapi pada penghitungan hasilnya adalah positif yang menandakan bahwa perubahan entalpi pada sistem bertambah yakni sebesar 964,2 J/mol.
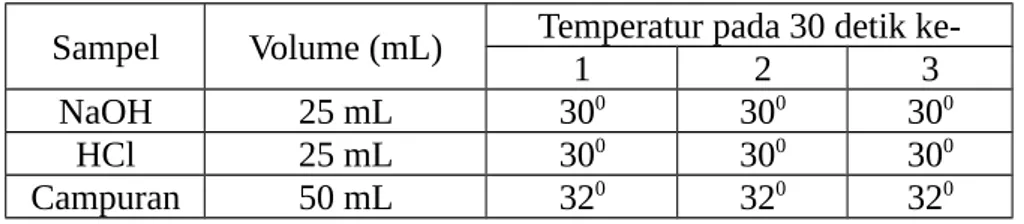
Percobaan ketiga yaitu penentuan kalor netralisasi HCl-NaOH. Dilakukan dengan cara mencampurkan larutan HCl dan larutan NaOH. Namun, sebelum dicampurkan, kedua larutan ini direndam dalam air biasa. Hal ini dimaksudkan agar suhu kedua larutan menjadi sama. Setelah direndam, suhu awal kedua larutan itu bernilai 300C. Jika dilihat dari hasil
pengamatan, maka suhu campuran larutan, setelah dicampurkan dengan
cara dikocok dalam calorimeter, suhu campuran pada 30 detik pertama adalah 320C. Pada 30 detik ke tiga suhu tetap sebesar 320C. Dari hasil
percobaan ini dapat diketahui bahwa hal tersebut tidak sesuai dengan teori yang menyatakan terjadinya reaksi endoterm pada percobaan ini yakni terjadi perpindahan kalor dari lingkungan ke sistem sehingga suhu lingkungan turun dan menjadi lebih dingin. Meskipun tidak sesuai dengan teori, tetapi pada penghitungan hasilnya adalah positif yang menandakan bahwa perubahan entalpi pada sistem bertambah yakni sebesar 4137,7 J/mol.
H. Kesimpulan
Setelah melakukan percobaan, dapat disimpulkan :
1. Termokimia merupakan bagian dari ilmu kimia yang mempelajari tentang perubahan kalor. Tetapan kalorimeter adalah banyak kalor yang diperlukan untuk menaikkan suhu kalorimeter beserta isinya 10C.
membentuk 1 mol H2O dari reaksi antara asam dan basa. Kalor reaksi (entalpi reaksi; panas reaksi) adalah kalor yang diserap atau yang dibebaskan suatu reaksi kimia pada tekanan tetap: ∆H.
2. Reaksi eksoterm yakni perpindahan kalor dari sistem ke lingkungan sehingga suhu lingkungan menjadi lebih panas. Reaksi eksoterm seharusnya dibuktikan pada percobaan pertama yaitu pencampuran air dengan suhu berbeda.
3. Reaksi endoterm pada percobaan ini yakni terjadi perpindahan kalor dari lingkungan ke sistem sehingga suhu lingkungan turun dan menjadi lebih dingin. Reaksi ini seharusnya dibuktikan pada percobaan 2 dan 3 yaitu kalor reaksi larutan CuSO4 & serbuk Zn dan kalor penetralan
larutan HCl &NaOH.
DAFTAR PUSTAKA
http://25.media.tumblr.com/tumblr_m9390e8doh1rcuee4o1_400.gif, diakses pada 21 Maret 2014 pukul 12.43 WIB
Anonim, 2010. Kalor reaksi - M Rifky Saiful Huda. http://kamuskimia.net84.net/cari3.php?kunci=71, diakses pada 22 Maret 2014 pukul 8.33 WIB
Anonim,2012.http://purnamadina.blogspot.com/2012/10/laporan-praktikum-kimia.html, diakses pada 22 Maret 2014 pukul 8.45 WIB
Indah, 2012. http://ndah-smile.blogspot.com/2012/03/laporan-praktikum-kimia-dasar-2.html, diakses pada 23 Maret 2014 pukul 14.12 WIB
PEER ASSESSMENT JUDUL PRAKTIKUM
No. Aspek Penilaian Fajrian Meitha Iana Milatul Maeni 1. Kerjasama
2. Disiplin 3. Keterampilan
4 Keaktivan Jumlah Nilai
Ttd. (Nama Lengkap)
LAMPIRAN
Alat dan bahan yang digunakan diantaranya air, gelas kimia, gelas ukur, CuSO4 dan Zn