LAPORAN PRAKTIKUM KIMIA DASAR II TERMOKIMIA
Dosen Pengampu: Dr.Kartimi, M.Pd.
Oleh:
Nama : Olis Dede Hayati NIM : 1413162038 Kelas : BIOLOGI C Kelompok : 4
Semester : II
Asisten Praktikum: Diana Yulianti Rina Rahmawati
LABOLATORIUM BIOLOGI
JURUSAN BIOLOGI FAKULTAS TARBIYAH INSTITUT AGAMA ISLAM NEGERI (IAIN)
TERMOKIMIA A. TUJUAN MATERI
1. Menentukan tetapan kalorimeter (harga air kalorimeter). 2. Menentukan kalor reaksi kimia.
B. DASAR TEORI
Kimia ilmu tentang materi (zat) yang meliputi struktur, susunan, sifat dan perubahan materi serta energi yang menyertainya. Energi merupakan kemampuan untuk melakukan usaha.(Chang,2004:4)
Energi dibutuhkan untuk memutuskan ikatan-ikatan dan energi pada ikatan-ikatan yang terbentuk, sehingga hampir semua reaksi kimia melibatkan perubahan energi. Perubahan energi yang terjadi dapat berupa kalor pembentukan, kalor pembakaran, kalor pelarutan, dan kalor netralisasi. Energi bisa dilepaskan (eksoterm) atau bisa juga ditangkap (endoterm). Reaksi Eksoterm adalah reaksi kimia dengan sistem melepaskan kalor. Pada reaksi ini suhu campuran reaksi akan naik dan energi potensial dari zat-zat kimia yang terikat akan turun sehingga sistem melepaskan kalor kelingkungan. Sedangkan Reaksi Endoterm adalah reaksi kimia dengan sistem menyerap kalor dari lingkungan. Pada reaksi ini terjadi kenaikan energi potensial zat-zat yang bereaksi atau terjadi penurunan energi kinetik sehingga suhu sistem turun. (Justiana Muchtardi,Sandri.2009:41)
eksperimental untuk menyusun suatu tabel harga-harga dari mana dapat dihitung kalor tiap reaksi kimia yang mungkin. (Keenan,dkk.1998:473-478)
Termokimia meliputi hukum kekekalan energi, hukum kekekalan energi menyatakan bahwa energi tidak dapat dimusnahkan ataupun diciptakan akan tetapi hanya dapat diubah dari bentuk energi yang satu menjadi bentuk energi yang lain. Nilai energi suatu materi yang hanya dapat diukur hanyalah perubahan energi, demikian juga dengan entalpi yang hanya dapat diukur hanyalah perubahan entalnpinya saja.(Utami Budi.2009:39)
Entalpi (H) adalah jumlah energi yang dimiliki sistem pada tekanan tetap. Perubahan entalpi (ΔH) pada reaksi endoterm merupakan selisih anatara entalpi produk dengan entalpi pereaksi (Hp - Hr) sehinggga ΔH bernilai positif. Sebaliknya, pada reaksi eksoterm entalpi produk lebih kecil dari pada entalpi pereaksi, oleh karena itu perubahan entalpi (ΔH) merupakan selisih antara entalpi pereaksi dengan entalpi produk (Hr – Hp) sehingga ΔH bernilai negatif. (Justiana Muchtardi,Sandri.2009:44)
Hukum Hess menyatakan bahwa untuk suatu keseluruhan tertentu, perubahan entalpi selalu sama, tak peduli apakah reaksi itu dilaksanakan secara langsung ataukah secara tak langsung dan lewat tahap-tahap yang berlainan. (Keenan,dkk.1998:479)
C. ALAT DAN BAHAN 1. Alat :
a. Kalorimeter. b. Gelas Kimia.
c. Thermometer. d. Pipet Tetes.
e. Gelas Ukur.
f. Batang Pengaduk.
g. Botol Semprot. h. Hot Plate.
2. Bahan a. Air.
b. Serbuk Zn 170 Gr. c. CuSO4 25 mL.
d. HCl 25 mL. e. NaOH 25 mL.
D. LANGKAH KERJA
1. Penentuan Tetapan Kalorimeter
a. Disiapkan alat dan bahan yang akan digunakan. b. Dimasukkan 25 ml air kedalam kalorimeter
c. Dipanaskan 25 ml air dalam gelas kimia sampai suhunnya mencapai 600 c, kemudian dicatat
suhunya (t2).
d. Air panas dimasukkan ke dalam kalorimeter yang telah berisi air dingin, kemudian kocok sambil suhu campuran diukur setiap 30 detik. Dilakukan sampai suhu air konstan.
e. Dibuat grafik, dengan mengalurkan harga suhu sebagai sumbu Y dan waktu pada sumbu X.
f. Dilakukan interpolasi grafik sampai pada waktu 0 detik. Pada waktu mendekati 0 detik menunjukan suhu campuran (t3).
g. Dihitung tetapan kalorimeter. 2. Penentuan Kalor Reaksi Zn-CuSO4
a. Dimasukkan 25 ml CuSO4 0.25 M ke dalam
kalorimeter, kemudian dicatat suhunya (t4).
b. Ditimbang serbuk Zn sebanyak 0.75 gr dengan ketelitian 3 desimal.
c. Dimasukkan serbuk Zn tersebut ke dalam kalorimeter yang berisi larutan CuSO4 . Dikocok
dan dicatat suhu campuran reaksi (t5) setiap 30
detik sampai dengan campuran konstan.
d. Dibuat grafik dengan mengalurkan harga suhu sebagai sumbu Y dan waktu pada sumbu X.
e. Ditentukan suhu campuran reaksi (t5) yaitu pada
waktu mendekati 0 detik.
3. Penentuan Kalor Netralisasi HCl-NaOH
a. Dimasukkan 25 ml HCl 0.5 M ke dalam gelas kimia dan 25 ml NaOH 1 M ke dalam gelas kimia lain.
b. Disimpan kedua gelas kimia tersebut ke dalam bak yang berisi air selama kurang lebih 5 menit.
c. Diukur suhu kedua larutan tersebut sampai sama dan dicatat hasil pengukurannya.
d. Diukur suhu salah satu pereaksi (t6).
e. Dicampurkan kedua larutan tersebut ke dalam kalorimeter,, kemudian diocok.
g. Dibuat grafik dengan mengalurkan harga suhu sebagai sumbu Y dan waktu pada sumbu X.
h. Ditentukan suhu campuran reaksi maksimum (t7)
yaitu pada waktu mendekati 0 detik.
E.HASIL PENGAMATAN
1. Penentuan Tetapan Kalorimeter Diketahui : t1 = 25 ml => 310 C
t2 = 25 ml => 600 C
t3 = 25 ml => 440 C
Ditanyakan : m = ρ . v ?
= 25 . 4.18 (440 - 310)
= 25 . 4.18 (13)
= 104.5 (13) = 1358.5 J
q2 = m . c . Δt
= m . c . (t2 – t)
= 25 . 4.18 (600 - 440)
= 25 . 4.18 (24) = 104.5 (24)
= 2508 q2 = q1 – q2
= 2508 J – 1358.5 J = 1149.5
K = qt31 = 1149.544
[image:7.595.131.509.51.747.2]= 26.125 kj
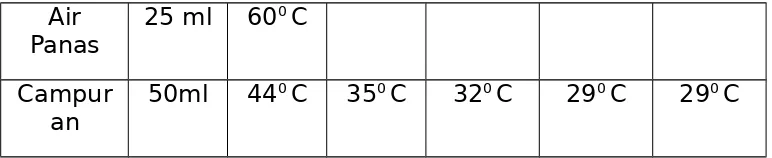
Tabel Pengamatan
Sampel Berat Temperature pada setiap 30 detik
1 2 3 4 5
Air
Dingin 25 ml 31
Air
Panas 25 ml 60
0 C
Campur
an 50ml 44
0 C 350 C 320 C 290 C 290 C
1 2 3 4 5
[image:8.595.120.506.84.163.2] [image:8.595.117.504.101.489.2]0 10 20 30 40 50
Grafik Percobaan
Grafik Percobaan
2.Penentuan Kalor Reaksi Zn-CuSO4 Diketahui : t4 = 25 => 330 C
t5 = 340
K = 26.125 J
Ditanyakan : q4, q5, q6 dan ΔHr?
Jawab : q4 = K (t5 - t4)
= 26.125 (34 - 33)
= 26.125 J
q5 = massa jenis larutan x kalor jenis larutan x perubahan suhu
= 4.54 J q6 = q4 – q5
= 26.125 – 4.54
= 30.66 J
[image:9.595.120.506.53.778.2]ΔHr = 0.05q6 = 30.660.05 = 613.2 J
Tabel Pengamatan
Sampel Berat Temperature pada setiap 30 detik
1 2 3 4 5
Larutan CuSO4
25 ml 330 C
Serbuk
Zn 0.75gr Campur
an 29
0 C 330 C 340 C 350 C 350 C
1 2 3 4 5
0 5 10 15 20 25 30 35 40
Grafik percobaan
Grafik percobaan
Diketahui : t6 = 25 ml => 330 C
t7 = 25 ml => 320 C
Massa jenis larutan = 1.12 g/ml Kalor jenis larutan = 3.89 J g-1 K-1
Ditanyakan : q7, q8, q9, dan ΔHn ?
Jawab : q7 = Massa jenis kalor x kalor jenis larutan (t7 - t6)
= 1.12 . 3.89 .(35 - 33) = 4.357 (2)
= 8.714 J
q8 = K (t7 - t6)
= 26.125 (35 - 33)
= 26.125 (2) = 52.25 J
q9 = q7 – q8
= 8.714 – 52.25
= 60.964 J
ΔHn = q9
0.10 =
60.964
0.10 = 609.64 J
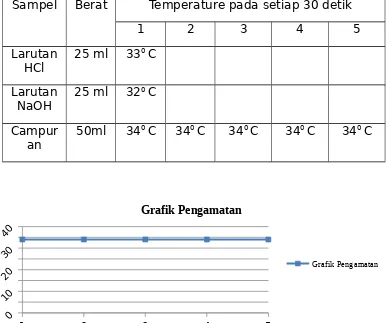
Sampel Berat Temperature pada setiap 30 detik
1 2 3 4 5
Larutan
HCl 25 ml 33
0 C
Larutan
NaOH 25 ml 32
0 C
Campur
an 50ml 34
0 C 340 C 340 C 340 C 340 C
1 2 3 4 5
[image:11.595.118.504.88.411.2]0 10 20 30 40
Grafik Pengamatan
Grafik Pengamatan
F. PEMBAHASAN
Pada praktikum pertama ini adalah melakukan percobaan mengenai penentuan tetapan kalorimetri dengan menggunakan kalorimeter. Penentuan yang ditentukan ini mengenai kalor tetapan kalorimeter, penentuan kalor reaksi Zn-CuSO4, dan
penentuan tetapan kalor netralisasi HCl-NaOH, dengan bahan yang digunakan adalah air, Serbuk Zn 170 Gr, CuSO4 25 Ml, HCl 25 Ml, dan NaOH 25 Ml.
semprot lalu dicatat suhunya (untuk mengetahui t1). Kedua
diambil kembali air sebanyak 25 mL dan dimasukkan kedalam gelas kimia lalu dipanaskan diatas hot plate hingga suhunya mencapai 600 C dan dicatat suhunya (untuk menegtahui t
2).
Setelah air yang dipanaskan suhunya telah mencapai 600 C
dimasukkanlah air tersebut kedalam kalorimetri tadi yang berisi air biasa sebanyak 25 mL lalu dikocok dan dihitung suhunya setiap 30 detik. Pengamatan suhu dilakukan sampai larutan tersebut konstan kurang lebih sampai pada 30 detik ke 5, setelah didapatkan suhu yang konstan maka itulah t3. Dari hasil yang
diperoleh terlihat bahwa terjadi penurunan pada reaksi yang berlangsung yakni dari 440 C sampai dengan akhir (konstan) 290
C. Hali ini menunjukan bahwa pencampuran air panas dengan air dingin termasuk kedalam reaksi endoterm dan eksoterm karena adanya penyerapan kalor oleh air dingin didalam kalorimeter terhadap air panas, dan ada pula kalor yang dilepas oleh air panas di dalam kalorimeter.
Peristiwa diatas sesuai dengan pengertian reaksi endoterm dan reaksi eksoterm yang menyatakan bahwa yang dimaksud dengan reaksi endoterm ialah reaksi kimia dengan sistem menyerap kalor dsan reaksi eksoterm ialah reaksi kimia dengan sistem melepas kalor.( Justiana Muchtardi,Sandri.2009:41)
Percobaan kedua adalah penentuan kalor reaksi Zn-CuSO4.
Pada percobaan ini langkah yang digunnakan pada dasarnya adalah sama dengan percobaan 1. Pertama yakni memasukkna larutan CuSO4 0.2 M sebanyak 25 mL kedalam kalorimeter lalu
dicatat suhuya (untuk menegtahui t4). Kemudian ditimbang
serbuk Zn ± 0.75 gr dengan ketelitian 3 desimal, lalu serbuk Zn tersebut dimasukkan kedalam kalorimeter yang berisi larutan CuSO4 tadi di awal, dikocok dan kemudian dicatat suhu campuran
terjadinya kenaikan pada reaksi tersebut, yakni dari suhu 290 C
-350 C. Peristiwa ini dikatagorikan ke dalam reaksi eksoterm. Dan
hal ini pun sama dengan teori pada percobaan pertama yang menyatakn bahwa reaksi eksoterm adalah reaksi kimia dengan sistem melepas kalor dalam arti keluar. (Justiana Muchtardi,Sandri.2009:41)
Selanjutnya adalah percobaan terakhir yakni penentuan kalor netralisasi HCl-NaOH. Dengan mengawali memasukkan larutan HCl 0.5 M sebanyak 25 ml kedalam gelas kimia I dan 25 ml larutan NaOH 1 M kedalam gelas kimia II, kemudian ke 2 gelas kimia tersebut direndam di dalam bak yang berisi air selama ± 5 menit dengan catatan bagian yang direndam hanya sampai pada tingginya larutan tersebut. Perendaman tersebut dilakukan untuk menyamakan suhu dari keduanya (konstan). Setelah ± 5 menit dan suhunya sudah konstan dimasukkan ke 2 larutan tersebut secara bersamaan ke dalam kalorimeter lalu dikocok dan dicatat suhu campuran setiap 30 detik sampai dengan suhu tersebut konstan.
Hasil yang terlihat dari percobaan di atas adalah tidak ada perubahan suhu yang terjadi dengan kata lain suhunya tetap sama yakni 340 C. Dari hasil ini maka dapat disimpulkan bahwa
G.KESIMPULAN
Berdasarkan percobaan mengenai termokimia dalam menentukan tetapan kalor reaksi Zn-CuSO4, HCl-NaOH, dan tetapan kalorimeter serta dengan menggunakan bahan air, Serbuk Zn 170 Gr, CuSO4 25 Ml, HCl 25 Ml, dan NaOH 25 Ml, maka dapat disimpulkan bahwa:
1) Termokimia adalah Ilmu kimia yang mempelajari pengukuran dan penafsiran perubahan kalor yang menyertai reaksi kimia, perubahann keadaan dan pembentukan larutan.
2) Perubahan yang terjadi pada tetapan kalorimeter adalah terjadinya reaksi endoterm dan eksoterm karena adanya penyerapan kalor oleh air dingin didalam kalorimeter terhadap air panas, dan ada pula kalor yang dilepas oleh air panas di dalam kalorimeter.
3) Pada penentuan kalor reaksi Zn-CuSO4 terjadi
kenaikan pada reaksi tersebut, yakni dari suhu 290
C - 350 C, dan termasuk kedalam reaksi eksoterm.
DAFTAR PUSTAKA
Keenan,dkk.1998.Kimia Untuk Universitas.Jakarta:Erlangga.
Chang,Raymond.2004.Kimia Dasar.Jakarta:Erlangga. Utami,Budi.2009.Kimia.Jakarta:Pusat Perbukuan DPN.