Laporan Praktikum Kimia Dasar ReaksiReaksi Kimia
PENDAHULUAN
Reaksi kimia (chemical reaction) yaitu suatu proses dimana zat atau senyawa diubah menjadi satu atau lebih senyawa baru. Untuk berkomunikasi satu sama lain tentang reaksi kimia, para kimiawan menggunakan cara standar untuk menggambarkan reaksi tersebut melalui persamaan kimia. Persamaan kimia (chemical equation) menggunakan lambang kimia untuk
menunjukan apa yang terjadi saat reaksi kimia berlangsung.
Tujuan percobaan Reaksi-Reaksi Kimia untuk mengetahui dan mempelajari jenis dan sifat (sifat kimia dan fisika) darizat yang direaksikan, serta untuk mencari rumus senyawa dan koefisien reaksi dari senyawa dengan cara mereaksikan dua buah zat atau lebih yang dibuktikan adanya perubahan warna, bau, suhu, timbulnya gas dan endapan. Perinsip percobaan adalah berdasarkan penggabungan molekul terbagi menjadi dua bagian atau lebih.
Perinsip percobaan adalah berdasarkan penggabungan molekul terbagi menjadi dua bagian atau lebih. Molekul yang kecil atau atom-atom dalam molekul. Reaksi kimia selalu melibatkan terbentuk dan terputusnya ikatan kimia. Berdasarkan Hukum Kekekalan Massa yang di temukan oleh Lavoisier: “Massa zat sebelum dan sesudah reaksi adalah sama” dan berdasarkan Hukum Perbandungan Tetap (Hukum Proust) : “Dalam setiap persenyawaan perbandingan massa unsur-unsur selalu tetap”. Berdasarkan bronsted Lowry : “Asam sebagai setiap zat sembarang yang menyumbang proton dan basa sebagai setiap zat sembarang yang menerima proton”.
1 Nama : Vika Wahyu D.
▸ Baca selengkapnya: laporan praktikum laju reaksi menggunakan cangkang telur dan balon
(2)METODOLOGI
Alat Yang Digunakan
Alat yang digunakan dalam percobaan ini adalah tabung reaksi, rak tabung, pipet tetes, penjepit tabung, pipa U, bunsen, kertas lakmus, botol semprot, neraca digital, tisyu,korek api.
Bahan Yang Digunakan
Bahan – bahan yang digunakan dalam percobaan ini adalah NaOH , HCl, CH3COOH, K2CrO4 ,K2CrO7, Al2(SO4)3, NH4OH, ZnSO4, (NH4)2SO4, Pb(NO3)2, NaCl, AgNO3, BaCl2, CaCO3, Ba(OH)2, H2C2O4, H2SO4, KMnO4, Besi (II) / Fe2+, CuSO4, Besi (III) / Fe3+,,KSCN, Na3PO4, phenolphthalein (PP), metil merah (MM).
Metode Percobaan
Tabel 1. Metode Percobaan Reaksi Reaksi Kimia
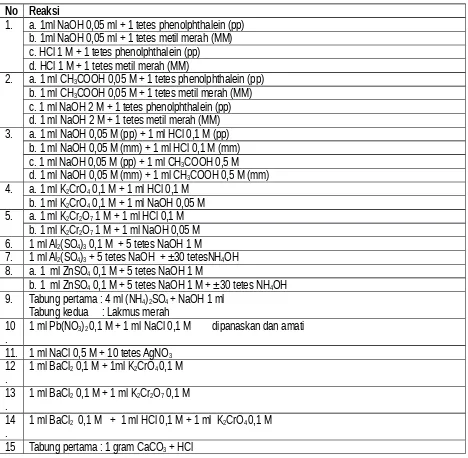
No Reaksi
1. a. 1ml NaOH 0,05 ml + 1 tetes phenolphthalein (pp) b. 1ml NaOH 0,05 ml + 1 tetes metil merah (MM) c. HCl 1 M + 1 tetes phenolphthalein (pp) d. HCl 1 M + 1 tetes metil merah (MM)
2. a. 1 ml CH3COOH 0,05 M + 1 tetes phenolphthalein (pp) b. 1 ml CH3COOH 0,05 M + 1 tetes metil merah (MM) c. 1 ml NaOH 2 M + 1 tetes phenolphthalein (pp) d. 1 ml NaOH 2 M + 1 tetes metil merah (MM) 3. a. 1 ml NaOH 0,05 M (pp) + 1 ml HCl 0,1 M (pp)
b. 1 ml NaOH 0,05 M (mm) + 1 ml HCl 0,1 M (mm) c. 1 ml NaOH 0,05 M (pp) + 1 ml CH3COOH 0,5 M d. 1 ml NaOH 0,05 M (mm) + 1 ml CH3COOH 0,5 M (mm) 4. a. 1 ml K2CrO4 0,1 M + 1 ml HCl 0,1 M
b. 1 ml K2CrO4 0,1 M + 1 ml NaOH 0,05 M 5. a. 1 ml K2Cr2O7 1 M + 1 ml HCl 0,1 M
b. 1 ml K2Cr2O7 1 M + 1 ml NaOH 0,05 M 6. 1 ml Al2(SO4)3 0,1 M + 5 tetes NaOH 1 M
7. 1 ml Al2(SO4)3 + 5 tetes NaOH + ±30 tetesNH4OH 8. a. 1 ml ZnSO4 0,1 M + 5 tetes NaOH 1 M
b. 1 ml ZnSO4 0,1 M + 5 tetes NaOH 1 M + ±30 tetes NH4OH 9. Tabung pertama : 4 ml (NH4)2SO4 + NaOH 1 ml
Tabung kedua : Lakmus merah 10
. 1 ml Pb(NO3)2 0,1 M + 1 ml NaCl 0,1 M dipanaskan dan amati 11. 1 ml NaCl 0,5 M + 10 tetes AgNO3
12
. 1 ml BaCl2 0,1 M + 1ml K2CrO4 0,1 M 13
. 1 ml BaCl2 0,1 M + 1 ml K2Cr2O7 0,1 M 14
. 1 ml BaCl2 0,1 M + 1 ml HCl 0,1 M + 1 ml K2CrO4 0,1 M
15 Tabung pertama : 1 gram CaCO3 + HCl
Hasil yang didapat sering kali berbeda dari hasil reaksi yang benar. Kesalahan tersebut dipengaruhi oleh beberapa faktor diantaranya kurangnya ketelitian praktikan saat mengguakan pipet. Pipet yang telah dipakai untuk mengambil zat sebelumnya tidak dibersihkan terlebih dahulu saat akan mengambil zat yang lain, sehingga zat sebelumnya tercampur dengan zat lain dan mempengaruhi hasil akhir dari reaksi kimia tersebut. Bila terjadi perbedaan baik itu perubahan warna, endapan, dan tidak adanya endapan, hal itu bisa terjadi karena faktor lingkungan. Faktor lingkungan disekitar seperti tinggi rendahnya suhu ruangan yang mempengaruhi proses kelarutan, takaran yang tidak sesuai ataupun botol larutan yang tidak ditutup kembali itu sangat mempengaruhi reaksi kimia ini. Sehingga ketika kita akan melakukan percobaan kita harus memperhatikan sekali kebersihan dan keadaan lingkungan disekitar kita.
Reaksi kimia adalah suatu proses dimana zat atau senyawa diubah menjadi satua atau lebih senyawa baru. Untuk berkomunikasi satu sama lain tentang reaksi kimia, para ilmuwan menggunakan cara standar untuk menggambarkan reaksi tersebut melalui persamaan kimia. Persamaan kimia adalah menggunakan lambang kimia untuk menunjukkan apa yang terjadi saat reaksi kimia tersebut berlangsung. Pereaksi ( reaktan ) → Hasil reaksi ( produk )
Reaksi kimia selalu melibatkan terbentuk dan terputusnya ikatan kimia. Reaksi kimia adalah perubahan yang melibatkan perubahan sifat fisik zat dengan membentuk zat baru, biasanya melibatkan perubahan sifat fisik seperti,
perubahan suhu, perubahan warna, bau, terbentuknya endapan dan timbulnya gelembung gas. (Sutrisno, E,T. Nurminabari, I,S, 2012).
Beberapa dari percobaan reaksi kimia diatas dapat digolongkan menjadi beberapa jenis reaksi, yaitu reaksi asam basa terdapat pada nomor 1, 2, 3, 4, dan 5. Reaksi pengendapan terdapat pada nomor 6, 8, 11, 12, 13, 18 dan19. Reaksi redoks terdapat pada 9, 16 dan 17. Reaksi metatesis terdapat pada nomor 10. Reaksi penguraian terdapat pada nomor 14. Reaksi pembentukan terdapat pada nomor 15. Reaksi kompleks terdapat pada nomor 20.
Reaksi Kimia dapat dikelompokkan dalam beberapa jenis, yaitu:
1. Reaksi asam basa, secara luas merupakan reaksi antara asam dengan basa. Ia memiliki berbagai definisi tergantung pada konsep asam basa yang digunakan. Beberapa definisi yang paling umum adalah:
a.Definisi Arrhenius: asam berdisosiasi dalam air melepaskan ion H3O+; basa berdisosiasi dalam air melepaskan ion OH-.
b.Definisi Brønsted-Lowry: Asam adalah pendonor proton (H+) donors; basa adalah penerima (akseptor) proton. Melingkupi definisi Arrhenius.
c.Definisi Lewis: Asam adalah akseptor pasangan elektron; basa adalah pendonor pasangan elektron. Definisi ini melingkupi definisi Brønsted-Lowry.
2. Reaksi pengendapan adalah reaksi antara zat ion logam yang sukar larut dalam air, sehingga terbentuklah endapan. Untuk mengetahui apakah suatu reaksi terbentuk endapan atau tidak, harus diketahui kelarutan zat yang terjadi. Sebagai contoh beberapa zat yang sukar larut dalam air, yaitu I+, Mg2+, Fe2+, dan Cl-.
3. Reaksi redoks, yang mana terjadi perubahan pada bilangan oksidasi atom senyawa yang bereaksi. Reaksi ini dapat diinterpretasikan sebagai transfer elektron. Contoh reaksi redoks adalah:
2 S2O32−(aq) + I2(aq) → S4O62−(aq) + 2 I−(aq)
4. Metatesis (pemindahan tanggal) adalah suatu reaksi dimana terjadi pertukaran antara dua reaksi.
AgNo3(ag)→NaCL(a g) →AgCL(p) + NaNO3(ag)
5. Penguraian adalah suatu reaksi dimana suatu zat dipecah menjadi zat-zat yang lebih sederhana
2Ag2O(p)→4Ag(p) + O2(9)
6. Penggabungan (sintetis) suatu reaksi dimana sebuah zat yang lebih kompleks terbentuk dari dua atau lebih zat yang lebih sederhana (baik unsur maupun senyawa).
2H2 (9) + O2 (9)→ 2H2O (9)
CO (9) + 2H2 (9)→ CH3OH (9)
7. Reaksi kompleksometri adalah reaksi ion logam, yaitu kation dengan anion atau molekul netral yang terdiri dari atom pusat dan sejumlah ligan.
Pada saat reaksi kimia berlangsung, akan muncul beberapa peristiwa yang menjadi tanda-tanda bahwa suatu materi sedang mengalami perubahan kimia. Tanda-tanda terjadinya reaksi kimia pada suatu materi dapat diketahui dari beberapa hal berikut ini:
1.Terjadi pembentukan endapan. Hal ini terjadi jika zat baru yang terbentuk tidak larut / sukar larut dalam air.
2.Terjadi pembentukan gas. Hal ini terjadi jika zat baru yang dihasilkan berbentuk gas sehingga menimbulkan gelembung-gelembung gas yang seringkali memiliki bau yang khas.
3.Terjadi perubahan warna. Hal ini biasa terjadi jika zat baru yang terbentuk mempunyai warna yang berbeda dengan warna zat semula.
4.Terjadi perubahan suhu. Pada setiap reaksi kimia berlangsung selalunya disertai dengan penyerapan dan pelepasan energi panas (kalor). Jika suhu materi naik, maka terjadi reaksi Eksoterm. Sedangkan jika suhu materi menurun maka terjadi reaksi Endoterm.
Laju reaksi atau kecepatan reaksi yang menyatakan banyaknya reaksi kimia yang berlangsung per satuan waktu. Laju reaksi menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan tiap detik reaksi. Laju reaksi dapat dipengaruhi oleh beberapa factor, yaitu:
1. Luas permukaan, untuk mengetahui apa yang dimaksud dengan luas permukaan dapat menceritakan luas permukaan
bola. Berbeda dengan luas permukaan bola, yang dimaksud dengan luas permukaan dalam reaksi kimia adalah luas permukaan zat-zat pereaksi yang bersentuhan untuk menghasilkan reaksi. Dalam reaksi kimai, tidak semua luas permukaan zat yang bereaksi dapat bersentuhan hingga terjadi reaksi, hal ini bergantung pada bentuk partikel zat-zat yang bereaksi. Suatu reaksi dapat saja melibatkan pereaksi dalam bentuk padatan. Luas permukaan zat ini akan berkaitan dengan bidang sentuh zat tersebut.Luas permukaan zat padat akan bertambah jika ukurannya diperkecil. Luas permukaan mempercepat laju reaksi karena semakin luas permukaan zat, semakin banyak bagian zat yang saling bertumbukan dan semakin besar peluang adanya tumbukan efektif menghasilkan perubahan. Semakin luas permukaan zat, semakin kecil ukuran partikel zat. Jadi semakin kecil ukuran partikel zat, reaksi pun akan semakin cepat.
2. Konsentrasi Larutan: Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel semakin
banyak sehingga partikel-partikel tersebut akan tersusun lebih rapat dibandingkan larutan yang konsentrasinya lebih rendah. Susunan partikel yang lebih rapat memungkinkan terjadinya tumbukan semakin banyak dan kemungkinan terjadi reaksi lebih besar. Makin besar konsentrasi zat, makin cepat laju reaksinya.
3. Suhu: Partikel-partikel dalam zat selalu bergerak. Jika suhu zat dinaikkan, maka energi kinetik partikel-partikel akan
bertambah sehingga tumbukan antar partikel akan mempunyai energi yang cukup untuk melampaui energi pengaktifan. Hal ini akan menyebabkan lebih banyak terjadi tumbukan yang efektif dan menghasilkan reaksi. Di samping memperbesar energi
kinetik, ternyata peningkatan suhu juga meningkatkan energi potensial suatu zat. Dengan semakin besarnya energi potensial zat, maka semakin besar terjadinya tumbukan yang efektif, sehingga laju reaksi semakin cepat.
4. Katalis: Katalis adalah zat yang pada umumnya ditambahkan dalam ke dalam suatu sistem reaksi untuk mempercepat
reaksi. Pada akhir reaksi, katalis diperoleh kembali dalam bentuk zat semula. Katalis bekerja dengan cara turut terlibat dalam setiap tahap reaksi, tetapi pada akhir tahap, katalis terbentuk kembali. Jika suatu campuran zat tidak dapat bereaksi,
penambahan katalis pun tidak akan membuat reaksi terjadi. Dengan kata lain, katalis tidak dapat memicu reaksi, tetapi hanya membantu reaksi yang berlangsung lambat menjadi lebih cepat. Katalis bekerja secara khusus. Artinya, tidak semua reaksi dapat dipercepat dengan satu macam katalis. Dengan kata lain, katalis bekerja hanya pada satu atau dua macam reaksi, tetapi untuk reaksi yang lain tidak dapat digunakan. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
5. Molaritas adalah banyaknya mol zat trelarut tiap satuan volum zat pelarut. Hubungannya dengan laju reaksi adalah
bahwa semakin besar molaritas suatu zat, maka semakin cepat reaksi berlangsung. Dengan demikian pada molaritas yang rendah suatu reaksi akan berjalan lebih lambat dari pada molaritas yang tinggi
Aplikasi dalam bidang pangan dapat berguna dan membantu kita dalam menentukan zat yang terdapat di dalam bahan pangan, yang berguna untuk menentukan kadar lemak, protein, kadar karbohidrat, dapat di tentukan dengan reaksi reaksi kimia, dengan adanya perubahan warna, pembentukan gas atau bau, perubahan suhu dan pembentukan endapan.
KESIMPULAN
Dari percobaan ini dapat disimpulkan bahwa ciri-ciri adanya reaksi kimia adalah adanya perubahan dari
pencampuran dua reaksi atau lebih, baik perubahan warna, suhu, bau, adanya endapan dan adanya gas. Maka dengan hasil percobaan ini kita dapat menuliskan sebuah persamaan reaksi. Reaksi kimia ini digunakan untuk menetukan kandungan zat dalam suatu bahan pangan, menilai kadar mutu pangan. Contoh indikator menilai kandungan zat bahan pangan komponen lemak, protein, karbohidrat, mineral, asam lemak dan gula untuk mengetahui dan menguji yang terjadi pada bahan pangan tersebut.
DAFTAR PUSATAKA
Brady, E., James, (1999), Kimia Universitas Asas dan Struktur, BinarupaAksara : Jakarta
Djulana, D. 2001. Kimia Analitik Kuantitatif Anorganik. Akademi analis kesehatan: Bandung
Kemdiknas, Pustekkom. 2010. Jenis-jenis Reaksi Kimia. www.kemendik.go.id. diakses: 23 Oktober 2013.
Turmala, ElaSutrisno, Dra, M.S.(2010). PenuntunPraktikum Kimia Dasar, UniversitasPasundan : Bandung
Yanisestria,(2012), Laporan Praktikum Kimia Analitik, yanisestria.blogspot.com diakses: 23oktober 2013