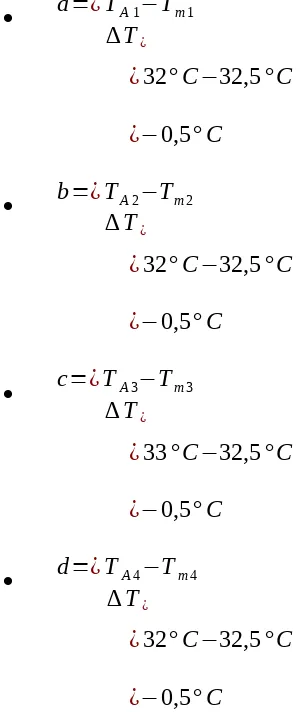ACARA II
REAKSI-REAKSI KIMIA
A. PELAKSANAAN PRAKTIKUM
1. Tujuan Praktikum : a. Untuk mengenal berbagai reaksi kimia.
b. Untuk menentukan stoikiometri reaksi.
2. Waktu Praktikum : Senin, 10 November 2014
3. Tempat Praktikum: Laboratorium Kimia Dasar, Lantai III, Fakultas Matematika dan Ilmu Pengetahuan Umum, Universitas Mataram.
B. LANDASAN TEORI
Definisi Bronsted-Lowry. Asam adalah zat yang menyediakan proton, dan basa penerima proton. Jadi dalam air, setiap zat yang meninggikan konsentrasi proton
terhidrasi (H3O+) yang disebabkan oleh otodisosiasi air adalah asam, dan setiap zat
yang menurunkan konsentrasi tersebut adalah basa, karena itu ion tersebut bergabung
dengan proton mengurangi konsentrasi H3O+. Namun zat lain seperti sulfida, oksida,
atau anion asam lemah (missal F-, CN-) juga basa (Cotton, 2013: 193).
Beberapa pereaksi dan hasil reaksi dapat berada dalam bentuk larutan (solurion) sesungguhnya ditentukan oleh komponen-komponennya, yaitu pelarut (solvent): merupakan substansi yang melarutkan zat. Komponen ini menentukan wujud larutan sebagai gas, padatan, atau sebagai cairan. Zat terlarut (solute): merupakan substansi yang terlarut dalam solvent. Misalnya bila tertulis: NaCl (aqueous) maka artinya NaCl sebagai solute dan aqua atau H2O sebagai solvent
(Barsasella, 2013: 55).
Beberapa pereaksi dan/atau hasil reaksi dapat berada dalam bentuk larutan. Seperti telah disimak pada Bab 1, satu komponen yang menentukan keadaan larutan apakah sebagai padatan, cairan, atau gas disebut pelarut (solvent), dan komponen
lainnya disebut zat terlarut (solute). Lambang NaCl(aq) misalnya, menunjukkan bahwa
air sebagai pelarut dan natrium klorida sebagai zat terlarut. Jumlah zat terlarut yang dapat dilarutkan dalam suatu pelarut sangat beragam. Itulah sebabnya, perlu mengetahui komposisi atau konsentrasi yang tepat dari suatu larutan jika harus berhubungan dengan perhitungan stoikiometri dalam larutan (Sunarya, 2012: 91).
C. ALAT DAN BAHAN PRAKTIKUM
1. Alat-alat Praktikum
a. Gelas kimia 100 mL
b. Gelas kimia 250 mL
c. Gelas ukur 25 mL
d. Gelas ukur 50 mL
e. Kain lap
f. Kertas label
g. Pipet tetes
i. Spatula
j. Tabung reaksi
k. Termometer
l. Tissue
2. Bahan-bahan Praktikum
a. Aquades (H2O(l))
b. Larutan Al2(SO4)3 (Alumunium sulfat)0,1 M
c. Larutan CH3COOH (Asam asetat) 0,05 M
d. Larutan HCl (Asam klorida) 0,05 M
e. Larutan HCl (Asam klorida) 1 M
f. Larutan indikator PP (fonolftalein)
g. Larutan K2CrO4 (Kalium kromat) 0,1 M
h. Larutan K2Cr2O7 (Kalium dikromat) 0,1 M
i. Larutan NaOH (Natrium hidroksida) 0,05 M
j. Larutan NaOH (Natrium hidroksida) 1 M
k. Larutan NaOH (Natrium hidroksida) 2 M
l. Larutan NH4OH (Amonium hidroksida) 1 M
m. Larutan CuSO4 (Tembaga (II) sulfat) 1 M
D. PROSEDUR PERCOBAAN
1. Reaksi-reaksi Kimia
a. Ke dalam 2 tabung reaksi, dimasukkan masing-masing dengan tepat 10 tetes
tetes larutan indikator PP. Diamati warna larutan-larutan tersebut. Diperhatikan warna sebelum dan sesudah reaksi.
b. Ke dalam 2 tabung reaksi lain dimasukkan larutan NaOH 0,05 M masing-masing 10 tetes. Ditambahkan pada keduanya 3 tetes larutan indikator PP. Diamati warna larutan-larutan tersebut.
c. Dicampurkan kedua asam (tabung A) dengan basa (tabung B). Diamati perubahan yang terjadi.
d. Dimasukkan ke dalam 2 tabung reaksi masing-masing 10 tetes larutan Kalium
kromat, K2CrO4 0,1 M. Ke dalam tabung reaksi pertama ditambahkan 10 tetes
larutan HCl 1 M. Dikocok dan diamati. Ke dalam tabung reaksi lainnya ditambahkan 10 tetes larutan NaOH 1 M. Disimpan larutan dan dibandingkan dengan percobaan e. Diperhatikan warna larutan sebelum dan sesudah reaksi.
e. Dimasukkan ke dalam 2 tabung reaksi masing-masing 10 tetes larutan Kalium
dikromat, K2Cr2O7 0,1 M. Diperhatikan warna larutan dan diperlakukan seperti
percobaan d di atas. Dibandingkan larutan d dan e.
f. Dimasukkan 10 tetes larutan Al2(SO4)3 0,1 M ke dalam tabung reaksi. Ditambahkan
tetes demi tetes larutan NaOH 1 M sampai terjadi perubahan warna putih dan diperhatikan apa yang terjadi.
g. Dimasukkan 10 tetes larutan Al2(SO4)3 0,1 M ke dalam tabung reaksi.
Ditambahkan 5 tetes NH4OH 1 M. Ditambahkan lagi tetes demi tetes NH4OH 1 M
sampai terjadi perubahan. Dibandingkan dengan larutan pada percobaan f.
2. Variasi Kontinu
a. Stoikiometri Sistem CuSO4–NaOH
Ke dalam 2 gelas kimia dimasukkan masing-masing 15 mL larutan NaOH 2 M dan 5 mL larutan CuSO4 1 M. Dicatat suhu awal masing-masing larutan.
Dicampurkan kedua larutan, diaduk dan dicatat suhu akhir campuran. Diamati perubahan yang terjadi pada larutan. Diulangi percobaan dengan menggunakan 10
M dan 15 mL larutan CuSO4 1 M. Sehingga volume total masing-masing campuran
menjadi 20 mL. Diperhatikan dan dibandingkan warna masing-masing larutan.
b. Stoikiometri Asam-Basa
Ke dalam 5 buah tabung reaksi dimasukkan masing-masing 1, 2, 3, 4, 5 mL larutan NaOH 1 M, kemudian dihitung suhu awal larutan. Ke dalam 5 buah tabung reaksi yang lain dimasukkan berturut-turut 5, 4, 3, 2, 1 mL larutan HCl 1 M, kemudian dicatat suhu awal larutan. Dicampurkan kedua larutan hingga volume totalnya pada masing-masing tabung reaksi menjadi 6 mL. Dicatat suhu akhir campuran.
E. HASIL PENGAMATAN
N
o PROSEDUR PERCOBAAN HASIL PENGAMATAN
1 Reaksi Kimia
a. Disiapkan 2 buah tabung reaksi, dimasukkan masing-masing 10 tetes larutan HCL 0,05 M. Ke dalam tabung pertama diteteskan 3 tetes indikator PP.
10 tetes larutan CH3COOH 0,05 M ke
dalam tabung kedua diteteskan 3 tetes indikator PP.
Diamati perubahannya !
Warna awal HCl : bening Warna PP : bening Warna HCl + PP : bening
Warna awal CH3COOH : bening
Warna PP : bening
Warna CH3COOH + PP : putih
b. Sementara itu, disiapkan 2 buah tabung reaksi lain yang telah diisi dengan larutan NaOH 0,05 M dan diteteskan 3 tetes indikator PP.
Diamati perubahannya!
Warna awal NaOH : bening Warna PP : bening Warna NaOH + PP : merah
c. Dicampurkan kedua asam (tabung A) dengan basa (tabung B). Diamati perubahan yang terjadi.
NaOH + HCl : putih
NaOH+ CH3COOH : merah
d. Dalam tabung lain, disiapkan larutan
K2CrO4 0,1 M sebanyak 10 tetes ke
dalam 2 tabung. Pada tabung pertama
Warna awal K2CrO4 : kuning
ditetesi larutan HCl 1 M sambil reaksi. Tabung pertama dimasukkan 1 tetes larutan HCl sambil dikocok dan tabung kedua dimasukkan 1 tetes
lebih pekat warnanya daripada ditambah NaOH 1 M .
K2CrO4 : kuning
K2Cr2O7 : kuning pudar
f. Ke dalam 1 tabung reaksi, dimasukkan 10 tetes larutan Al2(SO4)3
dan diteteskan NaOH 1 M, diamati
reaksi. Ditambahkan 5 tetes NH4OH 1
M. ditambahkan lagi tetes demi tetes
NH4OH 1 M dan diamati serta
a. Dimasukkan 20 mL larutan NaOH 2
M dan dicatat suhunya. Ke dalam
T NaOH = 32 ℃
T CuSO4 = 32 ℃
gelas kimia yang lain, diisi dengan 5 mL larutan CuSO4 1 M dan dicatat
suhunya.
Warna NaOH = bening Warna CuSO4 = biru tua
Warna campuran= biru tua ada endapan berwarna biru
b. Dimasukkan 15 mL larutan NaOH 2 M dan dicatat suhunya. Ke dalam gelas kimia yang lain, diisi dengan 10 mL larutan CuSO4 1 M dan dicatat
Warna campuran= biru tua, endapan berwarna biru dan lebih banyak dari percobaan a.
c. Dimasukkan 10 mL larutan NaOH 2 M dan dicatat suhunya. Ke dalam gelas kimia yang lain, diisi dengan 15 mL larutan CuSO4 1 M dan dicatat
Warna campuran= biru muda, ada endapan.
3. Stoikiometri Asam – Basa
Disiapkan 6 tabung reaksi dan dimasukkan berturut-turut 1, 2, 3, 4, 5 mL larutan NaOH 1 M dengan 5, 4, 3, 2, 1 mL larutan HCl 1 M.
Diukur suhu awal dari masing-masing larutan.
a. Dicampurkan kedua larutan dengan cara 1 mL NaOH dengan 5 mL HCl.
Dicatat suhu campurannya
T NaOH = 32 ℃
T HCl = 32 ℃
T campuran= 34 ℃
b. Dicampurkan kedua larutan dengan cara 2 mL NaOH dicampur dengan 4 mL HCl.
Dicatat suhu campurannya
T NaOH = 33 ℃
T HCl = 33 ℃
T campuran= 36 ℃
c. Dicampurkan kedua larutan dengan cara 3 mL NaOH dicampur dengan 3 mL HCl.
Dicatat suhu campurannya
T NaOH = 33 ℃
T HCl = 33 ℃
T campuran= 37 ℃
d. Dicampurkan kedua larutan dengan cara 4 mL NaOH dicampur dengan 2 mL HCl.
Dicatat suhu campurannya
T NaOH = 33 ℃
T HCl = 33 ℃
T campuran= 36 ℃
g. Al2(SO4)3(aq) + 6 NaOH (aq) 3 Na2SO4(aq) + 2 Al(OH)3(s)
h. Al2(SO4)3(aq) + 6 NH4OH (aq) (NH4)2SO4(aq) + 2 Al(OH)3(s)
2. Variasi Kontinu
a. Stoikiometri Sistem CuSO4–NaOH
Perhitungan mol larutan CuSO4 1 M
o Untuk 20 mL CuSO4 1 M
Mol CuSO4 = M . V
= 1 . 20 = 20 mmol
o Untuk 15 mL CuSO4 1 M
Mol CuSO4 = M . V
= 1 . 15 = 15 mmol
o Untuk 10 mL CuSO4 1 M
Mol CuSO4 = M . V
= 1 . 10 = 10 mmol
o Untuk 5 mL CuSO4 1 M
Mol CuSO4 = M . V
= 1 . 5 = 5 mmol
Perhitungan mol larutan NaOH 2 M
o Untuk 5 mL larutan NaOH 2 M
Mol NaOH = M . V
= 2 . 5 = 10 mmol
o Untuk 10 mL larutan NaOH 2 M
Mol NaOH = M . V
= 2 . 10
= 20 mmol
Mol NaOH = M . V
Mencari suhu mula-mula (Tm)
¿33C+32° C
Tabel Stoikiometri Sistem CuSO4 dan NaOH
V
Object 109
Reaksi antara CuSO4 dengan NaOH
2 NaOH (aq) + CuSO4(aq) Na2SO4(aq) + Cu(OH)2(aq)
Perbandingqn titik puncak
10 : 30 = 1 : 3
b. Stoikiometri Asam–Basa
o Perhitungan mol larutan HCl 1 M
Untuk 5 mL HCl 1 M
Mol HCl = M . V = 1 . 5 = 5 mmol
Untuk 4 mL HCl 1 M
Mol HCl = M . V
= 1 . 4
= 4 mmol
Untuk 3 mL HCl 1 M
Mol HCl = M . V
= 1 . 3
= 3 mmol
Mol HCl = M . V
= 1 . 2
= 2 mmol
Untuk 1 mL HCl 1 M
Mol HCl = M . V = 1 . 1 = 1 mmol
o Perhitungan mol larutan NaOH 1 M
Untuk 1 mL NaOH 1 M
Mol HCl = M . V
= 1 . 1
= 1 mmol
Untuk 2 mL NaOH 1 M
Mol HCl = M . V
= 1 . 2
= 2 mmol
Untuk 3 mL NaOH 1 M
Mol HCl = M . V
= 1 . 3
= 3 mmol
Untuk 4 mL NaOH 1 M
Mol HCl = M . V = 1 . 4
= 4 mmol
Untuk 5 mL NaOH 1 M
Mol HCl = M . V
= 5 mmol
Mencari suhu mula-mula (Tm)
1 mL NaOH 1 M dan 5 mL HCl1 M
Tm1 = T NaoH2+THCl
= 33+234
= 33,5 0C
2 mL NaOH 2 M dan 4 mL HCl1 M
Tm2=TNaOH+THCl
2
¿33 °
C+32° C
2
¿32,5° C
3 mL NaOH 2 M dan 3 mL HCl1 M
Tm3=TNaOH+THCl
2
¿33C+33° C
2
¿33°C
4 mL NaOH dan 2 mL HCl 1 M
Tm4=TNaOH+THCl
2
¿32C+32° C
2
¿32° C
5mL NaOH dan 1 mL HCl 1 M
Tm4=TNaOH+THCl
2
¿33C+34°C
¿33,5° C
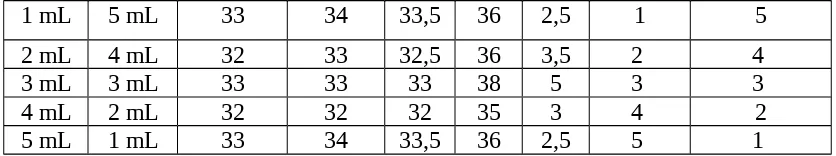
Tabel Stoikiometri Asam Basa
1 mL 5 mL 33 34 33,5 36 2,5 1 5
2 mL 4 mL 32 33 32,5 36 3,5 2 4
3 mL 3 mL 33 33 33 38 5 3 3
4 mL 2 mL 32 32 32 35 3 4 2
5 mL 1 mL 33 34 33,5 36 2,5 5 1
Grafik hubungan antara mmol NaOH dan HCl dengan ∆T
1 2 3 4 5 6 7
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5
Reaksi antara HCl dan NaOH
NaOH (aq) + HCl (aq) NaCl (aq) + H2O (l)
Perbandingan titik puncak
3 : 3 = 1 : 1
G. PEMBAHASAN
Reaksi kimia dapat digambarkan dengan lambang pada suatu persamaan kimia, dengan rumus reaktan di kiri dan rumus produk di kanan; reaktan dan produk dipisahkan dengan tanda panah. Persamaan ini harus setara. Persamaan yang setara mencerminkan hubungan kuantitatif yang benar antara reaktan dan produk. Suatu persamaan disetarakan dengan menempatkan koefisien stoikiometri di depan rumus untuk menandakan bahwa jumlah total setiap jenis atom sama di kedua sisi.
Pada percobaan pertama yaitu percobaan diamati berbagai reaksi-reaksi kimia yaitu reaksi penetralan asam basa, reaksi sintesis, reaksi metatesis dan didapatkan berbagai perubahan wujud, suhu, dan warna. Larutan HCl 0,05 M memiliki warna awal yaitu bening. Setelah ditetesi indikator fenolftalein (PP), warna HCl menjadi
keruh. Sedangkan pada larutan CH3COOH 0,05 M warna awalnya bening dan saat
ditetesi indikator fenolftalein (PP) warna larutan CH3COOH berubah menjadi sedikit
keruh. Indikator fenolftalein (PP) merupakan indikator yang menunjukkan pH basa, karena berada pada rentang pH 8,3-10 (dari tidak berwarna sampai merah keunguan). Fungsi ditambahkannya larutan indikator fenolftalein (PP) yaitu untuk menunjukkan bahwa suatu larutan bersifat basa atau asam. Selanjutnya pada larutan NaOH 0,05 M, warna awal pada larutan ini adalah bening setelah ditetesi indikator fenolftalein (PP), warna larutan berubah menjadi merah keunguan maka hal ini menandakan larutan NaOH bersifat basa dan memiliki pH lebih dari 8,3. Perubahan warna ini disebabkan
karena terjadi reaksi antara ion OH- pada NaOH dan ion H+ pada indikator PP dimana
ion OH- mendominasi reaksi tersebut, sehingga warna dari OH- pada NaOH
menggeser trayek pH dan warna larutan indikator PP. Kemudian dilakukan campuran larutan HCl yang sudah ditetesi dengan indikator PP juga. Pencampuran ini
Selanjutnya warna mula-mula K2CrO4 yaitu kuning tua, setelah ditambahkan 1
M HCl warnanya menjadi orange. Namun, setelah ditambahkan NaOH 1 M, warnanya tetap kuning. Pada percobaan ini terjadi reaksi redoks, yaitu reaksi kimia yang disertai perubahan bilangan oksidasi atau reaksi yang di dalamnya terdapat serah terima elektron atas zat. Sama halnya dengan penambahan HCl 1 M ke dalam
K2Cr2O7 dan NaOH 1 M ke dalam K2Cr2O7. Pada saat ditambahkan HCl warnanya
tetap orange tapi sedikit lebih pekat. Namun, ketika ditambahkan NaOH, warnanya tetap orange.
Percobaan selanjutnya mereaksikan larutan Al2(SO4)3 0,1 M yang dimasukkan
dalam tabung reaksi dan masing-masing ditambah NaoH 1M dan NH4OH yang
sama-sama bersifat basa. Setelah ditetesi 3 tetes NaOH 1M, Al2(SO4)3 berubah warna
menjadi putih keruh. Namun, setelah mencapai tetes ke 12, larutan Al2(SO4)3 kembali
bening. Ini disebabkan karena NaOH merupakan basa kuat sehingga walaupun tetes
demi tetes larutan Al2(SO4)3 akan cepat berubah menjadi warna semula. Sedangkan
untuk pemberian NH4OH pada Al2(SO4)3, dari 5 tetes pertama dan 5 tetes kedua
warnanya tidak berubah. NH4OH tergolong basa lemah jadi jumlah tetes yang
dibutuhkan untuk merubah Al2(SO4)3 kembali bening seharusnya lebih banyak tetapi
pada saat percobaan kami hanya memakai 4 tetes sehingga tidak menyebabkan perubahan warna.
Tahap kedua dari percobaan ini adalah menentukan stoikiomteri reaksi dengan cara variasi kontinu. Variasi kontinu adalah metode untuk memudahkan belajar stoikiometri, yaitu mengamati sederet reaksi yang kuantitas molar pereaksinya diubah-ubah (bervariasi), akan tetapi kualitas molar totalnya sama. Pada percobaan ini
dilakukan dua percobaan, yaitu stoikiometri sistem CuSO4-NaOH dan stoikiometri
H. KESIMPULAN
a. Pada percobaan diamati berbagai reaksi-reaksi kimia yaitu reaksi penetralan asam basa, reaksi sintesis, reaksi metatesis dan didapatkan berbagai perubahan wujud, suhu, dan warna.
b. Stoikiometri reaksi dapat ditentukan dengan cara variasi kontinu yaitu metode dengan cara memerhatikan suhu dan kuantitas mol pereaksi dan didapat perbandingan titik puncak yang menyatakan pereaksi-pereaksi senyawa.
DAFTAR PUSTAKA
Cotton, Albert. 2013. Kimia Anorganik Dasar. Jakarta: UI-Press.
Diana, Barsasella. 2013. Buku Wajib Kimia Dasar. Jakarta: Pelita.
Purwoko, Agus Abhi. 2010. Kimia Dasar II. Mataram: Arga Puji Press.